Method Article
マウスにおけるクラウドベース自動画像解析のための体適合動物型を用いた前臨床陽電子放出断層撮影法
要約
このプロトコルは、G8 PET / CTスキャナーでBody Conforming Animal Molds(BCAM)を使用してマウスに in vivo PETイメージングを実行する手順を説明しています。適切な腫瘍移植、最適なポジショニング、BCAM支援PET/CT画像取得、データ解析など、マウス調製に関する技術的な詳細を提供します。
要約
陽電子放出断層撮影法(PET)は、バイオマーカーの調節、受容体の占有率、目的の化合物の生体内分布など、多数の薬理学的問題を調査するために使用できる分子イメージングモダリティです。生体内分布研究では、実験対象を試験物を受け取った後に縦断的に画像化されることがよくあります。次に、画像を分析して、さまざまな時点のさまざまな臓器における化合物の分布プロファイルを導き出します。これは、治験薬の分布と潜在的に拘束力のあるプロファイルを理解するための医薬品開発における重要なステップです。しかし、PETイメージングベースの生体内分布分析の標準/手動法は、労働集約的で時間がかかり、多くの場合、オペレーター間のばらつきが大きくなります。さらに、異なる時点間で動物の位置を一定に保つことは困難です。これらの欠点に対処するために、一連のマウスBody Conforming Animal Molds(BCAM)を使用して、PET/CTイメージング取得中に動物の厳密で一貫した位置決めを可能にしました。さらに、クラウドベースの臓器確率マップ(OPM)と人工知能を活用したセグメンテーションツールで構成されるSaaS(Software-as-a-Service)プラットフォームを採用し、in vivo PETイメージングデータの信頼性と自動定量を可能にしました。ここで紹介するワークフローは、(1)BCAMによるイメージングのためのマウスの調製(型と適合する皮下腫瘍の適切な移植を含む)、(2)G8スキャナーを使用したBCAMによるPET/CT画像の取得、3)クラウドベースのSaaSを使用した自動臓器セグメンテーションおよび生体内分布解析の実行が含まれます。[18ファイル]ここではFDGが模範的なトレーサーとして使用されましたが、他のバイオマーカーや放射線標識化合物もワークフローに容易に適応させることができます。この手順は、最小限のトレーニングで正確かつ効果的に実行でき、自動化されたPETデータ分析により、手動の方法と一致する満足のいく結果が得られました。
概要
In vivo 分子イメージング技術は、薬理学の 3 つの柱である生体内分布、標的関与、薬力学の調節 1,2,3 の評価を容易にするための医薬品開発における重要なツールです。陽電子放出断層撮影法(PET)は、その臨床的翻訳性と高感度により、臨床と前臨床の研究開発分野の両方で最も一般的に使用される分子イメージングモダリティの1つです。前臨床PETイメージングと放射線治療の開花分野は、腫瘍内因性治療薬、標的治療薬、および新規の免疫腫瘍学(IO)療法の両方の開発に価値があります。新しいImmuno-PET放射性トレーサーの継続的な出現と開発は、特定のカスタマイズされたIO薬物レジメンに影響を与え、レスポンダーとノンレスポンダーを特定する可能性があります4,5,6。一方、[18F]FDGや[18F]FLTなどの代謝特異的放射性トレーサーは、治療に対する腫瘍の反応をモニターすることができ、それぞれ腫瘍が活発に増殖しているかグルコースを消費しているか7、または腫瘍細胞が阻害によって細胞周期停止を受けているかどうかを明らかにすることができる8,9。
非侵襲的な in vivo イメージングは、従来の非イメージング薬理学的実験と比較して、複数の利点があります。例えば、イメージングでは、被験者全体における薬物の分布や薬理学的効果を全身的かつ総合的に評価することができ、これにより、標的部位での有効性のモニタリングだけでなく、予期せぬオフサイト活動の検出も可能になります。その非侵襲的な性質により、同じ動物のセットを異なる時点にわたって、および/または異なるバイオマーカーを用いて縦断的に評価し、異なる生物学的問題に対処することができる10。これにより、研究に必要な動物の数が大幅に減少するだけでなく、時点間での直交制御も可能になり、相関関係を改善し、個々のばらつきを減らすのに役立ちます。イメージングバイオマーカーのこのような有望な開発にもかかわらず、PETイメージングベースの生体内分布研究でin vivo で調査化合物を評価する必要性に直面していますが、分析のための効率的な自動化プロセスが不足しています。PET生体内分布研究は、化合物の動態、組織蓄積、結合、および代謝に関する貴重な情報を生成します。再現性の高い定量データを取得することは、医薬品の開発にとって非常に重要です。
自動PET画像解析におけるこれらの満たされていないニーズに対応するため、InVivo Analyticsは、マウスBody Conforming Animal Molds(BCAM)11のセットを設計しました。これらは、マウスの頭、胴体(および内臓)、尾、手足を事前に定義された硬直した位置に保持する3Dプリントされたプラスチック型です。動物の体重に応じて大きさの異なる型を選ぶことができ、肩や下腹部など特定の部位に切り欠きをして皮下腫瘍をはみ出させることができます。これらのBCAMで取得したPET/CT画像は、非常に均一であり、同社のクラウドベースの自動セグメンテーションプラットフォーム11によりバッチで解析することができる。この記事では、BCAMを使用して画像を物理的に取得し、SaaSによる画像のセグメンテーションと解析を実行する自動化された in vivo 生体内分布解析ワークフローを紹介します。
プロトコル
動物に対して行われるすべての手順は、規制と確立されたガイドラインに従い、ファイザーの動物管理委員会または倫理審査プロセスを通じて審査および承認されました。PETイメージング研究は、すべての施設の放射線安全プロトコルに従って実施されました。この研究では、体重が18〜26 gの10〜12週齢の雌C57BL / 6マウスが使用されました。使用した試薬や機器の詳細は 、資料表に記載されています。
1. 動物の準備とステージング
注:このステップには、BCAMテンプレートガイド下腫瘍移植によるPETイメージングのための動物の病期分類が含まれます。
- 細胞移植の前に、腫瘍増殖の目的の領域でマウスの毛皮を剃ります。
- 麻酔ステーションを設置し、上部を90度上にして適切なサイズのBCAM型をプレクリップに取り付けます。これは、腫瘍移植ベースとして機能します(図1A)。
- 2.0%イソフルランと98%酸素を含む適切な誘導ボックスで動物を麻酔し、0.5〜1.5L/minの流量で投与します。
注:すべての麻酔システムは可変です。- 校正済みのシステムを使用し、使用前にテストしてください。麻酔をかけたマウスをベースに置き、手足を伸ばします(図1B)。
- BCAM腫瘍注射テンプレート型(図1C)をマウスの背側(図1D)に静かに置きます。
- マーカーを使用して、目的の切り欠き位置(肩や脇腹、左または右など)に一時的な円形の参照マークを慎重に作成します(図1D)。テンプレート型を取り外します。
- 必要な量をシリンジに引き込むことにより、注入用の細胞を準備します。27 Gの針をシリンジに取り付け、デッドボリュームスペースを埋めます。接種ごとに0.1〜0.2mLの容量が推奨されます。.
- 手順1.5の一時的なマークを参考にして指や鉗子で皮膚を持ち上げてテントを作成し、針をゆっくりと挿入し、目的の場所に細胞を皮下注射します。針をバイオハザード鋭利物容器に捨てます。
- 腫瘍の成長を監視します。この例への登録時の平均腫瘍体積は200〜300mm3でした。
注意: CTイメージングアーティファクトを防ぐために、イヤータグやマイクロチップなどの金属部品の使用は避けてください。
2.放射線量の採取
- すべての施設の放射線安全プロトコルに従って、約70〜80μCiの範囲の[18F]FDGの目標線量を静脈内注射に適した滅菌注射器に慎重に作成します。
注:70-80 μCiの範囲は、Sofie G8 PETスキャナーのダイナミックレンジに最適です。他のイメージャーは、異なる目標線量を必要とする異なるダイナミックレンジを持つ場合があります。 - 線量キャリブレーターで、シリンジを井戸チャンバーに入れ、ディッパーを下げて、放射性線量を慎重に測定します。測定前に適切な同位体またはキャリブレーション番号を選択するように注意してください。
- 安定した読み取りを行ってください。日付と時刻を記録します。必要に応じて用量を調整します。.
- (オプション)滅菌生理食塩水を使用して、最終用量を0.1〜0.2mLにします。.
注:必要な注入量は異なる場合があります。. - 用量を投与する準備ができています。
3. 静脈内投与
- 機関のIACUCおよび放射線安全プロトコルに従って、尾静脈を拡張してマウスの尾をIV注射用に準備します。この研究では、42°Cに設定されたスライドウォーマーに動物ケージまたは誘導チャンバーを置くことにより、尾静脈を拡張しました。
注:尾静脈が完全に拡張するまでに、温めるのに最大10分かかる場合があります。 - 注射する前に、マウスの体重を記録します。これにより、PET/CTイメージングに使用する重量固有のBCAMが決まります。
- 準備ができたら、マウスを適切な拘束具に移し(例:本研究では尾静脈注射プラットフォームを使用しました)、尾静脈を特定します。
- 放射性注射器を慎重に取り扱い、IVで意識のあるマウスに線量を注入します。注入時間を記録します。
- シリンジを慎重に脇に置き、ガーゼで尾から余分な血液滴を取り除きます。マウスを拘束装置から取り外し、適切なハウジングに戻します。
- シリンジを線量キャリブレーターチャンバーに慎重に戻し、適切な線量計算のために残りの測定値を記録します。.残余活動の読み取りの日時を記録します。
- 注射が完了したら、注意を払い、マウスのコホートを鉛の囲いの後ろや人員から離して配置し、施設に安全な放射線慣行に従ってください。注:使用されているすべての材料は、軽度の放射能汚染にさらされています。校正済みのガイガーカウンターですべてのエリアを監視し、放射線安全ガイドラインに従って清掃します。
4. PETイメージングのための動物の麻酔と位置決め
- 適切な時間(例:トレーサーの取り込み期間が終了する10〜15分前)に、麻酔導入とPETイメージングの両方に必要なすべての麻酔器具と動物加温器具の電源を入れます。麻酔は、98%酸素中で2.0%〜2.5%のイソフルランに設定できます(設定はマウスの系統や疾患モデルによって異なる場合があります)。
- すべてのアダプターとバルブがオンになっており、ガス流量が0.5〜1.0 L / minであることを確認します。特定の流量は、麻酔システムとイメージングシステムによって異なる場合があります。
- 適切な動物を誘導ボックスに入れ、被験者が正しい麻酔深度に達するまで待ちます。
- 各目にアイ潤滑剤軟膏を塗ります。
- マウスを体重に応じた適切なサイズのBCAMに移します。
- マウスの首筋をそっとつまみ、テールをテールスロットに挿入し、BCAMの下に巻き付けます。テールをテールプラットフォームに置き、テープで固定します。背骨がまっすぐであることを確認してください。BCAMを静かに閉じます(図2A、B)。
- 4本の手足すべてを慎重に配置して、BCAMの各足プラットフォームに置きます。必要に応じてテープを使用して、足を各プラットフォームに固定します(図2B)。
- 最初にフロントエンドを挿入して、BCAMをイメージングベッドシャトルにそっとはめ込みます(図2C)。シャトルは、麻酔が流れた状態でG8ローディングドックにすでに接続されている必要があります(図2D)。BCAMの背面を押し下げると、カチッと音がしてG8シャトルに固定されていることを示します。
注:イメージング中に動物が目的の麻酔面に留まるように、麻酔薬の供給を維持してください。
5. 画像取得
- G8 PET取得ソフトウェアを開きます。スタディフォルダ、スキャンパラメータ、および症例IDを事前に作成できます。
- マウスの体重、初期投与量の日付/時刻と量、注射の日付/時刻、残留活性の読み取り日/時刻と量など、研究の詳細をソフトウェアに入力します。
- マウス付きのシャトルをスキャナーの開口部に挿入します。青いインジケータライトは、システムに適切にドッキングされていることを示します。
- 適切なPET/CTパラメータを選択します。画像データを取得します。
注:この研究では、7分間の静的 18FPETスキャンが実行され、続いて70秒のデフォルトCTスキャンが実行され、最尤期待値最大化3D再構成アルゴリズム(G8スキャナーのデフォルトおよび唯一のオプション)が適用されてデータが再構築されました12。 - 取得が完了すると、シャトルは最初の開始位置に戻ります。マウスでシャトルを取り外し、ドックに挿入します。BCAM垂直タブの背面を押してG8シャトルから取り外し、マウスでBCAMをゆっくりと引き上げて取り外します。
- 2つの保持タブを押して跳ね上げ、BCAMの上部を開きます。
- マウスをそっと取り外します。マウスが麻酔から完全に回復し、明るく、警戒心が強く、反応が良い(BAR)ことを確認してから、ホームケージに戻ってください。
- 設定された時間間隔で手順を続行して、マウスのコホート/グループ全体をスキャンします。
6. SaaSへの画像のアップロード
- app.invivo.ax にログインし、プロジェクトを作成します。
- ウィンドウの右上にある赤い アップロード タブをクリックします。イメージング研究で使用するイメージングシステムとレポーター([18F]FDGなど)を選択します。画像データのあるフォルダーを選択します。
- プロジェクトフォルダ内の注釈タブに移動します。 [注釈] をクリックして、関連するスキャン情報(被験者名、性別、BCAMサイズ、被験者の体重、コホート名、時点、注射された線量値)を追加します。ほとんどのメタデータは自動入力されます。
7. 自動データ分析
- プロジェクトフォルダ内では、すべてのスキャンが入力されます。 スキャン をクリックして、プロジェクト、グループ、および個々のサブジェクトレベルからナビゲートします。右上隅にある [分析 ] を選択します。
- 分析リボン ウィンドウの右上にある [プロジェクト] で、 プラス 記号を選択し、[ 臓器確率マップ ROI] を選択します。Organ Probability Map(OPM)は、事前定義された複数の臓器や組織を網羅した統計マウス臓器アトラスです。研究ニーズに基づいて関心のある個々の臓器を選択します。
注:この例では、VivoQuantを使用してスプラインツールを使用して手動のセグメンテーションと分析を行い、その後、3D ROIオペレーター内で補間を行いました。自動分析結果をベンチマークとして手動セグメンテーションの結果と比較しました。
結果
アップロードされたPETデータは、冠状、矢状、および横方向の画像のパネルとしてSaaS Webサイトで表示でき、OPMによって指示された選択した臓器ROIと重ね合わせられます(図3A)。ソフトウェアは個々の画像をロードできるだけでなく、グループまたは研究全体の複数のマウスを一度に1つの折りたたまれた画像として表示できます。この解析ウィンドウ内には、ROIの色、スケールバーの強度、およびその他の一般的なパラメーターをカスタマイズするオプションがあります。理想的な分析指標が選択されると、SaaSは選択した臓器のダウンロード可能な生体内分布棒グラフを生成します(図3B)。
OPMベースのSaaSプラットフォームのパフォーマンスを評価するために、自動分析の結果と経験豊富なイメージングアナリストが導き出した結果をゴールドスタンダードとして比較しました。適合線形回帰は、脳、心臓、腎臓(右)、および脾臓からの[18F]FDG取り込み値に対して実行されました。注目すべきは、このプラットフォームでは、骨格、脳、膀胱、心臓、腎臓(左右)、肝臓、脾臓、肺、大腿四頭筋(右と左)など、ユーザーが選択できる臓器の包括的なリストを提供していることです。上記の4つの臓器は、説明のみを目的としてこの研究で選択されました。さらに、移植された腫瘍のサイズ、形状、深さ/位置が異なるため、腫瘍は OPM の臓器として含まれていないため、この比較分析から除外されます。 図4に示すように、自動解析と手動解析では全体的に一貫した結果が得られ、脳の相関が最も高い(r2 = 0.8466)ことが示されました。これは、臓器のサイズが大きく、頭蓋骨内の脳の位置が非常に一定であるために予想されます。右腎臓と心臓も、それぞれ0.6874と0.4849の妥当なr2 値を示しました。対照的に、脾臓の相関分析では、r2 値は0.3922で、これは試験した臓器の中で最も低い値でした。脾臓は膵臓と脂肪組織にネストされており、明確な形態を欠いており、CTで同じ軟部組織密度を推定しているため、これは驚くべきことではありません。したがって、脾臓を手動でセグメンテーションすることは困難であり、OPMはこの臓器を区切るためのより正確な手段を提示する可能性があります(つまり、ゴールドスタンダードを上回っています)。これらの相関分析の傾きとY切片も 図4に示されています。r2 の値と一致するように、脳の傾きは1に最も近い(つまり、OPMと手動の結果との完全な相関関係)と最小のY切片(つまり、最小の全身バイアス)を持っていましたが、他の臓器は完全な相関から大きく変動する偏差を示しました。

図1:BCAMおよびテンプレートガイド下腫瘍移植 (A) プレクリップ(1)は、BCAM型(2)の底部に麻酔ライン(3)を接続して取り付けます。これが腫瘍の移植基盤として機能します。(B)標的インプラント部位(この場合は右肩)を剃ったマウスを、細胞注入前に麻酔下でベースに載置する。(C)腫瘍細胞接種の配置をガイドするための事前定義されたカットアウトを備えた腫瘍移植テンプレート(4)。(D)マウスの背側にテンプレート型を配置して、細胞注入前に一時的な参照マークを作成します。 この図の拡大版を表示するには、ここをクリックしてください。
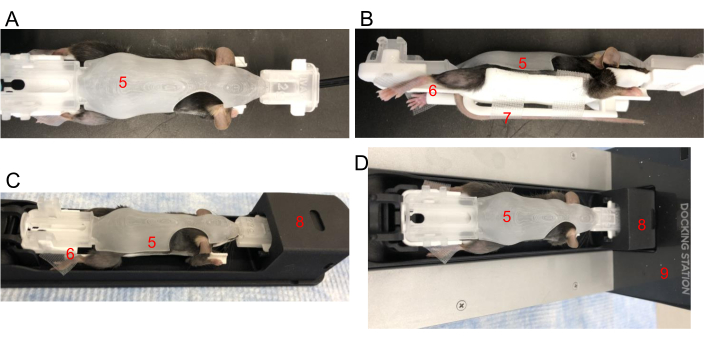
図2:BCAMでのマウスの配置。 (A)上面図 - 適切なサイズのBCAM(5)にマウスをぴったりと置きます。(B)側面図-テープを使用して、後足をプラットフォーム(6)に固定します。テールは、マウスの真下にあるテールプラットフォーム(7)にテープで固定されています。(c)マウスは、BCAMにおいて、イメージングシャトル(8)に挿入される。(D)マウス、BCAM、およびシャトルは、麻酔駆動ドッキングステーション(9)に接続されています。 この図の拡大版を表示するには、ここをクリックしてください。
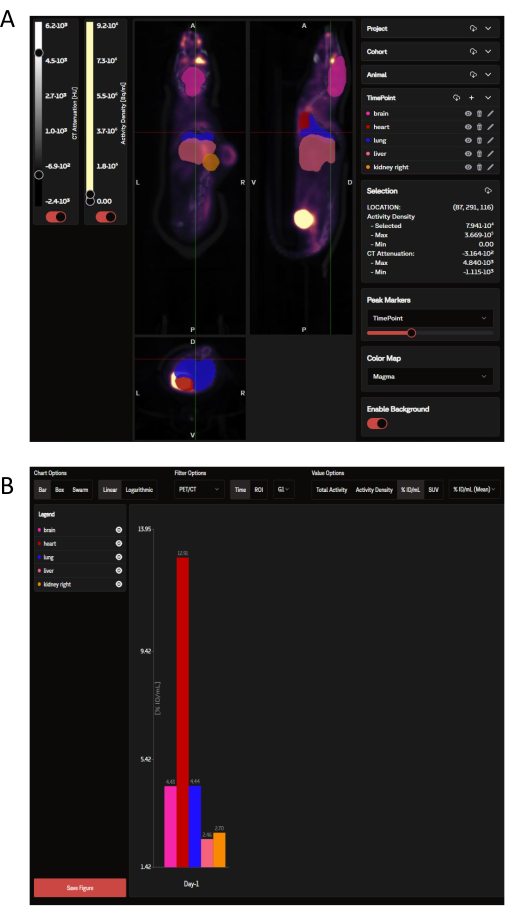
図3:SaaSツールで表示および分析された代表的な画像とデータ出力 。(A) SaaSウェブサイトに掲載されている代表的な画像です。PET/CT画像の冠状、矢状、および横方向のビューと、臓器確率マップ(OPM)から選択した臓器ROIを重ね合わせた画像。ピンク:脳;赤:ハート;ダークブルー:肺;サーモン:肝臓;オレンジ:腎臓(右)。腫瘍はOPMによって定義されていません。(B)自動分析から生成された代表的なダウンロード可能なグラフ。選択した臓器のリストは、左上のパネルで確認できます。ここでのデータは %ID/mL で報告されます。 この図の拡大版を表示するには、ここをクリックしてください。
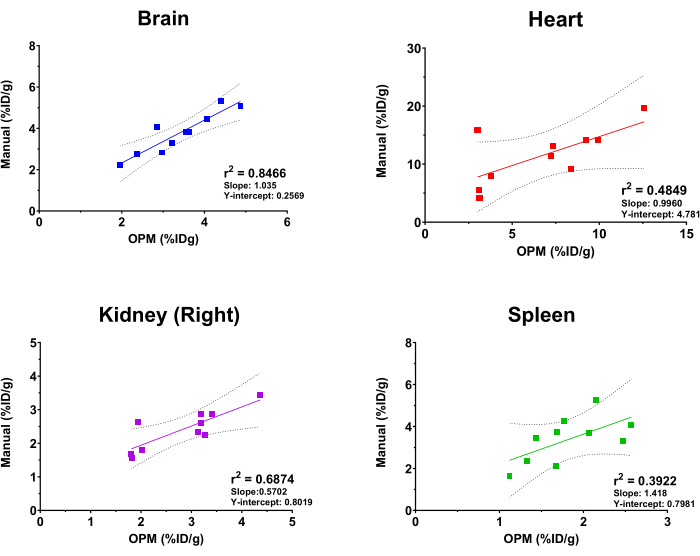
図4:手動分析とOPMベースの自動化ワークフローによって導き出された臓器[18F]FDG取り込み値を比較する線形回帰分析。 雌のC57BL/6マウスのPET/CTスキャンを10回使用した。r2 値、95% 信頼線、傾き、および Y 切片が、指定された各臓器のグラフに表示されます。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
本報告では、BCAM型を用いてマウス のin vivo PETイメージングを行い、自動SaaSツールを用いてデータを解析する手順について述べる。マウスの調製、イメージング取得、およびデータ処理に関するステップバイステップの説明が提供されます。この自動化ワークフローでは、手動分析と一致するデータも得られました。以下に、いくつかの重要な技術的考慮事項を示します。
腫瘍はOPMによって定義される器官の1つではありませんが、このプロトコルの重要なステップは、最終的に体腔内およびBCAM内のすべてのマウス臓器の最適なアライメントを確保するための皮下腫瘍の適切な移植です。OPMは、マウスの背骨が比較的まっすぐで、内臓が中立的に位置している場合にのみ、正確なデータを生成できます。腫瘍が大きすぎたり、位置がずれたりすると、マウスの姿勢に影響を与えて体腔に押し込まれ、内臓が移動する可能性があります。このシフトにより、OPMアルゴリズムから得られる定量分析が歪むことになります。他の研究者は、さまざまな画像診断法とセグメンテーションアルゴリズム13,14を使用して、不直進背椎が内臓の整列に与える影響を報告しています。したがって、テンプレートを使用して腫瘍の移植をガイドし、腫瘍の成長を綿密に監視して、腫瘍が適切に配置され、理想的なサイズ範囲にあることを確認することが重要です。
逸脱する可能性のある別の領域は、適切なサイズのBCAMの選択です。BCAMは、18〜26gの範囲で2gの積分で作成されます。ただし、体組成が異なるマウス(筋肉が多いマウスと脂肪が多いマウス)は、体重は同じでも体格が異なる場合があるため、体重を一般的な参考として使用しながら、最も適切なBCAMを選択することが重要です。試行錯誤しながらレベルアップまたはレベルダウンし、適切なアライメントが重要であることを覚えておいてください。大きすぎるBCAMを選択すると、マウスの内臓がベッドの底に「沈み込み」、特に腎臓や脊椎などの背側臓器の分析精度に影響を与えます。対照的に、小さすぎるBCAMにマウスを配置すると、マウスの体腔を圧迫したり、臓器の位置が歪んだり、呼吸が困難になる可能性があります。テープを使用して手足が足のプラットフォームに固定されていることを確認すると、セットアップとポジショニングに役立ちます。
この報告されたワークフローは、標準化され自動化されたPET画像解析を可能にしますが、現在のOPMは免疫適格なC57BL/6マウス系統と健康なマウスに基づいて構築されていることを指摘する価値があります。マウスの他の系統や健康状態は、アルゴリズムの追加の調整、最適化、および検証を必要とする異なる解剖学的特徴を示す場合があります。例えば、NSGやNCGなどの免疫不全株は、脾臓が小さくなります。同様に、同所性腫瘍インプラントを移植したマウスは、疾患状態に応じて内臓のサイズ、形状、および位置が異なる場合があります。このワークフローのもう1つの制限は、実験の取り込みフェーズにおける全体的なスループットです。これは主に、BCAMでマウスを適切にセットアップするために必要な追加の時間によるものです。トレーニングと練習により、適切な配置におけるオペレーターの効率を高めることができます。2 つ目のドッキングステーションを追加することで、全体的なスループットも向上し、1 つのドックは BCAM セットアップに、もう 1 つのドックはマウスをリカバリーケージに取り外すことができます。それにもかかわらず、スキャン前のBCAMセットアップに必要な時間が増えても、時間への投資はデータ分析側の時間を節約することで報われます。たとえば、本研究では、OPMが10枚の画像(4つのROI)を分析するのに10分もかからなかったのに対し、経験豊富なアナリストが同じ画像とROIのセットを手動でセグメント化して分析するのに3〜4時間かかりました。経験の浅いアナリストは、手動分析にさらに多くの時間を必要とします。SaaSプラットフォームでは、PETスキャンを大規模なバッチで分析することができ、データのアップロード後数分以内に完全な in vivo 生体内分布分析を完了することができます。これは、以下で説明するように、複数のグループや複数の時点にまたがる大量のデータを処理する場合に非常に便利な機能です。
1人の被験者の臓器の手動セグメンテーションは時間がかかる場合があり、通常、オペレーターの事前トレーニングが必要です。適切なトレーニングを行っても、手動分析は必然的にオペレーター間のばらつきに直面し、定量的な結果を歪める可能性があります15,16。対照的に、自動化されたセグメンテーションとデータ解析は、放射性トレーサーの全体的な生体内分布を正確かつ効率的に決定し、人間の操作に根ざした変動性を排除することができます。このような自動化の利点は、臨床画像解析と前臨床領域の両方で見られます。例えば、Sluisらは、AIクラウドベースの手法では30分かかるのに対し、1回のスキャンでは関心のある臓器をセグメント化するのに4時間かかることを実証した17。Nazariらによる別の研究も、肝臓と腎臓のアルゴリズムベースの分析が、2人の人間の医学物理学者と比較して7.0%以内の正確な結果を示したことを報告しています18。図4のデータは、SaaSベースのPETイメージング解析ワークフローの信頼性と、手動解析と比較して自動解析が一貫した結果をもたらすことを明確に示しています。
要約すると、この記事では、標準化された前臨床PET/CT画像取得とSaaS対応の自動PETデータ解析を容易にするためにBCAM金型を使用するワークフローについて説明します。このプラットフォーム技術は比較的簡単に採用でき、自動化で生成されたデータの品質は手動分析と一致していますが、大幅な時間節約のメリットを誇っていることが実証されています。したがって、このワークフローにより、研究者はデータ分析時間を数百時間節約し、オペレーター間のばらつきを標準化して削減できます。この手順は、モダリティや適応症を超えて多数の薬物化合物の開発を支援することができます。特に、治療用抗体、二重特異性抗体免疫細胞誘導剤、抗体-薬物複合体、さらにはナノ粒子などの高分子モダリティは、放射性金属(Zr-89、Cu-64など)で容易に標識でき、PETイメージングを介した生体内分布評価が可能になります19,20。同様に、このプラットフォーム技術は、マウス21における新規放射線治療薬の線量推定を決定するのに役立つ。この手順の適用は、医薬品開発に大きな付加価値をもたらします。
開示事項
すべての著者は、Pfizer, Inc.の現在または過去の従業員です。
謝辞
ファイザー・ラホヤ比較医学研究および技術スタッフに感謝します。
資料
| Name | Company | Catalog Number | Comments |
| [18F]FDG | PETNet Solutions, Culver City, CA | NA | Radiotracer used for PET imaging |
| 27 G needle | Becton, Dickinson and Company, San Diego, CA | 305136 | Used for cell injection |
| app.invivo.ax/login | Invivo Analytics, Seattle, WA | NA | Software as a Service webpage |
| Body Conforming Animal Molds | Invivo Analytics, Seattle, WA | NA | BCAMs with weight range of 18 - 26 g |
| Dose Calibrator; CRC-55tw | Capintec, Florham Park, NJ | CRC-55tw | Measurement of radioactive doses |
| G8 PET/CT scanner | Sofie Biosciences/Xodus Imaging, Torrence, CA | NA | Benchtop scanner with loading dock |
| G8-Docking station | Sofie Biosciences/Xodus Imaging, Torrence, CA | NA | Docking station for staging |
| Implantation Mold Template | Invivo Analytics, Seattle, WA | NA | Template for optimal tumor implantation |
| Lubricant eye ointment | BAUSCH & LOMB, Ontario, Canada | Soothe Nighttime | Eye lube for mice |
| Modified G8 shuttle | Invivo Analytics, Seattle, WA | NA | Shuttle for BCAM accommodation |
| Mouse anesthesia Induction box | Patterson Scientific, Waukesha, WI | 78933388 | Used for anesthetizing a mouse |
| PRE-Clip | Invivo Analytics, Seattle, WA | NA | BCAM adapter for anesthesia connection |
| Premiere Slide warmer | LabScientific, Danvers, MA | XH-2001 | Adjustable temp warmer used for tail vein dilation and anesthesia induction |
| Syringe (1 mL) | Becton, Dickinson and Company, San Diego, CA | 309659 | Used for cell injection |
| Tail Vein injection platform | Braintree Scientific, Pembroke, MA | IL-300 | Restrainer used for administering intravenous injections. |
| Vivoqaunt Software | Invicro, Needham, MA | NA | Software used for manual segmentation |
参考文献
- Huang, R., Wang, M., Zhu, Y., S Conti, P., Chen, K. Development of pet probes for cancer imaging. Curr Top Med Chem. 15 (8), 795-819 (2015).
- Schwenck, J., et al. Advances in pet imaging of cancer. Nat Rev Cancer. 23 (7), 474-490 (2023).
- Matthews, P. M., Rabiner, E. A., Passchier, J., Gunn, R. N. Positron emission tomography molecular imaging for drug development. Br J Clin Pharmacol. 73 (2), 175-186 (2012).
- Tavaré, R., et al. An effective immuno-pet imaging method to monitor CD8-dependent responses to immunotherapy. Cancer Res. 76 (1), 73-82 (2016).
- Maresca, K. P., et al. Preclinical evaluation of 89ZR-DF-IAB22M2C PET as an imaging biomarker for the development of the gucy2c-cd3 bispecific pf-07062119 as a t-cell engaging therapy. Mol Imaging Biol. 23 (6), 941-951 (2021).
- Nisnboym, M., et al. Immuno-pet imaging of cd69 visualizes t-cell activation and predicts survival following immunotherapy in murine glioblastoma. Cancer Res Commun. 3 (7), 1173-1188 (2023).
- Lee, C., et al. Efficacy and imaging-enabled pharmacodynamic profiling of Kras g12c inhibitors in xenograft and genetically engineered mouse models of cancer. Mol Cancer Ther. 22 (7), 891-900 (2023).
- Bollineni, V., Kramer, G., Jansma, E. P., Liu, Y., Oyen, W. J. A systematic review on [18f] flt-pet uptake as a measure of treatment response in cancer patients. Eur J Cancer. 55, 81-97 (2016).
- Everitt, S., et al. Imaging cellular proliferation during chemo-radiotherapy: A pilot study of serial 18f-flt positron emission tomography/computed tomography imaging for non-non-small-cell lung cancer. Int J Radiat Oncol Biol Phys. 75 (4), 1098-1104 (2009).
- Rashidian, M., et al. Predicting the response to CTLA-4 blockade by longitudinal non-invasive monitoring of cd8 t cells. J Exp Med. 214 (8), 2243-2255 (2017).
- Klose, A. D., Paragas, N. Automated quantification of bioluminescence images. Nat Commun. 9 (1), 4262 (2018).
- Gu, Z., et al. Performance Evaluation of G8, a high-sensitivity benchtop preclinical PET/CT Tomograph. J Nucl Med. 60 (1), 142-149 (2019).
- Bongratz, F., Rickmann, A. -. M., Wachinger, C. Abdominal organ segmentation via deep diffeomorphic mesh deformations. Sci Rep. 13 (1), 18270 (2023).
- Wang, H., Stout, D. B., Chatziioannou, A. F. Mouse atlas registration with non-tomographic imaging modalities-a pilot study based on simulation. Mol Imaging Biol. 14, 408-419 (2012).
- Montgomery, M. K., et al. Mouse lung automated segmentation tool for quantifying lung tumors after micro-computed tomography. PLoS One. 16 (6), e0252950 (2021).
- Montgomery, M. K., et al. Applying deep learning to segmentation of murine lung tumors in preclinical micro-computed tomography. Transl. Oncol. 40, 101833 (2024).
- Van Sluis, J., et al. Manual versus artificial intelligence-based segmentation as a pre-processing step in whole-body pet dosimetry calculations. Mol Imaging Biol. 25 (2), 435-441 (2023).
- Nazari, M., et al. Automated and robust organ segmentation for 3D-based internal dose calculation. EJNMMI Res. 11, 1-13 (2021).
- Goel, S., England, C. G., Chen, F., Cai, W. Positron emission tomography and nanotechnology: A dynamic duo for cancer theranostics. Adv Drug Deliv Rev. 113, 157-176 (2017).
- Campbell, D. O., et al. Preclinical evaluation of an anti-nectin-4 immunopet reagent in tumor-bearing mice and biodistribution studies in cynomolgus monkeys. Mol Imaging Biol. 18, 768-775 (2016).
- Bednarz, B., et al. Murine-specific internal dosimetry for preclinical investigations of imaging and therapeutic agents. Health Phys. 114 (4), 450-459 (2018).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved