Method Article
使用身体顺应动物模具的临床前正电子发射断层扫描用于小鼠基于云的自动图像分析
摘要
该协议描述了在 G8 PET/CT 扫描仪中使用身体顺应动物模具 (BCAM) 对小鼠进行 体内 PET 成像的程序。提供了有关小鼠制备的技术细节,包括正确的肿瘤植入、最佳定位、BCAM 辅助 PET/CT 图像采集和数据分析。
摘要
正电子发射断层扫描 (PET) 是一种分子成像模式,可用于研究多种药理学问题,例如生物标志物调节、受体占有率和目标化合物的生物分布。在生物分布研究中,实验对象通常在收到测试物品后进行纵向成像。然后分析图像以得出化合物在不同时间点在不同器官中的分布曲线。这是药物开发中了解研究化合物的分布和潜在结合特征的关键步骤。然而,基于 PET 成像的生物分布分析的标准/手动方法既费力又耗时,并且通常与作者之间的高度差异有关。此外,保持动物在不同时间点的位置一致是具有挑战性的。为了解决这些缺点,使用了一系列小鼠身体符合动物模具 (BCAM),以便在 PET/CT 成像采集过程中实现动物的刚性和一致定位。此外,采用由基于云的器官概率图 (OPM) 和人工智能驱动的分割工具组成的软件即服务 (SaaS) 平台,以实现体内 PET 成像数据的可靠和自动定量。这里介绍的工作流程包括 (1) 准备小鼠使用 BCAM 进行成像,包括正确植入皮下肿瘤以与模具兼容,(2) 使用 G8 扫描仪通过 BCAM 获取 PET/CT 图像,以及 3) 使用基于云的 SaaS 进行自动器官分割和生物分布分析。[18个地址]FDG 在这里用作示例示踪剂,但其他生物标志物和/或放射性标记化合物可以很容易地适应工作流程。该程序可以通过最少的培训准确有效地执行,并且自动 PET 数据分析产生了与手动方法一致的令人满意的结果。
引言
体内分子成像技术是药物开发中的重要工具,可促进药理学的所有三大支柱——生物分布、靶标结合和药效学调节 1,2,3。正电子发射断层扫描 (PET) 具有临床可转化性和高灵敏度,是临床和临床前研发领域最常用的分子成像模式之一。临床前 PET 成像和放射热解剖学蓬勃发展的领域对于肿瘤内在疗法、靶向疗法以及新型免疫肿瘤学 (IO) 疗法的开发都很有价值。新型免疫 PET 放射性示踪剂的不断出现和发展有可能影响特定的定制 IO 药物治疗方案,并确定应答者与无应答者 4,5,6。同时,代谢特异性放射性示踪剂,如 [18F]FDG 和 [18F]FLT,可以监测肿瘤对治疗的反应,并可以分别阐明肿瘤是否正在积极增殖或消耗葡萄糖7,或者肿瘤细胞是否通过抑制方式进行细胞周期停滞 8,9。
与传统的非成像药理学实验相比,非侵入性 体内 成像具有多种优势。例如,成像可以系统、全面地评估药物在整个受试者中的分布和/或药理作用,这不仅可以监测目标部位的疗效,还可以检测意外的场外活动。由于其非侵入性,可以在不同的时间点和/或使用不同的生物标志物对同一组动物进行纵向评估,以解决不同的生物学问题10。这不仅显著减少了研究所需的动物数量,而且还提供了跨时间点的正交控制,因此有助于改善相关性并减少个体变异性。尽管成像生物标志物的发展前景光明,但需要通过基于 PET 成像的生物分布研究在 体内 评估研究化合物,然而,缺乏高效的自动化分析流程。PET 生物分布研究可生成有关化合物动力学、组织积累、结合和代谢的宝贵信息。获得高度可重现的定量数据对于药物疗法的开发至关重要。
为了满足自动化 PET 图像分析中这些未满足的需求,InVivo Analytics 设计了一套小鼠体型动物模具 (BCAM)11。这些是 3D 打印的塑料模具,可将老鼠的头部、躯干(和内脏)、尾巴和四肢固定在刚性的预定义位置。可以根据动物的体重选择不同大小的模具,并且可以在特定区域(例如肩部或下腹部)创建切口,以允许皮下肿瘤突出。使用这些 BCAM 采集的 PET/CT 图像高度均匀,可以通过该公司基于云的自动分割平台进行批量分析11。本文介绍了一种自动化 的体内生物 分布分析工作流程,该工作流程通过使用 BCAM 物理采集图像并通过 SaaS 执行图像分割和分析来提供支持。
研究方案
对动物进行的所有程序都遵循法规和既定指南,并由辉瑞的机构动物护理和使用委员会或通过伦理审查程序审查和批准。按照所有机构辐射安全方案进行 PET 成像研究。本研究使用雌性 C57BL/6 小鼠,10-12 周龄,体重在 18-26 g 之间。所用试剂和设备的详细信息列在 材料表中。
1. 动物的准备和暂存
注意:此步骤涉及使用 BCAM 模板引导的肿瘤植入对动物进行 PET 成像进行分期。
- 在细胞植入之前,在肿瘤生长的所需区域剃掉小鼠的皮毛。
- 设置麻醉站并将适当大小的 BCAM 模具连接到预夹上,顶部向上翻转 90 度。这将作为肿瘤植入基础(图 1A)。
- 在含有 2.0% 异氟醚和 98% 氧气的合适诱导箱中以 0.5-1.5 L/min 的流速麻醉动物。
注意:所有麻醉系统都是可变的。- 使用经过校准的系统并在使用前进行测试。将麻醉的鼠标放在底座上并伸展其四肢(图 1B)。
- 轻轻地将 BCAM 肿瘤注射模板模具(图 1C)放在小鼠的背侧(图 1D)。
- 用记号笔在所需的切口位置(例如,肩部或侧面,左侧或右侧)小心地创建一个临时圆形参考标记(图 1D)。拆下模板模具。
- 通过将所需体积吸入注射器中来准备用于注射的细胞。将 27 G 针头连接到注射器上,并填充死体积空间。建议每次接种的体积为 0.1-0.2 mL。
- 使用步骤 1.5 中的临时标记作为参考,用手指或镊子提起皮肤,创建一个帐篷,慢慢插入针头,然后将细胞皮下注射到所需位置。将针头丢弃在生物危害锐器容器中。
- 监测肿瘤生长。本例入组时的平均肿瘤体积为 200-300 mm3。
注意:避免使用耳标或微芯片等金属部件,以防止 CT 成像伪影。
2. 绘制放射性剂量
- 遵循所有机构辐射安全协议,小心地将 [18F] FDG 的目标剂量在大约 70-80 μCi 的范围内吸入适合静脉注射的无菌注射器中。
注意:70-80 μCi 范围最适合 Sofie G8 PET 扫描仪的动态范围。其他成像仪可能具有不同的动态范围,需要不同的目标剂量。 - 将注射器放入孔室并降低舀球器,小心测量剂量校准器中的放射性剂量。注意在测量前选择合适的同位素或校准编号。
- 获取稳定的读数。记录日期和时间。如果需要,调整剂量。
- (可选)使用无菌盐水使最终剂量体积达到 0.1-0.2 mL。
注: 所需的进样量可能会有所不同。 - 剂量已准备好给药。
3. 静脉给药
- 按照机构 IACUC 和辐射安全协议,通过扩张尾静脉来准备小鼠尾巴进行 IV 注射。在这项研究中,通过将动物笼子或诱导室放在设置为 42 °C 的载玻片加热器上来扩张尾静脉。
注意:尾静脉可能需要长达 10 分钟的升温才能完全扩张。 - 注射前,记录小鼠体重。这将确定用于 PET/CT 成像的重量特异性 BCAM。
- 准备好后,将小鼠转移到合适的限制器中(例如,本研究中使用了尾静脉注射平台)并定位尾静脉。
- 小心处理放射性注射器,并将剂量静脉注射到有意识的小鼠中。记录注射时间。
- 小心地将注射器放在一边,用纱布清洁尾部多余的血滴。从限制器中取出鼠标,然后将其放回适当的外壳中。
- 小心地将注射器放回剂量校准室中,并记录任何残留读数,以便正确计算剂量。记录残余活动读数的日期和时间。
- 注射完成后,请小心并将小鼠队列放在铅围栏后面和/或远离人员,遵循机构安全的辐射做法。请注意,所有使用的材料都会受到轻微的放射性污染。使用校准的盖革计数器监测所有区域,并按照辐射安全指南进行清洁。
4. 麻醉和定位动物以进行 PET 成像
- 在适当的时间(例如,示踪剂摄取期结束前 10-15 分钟),打开麻醉诱导和 PET 成像所需的所有麻醉设备和动物加温器械。麻醉可设置为 2.0%-2.5% 异氟醚,溶于 98% 氧气(设置可能因小鼠品系和疾病模型而异)。
- 确认所有适配器和阀均已打开,气体流速为 0.5-1.0 L/min。特定流速可能因麻醉系统和成像系统而异。
- 将适当的动物放入诱导箱中,并等待受试者达到正确的麻醉深度。
- 在每只眼睛上涂抹眼部润滑剂软膏。
- 根据体重将小鼠转移到适当大小的 BCAM 中。
- 轻轻地抓住鼠标的后颈,将鼠标尾巴插入鼠标尾槽,然后将其包裹在 BCAM 下。将尾巴放在尾部平台上,并用胶带固定位置。检查脊柱是否笔直。轻轻关闭 BCAM(图 2A、B)。
- 小心地将所有四个肢体放在每个 BCAM 爪平台上。根据需要使用胶带将爪子固定到每个平台上(图 2B)。
- 先插入前端,将 BCAM 轻轻卡入成像床梭中(图 2C)。穿梭车应该已经连接到麻醉流动的 G8 装卸码头(图 2D)。向下推 BCAM 的背面,咔嗒一声表示它已固定在 G8 穿梭机上。
注意:保持麻醉剂供应,以便动物在成像过程中保持在所需的麻醉平面。
5. 图像采集
- 打开 G8 PET 采集软件。可以预先创建研究文件夹、扫描参数和主题 ID。
- 在软件中输入研究详细信息:小鼠体重、抽取初始剂量的日期/时间和量、注射日期/时间以及残余活性读数的日期/时间和量。
- 将带有鼠标的梭子插入扫描仪开口。蓝色指示灯将指示与系统正确对接。
- 选择合适的 PET/CT 参数。获取成像数据。
注意:在这项研究中,运行 7 分钟静态 18F PET 扫描,然后运行 70 秒默认 CT 扫描,并应用最大似然预期最大化 3D 重建算法(G8 扫描仪中的默认和唯一选项)来重建数据12。 - 采集完成后,航天飞机将返回其初始起始位置。用鼠标取下梭子并将其插入扩展坞。按下 BCAM 垂直卡舌的背面,将其从 G8 穿梭机上取下,然后用鼠标轻轻拉起并取下 BCAM。
- 按下两个固定片向上翻转并打开 BCAM 的顶部。
- 轻轻地拔下鼠标。确保小鼠已从麻醉中完全恢复,并且在返回其家笼之前保持明亮、警觉和反应灵敏 (BAR)。
- 以设定的时间间隔继续该过程以扫描整个小鼠队列/组。
6. 将图像上传到 SaaS
- 登录到 app.invivo.ax 并创建一个项目。
- 单击窗口右上角的红色 上传 选项卡。选择成像研究中使用的成像系统和报告基因(即 [18F]FDG)。选择包含映像数据的文件夹。
- 导航到项目文件夹中的 annotation 选项卡。单击 Annotate 添加相关扫描信息(受试者名称、性别、BCAM 大小、受试者权重、队列名称、时间点和注射剂量值)。大多数元数据将自动填充。
7. 自动数据分析
- 在项目文件夹中,应填充所有扫描内容。单击 扫描 内容以从项目、组和单个主题级别导航。选择右上角的 Analyze 。
- 在分析功能区窗口右上角的 Project 下,选择 加 号,然后选择 Organ Probability Map ROI。器官概率图 (OPM) 是一种统计小鼠器官图谱,包含多个预定义的器官和组织。根据研究需要选择感兴趣的单个器官。
注:在此示例中,使用 VivoQuant 使用样条工具进行手动分割和分析,然后在 3D ROI 运算符中进行插值。将自动分析结果与手动分割结果进行比较作为基准。
结果
上传后,PET 数据可以在 SaaS 网站上以冠状状、矢状和横向图像面板的形式查看,这些图像叠加着由 OPM 决定的选定器官 ROI(图 3A)。该软件不仅可以加载单个图像,还可以将一组或整个研究中的多只小鼠同时视为单个折叠图像。在此分析窗口中,有一些选项可以自定义 ROI 颜色、比例尺强度和其他常用参数。一旦选择了理想的分析指标,SaaS 就会生成所选器官的可下载生物分布条形图(图 3B)。
为了评估基于 OPM 的 SaaS 平台的性能,将自动分析的结果与经验丰富的成像分析师得出的结果作为黄金标准进行了比较。对来自大脑、心脏、肾脏 (右) 和脾脏的 [18F] FDG 摄取值进行拟合线性回归。值得注意的是,该平台提供了一个全面的器官列表供用户选择,包括骨骼、大脑、膀胱、心脏、肾脏(左右)、肝脏、脾脏、肺和股四头肌(左右)。本研究选择上述 4 个器官仅用于说明目的。此外,由于植入肿瘤的大小、形状和深度/位置可变,肿瘤未作为器官包含在 OPM 中,因此被排除在比较分析之外。如图 4 所示,自动分析和手动分析产生了总体一致的结果,大脑显示出最高的相关性 (r2 = 0.8466)。这是意料之中的,因为器官体积大,而且大脑在颅骨内的位置高度恒定。右肾和心脏也分别显示出 0.6874 和 0.4849 的合理 r2 值。相比之下,脾脏的相关性分析产生的 r2 值为 0.3922,这是受测器官中最低的。这并不奇怪,因为脾脏嵌套在胰腺和脂肪组织中,这些组织缺乏明确的形态,并且在 CT 上假定相同的软组织密度。因此,脾脏很难手动分割,OPM 可能提供一种更精确的方法来划分该器官(即,优于金标准)。这些相关性分析的斜率和 Y 轴截距也显示在 图 4 中。与 r2 值一致,大脑具有最接近 1 的斜率(即 OPM 和手动结果之间的完美相关性)和最小的 Y 截距(即最小的系统偏差),而其他器官显示出与完美相关性的更大且可变的偏差。

图 1:BCAM 和模板引导的肿瘤植入。 (A) 预夹 (1) 通过连接的麻醉线 (3) 连接到 BCAM 模具 (2) 的底部。这作为肿瘤植入基础。(B) 在细胞注射前,将剃光目标植入部位(在本例中为右肩)的小鼠置于麻醉下放在底座上。(C) 肿瘤植入模板 (4) 具有预定义的切口,以指导肿瘤细胞接种的放置。(D) 在细胞注射前制作临时参考标记,将模板模具放置在小鼠的背侧。 请单击此处查看此图的较大版本。
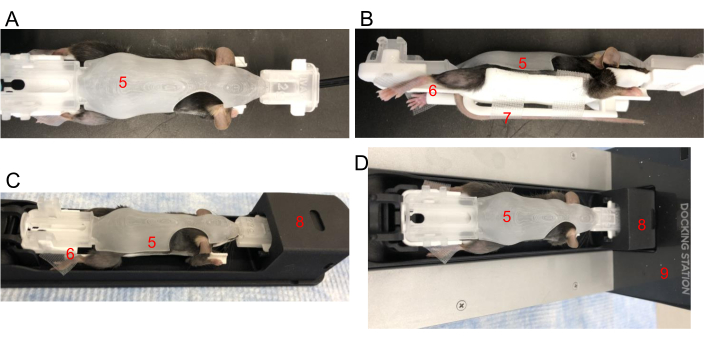
图 2:在 BCAM 中定位鼠标。 (A) 俯视图 - 将鼠标紧贴在适当大小的 BCAM (5) 中。(B) 侧视图 - 胶带用于将后爪固定在平台 (6) 上。尾巴用胶带固定在鼠标正下方的尾部平台 (7) 上。(C) 将 BCAM 中的鼠标插入成像梭 (8)。(D) 鼠标、BCAM 和穿梭车连接到运行麻醉的扩展坞 (9)。 请单击此处查看此图的较大版本。
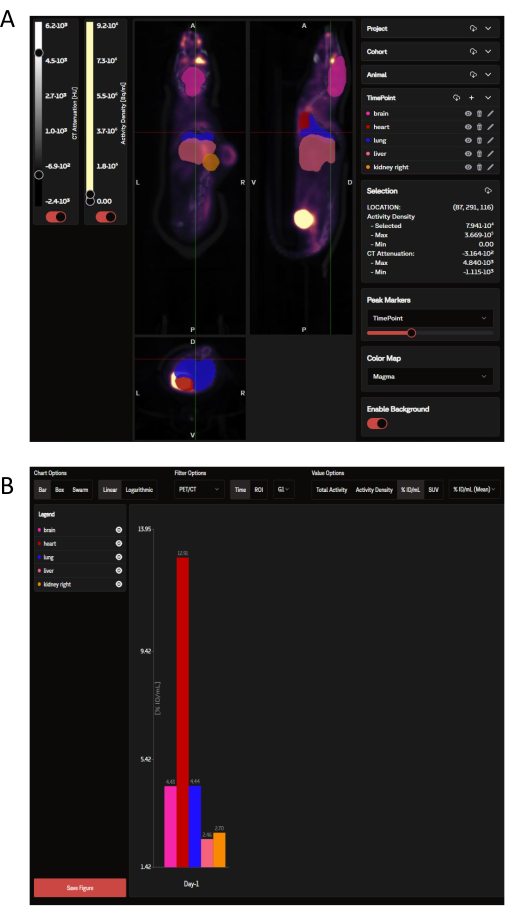
图 3:SaaS 工具分别查看和分析的代表性图像和数据输出。 (A) 在 SaaS 网站上查看的代表性图像。PET/CT 图像的冠状、矢状和横向视图与从器官概率图 (OPM) 中选择的器官 ROI 重叠。粉红色:大脑;红色:心形;深蓝色:肺;鲑鱼:肝脏;橙色:肾脏(右)。肿瘤不是由 OPM 定义的。(B) 从自动分析生成的代表性可下载图表。可以在左上方的面板中看到所选器官的列表。此处的数据以 %ID/mL 为单位报告。 请单击此处查看此图的较大版本。
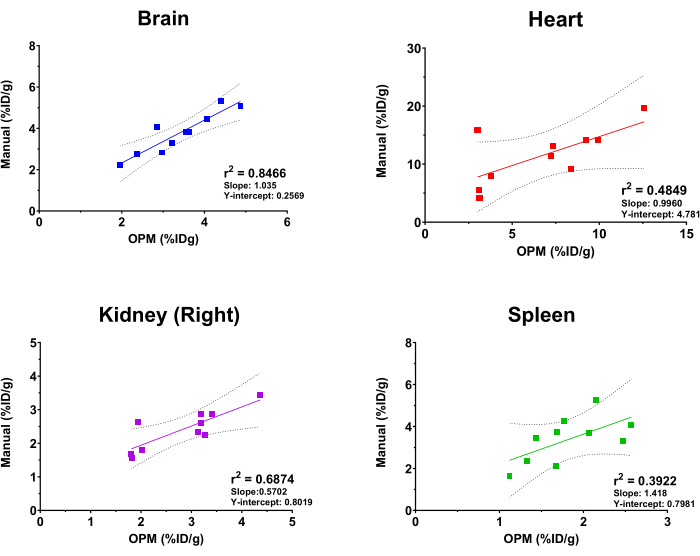
图 4:线性回归分析,比较通过手动分析和基于 OPM 的自动化工作流程得出的器官 [18F]FDG 摄取值。 使用雌性 C57BL/6 小鼠的 10 次 PET/CT 扫描。r2 值、95% 置信线、斜率和 Y 截距显示在图表上每个指示器官。 请单击此处查看此图的较大版本。
讨论
本报告描述了使用 BCAM 模具进行小鼠 体内 PET 成像和使用自动化 SaaS 工具分析数据的过程。提供了有关小鼠制备、成像采集和数据处理的分步说明。这种自动化工作流程还产生了与手动分析一致的数据。下面重点介绍了一些关键的技术考虑因素。
虽然肿瘤不是 OPM 定义的器官之一,但该方案中的一个关键步骤是正确植入皮下肿瘤,以最终确保体腔内所有小鼠器官和 BCAM 的最佳对齐。只有当鼠标的脊椎相对较直且内部器官处于中性位置时,OPM 才能产生准确的数据。过大或错位的肿瘤可能会影响老鼠的姿势并压入其体腔,从而移动内部器官。反过来,这种转变将使 OPM 算法的结果定量分析出现偏差。其他人使用各种成像模式和分割算法报告了不直的脊柱对内部器官对齐的影响13,14。因此,使用模板指导肿瘤植入并密切监测肿瘤生长以确保肿瘤位置正确且处于理想的大小范围内至关重要。
另一个可能出现偏差的领域是选择合适尺寸的 BCAM。BCAM 以 2 g 积分形式制成,范围为 18-26 g。然而,由于具有不同身体成分的小鼠(例如,更多的肌肉与更多的脂肪)可能具有相同的体重但不同的身体尺寸,因此在以它们的体重作为一般参考的同时选择最合适的 BCAM 非常重要。通过反复试验来提升或降低水平,并记住正确的对齐至关重要。选择太大的 BCAM 会导致小鼠的内部器官"沉"得更靠近床底,这将特别影响肾脏和脊柱等背器官分析的准确性。相比之下,将鼠标放置在太小的 BCAM 中可能会压迫他们的体腔,扭曲器官位置,并可能导致他们的呼吸困难。使用胶带确保四肢固定在爪子平台上将有助于设置和定位。
尽管这种报道的工作流程可实现标准化和自动化的 PET 图像分析,但值得指出的是,目前的 OPM 是基于免疫活性 C57BL/6 小鼠品系和健康小鼠构建的。小鼠的其他品系和健康状况可能呈现不同的解剖学特征,需要对算法进行额外的调整、优化和验证。例如,NSG 或 NCG 等免疫缺陷菌株的脾脏较小。同样,携带原位肿瘤植入物的小鼠可能具有不同的大小、形状和内部器官位置,具体取决于其疾病状态。此工作流程的另一个限制是实验采集阶段的总体吞吐量。这主要是由于在 BCAM 中正确设置鼠标需要额外的时间。培训和练习可以提高作员正确放置的效率。添加第二个扩展坞还可以提高整体吞吐量,其中一个扩展坞可用于 BCAM 设置,另一个扩展坞可用于将鼠标移动到恢复笼中。尽管如此,即使在扫描前设置 BCAM 所需的时间增加,时间投资也能通过节省数据分析端的时间来获得回报。例如,在本研究中,OPM 分析 10 张图像(具有 4 个 ROI)所需的时间不到 10 分钟,而经验丰富的分析师需要 3-4 小时来手动分割和分析同一组图像和 ROI。没有经验的分析师将需要更多时间进行手动分析。SaaS 平台允许对 PET 扫描进行大批量分析,其中完整的 体内 生物分布分析可以在数据上传后的几分钟内完成。在处理来自多个组和/或跨多个时间点的大量数据时,这是一个非常有用的功能,如下所述。
对单个受试者的器官进行手动分割可能非常耗时,并且通常需要对作员进行大量的前期培训。即使经过足够的培训,手动分析也不可避免地面临作员间的差异,这可能会扭曲定量结果15,16。相比之下,自动分割和数据分析可以准确有效地确定放射性示踪剂的整体生物分布,并消除植根于人类作的变异性。自动化的这种好处在临床图像分析和临床前领域都已经看到。例如,Sluis 等人证明,单次扫描需要 4 小时才能分割感兴趣的器官,而基于 AI 云的方法则需要 30 分钟17。Nazari 等人的另一项研究还报告说,与两名人类医学物理学家相比,基于算法的肝脏和肾脏分析表明,准确结果在 7.0% 以内18。图 4 中的数据还清楚地展示了基于 SaaS 的 PET 成像分析工作流程的可靠性,与手动分析相比,自动分析产生了一致的结果。
总之,本文说明了使用 BCAM 模具促进标准化临床前 PET/CT 图像采集以及支持 SaaS 的自动化 PET 数据分析的工作流程。结果表明,这种平台技术相对易于使用,并且自动化生成的数据质量与手动分析一致,但具有显着的节省时间优势。因此,此工作流程可以为研究人员节省数百小时的数据分析时间,并有助于标准化和减少作员间的差异。该程序可以帮助开发多种不同模式和适应症的药物化合物。特别是,治疗性抗体、双特异性抗体免疫细胞接合器、抗体-药物偶联物,甚至纳米颗粒等大分子模式可以很容易地用放射性金属(例如 Zr-89、Cu-64)标记,以实现 PET 成像介导的生物分布评估19,20。同样,该平台技术可以帮助确定小鼠21 中新型放射治疗药物的剂量学。该程序的应用将为药物开发带来巨大的价值。
披露声明
所有作者均为 Pfizer, Inc. 的现任或前任员工。
致谢
特别感谢 Pfizer La Jolla Comparative Medicine Research and Technical 工作人员。
材料
| Name | Company | Catalog Number | Comments |
| [18F]FDG | PETNet Solutions, Culver City, CA | NA | Radiotracer used for PET imaging |
| 27 G needle | Becton, Dickinson and Company, San Diego, CA | 305136 | Used for cell injection |
| app.invivo.ax/login | Invivo Analytics, Seattle, WA | NA | Software as a Service webpage |
| Body Conforming Animal Molds | Invivo Analytics, Seattle, WA | NA | BCAMs with weight range of 18 - 26 g |
| Dose Calibrator; CRC-55tw | Capintec, Florham Park, NJ | CRC-55tw | Measurement of radioactive doses |
| G8 PET/CT scanner | Sofie Biosciences/Xodus Imaging, Torrence, CA | NA | Benchtop scanner with loading dock |
| G8-Docking station | Sofie Biosciences/Xodus Imaging, Torrence, CA | NA | Docking station for staging |
| Implantation Mold Template | Invivo Analytics, Seattle, WA | NA | Template for optimal tumor implantation |
| Lubricant eye ointment | BAUSCH & LOMB, Ontario, Canada | Soothe Nighttime | Eye lube for mice |
| Modified G8 shuttle | Invivo Analytics, Seattle, WA | NA | Shuttle for BCAM accommodation |
| Mouse anesthesia Induction box | Patterson Scientific, Waukesha, WI | 78933388 | Used for anesthetizing a mouse |
| PRE-Clip | Invivo Analytics, Seattle, WA | NA | BCAM adapter for anesthesia connection |
| Premiere Slide warmer | LabScientific, Danvers, MA | XH-2001 | Adjustable temp warmer used for tail vein dilation and anesthesia induction |
| Syringe (1 mL) | Becton, Dickinson and Company, San Diego, CA | 309659 | Used for cell injection |
| Tail Vein injection platform | Braintree Scientific, Pembroke, MA | IL-300 | Restrainer used for administering intravenous injections. |
| Vivoqaunt Software | Invicro, Needham, MA | NA | Software used for manual segmentation |
参考文献
- Huang, R., Wang, M., Zhu, Y., S Conti, P., Chen, K. Development of pet probes for cancer imaging. Curr Top Med Chem. 15 (8), 795-819 (2015).
- Schwenck, J., et al. Advances in pet imaging of cancer. Nat Rev Cancer. 23 (7), 474-490 (2023).
- Matthews, P. M., Rabiner, E. A., Passchier, J., Gunn, R. N. Positron emission tomography molecular imaging for drug development. Br J Clin Pharmacol. 73 (2), 175-186 (2012).
- Tavaré, R., et al. An effective immuno-pet imaging method to monitor CD8-dependent responses to immunotherapy. Cancer Res. 76 (1), 73-82 (2016).
- Maresca, K. P., et al. Preclinical evaluation of 89ZR-DF-IAB22M2C PET as an imaging biomarker for the development of the gucy2c-cd3 bispecific pf-07062119 as a t-cell engaging therapy. Mol Imaging Biol. 23 (6), 941-951 (2021).
- Nisnboym, M., et al. Immuno-pet imaging of cd69 visualizes t-cell activation and predicts survival following immunotherapy in murine glioblastoma. Cancer Res Commun. 3 (7), 1173-1188 (2023).
- Lee, C., et al. Efficacy and imaging-enabled pharmacodynamic profiling of Kras g12c inhibitors in xenograft and genetically engineered mouse models of cancer. Mol Cancer Ther. 22 (7), 891-900 (2023).
- Bollineni, V., Kramer, G., Jansma, E. P., Liu, Y., Oyen, W. J. A systematic review on [18f] flt-pet uptake as a measure of treatment response in cancer patients. Eur J Cancer. 55, 81-97 (2016).
- Everitt, S., et al. Imaging cellular proliferation during chemo-radiotherapy: A pilot study of serial 18f-flt positron emission tomography/computed tomography imaging for non-non-small-cell lung cancer. Int J Radiat Oncol Biol Phys. 75 (4), 1098-1104 (2009).
- Rashidian, M., et al. Predicting the response to CTLA-4 blockade by longitudinal non-invasive monitoring of cd8 t cells. J Exp Med. 214 (8), 2243-2255 (2017).
- Klose, A. D., Paragas, N. Automated quantification of bioluminescence images. Nat Commun. 9 (1), 4262 (2018).
- Gu, Z., et al. Performance Evaluation of G8, a high-sensitivity benchtop preclinical PET/CT Tomograph. J Nucl Med. 60 (1), 142-149 (2019).
- Bongratz, F., Rickmann, A. -. M., Wachinger, C. Abdominal organ segmentation via deep diffeomorphic mesh deformations. Sci Rep. 13 (1), 18270 (2023).
- Wang, H., Stout, D. B., Chatziioannou, A. F. Mouse atlas registration with non-tomographic imaging modalities-a pilot study based on simulation. Mol Imaging Biol. 14, 408-419 (2012).
- Montgomery, M. K., et al. Mouse lung automated segmentation tool for quantifying lung tumors after micro-computed tomography. PLoS One. 16 (6), e0252950 (2021).
- Montgomery, M. K., et al. Applying deep learning to segmentation of murine lung tumors in preclinical micro-computed tomography. Transl. Oncol. 40, 101833 (2024).
- Van Sluis, J., et al. Manual versus artificial intelligence-based segmentation as a pre-processing step in whole-body pet dosimetry calculations. Mol Imaging Biol. 25 (2), 435-441 (2023).
- Nazari, M., et al. Automated and robust organ segmentation for 3D-based internal dose calculation. EJNMMI Res. 11, 1-13 (2021).
- Goel, S., England, C. G., Chen, F., Cai, W. Positron emission tomography and nanotechnology: A dynamic duo for cancer theranostics. Adv Drug Deliv Rev. 113, 157-176 (2017).
- Campbell, D. O., et al. Preclinical evaluation of an anti-nectin-4 immunopet reagent in tumor-bearing mice and biodistribution studies in cynomolgus monkeys. Mol Imaging Biol. 18, 768-775 (2016).
- Bednarz, B., et al. Murine-specific internal dosimetry for preclinical investigations of imaging and therapeutic agents. Health Phys. 114 (4), 450-459 (2018).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。