Method Article
Tomografia preclinica a emissione di positroni con stampi animali conformi al corpo per l'analisi automatizzata delle immagini basata su cloud nei topi
In questo articolo
Riepilogo
Questo protocollo descrive la procedura per l'esecuzione dell'imaging PET in vivo su topi utilizzando Body Conforming Animal Molds (BCAM) nello scanner PET/CT G8. Vengono forniti dettagli tecnici sulla preparazione del topo, tra cui il corretto impianto del tumore, il posizionamento ottimale, l'acquisizione di immagini PET/CT assistita da BCAM e l'analisi dei dati.
Abstract
La tomografia a emissione di positroni (PET) è una modalità di imaging molecolare che può essere utilizzata per studiare una moltitudine di questioni farmacologiche, come la modulazione dei biomarcatori, l'occupazione dei recettori e la biodistribuzione dei composti di interesse. Negli studi di biodistribuzione, i soggetti sperimentali vengono spesso sottoposti a imaging longitudinale dopo aver ricevuto l'articolo di prova. Le immagini vengono quindi analizzate per derivare il profilo di distribuzione del composto in vari organi in diversi punti temporali. Ciò costituisce un passo cruciale nello sviluppo di un farmaco per comprendere la distribuzione e il profilo potenzialmente vincolante di un composto sperimentale. I metodi standard/manuali delle analisi di biodistribuzione basate sull'imaging PET, tuttavia, sono laboriosi e dispendiosi in termini di tempo e sono spesso associati a un'elevata variabilità inter-operatore. Inoltre, è difficile mantenere le posizioni degli animali coerenti tra i diversi punti temporali. Per ovviare a queste carenze, è stata utilizzata una serie di stampi animali conformi al corpo (BCAM) di topo per consentire un posizionamento rigido e coerente degli animali durante l'acquisizione dell'imaging PET/CT. Inoltre, è stata impiegata una piattaforma Software-as-a-Service (SaaS) costituita da una mappa di probabilità degli organi (OPM) basata su cloud e da uno strumento di segmentazione basato sull'intelligenza artificiale per consentire una quantificazione affidabile e automatizzata dei dati di imaging PET in vivo. Il flusso di lavoro qui presentato include (1) la preparazione dei topi per l'imaging con i BCAM, incluso il corretto impianto di tumori sottocutanei per essere compatibili con gli stampi, (2) l'acquisizione di immagini PET/CT con BCAM utilizzando lo scanner G8 e 3) l'esecuzione automatizzata della segmentazione degli organi e dell'analisi della biodistribuzione utilizzando il SaaS basato su cloud. [18F]L'FDG è stato utilizzato come tracciante esemplare, ma altri biomarcatori e/o composti radiomarcati possono essere facilmente adattati al flusso di lavoro. Questa procedura può essere eseguita in modo accurato ed efficace con una formazione minima e l'analisi automatizzata dei dati PET ha prodotto risultati soddisfacenti coerenti con il metodo manuale.
Introduzione
Le tecnologie di imaging molecolare in vivo sono strumenti importanti nello sviluppo di farmaci per facilitare la valutazione di tutti e tre i pilastri della farmacologia: biodistribuzione, coinvolgimento del bersaglio e modulazione della farmacodinamica 1,2,3. La tomografia a emissione di positroni (PET), con la sua traducibilità clinica e l'elevata sensibilità, è tra le modalità di imaging molecolare più comunemente utilizzate sia in ambito clinico che in quello preclinico di ricerca e sviluppo. Il fiorente campo dell'imaging PET preclinico e della radioteranostica è prezioso per lo sviluppo di terapie intrinseche al tumore, terapie mirate e nuove terapie immuno-oncologiche (IO). La continua comparsa e lo sviluppo di nuovi radiotraccianti Immuno-PET hanno il potenziale per influenzare specifici regimi farmacologici IO su misura e identificare i responder rispetto ai non-responder 4,5,6. Nel frattempo, i radiotraccianti metabolici-specifici, come [18F]FDG e [18F]FLT, possono monitorare la risposta di un tumore alla terapia e possono rispettivamente far luce sul fatto che un tumore stia proliferando attivamente o stia consumando glucosio7, o se le cellule tumorali stanno subendo l'arresto del ciclo cellulare per mezzo dell'inibizione 8,9.
L'imaging in vivo non invasivo presenta molteplici vantaggi rispetto ai tradizionali esperimenti farmacologici non di imaging. Ad esempio, l'imaging consente una valutazione sistemica e olistica della distribuzione di un farmaco e/o dell'effetto farmacologico nell'intero soggetto, che consente non solo il monitoraggio dell'efficacia nel sito target, ma anche il rilevamento di attività fuori sede impreviste. Grazie alla sua natura non invasiva, lo stesso insieme di animali può essere valutato longitudinalmente in diversi punti temporali e/o con diversi biomarcatori per affrontare questioni biologiche distinte10. Questo non solo riduce significativamente il numero di animali necessari per lo studio, ma fornisce anche un controllo ortogonale tra i punti temporali e, quindi, aiuta a migliorare le correlazioni e ridurre le variabilità individuali. Nonostante lo sviluppo così promettente di biomarcatori di imaging, la necessità di valutare i composti sperimentali in vivo con studi di biodistribuzione basati sull'imaging PET, tuttavia, si scontra con la mancanza di processi automatizzati efficienti per l'analisi. Gli studi di biodistribuzione della PET generano informazioni preziose sulla cinetica, l'accumulo tissutale, il legame e il metabolismo di un composto. Ottenere dati quantitativi altamente riproducibili è fondamentale per lo sviluppo di terapie farmaceutiche.
Per rispondere a queste esigenze insoddisfatte nell'analisi automatizzata delle immagini PET, InVivo Analytics ha progettato una serie di stampi animali conformi al corpo (BCAM) di topo11. Si tratta di stampi in plastica stampati in 3D che mantengono la testa, il busto (e gli organi interni), la coda e gli arti di un topo in posizioni rigide e predefinite. È possibile selezionare stampi di diverse dimensioni in base al peso corporeo dell'animale e creare ritagli in regioni specifiche, come la spalla o la parte inferiore del fianco, per consentire ai tumori sottocutanei di sporgere. Le immagini PET/CT acquisite con questi BCAM sono altamente uniformi e possono essere analizzate in batch dalla piattaforma di segmentazione automatizzata basata su cloud dell'azienda11. Questo articolo presenta un flusso di lavoro automatizzato per l'analisi della biodistribuzione in vivo che si basa sull'acquisizione fisica di immagini con BCAM e sull'esecuzione della segmentazione e dell'analisi delle immagini da parte del SaaS.
Protocollo
Tutte le procedure eseguite sugli animali hanno seguito le normative e le linee guida stabilite e sono state esaminate e approvate dal Comitato istituzionale per la cura e l'uso degli animali di Pfizer o attraverso un processo di revisione etica. Lo studio di imaging PET è stato eseguito seguendo tutti i protocolli istituzionali di sicurezza dalle radiazioni. In questo studio sono stati utilizzati topi femmina C57BL/6, di 10-12 settimane, con peso corporeo compreso tra 18 e 26 g. I dettagli dei reagenti e delle attrezzature utilizzate sono elencati nella Tabella dei Materiali.
1. Preparazione e stadiazione degli animali
NOTA: Questa fase prevede la stadiazione degli animali per l'imaging PET con impianto tumorale guidato da modello BCAM.
- Prima dell'impianto cellulare, radere il pelo dei topi nella regione desiderata di crescita del tumore.
- Installa la stazione di anestesia e attacca uno stampo BCAM della dimensione appropriata alla pre-clip con la parte superiore ribaltata di 90 gradi. Questo servirà come base per l'impianto del tumore (Figura 1A).
- Anestetizzare gli animali in un'apposita scatola di induzione con isoflurano al 2,0% e ossigeno al 98% a una portata di 0,5-1,5 L/min.
NOTA: Tutti i sistemi di anestesia sono variabili.- Utilizzare un sistema calibrato e testare prima dell'uso. Posizionare un topo anestetizzato sulla base ed estenderne gli arti (Figura 1B).
- Posizionare delicatamente uno stampo per iniezione tumorale BCAM (Figura 1C) sul lato dorsale del topo (Figura 1D).
- Creare con cautela un segno di riferimento circolare temporaneo nel punto di apertura desiderato (ad es. spalla o fianco, sinistra o destra) con un pennarello (Figura 1D). Rimuovere lo stampo della sagoma.
- Preparare le cellule per l'iniezione aspirando il volume desiderato in una siringa. Collegare un ago da 27 G alla siringa e riempire lo spazio del volume morto. Si raccomanda un volume di 0,1-0,2 ml per inoculazione.
- Sollevare la pelle con le dita o con una pinza utilizzando i segni temporanei del passaggio 1.5 come riferimento per creare una tenda, inserire lentamente l'ago e iniettare le cellule per via sottocutanea nella posizione desiderata. Gettare l'ago in un contenitore per oggetti taglienti a rischio biologico.
- Monitorare la crescita del tumore. Il volume medio del tumore all'arruolamento in questo esempio era di 200-300 mm3.
NOTA: Evitare l'uso di componenti metallici come marchi auricolari o microchip per prevenire artefatti di imaging TC.
2. Prelievo di dosi radioattive
- Seguendo tutti i protocolli istituzionali di sicurezza dalle radiazioni, prelevare attentamente una dose target di [18F]FDG nell'intervallo di circa 70-80 μCi in una siringa sterile adatta per l'iniezione endovenosa.
NOTA: L'intervallo 70-80 μCi è ottimale per adattarsi alla gamma dinamica dello scanner PET Sofie G8. Altri imager possono avere intervalli dinamici diversi che richiedono una dose target diversa. - Misurare attentamente la dose radioattiva in un calibratore di dose posizionando la siringa nella camera del pozzetto e abbassando il mestolo. Prestare attenzione alla selezione dell'isotopo o del numero di calibrazione appropriato prima della misurazione.
- Effettua una lettura stabile. Registra data e ora. Aggiustare la dose se necessario.
- (Facoltativo) Utilizzare soluzione fisiologica sterile per portare il volume della dose finale a 0,1-0,2 ml.
NOTA: Il volume di iniezione desiderato può variare. - La dose è pronta per essere somministrata.
3. Somministrazione di dosi per via endovenosa
- Seguendo i protocolli istituzionali IACUC e di sicurezza dalle radiazioni, preparare la coda del topo per l'iniezione endovenosa dilatando la vena caudale. In questo studio, la vena caudale è stata dilatata posizionando la gabbia dell'animale o la camera di induzione su uno scaldavetrini impostato a 42 °C.
NOTA: Potrebbero essere necessari fino a 10 minuti di riscaldamento prima che la vena caudale si dilanci completamente. - Prima dell'iniezione, registrare il peso del topo. Questo determinerà quale BCAM specifico per il peso utilizzare per l'imaging PET/CT.
- Una volta pronto, trasferire il topo in un sistema di contenzione adatto (ad esempio, nel presente studio è stata utilizzata una piattaforma di iniezione della vena caudale) e individuare la vena caudale.
- Maneggiare con cura la siringa radioattiva e iniettare la dose in un topo cosciente. Registrare il tempo di iniezione.
- Mettere da parte con cura la siringa e pulire le gocce di sangue in eccesso dalla coda con una garza. Rimuovere il mouse dal sistema di ritenuta e riporlo nell'apposito alloggiamento.
- Riposizionare con cautela la siringa nella camera del calibratore della dose e registrare eventuali letture residue per un corretto calcolo della dose. Registrare la data e l'ora della lettura dell'attività residua.
- Una volta completate le iniezioni, prestare attenzione e posizionare coorti di topi dietro involucri di piombo e/o lontano dal personale, seguendo le pratiche di radioterapia sicure per l'istituto. Nota Tutti i materiali utilizzati sono soggetti a contaminazione radioattiva lieve. Monitora tutte le aree con un contatore Geiger calibrato e pulisci secondo le linee guida sulla sicurezza dalle radiazioni.
4. Anestetizzazione e posizionamento degli animali per l'imaging PET
- Al momento opportuno (ad esempio, 10-15 minuti prima della fine del periodo di assorbimento del tracciante), accendere tutte le apparecchiature per anestesia e gli strumenti di riscaldamento degli animali necessari sia per l'induzione dell'anestesia che per l'imaging PET. L'anestesia può essere impostata al 2,0%-2,5% di isoflurano in ossigeno al 98% (le impostazioni possono variare in base al ceppo del topo e al modello di malattia).
- Verificare che tutti gli adattatori e le valvole siano accesi e che la portata del gas sia 0,5-1,0 L/min. Le velocità di flusso specifiche possono variare tra i sistemi di anestesia e i sistemi di imaging.
- Posizionare gli animali appropriati in una scatola di induzione e attendere che il soggetto raggiunga la corretta profondità di anestesia.
- Applicare un unguento lubrificante per gli occhi su ciascun occhio.
- Trasferisci il mouse in un BCAM di dimensioni adeguate in base al peso corporeo.
- Prendi delicatamente il mouse per la nuca, inserisci la coda nella fessura della coda e avvolgila sotto il BCAM. Posiziona la coda sulla piattaforma di coda e fissa del nastro adesivo per fissare la posizione. Controlla che la colonna vertebrale sia dritta. Chiudere delicatamente il BCAM (Figura 2A, B).
- Posiziona con cura tutti e quattro gli arti in modo che appoggino su ciascuna delle piattaforme delle zampe BCAM. Utilizzare il nastro adesivo secondo necessità per fissare le zampe a ciascuna piattaforma (Figura 2B).
- Inserire delicatamente il BCAM nella navetta del letto di imaging inserendo prima l'estremità anteriore (Figura 2C). La navetta deve essere già collegata alla banchina di carico G8 con flusso di anestesia (Figura 2D). Spingendo verso il basso il retro del BCAM, un clic indicherà che è fissato alla navetta G8.
NOTA: Mantenere l'alimentazione di anestetico in modo che l'animale rimanga nel piano anestetico desiderato durante l'imaging.
5. Acquisizione delle immagini
- Aprire il software di acquisizione PET G8. Le cartelle di studio, i parametri di scansione e gli ID dei soggetti possono essere creati in anticipo.
- Inserisci i dettagli dello studio nel software: peso del mouse, data/ora e quantità della dose iniziale prelevata, data/ora dell'iniezione e data/ora e quantità di lettura dell'attività residua.
- Inserire la navetta con il mouse nell'apertura dello scanner. Una spia blu indicherà il corretto aggancio al sistema.
- Selezionare i parametri PET/CT appropriati. Acquisizione di dati di imaging.
NOTA: In questo studio, è stata eseguita una scansione PET statica di 7 minuti a 18F, seguita da una scansione TC predefinita di 70 secondi, ed è stato applicato un algoritmo di ricostruzione 3D di massimizzazione dell'aspettativa di massima verosimiglianza (impostazione predefinita e unica opzione nello scanner G8) per ricostruire i dati12. - Al termine dell'acquisizione, lo shuttle tornerà alla sua posizione iniziale di partenza. Rimuovere la navetta con il mouse e inserirla nel dock. Premere sul retro della linguetta verticale BCAM per rimuoverla dalla navetta G8, quindi tirare delicatamente verso l'alto e rimuovere il BCAM con il mouse.
- Premere sulle due linguette di fissaggio per sollevare e aprire la parte superiore del BCAM.
- Rimuovere delicatamente il mouse. Assicurati che il topo si sia completamente ripreso dall'anestesia e sia luminoso, vigile e reattivo (BAR) prima di tornare nella sua gabbia di casa.
- Continuare la procedura a intervalli di tempo prestabiliti per scansionare l'intera coorte/gruppo di topi.
6. Caricamento di immagini sul SaaS
- Accedi a app.invivo.ax e crea un progetto.
- Fai clic sulla scheda rossa di caricamento in alto a destra della finestra. Selezionare un sistema di imaging e un reporter utilizzati nello studio di imaging (ad esempio, [18F]FDG). Selezionare la cartella con i dati di imaging.
- Passare alla scheda delle annotazioni all'interno della cartella del progetto. Fare clic su Annota per aggiungere informazioni rilevanti sulla scansione (nome del soggetto, sesso, dimensione BCAM, peso del soggetto, nome della coorte, punto temporale e valore della dose iniettata). La maggior parte dei metadati verrà compilata automaticamente.
7. Analisi automatizzata dei dati
- All'interno della cartella del progetto, tutte le scansioni dovrebbero essere popolate. Fare clic sulle scansioni per navigare tra i livelli di progetto, gruppo e singolo soggetto. Seleziona Analizza nell'angolo in alto a destra.
- In alto a destra nella finestra della barra multifunzione dell'analisi, in Progetto, selezionare il simbolo più e selezionare ROI mappa di probabilità dell'organo. L'Organ Probability Map (OPM) è un atlante statistico degli organi del topo che comprende più organi e tessuti predefiniti. Selezionare i singoli organi di interesse in base alle esigenze di ricerca.
NOTA: In questo esempio, la segmentazione e l'analisi manuale sono state eseguite utilizzando VivoQuant, utilizzando lo strumento spline, seguite dall'interpolazione all'interno dell'operatore 3D ROI. I risultati dell'analisi automatizzata sono stati confrontati con i risultati della segmentazione manuale come punto di riferimento.
Risultati
Una volta caricati, i dati PET possono essere visualizzati sul sito Web SaaS come un pannello di immagini coronali, sagittali e trasversali sovrapposte alle ROI degli organi selezionati dettate dall'OPM (Figura 3A). Non solo il software può caricare singole immagini, ma più mouse di un gruppo o di un intero studio possono essere visualizzati contemporaneamente come un'unica immagine compressa. All'interno di questa finestra di analisi, sono disponibili opzioni per personalizzare i colori del ROI, l'intensità della barra di scala e altri parametri comuni. Una volta selezionate le metriche analitiche ideali, il SaaS genera un grafico a barre di biodistribuzione scaricabile degli organi selezionati (Figura 3B).
Per valutare le prestazioni della piattaforma SaaS basata su OPM, i risultati dell'analisi automatizzata sono stati confrontati con quelli derivati da un analista di imaging esperto come gold standard. La regressione lineare fit è stata eseguita sui valori di assorbimento di [18F] FDG da cervello, cuore, rene (a destra) e milza. Da notare che la piattaforma offre un elenco completo di organi tra cui gli utenti possono scegliere, tra cui scheletro, cervello, vescica, cuore, reni (destro e sinistro), fegato, milza, polmoni e muscoli quadricipiti (destro e sinistro). I quattro organi di cui sopra sono stati selezionati in questo studio solo a scopo illustrativo. Inoltre, a causa delle dimensioni, della forma e della profondità/posizione variabili dei tumori impiantati, il tumore non è incluso come organo nell'OPM e quindi escluso da questa analisi comparativa. Come mostrato nella Figura 4, l'analisi automatizzata e l'analisi manuale hanno prodotto risultati complessivamente coerenti, con il cervello che ha mostrato la correlazione più alta (r2 = 0,8466). Ciò è previsto a causa delle grandi dimensioni dell'organo e della posizione altamente costante del cervello all'interno del cranio. Anche il rene destro e il cuore hanno mostrato valori ragionevoli di r2 di 0,6874 e 0,4849, rispettivamente. Al contrario, l'analisi di correlazione per la milza ha generato un valore r2 di 0,3922, che è il più basso tra gli organi testati. Ciò non sorprende in quanto la milza è annidata nel pancreas e nei tessuti adiposi che mancano di morfologia definita e presumono la stessa densità dei tessuti molli alla TC. La milza è, quindi, difficile da segmentare manualmente e l'OPM può presentare un mezzo più preciso per demarcare questo organo (cioè, superando il gold standard). La pendenza e l'intercetta Y di queste analisi di correlazione sono mostrate anche nella Figura 4. Coerentemente con i valori di r2 , il cervello aveva una pendenza più vicina a 1 (cioè una perfetta correlazione tra OPM e risultati manuali) e la più piccola intercetta Y (cioè un minimo bias sistemico), mentre gli altri organi mostravano una deviazione maggiore e variabile da una perfetta correlazione.

Figura 1: Impianto tumorale guidato da BCAM e modello. (A) La pre-clip (1) è fissata al pezzo inferiore di uno stampo BCAM (2) con una linea di anestesia collegata (3). Questo funge da base per l'impianto del tumore. (B) Un topo con il sito dell'impianto target rasato (in questo caso, la spalla destra) viene posizionato sulla base in anestesia prima dell'iniezione di cellule. (C) Dima di impianto tumorale (4) con ritagli predefiniti per guidare il posizionamento dell'inoculazione delle cellule tumorali. (D) Realizzazione di un segno di riferimento temporaneo prima dell'iniezione della cellula con lo stampo modello posizionato sul lato dorsale del topo. Clicca qui per visualizzare una versione più grande di questa figura.
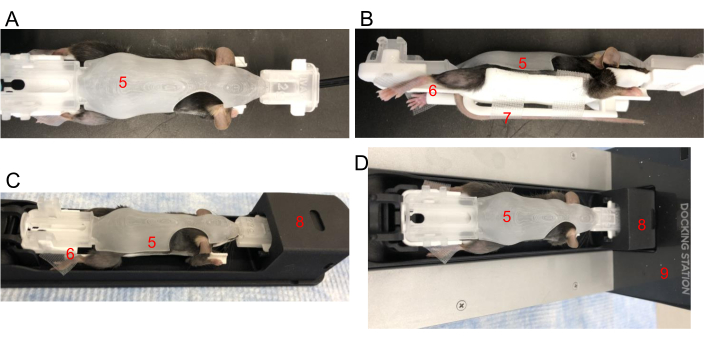
Figura 2: Posizionamento di un mouse in una BCAM. (A) Vista dall'alto - Posizionare un mouse in un BCAM di dimensioni adeguate (5). (B) Vista laterale - Il nastro viene utilizzato per fissare le zampe posteriori alle piattaforme (6). La coda è fissata con del nastro adesivo alla piattaforma di coda (7) direttamente sotto il mouse. (C) Il topo, nel BCAM, viene inserito nella navetta per immagini (8). (D) Il mouse, il BCAM e la navetta sono collegati a una docking station per anestesia (9). Clicca qui per visualizzare una versione più grande di questa figura.
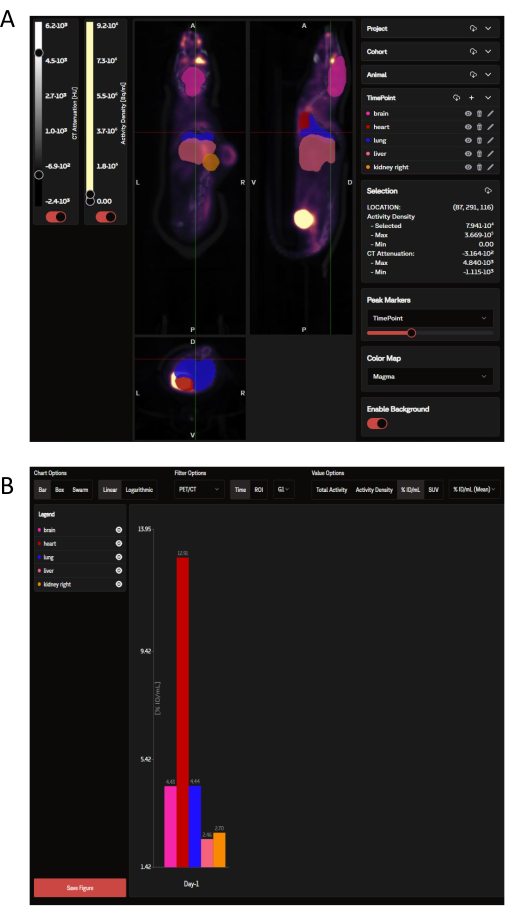
Figura 3: Immagini rappresentative e output dei dati visualizzati e analizzati rispettivamente dallo strumento SaaS. (A) Immagini rappresentative visualizzate sul sito Web SaaS. Viste coronali, sagittali e trasversali dell'immagine PET/CT sovrapposte alle ROI degli organi selezionate dalla mappa di probabilità degli organi (OPM). Rosa: cervello; rosso: cuore; blu scuro: polmone; salmone: fegato; Arancione: rene (a destra). Il tumore non è definito dall'OPM. (B) Un grafico rappresentativo scaricabile generato dall'analisi automatizzata. Un elenco degli organi selezionati può essere visualizzato nel pannello in alto a sinistra. I dati qui riportati sono riportati in %ID/mL. Clicca qui per visualizzare una versione più grande di questa figura.
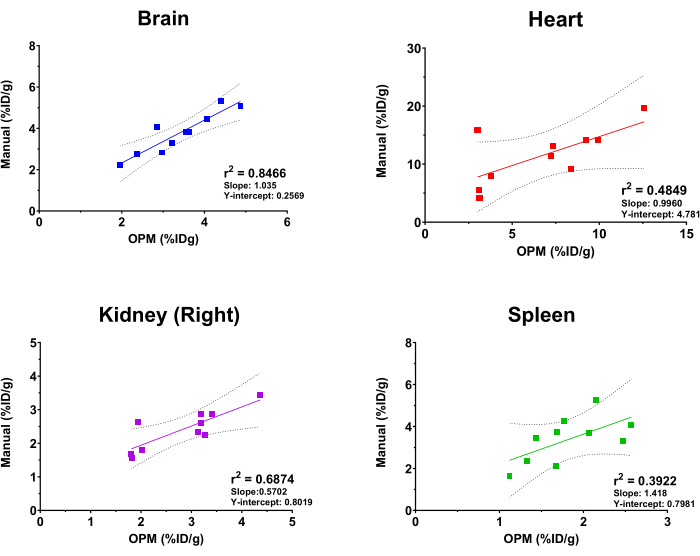
Figura 4: Analisi di regressione lineare che confronta i valori di assorbimento dell'organo [18F]FDG derivati dall'analisi manuale e dal flusso di lavoro di automazione basato su OPM. Sono state utilizzate dieci scansioni PET/TC di topi femmina C57BL/6. I valori r2 , le linee di confidenza del 95%, la pendenza e le intercette Y vengono visualizzati sul grafico per ciascun organo indicato. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Il presente rapporto descrive la procedura di esecuzione dell'imaging PET in vivo del topo con gli stampi BCAM e l'analisi dei dati con lo strumento SaaS automatizzato. Vengono fornite istruzioni dettagliate sulla preparazione del mouse, l'acquisizione delle immagini e l'elaborazione dei dati. Questo flusso di lavoro di automazione ha anche prodotto dati coerenti con l'analisi manuale. Di seguito sono evidenziate alcune considerazioni tecniche chiave.
Sebbene un tumore non sia uno degli organi definiti dall'OPM, un passaggio critico in questo protocollo è il corretto impianto di tumori sottocutanei per garantire in definitiva l'allineamento ottimale di tutti gli organi di topo all'interno della cavità corporea e BCAM. L'OPM può produrre dati accurati solo quando la colonna vertebrale di un topo è relativamente diritta e gli organi interni sono posizionati in modo neutro. Tumori eccessivamente grandi o fuori posto potrebbero influenzare la postura del topo e premere nella sua cavità corporea, spostando così gli organi interni. Questo cambiamento, a sua volta, distorcerà l'analisi quantitativa risultante dall'algoritmo OPM. Altri hanno riportato l'impatto di una colonna vertebrale non dritta sull'allineamento degli organi interni utilizzando varie modalità di imaging e algoritmi di segmentazione13,14. Pertanto, è fondamentale utilizzare il modello per guidare l'impianto del tumore e monitorare attentamente la crescita del tumore per garantire che i tumori siano posizionati correttamente e nell'intervallo di dimensioni ideali.
Un'altra area di possibile deviazione è la selezione di un BCAM di dimensioni adeguate. I BCAM sono creati in integrali da 2 g, con un intervallo di 18-26 g. Tuttavia, poiché i topi con composizioni corporee diverse (ad esempio, più muscoli contro più grasso) possono avere lo stesso peso corporeo ma dimensioni fisiche diverse, è importante scegliere il BCAM più adatto utilizzando il loro peso corporeo come riferimento generale. Sali o scendi di livello per tentativi ed errori e tieni presente che il corretto allineamento è fondamentale. La scelta di un BCAM troppo grande farà sì che gli organi interni del topo "affondino" più vicino al fondo del letto, il che influirà in particolare sull'accuratezza dell'analisi per gli organi dorsali come i reni e la colonna vertebrale. Al contrario, posizionare un topo in BCAM troppo piccolo potrebbe premere sulle cavità del corpo, inclinare il posizionamento degli organi e potenzialmente causare difficoltà respiratorie. L'uso del nastro adesivo per garantire che gli arti siano fissati sulle piattaforme delle zampe aiuterà con l'installazione e il posizionamento.
Sebbene questo flusso di lavoro riportato consenta un'analisi standardizzata e automatizzata delle immagini PET, vale la pena sottolineare che l'attuale OPM è costruito sulla base del ceppo di topo immunocompetente C57BL/6 e di topi sani. Altri ceppi e condizioni di salute dei topi possono presentare diverse caratteristiche anatomiche che richiedono ulteriori regolazioni, ottimizzazioni e convalida dell'algoritmo. Ad esempio, i ceppi immunodeficienti come NSG o NCG hanno milze più piccole. Allo stesso modo, i topi portatori di impianti tumorali ortotopici possono avere dimensioni, forme e posizioni diverse degli organi interni a seconda del loro stato di malattia. Un'altra limitazione di questo flusso di lavoro è la produttività complessiva durante la fase di acquisizione di un esperimento. Ciò è dovuto principalmente al tempo aggiuntivo necessario per impostare correttamente un mouse nel BCAM. La formazione e la pratica potrebbero aumentare l'efficienza dell'operatore nel corretto posizionamento. L'aggiunta di una seconda docking station può anche aumentare la produttività complessiva, in cui un dock può servire per la configurazione BCAM e l'altro può servire per rimuovere un mouse in una gabbia di recupero. Tuttavia, anche con l'aumento del tempo necessario per la configurazione della BCAM prima della scansione, l'investimento in termini di tempo si ripaga risparmiando tempo sul lato dell'analisi dei dati. Ad esempio, nel presente studio, l'OPM ha impiegato meno di 10 minuti per analizzare dieci immagini (con 4 ROI), mentre un analista di grande esperienza ha impiegato 3-4 ore per segmentare e analizzare manualmente lo stesso set di immagini e ROI. Un analista inesperto richiederebbe ancora più tempo per l'analisi manuale. La piattaforma SaaS consente l'analisi di scansioni PET in grandi lotti, dove l'analisi completa della biodistribuzione in vivo può essere completata in pochi minuti dopo il caricamento dei dati. Si tratta di una funzionalità estremamente utile quando si gestiscono grandi quantità di dati provenienti da più gruppi e/o in diversi punti temporali, come illustrato di seguito.
La segmentazione manuale degli organi per un singolo soggetto può richiedere molto tempo e di solito richiede una significativa formazione iniziale dell'operatore. Anche con un'adeguata formazione, le analisi manuali si scontrano inevitabilmente con variabilità interoperatorie, che possono distorcere i risultati quantitativi15,16. Al contrario, la segmentazione automatizzata e l'analisi dei dati possono determinare in modo accurato ed efficiente la biodistribuzione complessiva di un radiotracciante ed eliminare le variabilità radicate nelle operazioni umane. Tali vantaggi dell'automazione sono stati osservati sia nell'analisi delle immagini cliniche che nello spazio preclinico. Ad esempio, Sluis et al. hanno dimostrato che una singola scansione richiedeva 4 ore per segmentare gli organi di interesse rispetto ai 30 minuti dei metodi basati su cloud di intelligenza artificiale17. Un altro studio di Nazari et al. ha anche riportato che l'analisi basata su algoritmi del fegato e dei reni ha dimostrato risultati accurati entro il 7,0% rispetto a due fisici medici umani18. I dati nella Figura 4 hanno anche mostrato chiaramente l'affidabilità del flusso di lavoro di analisi dell'imaging PET basato su SaaS e che l'analisi automatizzata ha prodotto risultati coerenti rispetto all'analisi manuale.
In sintesi, questo articolo illustra il flusso di lavoro dell'utilizzo degli stampi BCAM per facilitare l'acquisizione standardizzata di immagini PET/CT precliniche e l'analisi automatizzata dei dati PET abilitata per SaaS. È dimostrato che questa tecnologia di piattaforma è relativamente semplice da utilizzare e che la qualità dei dati generati dall'automazione è coerente con l'analisi manuale, ma vanta notevoli vantaggi in termini di risparmio di tempo. Pertanto, questo flusso di lavoro può far risparmiare ai ricercatori centinaia di ore di tempo per l'analisi dei dati e aiutare a standardizzare e ridurre la variabilità tra gli operatori. Questa procedura può aiutare nello sviluppo di una moltitudine di composti farmacologici attraverso modalità e indicazioni. In particolare, le modalità di grandi molecole come gli anticorpi terapeutici, gli attivatori di cellule immunitarie anticorpali bi-specifici, i coniugati anticorpo-farmaco e persino le nanoparticelle possono essere facilmente marcate con radiometalli (ad esempio, Zr-89, Cu-64) per consentire la valutazione della biodistribuzione mediata dall'imaging PET19,20. Allo stesso modo, questa tecnologia di piattaforma può aiutare a determinare la dosimetria di nuove terapie radio nei topi21. L'applicazione di questa procedura sarà un grande valore aggiunto per lo sviluppo di farmaci.
Divulgazioni
Tutti gli autori sono dipendenti attuali o passati di Pfizer, Inc.
Riconoscimenti
Un ringraziamento speciale al personale tecnico e di ricerca di medicina comparata di Pfizer La Jolla.
Materiali
| Name | Company | Catalog Number | Comments |
| [18F]FDG | PETNet Solutions, Culver City, CA | NA | Radiotracer used for PET imaging |
| 27 G needle | Becton, Dickinson and Company, San Diego, CA | 305136 | Used for cell injection |
| app.invivo.ax/login | Invivo Analytics, Seattle, WA | NA | Software as a Service webpage |
| Body Conforming Animal Molds | Invivo Analytics, Seattle, WA | NA | BCAMs with weight range of 18 - 26 g |
| Dose Calibrator; CRC-55tw | Capintec, Florham Park, NJ | CRC-55tw | Measurement of radioactive doses |
| G8 PET/CT scanner | Sofie Biosciences/Xodus Imaging, Torrence, CA | NA | Benchtop scanner with loading dock |
| G8-Docking station | Sofie Biosciences/Xodus Imaging, Torrence, CA | NA | Docking station for staging |
| Implantation Mold Template | Invivo Analytics, Seattle, WA | NA | Template for optimal tumor implantation |
| Lubricant eye ointment | BAUSCH & LOMB, Ontario, Canada | Soothe Nighttime | Eye lube for mice |
| Modified G8 shuttle | Invivo Analytics, Seattle, WA | NA | Shuttle for BCAM accommodation |
| Mouse anesthesia Induction box | Patterson Scientific, Waukesha, WI | 78933388 | Used for anesthetizing a mouse |
| PRE-Clip | Invivo Analytics, Seattle, WA | NA | BCAM adapter for anesthesia connection |
| Premiere Slide warmer | LabScientific, Danvers, MA | XH-2001 | Adjustable temp warmer used for tail vein dilation and anesthesia induction |
| Syringe (1 mL) | Becton, Dickinson and Company, San Diego, CA | 309659 | Used for cell injection |
| Tail Vein injection platform | Braintree Scientific, Pembroke, MA | IL-300 | Restrainer used for administering intravenous injections. |
| Vivoqaunt Software | Invicro, Needham, MA | NA | Software used for manual segmentation |
Riferimenti
- Huang, R., Wang, M., Zhu, Y., S Conti, P., Chen, K. Development of pet probes for cancer imaging. Curr Top Med Chem. 15 (8), 795-819 (2015).
- Schwenck, J., et al. Advances in pet imaging of cancer. Nat Rev Cancer. 23 (7), 474-490 (2023).
- Matthews, P. M., Rabiner, E. A., Passchier, J., Gunn, R. N. Positron emission tomography molecular imaging for drug development. Br J Clin Pharmacol. 73 (2), 175-186 (2012).
- Tavaré, R., et al. An effective immuno-pet imaging method to monitor CD8-dependent responses to immunotherapy. Cancer Res. 76 (1), 73-82 (2016).
- Maresca, K. P., et al. Preclinical evaluation of 89ZR-DF-IAB22M2C PET as an imaging biomarker for the development of the gucy2c-cd3 bispecific pf-07062119 as a t-cell engaging therapy. Mol Imaging Biol. 23 (6), 941-951 (2021).
- Nisnboym, M., et al. Immuno-pet imaging of cd69 visualizes t-cell activation and predicts survival following immunotherapy in murine glioblastoma. Cancer Res Commun. 3 (7), 1173-1188 (2023).
- Lee, C., et al. Efficacy and imaging-enabled pharmacodynamic profiling of Kras g12c inhibitors in xenograft and genetically engineered mouse models of cancer. Mol Cancer Ther. 22 (7), 891-900 (2023).
- Bollineni, V., Kramer, G., Jansma, E. P., Liu, Y., Oyen, W. J. A systematic review on [18f] flt-pet uptake as a measure of treatment response in cancer patients. Eur J Cancer. 55, 81-97 (2016).
- Everitt, S., et al. Imaging cellular proliferation during chemo-radiotherapy: A pilot study of serial 18f-flt positron emission tomography/computed tomography imaging for non-non-small-cell lung cancer. Int J Radiat Oncol Biol Phys. 75 (4), 1098-1104 (2009).
- Rashidian, M., et al. Predicting the response to CTLA-4 blockade by longitudinal non-invasive monitoring of cd8 t cells. J Exp Med. 214 (8), 2243-2255 (2017).
- Klose, A. D., Paragas, N. Automated quantification of bioluminescence images. Nat Commun. 9 (1), 4262 (2018).
- Gu, Z., et al. Performance Evaluation of G8, a high-sensitivity benchtop preclinical PET/CT Tomograph. J Nucl Med. 60 (1), 142-149 (2019).
- Bongratz, F., Rickmann, A. -. M., Wachinger, C. Abdominal organ segmentation via deep diffeomorphic mesh deformations. Sci Rep. 13 (1), 18270 (2023).
- Wang, H., Stout, D. B., Chatziioannou, A. F. Mouse atlas registration with non-tomographic imaging modalities-a pilot study based on simulation. Mol Imaging Biol. 14, 408-419 (2012).
- Montgomery, M. K., et al. Mouse lung automated segmentation tool for quantifying lung tumors after micro-computed tomography. PLoS One. 16 (6), e0252950 (2021).
- Montgomery, M. K., et al. Applying deep learning to segmentation of murine lung tumors in preclinical micro-computed tomography. Transl. Oncol. 40, 101833 (2024).
- Van Sluis, J., et al. Manual versus artificial intelligence-based segmentation as a pre-processing step in whole-body pet dosimetry calculations. Mol Imaging Biol. 25 (2), 435-441 (2023).
- Nazari, M., et al. Automated and robust organ segmentation for 3D-based internal dose calculation. EJNMMI Res. 11, 1-13 (2021).
- Goel, S., England, C. G., Chen, F., Cai, W. Positron emission tomography and nanotechnology: A dynamic duo for cancer theranostics. Adv Drug Deliv Rev. 113, 157-176 (2017).
- Campbell, D. O., et al. Preclinical evaluation of an anti-nectin-4 immunopet reagent in tumor-bearing mice and biodistribution studies in cynomolgus monkeys. Mol Imaging Biol. 18, 768-775 (2016).
- Bednarz, B., et al. Murine-specific internal dosimetry for preclinical investigations of imaging and therapeutic agents. Health Phys. 114 (4), 450-459 (2018).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon