Method Article
Farelerde Bulut Tabanlı Otomatik Görüntü Analizi için Vücuda Uygun Hayvan Kalıpları ile Preklinik Pozitron Emisyon Tomografisi
Bu Makalede
Özet
Bu protokol, G8 PET/CT tarayıcıda Vücuda Uygun Hayvan Kalıpları (BCAM'ler) kullanılarak fareler üzerinde in vivo PET görüntüleme gerçekleştirme prosedürünü açıklar. Uygun tümör implantasyonu, optimal konumlandırma, BCAM destekli PET/CT görüntü elde etme ve veri analizi dahil olmak üzere fare hazırlığı ile ilgili teknik ayrıntılar sağlanmaktadır.
Özet
Pozitron Emisyon Tomografisi (PET), biyobelirteç modülasyonu, reseptör doluluğu ve ilgilenilen bileşiklerin biyodağılımı gibi çok sayıda farmakolojik soruyu araştırmak için kullanılabilen bir moleküler görüntüleme yöntemidir. Biyodağılım çalışmalarında, deney denekleri genellikle test makalesini aldıktan sonra uzunlamasına görüntülenir. Görüntüler daha sonra bileşiğin farklı zaman noktalarında çeşitli organlardaki dağılım profilini elde etmek için analiz edilir. Bu, bir araştırma bileşiğinin dağılımını ve potansiyel olarak bağlayıcı profilini anlamak için ilaç geliştirmede çok önemli bir adım oluşturur. Bununla birlikte, PET görüntülemeye dayalı biyodağılım analizlerinin standart/manuel yöntemleri, emek yoğun ve zaman alıcıdır ve genellikle operatörler arası yüksek değişkenlik ile ilişkilidir. Ayrıca, hayvanların konumlarını farklı zaman noktalarında tutarlı tutmak zordur. Bu eksiklikleri gidermek için, PET/CT görüntüleme edinimi sırasında hayvanların sert ve tutarlı bir şekilde konumlandırılmasını sağlamak için bir dizi fare Vücuduna Uyumlu Hayvan Kalıpları (BCAM'ler) kullanıldı. Ayrıca, in vivo PET görüntüleme verilerinin güvenilir ve otomatik olarak ölçülmesini sağlamak için bulut tabanlı bir Organ Olasılık Haritası (OPM) ve yapay zeka destekli bir segmentasyon aracından oluşan bir Hizmet Olarak Yazılım (SaaS) platformu kullanılmıştır. Burada sunulan iş akışı, (1) deri altı tümörlerin kalıplarla uyumlu olacak şekilde uygun şekilde implantasyonu da dahil olmak üzere farelerin BCAM'lerle görüntüleme için hazırlanmasını, (2) G8 tarayıcısını kullanarak BCAM'lerle PET/CT görüntülerinin elde edilmesini ve 3) bulut tabanlı SaaS kullanarak otomatik organ segmentasyonu ve biyodağılım analizi gerçekleştirmeyi içerir. [18F]FDG burada örnek bir izleyici olarak kullanılmıştır, ancak diğer biyobelirteçler ve/veya radyo etiketli bileşikler iş akışına kolayca uyarlanabilir. Bu prosedür, minimum eğitimle doğru ve etkili bir şekilde yürütülebilir ve otomatik PET veri analizi, manuel yöntemle tutarlı olarak tatmin edici sonuçlar vermiştir.
Giriş
İn vivo moleküler görüntüleme teknolojileri, farmakolojinin üç ayağının da (biyodağıtım, hedef katılımı ve farmakodinamik modülasyonu) değerlendirilmesini kolaylaştırmak için ilaç geliştirmede önemli araçlardır 1,2,3. Pozitron emisyon Tomografisi (PET), klinik translatabilitesi ve yüksek duyarlılığı ile hem klinikte hem de klinik öncesi araştırma ve geliştirme alanında en sık kullanılan moleküler görüntüleme yöntemleri arasında yer almaktadır. Klinik öncesi PET görüntüleme ve radyoteranostiklerin çiçek açan alanı, hem tümör intrinsik terapötiklerin, hedefe yönelik terapötiklerin hem de yeni İmmüno-Onkoloji (IO) tedavilerinin geliştirilmesi için değerlidir. Yeni İmmüno-PET radyoizleyicilerin sürekli ortaya çıkması ve geliştirilmesi, spesifik uyarlanmış IO ilaç rejimlerini etkileme ve yanıt verenlere karşı yanıt verenleri belirleme potansiyeline sahiptir 4,5,6. Bu arada, [18F]FDG ve [18F]FLT gibi metabolik spesifik radyoizleyiciler, bir tümörün tedaviye yanıtını izleyebilir ve sırasıyla bir tümörün aktif olarak çoğalıp çoğalmadığına veya glikoz7 tüketip tüketmediğine veya tümör hücrelerinin inhibisyon yoluyla hücre döngüsü durması geçirip geçirmediğine ışık tutabilir 8,9.
Non-invaziv in vivo görüntüleme, geleneksel, görüntüleme dışı farmakolojik deneylere kıyasla birçok avantaj sunar. Örneğin, görüntüleme, bir ilacın tüm denekteki dağılımının ve/veya farmakolojik etkisinin sistemik, bütünsel olarak değerlendirilmesine olanak tanır, bu da yalnızca hedef bölgedeki etkinliğin izlenmesini değil, aynı zamanda beklenmedik saha dışı aktivitelerin de tespit edilmesini sağlar. İnvaziv olmayan doğası nedeniyle, aynı hayvan grubu, farklı biyolojik soruları ele almak için farklı zaman noktalarında ve/veya farklı biyobelirteçlerle uzunlamasına değerlendirilebilir10. Bu sadece çalışma için gereken hayvan sayısını önemli ölçüde azaltmakla kalmaz, aynı zamanda zaman noktaları arasında ortogonal bir kontrol sağlar ve bu nedenle korelasyonları iyileştirmeye ve bireysel değişkenlikleri azaltmaya yardımcı olur. Görüntüleme biyobelirteçlerinin bu kadar umut verici gelişmesine rağmen, PET görüntülemeye dayalı biyo-dağıtım çalışmaları ile araştırma bileşiklerinin in vivo olarak değerlendirilmesi ihtiyacı, analiz için verimli otomatik süreçlerin eksikliği ile karşılanmaktadır. PET biyodağılım çalışmaları, bir bileşiğin kinetiği, doku birikimi, bağlanması ve metabolizması hakkında değerli bilgiler üretir. Yüksek oranda tekrarlanabilir kantitatif verilerin elde edilmesi, farmasötik tedavilerin geliştirilmesi için kritik öneme sahiptir.
InVivo Analytics, otomatik PET görüntü analizinde karşılanmayan bu ihtiyaçları karşılamak için bir dizi fare Vücuduna Uygun Hayvan Küfü (BCAM) tasarlamıştır11. Bunlar, bir farenin kafasını, gövdesini (ve iç organlarını), kuyruğunu ve uzuvlarını sert, önceden tanımlanmış pozisyonlarda tutan 3D baskılı plastik kalıplardır. Hayvanın vücut ağırlığına göre farklı büyüklükte kalıplar seçilebilir ve deri altı tümörlerin dışarı çıkmasına izin vermek için omuz veya alt kanat gibi belirli bölgelerde kesikler oluşturulabilir. Bu BCAM'lerle elde edilen PET/CT görüntüleri son derece tekdüzedir ve şirketin bulut tabanlı otomatik segmentasyon platformu11 tarafından toplu olarak analiz edilebilir. Bu makale, BCAM'lerle fiziksel olarak görüntü elde ederek ve SaaS tarafından görüntü segmentasyonu ve analizi gerçekleştirerek desteklenen otomatik bir in vivo biyodağıtım analizi iş akışı sunmaktadır.
Protokol
Hayvanlar üzerinde gerçekleştirilen tüm prosedürler, yönetmeliklere ve belirlenmiş yönergelere uygun hale geldi ve Pfizer'in Kurumsal Hayvan Bakımı ve Kullanımı Komitesi tarafından veya bir etik inceleme süreci yoluyla gözden geçirildi ve onaylandı. PET görüntüleme çalışması tüm kurumsal radyasyon güvenliği protokollerine uygun olarak gerçekleştirildi. Bu çalışmada vücut ağırlıkları 18-26 g arasında değişen, 10-12 haftalık dişi C57BL/6 fareler kullanıldı. Kullanılan reaktiflerin ve ekipmanın ayrıntıları Malzeme Tablosunda listelenmiştir.
1. Hayvanların hazırlanması ve sahnelenmesi
NOT: Bu adım, hayvanların BCAM şablonu kılavuzluğunda tümör implantasyonu ile PET görüntüleme için evrelendirilmesini içerir.
- Hücre implantasyonundan önce, farelerin kürkünü istenen tümör büyümesi bölgesinde tıraş edin.
- Anestezi istasyonunu kurun ve üst kısmı 90 derece yukarı çevrilmiş olarak ön klipse uygun boyutta bir BCAM kalıbı takın. Bu, tümör implantasyon tabanı olarak görev yapacaktır (Şekil 1A).
- Hayvanları uygun bir indüksiyon kutusunda %2.0 izofluran ve %98 oksijen ile 0.5-1.5 L/dk akış hızında uyuşturun.
NOT: Tüm anestezi sistemleri değişkendir.- Kalibre edilmiş bir sistem kullanın ve kullanmadan önce test edin. Anestezi uygulanmış bir fareyi tabana yerleştirin ve uzuvlarını uzatın (Şekil 1B).
- Farenin sırt tarafına yavaşça bir BCAM tümör enjeksiyon şablonu kalıbı (Şekil 1C) yerleştirin (Şekil 1D).
- İstenen kesme konumunda (örn. omuz veya yan, sol veya sağ) bir işaretleyici ile dikkatlice geçici bir dairesel referans işareti oluşturun (Şekil 1D). Şablon kalıbını çıkarın.
- İstenilen hacmi bir şırıngaya çekerek hücreleri enjeksiyon için hazırlayın. Şırıngaya 27 G'lik bir iğne takın ve ölü hacim alanını doldurun. Aşılama başına 0.1-0.2 mL'lik bir hacim önerilir.
- Bir çadır oluşturmak için adım 1.5'teki geçici işaretleri referans olarak kullanarak cildi parmaklarınızla veya forsepslerle kaldırın, iğneyi yavaşça yerleştirin ve hücreleri istenen yere deri altından enjekte edin. İğneyi biyolojik tehlike içeren bir kesici alet kabına atın.
- Tümör büyümesini izleyin. Bu örnekte kayıt sırasında ortalama tümör hacmi 200-300 mmidi 3.
NOT: BT görüntüleme artefaktlarını önlemek için kulak küpeleri veya mikroçipler gibi metal bileşenler kullanmaktan kaçının.
2. Radyoaktif dozların çizilmesi
- Tüm kurumsal radyasyon güvenliği protokollerini takiben, intravenöz enjeksiyona uygun steril bir şırıngaya yaklaşık 70-80 μCi aralığında bir hedef [18F] FDG dozunu dikkatlice hazırlayın.
NOT: 70-80 μCi aralığı, Sofie G8 PET tarayıcının dinamik aralığına uyacak şekilde idealdir. Diğer görüntüleyiciler, farklı bir hedef doz gerektiren farklı dinamik aralıklara sahip olabilir. - Şırıngayı kuyu haznesine yerleştirerek ve kepçeyi indirerek bir doz kalibratöründe radyoaktif dozu dikkatlice ölçün. Ölçümden önce uygun izotop veya kalibrasyon numarasını seçmeye dikkat edin.
- İstikrarlı bir okuma yapın. Tarih ve saati kaydedin. Gerekirse dozu ayarlayın.
- (İsteğe bağlı) Son doz hacmini 0.1-0.2 mL'ye getirmek için steril salin kullanın.
NOT: İstenen enjeksiyon hacmi değişebilir. - Doz uygulanmaya hazırdır.
3. İntravenöz doz uygulaması
- Kurumsal IACUC ve Radyasyon güvenliği protokollerini izleyerek, kuyruk damarını genişleterek fare kuyruğunu IV enjeksiyonu için hazırlayın. Bu çalışmada, hayvan kafesi veya indüksiyon odası 42 °C'ye ayarlanmış bir sürgü ısıtıcısı üzerine yerleştirilerek kuyruk damarı genişletildi.
NOT: Kuyruk damarının tamamen genişlemesi 10 dakika kadar ısınma sürebilir. - Enjeksiyondan önce fare ağırlığını kaydedin. Bu, PET / CT görüntüleme için hangi ağırlığa özgü BCAM'nin kullanılacağını belirleyecektir.
- Hazır olduğunda, fareyi uygun bir tutucuya aktarın (örneğin, bu çalışmada bir Kuyruk damarı enjeksiyon platformu kullanılmıştır) ve kuyruk damarını bulun.
- Radyoaktif şırıngayı dikkatlice tutun ve IV dozu bilinçli bir fareye enjekte edin. Enjeksiyon süresini kaydedin.
- Şırıngayı dikkatlice bir kenara koyun ve kuyruktaki fazla kan damlalarını gazlı bezle temizleyin. Fareyi sınırlayıcıdan çıkarın ve uygun yuvaya geri yerleştirin.
- Şırıngayı dikkatlice doz kalibratör odasına geri yerleştirin ve uygun doz hesaplamaları için kalan okumaları kaydedin. Kalan aktivite okumasının tarihini ve saatini kaydedin.
- Enjeksiyonlar tamamlandıktan sonra, dikkatli olun ve kurum tarafından güvenli radyasyon uygulamalarını izleyerek fare kohortlarını kurşun muhafazaların arkasına ve / veya personelden uzağa yerleştirin. Not: Kullanılan tüm malzemeler küçük radyoaktif kirlenmeye maruz kalır. Tüm alanları kalibre edilmiş bir Geiger sayacı ile izleyin ve radyasyon güvenliği yönergelerine göre temizleyin.
4. PET görüntüleme için hayvanların uyuşturulması ve konumlandırılması
- Uygun bir zamanda (ör., izleyici alım süresinin bitiminden 10-15 dakika önce), hem anestezi indüksiyonu hem de PET görüntüleme için gerekli tüm anestezi ekipmanını ve hayvan ısıtma aletlerini açın. Anestezi, %98 oksijende %2.0-2.5 izofluran olarak ayarlanabilir (ayarlar fare türüne ve hastalık modeline göre değişebilir).
- Tüm adaptörlerin ve valflerin açık olduğunu ve gaz akış hızının 0.5-1.0 L/dak olduğunu onaylayın. Spesifik akış hızları anestezi sistemleri ve görüntüleme sistemleri arasında farklılık gösterebilir.
- Uygun hayvan(lar)ı bir indüksiyon kutusuna yerleştirin ve denek doğru anestezi derinliğine ulaşana kadar bekleyin.
- Her göze göz kayganlaştırıcı merhem sürün.
- Fareyi vücut ağırlığına göre uygun boyutta bir BCAM'a aktarın.
- Fareyi yavaşça ensesinden alın, kuyruğu kuyruk yuvasına yerleştirin ve BCAM'ın altına sarın. Kuyruğu kuyruk platformuna yerleştirin ve konumu sabitlemek için bantlayın. Omurganın düz olup olmadığını kontrol edin. BCAM'ı yavaşça kapatın (Şekil 2A,B).
- Dört uzuvyu da BCAM pençe platformlarının her birine dayanacak şekilde dikkatlice konumlandırın. Pençeleri her platforma sabitlemek için gerektiği gibi bant kullanın (Şekil 2B).
- Önce ön ucu sokarak BCAM'ı görüntüleme yatağı mekiğine nazikçe oturtun (Şekil 2C). Mekik, anestezi akışı ile G8 yükleme istasyonuna zaten bağlanmış olmalıdır (Şekil 2D). BCAM'ın arkasını aşağı doğru bastırın ve bir klik sesi G8 mekiğine sabitlendiğini gösterecektir.
NOT: Görüntüleme sırasında hayvanın istenen anestezik düzlemde kalması için anestezik beslemeyi koruyun.
5. Görüntü edinme
- G8 PET edinme yazılımını açın. Çalışma klasörleri, tarama parametreleri ve konu kimlikleri önceden oluşturulabilir.
- Çalışma ayrıntılarını yazılıma girin: fare ağırlığı, çekilen ilk dozun tarihi / saati ve miktarı, enjeksiyon tarihi / saati ve rezidüel aktivite okumasının tarihi / saati ve miktarı.
- Mekiği fare ile tarayıcı açıklığına yerleştirin. Mavi bir gösterge ışığı, sisteme doğru şekilde yerleştirildiğini gösterecektir.
- Uygun PET/CT parametrelerini seçin. Görüntüleme verilerini elde edin.
NOT: Bu çalışmada, 7 dakikalık statik 18F PET taraması yapıldı, ardından 70 saniyelik varsayılan BT taraması yapıldı ve verileri yeniden oluşturmak için maksimum olabilirlik beklenti maksimizasyonu 3D rekonstrüksiyon algoritması (G8 tarayıcıda varsayılan ve tek seçenek) uygulandı12. - Edinme tamamlandıktan sonra, mekik ilk başlangıç konumuna geri dönecektir. Mekiği fare ile çıkarın ve yuvaya yerleştirin. G8 mekiğinden çıkarmak için BCAM dikey tırnağının arkasına bastırın ve BCAM'ı fare ile yavaşça yukarı çekin ve çıkarın.
- BCAM'ın üst kısmını yukarı çevirmek ve açmak için iki tutma tırnağına basın.
- Fareyi yavaşça çıkarın. Ev kafesine dönmeden önce farenin anesteziden tamamen kurtulduğundan ve parlak, uyanık ve duyarlı (BAR) olduğundan emin olun.
- Tüm kohortu/fare grubunu taramak için prosedüre ayarlanan zaman aralıklarında devam edin.
6. Görüntüleri SaaS'a yükleme
- app.invivo.ax giriş yapın ve bir proje oluşturun.
- Pencerenin sağ üst köşesindeki kırmızı yükleme sekmesine tıklayın. Görüntüleme çalışmasında kullanılan bir görüntüleme sistemi ve raportör seçin (yani, [18F]FDG). Görüntüleme verilerinin bulunduğu klasörü seçin.
- Proje klasörü içindeki ek açıklama sekmesine gidin. İlgili tarama bilgilerini (konu adı, cinsiyet, BCAM boyutu, denek ağırlığı, kohort adı, zaman noktası ve enjekte edilen doz değeri) eklemek için Açıklama Ekle'ye tıklayın. Meta verilerin çoğu otomatik olarak doldurulur.
7. Otomatik veri analizi
- Proje klasörü içinde tüm taramalar doldurulmalıdır. Proje, grup ve bireysel konu seviyeleri arasında gezinmek için taramalara tıklayın. Sağ üst köşedeki Çözümle'yi seçin.
- Analiz şeridi penceresinin sağ üst kısmında, Proje'nin altında artı simgesini seçin ve Organ Olasılık Haritası Yatırım Getirisi'ni seçin. Organ Olasılık Haritası (OPM), önceden tanımlanmış birden fazla organ ve dokuyu kapsayan istatistiksel bir fare organ atlasıdır. Araştırma ihtiyaçlarına göre bireysel ilgi alanlarını seçin.
NOT: Bu örnekte, VivoQuant kullanılarak, spline aracı kullanılarak manuel segmentasyon ve analiz yapıldı ve ardından 3D ROI operatörü içinde enterpolasyon yapıldı. Otomatik analiz sonuçları, bir kıyaslama olarak manuel segmentasyon sonuçlarıyla karşılaştırıldı.
Sonuçlar
PET verileri yüklendikten sonra, SaaS web sitesinde, OPM tarafından dikte edilen seçilmiş organ ROI'leri ile kaplanmış koronal, sagital ve enine görüntülerden oluşan bir panel olarak görüntülenebilir (Şekil 3A). Yazılım yalnızca tek tek görüntüleri yüklemekle kalmaz, aynı zamanda bir gruptan veya tüm bir çalışmadan birden fazla fare aynı anda tek, daraltılmış bir görüntü olarak görüntülenebilir. Bu analiz penceresinde, ROI renklerini, ölçek çubuğu yoğunluğunu ve diğer yaygın parametreleri özelleştirme seçenekleri vardır. İdeal analitik metrikler seçildikten sonra SaaS, seçilen organların indirilebilir bir biyodağılım çubuk grafiğini oluşturur (Şekil 3B).
OPM tabanlı SaaS platformunun performansını değerlendirmek için, otomatik analizden elde edilen sonuçlar, deneyimli bir görüntüleme analisti tarafından altın standart olarak elde edilen sonuçlarla karşılaştırıldı. Beyin, kalp, böbrek (sağ) ve dalaktan [18F] FDG alım değerleri üzerinde uygun doğrusal regresyon yapıldı. Platformun, iskelet, beyin, mesane, kalp, böbrekler (sağ ve sol), karaciğer, dalak, akciğerler ve kuadrisep kasları (sağ ve sol) dahil olmak üzere kullanıcıların seçebileceği kapsamlı bir organ listesi sunduğunu unutmayın. Yukarıdaki dört organ bu çalışmada sadece örnekleme amacıyla seçilmiştir. Ayrıca, implante edilen tümörlerin değişken boyutu, şekli ve derinliği/konumu nedeniyle, Tümör OPM'ye bir organ olarak dahil edilmez ve bu nedenle bu karşılaştırmalı analizin dışında tutulur. Şekil 4'te gösterildiği gibi, otomatik analiz ve manuel analiz, beynin en yüksek korelasyonu göstermesiyle (r2 = 0.8466) genel olarak tutarlı sonuçlar verdi. Bu, organın büyük boyutu ve beynin kafatası içindeki son derece sabit konumu nedeniyle beklenen bir durumdur. Sağ böbrek ve kalp de sırasıyla 0.6874 ve 0.4849'luk makulr2 değerleri gösterdi. Buna karşılık, dalak için korelasyon analizi, test edilen organlar arasında en düşük olan 0.3922'lik bir r2 değeri üretti. Dalak, tanımlanmış morfolojiden yoksun olan ve BT'de aynı yumuşak doku yoğunluğunu varsayan pankreas ve yağ dokularında iç içe geçtiği için bu şaşırtıcı değildir. Bu nedenle, dalağın manuel olarak segmentlere ayrılması zordur ve OPM, bu organın sınırlarını belirlemek için daha kesin bir yol sunabilir (yani, altın standarttan daha iyi performans gösterir). Bu korelasyon analizlerinin eğimi ve Y-kesişimi de Şekil 4'te gösterilmiştir. R2 değerleriyle tutarlı olarak, beyin 1'e en yakın eğime (yani, OPM ve manuel sonuçlar arasında mükemmel bir korelasyon) ve en küçük Y-kesişimine (yani, minimum sistemik sapma) sahipken, diğer organlar mükemmel bir korelasyondan daha büyük ve değişken sapma gösterdi.

Şekil 1: BCAM ve şablon kılavuzluğunda tümör implantasyonu. (A) Ön klips (1), bağlı bir anestezi hattı (3) ile bir BCAM kalıbının (2) alt parçasına tutturulur. Bu, tümör implantasyon üssü olarak hizmet eder. (B) Hedef implant bölgesi traş edilmiş bir fare (bu örnekte sağ omuz) hücre enjeksiyonundan önce anestezi altında tabana yerleştirilir. (C) Tümör hücresi aşılamasının yerleştirilmesine rehberlik etmek için önceden tanımlanmış kesiklere sahip tümör implantasyon şablonu (4). (D) Farenin sırt tarafına yerleştirilen şablon kalıbı ile hücre enjeksiyonundan önce geçici bir referans işareti yapmak. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
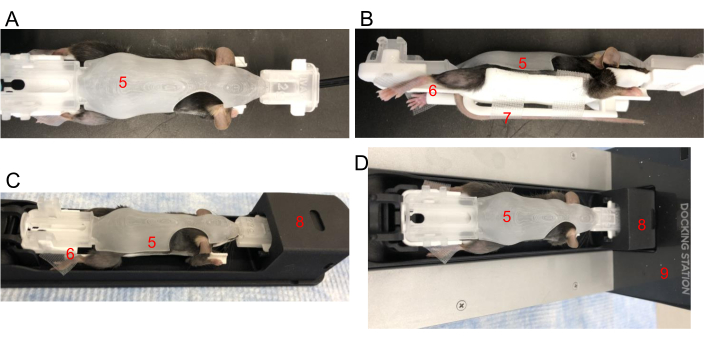
Şekil 2: Bir fareyi BCAM'e yerleştirme. (A) Üstten görünüm - Fareyi uygun boyutta bir BCAM'ye (5) sıkıca yerleştirin. (B) Yandan görünüm - Arka pençeleri platformlara sabitlemek için bant kullanılır (6). Kuyruk, farenin hemen altındaki kuyruk platformuna (7) bantla sabitlenir. (C) BCAM'deki fare, görüntüleme mekiğine (8) yerleştirilir. (D) Fare, BCAM ve mekik, anestezi ile çalışan bir yerleştirme istasyonuna bağlanır (9). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
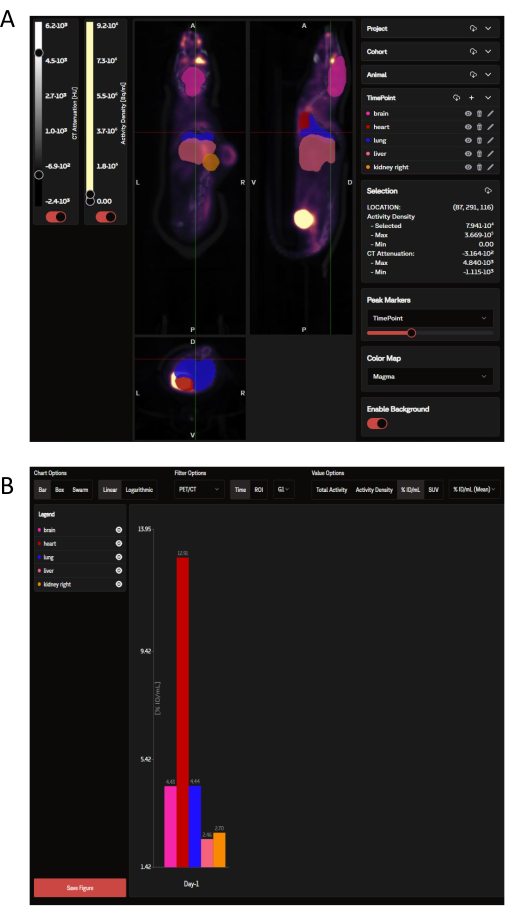
Şekil 3: Sırasıyla SaaS aracı tarafından görüntülenen ve analiz edilen temsili görüntüler ve veri çıktısı. (A) SaaS web sitesinde görüntülenen temsili görüntüler. Organ Olasılık Haritası'ndan (OPM) seçilen organ ROI'leri ile kaplanmış PET/CT görüntüsünün koronal, sagital ve enine görünümleri. Pembe: beyin; kırmızı: kalp; koyu mavi: akciğer; somon: karaciğer; Turuncu: böbrek (sağda). Tümör OPM tarafından tanımlanmamıştır. (B) Otomatik analizden oluşturulan temsili bir indirilebilir grafik. Seçilen organların bir listesi sol üst panelde görülebilir. Buradaki veriler %ID/mL cinsinden raporlanır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
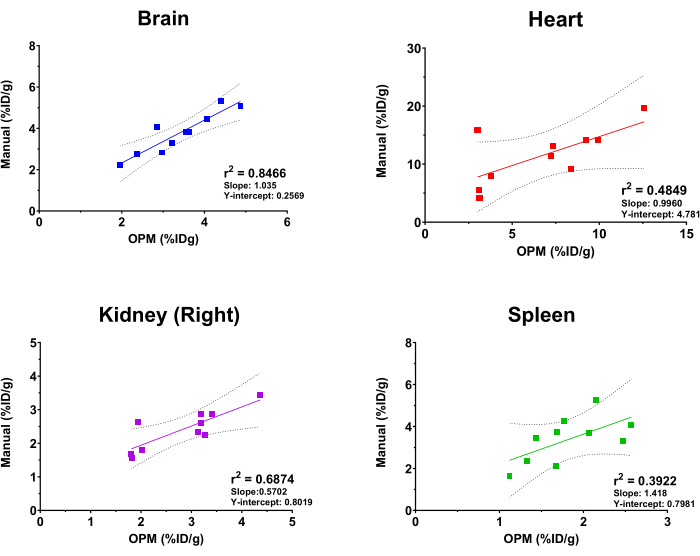
Şekil 4: Manuel analiz ve OPM tabanlı otomasyon iş akışı ile elde edilen organ [18F]FDG alım değerlerini karşılaştıran doğrusal regresyon analizi. Dişi C57BL / 6 farelerinin on PET / CT taraması kullanıldı. r2 değerleri, %95 güven çizgileri, eğim ve Y-kesişim noktaları, belirtilen her organ için grafikte görüntülenir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Mevcut rapor, BCAM kalıpları ile fare in vivo PET görüntüleme gerçekleştirme ve otomatik SaaS aracı ile verileri analiz etme prosedürünü açıklamaktadır. Fare hazırlama, görüntüleme elde etme ve veri işleme ile ilgili adım adım talimatlar sağlanır. Bu otomasyon iş akışı, manuel analizle tutarlı veriler de sağladı. Birkaç önemli teknik husus aşağıda vurgulanmıştır.
Bir Tümör, OPM tarafından tanımlanan organlardan biri olmasa da, bu protokoldeki kritik bir adım, vücut boşluğu ve BCAM içindeki tüm fare organlarının optimal hizalanmasını sağlamak için deri altı tümörlerin uygun şekilde implantasyonudur. OPM, yalnızca bir farenin omurgası nispeten düz olduğunda ve iç organlar nötr bir şekilde konumlandırıldığında doğru veriler üretebilir. Aşırı büyük veya yanlış yerleştirilmiş tümörler, farenin duruşunu etkileyebilir ve vücut boşluğuna baskı yaparak iç organları kaydırabilir. Bu değişim, sırayla, OPM algoritmasından elde edilen nicel analizi çarpıtacaktır. Diğerleri, çeşitli görüntüleme modaliteleri ve segmentasyon algoritmaları kullanarak düz olmayan bir omurganın iç organların hizalanması üzerindeki etkisini bildirmiştir13,14. Bu nedenle, tümörlerin hem uygun şekilde konumlandırıldığından hem de ideal boyut aralığında olduğundan emin olmak için tümör implantasyonuna rehberlik etmek ve tümör büyümesini yakından izlemek için şablonu kullanmak çok önemlidir.
Olası bir sapmanın başka bir alanı, uygun boyutta bir BCAM'ın seçilmesidir. BCAM'ler, 18-26 g aralığında 2 g integrallerinde oluşturulur. Bununla birlikte, farklı vücut bileşimlerine sahip fareler (örneğin, daha fazla kas ve daha fazla yağ) aynı vücut ağırlığına ancak farklı fiziksel boyutlara sahip olabileceğinden, vücut ağırlıklarını genel bir referans olarak kullanırken en uygun BCAM'ı seçmek önemlidir. Deneme yanılma yoluyla seviye atlayın veya azaltın ve doğru hizalamanın kritik olduğunu unutmayın. Çok büyük bir BCAM seçmek, farenin iç organlarının yatağın dibine daha yakın 'batmasına' neden olur ve bu da özellikle böbrekler ve omurga gibi sırt organları için analizin doğruluğunu etkiler. Buna karşılık, çok küçük bir fareyi BCAM'a yerleştirmek, vücut boşluklarına baskı yapabilir, organ pozisyonlarını çarpıtabilir ve potansiyel olarak nefes almalarında zorluğa neden olabilir. Uzuvların pençe platformlarına sabitlendiğinden emin olmak için bant kullanmak, kurulum ve konumlandırmaya yardımcı olacaktır.
Raporlanan bu iş akışı, standartlaştırılmış ve otomatikleştirilmiş PET görüntü analizine olanak sağlasa da, mevcut OPM'nin immünokompetan C57BL/6 fare türü ve sağlıklı farelere dayalı olarak oluşturulduğunu belirtmekte fayda var. Farelerin diğer suşları ve sağlık koşulları, algoritmanın ek olarak ayarlanması, optimizasyonu ve doğrulanmasını gerektiren farklı anatomik özellikler sunabilir. Örneğin, NSG veya NCG gibi bağışıklık yetmezliği olan suşlar daha küçük dalaklara sahiptir. Benzer şekilde, ortotopik tümör implantları taşıyan fareler, hastalık durumlarına bağlı olarak farklı boyutlara, şekillere ve iç organların konumlarına sahip olabilir. Bu iş akışının bir diğer sınırlaması, bir denemenin alım aşaması sırasındaki genel aktarım hızıdır. Bunun başlıca nedeni, BCAM'de bir fareyi düzgün bir şekilde kurmak için gereken ek süredir. Eğitim ve uygulama, operatörün doğru yerleştirmedeki verimliliğini artırabilir. İkinci bir yerleştirme istasyonunun eklenmesi, bir bağlantı istasyonunun BCAM kurulumu için hizmet edebileceği ve diğerinin bir fareyi bir kurtarma kafesine çıkarmak için hizmet edebileceği genel verimi de artırabilir. Bununla birlikte, taramadan önce BCAM kurulumu için gereken sürenin artmasına rağmen, zamana yapılan yatırım, veri analizi tarafında zamandan tasarruf ederek karşılığını verir. Örneğin, bu çalışmada, OPM'nin on görüntüyü (4 ROI ile) analiz etmesi 10 dakikadan az sürerken, çok deneyimli bir analistin aynı görüntü setini ve ROI'leri manuel olarak segmentlere ayırması ve analiz etmesi 3-4 saat sürdü. Deneyimsiz bir analist, manuel analiz için daha da fazla zamana ihtiyaç duyacaktır. SaaS platformu, PET taramalarının büyük partiler halinde analizine olanak tanır ve burada tam in vivo biyodağılım analizi, verilerin yüklenmesini takiben dakikalar içinde tamamlanabilir. Bu, aşağıda tartışıldığı gibi, birden çok gruptan ve/veya birkaç zaman noktasından büyük miktarda veriyi işlerken son derece yararlı bir özelliktir.
Tek bir denek için organların manuel olarak segmentasyona tabi tutulması zaman alıcı olabilir ve genellikle operatörün önemli ölçüde önceden eğitilmesini gerektirir. Yeterli eğitimle bile, manuel analizler kaçınılmaz olarak operatörler arası değişkenliklerle karşı karşıya kalırve bu da nicel sonuçları çarpıtabilir 15,16. Buna karşılık, otomatik segmentasyon ve veri analizi, bir radyoizleyicinin genel biyolojik dağılımını doğru ve verimli bir şekilde belirleyebilir ve insan operasyonlarından kaynaklanan değişkenlikleri ortadan kaldırabilir. Otomasyonun bu tür faydaları hem klinik görüntü analizinde hem de klinik öncesi alanda görülmüştür. Örneğin, Sluis ve ark. tek bir taramanın, AI bulut tabanlı yöntemlerle 30 dakikaya kıyasla, ilgilenilen organları segmentlere ayırmak için 4 saat gerektirdiğini göstermiştir17. Nazari ve arkadaşları tarafından yapılan bir başka çalışmada da karaciğer ve böbreklerin algoritma tabanlı analizinin, iki insan tıbbi fizikçi ile karşılaştırıldığında% 7.0 oranında doğru sonuçlar verdiğini bildirmiştir18. Şekil 4'teki veriler, SaaS tabanlı PET görüntüleme analizi iş akışının güvenilirliğini ve otomatik analizin manuel analize kıyasla tutarlı sonuçlar verdiğini de açıkça göstermiştir.
Özetle, bu makale, standartlaştırılmış klinik öncesi PET/CT görüntü alımının yanı sıra SaaS özellikli otomatik PET veri analizini kolaylaştırmak için BCAM kalıplarının kullanılmasının iş akışını göstermektedir. Bu platform teknolojisinin kullanımının nispeten basit olduğu ve otomasyonla oluşturulan verilerin kalitesinin manuel analizle tutarlı olduğu, ancak önemli zaman kazandıran avantajlara sahip olduğu gösterilmiştir. Bu nedenle, bu iş akışı araştırmacılara veri analizi süresinde yüzlerce saat kazandırabilir ve operatörler arası değişkenliği standartlaştırmaya ve azaltmaya yardımcı olabilir. Bu prosedür, modaliteler ve endikasyonlar arasında çok sayıda ilaç bileşiğinin geliştirilmesine yardımcı olabilir. Özellikle, terapötik antikorlar, bi-spesifik antikor bağışıklık hücresi angajmanları, antikor-ilaç-konjugatlar ve hatta nanopartiküller gibi büyük molekül modaliteleri, PET görüntüleme aracılı biyodağılım değerlendirmesini sağlamak için radyometallerle (örneğin, Zr-89, Cu-64) kolayca etiketlenebilir19,20. Benzer şekilde, bu platform teknolojisi, farelerde yeni radyo terapötiklerinin dozimetrisini belirlemeye yardımcı olabilir21. Bu prosedürün uygulanması, ilaç geliştirmeye büyük bir katma değer sağlayacaktır.
Açıklamalar
Tüm yazarlar Pfizer, Inc.'in mevcut veya geçmiş çalışanlarıdır.
Teşekkürler
Pfizer La Jolla Karşılaştırmalı Tıp Araştırma ve Teknik personeline özel teşekkürler.
Malzemeler
| Name | Company | Catalog Number | Comments |
| [18F]FDG | PETNet Solutions, Culver City, CA | NA | Radiotracer used for PET imaging |
| 27 G needle | Becton, Dickinson and Company, San Diego, CA | 305136 | Used for cell injection |
| app.invivo.ax/login | Invivo Analytics, Seattle, WA | NA | Software as a Service webpage |
| Body Conforming Animal Molds | Invivo Analytics, Seattle, WA | NA | BCAMs with weight range of 18 - 26 g |
| Dose Calibrator; CRC-55tw | Capintec, Florham Park, NJ | CRC-55tw | Measurement of radioactive doses |
| G8 PET/CT scanner | Sofie Biosciences/Xodus Imaging, Torrence, CA | NA | Benchtop scanner with loading dock |
| G8-Docking station | Sofie Biosciences/Xodus Imaging, Torrence, CA | NA | Docking station for staging |
| Implantation Mold Template | Invivo Analytics, Seattle, WA | NA | Template for optimal tumor implantation |
| Lubricant eye ointment | BAUSCH & LOMB, Ontario, Canada | Soothe Nighttime | Eye lube for mice |
| Modified G8 shuttle | Invivo Analytics, Seattle, WA | NA | Shuttle for BCAM accommodation |
| Mouse anesthesia Induction box | Patterson Scientific, Waukesha, WI | 78933388 | Used for anesthetizing a mouse |
| PRE-Clip | Invivo Analytics, Seattle, WA | NA | BCAM adapter for anesthesia connection |
| Premiere Slide warmer | LabScientific, Danvers, MA | XH-2001 | Adjustable temp warmer used for tail vein dilation and anesthesia induction |
| Syringe (1 mL) | Becton, Dickinson and Company, San Diego, CA | 309659 | Used for cell injection |
| Tail Vein injection platform | Braintree Scientific, Pembroke, MA | IL-300 | Restrainer used for administering intravenous injections. |
| Vivoqaunt Software | Invicro, Needham, MA | NA | Software used for manual segmentation |
Referanslar
- Huang, R., Wang, M., Zhu, Y., S Conti, P., Chen, K. Development of pet probes for cancer imaging. Curr Top Med Chem. 15 (8), 795-819 (2015).
- Schwenck, J., et al. Advances in pet imaging of cancer. Nat Rev Cancer. 23 (7), 474-490 (2023).
- Matthews, P. M., Rabiner, E. A., Passchier, J., Gunn, R. N. Positron emission tomography molecular imaging for drug development. Br J Clin Pharmacol. 73 (2), 175-186 (2012).
- Tavaré, R., et al. An effective immuno-pet imaging method to monitor CD8-dependent responses to immunotherapy. Cancer Res. 76 (1), 73-82 (2016).
- Maresca, K. P., et al. Preclinical evaluation of 89ZR-DF-IAB22M2C PET as an imaging biomarker for the development of the gucy2c-cd3 bispecific pf-07062119 as a t-cell engaging therapy. Mol Imaging Biol. 23 (6), 941-951 (2021).
- Nisnboym, M., et al. Immuno-pet imaging of cd69 visualizes t-cell activation and predicts survival following immunotherapy in murine glioblastoma. Cancer Res Commun. 3 (7), 1173-1188 (2023).
- Lee, C., et al. Efficacy and imaging-enabled pharmacodynamic profiling of Kras g12c inhibitors in xenograft and genetically engineered mouse models of cancer. Mol Cancer Ther. 22 (7), 891-900 (2023).
- Bollineni, V., Kramer, G., Jansma, E. P., Liu, Y., Oyen, W. J. A systematic review on [18f] flt-pet uptake as a measure of treatment response in cancer patients. Eur J Cancer. 55, 81-97 (2016).
- Everitt, S., et al. Imaging cellular proliferation during chemo-radiotherapy: A pilot study of serial 18f-flt positron emission tomography/computed tomography imaging for non-non-small-cell lung cancer. Int J Radiat Oncol Biol Phys. 75 (4), 1098-1104 (2009).
- Rashidian, M., et al. Predicting the response to CTLA-4 blockade by longitudinal non-invasive monitoring of cd8 t cells. J Exp Med. 214 (8), 2243-2255 (2017).
- Klose, A. D., Paragas, N. Automated quantification of bioluminescence images. Nat Commun. 9 (1), 4262 (2018).
- Gu, Z., et al. Performance Evaluation of G8, a high-sensitivity benchtop preclinical PET/CT Tomograph. J Nucl Med. 60 (1), 142-149 (2019).
- Bongratz, F., Rickmann, A. -. M., Wachinger, C. Abdominal organ segmentation via deep diffeomorphic mesh deformations. Sci Rep. 13 (1), 18270 (2023).
- Wang, H., Stout, D. B., Chatziioannou, A. F. Mouse atlas registration with non-tomographic imaging modalities-a pilot study based on simulation. Mol Imaging Biol. 14, 408-419 (2012).
- Montgomery, M. K., et al. Mouse lung automated segmentation tool for quantifying lung tumors after micro-computed tomography. PLoS One. 16 (6), e0252950 (2021).
- Montgomery, M. K., et al. Applying deep learning to segmentation of murine lung tumors in preclinical micro-computed tomography. Transl. Oncol. 40, 101833 (2024).
- Van Sluis, J., et al. Manual versus artificial intelligence-based segmentation as a pre-processing step in whole-body pet dosimetry calculations. Mol Imaging Biol. 25 (2), 435-441 (2023).
- Nazari, M., et al. Automated and robust organ segmentation for 3D-based internal dose calculation. EJNMMI Res. 11, 1-13 (2021).
- Goel, S., England, C. G., Chen, F., Cai, W. Positron emission tomography and nanotechnology: A dynamic duo for cancer theranostics. Adv Drug Deliv Rev. 113, 157-176 (2017).
- Campbell, D. O., et al. Preclinical evaluation of an anti-nectin-4 immunopet reagent in tumor-bearing mice and biodistribution studies in cynomolgus monkeys. Mol Imaging Biol. 18, 768-775 (2016).
- Bednarz, B., et al. Murine-specific internal dosimetry for preclinical investigations of imaging and therapeutic agents. Health Phys. 114 (4), 450-459 (2018).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır