Method Article
טומוגרפיה פרה-קלינית של פליטת פוזיטרונים עם תבניות בעלי חיים תואמות גוף לניתוח תמונה אוטומטי מבוסס ענן בעכברים
In This Article
Summary
פרוטוקול זה מתאר את ההליך לביצוע הדמיית PET in vivo בעכברים באמצעות תבניות בעלי חיים תואמות גוף (BCAMs) בסורק G8 PET/CT. פרטים טכניים על הכנת עכברים, כולל השתלת גידול נכונה, מיקום אופטימלי, רכישת תמונות PET/CT בסיוע BCAM וניתוח נתונים, מסופקים.
Abstract
טומוגרפיה של פליטת פוזיטרונים (PET) היא שיטת הדמיה מולקולרית שניתן להשתמש בה כדי לחקור מספר רב של שאלות פרמקולוגיות, כגון אפנון סמנים ביולוגיים, תפוסת קולטנים והפצה ביולוגית של תרכובות מעניינות. במחקרי הפצה ביולוגית, נבדקים ניסויים מצולמים לעתים קרובות לאורך לאחר קבלת מאמר הבדיקה. לאחר מכן מנתחים את התמונות כדי לגזור את פרופיל התפוצה של התרכובת באיברים שונים בנקודות זמן שונות. זה מהווה צעד מכריע בפיתוח תרופות להבנת התפוצה והפרופיל הפוטנציאלי המחייב של תרכובת חקירה. עם זאת, שיטות סטנדרטיות/ידניות של ניתוחי הפצה ביולוגית מבוססי הדמיית PET הן עתירות עבודה וגוזלות זמן ולעתים קרובות קשורות לשונות גבוהה בין מפעילים. יתר על כן, זה מאתגר לשמור על מיקומי בעלי החיים עקביים בנקודות זמן שונות. כדי לטפל בחסרונות אלה, נעשה שימוש בסדרה של תבניות בעלי חיים תואמות גוף עכבר (BCAMs) כדי לאפשר מיקום נוקשה ועקבי של בעלי חיים במהלך רכישת הדמיית PET/CT. יתר על כן, נעשה שימוש בפלטפורמת תוכנה כשירות (SaaS) המורכבת ממפת הסתברות איברים מבוססת ענן (OPM) וכלי פילוח המופעל על ידי בינה מלאכותית כדי לאפשר כימות אמין ואוטומטי של נתוני הדמיית PET in vivo. זרימת העבודה המוצגת כאן כוללת (1) הכנת עכברים להדמיה עם ה-BCAMs, כולל השתלה נכונה של גידולים תת עוריים כך שיתאימו לתבניות, (2) רכישת תמונות PET/CT עם BCAMs באמצעות סורק G8, ו-3) ביצוע פילוח איברים אוטומטי וניתוח הפצה ביולוגית באמצעות SaaS מבוסס ענן. [18ו]FDG שימש כאן כעוקב לדוגמה, אך ניתן להתאים בקלות סמנים ביולוגיים אחרים ו/או תרכובות עם תווית רדיו לזרימת העבודה. ניתן לבצע הליך זה בצורה מדויקת ויעילה עם הכשרה מינימלית, וניתוח נתוני ה-PET האוטומטי הניב תוצאות משביעות רצון העולות בקנה אחד עם השיטה הידנית.
Introduction
טכנולוגיות הדמיה מולקולרית in vivo הן כלים חשובים בפיתוח תרופות כדי להקל על ההערכה של כל שלושת עמודי התווך של הפרמקולוגיה - הפצה ביולוגית, מעורבות מטרה ואפנון של פרמקודינמיקה 1,2,3. טומוגרפיה של פליטת פוזיטרונים (PET), עם יכולת התרגום הקליני והרגישות הגבוהה שלה, היא בין שיטות ההדמיה המולקולרית הנפוצות ביותר הן במרפאה והן במרחב המחקר והפיתוח הפרה-קליני. התחום הפורח של הדמיית PET פרה-קלינית ורדיותרנוסטיקה הוא בעל ערך לפיתוח טיפולים פנימיים לגידול, טיפולים ממוקדים, כמו גם טיפולים אימונו-אונקולוגיים חדשים (IO). להופעתם והתפתחותם המתמשכת של רדיוטריסרים חדשים של Immuno-PET יש פוטנציאל להשפיע על משטרי תרופות IO מותאמים ספציפיים ולזהות מגיבים לעומת לא מגיבים 4,5,6. בינתיים, רדיו-טרסרים ספציפיים למטבוליים, כגון [18F]FDG ו-[18F]FLT, יכולים לנטר את תגובת הגידול לטיפול ויכולים בהתאמה לשפוך אור על האם הגידול מתפשט באופן פעיל או צורך גלוקוז7, או אם תאי הגידול עוברים עצירת מחזור תא בדרכים של עיכוב 8,9.
הדמיה לא פולשנית in vivo מציגה יתרונות מרובים בהשוואה לניסויים פרמקולוגיים מסורתיים שאינם הדמיה. לדוגמה, הדמיה מאפשרת הערכה מערכתית והוליסטית של התפלגות התרופה ו/או ההשפעה הפרמקולוגית על הנבדק כולו, מה שמאפשר לא רק ניטור היעילות באתר המטרה, אלא גם זיהוי של פעילויות בלתי צפויות מחוץ לאתר. בשל אופיו הלא פולשני, ניתן להעריך את אותה קבוצה של בעלי חיים לאורך נקודות זמן שונות ו/או עם סמנים ביולוגיים שונים כדי לענות על שאלות ביולוגיות שונות10. לא רק שזה מפחית משמעותית את מספר החיות הדרושות למחקר, אלא זה גם מספק בקרה אורתוגונלית על פני נקודות זמן, ולכן מסייע בשיפור המתאמים והפחתת השונות האינדיבידואלית. למרות פיתוח כה מבטיח של סמנים ביולוגיים להדמיה, הצורך להעריך תרכובות חקירה in vivo עם מחקרי הפצה ביולוגית מבוססי הדמיית PET, עם זאת, נתקל במחסור בתהליכים אוטומטיים יעילים לניתוח. מחקרי הפצה ביולוגית של PET מייצרים מידע רב ערך על הקינטיקה של התרכובת, הצטברות רקמות, קשירה וחילוף חומרים. השגת נתונים כמותיים הניתנים לשחזור היא קריטית לפיתוח טיפולים פרמצבטיים.
כדי לענות על הצרכים הבלתי מסופקים הללו בניתוח אוטומטי של תמונות PET, InVivo Analytics עיצבה קבוצה של תבניות בעלי חיים תואמות גוף עכבר (BCAMs)11. אלו הן תבניות פלסטיק מודפסות בתלת מימד המחזיקות את ראשו של העכבר, פלג גוף עליון (ואיברים פנימיים), זנב וגפיים בתנוחות קשיחות ומוגדרות מראש. ניתן לבחור תבניות בגדלים שונים על סמך משקל הגוף של החיה, וניתן ליצור חתכים באזורים ספציפיים, כמו הכתף או הצד התחתון, כדי לאפשר לגידולים תת עוריים לבלוט החוצה. תמונות PET/CT שנרכשו עם BCAMs אלה הן אחידות ביותר וניתנות לניתוח בקבוצות על ידי פלטפורמת הפילוח האוטומטית מבוססת הענן של החברה11. מאמר זה מציג זרימת עבודה אוטומטית של ניתוח הפצה ביולוגית in vivo המופעלת על ידי רכישה פיזית של תמונות עם BCAMs וביצוע פילוח וניתוח תמונה על ידי ה-SaaS.
Protocol
כל ההליכים שבוצעו בבעלי חיים פעלו בהתאם לתקנות ולהנחיות שנקבעו ונבדקו ואושרו על ידי הוועדה המוסדית לטיפול ושימוש בבעלי חיים של פייזר או באמצעות תהליך בדיקה אתי. מחקר הדמיית PET בוצע בהתאם לכל פרוטוקולי בטיחות הקרינה המוסדית. במחקר זה נעשה שימוש בעכברי C57BL/6 נקבות, בני 10-12 שבועות, עם משקל גוף שנע בין 18-26 גרם. פרטי הריאגנטים והציוד המשמשים מפורטים בטבלת החומרים.
1. הכנה ובימוי של בעלי חיים
הערה: שלב זה כולל בימוי בעלי החיים להדמיית PET עם השתלת גידול מונחה תבנית BCAM.
- לפני השתלת התאים, יש לגלח את פרוות העכברים באזור הרצוי של צמיחת הגידול.
- הגדר את תחנת ההרדמה והצמד תבנית BCAM בגודל המתאים לקליפ המקדים כשהחלק העליון הפוך כלפי מעלה ב-90 מעלות. זה ישמש כבסיס להשתלת הגידול (איור 1A).
- להרדים בעלי חיים בקופסת אינדוקציה מתאימה עם 2.0% איזופלורן ו-98% חמצן בקצב זרימה של 0.5-1.5 ליטר לדקה.
הערה: כל מערכות ההרדמה משתנות.- השתמש במערכת מכוילת ובדוק לפני השימוש. הניחו עכבר מורדם על הבסיס והאריכו את גפיו (איור 1B).
- הניחו בעדינות תבנית הזרקת גידול BCAM (איור 1C) בצד הגבי של העכבר (איור 1D).
- צור בזהירות סימן ייחוס עגול זמני במיקום החיתוך הרצוי (למשל, כתף או צד, שמאל או ימין) עם סמן (איור 1D). הסר את תבנית התבנית.
- הכן את התאים להזרקה על ידי משיכת הנפח הרצוי למזרק. חבר מחט 27 גרם למזרק ומלא את חלל הנפח המת. מומלץ נפח של 0.1-0.2 מ"ל לכל חיסון.
- הרם את העור בעזרת אצבעות או מלקחיים באמצעות הסימנים הזמניים משלב 1.5 כהתייחסות ליצירת אוהל, הכנס לאט את המחט והזריק תאים תת עורית במיקום הרצוי. השליכו את המחט למיכל חד ביולוגי.
- עקוב אחר צמיחת הגידול. נפח הגידול הממוצע בעת ההרשמה בדוגמה זו היה 200-300 מ"מ3.
הערה: הימנע משימוש ברכיבי מתכת כגון תגי אוזניים או שבבים כדי למנוע חפצי הדמיית CT.
2. משיכת מינונים רדיואקטיביים
- בהתאם לכל פרוטוקולי בטיחות הקרינה המוסדיים, ערכו בזהירות מינון יעד של [18F]FDG בטווח של כ-70-80 μCi למזרק סטרילי המתאים להזרקה תוך ורידית.
הערה: טווח ה-70-80 μCi אופטימלי כדי להתאים לטווח הדינמי של סורק Sofie G8 PET. מצלמות אחרות עשויות להיות בעלות טווחים דינמיים שונים הדורשים מינון יעד שונה. - מדוד בזהירות את המינון הרדיואקטיבי בכיול מינון על ידי הכנסת המזרק לתא הבאר והורדת המטבל. שימו לב לבחירת האיזוטופ או מספר הכיול המתאים לפני המדידה.
- קח קריאה יציבה. רשום תאריך ושעה. התאם את המינון במידת הצורך.
- (אופציונלי) השתמש במי מלח סטריליים כדי להביא את נפח המינון הסופי ל-0.1-0.2 מ"ל.
הערה: נפח ההזרקה הרצוי עשוי להשתנות. - המינון מוכן למתן
3. מתן מינון תוך ורידי
- בהתאם לפרוטוקולי בטיחות מוסדיים של IACUC וקרינה, הכינו את זנב העכבר להזרקה לווריד על ידי הרחבת וריד הזנב. במחקר זה, וריד הזנב הורחב על ידי הנחת כלוב בעלי החיים או תא האינדוקציה על מחמם שקופיות שהוגדר בטמפרטורה של 42 מעלות צלזיוס.
הערה: ייתכן שיידרשו עד 10 דקות של התחממות עד שוריד הזנב יתרחב במלואו. - לפני ההזרקה יש לרשום את משקל העכבר. זה יקבע באיזה BCAM ספציפי למשקל להשתמש עבור הדמיית PET/CT.
- ברגע שיהיה מוכן, העבירו את העכבר לתוך מרסן מתאים (למשל, נעשה שימוש בפלטפורמת הזרקת וריד זנב במחקר הנוכחי) ואתרו את וריד הזנב.
- טפל בזהירות במזרק הרדיואקטיבי והזריק את המינון לעכבר בהכרה. רשום את זמן ההזרקה.
- הניחו בזהירות את המזרק בצד ונקו טיפות דם עודפות מהזנב בעזרת גזה. הסר את העכבר מהמסנן והנח אותו בחזרה במארז המתאים.
- הנח בזהירות את המזרק בחזרה בתא כיול המינון ורשום את כל הקריאות הנותרות לחישובי מינון נכונים. רשום את התאריך והשעה של קריאת הפעילות השיורית.
- לאחר השלמת הזריקות, יש לנקוט משנה זהירות ולהניח קבוצות של עכברים מאחורי מארזי עופרת ו/או הרחק מאנשי הצוות, בהתאם לנוהלי קרינה בטוחים במוסד. הערה: כל החומרים המשמשים נתונים לזיהום רדיואקטיבי קל. עקוב אחר כל האזורים עם מונה גייגר מכויל ונקי לפי הנחיות בטיחות קרינה.
4. הרדמה ומיקום בעלי החיים להדמיית PET
- בזמן מתאים (למשל, 10-15 דקות לפני תום תקופת קליטת המעקב), הפעל את כל ציוד ההרדמה ומכשירי חימום בעלי החיים הנדרשים הן לאינדוקציה בהרדמה והן להדמיית PET. ניתן להגדיר את ההרדמה ל-2.0%-2.5% איזופלורן ב-98% חמצן (ההגדרות עשויות להשתנות בהתאם לזן העכבר ומודל המחלה).
- ודא שכל המתאמים והשסתומים מופעלים וקצב זרימת הגז הוא 0.5-1.0 ליטר לדקה. קצבי זרימה ספציפיים עשויים להשתנות בין מערכות הרדמה ומערכות הדמיה.
- הנח בעלי חיים מתאימים בקופסת אינדוקציה והמתן עד שהנבדק יגיע לעומק ההרדמה הנכון.
- יש למרוח משחת סיכה לעיניים על כל עין.
- העבר את העכבר ל-BCAM בגודל מתאים בהתבסס על משקל הגוף.
- הרם בעדינות את העכבר בעורף, הכנס את הזנב לחריץ הזנב ועטוף אותו מתחת ל-BCAM. הנח את הזנב על פלטפורמת הזנב והדבק כדי לאבטח את המיקום. בדוק שעמוד השדרה ישר. סגור בעדינות את ה-BCAM (איור 2A,B).
- מקם בזהירות את כל ארבע הגפיים כדי לנוח על כל אחת מפלטפורמות כפות ה-BCAM. השתמש בסרט לפי הצורך כדי לאבטח כפות לכל פלטפורמה (איור 2B).
- הצמד בעדינות את ה-BCAM לתוך מעבורת מיטת ההדמיה על ידי הכנסת הקצה הקדמי תחילה (איור 2C). המעבורת כבר צריכה להיות מחוברת לרציף הטעינה G8 עם הרדמה זורמת (איור 2D). לחץ כלפי מטה על גב ה-BCAM, ולחיצה תציין שהוא מאובטח למעבורת G8.
הערה: שמור על אספקת ההרדמה כך שהחיה תישאר במישור ההרדמה הרצוי במהלך ההדמיה.
5. רכישת תמונות
- פתח את תוכנת רכישת ה-PET של G8. ניתן ליצור תיקיות לימוד, פרמטרי סריקה ומזהי נושא מראש.
- הזן את פרטי המחקר לתוכנה: משקל העכבר, תאריך/שעה וכמות המינון הראשוני שנלקח, תאריך/שעה של ההזרקה, ותאריך/שעה וכמות קריאת הפעילות השיורית.
- הכנס את המעבורת עם העכבר לפתח הסורק. נורית חיווי כחולה תצביע על עגינה נכונה למערכת.
- בחר את הפרמטרים המתאימים של PET/CT. השגת נתוני הדמיה.
הערה: במחקר זה, הופעלה סריקת PET סטטית של 7 דקות 18F, ואחריה סריקת CT ברירת מחדל של 70 שניות, ואלגוריתם שחזור תלת מימד של סבירות מקסימלית למקסום ציפיות הוחל כדי לשחזר את הנתונים12. - עם השלמת הרכישה, המעבורת תחזור לעמדת ההתחלה הראשונית שלה. הסר את המעבורת עם העכבר והכנס אותה לרציף. לחץ על החלק האחורי של הלשונית האנכית BCAM כדי להסיר אותה ממעבורת ה-G8, ומשוך בעדינות כלפי מעלה והסר את ה-BCAM עם העכבר.
- לחץ על שתי לשוניות השמירה כדי להפוך למעלה ולפתוח את החלק העליון של ה-BCAM.
- הסר בעדינות את העכבר. ודא שהעכבר התאושש לחלוטין מההרדמה והוא בהיר, ערני ומגיב (BAR) לפני החזרה לכלוב הביתי שלו.
- המשך בהליך במרווחי זמן מוגדרים כדי לסרוק את כל העוקבה/קבוצת העכברים.
6. העלאת תמונות ל-SaaS
- היכנס כדי app.invivo.ax וצור פרויקט.
- לחץ על לשונית ההעלאה האדומה בפינה השמאלית העליונה של החלון. בחר מערכת הדמיה ומדווח המשמשים במחקר ההדמיה (כלומר, [18F]FDG). בחר את התיקייה עם נתוני ההדמיה.
- נווט ללשונית ההערות בתוך תיקיית הפרויקט. לחץ על ביאור כדי להוסיף מידע סריקה רלוונטי (שם הנושא, מין, גודל BCAM, משקל הנושא, שם העוקבה, נקודת הזמן וערך המינון המוזרק). רוב המטא-נתונים יאוכלסו אוטומטית.
7. ניתוח נתונים אוטומטי
- בתוך תיקיית הפרויקט, כל הסריקות אמורות להתאכלס. לחץ על סריקות כדי לנווט מרמת הפרויקט, הקבוצה ורמת הנושא הבודדת. בחר נתח בפינה השמאלית העליונה.
- בפינה השמאלית העליונה של חלון רצועת הכלים של הניתוח, תחת פרוייקט, בחר את סימן החיבור ובחר החזר ROI של מפת הסתברות איברים. מפת הסתברות האיברים (OPM) היא אטלס איברים סטטיסטי של עכברים המקיף מספר איברים ורקמות מוגדרים מראש. בחר איברים מעניינים בודדים על סמך צרכי המחקר.
הערה: בדוגמה זו, פילוח וניתוח ידניים נעשו באמצעות VivoQuant, באמצעות כלי spline, ואחריו אינטרפולציה בתוך אופרטור החזר ה-ROI התלת-ממדי. תוצאות הניתוח האוטומטי הושוו לתוצאות הפילוח הידני כמדד.
תוצאות
לאחר ההעלאה, ניתן לצפות בנתוני ה-PET באתר SaaS כפאנל של תמונות קורונליות, סגיטליות ורוחביות המונחות על גבי החזר ה-ROI של האיברים שנבחרו המוכתבים על ידי ה-OPM (איור 3A). לא רק שהתוכנה יכולה לטעון תמונות בודדות, אלא שניתן לראות מספר עכברים מקבוצה או ממחקר שלם בבת אחת כתמונה אחת מכווצת. בתוך חלון ניתוח זה, ישנן אפשרויות להתאמה אישית של צבעי החזר ROI, עוצמת סרגל קנה המידה ופרמטרים נפוצים אחרים. לאחר בחירת המדדים האנליטיים האידיאליים, ה-SaaS מייצר גרף עמודות הפצה ביולוגית להורדה של האיברים שנבחרו (איור 3B).
כדי להעריך את הביצועים של פלטפורמת SaaS מבוססת OPM, הושוו התוצאות מהניתוח האוטומטי לאלו שנגזרו על ידי מנתח הדמיה מנוסה כתקן הזהב. רגרסיה ליניארית מתאימה בוצעה על ערכי קליטת [18F]FDG מהמוח, הלב, הכליות (מימין) והטחול. יש לציין כי הפלטפורמה מציעה רשימה מקיפה של איברים לבחירת המשתמשים, כולל השלד, המוח, שלפוחית השתן, הלב, הכליות (ימין ושמאל), הכבד, הטחול, הריאות ושרירי הארבע ראשי (ימין ושמאל). ארבעת האיברים הנ"ל נבחרו במחקר זה להמחשה בלבד. יתר על כן, בשל הגודל, הצורה והעומק/מיקום המשתנים של הגידולים המושתלים, הגידול אינו נכלל כאיבר ב-OPM, ולכן אינו נכלל בניתוח השוואתי זה. כפי שמוצג באיור 4, הניתוח האוטומטי והניתוח הידני הניבו תוצאות עקביות כלליות, כאשר המוח הראה את המתאם הגבוה ביותר (r2 = 0.8466). זה צפוי בשל גודלו הגדול של האיבר והמיקום הקבוע מאוד של המוח בתוך הגולגולת. הכליה הימנית והלב הראו גם ערכי r2 סבירים של 0.6874 ו-0.4849, בהתאמה. לעומת זאת, ניתוח המתאם עבור הטחול הניב ערך r2 של 0.3922, שהוא הנמוך ביותר מבין האיברים שנבדקו. זה לא מפתיע מכיוון שהטחול מקונן בלבלב וברקמות שומן חסרות מורפולוגיה מוגדרת ומניחות את אותה צפיפות רקמות רכות ב-CT. לכן קשה לפלח את הטחול באופן ידני, וה-OPM עשוי להציג אמצעי מדויק יותר לתיחום איבר זה (כלומר, ביצועים טובים יותר מתקן הזהב). השיפוע ויירוט ה-Y של ניתוחי מתאם אלה מוצגים גם באיור 4. בהתאם לערכי r2 , למוח היה שיפוע הקרוב ביותר ל-1 (כלומר, מתאם מושלם בין OPM לתוצאות ידניות) ויירוט ה-Y הקטן ביותר (כלומר, הטיה מערכתית מינימלית), בעוד שהאיברים האחרים הראו סטייה גדולה ומשתנה יותר ממתאם מושלם.

איור 1: BCAM והשתלת גידול מונחה תבנית. (A) הקדם-קליפס (1) מחובר לחלק התחתון של תבנית BCAM (2) עם קו הרדמה מחובר (3). זה משמש כבסיס להשתלת הגידול. (B) עכבר עם אזור שתל המטרה מגולח (במקרה הזה, הכתף הימנית) מונח על הבסיס תחת הרדמה לפני הזרקת התא. (C) תבנית השתלת גידול (4) עם חיתוכים מוגדרים מראש כדי להנחות את מיקום החיסון של תאי הגידול. (ד) יצירת סימן ייחוס זמני לפני הזרקת התא עם תבנית התבנית המונחת בצד הגבי של העכבר. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
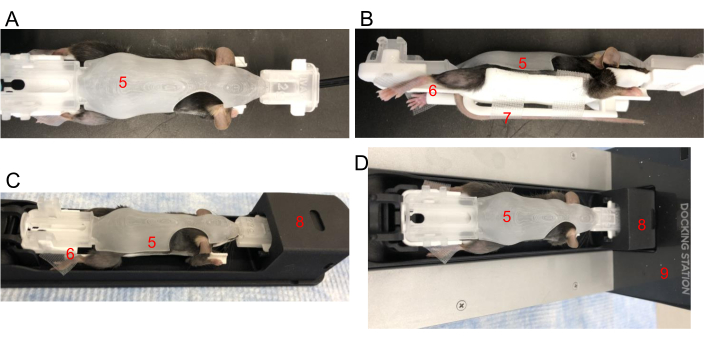
איור 2: מיקום עכבר ב-BCAM. (A) מבט למעלה - הנח עכבר בנוחות ב-BCAM בגודל מתאים (5). (B) מבט מהצד - סרט משמש לאבטחת הכפות האחוריות לפלטפורמות (6). הזנב מאובטח עם סרט לפלטפורמת הזנב (7) ישירות מתחת לעכבר. (C) עכבר, ב-BCAM, מוכנס לתוך מעבורת ההדמיה (8). (D) עכבר, BCAM ומעבורת מחוברים לתחנת עגינה הפועלת להרדמה (9). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
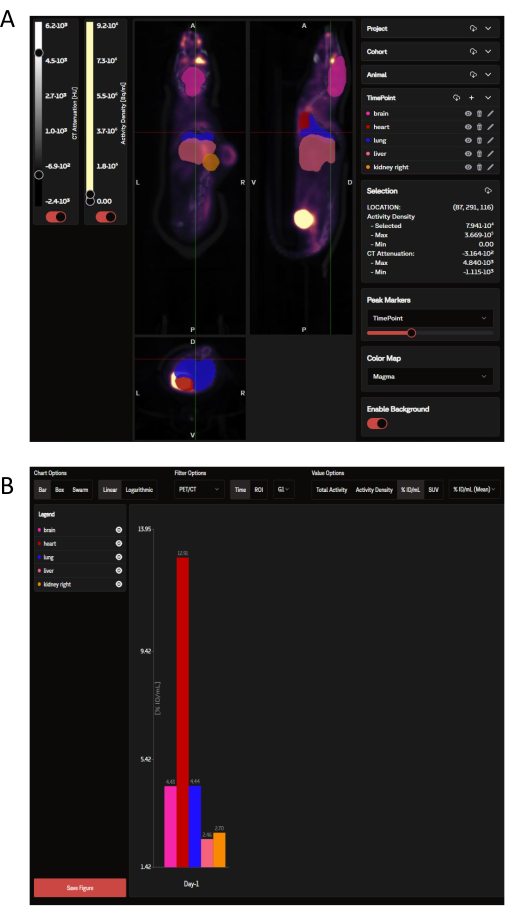
איור 3: תמונות מייצגות ופלט נתונים כפי שנצפו ונותחו על ידי כלי SaaS, בהתאמה. (א) תמונות מייצגות כפי שהן מוצגות באתר SaaS. תצוגות קורונליות, סגיטליות ורוחביות של תמונת ה-PET/CT עם החזר ROI של איברים שנבחרו ממפת הסתברות האיברים (OPM). ורוד: מוח; אדום: לב; כחול כהה: ריאה; סלמון: כבד; כתום: כליה (מימין). הגידול אינו מוגדר על ידי ה-OPM. (ב) גרף מייצג הניתן להורדה שנוצר מהניתוח האוטומטי. ניתן לראות רשימה של האיברים שנבחרו בלוח השמאלי העליון. הנתונים כאן מדווחים ב-%ID/mL. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
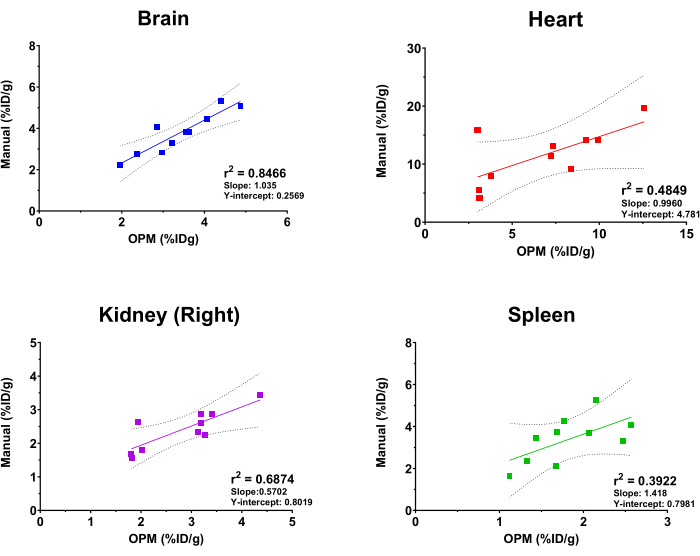
איור 4: ניתוח רגרסיה ליניארית המשווה ערכי קליטה של איברים [18F]FDG הנגזרים מניתוח ידני וזרימת העבודה של אוטומציה מבוססת OPM. נעשה שימוש בעשר סריקות PET/CT של נקבות עכברי C57BL/6. ערכי r2 , קווי ביטחון של 95%, שיפוע ויירוטי Y מוצגים בגרף עבור כל איבר שצוין. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
Discussion
הדוח הנוכחי מתאר את הליך ביצוע הדמיית PET in vivo של עכבר עם תבניות ה-BCAM וניתוח נתונים באמצעות כלי ה-SaaS האוטומטי. ניתנות הוראות שלב אחר שלב על הכנת עכבר, רכישת הדמיה ועיבוד נתונים. זרימת עבודה זו של אוטומציה הניבה גם נתונים שהיו עקביים עם ניתוח ידני. כמה שיקולים טכניים מרכזיים מודגשים להלן.
למרות שגידול אינו אחד האיברים המוגדרים על ידי ה-OPM, שלב קריטי בפרוטוקול זה הוא השתלה נכונה של גידולים תת עוריים כדי להבטיח בסופו של דבר יישור אופטימלי של כל איברי העכבר בחלל הגוף ו-BCAM. ה-OPM יכול להפיק נתונים מדויקים רק כאשר עמוד השדרה של העכבר ישר יחסית והאיברים הפנימיים ממוקמים באופן ניטרלי. גידולים גדולים מדי או שאינם במקומם עלולים להשפיע על תנוחת העכבר וללחוץ לתוך חלל גופו, ובכך להזיז את האיברים הפנימיים. שינוי זה, בתורו, יטה את הניתוח הכמותי המתקבל מאלגוריתם OPM. אחרים דיווחו על ההשפעה של עמוד שדרה לא ישר על יישור האיברים הפנימיים באמצעות שיטות הדמיה שונות ואלגוריתמי סגמנטציה13,14. לכן, חיוני להשתמש בתבנית כדי להנחות את השתלת הגידול ולעקוב מקרוב אחר צמיחת הגידול כדי להבטיח שהגידולים ממוקמים כראוי ובטווח הגודל האידיאלי.
תחום נוסף של סטייה אפשרית הוא הבחירה של BCAM בגודל מתאים. BCAMs נוצרים באינטגרלים של 2 גרם, עם טווח של 18-26 גרם. עם זאת, מכיוון שעכברים עם הרכב גוף שונה (למשל, יותר שריר לעומת יותר שומן) עשויים להיות בעלי אותו משקל גוף אך גדלים פיזיים שונים, חשוב לבחור את ה-BCAM המתאים ביותר תוך שימוש במשקל גופם כהתייחסות כללית. רמה למעלה או למטה על ידי ניסוי וטעייה, וזכור כי יישור נכון הוא קריטי. בחירה ב-BCAM גדול מדי תגרום לאיברים הפנימיים של העכבר 'לשקוע' קרוב יותר לתחתית המיטה, מה שישפיע במיוחד על דיוק הניתוח של איברי הגב כמו הכליות ועמוד השדרה. לעומת זאת, הצבת עכבר ב-BCAM קטן מדי עלולה ללחוץ על חללי הגוף שלהם, להטות את מיקום האיברים ולגרום לקשיי נשימה. שימוש בסרט כדי להבטיח שהגפיים מאובטחות על פלטפורמות כפות יעזור בהתקנה ובמיקום.
למרות שזרימת עבודה מדווחת זו מאפשרת ניתוח תמונת PET סטנדרטי ואוטומטי, ראוי לציין כי ה-OPM הנוכחי בנוי על בסיס זן העכבר C57BL/6 בעל היכולת החיסונית ועכברים בריאים. זנים ומצבים בריאותיים אחרים של עכברים עשויים להציג תכונות אנטומיות שונות הדורשות התאמה, אופטימיזציה ואימות נוספים של האלגוריתם. לדוגמה, לזנים חסרי חיסון כמו NSG או NCG יש טחול קטן יותר. באופן דומה, עכברים הנושאים שתלי גידול אורתוטופיים עשויים להיות בעלי גדלים, צורות ומיקומים שונים של איברים פנימיים בהתאם למצב המחלה שלהם. מגבלה נוספת של זרימת עבודה זו היא התפוקה הכוללת בשלב הרכישה של ניסוי. זה נובע בעיקר מהזמן הנוסף הנדרש להגדרת עכבר כראוי ב-BCAM. הכשרה ותרגול יכולים להגביר את יעילות המפעיל במיקום נכון. תוספת של תחנת עגינה שנייה יכולה גם להגדיל את התפוקה הכוללת, כאשר רציף אחד יכול לשמש להגדרת BCAM, והשני יכול לשמש להסרת עכבר לכלוב התאוששות. עם זאת, גם עם הזמן המוגבר הנדרש להגדרת BCAM לפני הסריקה, ההשקעה בזמן משתלמת על ידי חיסכון בזמן בקצה ניתוח הנתונים. לדוגמה, במחקר הנוכחי, לקח פחות מ-10 דקות ל-OPM לנתח עשר תמונות (עם 4 החזר ROI), בעוד שלקח 3-4 שעות לאנליסט מנוסה מאוד לפלח ולנתח באופן ידני את אותה קבוצה של תמונות והחזר ROI. אנליסט חסר ניסיון ידרוש עוד יותר זמן לניתוח ידני. פלטפורמת SaaS מאפשרת ניתוח של סריקות PET בקבוצות גדולות, כאשר ניתן להשלים ניתוח הפצה ביולוגית מלאה תוך דקות לאחר העלאת הנתונים. זוהי תכונה מועילה ביותר בעת טיפול בכמויות גדולות של נתונים ממספר קבוצות ו/או על פני מספר נקודות זמן, כפי שנדון להלן.
פילוח ידני של איברים לנושא בודד יכול לגזול זמן, ובדרך כלל הוא דורש הכשרה משמעותית מראש של המפעיל. אפילו עם הכשרה מתאימה, ניתוחים ידניים מתמודדים בהכרח עם שינויים בין מפעילים, שיכולים להטות את התוצאות הכמותיות15,16. לעומת זאת, פילוח אוטומטי וניתוח נתונים יכולים לקבוע בצורה מדויקת ויעילה את ההפצה הביולוגית הכוללת של רדיואקסר ולבטל שונות המושרשת בפעולות אנושיות. יתרונות כאלה של אוטומציה נראו הן בניתוח תמונות קליניות והן במרחב הפרה-קליני. לדוגמה, Sluis et al. הראו שסריקה בודדת דורשת 4 שעות כדי לפלח את האיברים המעניינים בהשוואה ל-30 דקות בשיטות מבוססות ענןAI 17. מחקר אחר של נזארי ועמיתיו דיווח גם כי ניתוח מבוסס אלגוריתם של הכבד והכליות הראה תוצאות מדויקות בטווח של 7.0% בהשוואה לשני פיזיקאים רפואיים אנושיים18. הנתונים באיור 4 גם הציגו בבירור את האמינות של זרימת העבודה של ניתוח הדמיית PET מבוססת SaaS, וכי ניתוח אוטומטי הניב תוצאות עקביות בהשוואה לניתוח ידני.
לסיכום, מאמר זה ממחיש את זרימת העבודה של שימוש בתבניות BCAM כדי להקל על רכישת תמונות PET/CT פרה-קליניות סטנדרטיות כמו גם ניתוח נתוני PET אוטומטי התומך ב-SaaS. הוכח כי טכנולוגיית פלטפורמה זו פשוטה יחסית לשימוש, ואיכות הנתונים שנוצרו על ידי אוטומציה עולה בקנה אחד עם ניתוח ידני אך מתהדרת ביתרונות משמעותיים של חיסכון בזמן. לכן, זרימת עבודה זו יכולה לחסוך לחוקרים מאות שעות בזמן ניתוח נתונים ולעזור לתקנן ולהפחית את השונות בין המפעילים. הליך זה יכול לסייע בפיתוח של מספר רב של תרכובות תרופות על פני שיטות ואינדיקציות. במיוחד, ניתן לתייג בקלות שיטות מולקולות גדולות כגון נוגדנים טיפוליים, נוגדנים דו-ספציפיים, נוגדנים-תרופות מצומדים ואפילו ננו-חלקיקים עם מתכות רדיו-מתכות (למשל, Zr-89, Cu-64) כדי לאפשר הערכת הפצה ביולוגית בתיווך הדמיית PET19,20. באופן דומה, טכנולוגיית פלטפורמה זו יכולה לסייע בקביעת המינון של טיפולי רדיו חדשים בעכברים21. יישום הליך זה יהווה ערך מוסף רב לפיתוח תרופות.
Disclosures
כל המחברים הם עובדים בהווה או בעבר של פייזר, בע"מ.
Acknowledgements
תודה מיוחדת לצוות המחקר והטכני של פייזר לה ג'ולה לרפואה השוואתית.
Materials
| Name | Company | Catalog Number | Comments |
| [18F]FDG | PETNet Solutions, Culver City, CA | NA | Radiotracer used for PET imaging |
| 27 G needle | Becton, Dickinson and Company, San Diego, CA | 305136 | Used for cell injection |
| app.invivo.ax/login | Invivo Analytics, Seattle, WA | NA | Software as a Service webpage |
| Body Conforming Animal Molds | Invivo Analytics, Seattle, WA | NA | BCAMs with weight range of 18 - 26 g |
| Dose Calibrator; CRC-55tw | Capintec, Florham Park, NJ | CRC-55tw | Measurement of radioactive doses |
| G8 PET/CT scanner | Sofie Biosciences/Xodus Imaging, Torrence, CA | NA | Benchtop scanner with loading dock |
| G8-Docking station | Sofie Biosciences/Xodus Imaging, Torrence, CA | NA | Docking station for staging |
| Implantation Mold Template | Invivo Analytics, Seattle, WA | NA | Template for optimal tumor implantation |
| Lubricant eye ointment | BAUSCH & LOMB, Ontario, Canada | Soothe Nighttime | Eye lube for mice |
| Modified G8 shuttle | Invivo Analytics, Seattle, WA | NA | Shuttle for BCAM accommodation |
| Mouse anesthesia Induction box | Patterson Scientific, Waukesha, WI | 78933388 | Used for anesthetizing a mouse |
| PRE-Clip | Invivo Analytics, Seattle, WA | NA | BCAM adapter for anesthesia connection |
| Premiere Slide warmer | LabScientific, Danvers, MA | XH-2001 | Adjustable temp warmer used for tail vein dilation and anesthesia induction |
| Syringe (1 mL) | Becton, Dickinson and Company, San Diego, CA | 309659 | Used for cell injection |
| Tail Vein injection platform | Braintree Scientific, Pembroke, MA | IL-300 | Restrainer used for administering intravenous injections. |
| Vivoqaunt Software | Invicro, Needham, MA | NA | Software used for manual segmentation |
References
- Huang, R., Wang, M., Zhu, Y., S Conti, P., Chen, K. Development of pet probes for cancer imaging. Curr Top Med Chem. 15 (8), 795-819 (2015).
- Schwenck, J., et al. Advances in pet imaging of cancer. Nat Rev Cancer. 23 (7), 474-490 (2023).
- Matthews, P. M., Rabiner, E. A., Passchier, J., Gunn, R. N. Positron emission tomography molecular imaging for drug development. Br J Clin Pharmacol. 73 (2), 175-186 (2012).
- Tavaré, R., et al. An effective immuno-pet imaging method to monitor CD8-dependent responses to immunotherapy. Cancer Res. 76 (1), 73-82 (2016).
- Maresca, K. P., et al. Preclinical evaluation of 89ZR-DF-IAB22M2C PET as an imaging biomarker for the development of the gucy2c-cd3 bispecific pf-07062119 as a t-cell engaging therapy. Mol Imaging Biol. 23 (6), 941-951 (2021).
- Nisnboym, M., et al. Immuno-pet imaging of cd69 visualizes t-cell activation and predicts survival following immunotherapy in murine glioblastoma. Cancer Res Commun. 3 (7), 1173-1188 (2023).
- Lee, C., et al. Efficacy and imaging-enabled pharmacodynamic profiling of Kras g12c inhibitors in xenograft and genetically engineered mouse models of cancer. Mol Cancer Ther. 22 (7), 891-900 (2023).
- Bollineni, V., Kramer, G., Jansma, E. P., Liu, Y., Oyen, W. J. A systematic review on [18f] flt-pet uptake as a measure of treatment response in cancer patients. Eur J Cancer. 55, 81-97 (2016).
- Everitt, S., et al. Imaging cellular proliferation during chemo-radiotherapy: A pilot study of serial 18f-flt positron emission tomography/computed tomography imaging for non-non-small-cell lung cancer. Int J Radiat Oncol Biol Phys. 75 (4), 1098-1104 (2009).
- Rashidian, M., et al. Predicting the response to CTLA-4 blockade by longitudinal non-invasive monitoring of cd8 t cells. J Exp Med. 214 (8), 2243-2255 (2017).
- Klose, A. D., Paragas, N. Automated quantification of bioluminescence images. Nat Commun. 9 (1), 4262 (2018).
- Gu, Z., et al. Performance Evaluation of G8, a high-sensitivity benchtop preclinical PET/CT Tomograph. J Nucl Med. 60 (1), 142-149 (2019).
- Bongratz, F., Rickmann, A. -. M., Wachinger, C. Abdominal organ segmentation via deep diffeomorphic mesh deformations. Sci Rep. 13 (1), 18270 (2023).
- Wang, H., Stout, D. B., Chatziioannou, A. F. Mouse atlas registration with non-tomographic imaging modalities-a pilot study based on simulation. Mol Imaging Biol. 14, 408-419 (2012).
- Montgomery, M. K., et al. Mouse lung automated segmentation tool for quantifying lung tumors after micro-computed tomography. PLoS One. 16 (6), e0252950 (2021).
- Montgomery, M. K., et al. Applying deep learning to segmentation of murine lung tumors in preclinical micro-computed tomography. Transl. Oncol. 40, 101833 (2024).
- Van Sluis, J., et al. Manual versus artificial intelligence-based segmentation as a pre-processing step in whole-body pet dosimetry calculations. Mol Imaging Biol. 25 (2), 435-441 (2023).
- Nazari, M., et al. Automated and robust organ segmentation for 3D-based internal dose calculation. EJNMMI Res. 11, 1-13 (2021).
- Goel, S., England, C. G., Chen, F., Cai, W. Positron emission tomography and nanotechnology: A dynamic duo for cancer theranostics. Adv Drug Deliv Rev. 113, 157-176 (2017).
- Campbell, D. O., et al. Preclinical evaluation of an anti-nectin-4 immunopet reagent in tumor-bearing mice and biodistribution studies in cynomolgus monkeys. Mol Imaging Biol. 18, 768-775 (2016).
- Bednarz, B., et al. Murine-specific internal dosimetry for preclinical investigations of imaging and therapeutic agents. Health Phys. 114 (4), 450-459 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved