Method Article
Tomographie par émission de positons préclinique avec des moules animaux conformes au corps pour l’analyse automatisée d’images basée sur le cloud chez la souris
Dans cet article
Résumé
Ce protocole décrit la procédure d’imagerie TEP in vivo sur des souris à l’aide de moules animaux conformes au corps (BCAM) dans le scanner PET/CT G8. Des détails techniques sur la préparation des souris, y compris l’implantation correcte de la tumeur, le positionnement optimal, l’acquisition d’images TEP/TDM assistée par BCAM et l’analyse des données, sont fournis.
Résumé
La tomographie par émission de positons (TEP) est une modalité d’imagerie moléculaire qui peut être utilisée pour étudier une multitude de questions pharmacologiques, telles que la modulation des biomarqueurs, l’occupation des récepteurs et la biodistribution des composés d’intérêt. Dans les études de biodistribution, les sujets expérimentaux sont souvent imagés longitudinalement après avoir reçu l’article testé. Les images sont ensuite analysées pour dériver le profil de distribution du composé dans divers organes à différents moments. Il s’agit d’une étape cruciale dans le développement d’un médicament pour comprendre la distribution et le profil potentiellement contraignant d’un composé d’investigation. Cependant, les méthodes standard/manuelles d’analyse de la biodistribution basées sur l’imagerie TEP sont laborieuses et chronophages et sont souvent associées à une grande variabilité entre opérateurs. De plus, il est difficile de maintenir les positions des animaux cohérentes à différents moments. Pour remédier à ces lacunes, une série de moules pour animaux conformes au corps de souris (BCAM) a été utilisée pour permettre un positionnement rigide et cohérent des animaux lors de l’acquisition d’imagerie TEP/TDM. De plus, une plate-forme SaaS (Software-as-a-Service) composée d’une carte de probabilité d’organe (OPM) basée sur le cloud et d’un outil de segmentation alimenté par l’intelligence artificielle a été utilisée pour permettre une quantification fiable et automatisée des données d’imagerie TEP in vivo. Le flux de travail présenté ici comprend (1) la préparation des souris pour l’imagerie avec les BCAM, y compris l’implantation correcte des tumeurs sous-cutanées pour qu’elles soient compatibles avec les moules, (2) l’acquisition d’images TEP/CT avec des BCAM à l’aide du scanner G8, et 3) la réalisation d’une segmentation automatisée des organes et d’une analyse de la biodistribution à l’aide du SaaS basé sur le cloud. [18FÉVRIER]Le FDG a été utilisé comme traceur exemplaire ici, mais d’autres biomarqueurs et/ou composés radiomarqués peuvent être facilement adaptés dans le flux de travail. Cette procédure peut être exécutée avec précision et efficacité avec un minimum de formation, et l’analyse automatisée des données TEP a donné des résultats satisfaisants conformes à la méthode manuelle.
Introduction
Les technologies d’imagerie moléculaire in vivo sont des outils importants dans le développement de médicaments pour faciliter l’évaluation des trois piliers de la pharmacologie : la biodistribution, l’engagement des cibles et la modulation de la pharmacodynamie 1,2,3. La tomographie par émission de positons (TEP), avec sa traduisibilité clinique et sa haute sensibilité, est l’une des modalités d’imagerie moléculaire les plus couramment utilisées dans le domaine de la recherche et du développement clinique et préclinique. Le domaine florissant de l’imagerie TEP préclinique et du radiothéranostique est précieux pour le développement de thérapies intrinsèques aux tumeurs, de thérapies ciblées et de nouvelles thérapies d’immuno-oncologie (IO). L’émergence et le développement continus de nouveaux radiotraceurs immuno-TEP ont le potentiel d’influencer des schémas thérapeutiques IO spécifiques et d’identifier les répondeurs par rapport aux non-répondeurs 4,5,6. Pendant ce temps, les radiotraceurs métaboliques spécifiques, tels que le [18F]FDG et le [18F]FLT, peuvent surveiller la réponse d’une tumeur au traitement et peuvent respectivement faire la lumière sur la prolifération active d’une tumeur ou sa consommation de glucose7, ou si les cellules tumorales subissent un arrêt du cycle cellulaire par des moyens d’inhibition 8,9.
L’imagerie in vivo non invasive présente de multiples avantages par rapport aux expériences pharmacologiques traditionnelles, sans imagerie. Par exemple, l’imagerie permet une évaluation systémique et holistique de la distribution et/ou de l’effet pharmacologique d’un médicament chez l’ensemble du sujet, ce qui permet non seulement de surveiller l’efficacité au site cible, mais aussi de détecter des activités inattendues hors site. En raison de sa nature non invasive, le même ensemble d’animaux peut être évalué longitudinalement à différents moments et/ou avec différents biomarqueurs pour répondre à des questions biologiques distinctes10. Non seulement cela réduit considérablement le nombre d’animaux nécessaires à l’étude, mais cela fournit également un contrôle orthogonal à travers les points temporels et, par conséquent, contribue à améliorer les corrélations et à réduire les variabilités individuelles. Malgré le développement prometteur de biomarqueurs d’imagerie, la nécessité d’évaluer les composés étudiés in vivo avec des études de biodistribution basées sur l’imagerie TEP se heurte toutefois à un manque de processus automatisés efficaces pour l’analyse. Les études de biodistribution du PET génèrent des informations précieuses sur la cinétique, l’accumulation tissulaire, la liaison et le métabolisme d’un composé. L’obtention de données quantitatives hautement reproductibles est essentielle pour le développement de thérapies pharmaceutiques.
Pour répondre à ces besoins non satisfaits en matière d’analyse automatisée d’images TEP, InVivo Analytics a conçu un ensemble de moules animaux conformes au corps de souris (BCAM)11. Il s’agit de moules en plastique imprimés en 3D qui maintiennent la tête, le torse (et les organes internes), la queue et les membres d’une souris dans des positions rigides et prédéfinies. Des moules de différentes tailles peuvent être sélectionnés en fonction du poids corporel de l’animal, et des découpes peuvent être créées dans des régions spécifiques, telles que l’épaule ou le flanc inférieur, pour permettre aux tumeurs sous-cutanées de faire saillie. Les images TEP/TDM acquises avec ces BCAM sont très uniformes et peuvent être analysées par lots par la plate-forme de segmentation automatisée basée sur le cloud de l’entreprise11. Cet article présente un flux de travail automatisé d’analyse de la biodistribution in vivo qui est alimenté par l’acquisition physique d’images avec des BCAM et la segmentation et l’analyse d’images par le SaaS.
Protocole
Toutes les procédures effectuées sur des animaux ont été soumises à des règlements et à des lignes directrices établies, et ont été examinées et approuvées par le comité institutionnel de protection et d’utilisation des animaux de Pfizer ou par le biais d’un processus d’examen éthique. L’imagerie TEP a été réalisée conformément à tous les protocoles de radioprotection de l’établissement. Des souris femelles C57BL/6, âgées de 10 à 12 semaines, avec des poids corporels variant de 18 à 26 g, ont été utilisées dans cette étude. Les détails des réactifs et de l’équipement utilisés sont répertoriés dans le tableau des matériaux.
1. Préparation et mise en scène des animaux
REMARQUE : Cette étape consiste à mettre les animaux en scène pour l’imagerie TEP avec l’implantation tumorale guidée par un modèle BCAM.
- Avant l’implantation cellulaire, rasez la fourrure des souris dans la région souhaitée de croissance tumorale.
- Installez la station d’anesthésie et fixez un moule BCAM de la taille appropriée au pré-clip avec le haut retourné à 90 degrés. Celui-ci servira de base d’implantation tumorale (Figure 1A).
- Anesthésier les animaux dans une boîte d’induction appropriée contenant 2,0 % d’isoflurane et 98 % d’oxygène à un débit de 0,5 à 1,5 L/min.
REMARQUE : Tous les systèmes d’anesthésie sont variables.- Utilisez un système calibré et testez avant utilisation. Placez une souris anesthésiée sur la base et étendez ses membres (Figure 1B).
- Placez délicatement un moule de modèle d’injection de tumeur BCAM (Figure 1C) sur la face dorsale de la souris (Figure 1D).
- Créez avec soin une marque de référence circulaire temporaire à l’endroit découpé souhaité (p. ex., épaulement ou flanc, gauche ou droite) à l’aide d’un marqueur (figure 1D). Retirez le moule du modèle.
- Préparez les cellules pour l’injection en aspirant le volume désiré dans une seringue. Fixez une aiguille de 27 G à la seringue et remplissez l’espace du volume mort. Un volume de 0,1 à 0,2 mL par inoculation est recommandé.
- Soulevez la peau avec les doigts ou une pince en utilisant les marques temporaires de l’étape 1.5 comme référence pour créer une tente, insérez lentement l’aiguille et injectez des cellules par voie sous-cutanée à l’endroit souhaité. Jetez l’aiguille dans un contenant pour objets tranchants et présentant un risque biologique.
- Surveillez la croissance tumorale. Le volume tumoral moyen au moment de l’inscription dans cet exemple était de 200 à 300 mm3.
REMARQUE : Évitez d’utiliser des composants métalliques tels que des étiquettes d’oreille ou des micropuces pour éviter les artefacts d’imagerie CT.
2. Prélèvement des doses radioactives
- Conformément à tous les protocoles de radioprotection de l’établissement, calculer soigneusement une dose cible de [18F]FDG dans la gamme d’environ 70 à 80 μCi dans une seringue stérile adaptée à l’injection intraveineuse.
REMARQUE : La plage de 70-80 μCi est optimale pour s’adapter à la plage dynamique du scanner TEP Sofie G8. D’autres imageurs peuvent avoir des plages dynamiques différentes qui nécessitent une dose cible différente. - Mesurez soigneusement la dose radioactive dans un calibrateur de dose en plaçant la seringue dans la chambre du puits et en abaissant la louche. Faites attention à sélectionner l’isotope ou le numéro d’étalonnage approprié avant la mesure.
- Prenez une lecture stable. Enregistrez la date et l’heure. Ajustez la dose si nécessaire.
- (Facultatif) Utilisez une solution saline stérile pour porter le volume final de la dose à 0,1-0,2 mL.
REMARQUE : Le volume d’injection souhaité peut varier. - La dose est prête à être administrée.
3. Administration de doses intraveineuses
- Conformément aux protocoles institutionnels de l’IACUC et de radioprotection, préparez la queue de souris pour l’injection IV en dilatant la veine de la queue. Dans cette étude, la veine de la queue a été dilatée en plaçant la cage de l’animal ou la chambre d’induction sur un chauffe-lames réglé à 42 °C.
REMARQUE : Cela peut prendre jusqu’à 10 minutes de réchauffement pour que la veine de la queue se dilate complètement. - Avant l’injection, notez le poids de la souris. Cela déterminera quel BCAM spécifique au poids à utiliser pour l’imagerie TEP/TDM.
- Une fois prête, transférez la souris dans un dispositif de contention approprié (p. ex., une plateforme d’injection de la veine de la queue a été utilisée dans la présente étude) et localisez la veine de la queue.
- Manipulez avec précaution la seringue radioactive et injectez la dose dans une souris consciente. Enregistrez le temps d’injection.
- Mettez soigneusement la seringue de côté et nettoyez l’excès de sang gouttes de la queue avec de la gaze. Retirez la souris de la retenue et remettez-la dans le boîtier approprié.
- Replacez soigneusement la seringue dans la chambre du calibrateur de dose et enregistrez toutes les lectures résiduelles pour un calcul correct de la dose. Enregistrez la date et l’heure de la lecture de l’activité résiduelle.
- Une fois les injections terminées, soyez prudent et placez des cohortes de souris derrière des enceintes en plomb et/ou à l’écart du personnel, conformément aux pratiques de radiothérapie sans danger de l’établissement. Veuillez noter que tous les matériaux utilisés sont sujets à une contamination radioactive mineure. Surveillez toutes les zones à l’aide d’un compteur Geiger calibré et nettoyez conformément aux directives de radioprotection.
4. Anesthésie et positionnement des animaux pour l’imagerie TEP
- Au moment approprié (p. ex., 10 à 15 minutes avant la fin de la période d’absorption du traceur), allumez tout l’équipement d’anesthésie et les instruments de réchauffement des animaux nécessaires à l’induction de l’anesthésie et à l’imagerie TEP. L’anesthésie peut être réglée à 2,0 % à 2,5 % d’isoflurane dans 98 % d’oxygène (les paramètres peuvent varier selon la souche de souris et le modèle de maladie).
- Vérifiez que tous les adaptateurs et vannes sont activés et que le débit de gaz est de 0,5 à 1,0 L/min. Les débits spécifiques peuvent varier selon les systèmes d’anesthésie et les systèmes d’imagerie.
- Placez le(s) animal(s) approprié(s) dans une boîte d’induction et attendez que le sujet atteigne la bonne profondeur d’anesthésie.
- Appliquez une pommade lubrifiante pour les yeux sur chaque œil.
- Transférez la souris dans un BCAM de taille appropriée en fonction du poids corporel.
- Prenez doucement la souris par la nuque, insérez la queue dans la fente de la queue et enroulez-la sous le BCAM. Placez la queue sur la plate-forme de queue et fixez-la avec du ruban adhésif pour sécuriser la position. Vérifiez que la colonne vertébrale est droite. Fermez doucement le BCAM (Figure 2A,B).
- Positionnez soigneusement les quatre membres pour qu’ils reposent sur chacune des plateformes de pattes BCAM. Utilisez du ruban adhésif au besoin pour fixer les pattes à chaque plate-forme (figure 2B).
- Enclenchez doucement le BCAM dans la navette du lit d’imagerie en insérant d’abord l’extrémité avant (Figure 2C). La navette doit déjà être reliée au quai de chargement du G8 avec un flux d’anesthésie (figure 2D). Appuyez sur l’arrière du BCAM et un clic indiquera qu’il est fixé à la navette G8.
REMARQUE : Maintenez l’alimentation en anesthésique de manière à ce que l’animal reste dans le plan anesthésique souhaité pendant l’imagerie.
5. Acquisition d’images
- Ouvrez le logiciel d’acquisition G8 PET. Les dossiers d’étude, les paramètres de numérisation et les ID de sujet peuvent être créés à l’avance.
- Entrez les détails de l’étude dans le logiciel : poids de la souris, date/heure et quantité de la dose initiale prélevée, date/heure de l’injection, date/heure et quantité de lecture de l’activité résiduelle.
- Insérez la navette avec la souris dans l’ouverture du scanner. Un voyant bleu indiquera l’amarrage correct au système.
- Sélectionnez les paramètres TEP/TDM appropriés. Acquérir des données d’imagerie.
REMARQUE : Dans cette étude, une tomographie par émission de positrons statiques de 7minutes a été exécutée, suivie d’une tomodensitométrie par défaut de 70 secondes, et un algorithme de reconstruction 3D de maximisation de l’espérance de vraisemblance maximale (par défaut et la seule option dans le scanner G8) a été appliqué pour reconstruire les données12. - Une fois l’acquisition terminée, la navette retournera à sa position de départ initiale. Retirez la navette avec la souris et insérez-la dans la station d’accueil. Appuyez sur l’arrière de la languette verticale du BCAM pour le retirer de la navette G8, puis tirez doucement vers le haut et retirez le BCAM avec la souris.
- Appuyez sur les deux languettes de fixation pour retourner et ouvrir le haut du BCAM.
- Retirez délicatement la souris. Assurez-vous que la souris s’est complètement rétablie de l’anesthésie et qu’elle est vive, alerte et réactive (BAR) avant de retourner dans sa cage d’origine.
- Poursuivez la procédure à intervalles de temps définis pour scanner l’ensemble de la cohorte/groupe de souris.
6. Téléchargement d’images sur le SaaS
- Connectez-vous à app.invivo.ax et créez un projet.
- Cliquez sur l’onglet rouge de téléchargement en haut à droite de la fenêtre. Sélectionnez un système d’imagerie et un rapporteur utilisés dans l’étude d’imagerie (c.-à-d. [18F]FDG). Sélectionnez le dossier contenant les données d’imagerie.
- Accédez à l’onglet d’annotation dans le dossier du projet. Cliquez sur Annoter pour ajouter les informations pertinentes sur l’examen (nom du sujet, sexe, taille du MECB, poids du sujet, nom de la cohorte, point temporel et valeur de la dose injectée). La plupart des métadonnées seront remplies automatiquement.
7. Analyse automatisée des données
- Dans le dossier du projet, toutes les numérisations doivent être remplies. Cliquez sur les numérisations pour naviguer à partir des niveaux de projet, de groupe et de sujet individuel. Sélectionnez Analyser dans le coin supérieur droit.
- En haut à droite de la fenêtre du ruban d’analyse, sous Projet, sélectionnez le symbole plus , puis sélectionnez Champ d’intérêt de la carte de probabilité d’organe. La carte de probabilité d’organe (OPM) est un atlas statistique des organes de souris englobant plusieurs organes et tissus prédéfinis. Sélectionner les organes d’intérêt en fonction des besoins de la recherche.
REMARQUE : Dans cet exemple, la segmentation et l’analyse manuelles ont été effectuées à l’aide de VivoQuant, à l’aide de l’outil spline, suivies d’une interpolation dans l’opérateur ROI 3D. Les résultats de l’analyse automatisée ont été comparés aux résultats de la segmentation manuelle à titre de référence.
Résultats
Une fois téléchargées, les données TEP peuvent être visualisées sur le site Web SaaS sous la forme d’un panel d’images coronales, sagittales et transversales superposées aux ROI des organes sélectionnés qui sont dictés par l’OPM (Figure 3A). Non seulement le logiciel peut charger des images individuelles, mais plusieurs souris d’un groupe ou d’une étude entière peuvent être visualisées à la fois comme une seule image réduite. Dans cette fenêtre d’analyse, il existe des options pour personnaliser les couleurs de ROI, l’intensité de la barre d’échelle et d’autres paramètres courants. Une fois les mesures analytiques idéales sélectionnées, le SaaS génère un graphique à barres de biodistribution téléchargeable des organes sélectionnés (Figure 3B).
Pour évaluer les performances de la plate-forme SaaS basée sur OPM, les résultats de l’analyse automatisée ont été comparés à ceux obtenus par un analyste d’imagerie expérimenté comme référence. Une régression linéaire d’ajustement a été effectuée sur les valeurs d’absorption de [18F]FDG du cerveau, du cœur, des reins (à droite) et de la rate. Il convient de noter que la plate-forme propose une liste complète d’organes parmi lesquels les utilisateurs peuvent choisir, notamment le squelette, le cerveau, la vessie, le cœur, les reins (droit et gauche), le foie, la rate, les poumons et les muscles quadriceps (droit et gauche). Les quatre organes ci-dessus ont été sélectionnés dans cette étude à des fins d’illustration seulement. De plus, en raison de la taille, de la forme et de la profondeur/emplacement variables des tumeurs implantées, la tumeur n’est pas incluse en tant qu’organe dans l’OPM, et donc exclue de cette analyse comparative. Comme le montre la figure 4, l’analyse automatisée et l’analyse manuelle ont donné des résultats globalement cohérents, le cerveau montrant la corrélation la plus élevée (r2 = 0,8466). Cela est attendu en raison de la grande taille de l’organe et de la position très constante du cerveau dans le crâne. Le rein droit et le cœur ont également montré des valeurs raisonnables de r2 de 0,6874 et 0,4849, respectivement. En revanche, l’analyse de corrélation pour la rate a généré une valeur r2 de 0,3922, ce qui est la plus basse parmi les organes testés. Ce n’est pas surprenant car la rate est imbriquée dans le pancréas et les tissus adipeux qui n’ont pas de morphologie définie et supposent la même densité de tissus mous sur la TDM. La rate est donc difficile à segmenter manuellement, et l’OPM peut présenter un moyen plus précis de délimiter cet organe (c’est-à-dire surpasser l’étalon-or). La pente et l’ordonnée à l’origine de ces analyses de corrélation sont également illustrées à la figure 4. Conformément aux valeurs de r2 , le cerveau avait une pente la plus proche de 1 (c’est-à-dire une corrélation parfaite entre l’OPM et les résultats manuels) et la plus petite ordonnée à l’origine (c’est-à-dire un biais systémique minimal), tandis que les autres organes présentaient un écart plus important et variable par rapport à une corrélation parfaite.

Figure 1 : Implantation tumorale guidée par un BCAM et un modèle. (A) Le pré-clip (1) est fixé à la pièce inférieure d’un moule BCAM (2) avec une ligne d’anesthésie connectée (3). Cela sert de base d’implantation tumorale. (B) Une souris dont le site d’implantation cible est rasé (dans ce cas, l’épaule droite) est placée sur la base sous anesthésie avant l’injection de cellule. (C) Modèle d’implantation tumorale (4) avec des découpes prédéfinies pour guider la mise en place de l’inoculation des cellules tumorales. (D) Réalisation d’une marque de référence temporaire avant l’injection de la cellule avec le moule de gabarit placé sur le côté dorsal de la souris. Veuillez cliquer ici pour voir une version agrandie de cette figure.
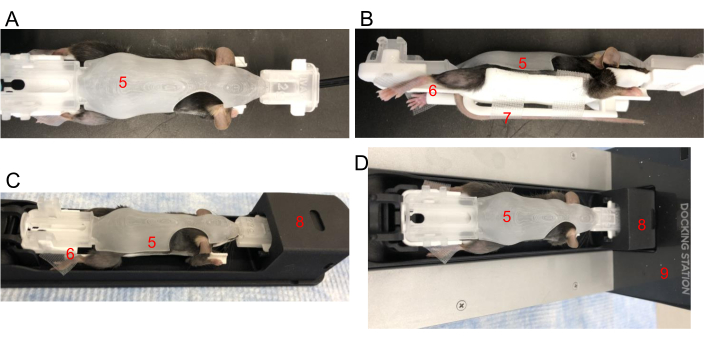
Figure 2 : Positionnement d’une souris dans un BCAM. (A) Vue de dessus - Placez une souris bien ajustée dans un BCAM de taille appropriée (5). (B) Vue latérale - Du ruban adhésif est utilisé pour fixer les pattes arrière aux plates-formes (6). La queue est fixée à l’aide d’un ruban adhésif à la plate-forme de queue (7) directement sous la souris. (C) La souris, dans le BCAM, est insérée dans la navette d’imagerie (8). (D) La souris, le BCAM et la navette sont reliés à une station d’accueil pour l’anesthésie (9). Veuillez cliquer ici pour voir une version agrandie de cette figure.
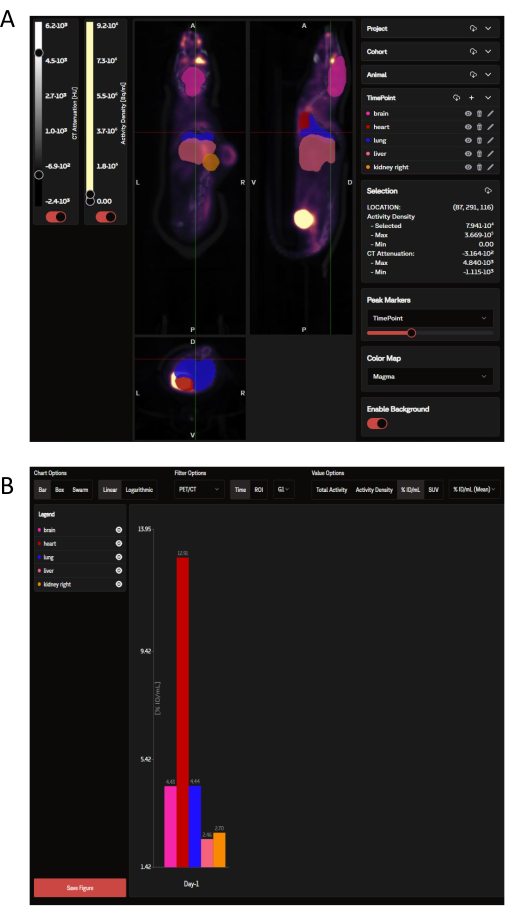
Figure 3 : Images représentatives et sorties de données telles qu’elles sont visualisées et analysées par l’outil SaaS, respectivement. (A) Images représentatives telles qu’elles sont visualisées sur le site Web SaaS. Vues coronales, sagittales et transversales de l’image TEP/TDM superposées aux ROI des organes sélectionnés à partir de la carte de probabilité des organes (OPM). Rose : cerveau ; rouge : cœur ; bleu foncé : poumon ; saumon : foie ; orange : rein (à droite). La tumeur n’est pas définie par l’OPM. (B) Un graphique représentatif téléchargeable généré à partir de l’analyse automatisée. Une liste des organes sélectionnés peut être consultée dans le panneau supérieur gauche. Les données sont présentées en % ID/ml. Veuillez cliquer ici pour voir une version agrandie de cette figure.
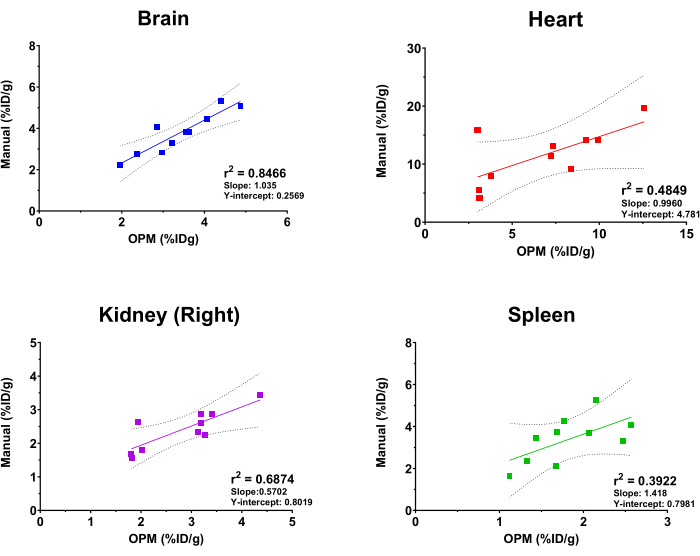
Figure 4 : Analyse de régression linéaire comparant les valeurs d’absorption de F]FDG dérivées de l’organe [18] par l’analyse manuelle et le flux de travail d’automatisation basé sur l’OPM. Dix tomographies TEP/TDM de souris femelles C57BL/6 ont été utilisées. Les valeurs r2, les lignes de confiance à 95 %, la pente et les points à l’origine sont affichés sur le graphique pour chaque organe indiqué. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Le présent rapport décrit la procédure d’imagerie TEP in vivo de souris avec les moules BCAM et d’analyse des données avec l’outil SaaS automatisé. Des instructions étape par étape sur la préparation de la souris, l’acquisition d’images et le traitement des données sont fournies. Ce flux de travail d’automatisation a également produit des données cohérentes avec l’analyse manuelle. Quelques considérations techniques clés sont mises en évidence ci-dessous.
Bien qu’une tumeur ne soit pas l’un des organes définis par l’OPM, une étape critique de ce protocole est l’implantation correcte des tumeurs sous-cutanées pour assurer un alignement optimal de tous les organes de la souris dans la cavité corporelle et le BCAM. L’OPM ne peut produire des données précises que lorsque la colonne vertébrale d’une souris est relativement droite et que les organes internes sont positionnés de manière neutre. Des tumeurs excessivement grandes ou mal placées pourraient avoir un impact sur la posture de la souris et s’enfoncer dans sa cavité corporelle, déplaçant ainsi les organes internes. Ce changement, à son tour, faussera l’analyse quantitative résultante de l’algorithme OPM. D’autres ont rapporté l’impact d’une colonne vertébrale non droite sur l’alignement des organes internes à l’aide de diverses modalités d’imagerie et algorithmes de segmentation13,14. Par conséquent, il est crucial d’utiliser le modèle pour guider l’implantation de la tumeur et de surveiller de près la croissance tumorale pour s’assurer que les tumeurs sont à la fois correctement positionnées et dans la plage de taille idéale.
Un autre domaine d’écart possible est le choix d’un BCAM de taille appropriée. Les BCAM sont créés en intégrales de 2 g, avec une gamme de 18 à 26 g. Cependant, étant donné que les souris ayant des compositions corporelles différentes (par exemple, plus de muscle ou plus de graisse) peuvent avoir le même poids corporel mais des tailles physiques différentes, il est important de choisir le BCAM le plus adapté tout en utilisant leur poids corporel comme référence générale. Montez ou diminuez le niveau par essais et erreurs, et gardez à l’esprit qu’un bon alignement est essentiel. Le choix d’un BCAM trop grand fera « couler » les organes internes de la souris plus près du fond du lit, ce qui aura un impact particulier sur la précision de l’analyse des organes dorsaux tels que les reins et la colonne vertébrale. En revanche, placer une souris trop petite dans une MECB pourrait appuyer sur leurs cavités corporelles, fausser le positionnement des organes et potentiellement causer des difficultés respiratoires. L’utilisation de ruban adhésif pour s’assurer que les membres sont fixés sur les plates-formes des pattes aidera à la configuration et au positionnement.
Bien que ce flux de travail permette une analyse standardisée et automatisée des images TEP, il convient de souligner que l’OPM actuel est construit sur la base de la souche de souris immunocompétente C57BL/6 et de souris saines. D’autres souches et problèmes de santé chez les souris peuvent présenter des caractéristiques anatomiques différentes qui nécessitent un ajustement, une optimisation et une validation supplémentaires de l’algorithme. Par exemple, les souches immunodéficientes telles que NSG ou NCG ont des rates plus petites. De même, les souris portant des implants de tumeurs orthotopiques peuvent avoir des tailles, des formes et des emplacements différents des organes internes en fonction de leur état pathologique. Une autre limitation de ce flux de travail est le débit global pendant la phase d’acquisition d’une expérience. Cela est principalement dû au temps supplémentaire nécessaire pour configurer correctement une souris dans le BCAM. La formation et la pratique pourraient augmenter l’efficacité de l’opérateur dans le placement approprié. L’ajout d’une deuxième station d’accueil peut également augmenter le débit global, où une station d’accueil peut servir à la configuration BCAM et l’autre peut servir à déplacer une souris vers une cage de récupération. Néanmoins, même avec le temps supplémentaire nécessaire à la configuration du BCAM avant la numérisation, l’investissement en temps est rentable en permettant de gagner du temps sur l’analyse des données. Par exemple, dans la présente étude, il a fallu moins de 10 minutes à l’OPM pour analyser dix images (avec 4 ROI), alors qu’il a fallu 3 à 4 heures à un analyste très expérimenté pour segmenter et analyser manuellement le même ensemble d’images et de ROI. Un analyste inexpérimenté aurait besoin d’encore plus de temps pour l’analyse manuelle. La plate-forme SaaS permet l’analyse de scanners TEP en grands lots, où une analyse complète de la biodistribution in vivo peut être effectuée en quelques minutes après le téléchargement des données. Il s’agit d’une fonctionnalité extrêmement utile lorsque vous gérez de grandes quantités de données provenant de plusieurs groupes et/ou à plusieurs points temporels, comme indiqué ci-dessous.
La segmentation manuelle d’organes pour un seul sujet peut prendre beaucoup de temps et nécessite généralement une formation préalable importante de l’opérateur. Même avec une formation adéquate, les analyses manuelles sont inévitablement confrontées à des variabilités inter-opérateurs, ce qui peut fausser les résultats quantitatifs15,16. En revanche, la segmentation et l’analyse automatisées des données peuvent déterminer avec précision et efficacité la biodistribution globale d’un radiotraceur et éliminer les variabilités inhérentes aux opérations humaines. De tels avantages de l’automatisation ont été observés à la fois dans l’analyse d’images cliniques et dans l’espace préclinique. Par exemple, Sluis et al. ont démontré qu’un seul scan nécessitait 4 h pour segmenter les organes d’intérêt contre 30 min pour les méthodes basées sur l’IA dans le cloud17. Une autre étude de Nazari et al. a également rapporté que l’analyse algorithmique du foie et des reins a démontré des résultats précis à 7,0 % près par rapport à deux physiciens médicaux humains18. Les données de la figure 4 ont également clairement démontré la fiabilité du flux de travail d’analyse d’imagerie PET basé sur SaaS, et que l’analyse automatisée a donné des résultats cohérents par rapport à l’analyse manuelle.
En résumé, cet article illustre le flux de travail de l’utilisation des moules BCAM pour faciliter l’acquisition d’images TEP/TDM précliniques standardisées ainsi que l’analyse automatisée des données TEP en mode SaaS. Il est démontré que cette technologie de plate-forme est relativement simple à utiliser, et que la qualité des données générées par l’automatisation est cohérente avec l’analyse manuelle, mais présente des avantages significatifs en termes de gain de temps. Par conséquent, ce flux de travail peut faire économiser aux chercheurs des centaines d’heures en temps d’analyse des données et aider à normaliser et à réduire la variabilité entre les opérateurs. Cette procédure peut aider au développement d’une multitude de composés médicamenteux à travers les modalités et les indications. En particulier, les grandes molécules telles que les anticorps thérapeutiques, les anticorps bispécifiques engageant les cellules immunitaires, les conjugués anticorps-médicament et même les nanoparticules peuvent être facilement marquées avec des radiométaux (par exemple, Zr-89, Cu-64) pour permettre l’évaluation de la biodistribution médiée par l’imagerie TEP19,20. De même, cette technologie de plateforme peut aider à déterminer la dosimétrie de nouvelles radiothérapies chez la souris21. L’application de cette procédure sera une grande valeur ajoutée pour le développement de médicaments.
Déclarations de divulgation
Tous les auteurs sont des employés actuels ou anciens de Pfizer, Inc.
Remerciements
Un merci spécial au personnel de recherche et technique en médecine comparative de Pfizer La Jolla.
matériels
| Name | Company | Catalog Number | Comments |
| [18F]FDG | PETNet Solutions, Culver City, CA | NA | Radiotracer used for PET imaging |
| 27 G needle | Becton, Dickinson and Company, San Diego, CA | 305136 | Used for cell injection |
| app.invivo.ax/login | Invivo Analytics, Seattle, WA | NA | Software as a Service webpage |
| Body Conforming Animal Molds | Invivo Analytics, Seattle, WA | NA | BCAMs with weight range of 18 - 26 g |
| Dose Calibrator; CRC-55tw | Capintec, Florham Park, NJ | CRC-55tw | Measurement of radioactive doses |
| G8 PET/CT scanner | Sofie Biosciences/Xodus Imaging, Torrence, CA | NA | Benchtop scanner with loading dock |
| G8-Docking station | Sofie Biosciences/Xodus Imaging, Torrence, CA | NA | Docking station for staging |
| Implantation Mold Template | Invivo Analytics, Seattle, WA | NA | Template for optimal tumor implantation |
| Lubricant eye ointment | BAUSCH & LOMB, Ontario, Canada | Soothe Nighttime | Eye lube for mice |
| Modified G8 shuttle | Invivo Analytics, Seattle, WA | NA | Shuttle for BCAM accommodation |
| Mouse anesthesia Induction box | Patterson Scientific, Waukesha, WI | 78933388 | Used for anesthetizing a mouse |
| PRE-Clip | Invivo Analytics, Seattle, WA | NA | BCAM adapter for anesthesia connection |
| Premiere Slide warmer | LabScientific, Danvers, MA | XH-2001 | Adjustable temp warmer used for tail vein dilation and anesthesia induction |
| Syringe (1 mL) | Becton, Dickinson and Company, San Diego, CA | 309659 | Used for cell injection |
| Tail Vein injection platform | Braintree Scientific, Pembroke, MA | IL-300 | Restrainer used for administering intravenous injections. |
| Vivoqaunt Software | Invicro, Needham, MA | NA | Software used for manual segmentation |
Références
- Huang, R., Wang, M., Zhu, Y., S Conti, P., Chen, K. Development of pet probes for cancer imaging. Curr Top Med Chem. 15 (8), 795-819 (2015).
- Schwenck, J., et al. Advances in pet imaging of cancer. Nat Rev Cancer. 23 (7), 474-490 (2023).
- Matthews, P. M., Rabiner, E. A., Passchier, J., Gunn, R. N. Positron emission tomography molecular imaging for drug development. Br J Clin Pharmacol. 73 (2), 175-186 (2012).
- Tavaré, R., et al. An effective immuno-pet imaging method to monitor CD8-dependent responses to immunotherapy. Cancer Res. 76 (1), 73-82 (2016).
- Maresca, K. P., et al. Preclinical evaluation of 89ZR-DF-IAB22M2C PET as an imaging biomarker for the development of the gucy2c-cd3 bispecific pf-07062119 as a t-cell engaging therapy. Mol Imaging Biol. 23 (6), 941-951 (2021).
- Nisnboym, M., et al. Immuno-pet imaging of cd69 visualizes t-cell activation and predicts survival following immunotherapy in murine glioblastoma. Cancer Res Commun. 3 (7), 1173-1188 (2023).
- Lee, C., et al. Efficacy and imaging-enabled pharmacodynamic profiling of Kras g12c inhibitors in xenograft and genetically engineered mouse models of cancer. Mol Cancer Ther. 22 (7), 891-900 (2023).
- Bollineni, V., Kramer, G., Jansma, E. P., Liu, Y., Oyen, W. J. A systematic review on [18f] flt-pet uptake as a measure of treatment response in cancer patients. Eur J Cancer. 55, 81-97 (2016).
- Everitt, S., et al. Imaging cellular proliferation during chemo-radiotherapy: A pilot study of serial 18f-flt positron emission tomography/computed tomography imaging for non-non-small-cell lung cancer. Int J Radiat Oncol Biol Phys. 75 (4), 1098-1104 (2009).
- Rashidian, M., et al. Predicting the response to CTLA-4 blockade by longitudinal non-invasive monitoring of cd8 t cells. J Exp Med. 214 (8), 2243-2255 (2017).
- Klose, A. D., Paragas, N. Automated quantification of bioluminescence images. Nat Commun. 9 (1), 4262 (2018).
- Gu, Z., et al. Performance Evaluation of G8, a high-sensitivity benchtop preclinical PET/CT Tomograph. J Nucl Med. 60 (1), 142-149 (2019).
- Bongratz, F., Rickmann, A. -. M., Wachinger, C. Abdominal organ segmentation via deep diffeomorphic mesh deformations. Sci Rep. 13 (1), 18270 (2023).
- Wang, H., Stout, D. B., Chatziioannou, A. F. Mouse atlas registration with non-tomographic imaging modalities-a pilot study based on simulation. Mol Imaging Biol. 14, 408-419 (2012).
- Montgomery, M. K., et al. Mouse lung automated segmentation tool for quantifying lung tumors after micro-computed tomography. PLoS One. 16 (6), e0252950 (2021).
- Montgomery, M. K., et al. Applying deep learning to segmentation of murine lung tumors in preclinical micro-computed tomography. Transl. Oncol. 40, 101833 (2024).
- Van Sluis, J., et al. Manual versus artificial intelligence-based segmentation as a pre-processing step in whole-body pet dosimetry calculations. Mol Imaging Biol. 25 (2), 435-441 (2023).
- Nazari, M., et al. Automated and robust organ segmentation for 3D-based internal dose calculation. EJNMMI Res. 11, 1-13 (2021).
- Goel, S., England, C. G., Chen, F., Cai, W. Positron emission tomography and nanotechnology: A dynamic duo for cancer theranostics. Adv Drug Deliv Rev. 113, 157-176 (2017).
- Campbell, D. O., et al. Preclinical evaluation of an anti-nectin-4 immunopet reagent in tumor-bearing mice and biodistribution studies in cynomolgus monkeys. Mol Imaging Biol. 18, 768-775 (2016).
- Bednarz, B., et al. Murine-specific internal dosimetry for preclinical investigations of imaging and therapeutic agents. Health Phys. 114 (4), 450-459 (2018).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon