Method Article
Доклиническая позитронно-эмиссионная томография с соответствующими телу формами животных для облачного автоматизированного анализа изображений у мышей
В этой статье
Резюме
Этот протокол описывает процедуру выполнения визуализации ПЭТ in vivo на мышах с использованием форм, соответствующих телу животных (BCAMs) в сканере G8 для ПЭТ/КТ. Предоставляются технические подробности о подготовке мыши, включая правильную имплантацию опухоли, оптимальное позиционирование, получение изображений ПЭТ/КТ с помощью BCAM и анализ данных.
Аннотация
Позитронно-эмиссионная томография (ПЭТ) — это метод молекулярной визуализации, который может быть использован для исследования множества фармакологических вопросов, таких как модуляция биомаркеров, занятость рецепторов и биораспределение интересующих соединений. В исследованиях биораспределения экспериментальные объекты часто получают продольную визуализацию после получения испытуемого изделия. Затем изображения анализируются для получения профиля распределения соединения в различных органах в разные моменты времени. Это представляет собой важнейший шаг в разработке лекарственного препарата, позволяющий понять распределение и потенциально связывающий профиль исследуемого соединения. Стандартные/ручные методы анализа биораспределения на основе ПЭТ-визуализации, однако, являются трудоемкими и длительными и часто связаны с высокой межоператорской вариабельностью. Кроме того, сложно поддерживать одинаковое положение животных в разные моменты времени. Для устранения этих недостатков была использована серия мышиных форм, соответствующих телу животных (BCAM), которые обеспечивают жесткое и последовательное позиционирование животных во время получения изображений с помощью ПЭТ/КТ. Кроме того, платформа Software-as-a-Service (SaaS), состоящая из облачной карты вероятности органов (OPM) и инструмента сегментации на основе искусственного интеллекта, была использована для обеспечения надежной и автоматизированной количественной оценки данных визуализации ПЭТ in vivo. Представленный здесь рабочий процесс включает в себя (1) подготовку мышей к визуализации с помощью BCAM, включая надлежащую имплантацию подкожных опухолей, совместимых с формами, (2) получение изображений ПЭТ/КТ с помощью BCAM с помощью сканера G8 и 3) выполнение автоматизированной сегментации органов и анализа биораспределения с использованием облачного SaaS. [18Ф]В качестве примера индикатора здесь использовался ФДГ, но другие биомаркеры и/или радиоактивно меченые соединения могут быть легко адаптированы к рабочему процессу. Эта процедура может быть выполнена точно и эффективно при минимальном обучении, а автоматизированный анализ данных ПЭТ дал удовлетворительные результаты, соответствующие ручному методу.
Введение
Технологии молекулярной визуализации in vivo являются важными инструментами в разработке лекарств, облегчающими оценку всех трех столпов фармакологии - биораспределения, вовлечения мишени и модуляции фармакодинамики 1,2,3. Позитронно-эмиссионная томография (ПЭТ), благодаря своей клинической переводимости и высокой чувствительности, является одним из наиболее часто используемых методов молекулярной визуализации как в клинике, так и в области доклинических исследований и разработок. Развивающаяся область доклинической ПЭТ-визуализации и радиотеранистики имеет важное значение для разработки как терапии, присущей опухоли, так и таргетной терапии, а также новых методов иммуноонкологической терапии (ИО). Постоянное появление и разработка новых иммуно-ПЭТ радиоиндикаторов могут влиять на конкретные индивидуальные схемы лечения ИО и выявлять ответивших по сравнению с неответившими 4,5,6. Между тем, метаболически специфичные радиоактивные индикаторы, такие как [18F]FDG и [18F]FLT, могут контролировать реакцию опухоли на терапию и, соответственно, могут пролить свет на то, активно ли опухоль пролиферирует или потребляет глюкозу7, или же опухолевые клетки подвергаются остановке клеточного цикла путем ингибирования 8,9.
Неинвазивная визуализация in vivo имеет множество преимуществ по сравнению с традиционными фармакологическими экспериментами без визуализации. Например, визуализация позволяет проводить системную, целостную оценку распределения лекарственного препарата и/или фармакологического эффекта у всего субъекта, что позволяет не только контролировать эффективность в целевом центре, но и обнаруживать неожиданные внешние активности. Благодаря своей неинвазивной природе, один и тот же набор животных может быть оценен в продольном отношении в разные моменты времени и/или с разными биомаркерами для решения различныхбиологических вопросов. Это не только значительно сокращает количество животных, необходимых для исследования, но и обеспечивает ортогональный контроль между временными точками и, следовательно, помогает улучшить корреляцию и уменьшить индивидуальную изменчивость. Несмотря на такое многообещающее развитие биомаркеров визуализации, потребность в оценке исследуемых соединений in vivo с помощью исследований биораспределения, основанных на ПЭТ-визуализации, тем не менее, сталкивается с отсутствием эффективных автоматизированных процессов анализа. Исследования биораспределения ПЭТ позволяют получить ценную информацию о кинетике соединения, накоплении в тканях, связывании и метаболизме. Получение высоковоспроизводимых количественных данных имеет решающее значение для разработки фармацевтической терапии.
Чтобы удовлетворить эти неудовлетворенные потребности в автоматизированном анализе изображений ПЭТ, компания InVivo Analytics разработала набор пресс-форм для животных (BCAM), соответствующих телу мыши11. Это напечатанные на 3D-принтере пластиковые формы, которые удерживают голову, туловище (и внутренние органы), хвост и конечности мыши в жестких, заранее определенных положениях. Формы разного размера могут быть выбраны в зависимости от массы тела животного, а вырезы могут быть созданы в определенных областях, таких как плечо или нижняя часть бока, чтобы подкожные опухоли могли выступать. Изображения ПЭТ/КТ, полученные с помощью этих BCAM, отличаются высокой однородностью и могут быть проанализированы в пакетах с помощью облачной автоматизированной платформы сегментации компании11. В этой статье представлен автоматизированный рабочий процесс анализа биораспределения in vivo , основанный на физическом получении изображений с помощью BCAM и выполнении сегментации и анализа изображений с помощью SaaS.
протокол
Все процедуры, выполняемые на животных, соответствовали правилам и установленным руководящим принципам, а также были рассмотрены и одобрены Комитетом по уходу за животными и их использованию в учреждениях компании Pfizer или в рамках процесса этической экспертизы. Исследование с помощью ПЭТ-визуализации проводилось в соответствии со всеми протоколами радиационной безопасности учреждения. В этом исследовании использовались самки мышей C57BL/6 в возрасте 10-12 недель с массой тела от 18 до 26 г. Подробная информация об используемых реагентах и оборудовании приведена в Таблице материалов.
1. Подготовка и постановка животных
ПРИМЕЧАНИЕ: Этот этап включает в себя подготовку животных к ПЭТ-визуализации с имплантацией опухоли под контролем шаблона BCAM.
- Перед имплантацией клеток сбрейте шерсть мышей в нужной области роста опухоли.
- Установите станцию анестезии и прикрепите форму BCAM соответствующего размера к предварительному зажиму с верхней частью, отвернутой вверх на 90 градусов. Это будет служить базой для имплантации опухоли (рисунок 1А).
- Обезболивайте животных в подходящем индукционном боксе с 2,0% изофлураном и 98% кислорода со скоростью потока 0,5-1,5 л/мин.
ПРИМЕЧАНИЕ: Все системы анестезии являются вариабельными.- Используйте откалиброванную систему и проверьте ее перед использованием. Поместите мышь под наркозом на основание и вытяните ее конечности (рисунок 1B).
- Аккуратно поместите шаблон для инъекции опухоли BCAM (рисунок 1C) на тыльную сторону мыши (рисунок 1D).
- Аккуратно создайте временную круглую метку привязки в нужном месте выреза (например, на плече или боку, слева или справа) с помощью маркера (рисунок 1D). Снимите шаблонную форму.
- Подготовьте клетки к инъекции, набрав нужный объем в шприц. Прикрепите к шприцу иглу 27 G и заполните мертвое пространство. Рекомендуется объем 0,1-0,2 мл на одну прививку.
- Подтяните кожу пальцами или щипцами, используя временные метки из шага 1.5 в качестве ориентира для создания палатки, медленно введите иглу и введите клетки подкожно в нужное место. Выбросьте иглу в контейнер для биологически опасных острых предметов.
- Следите за ростом опухоли. Средний объем опухоли при включении в этот пример составил 200-300мм3.
ПРИМЕЧАНИЕ: Избегайте использования металлических компонентов, таких как ушные бирки или микрочипы, чтобы предотвратить артефакты компьютерной томографии.
2. Нанесение радиоактивных доз
- Следуя всем институциональным протоколам радиационной безопасности, тщательно наберите целевую дозу [18F]FDG в диапазоне примерно 70-80 μКи в стерильный шприц, пригодный для внутривенного введения.
ПРИМЕЧАНИЕ: Диапазон 70-80 μCi является оптимальным для соответствия динамическому диапазону сканера Sofie G8 PET. Другие тепловизоры могут иметь другие динамические диапазоны, которые требуют другой целевой дозы. - Тщательно отмерьте радиоактивную дозу в калибраторе дозы, поместив шприц в камеру скважины и опустив ковш. Обратите внимание на выбор подходящего изотопа или калибровочного номера перед измерением.
- Снимайте стабильные показания. Запишите дату и время. При необходимости скорректируйте дозу.
- (Дополнительный) С помощью стерильного физиологического раствора довести объем конечной дозы до 0,1-0,2 мл.
ПРИМЕЧАНИЕ: Желаемый объем инъекции может варьироваться. - Доза готова к введению.
3. Внутривенное введение дозы
- В соответствии с институциональными протоколами IACUC и радиационной безопасности подготовьте хвост мыши к внутривенному введению путем расширения хвостовой вены. В этом исследовании хвостовую вену расширяли путем помещения клетки животного или индукционной камеры в нагреватель стекол, установленный при температуре 42 °C.
ПРИМЕЧАНИЕ: Для полного расширения хвостовой вены может потребоваться до 10 минут прогревания. - Перед инъекцией запишите вес мыши. Это определит, какой BCAM для конкретного веса использовать для визуализации ПЭТ/КТ.
- Когда все будет готово, переложите мышь в подходящее удерживающее устройство (например, в настоящем исследовании использовалась платформа для инъекции хвостовой вены) и найдите хвостовую вену.
- Осторожно обращайтесь с радиоактивным шприцем и внутривенно вводите дозу в находящуюся в сознании мышь. Запишите время инъекции.
- Аккуратно отложите шприц в сторону и смойте марлей лишние капли крови с хвоста. Извлеките мышь из ограничителя и поместите ее обратно в соответствующий корпус.
- Осторожно поместите шприц обратно в камеру калибратора дозы и запишите все остаточные показания для правильного расчета дозы. Запишите дату и время считывания остаточной активности.
- После завершения инъекций проявите осторожность и поместите когорты мышей за свинцовые корпуса и/или подальше от персонала, следуя безопасным для учреждения методам облучения. Обратите внимание, что все используемые материалы подвержены незначительному радиоактивному загрязнению. Контролируйте все зоны с помощью откалиброванного счетчика Гейгера и очищайте в соответствии с рекомендациями по радиационной безопасности.
4. Обезболивание и позиционирование животных для ПЭТ-визуализации
- В подходящее время (например, за 10-15 минут до окончания периода захвата индикатора) включите все оборудование для анестезии и согревание животных, необходимые как для индукции анестезии, так и для ПЭТ-визуализации. Анестезия может быть установлена на уровне 2,0%-2,5% изофлурана при 98% кислороде (настройки могут варьироваться в зависимости от штамма мыши и модели заболевания).
- Убедитесь, что все адаптеры и клапаны включены, а расход газа составляет 0,5-1,0 л/мин. Конкретная скорость потока может варьироваться в зависимости от системы анестезии и системы визуализации.
- Поместите подходящее животное (животных) в индукционную коробку и подождите, пока субъект не достигнет нужной глубины анестезии.
- Нанесите мазь-смазку для глаз на каждый глаз.
- Перенесите мышь в BCAM подходящего размера в зависимости от массы тела.
- Аккуратно возьмите мышь за затылок, вставьте хвост в прорезь хвоста и оберните его под BCAM. Поместите хвост на хвостовую платформу и заклейте лентой для фиксации положения. Убедитесь, что позвоночник прямой. Аккуратно закройте BCAM (рис. 2A, B).
- Осторожно расположите все четыре конечности так, чтобы они опирались на каждую из платформ для лап BCAM. Используйте ленту по мере необходимости, чтобы закрепить лапы на каждой платформе (рис. 2B).
- Аккуратно защелкните BCAM в челноке станины для визуализации, вставив сначала передний конец (рис. 2C). Шаттл уже должен быть подключен к погрузочной площадке G8 с потоком анестезии (Рисунок 2D). Нажмите на заднюю часть BCAM, и щелчок укажет, что он закреплен на шаттле G8.
ПРИМЕЧАНИЕ: Поддерживайте запас анестетика таким образом, чтобы животное оставалось в нужной анестезиологической плоскости во время визуализации.
5. Получение изображения
- Откройте программное обеспечение для сбора данных G8 PET. Папки для исследований, параметры сканирования и идентификаторы субъектов могут быть созданы заранее.
- Введите в программное обеспечение данные исследования: вес мыши, дату/время и количество начальной дозы, дату/время инъекции, а также дату/время и количество показаний остаточной активности.
- Вставьте челнок с мышкой в отверстие сканера. Синий световой индикатор укажет на правильную стыковку с системой.
- Выберите подходящие параметры ПЭТ/КТ. Получение данных визуализации.
ПРИМЕЧАНИЕ: В этом исследовании было выполнено 7-минутное статическое сканирование ПЭТ с температурой 18F, за которым последовало стандартное компьютерное сканирование за 70 секунд, и дляреконструкции данных был применен алгоритм 3D-реконструкции с максимальным ожиданием-максимизацией (стандартная и единственная опция в сканере G8). - После завершения захвата шаттл вернется в исходное исходное положение. Снимите челнок с мышкой и вставьте его в док-станцию. Нажмите на заднюю часть вертикального язычка BCAM, чтобы снять его с челнока G8, и аккуратно потяните вверх и снимите BCAM с помощью мыши.
- Нажмите на два фиксирующих язычка, чтобы откинуть вверх и открыть верхнюю часть BCAM.
- Аккуратно снимите мышку. Перед возвращением в домашнюю клетку убедитесь, что мышь полностью оправилась от анестезии и стала яркой, внимательной и отзывчивой (BAR).
- Продолжайте процедуру через заданные промежутки времени, чтобы просканировать всю когорту/группу мышей.
6. Загрузка изображений в SaaS
- Войдите в app.invivo.ax и создайте проект.
- Нажмите на красную вкладку загрузки в правом верхнем углу окна. Выберите систему визуализации и репортер, используемые в исследовании визуализации (т.е. [18F]FDG). Выберите папку с данными изображения.
- Перейдите на вкладку аннотаций в папке проекта. Нажмите « Аннотация», чтобы добавить соответствующую информацию о сканировании (имя субъекта, пол, размер BCAM, вес субъекта, название когорты, временную точку и значение введенной дозы). Большая часть метаданных будет заполнена автоматически.
7. Автоматизированный анализ данных
- В папке проекта должны быть заполнены все сканы. Нажимайте на сканы для навигации по проектному, групповому и индивидуальному уровням тем. Выберите «Анализ» в правом верхнем углу.
- В правом верхнем углу окна ленты анализа в разделе «Проект» выберите символ плюса и выберите «ROI карты вероятности органов». Карта вероятности органов (OPM) — это статистический атлас органов мыши, охватывающий множество заранее определенных органов и тканей. Выберите отдельные органы, представляющие интерес, исходя из потребностей исследования.
ПРИМЕЧАНИЕ: В этом примере ручная сегментация и анализ были выполнены с помощью VivoQuant с использованием инструмента сплайн с последующей интерполяцией в операторе 3D ROI. Результаты автоматизированного анализа сравнивались с результатами ручной сегментации в качестве бенчмарка.
Результаты
После загрузки данные ПЭТ можно просмотреть на веб-сайте SaaS в виде панели корональных, сагиттальных и поперечных изображений, наложенных на выбранные ROI органов, которые продиктованы OPM (рис. 3A). Программное обеспечение может не только загружать отдельные изображения, но и несколько мышей из группы или целого исследования могут быть просмотрены одновременно как единое свернутое изображение. В этом окне анализа есть опции для настройки цветов ROI, интенсивности масштабной линейки и других распространенных параметров. После того, как идеальные аналитические метрики выбраны, SaaS генерирует загружаемую гистограмму биораспределения выбранных органов (рис. 3B).
Чтобы оценить производительность SaaS-платформы на основе OPM, результаты автоматизированного анализа сравнивались с результатами, полученными опытным аналитиком изображений в качестве золотого стандарта. Линейная регрессия соответствия была проведена на основе значений поглощения [18F]ФДГ мозгом, сердцем, почками (справа) и селезенкой. Следует отметить, что платформа предлагает пользователям полный список органов на выбор, включая скелет, мозг, мочевой пузырь, сердце, почки (правые и левые), печень, селезенку, легкие и четырехглавые мышцы (правые и левые). Четыре вышеупомянутых органа были выбраны в этом исследовании только в иллюстративных целях. Кроме того, из-за изменчивого размера, формы и глубины/расположения имплантированных опухолей, опухоль не включается в качестве органа в OPM и, следовательно, исключается из данного сравнительного анализа. Как показано на рисунке 4, автоматический и ручной анализ дали в целом согласованные результаты, при этом мозг показал наибольшую корреляцию (r2 = 0,8466). Это ожидаемо из-за большого размера органа и очень постоянного положения мозга внутри черепа. Правая почка и сердце также показали разумные значенияr2 0,6874 и 0,4849 соответственно. Напротив, корреляционный анализ для селезенки показал значение r2 0,3922, что является самым низким показателем среди протестированных органов. Это неудивительно, поскольку селезенка расположена в поджелудочной железе и жировых тканях, которые не имеют определенной морфологии и предполагают такую же плотность мягких тканей на КТ. Таким образом, селезенку трудно сегментировать вручную, и OPM может предоставить более точный способ разграничения этого органа (т.е. превзойти золотой стандарт). Наклон и Y-точка пересечения этих корреляционных анализов также показаны на рисунке 4. В соответствии со значениями r2 , мозг имел наклон, близкий к 1 (т.е. идеальная корреляция между OPM и ручными результатами) и наименьший Y-пересечение (т.е. минимальное системное смещение), в то время как другие органы показали большее и вариабельное отклонение от идеальной корреляции.

Рисунок 1: BCAM и имплантация опухоли под контролем шаблона. (A) Предварительный зажим (1) прикреплен к нижней части формы BCAM (2) с помощью подключенной анестезиологической линии (3). Это служит базой для имплантации опухоли. (B) Мышь с выбритым участком имплантата-мишени (в данном случае с правым плечом) помещается на основание под анестезией перед инъекцией клеток. (C) Шаблон для имплантации опухоли (4) с заранее определенными вырезами для управления размещением инокуляции опухолевых клеток. (D) Создание временной контрольной метки перед инъекцией клеток с помощью шаблонной формы, размещенной на тыльной стороне мыши. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
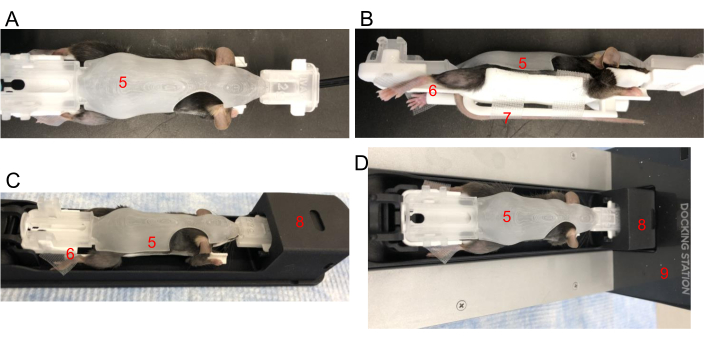
Рисунок 2: Позиционирование мыши в BCAM. (A) Вид сверху - Поместите мышь плотно в BCAM подходящего размера (5). (B) Вид сбоку - Лента используется для крепления задних лап к платформам (6). Хвост закреплен лентой на хвостовой платформе (7) непосредственно под мышью. (C) Мышь в BCAM вставляется в визуализирующий челнок (8). (D) Мышь, BCAM и шаттл подключены к док-станции для работы под анестезией (9). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
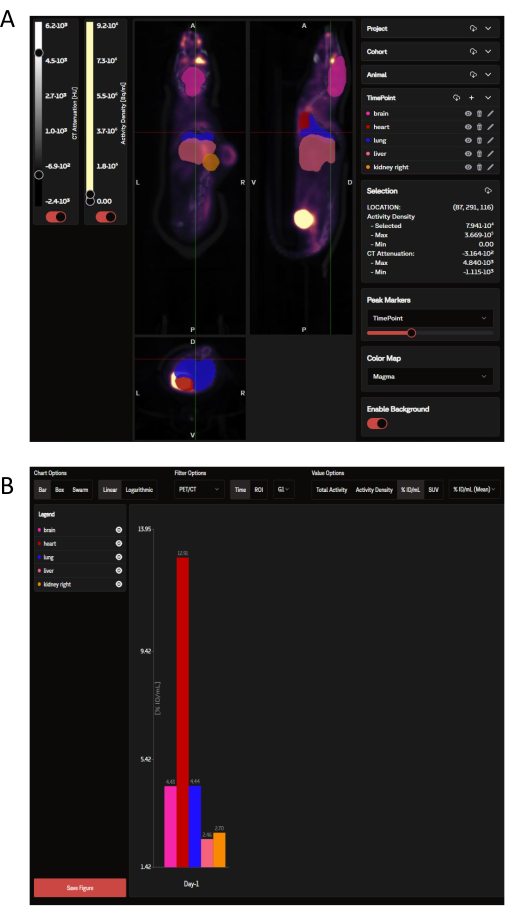
Рисунок 3: Репрезентативные изображения и выходные данные, просматриваемые и анализируемые инструментом SaaS соответственно. (A) Репрезентативные изображения в том виде, в каком они представлены на веб-сайте SaaS. Корональный, сагиттальный и поперечный виды изображения ПЭТ/КТ с наложением ROI органов, выбранных из карты вероятности органов (OPM). Розовый: мозг; красный: сердце; темно-синий: легкие; лосось: печень; Оранжевый: почка (справа). Опухоль не определяется OPM. (B) Репрезентативный загружаемый график, сгенерированный в результате автоматического анализа. Список выбранных органов можно увидеть в верхней левой панели. Данные здесь представлены в %ID/мл. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
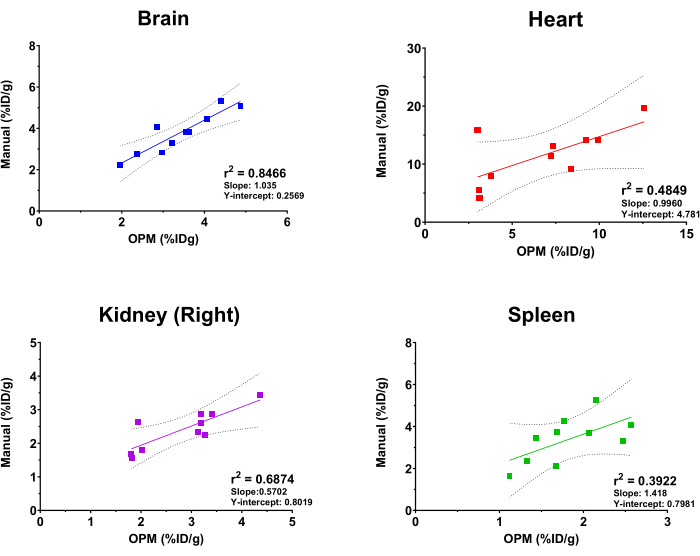
Рисунок 4: Линейный регрессионный анализ, сравнивающий значения поглощения органов [18F]FDG, полученные с помощью ручного анализа и автоматизированного рабочего процесса на основе OPM. Было использовано десять ПЭТ/КТ-сканирований самок мышей C57BL/6. Значения r2 , 95% доверительные линии, наклон и Y-пересечения отображаются на графике для каждого указанного органа. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Обсуждение
В настоящем отчете описана процедура проведения ПЭТ-визуализации на мышах in vivo с помощью пресс-форм BCAM и анализа данных с помощью автоматизированного инструмента SaaS. Предоставляются пошаговые инструкции по подготовке мыши, получению изображений и обработке данных. Этот автоматизированный рабочий процесс также выдавал данные, которые соответствовали ручному анализу. Ниже приведены некоторые ключевые технические соображения.
Несмотря на то, что опухоль не входит в число органов, определенных OPM, критическим шагом в этом протоколе является правильная имплантация подкожных опухолей, чтобы в конечном итоге обеспечить оптимальное выравнивание всех органов мыши в полости тела и BCAM. OPM может выдавать точные данные только тогда, когда позвоночник мыши относительно прямой, а внутренние органы расположены нейтрально. Чрезмерно большие или неправильно расположенные опухоли могут повлиять на осанку мыши и проникнуть в ее полость, тем самым смещая внутренние органы. Этот сдвиг, в свою очередь, исказит полученный количественный анализ от алгоритма OPM. Другие сообщали о влиянии непрямого позвоночника на выравнивание внутренних органов с использованием различных методов визуализации и алгоритмов сегментации13,14. Поэтому крайне важно использовать шаблон для управления имплантацией опухоли и тщательного мониторинга роста опухоли, чтобы убедиться, что опухоли расположены правильно и находятся в идеальном диапазоне размеров.
Еще одной областью возможного отклонения является выбор подходящего по размеру BCAM. BCAM создаются в интегралах по 2 g с диапазоном 18-26 g. Однако, поскольку мыши с разным составом тела (например, больше мышц по сравнению с большим количеством жира) могут иметь одинаковую массу тела, но разные физические размеры, важно выбрать наиболее подходящий BCAM, используя их массу тела в качестве общего ориентира. Повышайте или понижайте уровень методом проб и ошибок и помните, что правильное выравнивание имеет решающее значение. Выбор слишком большого BCAM приведет к тому, что внутренние органы мыши «опустятся» ближе к дну кровати, что особенно повлияет на точность анализа на спинные органы, такие как почки и позвоночник. Напротив, помещение слишком маленькой мыши в BCAM может давить на полости тела, искажать положение органов и потенциально вызывать трудности в дыхании. Использование ленты для фиксации конечностей на платформах для лап поможет с настройкой и позиционированием.
Несмотря на то, что этот рабочий процесс позволяет стандартизированный и автоматизированный анализ изображений ПЭТ, стоит отметить, что текущий OPM построен на основе иммунокомпетентной линии мышей C57BL/6 и здоровых мышей. Другие штаммы и состояния здоровья мышей могут иметь другие анатомические особенности, которые требуют дополнительной корректировки, оптимизации и валидации алгоритма. Например, иммунодефицитные штаммы, такие как NSG или NCG, имеют меньшую селезенку. Точно так же мыши с имплантатами ортотопических опухолей могут иметь разные размеры, формы и расположение внутренних органов в зависимости от их статуса заболевания. Еще одним ограничением этого рабочего процесса является общая пропускная способность на этапе сбора данных эксперимента. В основном это связано с дополнительным временем, необходимым для правильной настройки мыши в BCAM. Обучение и практика могут повысить эффективность работы оператора при правильном размещении. Добавление второй док-станции также может увеличить общую пропускную способность, где одна док-станция может служить для установки BCAM, а другая — для извлечения мыши в клетку для восстановления. Тем не менее, даже с учетом увеличения времени, необходимого для настройки BCAM перед сканированием, вложение времени окупается за счет экономии времени на этапе анализа данных. Например, в данном исследовании OPM понадобилось менее 10 минут, чтобы проанализировать десять изображений (с 4 ROI), в то время как высококвалифицированному аналитику потребовалось 3-4 часа, чтобы вручную сегментировать и проанализировать тот же набор изображений и ROI. Неопытному аналитику потребуется еще больше времени для ручного анализа. Платформа SaaS позволяет анализировать ПЭТ-сканирование большими партиями, при этом полный анализ биораспределения in vivo может быть завершен в течение нескольких минут после загрузки данных. Это чрезвычайно полезная функция при работе с большими объемами данных из нескольких групп и/или в нескольких временных точках, как описано ниже.
Ручная сегментация органов для одного объекта может занять много времени и обычно требует значительного предварительного обучения оператора. Даже при адекватной подготовке ручной анализ неизбежно сталкивается с межоператорскими вариациями, которые могут исказить количественные результаты15,16. В отличие от этого, автоматизированная сегментация и анализ данных могут точно и эффективно определить общее биораспределение радиоактивного индикатора и устранить изменчивость, которая коренится в действиях человека. Такие преимущества автоматизации были замечены как при анализе клинических изображений, так и в доклиническом пространстве. Например, Sluis et al. продемонстрировали, что для сегментации интересующих органов требуется 4 часа для сканирования по сравнению с 30 минутами при использованииоблачных методов искусственного интеллекта. В другом исследовании, проведенном Nazari et al., также сообщается, что основанный на алгоритмах анализ печени и почек показал точные результаты в пределах 7,0% по сравнению с двумя медицинскими физиками. Данные на рисунке 4 также наглядно продемонстрировали надежность рабочего процесса анализа ПЭТ-изображений на основе SaaS и то, что автоматизированный анализ дает стабильные результаты по сравнению с ручным анализом.
Подводя итог, можно сказать, что в этой статье показан рабочий процесс использования пресс-форм BCAM для упрощения стандартизированного доклинического получения изображений ПЭТ/КТ, а также автоматизированного анализа данных ПЭТ с поддержкой SaaS. Показано, что эта технология платформы относительно проста в использовании, а качество данных, генерируемых автоматизацией, соответствует ручному анализу, но при этом имеет значительные преимущества в экономии времени. Таким образом, такой рабочий процесс может сэкономить исследователям сотни часов на анализе данных, а также помочь стандартизировать и уменьшить межоператорскую вариативность. Эта процедура может помочь в разработке множества лекарственных соединений в разных модальностях и показаниях. В частности, модальности больших молекул, такие как терапевтические антитела, биспецифические антитела, иммуноклеточные антитела, конъюгаты антитела-лекарственные препараты и даже наночастицы, могут быть легко помечены радиометаллами (например, Zr-89, Cu-64) для обеспечения оценки биораспределения, опосредованного ПЭТ-визуализацией19,20. Аналогичным образом, эта платформенная технология может помочь определить дозиметрию новых радиотерапевтических средств у мышей21. Применение этой процедуры станет большим добавлением к разработке лекарств.
Раскрытие информации
Все авторы являются нынешними или бывшими сотрудниками компании Pfizer, Inc.
Благодарности
Особая благодарность научно-техническому персоналу отдела сравнительной медицины Pfizer La Jolla.
Материалы
| Name | Company | Catalog Number | Comments |
| [18F]FDG | PETNet Solutions, Culver City, CA | NA | Radiotracer used for PET imaging |
| 27 G needle | Becton, Dickinson and Company, San Diego, CA | 305136 | Used for cell injection |
| app.invivo.ax/login | Invivo Analytics, Seattle, WA | NA | Software as a Service webpage |
| Body Conforming Animal Molds | Invivo Analytics, Seattle, WA | NA | BCAMs with weight range of 18 - 26 g |
| Dose Calibrator; CRC-55tw | Capintec, Florham Park, NJ | CRC-55tw | Measurement of radioactive doses |
| G8 PET/CT scanner | Sofie Biosciences/Xodus Imaging, Torrence, CA | NA | Benchtop scanner with loading dock |
| G8-Docking station | Sofie Biosciences/Xodus Imaging, Torrence, CA | NA | Docking station for staging |
| Implantation Mold Template | Invivo Analytics, Seattle, WA | NA | Template for optimal tumor implantation |
| Lubricant eye ointment | BAUSCH & LOMB, Ontario, Canada | Soothe Nighttime | Eye lube for mice |
| Modified G8 shuttle | Invivo Analytics, Seattle, WA | NA | Shuttle for BCAM accommodation |
| Mouse anesthesia Induction box | Patterson Scientific, Waukesha, WI | 78933388 | Used for anesthetizing a mouse |
| PRE-Clip | Invivo Analytics, Seattle, WA | NA | BCAM adapter for anesthesia connection |
| Premiere Slide warmer | LabScientific, Danvers, MA | XH-2001 | Adjustable temp warmer used for tail vein dilation and anesthesia induction |
| Syringe (1 mL) | Becton, Dickinson and Company, San Diego, CA | 309659 | Used for cell injection |
| Tail Vein injection platform | Braintree Scientific, Pembroke, MA | IL-300 | Restrainer used for administering intravenous injections. |
| Vivoqaunt Software | Invicro, Needham, MA | NA | Software used for manual segmentation |
Ссылки
- Huang, R., Wang, M., Zhu, Y., S Conti, P., Chen, K. Development of pet probes for cancer imaging. Curr Top Med Chem. 15 (8), 795-819 (2015).
- Schwenck, J., et al. Advances in pet imaging of cancer. Nat Rev Cancer. 23 (7), 474-490 (2023).
- Matthews, P. M., Rabiner, E. A., Passchier, J., Gunn, R. N. Positron emission tomography molecular imaging for drug development. Br J Clin Pharmacol. 73 (2), 175-186 (2012).
- Tavaré, R., et al. An effective immuno-pet imaging method to monitor CD8-dependent responses to immunotherapy. Cancer Res. 76 (1), 73-82 (2016).
- Maresca, K. P., et al. Preclinical evaluation of 89ZR-DF-IAB22M2C PET as an imaging biomarker for the development of the gucy2c-cd3 bispecific pf-07062119 as a t-cell engaging therapy. Mol Imaging Biol. 23 (6), 941-951 (2021).
- Nisnboym, M., et al. Immuno-pet imaging of cd69 visualizes t-cell activation and predicts survival following immunotherapy in murine glioblastoma. Cancer Res Commun. 3 (7), 1173-1188 (2023).
- Lee, C., et al. Efficacy and imaging-enabled pharmacodynamic profiling of Kras g12c inhibitors in xenograft and genetically engineered mouse models of cancer. Mol Cancer Ther. 22 (7), 891-900 (2023).
- Bollineni, V., Kramer, G., Jansma, E. P., Liu, Y., Oyen, W. J. A systematic review on [18f] flt-pet uptake as a measure of treatment response in cancer patients. Eur J Cancer. 55, 81-97 (2016).
- Everitt, S., et al. Imaging cellular proliferation during chemo-radiotherapy: A pilot study of serial 18f-flt positron emission tomography/computed tomography imaging for non-non-small-cell lung cancer. Int J Radiat Oncol Biol Phys. 75 (4), 1098-1104 (2009).
- Rashidian, M., et al. Predicting the response to CTLA-4 blockade by longitudinal non-invasive monitoring of cd8 t cells. J Exp Med. 214 (8), 2243-2255 (2017).
- Klose, A. D., Paragas, N. Automated quantification of bioluminescence images. Nat Commun. 9 (1), 4262 (2018).
- Gu, Z., et al. Performance Evaluation of G8, a high-sensitivity benchtop preclinical PET/CT Tomograph. J Nucl Med. 60 (1), 142-149 (2019).
- Bongratz, F., Rickmann, A. -. M., Wachinger, C. Abdominal organ segmentation via deep diffeomorphic mesh deformations. Sci Rep. 13 (1), 18270 (2023).
- Wang, H., Stout, D. B., Chatziioannou, A. F. Mouse atlas registration with non-tomographic imaging modalities-a pilot study based on simulation. Mol Imaging Biol. 14, 408-419 (2012).
- Montgomery, M. K., et al. Mouse lung automated segmentation tool for quantifying lung tumors after micro-computed tomography. PLoS One. 16 (6), e0252950 (2021).
- Montgomery, M. K., et al. Applying deep learning to segmentation of murine lung tumors in preclinical micro-computed tomography. Transl. Oncol. 40, 101833 (2024).
- Van Sluis, J., et al. Manual versus artificial intelligence-based segmentation as a pre-processing step in whole-body pet dosimetry calculations. Mol Imaging Biol. 25 (2), 435-441 (2023).
- Nazari, M., et al. Automated and robust organ segmentation for 3D-based internal dose calculation. EJNMMI Res. 11, 1-13 (2021).
- Goel, S., England, C. G., Chen, F., Cai, W. Positron emission tomography and nanotechnology: A dynamic duo for cancer theranostics. Adv Drug Deliv Rev. 113, 157-176 (2017).
- Campbell, D. O., et al. Preclinical evaluation of an anti-nectin-4 immunopet reagent in tumor-bearing mice and biodistribution studies in cynomolgus monkeys. Mol Imaging Biol. 18, 768-775 (2016).
- Bednarz, B., et al. Murine-specific internal dosimetry for preclinical investigations of imaging and therapeutic agents. Health Phys. 114 (4), 450-459 (2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены