Method Article
Tomografia pré-clínica por emissão de pósitrons com moldes animais em conformidade com o corpo para análise automatizada de imagens baseada em nuvem em camundongos
Neste Artigo
Resumo
Este protocolo descreve o procedimento para realizar imagens PET in vivo em camundongos usando moldes animais conformes com o corpo (BCAMs) no scanner G8 PET/CT. São fornecidos detalhes técnicos sobre a preparação do camundongo, incluindo implantação adequada do tumor, posicionamento ideal, aquisição de imagens PET/CT assistidas por BCAM e análise de dados.
Resumo
A Tomografia por Emissão de Pósitrons (PET) é uma modalidade de imagem molecular que pode ser usada para investigar uma infinidade de questões farmacológicas, como modulação de biomarcadores, ocupação de receptores e biodistribuição de compostos de interesse. Em estudos de biodistribuição, os sujeitos experimentais são frequentemente fotografados longitudinalmente após o recebimento do artigo de teste. As imagens são então analisadas para derivar o perfil de distribuição do composto em vários órgãos em diferentes pontos de tempo. Isso constitui uma etapa crucial no desenvolvimento de medicamentos para entender a distribuição e o perfil potencialmente ligante de um composto investigativo. Os métodos padrão/manuais de análises de biodistribuição baseadas em imagens PET, no entanto, são trabalhosos e demorados e frequentemente associados a alta variabilidade entre operadores. Além disso, é um desafio manter as posições dos animais consistentes em diferentes pontos de tempo. Para resolver essas deficiências, uma série de moldes de animais em conformidade com o corpo de camundongos (BCAMs) foi usada para permitir o posicionamento rígido e consistente dos animais durante a aquisição de imagens PET / CT. Além disso, uma plataforma de software como serviço (SaaS) que consiste em um mapa de probabilidade de órgãos (OPM) baseado em nuvem e uma ferramenta de segmentação alimentada por inteligência artificial foi empregada para permitir a quantificação confiável e automatizada de dados de imagem PET in vivo. O fluxo de trabalho apresentado aqui inclui (1) preparar camundongos para imagens com os BCAMs, incluindo a implantação adequada de tumores subcutâneos para serem compatíveis com os moldes, (2) adquirir imagens de PET/CT com BCAMs usando o scanner G8 e 3) realizar segmentação automatizada de órgãos e análise de biodistribuição usando o SaaS baseado em nuvem. [18F]O FDG foi usado como um traçador exemplar aqui, mas outros biomarcadores e / ou compostos marcados com rádio podem ser prontamente adaptados ao fluxo de trabalho. Esse procedimento pode ser executado com precisão e eficácia com treinamento mínimo, e a análise automatizada dos dados do PET produziu resultados satisfatórios consistentes com o método manual.
Introdução
As tecnologias de imagem molecular in vivo são ferramentas importantes no desenvolvimento de medicamentos para facilitar a avaliação de todos os três pilares da farmacologia - biodistribuição, engajamento de alvos e modulação da farmacodinâmica 1,2,3. A tomografia por emissão de pósitrons (PET), com sua traduzibilidade clínica e alta sensibilidade, está entre as modalidades de imagem molecular mais comumente usadas tanto na clínica quanto no espaço de pesquisa e desenvolvimento pré-clínico. O campo florescente de imagens pré-clínicas de PET e radioteranósticas é valioso para o desenvolvimento de terapias intrínsecas ao tumor, terapêuticas direcionadas, bem como novas terapias de imuno-oncologia (IO). O surgimento e o desenvolvimento contínuos de novos radiotraçadores Immuno-PET têm o potencial de influenciar regimes específicos de medicamentos IO personalizados e identificar respondedores versus não respondedores 4,5,6. Enquanto isso, radiotraçadores metabólicos específicos, como [18F]FDG e [18F]FLT, podem monitorar a resposta de um tumor à terapia e podem, respectivamente, esclarecer se um tumor está proliferando ativamente ou consumindo glicose7, ou se as células tumorais estão sofrendo parada do ciclo celular por meio de inibição 8,9.
A imagem in vivo não invasiva apresenta múltiplas vantagens em comparação com os experimentos farmacológicos tradicionais e não imagiológicos. Por exemplo, a imagem permite a avaliação sistêmica e holística da distribuição de um medicamento e/ou efeito farmacológico em todo o sujeito, o que permite não apenas o monitoramento da eficácia no local alvo, mas também a detecção de atividades inesperadas fora do local. Devido à sua natureza não invasiva, o mesmo conjunto de animais pode ser avaliado longitudinalmente em diferentes pontos de tempo e/ou com diferentes biomarcadores para abordar questões biológicas distintas10. Isso não apenas reduz significativamente o número de animais necessários para o estudo, mas também fornece um controle ortogonal em todos os pontos de tempo e, portanto, ajuda a melhorar as correlações e reduzir as variabilidades individuais. Apesar desse desenvolvimento promissor de biomarcadores de imagem, a necessidade de avaliar compostos investigativos in vivo com estudos de biodistribuição baseados em imagens PET, no entanto, é atendida com a falta de processos automatizados eficientes para análise. Os estudos de biodistribuição de PET geram informações valiosas sobre a cinética, o acúmulo de tecido, a ligação e o metabolismo de um composto. A obtenção de dados quantitativos altamente reprodutíveis é fundamental para o desenvolvimento de terapias farmacêuticas.
Para atender a essas necessidades não atendidas na análise automatizada de imagens PET, a InVivo Analytics projetou um conjunto de moldes animais em conformidade com o corpo do camundongo (BCAMs)11. Estes são moldes de plástico impressos em 3D que seguram a cabeça, o tronco (e órgãos internos), a cauda e os membros de um rato em posições rígidas e predefinidas. Moldes de tamanhos diferentes podem ser selecionados com base no peso corporal do animal, e recortes podem ser criados em regiões específicas, como o ombro ou flanco inferior, para permitir que os tumores subcutâneos se projetem. As imagens PET/CT adquiridas com esses BCAMs são altamente uniformes e podem ser analisadas em lotes pela plataforma de segmentação automatizada baseada em nuvemda empresa 11. Este artigo apresenta um fluxo de trabalho automatizado de análise de biodistribuição in vivo que é alimentado pela aquisição física de imagens com BCAMs e pela realização de segmentação e análise de imagens pelo SaaS.
Protocolo
Todos os procedimentos realizados em animais seguiram regulamentos e diretrizes estabelecidas e foram revisados e aprovados pelo Comitê Institucional de Cuidados e Uso de Animais da Pfizer ou por meio de um processo de revisão ética. O estudo de imagem PET foi realizado seguindo todos os protocolos institucionais de segurança radiológica. Camundongos C57BL/6 fêmeas, de 10 a 12 semanas de idade, com pesos corporais variando de 18 a 26 g, foram utilizados neste estudo. Os detalhes dos reagentes e equipamentos usados estão listados na Tabela de Materiais.
1. Preparação e escalonamento dos animais
NOTA: Esta etapa envolve o estadiamento dos animais para imagens PET com implantação de tumor guiada por modelo BCAM.
- Antes da implantação celular, raspe o pelo dos camundongos na região desejada de crescimento do tumor.
- Configure a estação de anestesia e prenda um molde BCAM do tamanho apropriado ao pré-clipe com a parte superior virada para cima 90 graus. Isso servirá como base de implantação do tumor (Figura 1A).
- Anestesiar os animais em uma caixa de indução adequada com isoflurano a 2,0% e oxigênio a 98% a uma taxa de fluxo de 0,5-1,5 L/min.
NOTA: Todos os sistemas de anestesia são variáveis.- Use um sistema calibrado e teste antes de usar. Coloque um camundongo anestesiado na base e estenda seus membros (Figura 1B).
- Coloque suavemente um molde de molde de injeção de tumor BCAM (Figura 1C) no lado dorsal do mouse (Figura 1D).
- Crie cuidadosamente uma marca de referência circular temporária no local de recorte desejado (por exemplo, ombro ou flanco, esquerda ou direita) com um marcador (Figura 1D). Remova o molde do modelo.
- Prepare as células para a injeção aspirando o volume desejado para uma seringa. Encaixe uma agulha de 27 G na seringa e preencha o espaço do volume morto. Recomenda-se um volume de 0,1-0,2 mL por inoculação.
- Levante a pele com os dedos ou fórceps usando as marcas temporárias da etapa 1.5 como referência para criar uma tenda, insira lentamente a agulha e injete as células por via subcutânea no local desejado. Descarte a agulha em um recipiente para objetos cortantes de risco biológico.
- Monitore o crescimento do tumor. O volume médio do tumor na inscrição neste exemplo foi de 200-300 mm3.
NOTA: Evite usar componentes metálicos, como brincos ou microchips, para evitar artefatos de imagem de TC.
2. Extraindo doses radioativas
- Seguindo todos os protocolos institucionais de segurança contra radiação, elabore cuidadosamente uma dose-alvo de [18F]FDG na faixa de aproximadamente 70-80 μCi em uma seringa estéril adequada para injeção intravenosa.
NOTA: A faixa de 70-80 μCi é ideal para se ajustar à faixa dinâmica do scanner PET Sofie G8. Outros geradores de imagens podem ter diferentes faixas dinâmicas que requerem uma dose-alvo diferente. - Meça cuidadosamente a dose radioativa em um calibrador de dose, colocando a seringa na câmara do poço e abaixando a concha. Preste atenção à seleção do isótopo apropriado ou número de calibração antes da medição.
- Faça uma leitura estável. Registre a data e a hora. Ajuste a dose, se necessário.
- (Opcional) Use solução salina estéril para trazer o volume da dose final para 0,1-0,2 mL.
NOTA: O volume de injeção desejado pode variar. - A dose está pronta para ser administrada.
3. Administração de dose intravenosa
- Seguindo os protocolos institucionais de segurança IACUC e radiação, prepare a cauda do camundongo para injeção intravenosa dilatando a veia da cauda. Neste estudo, a veia da cauda foi dilatada colocando-se a gaiola do animal ou a câmara de indução em um aquecedor de lâminas ajustado a 42 °C.
NOTA: Pode levar até 10 minutos de aquecimento para que a veia da cauda se dilate completamente. - Antes da injeção, registre o peso do mouse. Isso determinará qual BCAM específico de peso usar para imagens PET/CT.
- Quando estiver pronto, transfira o mouse para um limitador adequado (por exemplo, uma plataforma de injeção de veia da cauda foi usada no presente estudo) e localize a veia da cauda.
- Manuseie cuidadosamente a seringa radioativa e injete a dose em um camundongo consciente. Registre o tempo de injeção.
- Coloque cuidadosamente a seringa de lado e limpe o excesso de sangue que cai da cauda com gaze. Remova o mouse do limitador e coloque-o de volta no alojamento apropriado.
- Coloque cuidadosamente a seringa de volta na câmara do calibrador de dose e registre quaisquer leituras residuais para cálculos de dose adequados. Registre a data e a hora da leitura da atividade residual.
- Assim que as injeções forem concluídas, tome cuidado e coloque coortes de camundongos atrás de recintos de chumbo e/ou longe do pessoal, seguindo as práticas de radiação seguras da instituição. Observe que todos os materiais usados estão sujeitos a contaminação radioativa menor. Monitore todas as áreas com um contador Geiger calibrado e limpe de acordo com as diretrizes de segurança contra radiação.
4. Anestesia e posicionamento dos animais para imagens PET
- Em um momento apropriado (por exemplo, 10-15 minutos antes do final do período de captação do traçador), ligue todos os equipamentos de anestesia e instrumentos de aquecimento animal necessários para indução anestésica e imagem PET. A anestesia pode ser ajustada em 2.0%-2.5% de isoflurano em oxigênio a 98% (as configurações podem variar de acordo com a cepa do camundongo e o modelo da doença).
- Confirme se todos os adaptadores e válvulas estão ligados e se a vazão de gás é de 0.5-1.0 L/min. As taxas de fluxo específicas podem variar entre os sistemas de anestesia e os sistemas de imagem.
- Coloque o(s) animal(is) apropriado(s) em uma caixa de indução e espere até que o sujeito atinja a profundidade correta da anestesia.
- Aplique pomada lubrificante ocular em cada olho.
- Transfira o mouse para um BCAM de tamanho apropriado com base no peso corporal.
- Pegue o mouse suavemente pela nuca, insira a cauda na ranhura da cauda e enrole-a sob o BCAM. Coloque a cauda na plataforma da cauda e prenda a fita adesiva para fixar a posição. Verifique se a coluna está reta. Feche suavemente o BCAM (Figura 2A,B).
- Posicione cuidadosamente todos os quatro membros para descansar em cada uma das plataformas da pata BCAM. Use fita adesiva conforme necessário para prender as patas em cada plataforma (Figura 2B).
- Encaixe suavemente o BCAM no suporte do leito de imagem inserindo primeiro a extremidade frontal (Figura 2C). O carro já deve estar conectado à doca de carga G8 com fluxo de anestesia (Figura 2D). Empurre para baixo a parte de trás do BCAM e um clique indicará que ele está preso ao ônibus G8.
NOTA: Mantenha o suprimento anestésico para que o animal permaneça no plano anestésico desejado durante a imagem.
5. Aquisição de imagem
- Abra o software de aquisição G8 PET. Pastas de estudo, parâmetros de varredura e IDs de assunto podem ser criados com antecedência.
- Insira os detalhes do estudo no software: peso do camundongo, data/hora e quantidade da dose inicial coletada, data/hora da injeção e data/hora e quantidade de leitura da atividade residual.
- Insira o vaivém com o mouse na abertura do scanner. Uma luz indicadora azul indicará o encaixe adequado ao sistema.
- Selecione os parâmetros PET/CT apropriados. Adquira dados de imagem.
NOTA: Neste estudo, uma tomografia computadorizada estática de 7 minutos de 18F foi executada, seguida por uma tomografia computadorizada padrão de 70 segundos, e um algoritmo de reconstrução 3D de máxima verossimilhança (padrão e única opção no scanner G8) foi aplicado para reconstruir os dados12. - Após a conclusão da aquisição, o ônibus espacial retornará à sua posição inicial inicial. Remova a lançadeira com o mouse e insira-a no dock. Pressione a parte de trás da aba vertical do BCAM para removê-lo da lançadeira G8 e puxe e remova suavemente o BCAM com o mouse.
- Pressione as duas abas de retenção para virar para cima e abrir a parte superior do BCAM.
- Remova o mouse com cuidado. Certifique-se de que o mouse tenha se recuperado totalmente da anestesia e esteja brilhante, alerta e responsivo (BAR) antes de retornar à gaiola de origem.
- Continue o procedimento em intervalos de tempo definidos para escanear toda a coorte/grupo de camundongos.
6. Upload de imagens para o SaaS
- Faça login no app.invivo.ax e crie um projeto.
- Clique na guia vermelha de upload no canto superior direito da janela. Selecione um sistema de imagem e um repórter usados no estudo de imagem (ou seja, [18F]FDG). Selecione a pasta com os dados de imagem.
- Navegue até a guia de anotação na pasta do projeto. Clique em Anotar para adicionar informações de varredura relevantes (nome do sujeito, sexo, tamanho do BCAM, peso do sujeito, nome da coorte, ponto de tempo e valor da dose injetada). A maioria dos metadados será preenchida automaticamente.
7. Análise automatizada de dados
- Na pasta do projeto, todas as verificações devem ser preenchidas. Clique nas digitalizações para navegar dos níveis de projeto, grupo e assunto individual. Selecione Analisar no canto superior direito.
- No canto superior direito da janela da faixa de opções de análise, em Projeto, selecione o símbolo de adição e selecione ROI do Mapa de Probabilidade do Órgão. O Mapa de Probabilidade de Órgãos (OPM) é um atlas estatístico de órgãos de camundongos que abrange vários órgãos e tecidos predefinidos. Selecione órgãos individuais de interesse com base nas necessidades de pesquisa.
NOTA: Neste exemplo, a segmentação e análise manual foram feitas usando o VivoQuant, usando a ferramenta spline, seguida de interpolação dentro do operador ROI 3D. Os resultados da análise automatizada foram comparados com os resultados da segmentação manual como referência.
Resultados
Uma vez carregados, os dados do PET podem ser visualizados no site do SaaS como um painel de imagens coronais, sagitais e transversais sobrepostas com as ROIs de órgãos selecionados que são ditadas pelo OPM (Figura 3A). Não apenas o software pode carregar imagens individuais, mas vários camundongos de um grupo ou de um estudo inteiro podem ser visualizados de uma só vez como uma única imagem recolhida. Nessa janela de análise, há opções para personalizar as cores do ROI, a intensidade da barra de escala e outros parâmetros comuns. Depois que as métricas analíticas ideais são selecionadas, o SaaS gera um gráfico de barras de biodistribuição para download dos órgãos selecionados (Figura 3B).
Para avaliar o desempenho da plataforma SaaS baseada em OPM, os resultados da análise automatizada foram comparados com aqueles que foram derivados por um analista de imagem experiente como padrão-ouro. A regressão linear de ajuste foi realizada nos valores de captação de [18F]FDG do cérebro, coração, rim (direito) e baço. É importante observar que a plataforma oferece uma lista abrangente de órgãos para os usuários selecionarem, incluindo esqueleto, cérebro, bexiga, coração, rins (direito e esquerdo), fígado, baço, pulmões e músculos quadríceps (direito e esquerdo). Os quatro órgãos acima foram selecionados neste estudo apenas para fins ilustrativos. Além disso, devido ao tamanho, forma e profundidade/localização variáveis dos tumores implantados, o tumor não está incluído como um órgão no OPM e, portanto, excluído desta análise comparativa. Conforme mostrado na Figura 4, a análise automatizada e a análise manual produziram resultados gerais consistentes, com o cérebro mostrando a maior correlação (r2 = 0,8466). Isso é esperado devido ao grande tamanho do órgão e à posição altamente constante do cérebro dentro do crânio. O rim direito e o coração também apresentaram valores razoáveis de r2 de 0,6874 e 0,4849, respectivamente. Em contraste, a análise de correlação para o baço gerou um valor de r2 de 0,3922, que é o mais baixo entre os órgãos testados. Isso não é surpreendente, pois o baço está aninhado no pâncreas e nos tecidos adiposos que não possuem morfologia definida e presumem a mesma densidade de tecidos moles na TC. O baço é, portanto, difícil de segmentar manualmente, e o MPO pode apresentar um meio mais preciso para demarcar esse órgão (ou seja, superar o padrão-ouro). A inclinação e o intercepto Y dessas análises de correlação também são mostrados na Figura 4. Consistente com os valores de r2 , o cérebro teve uma inclinação mais próxima de 1 (ou seja, uma correlação perfeita entre OPM e resultados manuais) e o menor intercepto Y (ou seja, viés sistêmico mínimo), enquanto os outros órgãos mostraram maior e variável desvio de uma correlação perfeita.

Figura 1: BCAM e implante tumoral guiado por molde. (A) O pré-clipe (1) é fixado à peça inferior de um molde BCAM (2) com uma linha de anestesia conectada (3). Isso serve como base de implantação do tumor. (B) Um camundongo com o local do implante alvo raspado (neste caso, o ombro direito) é colocado na base sob anestesia antes da injeção de células. (C) Modelo de implantação de tumor (4) com recortes pré-definidos para orientar a colocação da inoculação de células tumorais. (D) Fazer uma marca de referência temporária antes da injeção de células com o molde do molde colocado no lado dorsal do camundongo. Clique aqui para ver uma versão maior desta figura.
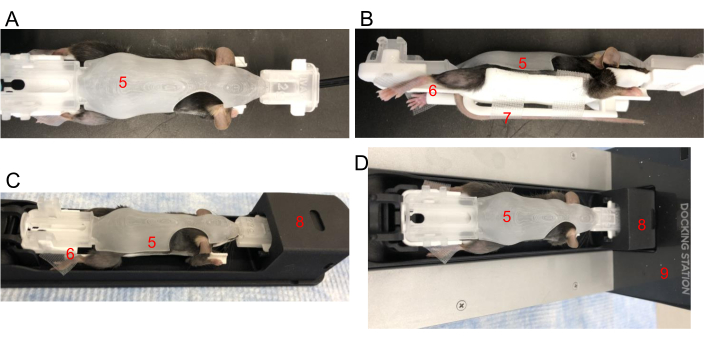
Figura 2: Posicionando um mouse em um BCAM. (A) Vista superior - Coloque um mouse confortavelmente em um BCAM de tamanho apropriado (5). (B) Vista lateral - A fita é usada para prender as patas traseiras às plataformas (6). A cauda é presa com fita adesiva à plataforma da cauda (7) diretamente abaixo do mouse. (C) O camundongo, no BCAM, é inserido no ônibus de imagem (8). (D) Mouse, BCAM e shuttle estão conectados a uma estação de acoplamento para anestesia (9). Clique aqui para ver uma versão maior desta figura.
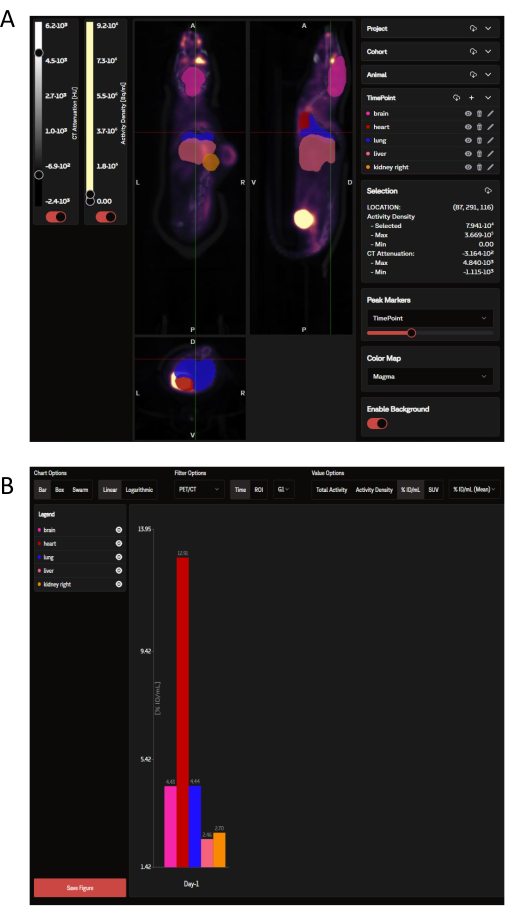
Figura 3: Imagens representativas e saída de dados conforme visualizadas e analisadas pela ferramenta SaaS, respectivamente. (A) Imagens representativas conforme visualizadas no site SaaS. Vistas coronal, sagital e transversal da imagem PET/CT sobrepostas com ROIs de órgãos selecionadas do Mapa de Probabilidade de Órgãos (OPM). Rosa: cérebro; vermelho: coração; azul escuro: pulmão; salmão: fígado; laranja: rim (direita). O tumor não é definido pelo OPM. (B) Um gráfico representativo para download gerado a partir da análise automatizada. Uma lista dos órgãos selecionados pode ser vista no painel superior esquerdo. Os dados aqui são relatados em %ID/mL. Clique aqui para ver uma versão maior desta figura.
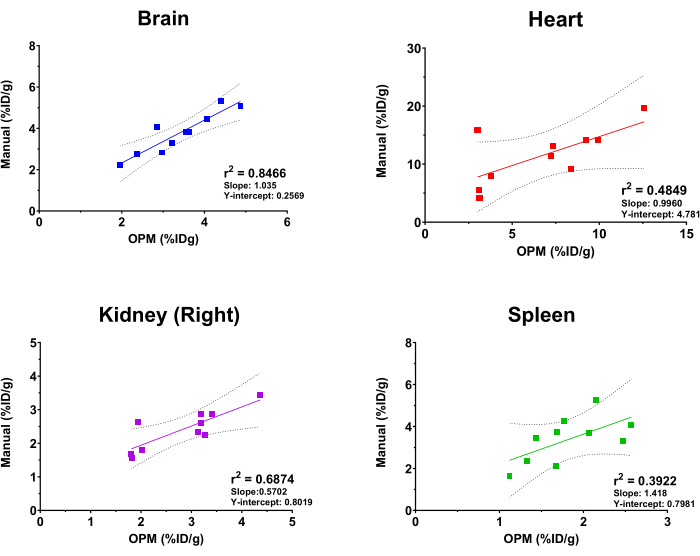
Figura 4: Análise de regressão linear comparando os valores de captação de [18F]FDG do órgão derivados da análise manual e do fluxo de trabalho de automação baseado em OPM. Foram utilizadas dez tomografias por emissão de pósitrons (PET/CT) de camundongos fêmeas C57BL/6. r2 valores, linhas de confiança de 95%, inclinação e interceptos Y são exibidos no gráfico para cada órgão indicado. Clique aqui para ver uma versão maior desta figura.
Discussão
O presente relatório descreve o procedimento de realização de imagens PET in vivo em camundongos com os moldes BCAM e análise de dados com a ferramenta SaaS automatizada. São fornecidas instruções passo a passo sobre preparação do mouse, aquisição de imagens e processamento de dados. Esse fluxo de trabalho de automação também gerou dados consistentes com a análise manual. Algumas considerações técnicas importantes são destacadas abaixo.
Embora um tumor não seja um dos órgãos definidos pelo OPM, uma etapa crítica neste protocolo é a implantação adequada de tumores subcutâneos para, em última análise, garantir o alinhamento ideal de todos os órgãos do camundongo dentro da cavidade do corpo e BCAM. O OPM só pode produzir dados precisos quando a coluna vertebral de um camundongo é relativamente reta e os órgãos internos estão posicionados de forma neutra. Tumores excessivamente grandes ou mal colocados podem afetar a postura do camundongo e pressionar sua cavidade corporal, deslocando assim os órgãos internos. Essa mudança, por sua vez, distorcerá a análise quantitativa resultante do algoritmo OPM. Outros relataram o impacto de uma coluna não reta no alinhamento dos órgãos internos usando várias modalidades de imagem e algoritmos de segmentação13,14. Portanto, é crucial usar o modelo para orientar a implantação do tumor e monitorar o crescimento do tumor de perto para garantir que os tumores estejam posicionados corretamente e na faixa de tamanho ideal.
Outra área de possível desvio é a seleção de um BCAM de tamanho adequado. Os BCAMs são criados em integrais de 2 g, com um intervalo de 18-26 g. No entanto, como camundongos com diferentes composições corporais (por exemplo, mais músculo versus mais gordura) podem ter o mesmo peso corporal, mas tamanhos físicos diferentes, é importante escolher o BCAM mais adequado usando seu peso corporal como referência geral. Suba ou desça de nível por tentativa e erro e lembre-se de que o alinhamento adequado é fundamental. Escolher um BCAM muito grande fará com que os órgãos internos do camundongo "afundem" mais perto do fundo da cama, o que afetará particularmente a precisão da análise dos órgãos dorsais, como os rins e a coluna. Em contraste, colocar um camundongo em BCAM muito pequeno pode pressionar suas cavidades corporais, distorcer o posicionamento dos órgãos e potencialmente causar dificuldade na respiração. Usar fita adesiva para garantir que os membros estejam presos nas plataformas das patas ajudará na configuração e no posicionamento.
Embora esse fluxo de trabalho relatado permita a análise padronizada e automatizada de imagens PET, vale ressaltar que o OPM atual é construído com base na cepa de camundongo C57BL/6 imunocompetente e em camundongos saudáveis. Outras cepas e condições de saúde de camundongos podem apresentar diferentes características anatômicas que requerem ajuste, otimização e validação adicionais do algoritmo. Por exemplo, cepas imunodeficientes, como NSG ou NCG, têm baços menores. Da mesma forma, camundongos portadores de implantes tumorais ortotópicos podem ter diferentes tamanhos, formas e localizações de órgãos internos, dependendo do estado da doença. Outra limitação desse fluxo de trabalho é a taxa de transferência geral durante a fase de aquisição de um experimento. Isso se deve principalmente ao tempo adicional necessário para configurar um mouse corretamente no BCAM. O treinamento e a prática podem aumentar a eficiência do operador na colocação adequada. A adição de uma segunda estação de acoplamento também pode aumentar a taxa de transferência geral, onde um dock pode servir para configuração de BCAM e o outro pode servir para remover um mouse para uma gaiola de recuperação. No entanto, mesmo com o aumento do tempo necessário para a configuração do BCAM antes da digitalização, o investimento em tempo compensa economizando tempo no final da análise de dados. Por exemplo, no presente estudo, levou menos de 10 minutos para o OPM analisar dez imagens (com 4 ROIs), enquanto levou de 3 a 4 horas para um analista altamente experiente segmentar e analisar manualmente o mesmo conjunto de imagens e ROIs. Um analista inexperiente exigiria ainda mais tempo para análise manual. A plataforma SaaS permite a análise de exames de PET em grandes lotes, onde a análise completa de biodistribuição in vivo pode ser concluída em minutos após o upload dos dados. Esse é um recurso extremamente útil ao lidar com grandes quantidades de dados de vários grupos e/ou em vários pontos de tempo, conforme discutido abaixo.
A segmentação manual de órgãos para um único sujeito pode ser demorada e geralmente requer treinamento inicial significativo do operador. Mesmo com treinamento adequado, as análises manuais inevitavelmente enfrentam variabilidades entre os operadores, o que pode distorcer os resultados quantitativos15,16. Por outro lado, a segmentação automatizada e a análise de dados podem determinar com precisão e eficiência a biodistribuição geral de um radiotraçador e eliminar variabilidades enraizadas nas operações humanas. Esses benefícios da automação foram observados tanto na análise de imagens clínicas quanto no espaço pré-clínico. Por exemplo, Sluis et al. demonstraram que uma única varredura exigia 4 h para segmentar os órgãos de interesse em comparação com 30 min por métodos baseados em nuvem de IA17. Outro estudo de Nazari et al. também relatou que a análise baseada em algoritmos do fígado e dos rins demonstrou resultados precisos em 7,0% quando comparados a dois físicos médicos humanos18. Os dados na Figura 4 também mostraram claramente a confiabilidade do fluxo de trabalho de análise de imagem PET baseado em SaaS e que a análise automatizada produziu resultados consistentes quando comparada à análise manual.
Em resumo, este artigo ilustra o fluxo de trabalho do uso de moldes BCAM para facilitar a aquisição padronizada de imagens PET/CT pré-clínicas, bem como a análise automatizada de dados PET habilitada para SaaS. É demonstrado que essa tecnologia de plataforma é relativamente simples de empregar e a qualidade dos dados gerados pela automação é consistente com a análise manual, mas possui benefícios significativos de economia de tempo. Portanto, esse fluxo de trabalho pode economizar centenas de horas de análise de dados para os pesquisadores e ajudar a padronizar e reduzir a variabilidade entre operadores. Este procedimento pode auxiliar no desenvolvimento de uma infinidade de compostos de medicamentos em todas as modalidades e indicações. Particularmente, modalidades de moléculas grandes, como anticorpos terapêuticos, engajadores de células imunes de anticorpos biespecíficos, conjugados anticorpo-droga e até nanopartículas podem ser prontamente marcadas com radiometais (por exemplo, Zr-89,-64) para permitir a avaliação da biodistribuição mediada por imagens PET19,20. Da mesma forma, essa tecnologia de plataforma pode ajudar a determinar a dosimetria de novas radioterapias em camundongos21. A aplicação deste procedimento será um grande valor agregado ao desenvolvimento de medicamentos.
Divulgações
Todos os autores são funcionários atuais ou anteriores da Pfizer, Inc.
Agradecimentos
Agradecimentos especiais à equipe técnica e de pesquisa em medicina comparada da Pfizer La Jolla.
Materiais
| Name | Company | Catalog Number | Comments |
| [18F]FDG | PETNet Solutions, Culver City, CA | NA | Radiotracer used for PET imaging |
| 27 G needle | Becton, Dickinson and Company, San Diego, CA | 305136 | Used for cell injection |
| app.invivo.ax/login | Invivo Analytics, Seattle, WA | NA | Software as a Service webpage |
| Body Conforming Animal Molds | Invivo Analytics, Seattle, WA | NA | BCAMs with weight range of 18 - 26 g |
| Dose Calibrator; CRC-55tw | Capintec, Florham Park, NJ | CRC-55tw | Measurement of radioactive doses |
| G8 PET/CT scanner | Sofie Biosciences/Xodus Imaging, Torrence, CA | NA | Benchtop scanner with loading dock |
| G8-Docking station | Sofie Biosciences/Xodus Imaging, Torrence, CA | NA | Docking station for staging |
| Implantation Mold Template | Invivo Analytics, Seattle, WA | NA | Template for optimal tumor implantation |
| Lubricant eye ointment | BAUSCH & LOMB, Ontario, Canada | Soothe Nighttime | Eye lube for mice |
| Modified G8 shuttle | Invivo Analytics, Seattle, WA | NA | Shuttle for BCAM accommodation |
| Mouse anesthesia Induction box | Patterson Scientific, Waukesha, WI | 78933388 | Used for anesthetizing a mouse |
| PRE-Clip | Invivo Analytics, Seattle, WA | NA | BCAM adapter for anesthesia connection |
| Premiere Slide warmer | LabScientific, Danvers, MA | XH-2001 | Adjustable temp warmer used for tail vein dilation and anesthesia induction |
| Syringe (1 mL) | Becton, Dickinson and Company, San Diego, CA | 309659 | Used for cell injection |
| Tail Vein injection platform | Braintree Scientific, Pembroke, MA | IL-300 | Restrainer used for administering intravenous injections. |
| Vivoqaunt Software | Invicro, Needham, MA | NA | Software used for manual segmentation |
Referências
- Huang, R., Wang, M., Zhu, Y., S Conti, P., Chen, K. Development of pet probes for cancer imaging. Curr Top Med Chem. 15 (8), 795-819 (2015).
- Schwenck, J., et al. Advances in pet imaging of cancer. Nat Rev Cancer. 23 (7), 474-490 (2023).
- Matthews, P. M., Rabiner, E. A., Passchier, J., Gunn, R. N. Positron emission tomography molecular imaging for drug development. Br J Clin Pharmacol. 73 (2), 175-186 (2012).
- Tavaré, R., et al. An effective immuno-pet imaging method to monitor CD8-dependent responses to immunotherapy. Cancer Res. 76 (1), 73-82 (2016).
- Maresca, K. P., et al. Preclinical evaluation of 89ZR-DF-IAB22M2C PET as an imaging biomarker for the development of the gucy2c-cd3 bispecific pf-07062119 as a t-cell engaging therapy. Mol Imaging Biol. 23 (6), 941-951 (2021).
- Nisnboym, M., et al. Immuno-pet imaging of cd69 visualizes t-cell activation and predicts survival following immunotherapy in murine glioblastoma. Cancer Res Commun. 3 (7), 1173-1188 (2023).
- Lee, C., et al. Efficacy and imaging-enabled pharmacodynamic profiling of Kras g12c inhibitors in xenograft and genetically engineered mouse models of cancer. Mol Cancer Ther. 22 (7), 891-900 (2023).
- Bollineni, V., Kramer, G., Jansma, E. P., Liu, Y., Oyen, W. J. A systematic review on [18f] flt-pet uptake as a measure of treatment response in cancer patients. Eur J Cancer. 55, 81-97 (2016).
- Everitt, S., et al. Imaging cellular proliferation during chemo-radiotherapy: A pilot study of serial 18f-flt positron emission tomography/computed tomography imaging for non-non-small-cell lung cancer. Int J Radiat Oncol Biol Phys. 75 (4), 1098-1104 (2009).
- Rashidian, M., et al. Predicting the response to CTLA-4 blockade by longitudinal non-invasive monitoring of cd8 t cells. J Exp Med. 214 (8), 2243-2255 (2017).
- Klose, A. D., Paragas, N. Automated quantification of bioluminescence images. Nat Commun. 9 (1), 4262 (2018).
- Gu, Z., et al. Performance Evaluation of G8, a high-sensitivity benchtop preclinical PET/CT Tomograph. J Nucl Med. 60 (1), 142-149 (2019).
- Bongratz, F., Rickmann, A. -. M., Wachinger, C. Abdominal organ segmentation via deep diffeomorphic mesh deformations. Sci Rep. 13 (1), 18270 (2023).
- Wang, H., Stout, D. B., Chatziioannou, A. F. Mouse atlas registration with non-tomographic imaging modalities-a pilot study based on simulation. Mol Imaging Biol. 14, 408-419 (2012).
- Montgomery, M. K., et al. Mouse lung automated segmentation tool for quantifying lung tumors after micro-computed tomography. PLoS One. 16 (6), e0252950 (2021).
- Montgomery, M. K., et al. Applying deep learning to segmentation of murine lung tumors in preclinical micro-computed tomography. Transl. Oncol. 40, 101833 (2024).
- Van Sluis, J., et al. Manual versus artificial intelligence-based segmentation as a pre-processing step in whole-body pet dosimetry calculations. Mol Imaging Biol. 25 (2), 435-441 (2023).
- Nazari, M., et al. Automated and robust organ segmentation for 3D-based internal dose calculation. EJNMMI Res. 11, 1-13 (2021).
- Goel, S., England, C. G., Chen, F., Cai, W. Positron emission tomography and nanotechnology: A dynamic duo for cancer theranostics. Adv Drug Deliv Rev. 113, 157-176 (2017).
- Campbell, D. O., et al. Preclinical evaluation of an anti-nectin-4 immunopet reagent in tumor-bearing mice and biodistribution studies in cynomolgus monkeys. Mol Imaging Biol. 18, 768-775 (2016).
- Bednarz, B., et al. Murine-specific internal dosimetry for preclinical investigations of imaging and therapeutic agents. Health Phys. 114 (4), 450-459 (2018).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados