Method Article
생쥐의 클라우드 기반 자동 이미지 분석을 위한 신체 순응 동물 주형을 사용한 전임상 양전자 방출 단층촬영(Preclinical Positron Emission Tomography)
요약
이 프로토콜은 G8 PET/CT 스캐너에서 BCAM(Body Conforming Animal Molds)을 사용하여 마우스에서 생체 내 PET 이미징을 수행하는 절차를 설명합니다. 적절한 종양 이식, 최적의 위치 지정, BCAM 지원 PET/CT 이미지 획득 및 데이터 분석을 포함한 마우스 준비에 대한 기술적 세부 정보가 제공됩니다.
초록
양전자 방출 단층촬영(PET)은 바이오마커 조절, 수용체 점유 및 관심 화합물의 생체 분포와 같은 다양한 약리학적 질문을 조사하는 데 사용할 수 있는 분자 이미징 양식입니다. 생체 분포 연구에서 실험 대상은 종종 테스트 물품을 받은 후 종단으로 이미지화됩니다. 그런 다음 이미지를 분석하여 서로 다른 시점의 다양한 기관에서 화합물의 분포 프로파일을 도출합니다. 이는 연구용 화합물의 분포 및 잠재적으로 결합 가능한 프로파일을 이해하기 위한 약물 개발의 중요한 단계를 구성합니다. 그러나 PET 이미징 기반 생체 내 분포 분석의 표준/수동 방법은 노동 집약적이고 시간이 많이 소요되며 종종 높은 작업자 간 변동성과 관련이 있습니다. 또한 서로 다른 시점에서 동물의 위치를 일관되게 유지하는 것이 어렵습니다. 이러한 단점을 해결하기 위해 일련의 BCAM(Mouse Body Conforming Animal Molds)을 사용하여 PET/CT 이미징 획득 중에 동물을 견고하고 일관된 위치로 배치할 수 있었습니다. 또한 클라우드 기반 OPM(Organ Probability Map)과 인공 지능 기반 세분화 도구로 구성된 SaaS(Software-as-a-Service) 플랫폼을 사용하여 생체 내 PET 이미징 데이터의 신뢰할 수 있고 자동화된 정량화를 가능하게 했습니다. 여기에 제시된 워크플로우에는 (1) 주형과 호환되도록 피하 종양을 적절하게 이식하는 것을 포함하여 BCAM으로 이미징을 위한 마우스 준비, (2) G8 스캐너를 사용하여 BCAM으로 PET/CT 이미지 획득, 3) 클라우드 기반 SaaS를 사용하여 자동화된 장기 분할 및 생체 분포 분석 수행이 포함됩니다. [18F]FDG는 여기에서 예시적인 추적자로 사용되었지만, 다른 바이오마커 및/또는 방사성 표지 화합물은 워크플로우에 쉽게 적용할 수 있습니다. 이 절차는 최소한의 교육으로 정확하고 효과적으로 실행할 수 있으며, 자동화된 PET 데이터 분석은 수동 방법과 일치하는 만족스러운 결과를 산출했습니다.
서문
In vivo 분자 이미징 기술은 약리학의 세 가지 기둥인 생체 내 분포, 표적 관여 및 약력학 조절의 평가를 용이하게 하는 약물 개발의 중요한 도구입니다 1,2,3. 양전자 방출 단층 촬영(PET)은 임상적 번역 가능성과 높은 감도를 특징으로 하며, 임상과 전임상 연구 개발 분야에서 가장 일반적으로 사용되는 분자 이미징 기법 중 하나입니다. 전임상 PET 이미징 및 방사선 치료제의 개화 분야는 종양 내인성 치료제, 표적 치료제 및 새로운 면역 종양학(IO) 치료제의 개발에 가치가 있습니다. 새로운 Immuno-PET 방사성 추적자의 지속적인 등장과 개발은 특정 맞춤형 IO 약물 요법에 영향을 미치고 반응자와 비반응자를 식별할 수 있는 잠재력을 가지고 있습니다 4,5,6. 한편, [18F]FDG 및 [18F]FLT와 같은 대사 특이적 방사성 추적자는 치료에 대한 종양의 반응을 모니터링할 수 있으며, 종양이 포도당을 활발하게 증식하거나 소비하는지 여부7 또는 종양 세포가 억제 방식으로 세포주기 정지를 겪고 있는지 여부를 각각 밝힐 수 있습니다 8,9.
비침습적 in vivo 이미징은 기존의 비이미징 약리학 실험에 비해 여러 가지 이점을 제공합니다. 예를 들어, 이미징을 통해 전체 피험자에 대한 약물의 분포 및/또는 약리학적 효과에 대한 체계적이고 전체적인 평가가 가능하므로 표적 부위의 효능을 모니터링할 수 있을 뿐만 아니라 예기치 않은 외부 활동을 감지할 수 있습니다. 비침습적 특성으로 인해, 동일한 동물 집단을 서로 다른 시점 및/또는 다른 바이오마커로 종단적으로 평가하여 뚜렷한 생물학적 질문을 해결할 수 있다10. 이는 연구에 필요한 동물의 수를 크게 줄일 뿐만 아니라 시점 전반에 걸쳐 직교 제어를 제공하므로 상관 관계를 개선하고 개별 변동성을 줄이는 데 도움이 됩니다. 이미징 바이오마커의 이러한 유망한 개발에도 불구하고 PET 이미징 기반 생체 분포 연구를 통해 in vivo 연구 화합물을 평가해야 할 필요성은 분석을 위한 효율적인 자동화 프로세스가 부족하여 충족되지 않습니다. PET 생체내 분포 연구는 화합물의 동역학, 조직 축적, 결합 및 대사에 대한 귀중한 정보를 생성합니다. 재현성이 높은 정량적 데이터를 얻는 것은 제약 요법 개발에 매우 중요합니다.
자동 PET 이미지 분석에서 이러한 충족되지 않은 요구 사항을 해결하기 위해 InVivo Analytics는 마우스 BCAM(Body Conforming Animal Molds) 세트를 설계했습니다11. 이것은 3D 프린팅된 플라스틱 주형으로, 쥐의 머리, 몸통(및 내부 장기), 꼬리 및 팔다리를 단단하고 미리 정의된 위치에 고정합니다. 동물의 체중에 따라 다양한 크기의 주형을 선택할 수 있으며, 어깨 또는 아래쪽 옆구리와 같은 특정 부위에 컷아웃을 만들어 피하 종양이 돌출될 수 있도록 할 수 있습니다. 이러한 BCAM으로 획득한 PET/CT 이미지는 매우 균일하며 회사의 클라우드 기반 자동 세분화 플랫폼11을 통해 일괄적으로 분석할 수 있습니다. 이 기사에서는 BCAM으로 이미지를 물리적으로 획득하고 SaaS에 의한 이미지 세분화 및 분석을 수행하여 구동되는 자동화된 생체 내 분포 분석 워크플로우를 제시합니다.
프로토콜
동물에 대해 수행된 모든 절차는 규정과 확립된 지침을 따랐으며 Pfizer의 기관 동물 관리 및 사용 위원회 또는 윤리적 검토 프로세스를 통해 검토 및 승인되었습니다. PET 이미징 연구는 모든 기관 방사선 안전 프로토콜에 따라 수행되었습니다. 이 연구에는 체중이 18-26g 인 10-12 주 된 암컷 C57BL / 6 마리의 마우스가 사용되었습니다. 사용된 시약 및 장비에 대한 자세한 내용은 재료 표에 나열되어 있습니다.
1. 동물의 준비 및 준비
참고: 이 단계에는 BCAM 템플릿 유도 종양 이식을 사용한 PET 이미징을 위해 동물을 스테이징하는 것이 포함됩니다.
- 세포 이식 전에 원하는 종양 성장 부위에서 마우스의 털을 면도합니다.
- 마취 스테이션을 설정하고 상단을 90도 위로 뒤집은 상태에서 적절한 크기의 BCAM 몰드를 프리 클립에 부착합니다. 이것은 종양 착상 기초 역할을 합니다(그림 1A).
- 2.0% 이소플루란과 98% 산소가 함유된 적절한 유도 상자에서 0.5-1.5L/min의 유속으로 동물을 마취합니다.
참고: 모든 마취 시스템은 가변적입니다.- 보정된 시스템을 사용하고 사용하기 전에 테스트하십시오. 마취된 마우스를 바닥에 놓고 팔다리를 뻗습니다(그림 1B).
- BCAM 종양 주입 템플릿 몰드(그림 1C)를 마우스의 등쪽(그림 1D)에 부드럽게 놓습니다.
- 마커를 사용하여 원하는 컷아웃 위치(예: 어깨 또는 측면, 왼쪽 또는 오른쪽)에 임시 원형 참조 마크를 조심스럽게 만듭니다(그림 1D). 템플릿 몰드를 제거합니다.
- 원하는 부피를 주사기에 끌어당겨 주입할 세포를 준비합니다. 주사기에 27G 바늘을 부착하고 데드 볼륨 공간을 채웁니다. 접종당 0.1-0.2mL의 부피가 권장됩니다.
- 1.5단계의 임시표시를 참고로 손가락이나 집게 등으로 피부를 들어 올려 텐트를 만들고 천천히 바늘을 삽입하여 원하는 위치에 세포를 피하로 주입합니다. 바늘을 생물학적 위험 날카로운 물건 용기에 버리십시오.
- 종양 성장을 모니터링합니다. 이 예에서 등록 시 평균 종양 부피는 200-300mm3였습니다.
알림: CT 영상 아티팩트를 방지하기 위해 귀표나 마이크로칩과 같은 금속 부품을 사용하지 마십시오.
2. 방사성 선량 채취
- 모든 기관 방사선 안전 프로토콜에 따라 약 70-80μCi 범위의 [18F]FDG의 목표 선량을 정맥 주사에 적합한 멸균 주사기에 조심스럽게 끌어냅니다.
참고: 70-80μCi 범위는 Sofie G8 PET 스캐너의 동적 범위에 맞게 최적입니다. 다른 이미저는 다른 목표 선량을 필요로 하는 다른 동적 범위를 가질 수 있습니다. - 선량 보정기에서 주사기를 웰 챔버에 넣고 디퍼를 내려 방사선 선량을 조심스럽게 측정합니다. 측정하기 전에 적절한 동위원소 또는 보정 번호를 선택하는 데 주의하십시오.
- 안정적인 판독값을 취하십시오. 날짜와 시간을 기록합니다. 필요한 경우 복용량을 조절하십시오.
- (선택 사항) 멸균 식염수를 사용하여 최종 투여량을 0.1-0.2mL로 가져옵니다.
참고: 원하는 주입량은 다를 수 있습니다. - 용량을 투여할 준비가 되었습니다.
3. 정맥 투여
- 기관의 IACUC 및 방사선 안전 프로토콜에 따라 꼬리 정맥을 확장하여 IV 주사를 위해 쥐 꼬리를 준비합니다. 이 연구에서는 동물 케이지 또는 유도 챔버를 42°C로 설정된 슬라이드 워머에 배치하여 꼬리 정맥을 확장했습니다.
알림: 꼬리 정맥이 완전히 확장되려면 최대 10분의 예열이 소요될 수 있습니다. - 주입하기 전에 마우스 체중을 기록하십시오. 이를 통해 PET/CT 영상에 사용할 체중별 BCAM을 결정할 수 있습니다.
- 준비가 되면 마우스를 적절한 구속기(예: 본 연구에서 꼬리 정맥 주입 플랫폼이 사용됨)로 옮기고 꼬리 정맥을 찾습니다.
- 방사성 주사기를 조심스럽게 다루고 의식이 있는 쥐에게 정맥 주사를 주입합니다. 사출 시간을 기록합니다.
- 주사기를 조심스럽게 옆으로 치우고 거즈로 꼬리에 묻은 과도한 혈액 방울을 닦아냅니다. 고정 장치에서 마우스를 분리하고 해당 하우징에 다시 놓습니다.
- 주사기를 투여 교정기에 조심스럽게 다시 넣고 적절한 투여 계산을 위해 잔류 판독값을 기록합니다. 잔류 활동 판독값의 날짜와 시간을 기록합니다.
- 주사가 완료되면 주의를 기울이고 기관에서 허용하는 방사선 관행에 따라 마우스 코호트를 리드 인클로저 뒤에 배치하거나 직원으로부터 멀리 떨어뜨립니다. 참고: 사용된 모든 물질은 경미한 방사능 오염에 노출되어 있습니다. 보정된 가이거 계수기로 모든 영역을 모니터링하고 방사선 안전 지침에 따라 청소하십시오.
4. PET 이미징을 위한 동물 마취 및 위치 지정
- 적절한 시간(예: 추적자 흡수 기간이 끝나기 10-15분 전)에 마취 유도 및 PET 이미징에 필요한 모든 마취 장비와 동물 가온 기구를 켭니다. 마취는 98% 산소에서 2.0%-2.5% 이소플루란으로 설정할 수 있습니다(설정은 마우스 균주 및 질병 모델에 따라 다를 수 있음).
- 모든 어댑터와 밸브가 켜져 있고 가스 유량이 0.5-1.0L/min인지 확인합니다. 특정 유속은 마취 시스템과 이미징 시스템에 따라 다를 수 있습니다.
- 적절한 동물(들)을 유도 상자에 넣고 피험자가 올바른 마취 깊이에 도달할 때까지 기다립니다.
- 각 눈에 눈 윤활제 연고를 바릅니다.
- 체중에 따라 적절한 크기의 BCAM으로 마우스를 옮깁니다.
- 목덜미를 잡고 마우스를 부드럽게 잡고 꼬리를 꼬리 슬롯에 삽입한 다음 BCAM 아래로 감쌉니다. 꼬리를 꼬리 플랫폼에 놓고 테이프를 붙여 위치를 고정합니다. 척추가 곧게 펴져 있는지 확인하십시오. BCAM을 부드럽게 닫습니다(그림 2A, B).
- 네 개의 팔다리를 모두 각 BCAM 발 플랫폼에 놓도록 조심스럽게 배치합니다. 필요에 따라 테이프를 사용하여 발을 각 플랫폼에 고정합니다(그림 2B).
- 프론트 엔드를 먼저 삽입하여 BCAM을 이미징 베드 셔틀에 부드럽게 끼웁니다(그림 2C). 셔틀은 이미 마취 흐름이 있는 G8 하역장에 연결되어 있어야 합니다(그림 2D). BCAM 뒷면을 아래로 누르면 딸깍 소리가 나면 G8 셔틀에 고정되었음을 나타냅니다.
알림: 이미징하는 동안 동물이 원하는 마취 평면에 남아 있도록 마취 공급을 유지하십시오.
5. 이미지 획득
- G8 PET 획득 소프트웨어를 엽니다. 스터디 폴더, 스캔 파라미터 및 주제 ID를 미리 생성할 수 있습니다.
- 소프트웨어에 연구 세부 정보를 입력합니다: 마우스 무게, 날짜/시간 및 초기 투여량, 주사 날짜/시간, 잔류 활성 판독값의 날짜/시간 및 양.
- 마우스가 있는 셔틀을 스캐너 구멍에 삽입합니다. 파란색 표시등은 시스템에 제대로 도킹되었음을 나타냅니다.
- 적절한 PET/CT 매개변수를 선택합니다. 이미징 데이터를 수집합니다.
참고: 이 연구에서는 7분 정적 18FPET 스캔을 실행한 후 70초 기본 CT 스캔을 실행하고, 최대 가능성 기대 최대화 3D 재구성 알고리즘(G8 스캐너의 기본 및 유일한 옵션)을 적용하여 데이터12를 재구성했습니다. - 획득이 완료되면 셔틀은 초기 시작 위치로 돌아갑니다. 마우스로 셔틀을 제거하고 도크에 삽입합니다. BCAM 수직 탭의 뒷면을 눌러 G8 셔틀에서 BCAM을 제거하고 마우스로 BCAM을 부드럽게 당겨 제거합니다.
- 두 개의 고정 탭을 눌러 위로 뒤집어 BCAM의 상단을 엽니다.
- 마우스를 조심스럽게 제거합니다. 마우스가 마취에서 완전히 회복되었고 홈 케이지로 돌아가기 전에 밝고 기민하며 반응성(BAR)이 있는지 확인하십시오.
- 설정된 시간 간격으로 절차를 계속하여 전체 코호트/마우스 그룹을 스캔합니다.
6. SaaS에 이미지 업로드
- 로그인하여 app.invivo.ax 하고 프로젝트를 만듭니다.
- 창의 오른쪽 상단에 있는 빨간색 업로드 탭을 클릭합니다. 이미징 연구에 사용되는 이미징 시스템 및 리포터를 선택합니다(예: [18F]FDG). 이미징 데이터가 있는 폴더를 선택합니다.
- 프로젝트 폴더 내의 주석 탭으로 이동합니다. Annotate 를 클릭하여 관련 스캔 정보(피험자 이름, 성별, BCAM 크기, 피험자 체중, 코호트 이름, 시점 및 주입된 투여량)를 추가합니다. 대부분의 메타데이터는 자동으로 채워집니다.
7. 자동화된 데이터 분석
- 프로젝트 폴더 내에서 모든 스캔이 채워져야 합니다. 스캔 을 클릭하여 프로젝트, 그룹 및 개별 주제 수준에서 이동합니다. 오른쪽 상단 모서리에서 분석을 선택합니다.
- 분석 리본 창의 오른쪽 위에 있는 프로젝트에서 더하기 기호를 선택하고 장기 확률 맵 ROI를 선택합니다. OPM(Organ Probability Map)은 미리 정의된 여러 장기와 조직을 포함하는 통계 마우스 장기 지도입니다. 연구 요구 사항에 따라 관심 있는 개별 기관을 선택합니다.
참고: 이 예에서는 VivoQuant를 사용하여 스플라인 도구를 사용하여 수동 분할 및 분석을 수행한 다음 3D ROI 연산자 내에서 보간을 수행했습니다. 자동화된 분석 결과를 벤치마크로 수동 세분화 결과와 비교했습니다.
결과
업로드된 PET 데이터는 SaaS 웹 사이트에서 OPM에 의해 결정된 선택된 장기 ROI와 오버레이된 관상동맥, 시상 및 횡방향 이미지 패널로 볼 수 있습니다(그림 3A). 소프트웨어는 개별 이미지를 로드할 수 있을 뿐만 아니라 그룹 또는 전체 연구의 여러 마우스를 한 번에 축소된 단일 이미지로 볼 수 있습니다. 이 분석 창에는 ROI 색상, 스케일 바 강도 및 기타 공통 매개변수를 사용자 정의할 수 있는 옵션이 있습니다. 이상적인 분석 지표가 선택되면 SaaS는 선택한 장기의 다운로드 가능한 생체 분포 막대 그래프를 생성합니다(그림 3B).
OPM 기반 SaaS 플랫폼의 성능을 평가하기 위해 자동화된 분석 결과를 숙련된 이미징 분석가가 황금 표준으로 도출한 결과와 비교했습니다. Fit 선형 회귀는 뇌, 심장, 신장(오른쪽) 및 비장의 [18F]FDG 흡수 값에 대해 수행되었습니다. 참고로, 이 플랫폼은 골격, 뇌, 방광, 심장, 신장(오른쪽 및 왼쪽), 간, 비장, 폐 및 대퇴사두근(오른쪽 및 왼쪽)을 포함하여 사용자가 선택할 수 있는 포괄적인 장기 목록을 제공합니다. 위의 4개 기관은 이 연구에서 설명 목적으로만 선택되었습니다. 또한, 이식된 종양의 다양한 크기, 모양 및 깊이/위치로 인해 종양은 OPM에 장기로 포함되지 않으므로 이 비교 분석에서 제외됩니다. 그림 4에서 볼 수 있듯이 자동 분석과 수동 분석은 전반적으로 일관된 결과를 산출했으며 뇌가 가장 높은 상관관계를 보였습니다(r2 = 0.8466). 이것은 장기의 크기가 크고 두개골 내에서 뇌의 매우 일정한 위치 때문에 예상됩니다. 우측 신장과 심장도 각각 0.6874와 0.4849의 합리적인r2 값을 보였다. 대조적으로, 비장에 대한 상관 분석은 0.3922의r2 값을 생성했으며, 이는 테스트된 장기 중 가장 낮았습니다. 비장이 췌장과 지방 조직에 중첩되어 있지만 형태가 정의되지 않고 CT에서 동일한 연조직 밀도를 가정하기 때문에 이는 놀라운 일이 아닙니다. 따라서 비장은 수동으로 절단하기 어렵고 OPM은 이 기관을 구분하는 보다 정확한 수단을 제시할 수 있습니다(즉, 황금 표준을 능가함). 이러한 상관 관계 분석의 기울기 및 Y-절편도 그림 4에 나와 있습니다. r2 값과 일치하게, 뇌는 1에 가장 가까운 기울기(즉, OPM과 수동 결과 간의 완벽한 상관관계)와 가장 작은 Y절편(즉, 최소 전신 편향)을 보인 반면, 다른 기관은 완벽한 상관관계에서 더 크고 가변적인 편차를 보였습니다.

그림 1: BCAM 및 템플릿 유도 종양 이식. (A) 프리 클립(1)은 연결된 마취 라인(3)으로 BCAM 몰드(2)의 바닥 부분에 부착됩니다. 이것은 종양 이식 기초 역할을 합니다. (B) 대상 임플란트 부위(이 경우 오른쪽 어깨)를 면도한 마우스를 세포 주입 전에 마취 하에 베이스에 놓습니다. (C) 종양 이식 템플릿 (4) 종양 세포 접종의 배치를 안내하기 위해 사전 정의된 컷아웃이 있습니다. (D) 마우스의 등쪽에 배치된 템플릿 몰드로 세포 주입 전에 임시 참조 표시를 만드는 것. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
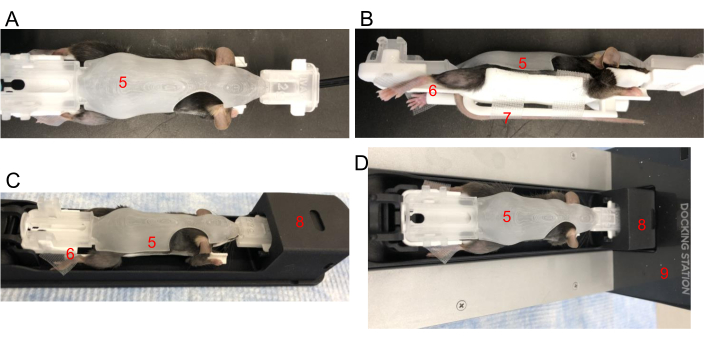
그림 2: BCAM에서 마우스 위치 지정. (A) 평면도 - 적절한 크기의 BCAM(5)에 마우스를 꼭 맞게 놓습니다. (B) 측면 보기 - 테이프는 뒷발을 플랫폼에 고정하는 데 사용됩니다(6). 꼬리는 마우스 바로 아래에 있는 꼬리 플랫폼(7)에 테이프로 고정됩니다. (C) BCAM의 마우스가 이미징 셔틀(8)에 삽입됩니다. (D) 마우스, BCAM 및 셔틀은 마취 작동 도킹 스테이션(9)에 연결됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
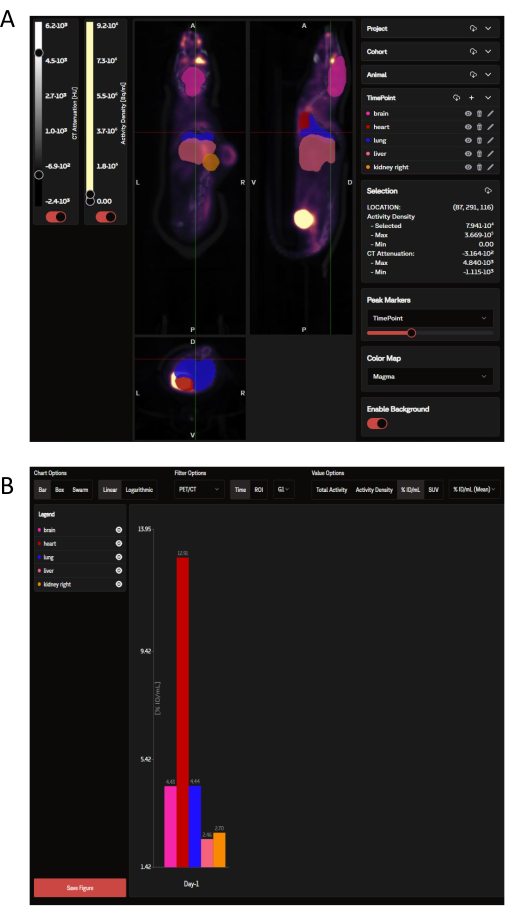
그림 3: SaaS 도구에서 각각 보고 분석한 대표 이미지 및 데이터 출력. (A) SaaS 웹 사이트에서 볼 수 있는 대표 이미지. OPM(Organ Probability Map)에서 선택한 장기 ROI와 오버레이된 PET/CT 이미지의 관상, 시상 및 횡방향 보기. 분홍색: 뇌; 빨간색: 심장; 진한 파란색 : 폐; 연어 : 간; 주황색: 신장(오른쪽). 종양은 OPM에 의해 정의되지 않습니다. (B) 자동화된 분석에서 생성된 대표적인 다운로드 가능한 그래프. 선택한 장기 목록은 왼쪽 상단 패널에서 볼 수 있습니다. 여기의 데이터는 %ID/mL로 보고됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
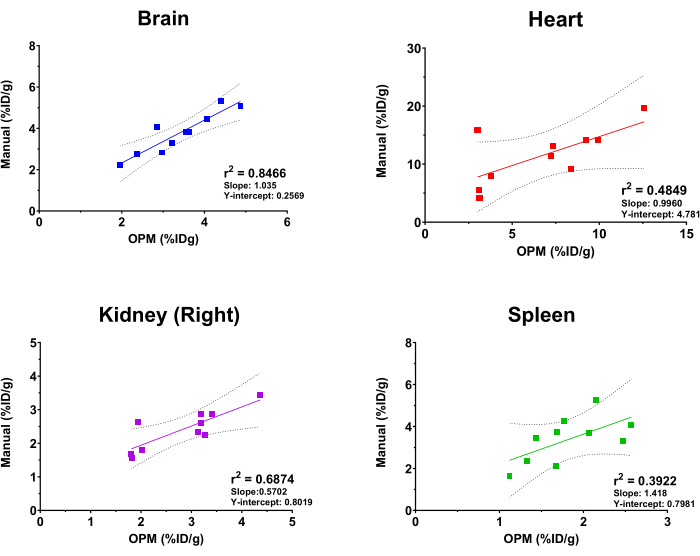
그림 4: 수동 분석과 OPM 기반 자동화 워크플로우에서 도출된 장기 [18F]FDG 흡수 값을 비교한 선형 회귀 분석. 암컷 C57BL/6 마우스에 대한 10개의 PET/CT 스캔이 사용되었습니다. r2 값, 95% 신뢰선, 기울기 및 Y 절편이 표시된 각 기관에 대한 그래프에 표시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
본 보고서는 BCAM 금형을 사용하여 마우스 생체 내 PET 이미징을 수행하고 자동화된 SaaS 도구로 데이터를 분석하는 절차를 설명합니다. 마우스 준비, 이미징 획득 및 데이터 처리에 대한 단계별 지침이 제공됩니다. 이 자동화 워크플로우는 또한 수동 분석과 일치하는 데이터를 생성했습니다. 몇 가지 주요 기술 고려 사항이 아래에 강조 표시되어 있습니다.
종양은 OPM에 의해 정의된 기관 중 하나가 아니지만, 이 프로토콜의 중요한 단계는 궁극적으로 체강과 BCAM 내의 모든 마우스 장기의 최적 정렬을 보장하기 위해 피하 종양을 적절하게 이식하는 것입니다. OPM은 마우스의 척추가 비교적 곧게 펴고 내부 장기가 중립적으로 위치할 때만 정확한 데이터를 생성할 수 있습니다. 종양이 너무 크거나 잘못 배치되면 쥐의 자세에 영향을 미치고 체강을 눌러 내부 장기를 이동시킬 수 있습니다. 이러한 변화는 차례로 OPM 알고리즘의 정량적 분석 결과를 왜곡합니다. 다른 사람들은 다양한 영상 양식과 세분화 알고리즘을 사용하여 곧지 않은 척추가 내부 장기의 정렬에 미치는 영향을 보고했습니다13,14. 따라서 템플릿을 사용하여 종양 이식을 안내하고 종양 성장을 면밀히 모니터링하여 종양이 적절한 위치에 있고 이상적인 크기 범위에 있는지 확인하는 것이 중요합니다.
편차가 발생할 수 있는 또 다른 영역은 적절한 크기의 BCAM을 선택하는 것입니다. BCAM은 18-26g 범위의 2g 적분으로 생성됩니다. 그러나 신체 구성이 다른 마우스(예: 더 많은 근육 대 더 많은 지방)를 가진 마우스는 체중은 같지만 신체 크기가 다를 수 있으므로 체중을 일반적인 기준으로 사용하면서 가장 적합한 BCAM을 선택하는 것이 중요합니다. 시행착오를 통해 레벨을 올리거나 낮추고, 적절한 정렬이 중요하다는 점을 명심하십시오. 너무 큰 BCAM을 선택하면 마우스의 내부 장기가 침대 바닥에 더 가깝게 '가라앉게' 되며, 이는 특히 신장 및 척추와 같은 등쪽 장기에 대한 분석 정확도에 영향을 미칩니다. 대조적으로, 너무 작은 BCAM에 마우스를 배치하면 체강을 누르고, 장기 위치를 왜곡하고, 잠재적으로 호흡에 어려움을 겪을 수 있습니다. 테이프를 사용하여 팔다리가 발 플랫폼에 고정되었는지 확인하면 설정 및 위치 지정에 도움이 됩니다.
이 보고된 워크플로우를 통해 표준화되고 자동화된 PET 이미지 분석이 가능하지만, 현재 OPM은 면역 능력이 있는 C57BL/6 마우스 균주와 건강한 마우스를 기반으로 구성되었다는 점을 지적할 가치가 있습니다. 마우스의 다른 균주 및 건강 상태는 알고리즘의 추가 조정, 최적화 및 검증이 필요한 다른 해부학적 특징을 나타낼 수 있습니다. 예를 들어, NSG 또는 NCG와 같은 면역 결핍 균주는 비장이 더 작습니다. 마찬가지로, 정소성 종양 보형물을 이식한 마우스는 질병 상태에 따라 내부 장기의 크기, 모양 및 위치가 다를 수 있습니다. 이 워크플로우의 또 다른 한계는 실험의 수집 단계 동안의 전체 처리량입니다. 이는 주로 BCAM에서 마우스를 올바르게 설정하는 데 필요한 추가 시간 때문입니다. 교육과 연습은 적절한 배치에서 작업자의 효율성을 높일 수 있습니다. 두 번째 도킹 스테이션을 추가하면 전체 처리량을 늘릴 수도 있으며, 한 도크는 BCAM 설정을 위해 제공하고 다른 도크는 마우스를 복구 케이지로 제거하는 데 사용할 수 있습니다. 그럼에도 불구하고 스캔 전에 BCAM을 설정하는 데 필요한 시간이 늘어나더라도 데이터 분석 측면에서 시간을 절약하여 시간 투자가 결실을 맺습니다. 예를 들어, 본 연구에서는 OPM이 10개의 이미지(4개의 ROI 포함)를 분석하는 데 10분도 채 걸리지 않은 반면, 고도로 숙련된 분석가가 동일한 이미지 및 ROI 세트를 수동으로 분류하고 분석하는 데 3-4시간이 걸렸습니다. 경험이 부족한 분석가는 수동 분석에 훨씬 더 많은 시간을 할애해야 합니다. SaaS 플랫폼을 사용하면 PET 스캔을 대량으로 분석할 수 있으며, 데이터 업로드 후 몇 분 이내에 완전한 생체 내 분포 분석을 완료할 수 있습니다. 이는 아래에서 설명하는 것처럼 여러 그룹 및/또는 여러 시점에 걸쳐 많은 양의 데이터를 처리할 때 매우 유용한 기능입니다.
단일 피험자에 대한 장기 수동 분할은 시간이 많이 소요될 수 있으며 일반적으로 작업자의 상당한 사전 교육이 필요합니다. 적절한 교육이 있더라도 수동 분석은 필연적으로 작업자 간 변동성에 직면하게 되며, 이로 인해 정량적 결과가 왜곡될 수 있습니다15,16. 반면, 자동화된 세분화 및 데이터 분석은 방사성 추적자의 전반적인 생체 분포를 정확하고 효율적으로 결정하고 인간 작업에 뿌리를 둔 변동성을 제거할 수 있습니다. 이러한 자동화의 이점은 임상 이미지 분석과 전임상 공간 모두에서 볼 수 있습니다. 예를 들어, Sluis 등은 단일 스캔으로 관심 기관을 분할하는 데 4시간이 소요되는 반면, AI 클라우드 기반 방법에서는 30분이 소요된다는 것을 입증했습니다17. Nazari 등의 또 다른 연구에서도 간과 신장에 대한 알고리즘 기반 분석에서 두 명의 인간 의학 물리학자와 비교했을 때 7.0% 이내의 정확한 결과를 보여주었다고 보고했습니다18. 그림 4의 데이터는 또한 SaaS 기반 PET 이미징 분석 워크플로우의 신뢰성을 명확하게 보여주었으며, 자동 분석이 수동 분석과 비교할 때 일관된 결과를 산출한다는 것을 보여주었습니다.
요약하면, 이 기사에서는 BCAM 금형을 사용하여 표준화된 전임상 PET/CT 이미지 획득과 SaaS 지원 자동 PET 데이터 분석을 용이하게 하는 워크플로를 설명합니다. 이 플랫폼 기술은 채택하기가 비교적 간단하고 자동화로 생성된 데이터의 품질은 수동 분석과 일치하지만 상당한 시간 절약 이점을 자랑한다는 것이 입증되었습니다. 따라서 이 워크플로우는 연구원의 데이터 분석 시간을 수백 시간 절약하고 표준화하고 작업자 간 변동성을 줄이는 데 도움이 될 수 있습니다. 이 절차는 양상과 적응증에 걸쳐 다양한 약물 화합물을 개발하는 데 도움이 될 수 있습니다. 특히, 치료용 항체, 이중 특이적 항체 면역 세포 결합체, 항체-약물-접합체 및 심지어 나노 입자와 같은 거대 분자 양식은 방사성 금속(예: Zr-89, Cu-64)으로 쉽게 표지하여 PET 이미징 매개 생체 내 분포 평가를 가능하게 할 수 있습니다19,20. 마찬가지로, 이 플랫폼 기술은 마우스21에서 새로운 무선 치료제의 선량 측정을 결정하는 데 도움이 될 수 있습니다. 이 절차의 적용은 약물 개발에 큰 가치를 더할 것입니다.
공개
모든 저자는 Pfizer, Inc.의 현재 또는 과거 직원입니다.
감사의 말
Pfizer La Jolla Comparative Medicine Research and Technical 직원에게 특별한 감사를 드립니다.
자료
| Name | Company | Catalog Number | Comments |
| [18F]FDG | PETNet Solutions, Culver City, CA | NA | Radiotracer used for PET imaging |
| 27 G needle | Becton, Dickinson and Company, San Diego, CA | 305136 | Used for cell injection |
| app.invivo.ax/login | Invivo Analytics, Seattle, WA | NA | Software as a Service webpage |
| Body Conforming Animal Molds | Invivo Analytics, Seattle, WA | NA | BCAMs with weight range of 18 - 26 g |
| Dose Calibrator; CRC-55tw | Capintec, Florham Park, NJ | CRC-55tw | Measurement of radioactive doses |
| G8 PET/CT scanner | Sofie Biosciences/Xodus Imaging, Torrence, CA | NA | Benchtop scanner with loading dock |
| G8-Docking station | Sofie Biosciences/Xodus Imaging, Torrence, CA | NA | Docking station for staging |
| Implantation Mold Template | Invivo Analytics, Seattle, WA | NA | Template for optimal tumor implantation |
| Lubricant eye ointment | BAUSCH & LOMB, Ontario, Canada | Soothe Nighttime | Eye lube for mice |
| Modified G8 shuttle | Invivo Analytics, Seattle, WA | NA | Shuttle for BCAM accommodation |
| Mouse anesthesia Induction box | Patterson Scientific, Waukesha, WI | 78933388 | Used for anesthetizing a mouse |
| PRE-Clip | Invivo Analytics, Seattle, WA | NA | BCAM adapter for anesthesia connection |
| Premiere Slide warmer | LabScientific, Danvers, MA | XH-2001 | Adjustable temp warmer used for tail vein dilation and anesthesia induction |
| Syringe (1 mL) | Becton, Dickinson and Company, San Diego, CA | 309659 | Used for cell injection |
| Tail Vein injection platform | Braintree Scientific, Pembroke, MA | IL-300 | Restrainer used for administering intravenous injections. |
| Vivoqaunt Software | Invicro, Needham, MA | NA | Software used for manual segmentation |
참고문헌
- Huang, R., Wang, M., Zhu, Y., S Conti, P., Chen, K. Development of pet probes for cancer imaging. Curr Top Med Chem. 15 (8), 795-819 (2015).
- Schwenck, J., et al. Advances in pet imaging of cancer. Nat Rev Cancer. 23 (7), 474-490 (2023).
- Matthews, P. M., Rabiner, E. A., Passchier, J., Gunn, R. N. Positron emission tomography molecular imaging for drug development. Br J Clin Pharmacol. 73 (2), 175-186 (2012).
- Tavaré, R., et al. An effective immuno-pet imaging method to monitor CD8-dependent responses to immunotherapy. Cancer Res. 76 (1), 73-82 (2016).
- Maresca, K. P., et al. Preclinical evaluation of 89ZR-DF-IAB22M2C PET as an imaging biomarker for the development of the gucy2c-cd3 bispecific pf-07062119 as a t-cell engaging therapy. Mol Imaging Biol. 23 (6), 941-951 (2021).
- Nisnboym, M., et al. Immuno-pet imaging of cd69 visualizes t-cell activation and predicts survival following immunotherapy in murine glioblastoma. Cancer Res Commun. 3 (7), 1173-1188 (2023).
- Lee, C., et al. Efficacy and imaging-enabled pharmacodynamic profiling of Kras g12c inhibitors in xenograft and genetically engineered mouse models of cancer. Mol Cancer Ther. 22 (7), 891-900 (2023).
- Bollineni, V., Kramer, G., Jansma, E. P., Liu, Y., Oyen, W. J. A systematic review on [18f] flt-pet uptake as a measure of treatment response in cancer patients. Eur J Cancer. 55, 81-97 (2016).
- Everitt, S., et al. Imaging cellular proliferation during chemo-radiotherapy: A pilot study of serial 18f-flt positron emission tomography/computed tomography imaging for non-non-small-cell lung cancer. Int J Radiat Oncol Biol Phys. 75 (4), 1098-1104 (2009).
- Rashidian, M., et al. Predicting the response to CTLA-4 blockade by longitudinal non-invasive monitoring of cd8 t cells. J Exp Med. 214 (8), 2243-2255 (2017).
- Klose, A. D., Paragas, N. Automated quantification of bioluminescence images. Nat Commun. 9 (1), 4262 (2018).
- Gu, Z., et al. Performance Evaluation of G8, a high-sensitivity benchtop preclinical PET/CT Tomograph. J Nucl Med. 60 (1), 142-149 (2019).
- Bongratz, F., Rickmann, A. -. M., Wachinger, C. Abdominal organ segmentation via deep diffeomorphic mesh deformations. Sci Rep. 13 (1), 18270 (2023).
- Wang, H., Stout, D. B., Chatziioannou, A. F. Mouse atlas registration with non-tomographic imaging modalities-a pilot study based on simulation. Mol Imaging Biol. 14, 408-419 (2012).
- Montgomery, M. K., et al. Mouse lung automated segmentation tool for quantifying lung tumors after micro-computed tomography. PLoS One. 16 (6), e0252950 (2021).
- Montgomery, M. K., et al. Applying deep learning to segmentation of murine lung tumors in preclinical micro-computed tomography. Transl. Oncol. 40, 101833 (2024).
- Van Sluis, J., et al. Manual versus artificial intelligence-based segmentation as a pre-processing step in whole-body pet dosimetry calculations. Mol Imaging Biol. 25 (2), 435-441 (2023).
- Nazari, M., et al. Automated and robust organ segmentation for 3D-based internal dose calculation. EJNMMI Res. 11, 1-13 (2021).
- Goel, S., England, C. G., Chen, F., Cai, W. Positron emission tomography and nanotechnology: A dynamic duo for cancer theranostics. Adv Drug Deliv Rev. 113, 157-176 (2017).
- Campbell, D. O., et al. Preclinical evaluation of an anti-nectin-4 immunopet reagent in tumor-bearing mice and biodistribution studies in cynomolgus monkeys. Mol Imaging Biol. 18, 768-775 (2016).
- Bednarz, B., et al. Murine-specific internal dosimetry for preclinical investigations of imaging and therapeutic agents. Health Phys. 114 (4), 450-459 (2018).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유