Method Article
وضع العلامات الطرفية الفلورية وتغليف الحمض النووي الريبي الطويل للفحص المجهري أحادي الجزيء FRET-TIRF
In This Article
Summary
تصف هذه المقالة وضع العلامات ثنائية اللون للحمض النووي الريبي الطويل في مواضع النهاية وتثبيت سطحها عن طريق التغليف في حويصلات الفوسفوليبيد لتطبيقات الفحص المجهري أحادي الجزيء FRET TIRF. يتيح الجمع بين هذه التقنيات التصور الدقيق وتحليلا لديناميكيات الحمض النووي الريبي على مستوى الجزيء الفردي.
Abstract
يتفوق نقل طاقة الرنين Förster أحادي الجزيء (smFRET) في دراسة الجزيئات الحيوية الديناميكية من خلال السماح بالملاحظة الدقيقة لتغييراتها التوافقية بمرور الوقت. لمراقبة ديناميكيات الحمض النووي الريبي باستخدام smFRET ، قمنا بتطوير طريقة لتسمية الحمض النووي الريبي تساهميا في محوطتها باستخدام زوج من الفلوروفورات FRET. تستهدف استراتيجية وضع العلامات النهائية المباشرة هذه تنشيط 5'-phosphate بواسطة carbodiimide (EDC) / N-hydroxysuccinimide (NHS) و 3'-ribose عن طريق أكسدة دورية ، والتي يمكن تكييفها مع الحمض النووي الريبي الأخرى بغض النظر عن حجمها وتسلسلها لدراستها بشكل مستقل عن التعديلات الاصطناعية. علاوة على ذلك ، فإن تنشيط 5'-EDC / NHS له أهمية عامة لجميع الأحماض النووية التي تحتوي على 5'-فوسفات. يلغي استخدام المواد الكيميائية المتاحة تجاريا الحاجة إلى تصنيع مجسات خاصة بالحمض النووي الريبي.
يتطلب الفحص المجهري للانعكاس الداخلي الكلي (TIRF) أن تكون الجزيئات السطحية ذات الأهمية داخل المجال الزائل. تتمثل إحدى الطرق المتطورة للحفاظ على جزيئات الحمض النووي الريبي داخل المجال الزائي في تغليفها في حويصلات الفوسفوليبيد. يستفيد التغليف من أفضل ما في العالمين ، حيث يربط الجزيء بالسطح مع تمكين الانتشار الحر للجزيء. نحن نضمن أن كل حويصلة تحتوي على جزيء RNA واحد فقط ، مما يتيح التصوير أحادي الجزيء. عند وضع العلامات المزدوجة وتغليف الحمض النووي الريبي ذي الأهمية ، تقدم قياسات smFRET عرضا ديناميكيا ومفصلا لسلوك الحمض النووي الريبي.
Introduction
Förster Resonance Energy Transfer (FRET) هي تقنية قوية وحساسة لدراسة التفاعلات بين الجزيئات الحيوية وداخلها للجزيئات الحيوية على نطاق النانو. يعتمد على نقل الطاقة غير الإشعاعية من جزيء متبرع متحمس إلى جزيء متقبل قريب ، والذي يحدث عبر مسافات تتراوح عادة بين 1 نانومتر و 10 نانومتر. تحدد المسافة بين الأصباغ المانحة والمتقبلة كفاءة نقل الطاقة هذا ، مما يجعل FRET أداة لا تقدر بثمن لدراسة الديناميكيات الجزيئية والتغيرات التوافقية والتفاعلات في مجموعة واسعة من الأنظمة البيولوجية1،2 ، بما في ذلك الحمض النووي الريبي. أثبت الفحص المجهري للانعكاس الداخلي الكلي (TIRF) أنه تقنية قوية لتحقيقات smFRET ، لأنه يضيء بشكل انتقائي الجزيئات بالقرب من السطح فقط ، مما يسمح بديناميكيات FRET للجزيئات الفردية بدقة مكانية وزمانية عالية. ومع ذلك ، قبل إجراء تجارب smFRET-TIRF ، يجب أولا تصنيف الجزيء محل الاهتمام بالفلورسنت بزوج FRET مناسب ثم تثبيته على سطح الفحص المجهري. تم التحقق من صحة بروتوكول smFRET-TIRF الموصوف هنا باستخدام النوع البري من المجموعة الثانية إنترون Sc.ai5γ من خميرة الخميرة المخيرقة الميتوكوندريا ، محاطا بتسلسلين خارجيين (915 نيوكليوتيد)3. للحصول على عرض أكثر تفصيلا لإنترونات المجموعة الثانية لوضع العلامات الفلورية وتثبيتها للفحص المجهري smFRET TIRF ، راجع مراجعتنا4.
ستسمح استراتيجية وضع العلامات المثالية على الحمض النووي الريبي الخاصة بالموقع بالدمج الدقيق للأصباغ المانحة والمتقبلة في مواضع محددة مسبقا دون تغيير بنية الحمض النووي الريبي أو وظيفته ، مما يضمن قياسات FRET دقيقة وفعالة. هذا يمثل تحديا بسبب أوجه التشابه الكيميائية بين القواعد النووية الأربعة ، مما يعقد وضع العلامات الانتقائي. يربط وضع العلامات النهائية الأصباغ المانحة والمتقبلة على نهايات الحمض النووي الريبي من خلال استهداف 5'-فوسفات و 3'-الريبوز. يقدم هذا النهج نهجا طفيفا التوغل مع الاستمرار في تقديم رؤى قيمة حول الديناميكيات والتفاعلات الهيكلية. تقيد قدرة الإنترون من المجموعة الثانية على لصق ذاتي في وجود Mg2+ استخدام الإنزيمات المعتمدة على أيونات المعادن. هنا ، نقدم نهجا للحمض النووي الريبي الطويل والنشط تحفيزيا (الريبوزيمات) المزدوج الذي يتجاوز الحاجة إلى الإنزيمات أو تخليق المجسات المتخصصة.
تتمثل إحدى الطرق الشائعة لربط جزيئات الحمض النووي الريبي بالسطح للفحص المجهري TIRF في ربط جزء من البيوتين تساهميا مباشرة بالحمض النووي الريبي أو تهجين قليل النوكليوتيد المضاد للمعنى الحامل للبيوتين (ASO) 5،6،7. ومع ذلك ، يمكن أن تؤدي طريقة الشلل المباشر هذه إلى إدخال القطع الأثرية بسبب تفاعلات سطح الحمض النووي الريبي ، مما قد يؤدي إلى خلل في الطي في الحمض النوويالريبي 8. يتمثل الحل الأنيق للتخفيف من هذه القطع الأثرية للتثبيت في تغليف الحمض النووي الريبي في حويصلات الفوسفوليبيد النانوية المتصلة بالسطح9،10،11. هذه الحويصلات ، التي يبلغ قطرها حوالي 100 نانومتر ، مثبتة على السطح من خلال ارتباط البيوتين والستربتافيدين12،13،14 ، مما يسمح للحمض النووي الريبي بالانتشار بحرية في الداخل مع السماح بتبادل الأيونات عبر الغشاء الدهني10. بعد وضع العلامات التساهمية على الحمض النووي الريبيالوظيفي الكبير 3 ، نقدم نهجا لتغليف هذه الحمض النووي الريبي في حويصلات الفوسفوليبيد من خلال الجمع بين البروتوكولات المعمول بها لتخميل السطح وتغليف الحويصلة ، والتي تم تكييفها للحفاظ على وظيفة الحمض النوويالريبي 10،11،14. يحقق نهج وضع العلامات والتغليف ثنائي الطرف هذا معدلا عاليا من التغليف الأحادي للحمض النووي الريبي الوظيفي للفحص المجهري smFRET TIRF.
Protocol
1. وضع العلامات المزدوجة على نهاية الحمض النووي الريبي
ملاحظة: يصف البروتوكول التالي وضع العلامات الخاصة بالموقع للحمض النووي الريبي مع زوج من الفلوروفورات FRET عن طريق الربط التساهمي لصبغة مانحة (sCy3) ب 5'-phosphate وصبغة متقبل (Cy5) إلى 3'-ريبوز. يتم اختيار الحمض النووي الريبي الطويل النشط تحفيزيا ، وهو ريبوزيم الإنترون من المجموعة الثانية ، باعتباره الحمض النووي الريبي محل الاهتمام. يلخص الجدول 1 والشكل 1 بروتوكول وضع العلامات ثنائي الطرف هذا. قم بتنفيذ جميع الخطوات التي تنطوي على الفلوروفورات في ظل الظروف المظلمة.
| اليوم 0 | ▪ Aliquot 50-75 ميكروغرام من الحمض النووي الريبي إلى حجم إجمالي يبلغ 55 ميكرولتر لكل أنبوب 1.5 مل. | |||||
| اليوم 1 | 5 ′-تنشيط الفوسفات | |||||
| ▪ أضف 45 ميكرولتر من محلول EDC-NHS المحضر حديثا ، ومحلول الأس الهيدروجيني 6.0 إلى الحمض النووي الريبي في ddH2O إلى حجم نهائي قدره 100 ميكرولتر ، واخلطه جيدا واحتضنه لمدة 4 ساعات عند 25 درجة مئوية و 500 دورة في الدقيقة. | ||||||
| ▪ جولة التنقية 1: هطول الأمطار بين عشية وضحاها. | ||||||
| اليوم 2 | ▪ قم بترسيب الحمض النووي الريبي المنشط 5 واغسله وجففه. | |||||
| 5 ′-مرفق الصبغة | ||||||
| ▪ أعد التعليق في 95 ميكرولتر من 100 ملي مولار MOPS ، درجة الحموضة 7.5. | ||||||
| ▪ أضف 5 ميكرولتر من محلول صبغة يعمل بأمين 2 ملي. | ||||||
| ▪ تخلط جيدا وتحتضن لمدة 16 ساعة عند 25 درجة مئوية و 500 دورة في الدقيقة. | ||||||
| اليوم 3 | ▪ جولة التنقية 2: هطول الأمطار EtOH. | |||||
| يوم 4 | ▪ قم بترسيب الحمض النووي الريبي المنشط 5 واغسله وجففه. | |||||
| خطوة الحظر | ||||||
| ▪ أعد التعليق في 100 ميكرولتر من 100 ملي مولار Tris-HCl ، درجة الحموضة 7.5 ، واحتضن لمدة ساعتين عند 25 درجة مئوية و 500 دورة في الدقيقة. | ||||||
| ▪ جولة التنقية 3: ترشيح الطرد المركزي. | ||||||
| → قم بإزالة الحمض النووي الريبي المسمى 5. | ||||||
| اليوم 5 | 3 ′ - أكسدة دورية | |||||
| ▪ احتضان الحمض النووي الريبي ب 20 ملي مولار NaIO4 في 50 ملي مولار NaOAc ، ودرجة الحموضة 5.5 في حجم نهائي يبلغ 100 ميكرولتر لمدة ساعتين عند 25 درجة مئوية و 500 دورة في الدقيقة. | ||||||
| ▪ اروي الفترات الزائدة: أضف 30 ميكرولتر من 50٪ جلسرين ، واخلطها جيدا ، واحتضنها لمدة 30 دقيقة عند 25 درجة مئوية و 500 دورة في الدقيقة. | ||||||
| ▪ جولة التنقية 4: هطول الأمطار بين عشية وضحاها. | ||||||
| يوم 6 | ▪ قم بترسيب الحمض النووي الريبي المؤكسد 3 واغسله وجففه. | |||||
| 3 ′-مرفق الصبغة | ||||||
| ▪ يعاد تعليقه في 95 ميكرولتر من 50 ملي NaOAc ، درجة الحموضة 6.0. | ||||||
| ▪ أضف 5 ميكرولتر من محلول صبغة وظيفي بالهيدرازيد 2 ملي. تخلط جيدا وتحتضن لمدة 16 ساعة عند 25 درجة مئوية و 500 دورة في الدقيقة. | ||||||
| اليوم 7 | ▪ جولة التنقية 5: هطول الأمطار EtOH. | |||||
| يوم 8 | ▪ قم بترسيب الحمض النووي الريبي المسمى واغسله وجففه. | |||||
| ▪ ترشيح الطرد المركزي. | ||||||
| → قم بإزالة الحمض النووي الريبي المسمى ثنائي النهاية. | ||||||
الجدول 1: ملخص البروتوكول لوضع العلامات على الحمض النووي الريبي ثنائي النهاية. الرجاء النقر هنا لتنزيل هذا الجدول.
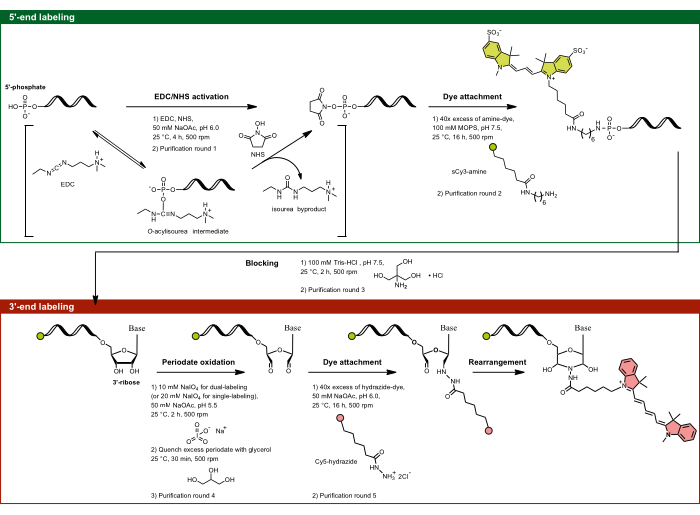
الشكل 1: التدفق التجريبي لوضع العلامات المزدوجة من خلال استهداف سكر الريبوز 5 '-فوسفات و 3'-الريبوز. يتم تنشيط 5'-fosat باستخدام EDC في وجود NHS ويقترن لاحقا بالصبغة الوظيفية بالأمين. يتأكسد جزء 3'-diol من الحمض النووي الريبي عن طريق نشاط الدوري إلى ثنائي الديهايد ، والذي يتفاعل بشكل أكبر مع الصبغة الوظيفية بالهيدرازيد. بالنسبة لوضع العلامات المزدوجة ، من المهم أن تبدأ بوضع العلامات 5 'لمنع وضع العلامات المتقاطعة ، متبوعا بوضع العلامات 3 بوصات مع خطوة حظر وسيطة. الاختصارات: EDC = carbodiimide; NHS = N-hydroxysuccinimide ؛ MOPS = 3-مورفولينوبروبان-1-حمض السلفونيك; NaOAc = أسيتات الصوديوم. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
- وضع العلامات على 5 '-end: استهداف 5'-phosphate عن طريق تنشيط EDC / NHS
ملاحظة: لا تنطبق طريقة وضع العلامات هذه على الحمض النووي الريبي فحسب ، بل تنطبق على أي حمض نووي أحادي الشريطة يحتوي على 5 '-فوسفات. تخضع خصوصية التفاعل للاعتماد على الأس الهيدروجيني ، مما يسمح فقط باستهداف 5'-فوسفات على وجه التحديد ، على الرغم من وجود فوسفات متعدد في العمود الفقري للحمض النووي الريبي. عند الرقم الهيدروجيني 6.0 ، يرجع التفاعل الفريد للفوسفات 5'-fosat تجاه الكربوديميدات إلى حالة البروتونات المحددة ، حيث يتم إزالة البروتونات من الأكسجين ، ويظل أحدهما بروتونيا. هذا يجعل الفوسفات 5 'تفاعلي ، بينما يظل فوسفات العمود الفقري منزوع البروتون بالكامل غير متفاعل ، مما يتيح وضع العلامات الانتقائية للطرف 5 'عبر استهداف EDC / NHS.- تحضير EDC-NHS-NaOAc ، محلول الأس الهيدروجيني 6.0. امزج 1.5 مجم من EDC و 2.0 مجم من NHS لكل حصة في 35 ميكرولتر من ddH2O و 10 ميكرولتر من 0.5 M NaOAc ، الرقم الهيدروجيني 6.0 (الرقم الهيدروجيني المعدل بحمض الخليك الجليدي).
- Aliquot الحمض النووي الريبي محل الاهتمام ليكون لديه ما يقرب من 50-75 ميكروغرام من الحمض النووي الريبي لكل أنبوب في 55 ميكرولتر من ddH2O. أضف 45 ميكرولتر من خليط EDC-NHS-NaOAc ، ودرجة الحموضة 6.0 إلى الحمض النووي الريبي ، ليصل الحجم الإجمالي إلى 100 ميكرولتر مع التركيزات النهائية 78 ملي مولار EDC ، و 174 ملي مولار NHS ، و 50 ملي NaOAc ، الرقم الهيدروجيني 6.0. احتضان لمدة 4 ساعات عند 25 درجة مئوية أثناء الاهتزاز عند 500 دورة في الدقيقة.
ملاحظة: هنا ، 70 ميكروغرام يتوافق مع 250 ميكروغرام من 915 nt RNA المنسوخ في المختبر و 2.5 ميكرومتر في حجم التفاعل النهائي البالغ 100 ميكرولتر. - جولة التنقية 1: تنقية الحمض النووي الريبي المنشط بالفوسفات 5 بوصات عن طريق ترسيب EtOH.
- تحضير محلول أمين السيانين 3 السلفوني 2 ملي مولار (sCy3-amine) في الماء.
- أعد تعليق حبيبات الحمض النووي الريبي المنشط في 95 ميكرولتر من 100 ملي مولار 3-مورفولينوبروبان-1-حمض السلفونيك (MOPS) ، درجة الحموضة 7.5 (الأس الهيدروجيني المعدل باستخدام هيدروكسيد الصوديوم). أضف 5 ميكرولتر من محلول 2 ملي مولار sCy3-amine إلى الحمض النووي الريبي المنشط. قم بإقران الفلوروفور بالفوسفات 5 'المنشط عن طريق الحضانة لمدة 16 ساعة عند 25 درجة مئوية ، مع الاهتزاز عند 500 دورة في الدقيقة.
ملاحظة: قم بتخزين المخزن المؤقت للمساتير ومكونات المشغل (MOPS) عند 4 درجات مئوية في الظلام. يتم اختيار هيدروكسيد الصوديوم لتعديل الأس الهيدروجيني للحفاظ على ريبوزيم إنترون المجموعة الثانية غير نشط. يجب أن يكون الفلوروفور زائدا بمقدار 40 ضعفا على الأقل من الحمض النووي الريبي. - جولة التنقية 2: قم بزيادة الحجم عن طريق إضافة 200 ميكرولتر من ddH2O لتحسين الفصل. قم بتنقية الحمض النووي الريبي المسمى 5 بوصات من الفوسفات عن طريق ترسيب EtOH وكرر ذلك حتى يصبح المادة الطافية عديمة اللون (عادة ما تكون هناك حاجة إلى جولتين).
- خطوة الحظر: أعد تعليق الحمض النووي الريبي في 100 ميكرولتر من 100 ملي مولار Tris-HCl ، درجة الحموضة 7.5 ، واحتضانه لمدة ساعتين عند 25 درجة مئوية و 500 دورة في الدقيقة. بالنسبة إلى وضع العلامات أحادية الطرف ذات 5 's فقط ، تخطي خطوة الحظر ، وأعد تعليق RNA في ddH2O ، وتابع الخطوة 1.1.8. ومع ذلك، من أجل البساطة، إذا كانت التسمية المزدوجة، فقم بفصل عنصر التحكم أحادي التسمية 5's فقط بعد الخطوة 1.1.9.
ملاحظة: تعمل هذه الخطوة على منع الفوسفات المنشط 5 'التي لم يتم ربطها بالفلوروفور الوظيفي بالأمين من خلال التفاعل مع مصدر أمين أولي أصغر نسبيا (على سبيل المثال ، Tris) لتقليل مخاطر وضع العلامات المتقاطعة مع الفلوروفور الوظيفي بالهيدرازيد المستخدم في بروتوكول وضع العلامات 3'. - جولة التنقية 3: قم بإزالة الأصباغ الحرة عن طريق غسل الحمض النووي الريبي المسمى عن طريق ترشيح الطرد المركزي بإجمالي 10 مل على الأقل من ddH2O ، ثم قم بإزالتها في ddH2O.
ملاحظة: يجب أن يكون القطع الجزيئي للمرشح أقل من نصف حجم الحمض النووي. يمكن استخدام المخزن المؤقت المفضل بدلا من ddH2O. يجب أن يتبع Elution تعليمات الشركة المصنعة ، مما يضمن عدم تدوير العينة حتى الجفاف الكامل. - تحديد الحمض النووي الريبي وتركيزات الصبغة المترافقة عن طريق التحليل الطيفي للأشعة فوق البنفسجية.
- وضع العلامات 3 '-end: استهداف 3'-ribose عن طريق أكسدة الدورة الدورية
- Aliquot الحمض النووي الريبي المسمى 5 'في ddH2O ليحتوي على ما يقرب من 50-75 ميكروغرام من الحمض النووي الريبي لكل أنبوب في 90 ميكرولتر. إذا كان حجم الشطف للخطوة السابقة مرتفعا ، مما أدى إلى تركيز منخفض ، فقم بتركيز الحمض النووي الريبي عن طريق ترسيب الحبيبات وإعادة تعليقها في ddH2O. أضف 5 ميكرولتر من 1.0 M NaOAc المخزن المؤقت ، الرقم الهيدروجيني 5.5 (المقابل 50 ملي مولار NaOAc ، الرقم الهيدروجيني 5.5 لحجم تفاعل 100 ميكرولتر).
ملاحظة: على غرار الحمض النووي الريبي أحادي التسمية ذو 5 بوصات ، نقوم بشكل روتيني بإعداد الحمض النووي الريبي أحادي التسمية ذو 3 بوصات كعنصر تحكم. للقيام بذلك ، قم بنقل الحمض النووي الريبي غير المسمى ليحتوي على ما يقرب من 50-75 ميكروغرام من الحمض النووي الريبي لكل أنبوب في 86 ميكرولتر من ddH2O. - أضف 4 ميكرولتر من محلول مخزون الدوريات الفوقية للصوديوم المحضر حديثا 500 ملي مولار (NaIO4) (المقابل 10 ملي مولار NaIO4 لحجم تفاعل 100 ميكرولتر). بالنسبة لوضع العلامات الفردية ذات 3 's ، أضف 8 ميكرولتر من محلول مخزون NaIO4 (المقابل 20 ملي مولار NaIO4 لحجم تفاعل 100 ميكرولتر). تخلط جيدا وتحتضن لمدة ساعتين عند 25 درجة مئوية مع الرج عند 500 دورة في الدقيقة في الظروف المظلمة لأن NaIO4 حساس للضوء.
ملاحظة: لا تغير ترتيب الإضافة أو تزيد من وقت الحضانة ، لأن ذلك قد يتسبب في تبييض الصبغة المانحة المرفقة. يتم تقليل تركيز NaIO4 المستخدم بمقدار النصف لوضع العلامات المزدوجة لتقليل تبريد الصبغة المرفقة بالفعل في الطرف 5. - أوقف التفاعل بإضافة 30 ميكرولتر من 50٪ جلسرين. احتضن لمدة 30 دقيقة عند 25 درجة مئوية أثناء الاهتزاز عند 500 دورة في الدقيقة.
ملاحظة: يعمل الجلسرين كديول لإخماد فائض الدورة الشهرية. - جولة التنقية 4: أضف 400 ميكرولتر من خليط ترسيب EtOH-NaOAc المثلج وقم بإجراء ترسيب الإيثانول.
- أعد تعليق حبيبات الحمض النووي الريبي المؤكسدة في 95 ميكرولتر من 50 ملي مولار NaOAc ، درجة الحموضة 6.0.
- مرفق صبغة الهيدرازيد: تحضير محلول الفلوروفور عن طريق إذابة بضع بلورات من هيدرازيد السيانين 5 (Cy5-hydrazide) في DMSO ثم تخفيفه ب ddH2O إلى تركيز 2 ملليمتر. إذا كان الفلوروفور المفضل قابلا للذوبان في الماء ، فقم بإعداد المحلول في ddH2O. أضف 5 ميكرولتر من محلول 2 ملي مولار Cy5-hydrazide إلى الحمض النووي الريبي المؤكسد. تخلط جيدا وتحتضن لمدة 16 ساعة عند 25 درجة مئوية مع الرج عند 500 دورة في الدقيقة.
ملاحظة: يجب أن يكون الفلوروفور يزيد عن الحمض النووي الريبي بمقدار 40 ضعفا على الأقل. - جولة التنقية 5: قم بتنقية الحمض النووي الريبي ذو العلامات المزدوجة (أو الحمض النووي الريبي المفرد المسمى 3 بوصات) عن طريق ترسيب EtOH وترشيح الطرد المركزي ، على غرار الخطوتين 1.2.6 و 1.2.8 ، على التوالي ، والتخلص منها في ddH2O.
- احسب الحمض النووي الريبي وتركيزات الصبغة المترافقة بواسطة التحليل الطيفي للأشعة فوق البنفسجية.
- قم بتمييز الحمض النووي الريبي المسمى باستخدام المقايسات التحليلية القائمة على الهلام ، والتحليل الطيفي الفلوري الجماعي (انظر قسم النتائج التمثيلية ) ، و / أو HPLC التحليلي كما هو موضح في مكان آخر3.
- Aliquot الحمض النووي الريبي المسمى 5 'في ddH2O ليحتوي على ما يقرب من 50-75 ميكروغرام من الحمض النووي الريبي لكل أنبوب في 90 ميكرولتر. إذا كان حجم الشطف للخطوة السابقة مرتفعا ، مما أدى إلى تركيز منخفض ، فقم بتركيز الحمض النووي الريبي عن طريق ترسيب الحبيبات وإعادة تعليقها في ddH2O. أضف 5 ميكرولتر من 1.0 M NaOAc المخزن المؤقت ، الرقم الهيدروجيني 5.5 (المقابل 50 ملي مولار NaOAc ، الرقم الهيدروجيني 5.5 لحجم تفاعل 100 ميكرولتر).
2. إعداد غرفة الموائع الدقيقة
ملاحظة: نوصي بالتعامل مع ست أو ثماني غرف في المرة الواحدة. يتم إجراء صوتنة في درجة حرارة الغرفة ما لم يذكر خلاف ذلك. يحد هذا البروتوكول من استخدام المذيبات العضوية ، مثل الأسيتون ، لمنع إذابة الشوائب النزرة. للاطلاع على البدائل، يرجى الرجوع إلى المراجع15، 16.
- تنظيف
- قم بحفر أربعة ثقوب في شرائح الكوارتز باستخدام حفار الماس وفقا للمخطط الوارد في الشكل 2 أ لتشكيل قناتين.
ملاحظة: على الرغم من أنها قد تنكسر بسهولة أكبر أثناء الحفر ، إلا أن الشرائح الزجاجية هي بديل فعال من حيث التكلفة لشرائح الكوارتز لإعدادات الفحص المجهري TIRF القائمة على الأهداف حيث يكون الغطاء هو سطح التصوير (الشكل 2 ب). هذا ليس خيارا لإعدادات TIRF المستندة إلى المنشور ، حيث تكون شريحة الفحص المجهري هي سطح التصوير بسبب تألق الخلفية.
ملاحظة: بدلا من ذلك ، أعد تدوير غرف الموائع الدقيقة المستخدمة16. لهذا الغرض ، اغمر الغرف المستخدمة طوال الليل في الأسيتون (لف جرة تلطيخ كوبلين بورق الألمنيوم لتقليل التبخر) في غطاء الدخان ، وبعد ذلك صوتنة لمدة 5 دقائق. قم بتفكيك الغرفة وتخلص من أغطية الملصقات. إذا لم يعمل التفكيك على الفور ، فقم بصوتنة الغرفة في الأسيتون لمدة 10 دقائق أخرى. تابع الخطوة 2.1.2. - ضع شرائح الكوارتز المحفورة وحوالي ضعف عدد الأغطية (لأنها قد تنكسر بسهولة) في وعاء زجاجي من كوبلين بغطاء. اشطف 3x باستخدام ddH2O. Sonicate في ddH2O لمدة 5 دقائق ، ثم اشطفها 3x باستخدام ddH2O.
- Sonicate في محلول تنظيف الأواني الزجاجية المختبرية بنسبة 10٪ (انظر جدول المواد) لمدة 30 دقيقة عند 50 درجة مئوية. اشطف 3 مرات على الأقل باستخدام ddH2O حتى تختفي فقاعات المنظف. Sonicate في ddH2O لمدة 5 دقائق. اشطف 3 مرات باستخدام ddH2O.
- صوتي في محلول 1 متر KOH لمدة 30 دقيقة ، ثم اتركيه طوال الليل. اشطف 3x مع ddH2O. Sonicate في ddH2O لمدة 5 دقائق. اشطف 3 مرات باستخدام ddH2O.
ملاحظة: على الرغم من أن التآكل الناتج عن الحضانة المفرطة هو مصدر قلق أثاره Chandradoss et al.15 سابقا ، إلا أننا نوصي بهذا الحضانة الطويلة التي تمكن من تجنب نقش سمكة الضاري المفترسة. - جفف الشرائح والأغطية باستخدام N2 (g).
- عالج الشرائح والأغطية المجففة بمنظف بلازما الأكسجين لمدة 30 دقيقة وفقا لتعليمات الشركة المصنعة.
- قم بحفر أربعة ثقوب في شرائح الكوارتز باستخدام حفار الماس وفقا للمخطط الوارد في الشكل 2 أ لتشكيل قناتين.
- أمينوسيلان
- قم بإعداد محلول APTES-EtOH بنسبة 3٪ عن طريق خلط 288.5 مل من EtOH المطلق ، و 1.5 مل من ddH2O ، و 9 مل من (3-أمينوبروبيل) ثلاثي إيثوكسيسيلان (APTES) في قارورة إرلينماير سعة 500 مل.
- ضع الشرائح والأغطية النظيفة في وعاء تلطيخ Coplin ، واغمرها في محلول APTES-EtOH بنسبة 3٪ ، وصوتنة لمدة دقيقة واحدة ، واحتضنها لمدة 30 دقيقة.
- اشطف 3x باستخدام EtOH المطلق ، ثم 3x باستخدام ddH2O.
- جفف الشرائح والأغطية تحت تدفق N2 (g).
- التخميل السطحي والبيوتينيل
- قم بإعداد صندوق رطب عن طريق ملء صندوق طرف ماصة فارغ يصل إلى النصف ب ddH2O. ضع الشرائح داخل الصندوق ، بحيث يكون الجانب المراد معالجته متجها لأعلى.
- قم بإعداد خليط bPEG-mPEG حديثا في أنبوب طرد مركزي دقيق معقم ونظيف سعة 1.5 مل عن طريق خلط 2 مجم من البيوتين والبولي إيثيلين جلايكول سوكسينيميديل فاليرات 5000 (البيوتين-PEG-SVA) و 80 مجم من ميثوكسي بولي إيثيلين جلايكول سكسينيميديل فاليرات (mPEG-SVA) في 640 ميكرولتر من 100 ملي مولار من بيكربونات الصوديوم (NaHCO3) ، درجة الحموضة 8.3. الطرد المركزي لخليط bPEG-mPEG عند 16,000 × جم لمدة 1 دقيقة لإزالة أي فقاعات هواء.
- قم بإزالة المادة الطافية بعناية وأضف قطرة 30 ميكرولتر إلى وسط الشريحة لتغطية كلتا القناتين. ضع قطرة إضافية على جانب واحد من الشريحة للحصول على غطاء PEGylated إضافي ، لأنها تنكسر بسهولة ، ومن المفيد الحصول على قطعة احتياطية. أخيرا ، قم بتغطية القطرة بغطاء نظيف ، وأغلق الصندوق الرطب ، وقم بإجراء PEGylation طوال الليل في ظل الظروف المظلمة.
- اشطف الشرائح والأغطية المخلة ب PEG والحيوية جيدا باستخدام ddH2O. لاحظ التغيير في الكراهية للماء للأسطح المعالجة. يجف تحت تدفق N2 (g).
- تجميع غرفة الموائع الدقيقة
- قص ملصق على الوجهين لإنشاء القنوات. قم بتوصيل الملصق بالشريحة ، وتأكد من أنه يغطي منطقة الاهتمام. ضع الغطاء بعناية في الأعلى ، وقم بمحاذاة بحيث تواجه الأسطح PEGylated بعضها البعض.
- ضع كل غرفة مجمعة في أنبوب طرد مركزي سعة 50 مل واملأ الأنابيب ب N2 (g) ، وقم بتخزينها في درجة حرارة -20 درجة مئوية لمدة تصل إلى شهر واحد.
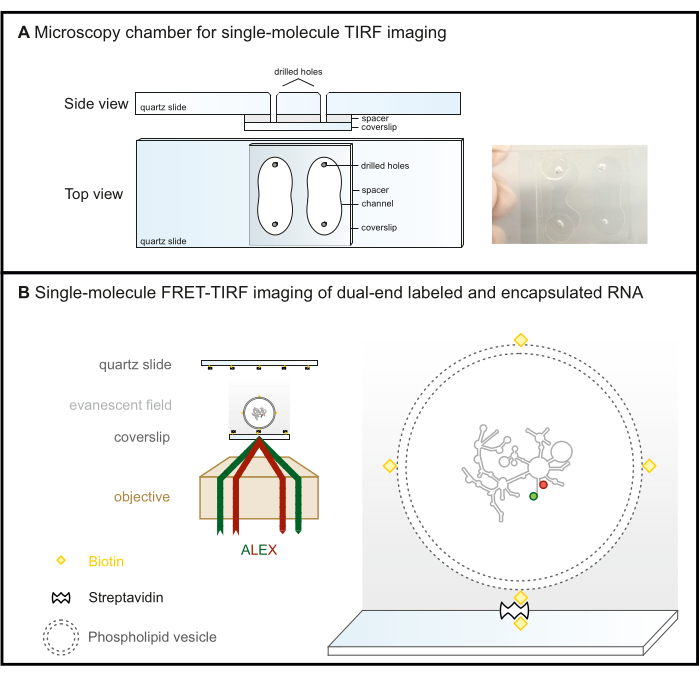
الشكل 2: الفحص المجهري أحادي الجزيء FRET-TIRF. (أ) غرفة الموائع الدقيقة لتصوير TIRF. (ب) يتم تغليف الحمض النووي الريبي المسمى FRET في حويصلة فوسفوليبيد بيوتينيل ويتم تثبيتها على سطح زجاجي مطلي بستيبتافيدين. هذا يحافظ على جزيء الاهتمام داخل المجال الزائل (التدرج الرمادي) ، والذي يتم إنشاؤه بواسطة الضوء الساقط الذي ينعكس تماما في الزاوية الحرجة في الفحص المجهري TIRF. هنا ، يتم تحمس كلا الفلوروفورين لاحقا بمخطط ALEX. الاختصارات: FRET = Förster Resonance Energy Transfer; TIRF = إجمالي انعكاس داخلي مضان ؛ أليكس = إثارة ليزر بديلة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
3. تغليف حويصلة الفوسفوليبيد
- تحضير كعكة الدهون
ملاحظة: تعامل دائما مع الكلوروفورم تحت غطاء الدخان.- باستخدام إبرة معقمة ، قم بعمل ثقوب في الغطاء (من الداخل إلى الخارج) لأنابيب الطرد المركزي الدقيقة المعقمة 2.0 مل ، كما هو موضح في الشكل 3 أ.
- تحضير محلول مخزون البيوتينيل 1،2-dipalmitoyl-sn-glycero-3-phosphoethanolamine-N-cap (bPE) عن طريق إذابة ما لا يقل عن 2 مجم من bPE بكمية مناسبة من الكلوروفورم إلى تركيز نهائي قدره 1 مجم / مل.
- تحضير محلول مخزون 1،2-dimyristoyl-sn-glycero-3-phosphocholine (DMPC) عن طريق إذابة ما لا يقل عن 10 مجم من DMPC بكمية مناسبة من الكلوروفورم إلى تركيز نهائي قدره 10 مجم / مل.
- تحضير خليط bPE-DMPC (مع الحفاظ على نسبة 1:99 واط / وزن) عن طريق خلط 100 ميكرولتر من bPE و 990 ميكرولتر من محاليل مخزون DMPC. توزيع 109 ميكرولتر من خليط bPE-DMPC لكل أنبوب 2 مل.
- ضع إدراج قسم خلية من الورق المقوى لصندوق تخزين الأنابيب الدقيقة في قارورة Schlenk ، ليكون بمثابة حامل أنبوب. باستخدام ملاقط طويلة ، ضع الأنابيب التي تحتوي على خليط الدهون في حامل الأنبوب في قارورة شلينك سعة 500 مل (الشكل 3 ب).
ملاحظة: تأكد من أنها منتصبة وليست مائلة. - تبخر الكلوروفورم تحت تدفق منخفض من N2 (ز) بين عشية وضحاها (أو لمدة ساعتين على الأقل حتى يتبخر المذيب تماما).
- أغلق الأنابيب باستخدام Parafilm لتغطية الثقوب. قم بتخزين كعك الدهون عند -20 درجة مئوية لمدة تصل إلى شهر واحد.
- تغليف الحمض النووي الريبي
- قم بإعداد المخازن المؤقتة والمحاليل التالية عن طريق ضبط تركيزات K + و Mg2+ وفقا للنظام البيولوجي محل الاهتمام.
- تحضير المخزن المؤقت القياسي 5x (5x SB): 2.5 M KCl ، 400 ملي مولار MOPS ؛ اضبط الرقم الهيدروجيني إلى 6.9 باستخدام KOH ، مرشح معقم ، وقم بتخزينه عند 4 درجات مئوية في الظلام (على التوالي 1x SB: 500 ملي مولار KCl ، 80 ملي مولار MOPS ، درجة الحموضة 6.9).
- تحضير المخزن المؤقت المضاد للوميض (AB): 100 ملي MgCl2 ، Trolox ، 1x SB ، مرشح معقم ، وتخزينه في درجة حرارة 4 درجات مئوية في الظلام لمدة تصل إلى أسبوع واحد.
ملاحظة: استخدم طرف ملعقة من Trolox للحجم النهائي 10 مل ، ودوامة للخلط ، وإعادة ضبط الرقم الهيدروجيني.
- قم بتجميع الطارد باستخدام غشاء البولي كربونات (PC) 100 نانومتر وقرص تصريف البوليستر (PE) مقاس 10 مم ، وقم بموازنة المحقنة والأغشية مع AB ، وقم بتسخينها إلى 30 درجة مئوية (أو بشكل أساسي أعلى من درجة حرارة التزجج DMPC البالغة 24 درجة مئوية).
- امزج 5 ميكرولتر من 1 ميكرومتر من الحمض النووي الريبي المسمى ثنائي الطرف و 45 ميكرولتر من AB (بحجم إجمالي قدره 50 ميكرولتر).
- رطب كعكة الدهون بمحلول الحمض النووي الريبي هذا. عند 30 درجة مئوية ، اخلطي لمدة 5 دقائق عن طريق الرج عند 1,400 دورة في الدقيقة ، ثم لمدة 15 دقيقة عند 700 دورة في الدقيقة. جهاز طرد مركزي لمدة دقيقتين عند 13,000 جم ونقل المادة الطافية بعناية إلى أنبوب جديد.
- خفف العينة ب 250 ميكرولتر من AB.
- املأ المحقنة بتعليق الحمض النووي الريبي الدهني. قم بثق 35x عند 30 درجة مئوية على كتلة تسخين لتغليف الحمض النووي الريبي ذو الطرف المزدوج في حويصلات فوسفوليبيد بقطر 100 نانومتر.
ملاحظة: يمكن التحقق من توزيع حجم الحويصلات بعد استخدام الطارد عن طريق تشتت الضوء الديناميكي (DLS) ، كما هو موضح في المرجع11.
- قم بإعداد المخازن المؤقتة والمحاليل التالية عن طريق ضبط تركيزات K + و Mg2+ وفقا للنظام البيولوجي محل الاهتمام.

الشكل 3: تحضير كعكة الدهون. (أ) يتم وخز أغطية الأنبوب لتمكين تبخر المذيبات. (ب) توضع الأنابيب التي تحتوي على خليط الدهون في قارورة شلينك ، ويتم تبخير الكلوروفورم للحصول على كعكة دهنية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
4. الفحص المجهري smFRET-TIRF
- تثبيت السطح
- قم بإعداد المخازن المؤقتة والحلول التالية.
- تحضير المخزن المؤقت المضاد للوميض (SAB): 1٪ D-glucose (وزن / حجم) في AB ، مرشح معقم ، وتخزينه في درجة حرارة 4 درجات مئوية في الظلام لمدة تصل إلى أسبوع واحد.
- تحضير نظام مسح الأكسجين 100x OSS: 100x نظام كسح الأكسجين (OSS): 3 مجم من الجلوكوز أوكسيديز (المقابل 1.7 U) ، 10 ميكرولتر من الكاتلاز (المقابل 22 U) في 90 ميكرولتر من 1x SB ، يخزن في 4 درجات مئوية في الظلام لمدة تصل إلى أسبوع واحد.
- قم بإعداد المخزن المؤقت للتصوير (IB) حديثا عن طريق خلط 198 ميكرولتر من SAB و 2 ميكرولتر من محلول 100x OSS.
- اسمح لغرفة الموائع الدقيقة بالوصول إلى درجة حرارة الغرفة. اغسل الغرفة 2x ب 200 ميكرولتر من 1x SB.
- املأ الغرفة ب 50 ميكرولتر من محلول الستربتافيدين 20 ميكرولتر / مل واحتضنه لمدة 5 دقائق.
- اغسل الغرفة ب 200 ميكرولتر من 1x SB ثم ب 100 ميكرولتر من AB.
- قم بتثبيت الحمض النووي الريبي المغلف على السطح بإضافة 75 ميكرولتر من تعليق الحويصلة واحتضانه لمدة 10 دقائق.
- اغسل الغرفة ب 200 ميكرولتر من IB المحضر حديثا واحتضنه لمدة 5 دقائق.
- الغرفة جاهزة الآن للحصول على البيانات (الشكل 2 ب). لمنع التبخر أثناء القياسات الطويلة ، أغلق الثقوب كما هو موضح في الشكل 2 أ. إذا كانت التسريبات من قناة إلى أخرى مثيرة للقلق ، فقم بإغلاق القناة غير المستخدمة قبل بدء بروتوكول تثبيت السطح.
ملاحظة: نوصي بإجراء قياسات فارغة كفحص جودة لنظافة غرف الموائع الدقيقة والحويصلات الفوسفوليبيد ضد التلوث الفلوري.
- قم بإعداد المخازن المؤقتة والحلول التالية.
النتائج
نقدم الملصقات الفلورية المفردة والمزدوجة الخاصة بالموقع للحمض النووي الريبي 915-nt محل الاهتمام ، وهي خميرة الميتوكوندريا Sc.ai5γ المجموعة الثانية من الإنترون ، محاطة بتسلسلات خارجية. يتم وضع زوج الفلوروفور FRET في نهايات الحمض النووي الريبي عن طريق تنشيط EDC / NHS لأكسدة 5'-فوسفات وأكسدة دورية للريبوز 3'، متبوعا بمرفقات الصبغة المعنية. ثم تحققنا من اقترانات صبغة الحمض النووي الريبي عن طريق الرحلان الكهربائي للهلام الفلوري ، كما هو موضح في الشكل 4 أ. تؤكد الهجرة المشتركة للحمض النووي الريبي والفلوروفورات الموجودة على هلام الاغاروز نجاح الملصقات. بعد ذلك ، كما هو موضح في الشكل 4 ب ، تم استخدام التحليل الطيفي الفلوري الجماعي لتوصيف الإنترون الثاني ذو التسمية المزدوجة. لوحظ نقل الطاقة ، أي FRET ، عند إثارة الصبغة المانحة التي تثبت الملصقات المزدوجة للحمض النووي الريبي. والجدير بالذكر أنه بما يتفق مع الطبيعة المعتمدة على المسافة ل FRET ، أدى طي الحمض النووي الريبي الإنترون من المجموعة الثانية في وجود أيونات معدنية إلى زيادة كفاءة FRET ، كما يتضح من انخفاض انبعاث المتبرع (السهم الأخضر) والزيادة المقابلة في انبعاث المستقبل (السهم الأحمر). يشير هذا إلى أن وضع العلامات على FRET يتتبع التغيرات التوافقية للريبوزيم.
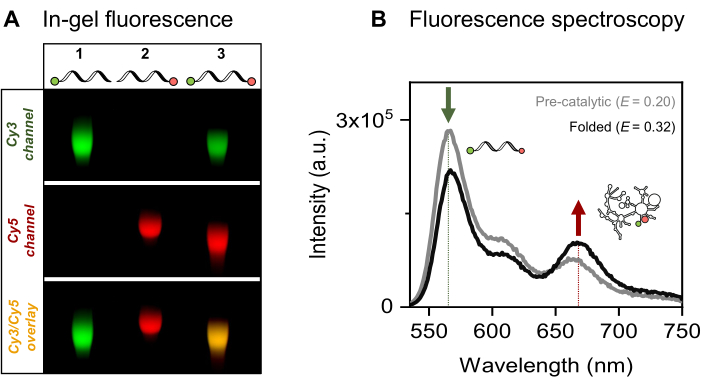
الشكل 4: توصيف اقترانات صبغة الحمض النووي الريبي. (أ) يظهر التحليل التحليلي القائم على الهلام للحمض النووي الريبي المصنف بالفلورسنت الفردي والمزدوج الهجرة المشتركة للأصباغ مع الحمض النووي الريبي على هلام الاغاروز بنسبة 2٪. يشار إلى التوطين المشترك للفلوروفورات في العينة ذات العلامات المزدوجة من خلال الشريط الأصفر في الصورة المدمجة (أسفل) للقنوات Cy3 (الأعلى ، الأخضر) و Cy5 (الوسطى ، الحمراء) ، التي يتم تصورها تحت إضاءة 532 نانومتر و 635 نانومتر ، على التوالي. حارة 1: 5'-sCy3 المسمى فقط RNA ، الممر 2: 3'-Cy5 المسمى فقط RNA ، والممر 3: مزدوج الطرف (5'-sCy3 و 3'-Cy5) المسمى RNA. (ب) يؤكد التحليل الطيفي الفلوري الجماعي وضع العلامات المزدوجة. يتحقق نقل الطاقة عند إثارة المتبرع (λex = 515 نانومتر ، λem = 670 نانومتر) من أن كلا الأصباغ يقترنان بنجاح بالحمض النووي الريبي. يمثل المنحنى الرمادي ملف انبعاث الحمض النووي الريبي قبل التحفيزي ، بينما يوضح المنحنى الأسود زيادة كفاءة FRET في الحمض النووي الريبي الإنترون من المجموعة الثانية المطوية (محتضن ب 500 ملي مولار KCl عند 70 درجة مئوية لمدة 3 دقائق ، ويتم تبريده إلى 42 درجة مئوية لمدة 5 دقائق ، متبوعا بإضافة 100 ملي مولار MgCl2). تم اقتباس هذا الرقم من Ahunbay et al.3 الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
مع وجود إنترون من النوع البري من النوع الثاني ذو العلامات الفلورية المزدوجة في متناول اليد ، أصبحنا الآن في وضع يسمح لنا باستكشاف ديناميكياته على مستوى الجزيء الفردي. بمجرد تغليفه في حويصلات الفوسفوليبيد ، يتم تثبيت الحمض النووي الريبي المسمى على سطح مجهري بكثافات سطحية منخفضة جدا لتحقيق دقة جزيء واحد ل smFRET-TIRF. كما هو موضح في الشكل 5 أ ، يمكن تتبع العديد من الجزيئات الفردية في وقت واحد. يتيح الفحص المجهري TIRF المراقبة في الوقت الفعلي لكفاءة FRET وتغيراتها بمرور الوقت. يوضح الشكل 5 ب آثار FRET أحادية الجزيء الثابتة والديناميكية للحمض النووي الريبي المسمى والمغلف. يظهر التتبع الديناميكي النموذجي ارتباطا مضادا بين إشارات المانحة والمتقبل التي تتقلب كفاءة FRET. عندما يزداد انبعاث المستقبل عند إثارة المتبرع ، ينخفض انبعاث المتبرع في المقابل ، مما يشير إلى تغير ديناميكي في المسافة بين الصبغات. يشير هذا الارتباط المضاد إلى تغيرات توافقية في جزيء الحمض النووي الريبي.
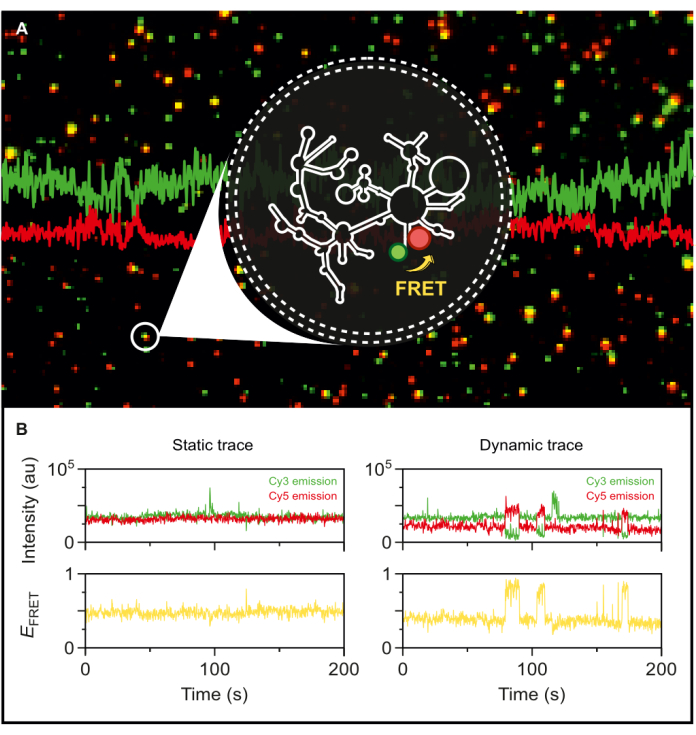
الشكل 5: السلوك الديناميكي للغاية للحمض النووي الريبي الإنترون من المجموعة الثانية الذي تم الكشف عنه بواسطة smFRET. يتم تغليف الحمض النووي الريبي الإنترون ذو الطرف المزدوج المسمى من المجموعة الثانية في حويصلة فوسفوليبيد ويتم تثبيتها على السطح للتصوير باستخدام مجهر TIRF القائم على الهدف. (أ) صورة مدمجة لجزيئات الحمض النووي الريبي الفردية المسماة التي تظهر انبعاث المتبرع (sCy3 ، أخضر) وانبعاث المستقبل (Cy5 ، أحمر) عند إثارة 532 نانومتر. (ب) مسارات smFRET النموذجية (يسار) جزيء الحمض النووي الريبي الثابت حيث لا تتقلب شدة المتبرع والمتلقي بمرور الوقت و (يمين) جزيء الحمض النووي الريبي الديناميكي ، حيث ترتبط شدة المانح والمتلقي ، مع كفاءات FRET باللون الأصفر. يتم توطين الجزيئات المفردة وتحليلها باستخدام MASH-FRET17. يتم تطبيق الإثارة المباشرة ، والنزيف ، والتصحيحات γ العامل. الاختصارات: smFRET = نقل طاقة الرنين Förster أحادي الجزيء. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
يعتبر FRET على مستوى الجزيء الفردي فريدا لأنه يسمح بمراقبة وتحليل الجزيئات الفردية ، والكشف عن عدم تجانس العينة والتقاط الحالات العابرة التي يمكن حجبها في قياسات المجموعة1،2. توفر مراقبة جزيئات الحمض النووي الريبي الفردية باستخدام smFRET رؤى عالية الدقة حول مساراتها وديناميكياتها القابلة للطي. يصف هذا البروتوكول الملصقات الكيميائية ذات الطرف المزدوج للحمض النووي الريبي وتثبيت سطحه عن طريق تغليف حويصلة الفوسفوليبيد ، والتي تتيح معا اتباع التغييرات التوافقية الديناميكية عبر الفحص المجهري smFRET-TIRF.
تعد دراسة ديناميكيات الحمض النووي الريبي مجالا متزايدا باستمرار مع الحاجة إلى استراتيجيات جديدة لوضع العلامات الفلورية الخاصة بالموقع. نقوم بتسمية نهايات الحمض النووي الريبي من خلال استهداف 5'-فوسفات مع الكربوديميدات وسكر الريبوز 3'-مع الدوريات. تم وصف هذه الأساليب في وقت سابق (5'-end18،19 و 3'-end19،20،21،22) ولكن لم يتم تطبيقها سابقا على RNA بحجم مماثل لنوع البري Sc.ai5γ المجموعة الثانية من ريبوزيم إنترون ، والذي تطلب التحسين. تنشيط Carbodiimide (على سبيل المثال ، EDC) للفوسفات 5'-قابل للعكس. لذلك ، تم استخدام إيميدازول للتفاعل بشكل لا رجعة فيه مع وسيط O-acylisourea لتشكيل فوسفوريميدازوليد عالي التفاعل19،20. ومع ذلك ، فمن المعروف الآن أنه عند ارتفاع درجة الحموضة ، يمكن للكاربوديميدات تعديل القواعد النووية ، وتحديدا الجوانين واليوراسيل ، مما أدى مؤخرا إلى استخدامها كعوامل فحص هيكلية23،24.
لتجنب التفاعل المتبادل ، يعد تنقية الحمض النووي الريبي المنشط من EDC قبل رفع الرقم الهيدروجيني إلى 7.5 لخطوة اقتران الصبغة أمرا بالغ الأهمية. ومع ذلك ، عندما أدخلنا خطوة تنقية بين التنشيط ومرفق الصبغة25 ، حصلنا على عوائد منخفضة جدا. وبالمثل ، في وضع العلامات على البروتين ، يمكن تنشيط بقايا اللايسين التي يمكن الوصول إليها على السطح باستخدام الكربوديميدات. ومع ذلك ، بدلا من إيميدازول ، الذي يمنع انعكاس التنشيط ، يتم استخدام NHS بشكل روتيني. اعتمدنا هذه الاستراتيجية أيضا ، وبالتالي استبدلنا وسيط الفوسفوريميدازوليد بوسيط NHS-Phosphate. بهذه الطريقة حققنا التحكم في الأس الهيدروجيني بالإضافة إلى زيادة كثافة الملصقات في درجات حرارة منخفضة وأوقات حضانة أقصر ، أي 25 درجة مئوية لمدة 4 ساعات مقارنة ب 37 درجة مئوية لمدة 16 ساعة. تم تطوير استراتيجية وضع العلامات هذه من أجل الحمض النووي الريبي ، ويمكن تطبيقها على أي حمض نووي آخر أحادي الشريطة مع فوسفات 5'.
كان تنشيط 5'-فوسفات وأكسدة 3'-ريبوز متعارضين ، لأن الكيمياء ليست متعامدة. للتغلب على هذا التحدي وتجنب وضع العلامات المتقاطعة ، بدأنا بنهاية 5 '، متبوعة بخطوة حظر لمنع المواقع التي تم تنشيطها ولكن غير المصنفة قبل الشروع في وضع العلامات على 3'. أثناء أكسدة 3'-diol ، يمكن أن يؤدي العصر الفوقي للصوديوم الزائد (NaIO4) إلى إخماد الفلوروفور المتصل بالفعل في الطرف 5'. لذلك ، قمنا بتقليل تركيز NaIO4 المستخدم في وضع العلامات الفردية من 20 ملي مولار إلى 10 مليمتر.
نوصي بالعمل مع حصص متعددة بالتوازي بدلا من زيادة التفاعلات. يتطلب هذا البروتوكول خطوات متعددة لترسيب الإيثانول (EtOH). عند العمل مع العديد من الحصص بالتوازي ، قم بإعداد خليط هطول الأمطار (30 مل من EtOH المطلق بنسبة 100٪ و 1 مل من 3 M NaOAc ، الرقم الهيدروجيني 5.2). لا يتم استخدام كلوريد الصوديوم بسبب قابليته المنخفضة للذوبان في EtOH. قم بترسيب الحمض النووي الريبي ب 3.1 مجلد من هذا الخليط عن طريق الحضانة بين عشية وضحاها عند -20 درجة مئوية ، متبوعا بالطرد المركزي. اغسل حبيبات الحمض النووي الريبي مرتين باستخدام 500 ميكرولتر مثلج 70٪ EtOH ، وقم بالدوران عند 4 درجات مئوية بعد كل مرة ، وجففها تحت الفراغ. يستفيد ترسيب EtOH من عدم ذوبان الحمض النووي الريبي وقابلية ذوبان الأصباغ الحرة في 70٪ من الإيثانول. يزيل ترشيح الطرد المركزي بشكل فعال الأصباغ الحرة بسبب اختلاف حجمها الكبير عن الحمض النووي الريبي ويسهل تبادل العازلة ، مما يزيل الأملاح. بالإضافة إلى طرق الترشيح بالطرد المركزي والترسيب EtOH ، يمكن أيضا إزالة الأصباغ الحرة باستخدام تقنيات استخراج الهلام و / أو الكروماتوغرافيا (على سبيل المثال ، HPLC) ؛ ومع ذلك، ينبغي تكييف المقياس وفقا لذلك. لا تقم بتدوير الحمض النووي الريبي الطويل للتعليق ، لأن هذا قد يتسبب في القص الميكانيكي26. الوقت الأمثل لإيقاف البروتوكول مؤقتا هو عندما يتم تكوير الحمض النووي الريبي. نستخدم أنابيب الحمض النووي منخفضة الارتباط لتحسين استعادة الحمض النووي. على الرغم من أن حجم التفاعل النهائي هو 100 ميكرولتر ، إلا أنه يفضل استخدام أنابيب 1.5 مل (وليس أقل حجما) من أجل تنقية أفضل بواسطة ترسيب EtOH.
بمجرد إزالة الأصباغ الحرة غير المتفاعلة عن طريق هطول الأمطار والترشيح بالطرد المركزي ، أكدنا وضع العلامات عن طريق الرحلان الكهربائي للهلام الفلوري (الشكل 4 أ) ، التحليل الطيفي للأشعة فوق البنفسجية ، HPLCالتحليلي 3. ومع ذلك ، من المهم ملاحظة أن هذه الطرق لا يمكنها التمييز بين جزيء الحمض النووي الريبي الذي يحمل كلا من الفلوروفورات ومزيج من الحمض النووي الريبي ، كل منها مصنف بلون واحد. وبالمثل ، لا يمكن استخدامها لتحديد ما إذا كان جزيء الحمض النووي الريبي يحمل العديد من الفلوروفورات من نفس اللون. لا يمكن استخدام قياس الطيف الكتلي بسبب قيود الحجم. تؤكد النظارات الطيفية للمجموعة3 وأحادية الجزيء FRET وضع العلامات الفلورية المزدوجة ، كما هو موضح في الشكلين 4 ب و 5 ب. يؤكد القياس المتكافئ البالغ 0.5 (نسبة sCy3 إلى Cy5 من 1: 1) في تجارب smFRET الاقتران المتساوي للفلوروفورين. كان أحد المخاوف هو وضع العلامات المزدوجة في النهاية 3 من خلال تسمية كل من الألدهيدات بدلا من التدوير المقترح. يشير نقص الأنواع ذات القياس المتكافئ 0.25 (نسبة sCy3 إلى Cy5 من 1: 2) في تجارب smFRET إلى أن ارتباط الصبغة يعيق بشكل ستيري ويمنع التصاق صبغة ثانية.
باستخدام هذه الملصقات الفلورية المزدوجة ، يمكن أن تعزى تغييرات إشارة FRET إلى إعادة الترتيب الهيكلي في جميع أنحاء طي الحمض النووي الريبي وتحفيزه. للحفاظ على الحمض النووي الريبي المسمى بالفلورسنت داخل المجال الزائل لتصوير TIRF أحادي الجزيء ، يفضل التغليف على الربط المباشر بالسطح. يتضمن هذا النهج حبس جزيئات الحمض النووي الريبي الفردية داخل طبقات ثنائية الدهون من الحويصلات ، مما يخلق بيئة خاضعة للرقابة تساعد على مراقبة سلوكها الديناميكي. يثري البروتوكول الموصوف التغليف الأحادي ، حيث يوضح التبييض الضوئي في خطوةواحدة 11. لفهم طي الحمض النووي الريبي ووظيفته ، يعد سد الفجوة في المختبر وفي الجسم الحي أمراضروريا 27. يمكن لعوامل الازدحام الجزيئي أن تحاكي الظروف داخل الخلايا لتعزيز تحفيز الحمض النووي الريبي بواسطة إنترونات المجموعة الثانية7،28. بدلا من ذلك ، يخلق التغليف بيئات مكروية مقيدة تعزز طي الحمض النووي الريبي29 ، مما يجعل فهمنا لبنية الحمض النووي الريبي وديناميكياته أقرب إلى سياق خلوي واقعي.
Disclosures
يعلن أصحاب البلاغ عدم وجود تضارب في المصالح.
Acknowledgements
الدعم المالي من المؤسسة الوطنية السويسرية للعلوم [200020_192153 إلى RKOS] ، و UZH Forschungskredit [FK-20-081 إلى EA] ، و UZH Stiftung für wissenschaftliche Forschung [إلى RKOS و SZP] ، ومنحة حرم أبحاث الدراسات العليا (GRC) [2024__SG_092 إلى EA] ، وكلية الدراسات العليا للعلوم الكيميائية والجزيئية في زيورخ (CMSZH) وجامعة زيورخ.
Materials
| Name | Company | Catalog Number | Comments |
| RNA labeling | |||
| 1.5 mL DNA LoBind tubes | Eppendorf | 30108035 | |
| 1-ethyl-3-(3-dimethylaminopropyl)carbodiimide hydrochloride (EDC-HCl or EDC) | Thermo Scientific | 11844071 | Pierce EDC, No-Weigh Format. Store at -20 °C |
| 3-morpholinopropane-1-sulfonic acid (MOPS) | Sigma-Aldrich | 69947 | BioUltra, for molecular biology, ≥99.5% (titration) |
| Acetic acid (glacial) | Sigma-Aldrich | 1.00063 | 100%, anhydrous for analysis EMSURE ACS,ISO,Reag. Ph Eur |
| Centrifugal filtration unit | Sartorius | VS0132 | Vivaspin 500, MWCO 50.000, PES, 500 μL |
| Cyanine5 hydrazide (Cy5-hydrazide) | Lumiprobe | 23070 | 5 mg, CAS number 1427705-31-4 |
| Dimethyl sulfoxide (DMSO) | New England Biolabs | 12611P | Molecular biology grade |
| Ethanol | VWR Chemicals | 20821.296P | Absolute ≥99,8% |
| Glycerol | Sigma-Aldrich | G5516 | for molecular biology, ≥99.0% |
| Hydrochloric acid (HCl) | Sigma-Aldrich | 1.00317 | fuming 37%, for analysis EMSURE ACS,ISO,Reag. Ph Eur |
| N-hydroxysuccinimide (NHS) | Sigma-Aldrich | 130672 | 98% |
| Sodium acetate (NaOAc) | Sigma-Aldrich | S8750 | anhydrous, ReagentPlus, ≥99.0% |
| Sodium meta-periodate (NaIO4) | Thermo Fisher Scientific, Life Technologies | 20504 | Pierce product line |
| Sulfo-Cyanine3 amine (sCy3-amine) | Lumiprobe | 213C0 | 5 mg, CAS number 2183440-43-7 |
| Tris(hydroxymethyl)aminomethane (Tris) | Biosolve | 200923 | Molecular biology grade |
| Chamber preparation | |||
| 3-aminopropyl)triethoxysilane (APTES) | Sigma-Aldrich | 440140 | 99% |
| Acetone | Sigma-Aldrich | 1.00014 | for analysis EMSURE ACS,ISO,Reag. Ph Eur |
| Biotin-Polyethylene glycol-Succinimidyl valerate (biotin-PEG-SVA, bPEG) and Methoxy polyethylene glycol-Succinimidyl valerate (mPEG-SVA) | Laysan Bio, Inc. | BIO-PEG-SVA, MW 5,000 and MPEG-SVA, MW 5,000 - Combo Kit | |
| Coverslips | Carl Roth | H876.2 | 24 x 24 mm, 0.13-0.16 mm thickness |
| Deconex 11 universal | Borer Chemie AG | 17416492 | Laboratory glassware cleaning solution |
| Diamond coated core drill bit | Crystalite corporation | 1 mm thickness | |
| Diamond driller | |||
| Ethanol | VWR Chemicals | 20821.296P | Absolute ≥99,8% |
| Glass Coplin staining jar with cover | |||
| Imaging spacer | Grace Bio-Labs | 654008 | SecureSeal, 8 wells, 9 mm × 0.12 mm |
| Oxygen plasma cleaner | Zepto One | Diener | |
| Potassium hydroxide (KOH) | Sigma-Aldrich | P9541 | for molecular biology, ≥99.0% |
| Quartz slides | G. Finkenbeiner, Inc. | 7.5 x 2.5 cm, 1 mm thickness | |
| Sodium bicarbonate (NaHCO3) | Sigma-Aldrich | S6297 | BioXtra, 99.5-100.5% |
| Lipid cake preparation | |||
| 16:0 Biotinyl Cap PE, bPE (1,2-dipalmitoyl-sn-glycero-3-phosphoethanolamine-N-(cap biotinyl) (sodium salt), C53H98N4O11PNaS) | Avanti Polar Lipids | 870277P | Stable for 1 year at -20 °C |
| 14:0 PC, DMPC (1,2-ditetradecanoyl-sn-glycero-3-phosphocholine or 1,2-dimyristoyl-sn-glycero-3-phosphocholine, C36H72NO8P) | Avanti Polar Lipids | 850345P | |
| 2.0 mL microcentrifuge tubes, Safe-Lock | Eppendorf | 0030120094 | Autoclave to sterilize |
| 500 mL Schlenk flask | |||
| Chloroform | Merck | 1.02445 | for analysis EMSURE ACS, ISO, Reag. Ph Eur |
| Parafilm | |||
| Surface immobilization via encapsulation | |||
| (±)-6-Hydroxy-2,5,7,8-tetramethylchromane-2-carboxylic acid (Trolox®) | Thermo Fischer | 53188-07-1 | 97% |
| 3-morpholinopropane-1-sulfonic acid (MOPS) | Sigma-Aldrich | 69947 | BioUltra, for molecular biology, ≥99.5% (titration). Store at +4 °C in the dark. |
| Adhesive seal tabs | Grace Bio-Labs | 629200 | |
| Catalase | Sigma-Aldrich | 9001-05-2, C30 | from bovine liver, aqueous suspension, 10,000-40,000 units/mg protein |
| D-glucose | Sigma-Aldrich | G7528 | ≥99.5% (GC), BioXtra |
| Extruder polycarbonate (PC) membrane | Avanti Polar Lipids | 610005-1EA | 0.1 μm, 19 mm |
| Extruder set with heating block | Avanti Polar Lipids | 610000 | |
| Glucose oxidase | Sigma-Aldrich | 9001-37-0 | from Aspergillus niger, Type VII, lyophilized powder, ≥100,000 units/g solid (without added oxygen) |
| Magnesium chloride (MgCl2) | Sigma-Aldrich | 7786-30-3, M1028 | for molecular biology, 1.00 M ± 0.01 M solution |
| Polyester (PE) drain disc, membrane | Whatman, Cytiva | 230300 | 10 mm |
| Potassium chloride (KCl) | Sigma-Aldrich | 60128 | BioUltra, for molecular biology, ≥99.5% (AT) |
| Potassium hydroxide (KOH) | Sigma-Aldrich | P9541 | for molecular biology, ≥99.0% |
| Streptavidin | Thermo Fischer | 434301 |
References
- Eitan, L., et al. FRET-based dynamic structural biology: Challenges, perspectives and an appeal for open-science practices. Elife. 10, e60416 (2021).
- Taekjip, H., et al. Fluorescence resonance energy transfer at the single-molecule level. Nat Rev Methods Primers. 4, 22 (2024).
- Ahunbay, E., Steffen, F. D., Zelger-Paulus, S., Sigel, R. K. O. Chemical dual end-labeling of large ribozymes. Methods Mol Biol. 2439, 191-204 (2022).
- Ahunbay, E., Zelger-Paulus, S., Sigel, R. K. O. Group II Introns: Highly structured yet dynamic. Chimia (Aarau). 77 (4), 235-241 (2023).
- Steiner, M., Karunatilaka, K. S., Sigel, R. K. O., Rueda, D. Single-molecule studies of group II intron ribozymes. Proc Natl Acad Sci USA. 105 (37), 13853-13858 (2008).
- Karunatilaka, K. S., Solem, A., Pyle, A. M., Rueda, D. Single-molecule analysis of Mss116-mediated group II intron folding. Nature. 467 (7318), 935-939 (2010).
- Paudel, B. P., Fiorini, E., Börner, R., Sigel, R. K. O., Rueda, D. S. Optimal molecular crowding accelerates group II intron folding and maximizes catalysis. Proc Natl Acad Sci USA. 115 (47), 11917-11922 (2018).
- Saha, R., Verbanic, S., Chen, I. A. Lipid vesicles chaperone an encapsulated RNA aptamer. Nat Commun. 9 (1), 2313 (2018).
- Boukobza, E., Sonnenfeld, A., Haran, G. Immobilization in surface-tethered lipid vesicles as a new tool for single biomolecule spectroscopy. J Phys Chem B. 105 (48), 12165-12170 (2001).
- Cisse, I., Okumus, B., Joo, C., Ha, T. Fueling protein DNA interactions inside porous nanocontainers. Proc Natl Acad Sci USA. 104 (31), 12646-12650 (2007).
- Zelger-Paulus, S., Hadzic, M. C. A. S., Sigel, R. K. O., Börner, R. Encapsulation of fluorescently labeled RNAs into surface-tethered vesicles for single-molecule FRET studies in TIRF microscopy. Methods Mol Biol. 2331, 1-16 (2020).
- Okumus, B., Wilson, T. J., Lilley, D. M. J., Ha, T. Vesicle encapsulation studies reveal that single molecule ribozyme heterogeneities are intrinsic. Biophys J. 87 (4), 2798-2806 (2004).
- Ishitsuka, Y., Okumus, B., Arslan, S., Chen, K. H., Ha, T. Temperature-independent porous nanocontainers for single-molecule fluorescence studies. Anal Chem. 82 (23), 9694-9701 (2010).
- Liu, B., Mazouchi, A., Gradinaru, C. C. Trapping single molecules in liposomes: surface interactions and freeze-thaw effects. J Phys Chem B. 114 (46), 15191-15198 (2010).
- Chandradoss, S. D., et al. Surface passivation for single-molecule protein studies. J Vis Exp. (86), e50549 (2014).
- Paul, T., Myong, S. Protocol for generation and regeneration of PEG-passivated slides for single-molecule measurements. STAR Protoc. 3 (1), 101152 (2022).
- Hadzic, M. C. A. S., Kowerko, D., Börner, R., Zelger-Paulus, S., Sigel, R. K. O., Farkas, D. L., Nicolau, D. V., Leif, R. C. Detailed analysis of complex single molecule FRET data with the software MASH. Imaging, Manipulation, and Analysis of Biomolecules, Cells, and Tissues IX. SPIE 971119, (2016).
- Chu, B. C., Wahl, G. M. Le Orgel. Derivatization of unprotected polynucleotides. Nucleic Acids Res. 11 (18), 6513-6529 (1983).
- Qin, P. Z., Pyle, A. M. Site-specific labeling of RNA with fluorophores and other structural probes. Methods. 18 (1), 60-70 (1999).
- Whitfeld, P. R. A method for the determination of nucleotide sequence in polyribonucleotides. Biochem J. 58 (3), 390-396 (1954).
- Zamecnik, P. C., Stephenson, M. L., Scott, J. F. Partial purification of soluble RNA. Proc Natl Acad Sci USA. 46 (6), 811-822 (1960).
- Proudnikov, D., Mirzabekov, A. Chemical methods of DNA and RNA fluorescent labeling. Nucleic Acids Res. 24 (22), 4535-4542 (1996).
- Wang, P. Y., Sexton, A. N., Culligan, W. J., Simon, M. D. Carbodiimide reagents for the chemical probing of RNA structure in cells. RNA. 25 (1), 135-146 (2019).
- Mitchell, D., et al. In vivo RNA structural probing of uracil and guanine base-pairing by 1-ethyl-3-(3-dimethylaminopropyl)carbodiimide (EDC). RNA. 25 (1), 147-157 (2019).
- Rinaldi, A. J., Suddala, K. C., Walter, N. G. Native purification and labeling of RNA for single molecule fluorescence studies. Methods Mol Biol. 1240, 63-95 (2015).
- Liu, T., Patel, S., Pyle, A. M. Making RNA: Using T7 RNA polymerase to produce high yields of RNA from DNA templates. Methods in Enzymology. , (2023).
- Leamy, K. A., Assmann, S. M., Mathews, D. H., Bevilacqua, P. C. Bridging the gap between in vitro and in vivo RNA folding. Q Rev Biophys. 49, e10 (2016).
- Fiorini, E., Börner, R., Sigel, R. K. O. Mimicking the in vivo Environment--The Effect of Crowding on RNA and Biomacromolecular Folding and Activity. Chimia. 69 (4), 207-212 (2015).
- Peng, H., Lelievre, A., Landenfeld, K., Müller, S., Chen, I. A. Vesicle encapsulation stabilizes intermolecular association and structure formation of functional RNA and DNA. Curr Biol. 32 (1), 86-96.e6 (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved