Method Article
Флуоресцентное мечение концов и инкапсуляция длинных РНК для одномолекулярной микроскопии FRET-TIRF
В этой статье
Резюме
В данной статье описывается двухцветное мечение длинных РНК в конечных положениях и их поверхностная иммобилизация путем инкапсуляции в фосфолипидные везикулы для применения в одномолекулярной микроскопии FRET TIRF. Сочетание этих методов позволяет точно визуализировать и анализировать динамику РНК на уровне отдельных молекул.
Аннотация
Одномолекулярный резонансный перенос энергии Фёрстера (smFRET) превосходно подходит для изучения динамических биомолекул, позволяя точно наблюдать за их конформационными изменениями с течением времени. Для мониторинга динамики РНК с помощью smFRET мы разработали метод ковалентного мечения РНК на их концах парой флуорофоров FRET. Эта стратегия прямого мечения концевого мечения нацелена на 5'-фосфат путем активации карбодиимидом (EDC)/N-гидроксисукцинимидом (NHS) и 3'-рибозу путем окисления периодата, которые могут быть адаптированы к другим РНК независимо от их размера и последовательности для их изучения независимо от искусственных модификаций. Кроме того, активация 5'-EDC/NHS представляет общий интерес для всех нуклеиновых кислот с 5'-фосфатом. Использование коммерчески доступных химических веществ избавляет от необходимости синтезировать РНК-специфичные зонды.
Флуоресцентная микроскопия с полным внутренним отражением (TIRF) требует, чтобы исследуемые молекулы с поверхностной иммобилизацией находились в пределах затухающего поля, которое должно быть освещено. Изощренный способ удержания молекул РНК в исчезающем поле заключается в их инкапсуляции в фосфолипидные везикулы. Инкапсуляция сочетает в себе лучшее из обоих миров, связывая молекулу с поверхностью и обеспечивая свободную диффузию молекулы. Мы гарантируем, что каждый везикула содержит только одну молекулу РНК, что позволяет визуализировать одну молекулу. После двустороннего мечения и инкапсуляции интересующей РНК измерения smFRET позволяют получить динамическое и подробное представление о поведении РНК.
Введение
Резонансный перенос энергии Фёрстера (FRET) — это мощный и чувствительный метод для изучения меж- и внутримолекулярных взаимодействий биомолекул на наноуровне. Он основан на безызлучательном переносе энергии от возбужденной молекулы-донора к ближайшей акцепторной молекуле, который происходит на расстояниях, как правило, от 1 нм до 10 нм. Расстояние между донорным и акцепторным красителями определяет эффективность этого переноса энергии, что делает FRET бесценным инструментом для изучения молекулярной динамики, конформационных изменений и взаимодействий в широком спектре биологических систем 1,2, включая РНК. Флуоресцентная микроскопия полного внутреннего отражения (TIRF) оказалась мощным методом для исследований smFRET, поскольку она избирательно освещает молекулы только вблизи поверхности, что позволяет получать динамику FRET отдельных молекул с высоким пространственным и временным разрешением. Однако перед проведением экспериментов smFRET-TIRF интересующая молекула должна быть сначала флуоресцентно помечена соответствующей парой FRET, а затем иммобилизована на поверхности микроскопии. Описанный здесь протокол smFRET-TIRF был валидирован с использованием интрона Sc.ai5γ группы II дикого типа из митохондрий Saccharomyces cerevisiae, окруженного двумя его экзонными последовательностями (915 нуклеотидов)3. Более подробное представление об интронах флуоресцентного мечения II группы и их иммобилизации для микроскопии smFRET TIRF смотрите в нашем обзоре4.
Идеальная сайт-специфичная стратегия мечения РНК позволила бы точно встраивать донорные и акцепторные красители в заранее определенные позиции без изменения структуры или функции РНК, обеспечивая точные и эффективные измерения FRET. Это сложно из-за химического сходства между четырьмя нуклеотидами, что усложняет селективное мечение. При мечении концов донорные и акцепторные красители прикрепляются к концам РНК, нацеливаясь на 5'-фосфат и 3'-рибозу. Этот подход предлагает минимально инвазивный подход, в то же время предоставляя ценную информацию о структурной динамике и взаимодействиях. Способность интрона II группы к самосплайсингу в присутствии Mg2+ ограничивает использование ионозависимых ферментов металлов. В данной работе мы представляем подход к созданию длинных и каталитически активных РНК (рибозимов) с двойными концевыми метками, которые обходят необходимость в ферментах или синтезе специализированных зондов.
Распространенным подходом к связыванию молекул РНК с поверхностью для микроскопии TIRF является ковалентное связывание биотиновой группы непосредственно с РНК или гибридизация биотин-несущего антисмысловой олигонуклеотид (ASO)5,6,7. Однако этот метод прямой иммобилизации может привести к образованию артефактов из-за взаимодействия РНК с поверхностью, что потенциально может привести к неправильному свертыванию РНК8. Элегантным решением для смягчения этих иммобилизационных артефактов является инкапсуляция РНК в наноразмерные фосфолипидные везикулы 9,10,11, прикрепленные к поверхности. Эти везикулы, имеющие приблизительно 100 нм в диаметре, закреплены на поверхности через биотин-стрептавидиновую связь 12,13,14, что позволяет РНК свободно диффундировать внутрь, обеспечивая при этом обмен ионами через липидную мембрану 10. После ковалентного мечения большой функциональной РНК3 мы представляем подход к инкапсуляции таких РНК в фосфолипидные везикулы путем комбинации установленных протоколов поверхностной пассивации и инкапсуляции везикул, адаптированных для сохранения функциональности РНК 10,11,14. Этот подход к двусторонней маркировке и инкапсуляции позволяет достичь высокой скорости моноинкапсуляции функциональных РНК для микроскопии smFRET TIRF.
протокол
1. Двойная маркировка РНК
Примечание: Следующий протокол описывает сайт-специфичное мечение РНК парой флуорофоров FRET путем ковалентного присоединения донорского красителя (sCy3) к 5'-фосфату и акцепторного красителя (Cy5) к 3'-рибозе. В качестве представляющей интерес РНК выбрана каталитически активная длинная РНК, интрон II группы рибозим. В таблицах 1 и на рисунке 1 обобщен этот протокол двусторонней маркировки. Выполняйте все действия с использованием флуорофоров в условиях темноты.
| День 0 | ▪ Аликвота 50-75 мкг РНК на общий объем 55 мкл на 1,5 мл пробирки. | |||||
| День 1 | Активация 5'-фосфата | |||||
| ▪ Добавьте 45 мкл свежеприготовленного раствора EDC-NHS, pH 6.0 к РНК в ddH2O до конечного объема 100 μл, хорошо перемешайте и инкубируйте в течение 4 ч при 25 °C и 500 об/мин. | ||||||
| ▪ Очистительный раунд 1: Ночное осаждение EtOH. | ||||||
| День 2 | ▪ Осадите 5'-активированную РНК, промойте и высушите. | |||||
| Насадка для красителя 5 футов | ||||||
| ▪ Ресуспендировать в 95 мкл 100 мМ MOPS, pH 7,5. | ||||||
| ▪ Добавьте 5 мкл 2 мМ раствора амин-функционализированного красителя. | ||||||
| ▪ Хорошо перемешайте и выдерживайте в течение 16 часов при температуре 25 °C и 500 об/мин. | ||||||
| День 3 | ▪ Этап очистки 2: осаждение EtOH. | |||||
| День 4 | ▪ Осадите 5'-активированную РНК, промойте и высушите. | |||||
| Шаг блокировки | ||||||
| ▪ Ресуспендировать в 100 мкл 100 мМ Tris–HCl, pH 7,5 и инкубировать в течение 2 ч при 25 °C и 500 об/мин. | ||||||
| ▪ Этап очистки 3: Центробежная фильтрация. | ||||||
| → Элуируйте 5'-меченую РНК. | ||||||
| День 5 | 3'-Периодатное окисление | |||||
| ▪ Инкубируйте РНК с 20 мМ NaIO4 в 50 мМ буфере NaOAc, pH 5,5 в конечном объеме 100 мкл в течение 2 ч при 25 °C и 500 об/мин. | ||||||
| ▪ Утолите избыток периодата: добавьте 30 μл 50% глицерина, хорошо перемешайте и выдерживайте в течение 30 минут при температуре 25 °C и 500 об/мин. | ||||||
| ▪ Этап очистки 4: Ночное осаждение EtOH. | ||||||
| День 6 | ▪ Осаждайте 3'-окисленную РНК, промойте и высушите. | |||||
| 3'-Насадка для красителя | ||||||
| ▪ Ресуспендировано в 95 мкл 50 мМ NaOAc, pH 6,0. | ||||||
| ▪ Добавьте 5 мкл 2 мМ раствора гидразид-функционализированного красителя. Хорошо перемешайте и выдерживайте в течение 16 часов при температуре 25 °C и 500 об/мин. | ||||||
| День 7 | ▪ Круг очистки 5: осаждение EtOH. | |||||
| День 8 | ▪ Осаждайте помеченную РНК, промойте и высушите. | |||||
| ▪ Центробежная фильтрация. | ||||||
| → Элюируйте двустороннюю меченую РНК. | ||||||
Таблица 1: Резюме протокола для двустороннего мечения РНК. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
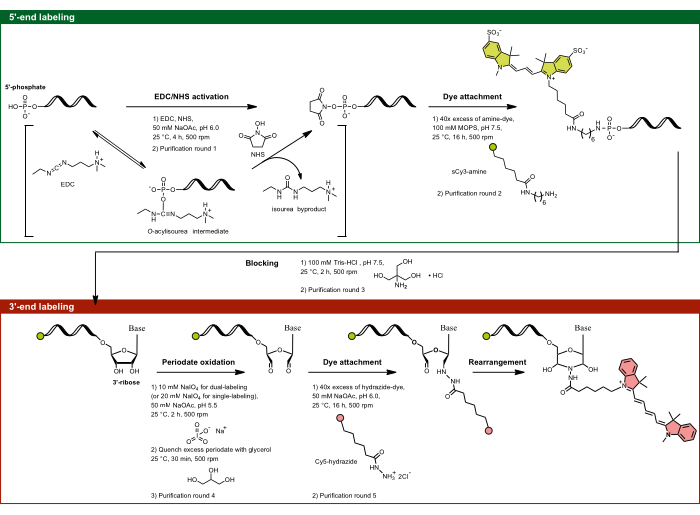
Рисунок 1: Экспериментальный процесс двустороннего мечения с нацеливанием на 5'-фосфат и 3'-рибозу. 5'-фосфат активируется с помощью EDC в присутствии NHS и впоследствии соединяется с аминофункционализированным красителем. 3'-диоловая часть РНК окисляется за счет активности периодата до диальдегида, который в дальнейшем вступает в реакцию с гидразид-функционализированным красителем. При двусторонней маркировке важно начать с 5'-маркировки, чтобы предотвратить перекрестную маркировку, а затем 3'-маркировки с промежуточным этапом блокировки. Сокращения: EDC = карбодиимид; NHS = N-гидроксисукцинимид; MOPS = 3-морфолинопропан-1-сульфоновая кислота; NaOAc = ацетат натрия. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
- 5'-концевая маркировка: нацеливание на 5'-фосфат с помощью активации EDC/NHS
Примечание: Этот метод 5'-мечения применим не только к РНК, но и к любой одноцепочечной нуклеиновой кислоте, содержащей 5'-фосфат. Специфичность реакции определяется зависимостью от pH, что позволяет использовать только 5'-фосфат в качестве сайт-специфичного мишени, несмотря на присутствие нескольких фосфатов в остове РНК. При pH 6,0 уникальная реакционная способность 5'-фосфата по отношению к карбодиимидам обусловлена его специфическим состоянием протонирования, при котором два кислорода депротонированы, а один остается протонированным. Это делает 5'-фосфат реакционноспособным, в то время как полностью депротонированные фоновые фосфаты остаются нереакционноспособными, что позволяет селективно мечить 5'-конец с помощью таргетирования EDC/NHS.- Приготовьте раствор EDC-NHS-NaOAc, pH 6,0. Смешайте 1,5 мг EDC и 2,0 мг NHS на аликвоту с 35 μL ddH2O и 10 μL 0,5 M NaOAc, pH 6,0 (pH скорректирован с помощью ледяной уксусной кислоты).
- Аликвотируйте интересующую РНК примерно 50-75 мкг РНК на пробирку в 55 мкл ddH2O. Добавьте к РНК 45 мкл смеси EDC-NHS-NaOAc, pH 6,0, достигнув общего объема 100 мкл с конечными концентрациями 78 мМ EDC, 174 мМ NHS и 50 мМ NaOAc, pH 6,0. Выдерживать в течение 4 ч при температуре 25 °C и встряхивать при 500 об/мин.
Примечание: Здесь 70 мкг соответствует 250 пмоль транскрибируемой in vitro 915 нт РНК и 2,5 мкМ в конечном реакционном объеме 100 мкл. - Раунд 1: Очистите 5'-фосфат-активированную РНК осаждением EtOH.
- Приготовьте в воде раствор сульфированного цианина3 амина (sCy3-амина) в концентрации 2 мМ.
- Ресуспендируйте активированную РНК-гранулу в 95 мкл 100 мМ буфера 3-морфолинопропан-1-сульфоновой кислоты (MOPS), pH 7,5 (pH скорректирован с помощью NaOH). Добавьте 5 мкл 2 мМ раствора sCy3-амина к активированной РНК. Соедините флуорофор с активированным 5'-фосфатом путем инкубации в течение 16 ч при 25 °C, встряхивая при 500 об/мин.
ПРИМЕЧАНИЕ: Храните буфер для швабры при температуре 4 °C в темноте. NaOH выбран для коррекции pH, чтобы интрон группы II рибозим оставался неактивным. Во флуорофоре должно быть не менее чем в 40 раз больше РНК. - Раунд очистки 2: Увеличьте объем, добавив 200 мкл ddH2O для улучшения сепарации. Очистите меченную 5'-фосфатом РНК с помощью осаждения EtOH и повторяйте до тех пор, пока надосадочная жидкость не станет бесцветной (обычно требуется два раунда).
- Этап блокирования: Ресуспендировать РНК в 100 мкл 100 мМ Tris-HCl, pH 7,5, и инкубировать в течение 2 ч при 25 °C и 500 об/мин. Только для 5'-концевой одиночной мечения пропустите этап блокирования, ресуспендируйте РНК в ddH2O и перейдите к шагу 1.1.8. Однако, для простоты, если используется двойная маркировка, отделите 5'-концевой блок управления с одной меткой только после шага 1.1.9.
Примечание: Этот этап служит для блокирования активированных 5'-фосфатов, которые не были связаны с флюорофором, функционализированным амином, путем реакции с относительно меньшим первичным источником аминов (например, Tris) для минимизации риска перекрестного мечения с функционализированным гидразидом флуорофором, который используется для протокола 3'-концевого мечения. - Раунд очистки 3: Удалите свободные красители путем промывки меченой РНК центробежной фильтрацией в общей сложности не менее 10 мл ddH2O, затем выведите в ddH2O.
ПРИМЕЧАНИЕ: Молекулярный порог фильтра должен составлять менее половины размера нуклеиновой кислоты. Вместо ddH2O. Элюирование должно соответствовать инструкциям производителя, гарантируя, что образец не будет раскручен до полного высыхания. - Определение концентраций РНК и конъюгатных красителей с помощью УФ-ВИД спектроскопии.
- 3'-концевое мечение: нацеливание на 3'-рибозу путем окисления периодата
- Аликвотируйте меченую 5'-концевую РНК вddH2O для получения примерно 50-75 мкг РНК на пробирку в 90 мкл. Если объем элюирования на предыдущей стадии был высоким, что приводило к низкой концентрации, сконцентрируйте РНК путем осаждения и повторного суспендирования гранулы в ddH2O. Добавьте 5 мкл 1,0 М буфера NaOAc, pH 5,5 (что соответствует 50 мМ NaOAc, pH 5,5 для 100 μL реакционного объема).
Примечание: Подобно 5'-концевой одномеченой РНК, мы обычно получаем 3'-концевую одномеченую РНК в качестве контроля. Для этого немеченую РНК аликотируют так, чтобы она содержала примерно 50-75 мкг РНК на пробирку в 86 мклddH2O. - Добавьте 4 мкл свежеприготовленного 500 мМ раствора метапериодата натрия (NaIO4) (что соответствует 10 мМ NaIO4 на 100 мкл реакционного объема). Для 3'-эндовой одиночной маркировки добавьте 8 мкл стокового раствора NaIO4 (что соответствует 20 мМ NaIO4 для реакционного объема 100 мкл). Тщательно перемешайте и инкубируйте в течение 2 часов при температуре 25 °C, встряхивая при 500 об/мин в темноте, так как NaIO4 светочувствительна.
ПРИМЕЧАНИЕ: Не изменяйте порядок добавления и не увеличивайте время инкубации в дальнейшем, так как это может вызвать фотообесцвечивание прикрепленного донорского красителя. Используемая концентрация NaIO4 уменьшается вдвое при двустороннем мечении, чтобы свести к минимуму гашение уже прикрепленного красителя на 5'-конце. - Остановите реакцию, добавив 30 мкл 50% глицерина. Инкубировать в течение 30 минут при температуре 25 °C, встряхивая при 500 об/мин.
ПРИМЕЧАНИЕ: Глицерин служит диолом для гашения избытка периодата. - Этап очистки 4: Добавьте 400 μL ледяной смеси осадков EtOH-NaOAc и выполните осаждение этанола.
- Ресуспендируйте окисленную РНК-гранулу в 95 мкл 50 мМ NaOAc, pH 6,0.
- Присоединение гидразид-краситель: Приготовьте раствор флуорофора, растворив несколько кристаллов гидразида цианина5 (Cy5-гидразида) в ДМСО, а затем разбавьте ddH2O до концентрации 2 мМ. Если выбранный флуорофор является водорастворимым, приготовьте раствор в ddH2O. Добавьте 5 мкл 2 мМ раствора гидразида Cy5 к окисленной РНК. Хорошо перемешайте и выдерживайте в течение 16 часов при температуре 25 °C, встряхивая при 500 об/мин.
Примечание: Флуорофор должен иметь как минимум 40-кратный избыток РНК. - Раунд 5 очистки: Очистите РНК с двойным концом (или 3'-концевую одинарную меченую РНК) с помощью осаждения EtOH и центробежной фильтрации, аналогично шагам 1.2.6 и 1.2.8 соответственно, и элуируйте в ddH2O.
- Рассчитайте концентрацию РНК и конъюгированного красителя с помощью УФ-ВИД спектроскопии.
- Охарактеризовать меченую РНК с помощью аналитических анализов на основе геля, ансамблевофлуоресцентной спектроскопии (см. раздел «Репрезентативные результаты ») и/или аналитической ВЭЖХ, как показано в другом месте3.
- Аликвотируйте меченую 5'-концевую РНК вddH2O для получения примерно 50-75 мкг РНК на пробирку в 90 мкл. Если объем элюирования на предыдущей стадии был высоким, что приводило к низкой концентрации, сконцентрируйте РНК путем осаждения и повторного суспендирования гранулы в ddH2O. Добавьте 5 мкл 1,0 М буфера NaOAc, pH 5,5 (что соответствует 50 мМ NaOAc, pH 5,5 для 100 μL реакционного объема).
2. Подготовка микрофлюидной камеры
ПРИМЕЧАНИЕ: Мы рекомендуем работать с шестью или восемью камерами одновременно. Ультразвуковая обработка проводится при комнатной температуре, если не указано иное. Этот протокол ограничивает использование органических растворителей, таких как ацетон, для предотвращения солюбилизации следовых примесей. Альтернативные варианты см. в ссылках15,16.
- Чистка
- Просверлите четыре отверстия в кварцевых предметных стеклах алмазным бурильщиком по схеме, приведенной на рисунке 2А , чтобы сформировать два канала.
ПРИМЕЧАНИЕ: Несмотря на то, что стеклянные стекла могут легко сломаться во время сверления, они являются экономичной альтернативой кварцевым предметным стеклам для объективной микроскопии TIRF, где покровное стекло является поверхностью изображения (Рисунок 2B). Это не вариант для установок TIRF на основе призмы, где предметное стекло микроскопии является поверхностью изображения из-за фоновой флуоресценции.
ПРИМЕЧАНИЕ: В качестве альтернативы утилизируйте использованные микрофлюидные камеры16. Для этого погрузите использованные камеры на ночь в ацетон (оберните банку для окрашивания Coplin алюминиевой фольгой, чтобы свести к минимуму испарения) в вытяжном шкафу, а затем проведите ультразвуковую обработку в течение 5 минут. Разберите камеру и выбросьте покровные листы и наклейки. Если разборка не получается сразу, обработайте камеру ультразвуком в ацетоне еще 10 мин. Перейдите к шагу 2.1.2. - Поместите просверленные кварцевые предметные стекла и примерно в два раза больше покровных стекол (так как они могут легко сломаться) в стеклянную банку для окрашивания Coplin с крышкой. Прополощите 3x с ddH2O. Сокатывайте в ddH2O в течение 5 минут, затем промойте 3x ddH2O.
- Обработать ультразвуком в 10% растворе для чистки лабораторной посуды (см. Таблицу материалов) в течение 30 мин при температуре 50 °C. Прополощите не менее 3 раз с ddH2O, пока пузырьки моющего средства не исчезнут. Ультразвуком в ddH2O в течение 5 мин. Промойте 3 раза с ddH2O.
- Обработать ультразвуком в 1 М растворе KOH в течение 30 минут, затем оставить на ночь. Смойте 3x с ddH2O. Сокатывайте в ddH2O в течение 5 минут. Промойте 3 раза с ddH2O.
ПРИМЕЧАНИЕ: Несмотря на то, что коррозия из-за чрезмерной инкубации является проблемой, ранее поднятой Chandradoss et al.15, мы рекомендуем эту длительную инкубацию, которая позволяет избежать травления пираньей. - Высушите слайды и покровные стекла с помощью N2(g).
- Высохшие предметные стекла и покровные стекла обработать кислородным плазменным очистителем в течение 30 минут в соответствии с инструкциями производителя.
- Просверлите четыре отверстия в кварцевых предметных стеклах алмазным бурильщиком по схеме, приведенной на рисунке 2А , чтобы сформировать два канала.
- Аминосиланизация
- Приготовьте 3% раствор APTES-EtOH, тщательно перемешав 288,5 мл абсолютного EtOH, 1,5 мл ddH2O и 9 мл (3-аминопропил)триэтоксисилана (APTES) в колбе Эрленмейера объемом 500 мл.
- Поместите чистые предметные стекла и покровные стекла в банку для окрашивания Coplin, погрузите в 3% раствор APTES-EtOH, окуните ультразвуком на 1 минуту и инкубируйте в течение 30 минут.
- Промойте 3 раза абсолютным EtOH, затем 3 раза ddH2O.
- Высушите слайды и покровные стекла под потоком N2(g).
- Поверхностная пассивация и биотинилирование
- Подготовьте влажную коробку, заполнив пустую коробку с наконечником для пипетки до половины ddH2O. Поместите предметные стекла внутрь коробки стороной для обработки вверх.
- Приготовьте смесь bPEG-mPEG в стерильно чистой микроцентрифужной пробирке объемом 1,5 мл, осторожно смешав 2 мг биотина-полиэтиленгликоля-сукцинимидилвалерата 5000 (биотин-PEG-SVA) и 80 мг метоксиполиэтиленгликоля-сукцинимидилвалерата (mPEG-SVA) в 640 мкл 100 мМ буфера бикарбоната натрия (NaHCO3), pH 8,3. Центрифугируйте смесь bPEG-mPEG при давлении 16 000 × г в течение 1 минуты, чтобы удалить пузырьки воздуха.
- Осторожно удалите надосадочную жидкость и добавьте каплю объемом 30 мкл в центр предметного стекла, чтобы покрыть оба канала. Поместите дополнительную каплю на одну сторону предметного стекла, чтобы получить дополнительное покровное стекло PEGylated, так как они легко ломаются, и полезно иметь запасной. Наконец, накройте каплю чистым покровным стеклом, закройте влажную коробку и выполните PEGylation на ночь в темноте.
- Тщательно промойте ПЭГ-пассивированные и биотинилированные стекла и покровные стекла с помощью ddH2O. Обратите внимание на изменение гидрофобности обработанных поверхностей. Высушите под потоком N2(g).
- Микрофлюидная камера в сборе
- Вырежьте двустороннюю наклейку, чтобы создать каналы. Прикрепите наклейку к предметному стеклу, убедившись, что она покрывает интересующую область. Аккуратно поместите покровное стекло сверху, выровняв его так, чтобы PEGилированные поверхности были обращены друг к другу.
- Поместите каждую собранную камеру в центрифужную пробирку объемом 50 мл, заполните пробирки N2(g) и храните при температуре -20 °C до 1 месяца.
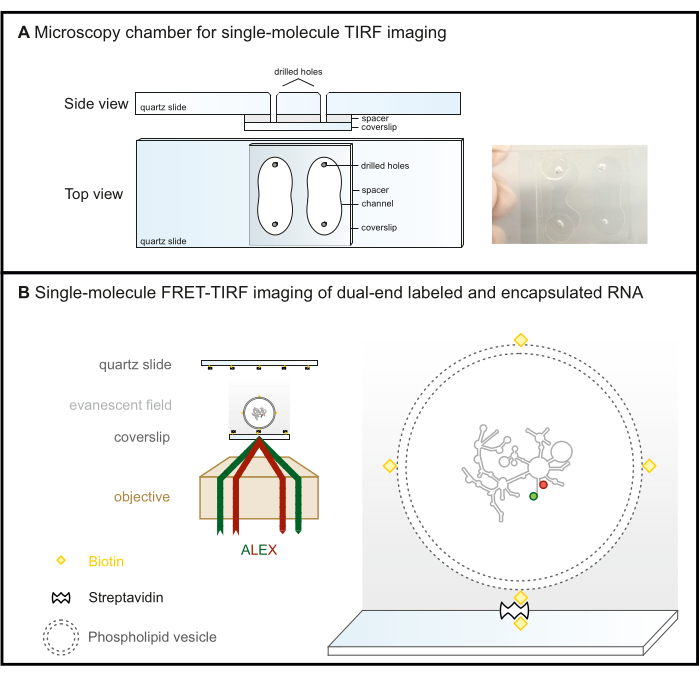
Рисунок 2: Одномолекулярная микроскопия FRET-TIRF. (A) Микрофлюидная камера для визуализации TIRF. (B) РНК, меченная FRET, инкапсулирована в биотинилированный фосфолипидный везикулу и иммобилизована на стеклянной поверхности, покрытой стептавидином. При этом интересующая молекула удерживается в затухающем поле (сером градиенте), которое создается падающим светом, полностью отражающимся под критическим углом в микроскопии TIRF. Здесь оба флуорофора впоследствии возбуждаются по схеме ALEX. Сокращения: FRET = Förster Resonance Energy Transfer; TIRF = полная флуоресценция внутреннего отражения; ALEX = альтернативное лазерное возбуждение. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
3. Инкапсуляция фосфолипидных везикул
- Приготовление липидного торта
ПРИМЕЧАНИЕ: Всегда работайте с хлороформом под вытяжным шкафом.- С помощью стерильной иглы проделайте отверстия в крышке (изнутри наружу) стерильно чистых микроцентрифужных пробирок объемом 2,0 мл, как показано на рисунке 3A.
- Готовьте стоковый раствор 1,2-дипальмитоил-sn-глицеро-3-фосфоэтаноламин-N-кап биотинила (bPE) путем растворения не менее 2 мг bPE в соответствующем количестве хлороформа до конечной концентрации 1 мг/мл.
- Готовьте стоковый раствор 1,2-димиристоил-sn-глицеро-3-фосфохолина (DMPC) путем растворения не менее 10 мг DMPC в соответствующем количестве хлороформа до конечной концентрации 10 мг/мл.
- Приготовьте смесь bPE-DMPC (сохраняя соотношение 1:99 мас./масса), смешав 100 μL bPE и 990 μL стоковых растворов DMPC. Распределите 109 мкл смеси bPE-DMPC на 2 мл пробирки.
- Поместите картонную ячейковую перегородку коробки для хранения микротрубок в колбу Schlenk, служащую держателем пробирки. С помощью длинного пинцета поместите пробирки, содержащие липидную смесь, в держатель пробирки в колбе Schlenk объемом 500 мл (рис. 3B).
ПРИМЕЧАНИЕ: Убедитесь, что они стоят вертикально и не наклонены. - Выпарить хлороформ при слабом потоке N2(g) в течение ночи (или не менее 2 часов до полного испарения растворителя).
- Заклейте трубки парапленкой, чтобы закрыть отверстия. Хранить липидные лепешки при температуре -20 °C до 1 месяца.
- Инкапсуляция РНК
- Приготовьте следующие буферы и растворы, регулируя концентрации K+ и Mg2+ в соответствии с интересующей биологической системой.
- Подготовьте стандартный буфер 5x (5x SB): 2,5 M KCl, 400 mM MOPS; отрегулируйте pH до 6,9 с помощью стерильного фильтра KOH и храните при температуре 4 °C в темноте (соответственно 1x SB: 500 мМ KCl, 80 мМ MOPS, pH 6,9).
- Приготовьте антимигающий буфер (AB): 100 мМ MgCl2, Trolox, 1x SB, стерильный фильтр, и храните при 4 °C в темноте до 1 недели.
ПРИМЕЧАНИЕ: Используйте кончик шпателя Trolox для конечного объема 10 мл, перемешайте и отрегулируйте pH.
- Соберите экструдер с помощью мембраны из поликарбоната (ПК) длиной 100 нм и дренажного диска из полиэстера (ПЭ) толщиной 10 мм, уравновесьте шприц и мембраны с помощью AB и нагрейте до 30 °C (или значительно выше температуры стеклования DMPC в 24 °C).
- Смешайте 5 мкл 1 мкМ меченой с двух сторон РНК и 45 мкл AB (до общего объема 50 мкл).
- Увлажните липидный жмых этим раствором РНК. При 30 °C перемешивайте в течение 5 минут, встряхивая при 1 400 об/мин, затем в течение 15 минут при 700 об/мин. Центрифугируйте в течение 2 мин при 13 000 г и осторожно переложите надосадочную жидкость в новую пробирку.
- Разбавьте образец 250 μл AB.
- Наполните шприц РНК-липидной суспензией. Экструдируйте 35 раз при 30 °C нагревательный блок, чтобы инкапсулировать РНК с двойным концом в фосфолипидные везикулы диаметром 100 нм.
ПРИМЕЧАНИЕ: Распределение везикул по размерам после использования экструдера может быть проверено с помощью динамического рассеяния света (DLS), как показано в ссылке11.
- Приготовьте следующие буферы и растворы, регулируя концентрации K+ и Mg2+ в соответствии с интересующей биологической системой.

Иллюстрация 3: Приготовление липидного кека. (A) Крышки трубок вытыкаются для обеспечения испарения растворителя. (В) Пробирки, содержащие липидную смесь, помещают в колбу Шленка, и хлороформ выпаривают с получением липидного пирога. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
4. Микроскопия smFRET-TIRF
- Поверхностная иммобилизация
- Приготовьте следующие буферы и растворы.
- Приготовьте сахаро-антимигающий буфер (SAB): 1% D-глюкозы (w/v) в AB, стерильном фильтре и храните при температуре 4 °C в темноте до 1 недели.
- Приготовьте 100x OSS: 100x Система очистки кислорода (OSS): 3 мг глюкозооксидазы (соответствует 1,7 U), 10 мкл каталазы (соответствует 22 U) в 90 мкл 1x SB, храните при 4 °C в темноте до 1 недели.
- Приготовьте буфер для визуализации (IB), смешав 198 μL SAB и 2 μL 100x OSS раствора.
- Дайте микрофлюидной камере нагреться до комнатной температуры. Промойте камеру 2x 200 μL 1x SB.
- Заполните камеру 50 мкл 20 мкл раствора стрептавидина в концентрации 20 мкл/мл и инкубируйте в течение 5 минут.
- Промойте камеру 200 мкл 1x SB, а затем 100 мкл AB.
- Инкапсулированную РНК обездвижить на поверхности, добавив 75 мкл везикулярной суспензии, и инкубировать в течение 10 минут.
- Промойте камеру 200 мкл свежеприготовленного IB и инкубируйте в течение 5 минут.
- Теперь камера готова к сбору данных (рис. 2B). Чтобы предотвратить испарение во время длительных измерений, загерметизируйте отверстия, как показано на рисунке 2A. Если утечки из канала в канал вызывают беспокойство, загерметизируйте неиспользуемый канал перед началом протокола иммобилизации поверхности.
ПРИМЕЧАНИЕ: Мы рекомендуем проводить холостые измерения в качестве проверки чистоты микрофлюидных камер и фосфолипидных везикул на предмет флуоресцентных загрязнений.
- Приготовьте следующие буферы и растворы.
Результаты
Мы представляем сайт-специфичную одно- и двойную флуоресцентную маркировку 915-нт РНК, представляющей интерес для митохондриального интрона дрожжей Sc.ai5γ группы II, окруженную экзонными последовательностями. Пара флуорофоров FRET располагается на концах РНК посредством активации 5'-фосфата EDC/NHS и окисления периодата 3'-рибозы с последующим присоединением соответствующего красителя. Затем мы верифицировали конъюгаты РНК-красителя с помощью флуоресцентного гель-электрофореза, как показано на рисунке 4A. Совместная миграция РНК и флуорофоров на агарозном геле подтверждает успешное мечение. Далее, как показано на рисунке 4B, была использована ансамблевая флуоресцентная спектроскопия для определения характеристик интрона II группы с двойной меткой. Перенос энергии, то есть FRET, наблюдался при возбуждении донорского красителя, что доказывает двойную маркировку РНК. Примечательно, что в соответствии с расстояние-зависимым характером FRET, сворачивание интронной РНК группы II в присутствии ионов металлов приводило к увеличению эффективности FRET, о чем свидетельствует снижение донорской эмиссии (зеленая стрелка) и соответствующее увеличение акцепторного излучения (красная стрелка). Это указывает на то, что данная маркировка FRET отслеживает конформационные изменения рибозима.
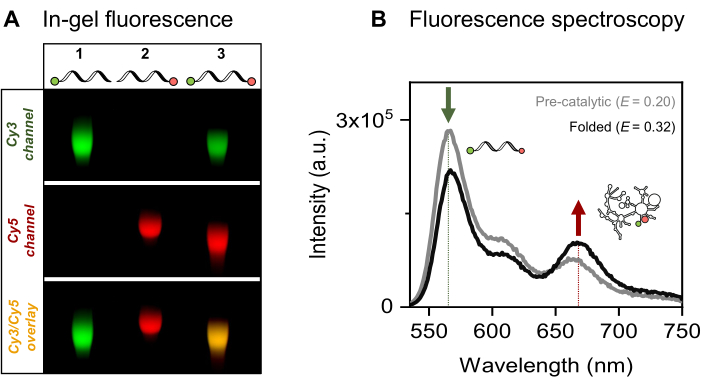
Рисунок 4: Характеристика конъюгатов РНК-красителя. (A) Аналитический анализ одно- и двухфлуоресцентно меченых РНК на основе геля показывает комиграцию красителей с РНК на 2% агарозном геле. На совместную локализацию флуорофоров в двойном меченом образце указывает желтая полоса на объединенном изображении (внизу) каналов Cy3 (вверху, зеленый) и Cy5 (средний, красный), визуализированных при освещении 532 нм и 635 нм соответственно. Дорожка 1: 5'-sCy3 мечена только РНК, линия 2: 3'-Cy5 мечена только РНК, а полоса 3: двухконечная (5'-sCy3 и 3'-Cy5) меченая РНК. (B) Ансамблевая флуоресцентная спектроскопия подтверждает двойную маркировку. Перенос энергии при донорском возбуждении (λex = 515 нм, λem = 670 нм) подтверждает, что оба красителя успешно связаны с РНК. Серая кривая представляет профиль излучения предкаталитической РНК, в то время как черная кривая демонстрирует повышенную эффективность FRET в свернутой интронной РНК группы II (инкубированной с 500 мМ KCl при 70 °C в течение 3 мин, охлажденной до 42 °C в течение 5 мин с последующим добавлением 100 мМ MgCl2). Этот рисунок был адаптирован из Ahunbay et al.3 Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Имея в руках флуоресцентный интрон II группы II с двойным мечением, мы теперь можем исследовать его динамику на уровне одной молекулы. После инкапсуляции в фосфолипидные везикулы меченая РНК иммобилизуется на поверхности микроскопии при очень низкой поверхностной плотности для достижения одномолекулярного разрешения для smFRET-TIRF. Как видно на рисунке 5А, несколько отдельных молекул могут быть отслежены одновременно. Микроскопия TIRF позволяет в режиме реального времени отслеживать эффективность FRET и ее изменения с течением времени. На рисунке 5B показаны статические и динамические одномолекулярные следы FRET меченой и инкапсулированной РНК. Типичная динамическая трассировка демонстрирует антикорреляцию между сигналами донора и акцептора, которая колеблется в эффективности FRET. Когда акцепторная эмиссия при донорном возбуждении увеличивается, донорская эмиссия соответственно уменьшается, что свидетельствует о динамическом изменении межкраевого расстояния. Эта антикорреляция предполагает конформационные изменения в молекуле РНК.
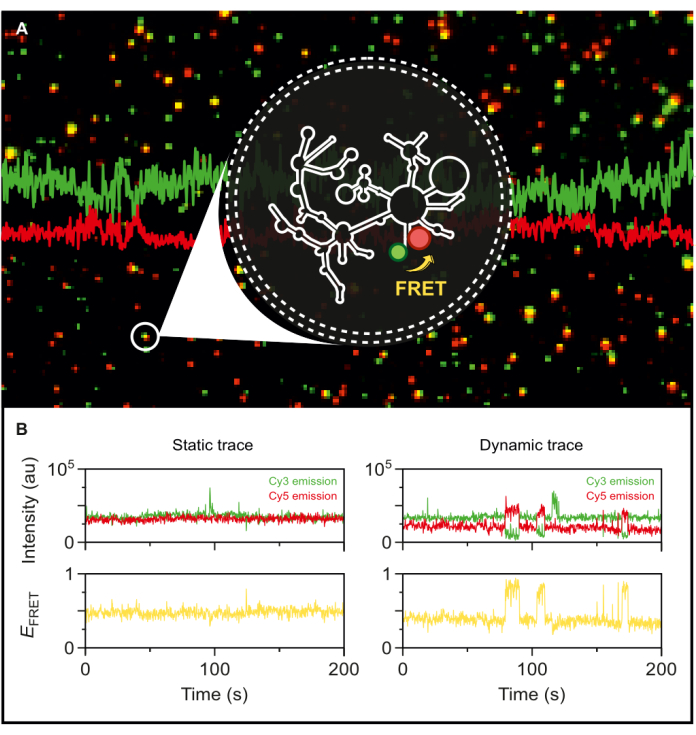
Рисунок 5: Высокодинамичное поведение интронной РНК группы II, выявленное с помощью smFRET. Меченая с двойным концом интронная РНК группы II инкапсулируется в фосфолипидный везикулу и иммобилизуется на поверхности для визуализации с помощью объективного микроскопа TIRF. (A) Объединенное изображение отдельных меченых молекул РНК, демонстрирующих донорную эмиссию (sCy3, зеленый) и акцепторную эмиссию (Cy5, красный) при возбуждении с длиной волны 532 нм. (B) Типичные траектории smFRET (слева) статической молекулы РНК, где интенсивности донора и акцептора не колеблются во времени, и (справа) динамической молекулы РНК, где интенсивности донора и акцептора антикоррелятны, с эффективностью FRET выделена желтым цветом. Отдельные молекулы локализуются и анализируются с помощью MASH-FRET17. Применяются коррекции прямого возбуждения, просвечивания и γ-факторной коррекции. Сокращения: smFRET = одномолекулярный резонансный перенос энергии Фёрстера. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Обсуждение
FRET на уровне отдельных молекул уникален, поскольку он позволяет наблюдать и анализировать отдельные молекулы, выявляя неоднородность образца и захватывая переходные состояния, которые могут быть скрыты при ансамблевых измерениях 1,2. Наблюдение за отдельными молекулами РНК с помощью smFRET позволяет с высоким разрешением получить представление об их путях сворачивания и динамике. Этот протокол описывает химическое двустороннее мечение РНК и ее поверхностную иммобилизацию с помощью инкапсуляции фосфолипидных везикул, что в совокупности позволяет отслеживать динамические конформационные изменения с помощью микроскопии smFRET-TIRF.
Изучение динамики РНК — постоянно развивающаяся область с потребностью в новых сайт-специфичных стратегиях флуоресцентного мечения. Мы помечаем концы РНК, нацеливаясь на 5'-фосфат карбодиимидами и 3'-рибозный сахар с периодатом. Эти подходы были описаны ранее (5'-end18,19 и 3'-end 19,20,21,22), но ранее не применялись к РНК аналогичного размера интрону Sc.ai5γ группы II группы дикого типа, которая требовала оптимизации. Активация 5'-фосфата карбодиимидом (например, EDC) обратима. Таким образом, имидазол использовали для необратимой реакции с промежуточным продуктом O-ацилизомочевины с образованием высокореакционноспособного фосфоримидазолида19,20. Тем не менее, в настоящее время известно, что при более высоком pH карбодиимиды могут модифицировать нуклеиновые основания, в частности гуанины и урацилы, что в последнее время привело к их использованию в качестве структурных зондирующих агентов.
Чтобы избежать перекрестной реактивности, решающее значение имеет очистка активированной РНК от EDC до повышения pH до 7,5 на этапе связывания красителя. Однако, когда мы ввели стадию очистки между активацией и присоединением красителя25, мы получили очень низкие выходы. Аналогично, при мечении белков поверхностно доступные остатки лизина могут быть активированы карбодиимидами. Однако вместо имидазола, который предотвращает реверсивную активацию, обычно используется NHS. Мы также приняли эту стратегию, заменив промежуточный продукт фосфоримидазолида на промежуточный продукт NHS-фосфата. Таким образом, мы добились контроля pH, а также увеличенной плотности мечения при более низких температурах и более коротком времени инкубации, т. е. 25 °C в течение 4 ч по сравнению с 37 °C в течение 16 ч. Разработанная для РНК, эта стратегия 5'-мечения может быть применена к любой другой одноцепочечной нуклеиновой кислоте с 5'-фосфатом.
Активация 5'-фосфата и окисление 3'-рибозы были взаимоисключающими, поскольку химические вещества не являются ортогональными. Чтобы преодолеть эту проблему и избежать перекрестной маркировки, мы начали с 5'-конца, за которым последовал этап блокировки для ингибирования активированных, но не помеченных сайтов, прежде чем приступить к 3'-концевой маркировке. При окислении 3'-диола избыток метапериодата натрия (NaIO4) может погасить уже прикрепленный флуорофор на 5'-конце. Поэтому мы снизили концентрацию NaIO4 , используемого для одиночного мечения, с 20 мМ до 10 мМ.
Мы рекомендуем работать с несколькими аликвотами параллельно, а не масштабировать реакции. Этот протокол требует нескольких этапов осаждения этанола (EtOH). При работе с несколькими аликвотами параллельно готовят осадочную смесь (30 мл 100% абсолютного EtOH и 1 мл 3 М NaOAc, pH 5,2). NaCl не используется из-за его низкой растворимости в EtOH. Осаждение РНК с 3,1 об. этой смеси путем ночной инкубации при -20 °C с последующим центрифугированием. Дважды промойте гранулу РНК с 500 мкл ледяного 70% EtOH, после каждого раза отжимайте при 4 °C и сушите под вакуумом. Осаждение EtOH использует преимущества нерастворимости РНК и растворимости свободных красителей в 70% этаноле. Центробежная фильтрация эффективно удаляет свободные красители благодаря их значительному отличию в размерах от РНК и способствует буферному обмену, устраняя соли. В дополнение к методам осаждения EtOH и центробежной фильтрации, свободные красители также могут быть удалены с помощью методов гелевой экстракции и/или хроматографии (например, ВЭЖХ); Тем не менее, масштаб должен быть соответствующим образом адаптирован. Не делайте вихревые длинные РНК для ресуспенда, так как это может привести к механическому сдвигу26. Оптимальное время для приостановки протокола — когда РНК гранулирована. Мы используем трубки с низким связыванием ДНК для улучшения восстановления нуклеиновых кислот. Несмотря на то, что конечный объем реакции составляет 100 мкл, для лучшей очистки осаждением EtOH предпочтительны пробирки объемом 1,5 мл (и не меньше).
После удаления непрореагировавших свободных красителей с помощью осаждения и центробежной фильтрации мы подтвердили мечение с помощью флуоресцентного гелевого электрофореза (рис. 4А), УФ-ВИД спектроскопии, аналитической ВЭЖХ3. Тем не менее, важно отметить, что эти методы не могут различить молекулу РНК, несущую как флуорофоры, так и смесь РНК, каждая из которых помечена одним цветом. Точно так же они не могут быть использованы для определения того, несет ли молекула РНК несколько флуорофоров одного цвета. Масс-спектрометрия не может быть использована из-за ограничений по размеру. Ансамбль3 и одномолекулярная FRET-спектроскопия подтверждают двойное флуоресцентное мечение, как показано на рисунках 4B и 5B. Стехиометрия 0,5 (соотношение sCy3 и Cy5 1:1) в экспериментах smFRET подтверждает равное сопряжение двух флуорофоров. Одной из проблем была двойная маркировка на 3'-конце путем маркировки обоих альдегидов вместо предложенной циклизации. Отсутствие видов со стехиометрией 0,25 (соотношение sCy3 к Cy5 1:2) в экспериментах smFRET позволяет предположить, что прикрепление красителя стерически препятствует и предотвращает прикрепление второго красителя.
При таком двойном флуоресцентном мечении изменения сигнала FRET можно объяснить структурными перестройками в процессе сворачивания РНК и катализа. Для поддержания флуоресцентно меченой РНК в затухающем поле при визуализации одномолекулярного TIRF инкапсуляция предпочтительнее прямого поверхностного связывания. Этот подход включает в себя захват отдельных молекул РНК в липидных бислоях везикул, создавая контролируемую среду, способствующую наблюдению за их динамическим поведением. Описанный протокол обогащает моноинкапсуляцию, как показывает фотообесцвечивание за один этап11. Чтобы понять сворачивание и функцию РНК, необходимо соединить разрыв in vitro и in vivo 27. Агенты молекулярного скученности могут имитировать условия внутри клеток для усиления катализа РНК интронами группы II 7,28. С другой стороны, инкапсуляция создает ограниченное микроокружение, которое способствует сворачиванию РНК29, приближая наше понимание структуры и динамики РНК к реалистичному клеточному контексту.
Раскрытие информации
Авторы заявляют об отсутствии конфликта интересов.
Благодарности
Выражается благодарность за финансовую поддержку от Швейцарского национального научного фонда [200020_192153 RKOS], UZH Forschungskredit [FK-20-081 to EA], UZH Stiftung für wissenschaftliche Forschung [RKOS и SZP], Graduate Research Campus (GRC) Short Grant [2024__SG_092 EA], Высшей школы химических и молекулярных наук Цюриха (CMSZH) и Цюрихского университета.
Материалы
| Name | Company | Catalog Number | Comments |
| RNA labeling | |||
| 1.5 mL DNA LoBind tubes | Eppendorf | 30108035 | |
| 1-ethyl-3-(3-dimethylaminopropyl)carbodiimide hydrochloride (EDC-HCl or EDC) | Thermo Scientific | 11844071 | Pierce EDC, No-Weigh Format. Store at -20 °C |
| 3-morpholinopropane-1-sulfonic acid (MOPS) | Sigma-Aldrich | 69947 | BioUltra, for molecular biology, ≥99.5% (titration) |
| Acetic acid (glacial) | Sigma-Aldrich | 1.00063 | 100%, anhydrous for analysis EMSURE ACS,ISO,Reag. Ph Eur |
| Centrifugal filtration unit | Sartorius | VS0132 | Vivaspin 500, MWCO 50.000, PES, 500 μL |
| Cyanine5 hydrazide (Cy5-hydrazide) | Lumiprobe | 23070 | 5 mg, CAS number 1427705-31-4 |
| Dimethyl sulfoxide (DMSO) | New England Biolabs | 12611P | Molecular biology grade |
| Ethanol | VWR Chemicals | 20821.296P | Absolute ≥99,8% |
| Glycerol | Sigma-Aldrich | G5516 | for molecular biology, ≥99.0% |
| Hydrochloric acid (HCl) | Sigma-Aldrich | 1.00317 | fuming 37%, for analysis EMSURE ACS,ISO,Reag. Ph Eur |
| N-hydroxysuccinimide (NHS) | Sigma-Aldrich | 130672 | 98% |
| Sodium acetate (NaOAc) | Sigma-Aldrich | S8750 | anhydrous, ReagentPlus, ≥99.0% |
| Sodium meta-periodate (NaIO4) | Thermo Fisher Scientific, Life Technologies | 20504 | Pierce product line |
| Sulfo-Cyanine3 amine (sCy3-amine) | Lumiprobe | 213C0 | 5 mg, CAS number 2183440-43-7 |
| Tris(hydroxymethyl)aminomethane (Tris) | Biosolve | 200923 | Molecular biology grade |
| Chamber preparation | |||
| 3-aminopropyl)triethoxysilane (APTES) | Sigma-Aldrich | 440140 | 99% |
| Acetone | Sigma-Aldrich | 1.00014 | for analysis EMSURE ACS,ISO,Reag. Ph Eur |
| Biotin-Polyethylene glycol-Succinimidyl valerate (biotin-PEG-SVA, bPEG) and Methoxy polyethylene glycol-Succinimidyl valerate (mPEG-SVA) | Laysan Bio, Inc. | BIO-PEG-SVA, MW 5,000 and MPEG-SVA, MW 5,000 - Combo Kit | |
| Coverslips | Carl Roth | H876.2 | 24 x 24 mm, 0.13-0.16 mm thickness |
| Deconex 11 universal | Borer Chemie AG | 17416492 | Laboratory glassware cleaning solution |
| Diamond coated core drill bit | Crystalite corporation | 1 mm thickness | |
| Diamond driller | |||
| Ethanol | VWR Chemicals | 20821.296P | Absolute ≥99,8% |
| Glass Coplin staining jar with cover | |||
| Imaging spacer | Grace Bio-Labs | 654008 | SecureSeal, 8 wells, 9 mm × 0.12 mm |
| Oxygen plasma cleaner | Zepto One | Diener | |
| Potassium hydroxide (KOH) | Sigma-Aldrich | P9541 | for molecular biology, ≥99.0% |
| Quartz slides | G. Finkenbeiner, Inc. | 7.5 x 2.5 cm, 1 mm thickness | |
| Sodium bicarbonate (NaHCO3) | Sigma-Aldrich | S6297 | BioXtra, 99.5-100.5% |
| Lipid cake preparation | |||
| 16:0 Biotinyl Cap PE, bPE (1,2-dipalmitoyl-sn-glycero-3-phosphoethanolamine-N-(cap biotinyl) (sodium salt), C53H98N4O11PNaS) | Avanti Polar Lipids | 870277P | Stable for 1 year at -20 °C |
| 14:0 PC, DMPC (1,2-ditetradecanoyl-sn-glycero-3-phosphocholine or 1,2-dimyristoyl-sn-glycero-3-phosphocholine, C36H72NO8P) | Avanti Polar Lipids | 850345P | |
| 2.0 mL microcentrifuge tubes, Safe-Lock | Eppendorf | 0030120094 | Autoclave to sterilize |
| 500 mL Schlenk flask | |||
| Chloroform | Merck | 1.02445 | for analysis EMSURE ACS, ISO, Reag. Ph Eur |
| Parafilm | |||
| Surface immobilization via encapsulation | |||
| (±)-6-Hydroxy-2,5,7,8-tetramethylchromane-2-carboxylic acid (Trolox®) | Thermo Fischer | 53188-07-1 | 97% |
| 3-morpholinopropane-1-sulfonic acid (MOPS) | Sigma-Aldrich | 69947 | BioUltra, for molecular biology, ≥99.5% (titration). Store at +4 °C in the dark. |
| Adhesive seal tabs | Grace Bio-Labs | 629200 | |
| Catalase | Sigma-Aldrich | 9001-05-2, C30 | from bovine liver, aqueous suspension, 10,000-40,000 units/mg protein |
| D-glucose | Sigma-Aldrich | G7528 | ≥99.5% (GC), BioXtra |
| Extruder polycarbonate (PC) membrane | Avanti Polar Lipids | 610005-1EA | 0.1 μm, 19 mm |
| Extruder set with heating block | Avanti Polar Lipids | 610000 | |
| Glucose oxidase | Sigma-Aldrich | 9001-37-0 | from Aspergillus niger, Type VII, lyophilized powder, ≥100,000 units/g solid (without added oxygen) |
| Magnesium chloride (MgCl2) | Sigma-Aldrich | 7786-30-3, M1028 | for molecular biology, 1.00 M ± 0.01 M solution |
| Polyester (PE) drain disc, membrane | Whatman, Cytiva | 230300 | 10 mm |
| Potassium chloride (KCl) | Sigma-Aldrich | 60128 | BioUltra, for molecular biology, ≥99.5% (AT) |
| Potassium hydroxide (KOH) | Sigma-Aldrich | P9541 | for molecular biology, ≥99.0% |
| Streptavidin | Thermo Fischer | 434301 |
Ссылки
- Eitan, L., et al. FRET-based dynamic structural biology: Challenges, perspectives and an appeal for open-science practices. Elife. 10, e60416(2021).
- Taekjip, H., et al. Fluorescence resonance energy transfer at the single-molecule level. Nat Rev Methods Primers. 4, 22(2024).
- Ahunbay, E., Steffen, F. D., Zelger-Paulus, S., Sigel, R. K. O. Chemical dual end-labeling of large ribozymes. Methods Mol Biol. 2439, 191-204 (2022).
- Ahunbay, E., Zelger-Paulus, S., Sigel, R. K. O. Group II Introns: Highly structured yet dynamic. Chimia (Aarau). 77 (4), 235-241 (2023).
- Steiner, M., Karunatilaka, K. S., Sigel, R. K. O., Rueda, D. Single-molecule studies of group II intron ribozymes. Proc Natl Acad Sci USA. 105 (37), 13853-13858 (2008).
- Karunatilaka, K. S., Solem, A., Pyle, A. M., Rueda, D. Single-molecule analysis of Mss116-mediated group II intron folding. Nature. 467 (7318), 935-939 (2010).
- Paudel, B. P., Fiorini, E., Börner, R., Sigel, R. K. O., Rueda, D. S. Optimal molecular crowding accelerates group II intron folding and maximizes catalysis. Proc Natl Acad Sci USA. 115 (47), 11917-11922 (2018).
- Saha, R., Verbanic, S., Chen, I. A. Lipid vesicles chaperone an encapsulated RNA aptamer. Nat Commun. 9 (1), 2313(2018).
- Boukobza, E., Sonnenfeld, A., Haran, G. Immobilization in surface-tethered lipid vesicles as a new tool for single biomolecule spectroscopy. J Phys Chem B. 105 (48), 12165-12170 (2001).
- Cisse, I., Okumus, B., Joo, C., Ha, T. Fueling protein DNA interactions inside porous nanocontainers. Proc Natl Acad Sci USA. 104 (31), 12646-12650 (2007).
- Zelger-Paulus, S., Hadzic, M. C. A. S., Sigel, R. K. O., Börner, R. Encapsulation of fluorescently labeled RNAs into surface-tethered vesicles for single-molecule FRET studies in TIRF microscopy. Methods Mol Biol. 2331, 1-16 (2020).
- Okumus, B., Wilson, T. J., Lilley, D. M. J., Ha, T. Vesicle encapsulation studies reveal that single molecule ribozyme heterogeneities are intrinsic. Biophys J. 87 (4), 2798-2806 (2004).
- Ishitsuka, Y., Okumus, B., Arslan, S., Chen, K. H., Ha, T. Temperature-independent porous nanocontainers for single-molecule fluorescence studies. Anal Chem. 82 (23), 9694-9701 (2010).
- Liu, B., Mazouchi, A., Gradinaru, C. C. Trapping single molecules in liposomes: surface interactions and freeze-thaw effects. J Phys Chem B. 114 (46), 15191-15198 (2010).
- Chandradoss, S. D., et al. Surface passivation for single-molecule protein studies. J Vis Exp. (86), e50549(2014).
- Paul, T., Myong, S. Protocol for generation and regeneration of PEG-passivated slides for single-molecule measurements. STAR Protoc. 3 (1), 101152(2022).
- Hadzic, M. C. A. S., Kowerko, D., Börner, R., Zelger-Paulus, S., Sigel, R. K. O. Detailed analysis of complex single molecule FRET data with the software MASH. Imaging, Manipulation, and Analysis of Biomolecules, Cells, and Tissues IX. Farkas, D. L., Nicolau, D. V., Leif, R. C. SPIE 971119, (2016).
- Chu, B. C., Wahl, G. M. Le Orgel. Derivatization of unprotected polynucleotides. Nucleic Acids Res. 11 (18), 6513-6529 (1983).
- Qin, P. Z., Pyle, A. M. Site-specific labeling of RNA with fluorophores and other structural probes. Methods. 18 (1), 60-70 (1999).
- Whitfeld, P. R. A method for the determination of nucleotide sequence in polyribonucleotides. Biochem J. 58 (3), 390-396 (1954).
- Zamecnik, P. C., Stephenson, M. L., Scott, J. F. Partial purification of soluble RNA. Proc Natl Acad Sci USA. 46 (6), 811-822 (1960).
- Proudnikov, D., Mirzabekov, A. Chemical methods of DNA and RNA fluorescent labeling. Nucleic Acids Res. 24 (22), 4535-4542 (1996).
- Wang, P. Y., Sexton, A. N., Culligan, W. J., Simon, M. D. Carbodiimide reagents for the chemical probing of RNA structure in cells. RNA. 25 (1), 135-146 (2019).
- Mitchell, D., et al. In vivo RNA structural probing of uracil and guanine base-pairing by 1-ethyl-3-(3-dimethylaminopropyl)carbodiimide (EDC). RNA. 25 (1), 147-157 (2019).
- Rinaldi, A. J., Suddala, K. C., Walter, N. G. Native purification and labeling of RNA for single molecule fluorescence studies. Methods Mol Biol. 1240, 63-95 (2015).
- Liu, T., Patel, S., Pyle, A. M. Making RNA: Using T7 RNA polymerase to produce high yields of RNA from DNA templates. Methods in Enzymology. , Academic Press. (2023).
- Leamy, K. A., Assmann, S. M., Mathews, D. H., Bevilacqua, P. C. Bridging the gap between in vitro and in vivo RNA folding. Q Rev Biophys. 49, e10(2016).
- Fiorini, E., Börner, R., Sigel, R. K. O. Mimicking the in vivo Environment--The Effect of Crowding on RNA and Biomacromolecular Folding and Activity. Chimia. 69 (4), 207-212 (2015).
- Peng, H., Lelievre, A., Landenfeld, K., Müller, S., Chen, I. A. Vesicle encapsulation stabilizes intermolecular association and structure formation of functional RNA and DNA. Curr Biol. 32 (1), 86-96.e6 (2022).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены