Method Article
Tek Moleküllü FRET-TIRF Mikroskobu için Uzun RNA'ların Floresan Uç Etiketlemesi ve Kapsüllenmesi
Bu Makalede
Özet
Bu makale, uzun RNA'ların terminal konumlarında çift renkli etiketlenmesini ve tek moleküllü FRET TIRF mikroskobu uygulamaları için fosfolipid veziküllerde kapsülleme yoluyla yüzey immobilizasyonunu açıklamaktadır. Bu tekniklerin birleştirilmesi, RNA dinamiklerinin tek molekül düzeyinde hassas bir şekilde görselleştirilmesini ve analiz edilmesini sağlar.
Özet
Tek moleküllü Förster Rezonans Enerji Transferi (smFRET), zaman içindeki konformasyonel değişikliklerinin hassas bir şekilde gözlemlenmesine izin vererek dinamik biyomoleküllerin incelenmesinde mükemmeldir. smFRET ile RNA dinamiklerini izlemek için, RNA'ları bir FRET florofor çifti ile terminallerinde kovalent olarak etiketlemek için bir yöntem geliştirdik. Bu doğrudan uç etiketleme stratejisi, karbodiimid (EDC)/N-hidroksisüksinamid (NHS) aktivasyonu ile 5'-fosfatı ve periyotat oksidasyonu ile 3'-ribozu hedefler, bu da boyutlarına ve dizilerine bakılmaksızın diğer RNA'lara uyarlanabilir ve bunları yapay modifikasyonlardan bağımsız olarak incelemek için kullanılabilir. Ayrıca, 5'-EDC/NHS aktivasyonu, 5'-fosfatlı tüm nükleik asitler için genel ilgi çekicidir. Ticari olarak temin edilebilen kimyasalların kullanılması, RNA'ya özgü probların sentezlenmesi ihtiyacını ortadan kaldırır.
Toplam İç Yansıma Floresan (TIRF) mikroskobu, ilgilenilen yüzeyle hareketsiz hale getirilmiş moleküllerin aydınlatılacak buharlaşma alanı içinde olmasını gerektirir. RNA moleküllerini buharlaşan alan içinde tutmanın karmaşık bir yolu, onları fosfolipid veziküller içinde kapsüllemektir. Kapsülleme, molekülün serbest difüzyonunu sağlarken molekülü yüzeye bağlayarak her iki dünyanın da en iyisinden yararlanır. Her vezikülün yalnızca tek bir RNA molekülü içerdiğinden emin olarak tek moleküllü görüntülemeyi mümkün kılıyoruz. İlgilenilen RNA'nın çift uçlu etiketlenmesi ve kapsüllenmesi üzerine, smFRET ölçümleri, RNA davranışının dinamik ve ayrıntılı bir görünümünü sunar.
Giriş
Förster Rezonans Enerji Transferi (FRET), biyomoleküllerin moleküller arası ve moleküller arası etkileşimlerini nano ölçekte incelemek için güçlü ve hassas bir tekniktir. Uyarılmış bir donör molekülden yakındaki bir alıcı moleküle, tipik olarak 1 nm ile 10 nm arasındaki mesafelerde meydana gelen radyasyonel olmayan enerji transferine dayanır. Verici ve alıcı boyalar arasındaki mesafe, bu enerji transferinin verimliliğini belirler ve FRET'i, RNA'lar da dahil olmak üzere çok çeşitli biyolojik sistemlerde 1,2 moleküler dinamikleri, konformasyonel değişiklikleri ve etkileşimleri incelemek için paha biçilmez bir araç haline getirir. Toplam İç Yansıma Floresan (TIRF) mikroskobunun smFRET araştırmaları için güçlü bir teknik olduğu kanıtlanmıştır, çünkü molekülleri yalnızca yüzeye yakın seçici olarak aydınlatır ve tek tek moleküllerin yüksek uzamsal ve zamansal çözünürlüğe sahip FRET dinamiklerine izin verir. Bununla birlikte, smFRET-TIRF deneylerini gerçekleştirmeden önce, ilgilenilen molekül önce uygun bir FRET çifti ile floresan olarak etiketlenmeli ve daha sonra mikroskopi yüzeyi üzerinde hareketsiz hale getirilmelidir. Burada tarif edilen smFRET-TIRF protokolü, iki ekzonik dizisi (915 nükleotid) ile çevrili Saccharomyces cerevisiae mitokondriden vahşi tip grup II intron Sc.ai5γ kullanılarak doğrulanmıştır.3. Floresan etiketleme grubu II intronlarının ve bunların smFRET TIRF mikroskobu için immobilizasyonunun daha ayrıntılı bir görünümü için, incelememizebakın 4.
İdeal bir bölgeye özgü RNA etiketleme stratejisi, RNA'nın yapısını veya işlevini değiştirmeden donör ve alıcı boyaların önceden belirlenmiş konumlarda hassas bir şekilde birleştirilmesine izin vererek doğru ve verimli FRET ölçümleri sağlar. Bu, seçici etiketlemeyi karmaşıklaştıran dört nükleobaz arasındaki kimyasal benzerlikler nedeniyle zordur. Uç etiketleme, 5'-fosfat ve 3'-riboz'u hedefleyerek donör ve alıcı boyaları RNA uçlarına bağlar. Bu yaklaşım, minimal invaziv bir yaklaşım sunarken, yapısal dinamikler ve etkileşimler hakkında değerli bilgiler sağlamaya devam eder. Grup II intron'un Mg2+ varlığında kendi kendine birleşme yeteneği, metal iyonuna bağımlı enzimlerin kullanımını kısıtlar. Burada, enzimlere veya özel probların sentezine olan ihtiyacı atlayan çift uç etiketli uzun ve katalitik olarak aktif RNA'lara (ribozimler) bir yaklaşım sunuyoruz.
TIRF mikroskobu için RNA moleküllerini yüzeye bağlamak için yaygın bir yaklaşım, bir biyotin parçasını doğrudan RNA'ya kovalent olarak bağlamak veya biyotin taşıyan bir antisens oligonükleotidi (ASO) hibritleştirmektir5,6,7. Bununla birlikte, bu doğrudan immobilizasyon yöntemi, RNA-yüzey etkileşimlerine bağlı olarak artefaktlara neden olabilir ve bu da potansiyel olarak yanlış katlanmış RNA'laraneden olabilir 8. Bu immobilizasyon artefaktlarını hafifletmek için zarif bir çözüm, RNA'yı yüzeye bağlı nano ölçekli fosfolipid veziküller 9,10,11 içinde kapsüllemektir. Çapı yaklaşık 100 nm olan bu veziküller, bir biyotin-streptavidin bağı 12,13,14 ile yüzeye tutturulur ve RNA'nın lipid zarı10 boyunca iyon alışverişine izin verirken içeride serbestçe yayılmasına izin verir. Büyük bir fonksiyonel RNA3'ü kovalent olarak etiketledikten sonra, RNA işlevselliğini korumak için uyarlanmış yüzey pasivasyonu ve vezikül kapsüllemesi için yerleşik protokolleri birleştirerek bu tür RNA'ları fosfolipid veziküllerde kapsüllemek için bir yaklaşım sunuyoruz 10,11,14. Bu çift uçlu etiketleme ve kapsülleme yaklaşımı, smFRET TIRF mikroskobu için fonksiyonel RNA'ların yüksek oranda mono kapsüllenmesini sağlar.
Protokol
1. RNA çift uç etiketleme
NOT: Aşağıdaki protokol, bir donör boyanın (sCy3) 5'-fosfata ve bir alıcı boyanın (Cy5) 3'-riboza kovalent bağlanmasıyla bir FRET çift florofor ile RNA'ların bölgeye özgü etiketlenmesini açıklar. Katalitik olarak aktif bir uzun RNA, grup II intron ribozimi, ilgilenilen RNA olarak seçilir. Tablo 1 ve Şekil 1 , bu çift uçlu etiketleme protokolünü özetlemektedir. Floroforları içeren tüm adımları karanlık koşullar altında gerçekleştirin.
| Gün 0 | ▪ 1.5 mL tüp başına toplam 55 μL hacme 50-75 μg RNA'yı alikot. | |||||
| 1. Gün | 5" -Fosfat aktivasyonu | |||||
| ▪ 45 μL taze hazırlanmış EDC-NHS, pH 6.0 çözeltisi ddH2O'dakiRNA'ya 100 μL'lik bir nihai hacme ekleyin, iyice karıştırın ve 25 ° C ve 500 rpm'de 4 saat inkübe edin. | ||||||
| ▪ Arınma turu 1: Gece boyunca EtOH yağışı. | ||||||
| 2. Gün | ▪ 5' ile aktive edilmiş RNA'yı çökeltin, yıkayın ve kurulayın. | |||||
| 5" -Boya eki | ||||||
| ▪ 95 μL 100 mM MOPS, pH 7.5 içinde yeniden süspanse edin. | ||||||
| ▪ 5 μL 2 mM amin ile işlevselleştirilmiş boya çözeltisi ekleyin. | ||||||
| ▪ İyice karıştırın ve 25 ° C ve 500 rpm'de 16 saat inkübe edin. | ||||||
| 3. Gün | ▪ Arınma turu 2: EtOH yağışı. | |||||
| 4. Gün | ▪ 5' ile aktive edilmiş RNA'yı çökeltin, yıkayın ve kurulayın. | |||||
| Engelleme adımı | ||||||
| ▪ 100 μL'lik 100 μM Tris-HCl, pH 7.5'te yeniden süspanse edin ve 25 ° C ve 500 rpm'de 2 saat inkübe edin. | ||||||
| ▪ Saflaştırma turu 3: Santrifüj filtrasyonu. | ||||||
| → 5' etiketli RNA'yı elute edin. | ||||||
| 5. Gün | 3′-Periyoda oksidasyonu | |||||
| ▪ RNA'yı 50 mM NaOAc tamponunda 20 mM NaIO4 ile inkübe edin, pH 5.5, 100 μL'lik bir son hacimde 25 °C ve 500 rpm'de 2 saat boyunca inkübe edin. | ||||||
| ▪ Fazla periyodu söndürün: 30 μL %50 gliserol ekleyin, iyice karıştırın ve 25 °C ve 500 rpm'de 30 dakika inkübe edin. | ||||||
| ▪ Arınma turu 4: Gece boyunca EtOH yağışı. | ||||||
| 6. Gün | ▪ 3'-oksitlenmiş RNA'yı çökeltin, yıkayın ve kurutun. | |||||
| 3′-Boya eki | ||||||
| ▪ 95 μL'lik 50 mM NaOAc, pH 6.0 içinde yeniden süspanse edin. | ||||||
| ▪ 5 μL 2 mM hidrazid ile işlevselleştirilmiş boya çözeltisi ekleyin. İyice karıştırın ve 25 ° C ve 500 rpm'de 16 saat inkübe edin. | ||||||
| 7. Gün | ▪ Arınma turu 5: EtOH yağışı. | |||||
| 8. Gün | ▪ Etiketli RNA'yı çökeltin, yıkayın ve kurulayın. | |||||
| ▪ Santrifüj filtrasyonu. | ||||||
| → Çift uçlu etiketli RNA'yı elute. | ||||||
Tablo 1: RNA çift uçlu etiketleme için protokol özeti. Bu Tabloyu indirmek için lütfen buraya tıklayın.
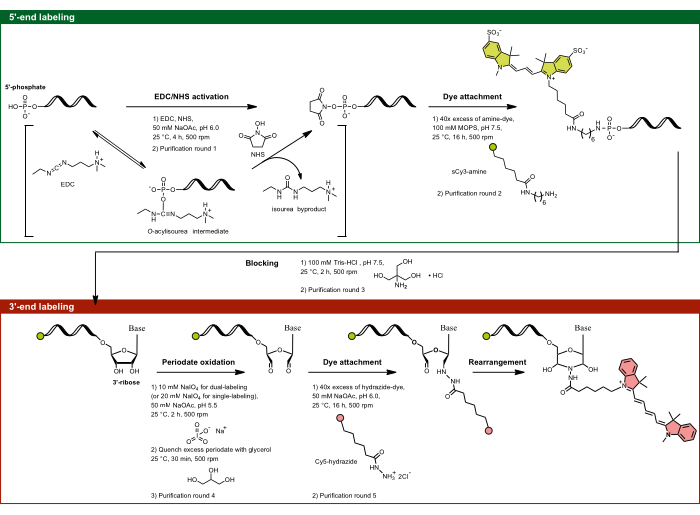
Şekil 1: 5'-fosfat ve 3'-riboz şekerini hedefleyerek çift uçlu etiketlemenin deneysel akışı. 5'-fosfat, NHS varlığında EDC kullanılarak aktive edilir ve daha sonra amin ile işlevselleştirilmiş boya ile birleştirilir. RNA'nın 3'-diol kısmı, periyodat aktivitesi ile dialdehite oksitlenir, bu da hidrazid ile işlevselleştirilmiş boya ile daha fazla reaksiyona girer. Çift uçlu etiketleme için, çapraz etiketlemeyi önlemek için 5' etiketleme ile başlamak ve ardından bir ara engelleme adımıyla 3' etiketleme yapmak önemlidir. Kısaltmalar: EDC = karbodiimid; NHS = N-hidroksisüksinimid; MOPS = 3-morfolinopropan-1-sülfonik asit; NaOAc = sodyum asetat. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
- 5' uçlu etiketleme: EDC/NHS aktivasyonu ile 5'-fosfatın hedeflenmesi
NOT: Bu 5' etiketleme yöntemi sadece RNA için değil, 5'-fosfat içeren herhangi bir tek sarmallı nükleik asit için de geçerlidir. Reaksiyonun özgüllüğü, pH bağımlılığı tarafından yönetilir ve RNA omurgasında çoklu fosfatların varlığına rağmen, yalnızca 5'-fosfatın bölgeye özel olarak hedeflenmesine izin verir. PH 6.0'da, 5'-fosfatın karbodiimidlere karşı benzersiz reaktivitesi, iki oksijenin protondan arındırıldığı ve birinin protonlanmış kaldığı spesifik protonasyon durumundan kaynaklanır. Bu, 5'-fosfatı reaktif hale getirirken, tamamen protondan arındırılmış omurga fosfatları reaktif kalmaz ve EDC/NHS hedeflemesi yoluyla 5'-ucun seçici olarak etiketlenmesini sağlar.- EDC-NHS-NaOAc, pH 6.0 çözeltisini hazırlayın. 35 μL ddH2O ve 10 μL 0.5 M NaOAc, pH 6.0 (buzlu asetik asit ile ayarlanmış pH) içinde alikot başına 1.5 mg EDC ve 2.0 mg NHS'yi karıştırın.
- İlgilenilen RNA'nın 55 μL ddH2O'da tüp başına yaklaşık 50-75 μg RNA'ya sahip olmasını sağlayın. RNA'ya 45 μL EDC-NHS-NaOAc, pH 6.0 karışımı ekleyin, 78 mM EDC, 174 mM NHS ve 50 mM NaOAc, pH 6.0 nihai konsantrasyonları ile toplam 100 μL hacme ulaşın. 500 rpm'de çalkalarken 25 °C'de 4 saat inkübe edin.
NOT: Burada 70 μg, in vitro kopyalanmış 250 nt RNA'nın 915 pmol'üne ve 2.5 μL'lik son reaksiyon hacminde 100 μM'ye karşılık gelir. - Saflaştırma turu 1: 5'-fosfatla aktive edilen RNA'yı EtOH çökeltme ile saflaştırın.
- Suda 2 mM sülfonatlı Siyanin3 amin (sCy3-amin) çözeltisi hazırlayın.
- Aktive edilmiş RNA peletini 95 μL 100 mM 3-morfolinopropan-1-sülfonik asit (MOPS) tamponunda, pH 7.5'te (NaOH ile ayarlanmış pH) yeniden süspanse edin. Aktive edilmiş RNA'ya 5 μL 2 mM sCy3-amin çözeltisi ekleyin. 500 rpm'de çalkalarken 25 ° C'de 16 saat inkübe ederek floroforu aktive edilmiş 5'-fosfata birleştirin.
NOT: MOPS tamponunu karanlıkta 4 °C'de saklayın. Grup II intron ribozimi inaktif tutmak için pH ayarlaması için NaOH seçilir. Florofor, RNA'nın en az 40 kat fazla olmalıdır. - Saflaştırma turu 2: Ayırmayı iyileştirmek için 200 μL ddH2O ekleyerek hacmi artırın. 5'-fosfat etiketli RNA'yı EtOH çökeltme ile saflaştırın ve süpernatant renksiz olana kadar tekrarlayın (genellikle iki tur gerekir).
- Bloke etme adımı: RNA'yı 100 μL'lik 100 mM Tris-HCl, pH 7.5'te yeniden süspanse edin ve 25 ° C ve 500 rpm'de 2 saat inkübe edin. Yalnızca 5' uçlu tek etiketleme için, engelleme adımını atlayın, RNA'yı ddH2O'da yeniden askıya alın ve adım 1.1.8 ile devam edin. Ancak, basitlik için, çift etiketleme varsa, 5'uçlu tek etiketli denetimi yalnızca adım 1.1.9'dan sonra ayırın.
NOT: Bu adım, hidrazid ile işlevselleştirilmiş florofor ile çapraz etiketleme riskini en aza indirmek için nispeten daha küçük bir birincil amin kaynağı (örneğin, Tris) ile reaksiyona girerek amin ile işlevselleştirilmiş bir florofora bağlanmamış aktif 5'-fosfatları bloke etmeye hizmet eder. - Saflaştırma turu 3: Etiketli RNA'yı santrifüjlü filtrasyon ile toplamda en az 10 mL ddH2O ile yıkayarak serbest boyaları çıkarın, ardından ddH2O içinde elüte edin.
NOT: Filtrenin moleküler kesimi, nükleik asidin boyutunun yarısından daha az olmalıdır. Tercih edilen tampon ddH2O yerine kullanılabilir. Elüsyon, numunenin tamamen kuruyana kadar döndürülmediğinden emin olarak üreticinin talimatlarına uymalıdır. - UV-Vis spektroskopisi ile RNA ve konjuge boya konsantrasyonlarını belirleyin.
- 3' uçlu etiketleme: Periyodot oksidasyonu ile 3'-ribozun hedeflenmesi
- 90 μL'de tüp başına yaklaşık 50-75 μg RNA'ya sahip olacak şekilde ddH2O'da 5' uçlu etiketli RNA'yı alikot edin. Önceki adımın elüsyon hacmi yüksekse ve düşük bir konsantrasyonla sonuçlanıyorsa, peleti ddH2O'da çökelterek ve yeniden süspanse ederek RNA'yı konsantre edin. 5 μL 1.0 M NaOAc tamponu, pH 5.5 (50 mM NaOAc'ye karşılık gelir, 100 μL reaksiyon hacmi için pH 5.5'e karşılık gelir).
NOT: 5' uçlu tek etiketli RNA'ya benzer şekilde, rutin olarak 3' uçlu tek etiketli RNA'yı kontrol olarak hazırlıyoruz. Bunu yapmak için, etiketlenmemiş RNA'yı 86 μL ddH2O'da tüp başına yaklaşık 50-75 μg RNA'ya sahip olacak şekilde alikotleyin. - 4 μL taze hazırlanmış 500 mM sodyum meta-periodat (NaIO4) stok çözeltisi ekleyin (100 μL reaksiyon hacmi için 10 mM NaIO4'e karşılık gelir). 3' uçlu tek etiketleme için 8 μL NaIO4 stok çözeltisi ekleyin (100 μL reaksiyon hacmi için 20 mM NaIO4'e karşılık gelir). İyice karıştırın ve NaIO4 ışığa duyarlı olduğu için karanlık koşullarda 500 rpm'de çalkalarken 25 °C'de 2 saat inkübe edin.
NOT: Ekleme sırasını değiştirmeyin veya kuluçka süresini daha fazla artırmayın, çünkü bu, ekli donör boyasının fotoağartılmasına neden olabilir. Kullanılan NaIO4 konsantrasyonu, 5' uçta zaten eklenmiş olan boyanın su vermesini en aza indirmek için çift uçlu etiketleme için yarı yarıya azaltılır. - 30 μL% 50 gliserol ekleyerek reaksiyonu durdurun. 500 rpm'de çalkalarken 25 °C'de 30 dakika inkübe edin.
NOT: Gliserol, periodat fazlalığını gidermek için bir diol görevi görür. - Saflaştırma turu 4: 400 μL buz gibi soğuk EtOH-NaOAc çökeltme karışımı ekleyin ve etanol çökeltme işlemini gerçekleştirin.
- Oksitlenmiş RNA peletini 95 μL 50 mM NaOAc, pH 6.0 içinde yeniden süspanse edin.
- Hidrazid-boya eki: Birkaç kristal Cyanine5 hidrazidini (Cy5-hidrazid) DMSO'da çözerek ve ardındanddH2Oile 2 mM konsantrasyonuna seyrelterek florofor çözeltisini hazırlayın. Tercih edilen florofor suda çözünürse, çözeltiyi ddH2O'da hazırlayın. Oksitlenmiş RNA'ya 5 μL 2 mM Cy5-hidrazid çözeltisi ekleyin. İyice karıştırın ve 500 rpm'de çalkalarken 25 °C'de 16 saat inkübe edin.
NOT: Florofor, RNA'nın en az 40 katı fazla olmalıdır. - Saflaştırma turu 5: Çift uçlu etiketli RNA'yı (veya 3'uçlu tek etiketli RNA'yı), sırasıyla 1.2.6 ve 1.2.8 adımlarına benzer şekilde EtOH çökeltme ve santrifüj filtrasyonu ile saflaştırın ve ddH2O'da elüte edin.
- UV-Vis spektroskopisi ile RNA ve konjuge boya konsantrasyonlarını hesaplayın.
- Etiketli RNA'yı analitik jel bazlı tahliller, topluluk floresan spektroskopisi ( Temsili Sonuçlar bölümüne bakın) ve/veya başka bir yerde gösterildiği gibi analitik HPLC kullanarak karakterize edin3.
- 90 μL'de tüp başına yaklaşık 50-75 μg RNA'ya sahip olacak şekilde ddH2O'da 5' uçlu etiketli RNA'yı alikot edin. Önceki adımın elüsyon hacmi yüksekse ve düşük bir konsantrasyonla sonuçlanıyorsa, peleti ddH2O'da çökelterek ve yeniden süspanse ederek RNA'yı konsantre edin. 5 μL 1.0 M NaOAc tamponu, pH 5.5 (50 mM NaOAc'ye karşılık gelir, 100 μL reaksiyon hacmi için pH 5.5'e karşılık gelir).
2. Mikroakışkan oda hazırlığı
NOT: Bir seferde altı veya sekiz odayı kullanmanızı öneririz. Sonikasyon, aksi belirtilmedikçe oda sıcaklığında gerçekleştirilir. Bu protokol, eser miktarda safsızlıkların çözünmesini önlemek için aseton gibi organik çözücülerin kullanımını sınırlar. Alternatifler için15,16 numaralı referanslara bakın.
- Temizleme
- İki kanal oluşturmak için Şekil 2A'da verilen şemaya göre bir elmas delici ile kuvars kızaklarında dört delik açın.
NOT: Delme sırasında daha kolay kırılabilmelerine rağmen, cam kızaklar, lamel görüntüleme yüzeyi olan objektif tabanlı TIRF mikroskobu kurulumları için kuvars kızaklara uygun maliyetli bir alternatiftir (Şekil 2B). Bu, mikroskopi slaytının arka plan floresansı nedeniyle görüntüleme yüzeyi olduğu prizma tabanlı TIRF kurulumları için bir seçenek değildir.
NOT: Alternatif olarak, kullanılmış mikroakışkan odalarını16 geri dönüştürün. Bunun için, kullanılmış hazneleri gece boyunca asetona daldırın (buharlaşmayı en aza indirmek için Coplin boyama kavanozunu alüminyum folyoya sarın) çeker ocakta ve ardından 5 dakika boyunca sonikasyon yapın. Hazneyi sökün ve lamelleri ve çıkartmaları atın. Sökme işlemi hemen işe yaramazsa, odayı 10 dakika daha asetonda sonikleştirin. Adım 2.1.2 ile devam edin. - Delinmiş kuvars slaytları ve yaklaşık iki kat daha fazla lameli (kolayca kırılabilecekleri için) kapaklı bir cam Coplin boyama kavanozuna yerleştirin. 3x'i ddH2O ile durulayın. ddH2O'da 5 dakika boyunca sonikate, ardından 3x'i ddH2O ile durulayın.
- 50 ° C'de 30 dakika boyunca% 10 laboratuvar cam eşya temizleme solüsyonunda (Malzeme Tablosuna bakınız) sonikat. Deterjan kabarcıkları gidene kadar ddH2O ile en az 3 kez durulayın. 5 dakika boyunca ddH2O'da sonikate. ddH2O ile 3 kez durulayın.
- 30 dakika boyunca 1 M KOH çözeltisinde sonikate, sonra gece boyunca bırakın. 3x'i ddH2O ile durulayın. ddH2O'da 5 dakika boyunca sonikate. ddH2O ile 3 kez durulayın.
NOT: Aşırı inkübasyondan kaynaklanan korozyon, daha önce Chandradoss ve ark.15 tarafından dile getirilen bir endişe olmasına rağmen, Piranha aşındırmasından kaçınmayı sağlayan bu uzun inkübasyonu öneriyoruz. - Slaytları ve lameller N2(g) ile kurulayın.
- Kurumuş slaytları ve lamellere üreticinin talimatlarına göre 30 dakika boyunca oksijen plazma temizleyici ile muamele edin.
- İki kanal oluşturmak için Şekil 2A'da verilen şemaya göre bir elmas delici ile kuvars kızaklarında dört delik açın.
- Aminosilanizasyon
- 3 mL Erlenmeyer şişesinde 288.5 mL mutlak EtOH, 1.5 mL ddH2O ve 9 mL (3-aminopropil) trietoksisilan (APTES) 500 mL Erlenmeyer şişesinde iyice karıştırarak% 500 APTES-EtOH çözeltisini hazırlayın.
- Temiz slaytları ve lamelleri bir Coplin boyama kavanozuna koyun,% 3 APTES-EtOH çözeltisine daldırın, 1 dakika sonikat yapın ve 30 dakika inkübe edin.
- 3 kez mutlak EtOH ile, ardından 3 kez ddH2O ile durulayın.
- Slaytları ve lameller N2(g) akış altında kurutun.
- Yüzey pasivasyonu ve biyotinilasyon
- Boş bir pipet ucu kutusunu yarıya kadar ddH2O ile doldurarak nemli bir kutu hazırlayın. Slaytları, tedavi edilecek tarafı yukarı bakacak şekilde kutunun içine yerleştirin.
- 2 mg biotin-polietilen glikol-süksinimidil valerat 5000 (biotin-PEG-SVA) ve 80 mg metoksi polietilen glikol-süksinimidil valerat (mPEG-SVA) 640 μL 100 mM sodyum bikarbonat (NaHCO3) tamponunda, pH 8.3 içinde hafifçe karıştırarak bPEG-mPEG karışımını 1.5 mL steril-temiz bir mikrosantrifüj tüpünde taze olarak hazırlayın. Hava kabarcıklarını gidermek için bPEG-mPEG karışımını 16.000 × g'da 1 dakika santrifüjleyin.
- Süpernatanı dikkatlice çıkarın ve her iki kanalı da kaplamak için sürgünün ortasına 30 μL'lik bir damlacık ekleyin. Ekstra bir PEGile lamel elde etmek için sürgünün bir tarafına ek bir damlacık yerleştirin, çünkü kolayca kırılırlar ve yedek bulundurmak faydalıdır. Son olarak, damlayı temiz bir lamel ile örtün, nemli kutuyu kapatın ve karanlık koşullar altında gece boyunca PEGilasyonunu gerçekleştirin.
- PEG ile pasifleştirilmiş ve biyotinile edilmiş slaytları ve lameller ddH2O ile iyice durulayın. İşlem görmüş yüzeylerin hidrofobikliğindeki değişime dikkat edin. N2(g) akış altında kurutun.
- Mikroakışkan oda montajı
- Kanalları oluşturmak için çift taraflı bir çıkartma kesin. Çıkartmayı, ilgilenilen alanı kapladığından emin olarak slayta yapıştırın. Lameli dikkatlice üstüne yerleştirin ve PE ile yüzeyler birbirine bakacak şekilde hizalayın.
- Monte edilmiş her bir hazneyi 50 mL'lik bir santrifüj tüpüne yerleştirin ve tüpleri N2 (g) ile doldurun ve -20 ° C'de 1 aya kadar saklayın.
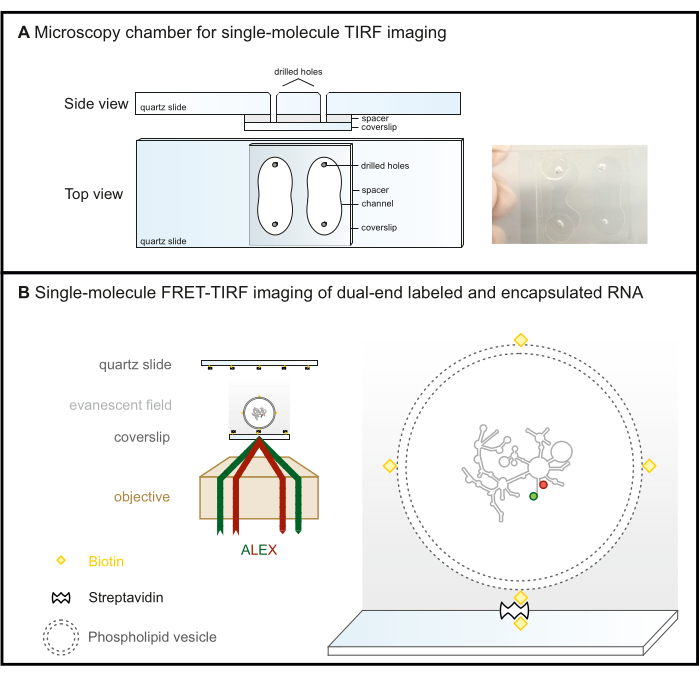
Şekil 2: Tek moleküllü FRET-TIRF mikroskobu. (A) TIRF görüntüleme için mikroakışkan oda. (B) FRET etiketli RNA, biyotinile edilmiş bir fosfolipid vezikül içinde kapsüllenir ve steptavidin kaplı bir cam yüzey üzerinde hareketsiz hale getirilir. Bu, ilgilenilen molekülü, TIRF mikroskobunda kritik açıda tamamen yansıtılan gelen ışık tarafından oluşturulan buharlaşan alan (gri gradyan) içinde tutar. Burada, her iki florofor daha sonra ALEX şeması ile uyarılır. Kısaltmalar: FRET = Förster Rezonans Enerji Transferi; TIRF = Toplam İç Yansıma Floresansı; ALEX = alternatif lazer uyarımı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
3. Fosfolipid vezikül kapsüllemesi
- Lipid kek hazırlama
NOT: Kloroformu her zaman çeker ocak altında tutun.- Steril bir iğne kullanarak, Şekil 3A'da gösterildiği gibi steril temiz 2.0 mL mikrosantrifüj tüplerinin kapağına (içten dışa) delikler açın.
- En az 2 mg bPE'yi uygun miktarda kloroform içinde 1 mg / mL'lik bir nihai konsantrasyona çözerek 1,2-dipalmitoil-sn-glisero-3-fosfoetanolamin-N-cap biotinyl (bPE) stok çözeltisini hazırlayın.
- En az 10 mg DMPC'yi uygun miktarda kloroform içinde 10 mg / mL'lik bir nihai konsantrasyona çözerek 1,2-dimyristoyl-sn-glisero-3-fosfokolin (DMPC) stok çözeltisini hazırlayın.
- 100 μL bPE ve 990 μL DMPC stok çözeltilerini karıştırarak bPE-DMPC karışımını (1:99 w/w oranını koruyarak) hazırlayın. 2 mL tüp başına 109 μL bPE-DMPC karışımını dağıtın.
- Bir mikrotüp saklama kutusunun karton hücre bölme ekini, bir tüp tutucu görevi gören bir Schlenk şişesine yerleştirin. Uzun cımbız kullanarak, lipid karışımını içeren tüpleri 500 mL'lik bir Schlenk şişesindeki tüp tutucusuna yerleştirin (Şekil 3B).
NOT: Dik olduklarından ve eğilmediklerinden emin olun. - Kloroformu gece boyunca (veya çözücü tamamen buharlaşana kadar en az 2 saat) N2 (g) gibi düşük bir akış altında buharlaştırın.
- Delikleri kapatmak için tüpleri Parafilm ile kapatın. Lipid kekleri -20 °C'de 1 aya kadar saklayın.
- RNA kapsülleme
- K+ ve Mg2+ konsantrasyonlarını ilgilenilen biyolojik sisteme göre ayarlayarak aşağıdaki tamponları ve çözeltileri hazırlayın.
- 5x standart tamponu (5x SB) hazırlayın: 2,5 M KCl, 400 mM MOPS; KOH, steril filtre ile pH'ı 6.9'a ayarlayın ve karanlıkta 4 °C'de saklayın (sırasıyla 1x SB: 500 mM KCl, 80 mM MOPS, pH 6.9).
- Yanıp sönme önleyici tamponu (AB): 100 mM MgCl2, Trolox, 1x SB, steril filtreyi hazırlayın ve karanlıkta 4 °C'de 1 haftaya kadar saklayın.
NOT: 10 mL son hacim için bir spatula ucu Trolox kullanın, karıştırmak için girdap yapın ve pH'ı yeniden ayarlayın.
- Ekstrüderi 100 nm polikarbonat (PC) membran ve 10 mm polyester (PE) drenaj diski kullanarak monte edin, şırıngayı ve membranları AB ile dengeleyin ve 30 °C'ye ısıtın (veya esasen 24 °C'lik DMPC cam geçiş sıcaklığının üzerinde).
- 5 μL 1 μM çift uçlu etiketli RNA ve 45 μL AB'yi (toplam 50 μL hacme kadar) karıştırın.
- Lipid kekini bu RNA çözeltisi ile nemlendirin. 30 °C'de 1.400 rpm'de sallayarak 5 dakika, ardından 700 rpm'de 15 dakika karıştırın. 13.000 g'da 2 dakika santrifüjleyin ve süpernatanı dikkatlice yeni bir tüpe aktarın.
- Numuneyi 250 μL AB ile seyreltin.
- Şırıngayı RNA-lipid süspansiyonu ile doldurun. Çift uçlu etiketli RNA'yı 100 nm çapındaki fosfolipid veziküllerde kapsüllemek için bir ısıtma bloğu üzerinde 30 °C'de 35x ekstrüde edin.
NOT: Ekstrüder kullanıldıktan sonra veziküllerin boyut dağılımı, referans11'de gösterildiği gibi dinamik ışık saçılımı (DLS) ile doğrulanabilir.
- K+ ve Mg2+ konsantrasyonlarını ilgilenilen biyolojik sisteme göre ayarlayarak aşağıdaki tamponları ve çözeltileri hazırlayın.

Şekil 3: Lipid kek hazırlama. (A) Solvent buharlaşmasını sağlamak için tüp kapakları dürtülür. (B) Lipid karışımını içeren tüpler bir Schlenk şişesine yerleştirilir ve bir lipit keki elde etmek için kloroform buharlaştırılır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
4. smFRET-TIRF mikroskobu
- Yüzey immobilizasyonu
- Aşağıdaki arabellekleri ve çözeltileri hazırlayın.
- Şeker yanıp sönme önleyici tamponu (SAB): AB'de, steril filtrede %1 D-glikoz (a/h) hazırlayın ve karanlıkta 4 °C'de 1 haftaya kadar saklayın.
- 100x OSS'yi hazırlayın: 100x Oksijen süpürme sistemi (OSS): 3 mg glikoz oksidaz (1.7 U'ya karşılık gelir), 10 μL katalaz (22 U'ya karşılık gelir) 90 μL 1x SB içinde, karanlıkta 4 °C'de 1 haftaya kadar saklayın.
- 198 μL SAB ve 2 μL 100x OSS solüsyonunu karıştırarak görüntüleme tamponunu (IB) taze olarak hazırlayın.
- Mikroakışkan odanın oda sıcaklığına ulaşmasına izin verin. Hazneyi 2x'i 200 μL 1x SB ile yıkayın.
- Hazneyi 50 μL 20 μL / mL streptavidin çözeltisi ile doldurun ve 5 dakika inkübe edin.
- Hazneyi 200 μL 1x SB ve ardından 100 μL AB ile yıkayın.
- 75 μL vezikül süspansiyonu ekleyerek kapsüllenmiş RNA'yı yüzeyde hareketsiz hale getirin ve 10 dakika inkübe edin.
- Hazneyi 200 μL taze hazırlanmış IB ile yıkayın ve 5 dakika inkübe edin.
- Oda artık veri toplama için hazırdır (Şekil 2B). Uzun ölçümler sırasında buharlaşmayı önlemek için delikleri Şekil 2A'da gösterildiği gibi kapatın. Kanaldan kanala sızıntı söz konusuysa, yüzey immobilizasyon protokolünü başlatmadan önce kullanılmayan kanalı kapatın.
NOT: Floresan kontaminasyonlarına karşı mikroakışkan odaların ve fosfolipid veziküllerin temizliği için bir kalite kontrolü olarak boş ölçümler yapmanızı öneririz.
- Aşağıdaki arabellekleri ve çözeltileri hazırlayın.
Sonuçlar
İlgilenilen 915-nt RNA'nın, maya mitokondriyal Sc.ai5γ grup II intronun, ekzonik dizilerle çevrili, bölgeye özgü tek ve çift floresan etiketlemesini sunuyoruz. FRET florofor çifti, 5'-fosfatın EDC/NHS aktivasyonu ve 3'-ribozun periyodat oksidasyonu ve ardından ilgili boya ekleri yoluyla RNA uçlarına yerleştirilir. Daha sonra RNA-boya konjugatlarını Şekil 4A'da gösterildiği gibi floresan jel elektroforezi ile doğruladık. RNA ve floroforların agaroz jeli üzerindeki birlikte göçü, başarılı etiketlemeyi doğrular. Daha sonra, Şekil 4B'de gösterildiği gibi, çift etiketli grup II intronunu karakterize etmek için topluluk floresan spektroskopisi kullanıldı. Enerji transferi, yani FRET, RNA'nın ikili etiketlemesini kanıtlayan donör boyanın uyarılması üzerine gözlendi. Özellikle, FRET'in mesafeye bağlı doğası ile tutarlı olarak, metal iyonlarının varlığında grup II intron RNA'nın katlanması, donör emisyonundaki azalma (yeşil ok) ve alıcı (kırmızı ok) emisyonunda karşılık gelen bir artış ile kanıtlandığı gibi FRET verimliliğinde bir artışa yol açmıştır. Bu, bu FRET etiketlemesinin ribozimin konformasyonel değişikliklerini izlediğini gösterir.
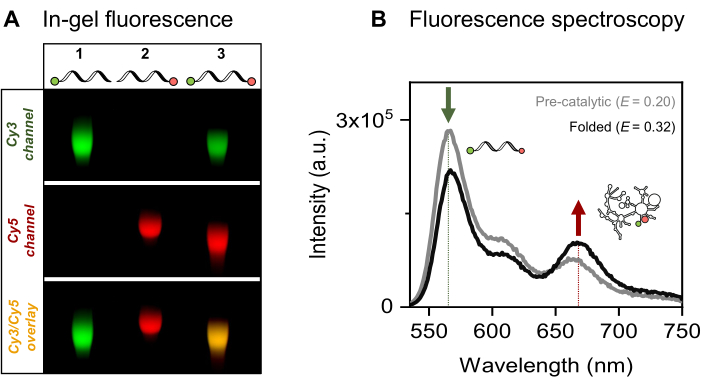
Şekil 4: RNA-boya konjugatlarının karakterizasyonu. (A) Tek ve çift floresan etiketli RNA'nın analitik jel bazlı analizi, boyaların %2'lik bir agaroz jel üzerinde RNA ile birlikte göçünü gösterir. Çift etiketli numunedeki floroforların birlikte lokalizasyonu, sırasıyla 532 nm ve 635 nm aydınlatma altında görselleştirilen Cy3 (üst, yeşil) ve Cy5 (orta, kırmızı) kanallarının birleştirilmiş görüntüsündeki (alt) sarı bant ile gösterilir. Şerit 1: 5'-sCy3 yalnızca RNA olarak etiketlendi, şerit 2: 3'-Cy5 yalnızca RNA olarak etiketlendi ve şerit 3: çift uçlu (5'-sCy3 ve 3'-Cy5) etiketli RNA. (B) Topluluk floresan spektroskopisi çift etiketlemeyi doğrular. Donör uyarması üzerine enerji transferi (λex = 515 nm, λem = 670 nm), her iki boyanın da RNA'ya başarılı bir şekilde bağlandığını doğrular. Gri eğri, katalitik öncesi RNA'nın emisyon profilini temsil ederken, siyah eğri, katlanmış grup II intron RNA'sında (3 dakika boyunca 70 ° C'de 500 mM KCl ile inkübe edilir, 5 dakika boyunca 42 ° C'ye soğutulur, ardından 100 mM MgCl2 ilavesi). Bu rakam Ahunbay ve ark.3 Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Elimizdeki floresan çift etiketli vahşi tip grup II intron ile, şimdi dinamiklerini tek molekül düzeyinde keşfetmek için konumlandık. Fosfolipid veziküller içinde kapsüllendikten sonra, etiketli RNA, smFRET-TIRF için tek molekül çözünürlüğü elde etmek için çok düşük yüzey yoğunluklarında bir mikroskopi yüzeyi üzerinde hareketsiz hale getirilir. Şekil 5A'da görüldüğü gibi, birkaç ayrı molekül aynı anda izlenebilir. TIRF mikroskobu, FRET verimliliğinin ve zaman içindeki değişimlerinin gerçek zamanlı olarak izlenmesini sağlar. Şekil 5B , etiketli ve kapsüllenmiş RNA'nın statik ve dinamik tek moleküllü FRET izlerini örneklemektedir. Tipik bir dinamik iz, FRET verimliliğini dalgalandıran verici ve alıcı sinyaller arasında antikorelasyon sergiler. Donör uyarması üzerine alıcı emisyonu arttığında, donör emisyonu buna bağlı olarak azalır ve bu da boyalar arası mesafede dinamik bir değişikliği gösterir. Bu antikorelasyon, RNA molekülündeki konformasyonel değişiklikleri önerir.
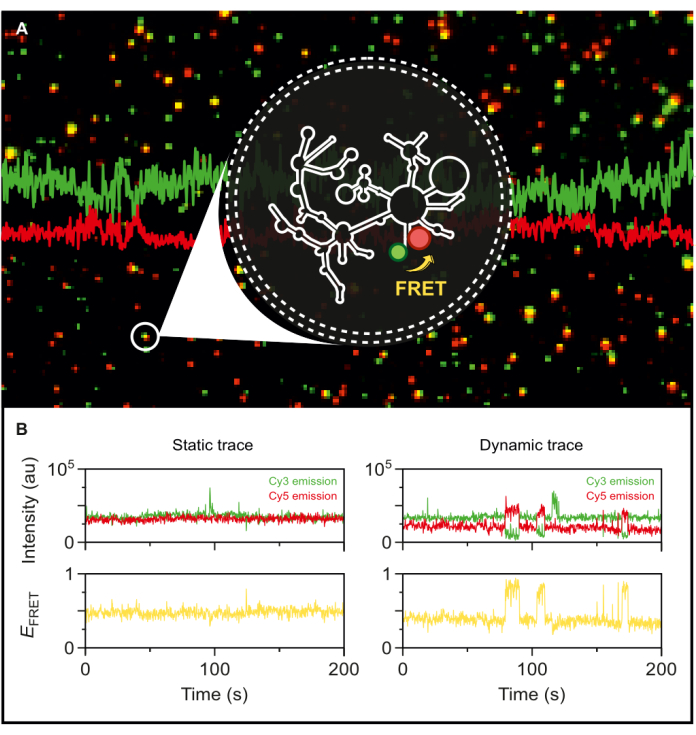
Şekil 5: smFRET ile ortaya konan grup II intron RNA'nın oldukça dinamik davranışı. Çift uçlu etiketli grup II intron RNA, bir fosfolipid vezikül içinde kapsüllenir ve objektif tabanlı bir TIRF mikroskobu ile görüntüleme için yüzeyde hareketsiz hale getirilir. (A) 532 nm uyarılma üzerine donör emisyonu (sCy3, yeşil) ve alıcı emisyonu (Cy5, kırmızı) sergileyen bireysel etiketli RNA moleküllerinin birleştirilmiş görüntüsü. (B) (Solda) verici ve alıcı yoğunluklarının zaman içinde dalgalanmadığı statik bir RNA molekülünün ve (sağda) verici ve alıcı yoğunluklarının antikorreli olduğu dinamik bir RNA molekülünün tipik smFRET yörüngeleri, FRET verimlilikleri sarı renktedir. Tek moleküller MASH-FRET17 kullanılarak lokalize edilir ve analiz edilir. Doğrudan uyarma, kanama ve γ faktörlü düzeltmeler uygulanır. Kısaltmalar: smFRET = tek moleküllü Förster Rezonans Enerji Transferi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Tek molekül düzeyinde FRET benzersizdir, çünkü tek tek moleküllerin gözlemlenmesine ve analizine izin verir, numune heterojenliğini ortaya çıkarır ve topluluk ölçümlerindegizlenebilecek geçici durumları yakalar 1,2. smFRET kullanarak tek tek RNA moleküllerini gözlemlemek, katlanma yolları ve dinamikleri hakkında yüksek çözünürlüklü bilgiler sağlar. Bu protokol, RNA'nın kimyasal çift uçlu etiketlemesini ve fosfolipid vezikül kapsüllemesi yoluyla yüzey immobilizasyonunu tanımlar ve bunlar birlikte smFRET-TIRF mikroskobu yoluyla dinamik konformasyonel değişikliklerin izlenmesini sağlar.
RNA dinamiklerini incelemek, bölgeye özgü yeni floresan etiketleme stratejilerine ihtiyaç duyulan, sürekli büyüyen bir alandır. RNA uçlarını, 5'-fosfatı karbodiimidlerle ve 3'-riboz şekerini periyodontatla hedefleyerek etiketliyoruz. Bu yaklaşımlar daha önce tanımlanmıştır (5'-uç18,19 ve 3'-uç19,20,21,22), ancak daha önce optimizasyon gerektiren vahşi tip Sc.ai5γ grup II intron ribozimine benzer büyüklükte bir RNA'ya uygulanmamıştır. 5'-fosfatın karbodiimid (örneğin, EDC) aktivasyonu geri dönüşümlüdür. Bu nedenle, imidazol, oldukça reaktif bir fosforimidazolit19,20 oluşturmak için O-açilizoüre ara maddesi ile geri dönüşümsüz bir şekilde reaksiyona girmek için kullanıldı. Bununla birlikte, daha yüksek pH'da, karbodiimidlerin nükleobazları, özellikle guaninleri ve urasilleri değiştirebildiği bilinmektedir, bu da son zamanlarda yapısal sondalama ajanları olarak kullanılmalarına yol açmıştır23,24.
Çapraz reaktiviteyi önlemek için, boya birleştirme adımı için pH'ı 7.5'e yükseltmeden önce aktive edilmiş RNA'nın EDC'den saflaştırılması çok önemlidir. Bununla birlikte, aktivasyon ile boya eki25 arasına bir saflaştırma adımı eklediğimizde, çok düşük verimler elde ettik. Benzer şekilde, protein etiketlemesinde, yüzeye erişilebilir lizin kalıntıları karbodiimidlerle aktive edilebilir. Bununla birlikte, aktivasyonun tersine çevrilmesini önleyen imidazol yerine, NHS rutin olarak kullanılmaktadır. Biz de bu stratejiyi benimsedik, böylece fosforimidazolid ara ürününü bir NHS-fosfat ara maddesi ile değiştirdik. Bu şekilde, pH kontrolünün yanı sıra daha düşük sıcaklıklarda ve daha kısa inkübasyon sürelerinde artan etiketleme yoğunluğu elde ettik, yani 16 saat için 37 °C'ye kıyasla 4 saat boyunca 25 °C. RNA için geliştirilen bu 5' etiketleme stratejisi, 5'-fosfatlı diğer herhangi bir tek sarmallı nükleik aside uygulanabilir.
5'-fosfat aktivasyonu ve 3'-riboz oksidasyonu birbirini dışladı, çünkü kimyalar ortogonal değildir. Bu zorluğun üstesinden gelmek ve çapraz etiketlemeyi önlemek için, 5' uç ile başladık, ardından 3' uç etiketlemeye devam etmeden önce etkinleştirilmiş ancak etiketlenmemiş siteleri engellemek için bir engelleme adımı izledik. 3'-diol'ü oksitlerken, fazla sodyum meta-periyodat (NaIO4), 5' ucunda zaten bağlı olan floroforu söndürebilir. Bu nedenle, tek etiketleme için kullanılan NaIO4 konsantrasyonunu 20 mM'den 10 mM'ye düşürdük.
Reaksiyonları büyütmek yerine paralel olarak birden fazla alikotla çalışmanızı öneririz. Bu protokol, birden fazla etanol (EtOH) çökeltme adımı gerektirir. Paralel olarak birkaç alikotla çalışırken, bir çökeltme karışımı hazırlayın (30 mL% 100 mutlak EtOH ve 1 mL 3 M NaOAc, pH 5.2). NaCl, EtOH'deki düşük çözünürlüğü nedeniyle kullanılmaz. RNA'yı 3.1 hacim ile çökeltin. bu karışımın -20 ° C'de gece boyunca inkübe edilmesi ve ardından santrifüjleme ile çökeltin. RNA peletini 500 μL buz gibi %70 EtOH ile iki kez yıkayın, her seferinde 4 °C'de döndürün ve vakum altında kurutun. EtOH çökeltisi, RNA'nın çözünmezliğinden ve serbest boyaların %70 etanol içindeki çözünürlüğünden yararlanır. Santrifüjlü filtrasyon, RNA'dan önemli boyut farkları nedeniyle serbest boyaları etkili bir şekilde uzaklaştırır ve tampon değişimini kolaylaştırarak tuzları ortadan kaldırır. EtOH çökeltme ve santrifüjlü filtrasyon yöntemlerine ek olarak, serbest boyalar jel ekstraksiyonu ve/veya kromatografi teknikleri (örn., HPLC) kullanılarak da çıkarılabilir; Ancak ölçek buna göre uyarlanmalıdır. Uzun RNA'ları yeniden süspanse etmek için girdap yapmayın, çünkü bu mekanik kesmeyeneden olabilir 26. Protokolü duraklatmak için en uygun zaman, RNA'nın peletlendiği zamandır. Nükleik asit geri kazanımını iyileştirmek için DNA düşük bağlayıcı tüpler kullanıyoruz. Son reaksiyon hacmi 100 μL olmasına rağmen, EtOH çökeltme ile daha iyi saflaştırma için 1.5 mL (ve daha düşük hacimli olmayan) tüpler tercih edilir.
Reaksiyona girmemiş serbest boyalar çökeltme ve santrifüj filtrasyon ile uzaklaştırıldıktan sonra, floresan jel elektroforezi (Şekil 4A), UV-Vis spektroskopisi, analitik HPLC3 ile etiketlemeyi doğruladık. Bununla birlikte, bu yöntemlerin, her iki floroforu taşıyan bir RNA molekülü ile her biri tek bir renkle etiketlenmiş bir RNA karışımı arasında ayrım yapamayacağına dikkat etmek önemlidir. Benzer şekilde, bir RNA molekülünün aynı renkte birden fazla florofor taşıyıp taşımadığını belirlemek için kullanılamazlar. Boyut sınırlamaları nedeniyle kütle spektrometresi kullanılamaz. Topluluk3 ve tek moleküllü FRET spektroskopileri, Şekil 4B ve 5B'de gösterildiği gibi çift floresan etiketlemeyi doğrular. smFRET deneylerinde 0.5'lik stokiyometri (sCy3 ila Cy5 oranı 1:1), iki floroforun eşit konjugasyonunu doğrular. Bir endişe, önerilen siklizasyon yerine her iki aldehiti de etiketleyerek 3 'ucundaki çift etiketlemeydi. smFRET deneylerinde stokiyometrisi 0.25 (sCy3 ila Cy5 oranı 1:2) olan türlerin eksikliği, boya bağlanmasının ikinci bir boyanın bağlanmasını sterik olarak engellediğini ve önlediğini düşündürmektedir.
Bu çift floresan etiketleme ile FRET sinyal değişiklikleri, RNA katlanması ve katalizi boyunca yapısal yeniden düzenlemelere bağlanabilir. Tek moleküllü TIRF görüntüleme için kaçan alan içinde floresan etiketli RNA'yı korumak için, doğrudan yüzey bağlamaya göre kapsülleme tercih edilir. Bu yaklaşım, tek tek RNA moleküllerini veziküllerin lipid çift katmanları içinde yakalamayı ve dinamik davranışlarını gözlemlemeye elverişli kontrollü bir ortam yaratmayı içerir. Tarif edilen protokol, mono-kapsüllemeyi zenginleştirir, çünkü tek bir adımda foto ağartma11'i gösterir. RNA katlanmasını ve işlevini anlamak için in vitro ve in vivo boşluğu köprülemek esastır27. Moleküler kalabalık ajanlar, grup II intronları 7,28 ile RNA katalizini arttırmak için hücrelerin içindeki koşulları taklit edebilir. Alternatif olarak, kapsülleme, RNA katlanmasını29 teşvik eden kısıtlı mikro ortamlar yaratarak RNA yapısı ve dinamikleri hakkındaki anlayışımızı gerçekçi bir hücresel bağlama yaklaştırır.
Açıklamalar
Yazarlar herhangi bir çıkar çatışması beyan etmemektedir.
Teşekkürler
İsviçre Ulusal Bilim Vakfı [200020_192153'dan RKOS'a], UZH Forschungskredit [FK-20-081'den EA'ya], UZH Stiftung für wissenschaftliche Forschung'dan [RKOS ve SZP'ye], Lisansüstü Araştırma Kampüsü (GRC) Kısa Bursu [EA'ya 2024__SG_092], Zürih Kimyasal ve Moleküler Bilimler Enstitüsü (CMSZH) ve Zürih Üniversitesi'nden mali destek minnetle kabul edilmektedir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| RNA labeling | |||
| 1.5 mL DNA LoBind tubes | Eppendorf | 30108035 | |
| 1-ethyl-3-(3-dimethylaminopropyl)carbodiimide hydrochloride (EDC-HCl or EDC) | Thermo Scientific | 11844071 | Pierce EDC, No-Weigh Format. Store at -20 °C |
| 3-morpholinopropane-1-sulfonic acid (MOPS) | Sigma-Aldrich | 69947 | BioUltra, for molecular biology, ≥99.5% (titration) |
| Acetic acid (glacial) | Sigma-Aldrich | 1.00063 | 100%, anhydrous for analysis EMSURE ACS,ISO,Reag. Ph Eur |
| Centrifugal filtration unit | Sartorius | VS0132 | Vivaspin 500, MWCO 50.000, PES, 500 μL |
| Cyanine5 hydrazide (Cy5-hydrazide) | Lumiprobe | 23070 | 5 mg, CAS number 1427705-31-4 |
| Dimethyl sulfoxide (DMSO) | New England Biolabs | 12611P | Molecular biology grade |
| Ethanol | VWR Chemicals | 20821.296P | Absolute ≥99,8% |
| Glycerol | Sigma-Aldrich | G5516 | for molecular biology, ≥99.0% |
| Hydrochloric acid (HCl) | Sigma-Aldrich | 1.00317 | fuming 37%, for analysis EMSURE ACS,ISO,Reag. Ph Eur |
| N-hydroxysuccinimide (NHS) | Sigma-Aldrich | 130672 | 98% |
| Sodium acetate (NaOAc) | Sigma-Aldrich | S8750 | anhydrous, ReagentPlus, ≥99.0% |
| Sodium meta-periodate (NaIO4) | Thermo Fisher Scientific, Life Technologies | 20504 | Pierce product line |
| Sulfo-Cyanine3 amine (sCy3-amine) | Lumiprobe | 213C0 | 5 mg, CAS number 2183440-43-7 |
| Tris(hydroxymethyl)aminomethane (Tris) | Biosolve | 200923 | Molecular biology grade |
| Chamber preparation | |||
| 3-aminopropyl)triethoxysilane (APTES) | Sigma-Aldrich | 440140 | 99% |
| Acetone | Sigma-Aldrich | 1.00014 | for analysis EMSURE ACS,ISO,Reag. Ph Eur |
| Biotin-Polyethylene glycol-Succinimidyl valerate (biotin-PEG-SVA, bPEG) and Methoxy polyethylene glycol-Succinimidyl valerate (mPEG-SVA) | Laysan Bio, Inc. | BIO-PEG-SVA, MW 5,000 and MPEG-SVA, MW 5,000 - Combo Kit | |
| Coverslips | Carl Roth | H876.2 | 24 x 24 mm, 0.13-0.16 mm thickness |
| Deconex 11 universal | Borer Chemie AG | 17416492 | Laboratory glassware cleaning solution |
| Diamond coated core drill bit | Crystalite corporation | 1 mm thickness | |
| Diamond driller | |||
| Ethanol | VWR Chemicals | 20821.296P | Absolute ≥99,8% |
| Glass Coplin staining jar with cover | |||
| Imaging spacer | Grace Bio-Labs | 654008 | SecureSeal, 8 wells, 9 mm × 0.12 mm |
| Oxygen plasma cleaner | Zepto One | Diener | |
| Potassium hydroxide (KOH) | Sigma-Aldrich | P9541 | for molecular biology, ≥99.0% |
| Quartz slides | G. Finkenbeiner, Inc. | 7.5 x 2.5 cm, 1 mm thickness | |
| Sodium bicarbonate (NaHCO3) | Sigma-Aldrich | S6297 | BioXtra, 99.5-100.5% |
| Lipid cake preparation | |||
| 16:0 Biotinyl Cap PE, bPE (1,2-dipalmitoyl-sn-glycero-3-phosphoethanolamine-N-(cap biotinyl) (sodium salt), C53H98N4O11PNaS) | Avanti Polar Lipids | 870277P | Stable for 1 year at -20 °C |
| 14:0 PC, DMPC (1,2-ditetradecanoyl-sn-glycero-3-phosphocholine or 1,2-dimyristoyl-sn-glycero-3-phosphocholine, C36H72NO8P) | Avanti Polar Lipids | 850345P | |
| 2.0 mL microcentrifuge tubes, Safe-Lock | Eppendorf | 0030120094 | Autoclave to sterilize |
| 500 mL Schlenk flask | |||
| Chloroform | Merck | 1.02445 | for analysis EMSURE ACS, ISO, Reag. Ph Eur |
| Parafilm | |||
| Surface immobilization via encapsulation | |||
| (±)-6-Hydroxy-2,5,7,8-tetramethylchromane-2-carboxylic acid (Trolox®) | Thermo Fischer | 53188-07-1 | 97% |
| 3-morpholinopropane-1-sulfonic acid (MOPS) | Sigma-Aldrich | 69947 | BioUltra, for molecular biology, ≥99.5% (titration). Store at +4 °C in the dark. |
| Adhesive seal tabs | Grace Bio-Labs | 629200 | |
| Catalase | Sigma-Aldrich | 9001-05-2, C30 | from bovine liver, aqueous suspension, 10,000-40,000 units/mg protein |
| D-glucose | Sigma-Aldrich | G7528 | ≥99.5% (GC), BioXtra |
| Extruder polycarbonate (PC) membrane | Avanti Polar Lipids | 610005-1EA | 0.1 μm, 19 mm |
| Extruder set with heating block | Avanti Polar Lipids | 610000 | |
| Glucose oxidase | Sigma-Aldrich | 9001-37-0 | from Aspergillus niger, Type VII, lyophilized powder, ≥100,000 units/g solid (without added oxygen) |
| Magnesium chloride (MgCl2) | Sigma-Aldrich | 7786-30-3, M1028 | for molecular biology, 1.00 M ± 0.01 M solution |
| Polyester (PE) drain disc, membrane | Whatman, Cytiva | 230300 | 10 mm |
| Potassium chloride (KCl) | Sigma-Aldrich | 60128 | BioUltra, for molecular biology, ≥99.5% (AT) |
| Potassium hydroxide (KOH) | Sigma-Aldrich | P9541 | for molecular biology, ≥99.0% |
| Streptavidin | Thermo Fischer | 434301 |
Referanslar
- Eitan, L., et al. FRET-based dynamic structural biology: Challenges, perspectives and an appeal for open-science practices. Elife. 10, e60416(2021).
- Taekjip, H., et al. Fluorescence resonance energy transfer at the single-molecule level. Nat Rev Methods Primers. 4, 22(2024).
- Ahunbay, E., Steffen, F. D., Zelger-Paulus, S., Sigel, R. K. O. Chemical dual end-labeling of large ribozymes. Methods Mol Biol. 2439, 191-204 (2022).
- Ahunbay, E., Zelger-Paulus, S., Sigel, R. K. O. Group II Introns: Highly structured yet dynamic. Chimia (Aarau). 77 (4), 235-241 (2023).
- Steiner, M., Karunatilaka, K. S., Sigel, R. K. O., Rueda, D. Single-molecule studies of group II intron ribozymes. Proc Natl Acad Sci USA. 105 (37), 13853-13858 (2008).
- Karunatilaka, K. S., Solem, A., Pyle, A. M., Rueda, D. Single-molecule analysis of Mss116-mediated group II intron folding. Nature. 467 (7318), 935-939 (2010).
- Paudel, B. P., Fiorini, E., Börner, R., Sigel, R. K. O., Rueda, D. S. Optimal molecular crowding accelerates group II intron folding and maximizes catalysis. Proc Natl Acad Sci USA. 115 (47), 11917-11922 (2018).
- Saha, R., Verbanic, S., Chen, I. A. Lipid vesicles chaperone an encapsulated RNA aptamer. Nat Commun. 9 (1), 2313(2018).
- Boukobza, E., Sonnenfeld, A., Haran, G. Immobilization in surface-tethered lipid vesicles as a new tool for single biomolecule spectroscopy. J Phys Chem B. 105 (48), 12165-12170 (2001).
- Cisse, I., Okumus, B., Joo, C., Ha, T. Fueling protein DNA interactions inside porous nanocontainers. Proc Natl Acad Sci USA. 104 (31), 12646-12650 (2007).
- Zelger-Paulus, S., Hadzic, M. C. A. S., Sigel, R. K. O., Börner, R. Encapsulation of fluorescently labeled RNAs into surface-tethered vesicles for single-molecule FRET studies in TIRF microscopy. Methods Mol Biol. 2331, 1-16 (2020).
- Okumus, B., Wilson, T. J., Lilley, D. M. J., Ha, T. Vesicle encapsulation studies reveal that single molecule ribozyme heterogeneities are intrinsic. Biophys J. 87 (4), 2798-2806 (2004).
- Ishitsuka, Y., Okumus, B., Arslan, S., Chen, K. H., Ha, T. Temperature-independent porous nanocontainers for single-molecule fluorescence studies. Anal Chem. 82 (23), 9694-9701 (2010).
- Liu, B., Mazouchi, A., Gradinaru, C. C. Trapping single molecules in liposomes: surface interactions and freeze-thaw effects. J Phys Chem B. 114 (46), 15191-15198 (2010).
- Chandradoss, S. D., et al. Surface passivation for single-molecule protein studies. J Vis Exp. (86), e50549(2014).
- Paul, T., Myong, S. Protocol for generation and regeneration of PEG-passivated slides for single-molecule measurements. STAR Protoc. 3 (1), 101152(2022).
- Hadzic, M. C. A. S., Kowerko, D., Börner, R., Zelger-Paulus, S., Sigel, R. K. O. Detailed analysis of complex single molecule FRET data with the software MASH. Imaging, Manipulation, and Analysis of Biomolecules, Cells, and Tissues IX. Farkas, D. L., Nicolau, D. V., Leif, R. C. SPIE 971119, (2016).
- Chu, B. C., Wahl, G. M. Le Orgel. Derivatization of unprotected polynucleotides. Nucleic Acids Res. 11 (18), 6513-6529 (1983).
- Qin, P. Z., Pyle, A. M. Site-specific labeling of RNA with fluorophores and other structural probes. Methods. 18 (1), 60-70 (1999).
- Whitfeld, P. R. A method for the determination of nucleotide sequence in polyribonucleotides. Biochem J. 58 (3), 390-396 (1954).
- Zamecnik, P. C., Stephenson, M. L., Scott, J. F. Partial purification of soluble RNA. Proc Natl Acad Sci USA. 46 (6), 811-822 (1960).
- Proudnikov, D., Mirzabekov, A. Chemical methods of DNA and RNA fluorescent labeling. Nucleic Acids Res. 24 (22), 4535-4542 (1996).
- Wang, P. Y., Sexton, A. N., Culligan, W. J., Simon, M. D. Carbodiimide reagents for the chemical probing of RNA structure in cells. RNA. 25 (1), 135-146 (2019).
- Mitchell, D., et al. In vivo RNA structural probing of uracil and guanine base-pairing by 1-ethyl-3-(3-dimethylaminopropyl)carbodiimide (EDC). RNA. 25 (1), 147-157 (2019).
- Rinaldi, A. J., Suddala, K. C., Walter, N. G. Native purification and labeling of RNA for single molecule fluorescence studies. Methods Mol Biol. 1240, 63-95 (2015).
- Liu, T., Patel, S., Pyle, A. M. Making RNA: Using T7 RNA polymerase to produce high yields of RNA from DNA templates. Methods in Enzymology. , Academic Press. (2023).
- Leamy, K. A., Assmann, S. M., Mathews, D. H., Bevilacqua, P. C. Bridging the gap between in vitro and in vivo RNA folding. Q Rev Biophys. 49, e10(2016).
- Fiorini, E., Börner, R., Sigel, R. K. O. Mimicking the in vivo Environment--The Effect of Crowding on RNA and Biomacromolecular Folding and Activity. Chimia. 69 (4), 207-212 (2015).
- Peng, H., Lelievre, A., Landenfeld, K., Müller, S., Chen, I. A. Vesicle encapsulation stabilizes intermolecular association and structure formation of functional RNA and DNA. Curr Biol. 32 (1), 86-96.e6 (2022).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır