A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
الكشف عن قلويدات الإرغوت المنظمة في مصفوفات الطعام عن طريق قياس طيف الحركة الأيونية المحاصرة بالكروماتوغرافيا السائلة - قياس الطيف الكتلي لوقت الرحلة
In This Article
Summary
يقدم هذا البروتوكول طريقة قياس الطيف الكتلي عالية الدقة للكروماتوغرافيا السائلة - حركة الأيونات - عالية الدقة لتحديد وجود قلويدات الإرغوت في الطعام وفقا للائحة المفوضية (EU) الصادرة مؤخرا 2023/915.
Abstract
يعمل قياس الطيف الكتلي للحركة الأيونية (IMS) كبعد فصل إضافي عند دمجه في سير عمل قياس الطيف الكتلي للكروماتوغرافيا السائلة (LC-MS). توفر طرق LC-IMS-MS دقة ذروة أعلى ، وفصلا محسنا للمركبات متساوية الضغط والأيزومر ، ونسبة إشارة إلى ضوضاء محسنة (S / N) مقارنة بطرق LC-MS التقليدية. يوفر IMS خاصية جزيئية أخرى لتحديد التحليلات ، وهي معلمة المقطع العرضي للتصادم (CCS) ، مما يقلل من النتائج الإيجابية الخاطئة. لذلك ، تعالج طرق LC-IMS-MS تحديات تحليلية مهمة في مجال سلامة الأغذية (أي الكشف عن المركبات عند مستويات ضئيلة في مصفوفات غذائية معقدة وتحديد لا لبس فيه للجزيئات متساوية الضغط والأيزومرية).
قلويدات الإرغوت (EAs) هي عائلة من السموم الفطرية التي تنتجها الفطريات التي تهاجم مجموعة متنوعة من أنواع الحشائش ، بما في ذلك الحبوب الصغيرة مثل الجاودار والتريتيكال والقمح والشعير والدخن والشوفان. تم تحديد المستويات القصوى (MLs) من هذه السموم الفطرية في العديد من المواد الغذائية ، كما هو مفصل في لائحة المفوضية EC / 2023/915. يتضمن هذا التشريع الجديد ستة EAs رئيسية وepimers المقابلة لها ، لذلك هناك حاجة إلى منهجية فعالة لتمييز هذه الجزيئات الأيزوميرية بشكل صحيح مع مراعاة حدوثها.
لذلك ، فإن الهدف من هذا البروتوكول هو إظهار كيف يساهم تكامل IMS في تدفقات عمل LC-MS في فصل EAs الأيزومرية ، مما يعزز انتقائية الطريقة التحليلية. بالإضافة إلى ذلك ، يوضح كيف أن إنشاء مكتبات احتجاز الكربون وتخزينه من خلال توصيف المعايير التحليلية يوفر ثقة أعلى لتحديد السموم الفطرية. تم تصميم هذا البروتوكول لشرح فوائد تطبيق نظام الإدارة البيضية في سلامة الأغذية بوضوح ، مع الأخذ على سبيل المثال تحديد المستشارين الخبراء في الحبوب. قدم الاستخراج المستند إلى QuEChERS متبوعا بتحليل مطياف الحركة الأيونية المحبوسة LC (TIMS) -MS حدودا للقياس الكمي تتراوح من 0.65 إلى 2.6 نانوغرام / غرام بدقة مقبولة (على الرغم من انخفاض الاسترداد للإرغوتامينين) عند 1.5x و 1x و 0.5x ML وأظهر تأثير مصفوفة ضئيل.
Introduction
أصبح قياس الطيف الكتلي للتنقل الأيوني (IMS) تقنية تحليلية مستخدمة بشكل متزايد ، وغالبا ما يتم تقديمها كبعد فصل إضافي مدمج في كروماتوغرافيا السائل / الغاز التقليدية (LC / GC) إلى جانب سير عمل MS. يتكون IMS من فصل الجزيئات على طول خلية الحركة ، مملوءة بغاز عازل ، تحت مجال كهربائي وعند الضغط الجوي1. اعتمادا على نسبة الكتلة إلى الشحنة (م / ز) والتشكل الهندسي ، سيتفاعل الجزيء المتأين مع الغاز العازل أثناء تحركه عبر خلية الحركة ، وهو ما ينعكس في معلمة الحركة الأيونية (K)2 ويتم حسابها من خلال المعادلة التالية:
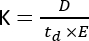
حيث يمثل D طول الانجراف الكلي ، و td هو إجمالي وقت الانجراف ، و E هو المجال الكهربائي. لذلك ، يتم قياس K في m2 V−1 s−1 ، على الرغم من أنه لأسباب عملية غالبا ما يتم التعبير عنه على أنه سم2 V−1 s−1. يمكن قياس القدرة الجوهرية على التحرك عبر خلية التنقل من خلال وقت الانجراف وتحويلها لاحقا إلى ما يسمى بقيمة المقطع العرضي للتصادم (CCS) ، وهي معلمة قابلة للتكرار بدرجة كبيرة لكل جزيء بشكل مستقل عن أداة IMS3. يمكن اشتقاق احتجاز الكربون وتخزينه من التنقل التالي لهذه المعادلة:
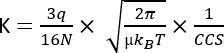
س كونها تهمة الأيون. N كثافة عدد الغاز العازل ؛ μ الكتلة المنخفضة لشركاء الاصطدام أيون الغاز العازل ؛ كب ثابت بولتزمان. و T درجة حرارة الغاز العازلة. لذلك ، يوفر IMS معلومات إضافية مكملة للبيانات التحليلية الناتجة عن تحليلات الكروماتوغرافيا وMS.
وقد ثبت أن تنفيذ نظام الإدارة المتكاملة في منصات LC-MS يزيد من موثوقية التحديدات التحليلية، لا سيما عند العمل مع المركبات التي تكون بتركيزات ضئيلة. أفادت العديد من الدراسات أن طرق LC-IMS-MS تعمل على تحسين جودة أطياف الكتلة عن طريق تقليل ضوضاء الخلفية ، مما يؤثر في النهاية على حساسية الطريقة ، ويقلل من معدل الإيجابيات والسلبيات الكاذبة التي توفرها منهجيات LC-MS متعددة المخلفات4،5،6. علاوة على ذلك ، تسمح قابلية تكرار قيم احتجاز الكربون وتخزينه بالمقارنة ليس فقط بين الأدوات المختلفة التي تستخدم نفس التكنولوجيا ، ولكن أيضا بين تقنيات الحركة الأيونية المختلفة ، وهي مطياف حركة الأيونات الموجة المتحركة (TWIMS) ، ومطياف حركة الأيونات المحاصرة (TIMS) ، ومطياف حركة أيون أنبوب الانجراف (DTIMS) 2،7 ، وهي الأنظمة الأكثراستخداما 1. وبالتالي ، فإن النتيجة الملحوظة لإمكانات احتجاز ثاني أكسيد الكربون وتخزينه كمعامل تعريف تكمن في إمكانية بناء مكتبات احتجاز ثاني أكسيد الكربون وتخزينه ، مما ينعكس في قابليته للتطبيق في دراسات التمثيل الغذائي8. ومع ذلك ، فإن واحدة من أقوى ميزات IMS هي القدرة على فصل المركبات المتشابهة ومتساوية الضغط التي قد لا يتم حلها بشكل كاف بواسطة طرق LC-MS. قد يكون هذا هو الحال عند العمل مع مجموعات كبيرة من التحليلات ذات الأهمية في المصفوفات المعقدة ، وهي حالة شائعة في التحليل البيئي والغذائي. وفي هذا السياق، اقترحت طرائق LC-IMS-MS لرصد مبيدات الآفات، وبدرجة أقل، الأدوية البيطرية والسموم الفطرية في الأغذية.
نظرا لقدرتها العالية على الحل وانتقائيتها ، تبرز منصات LC / GC-IMS-MS كأكثر الأدوات فائدة لمواجهة بعض التحديات الحالية في سلامة الأغذية ، خاصة تلك المتعلقة بالمخاليط الأيزومرية. انعكس القلق الصحي المتعلق بالمخاليط الأيزومرية كملوثات غذائية في التشريع الأوروبي الحالي ، والذي ، على سبيل المثال ، يحد من الحد الأقصى لتركيز ستة قلويدات الإرغوت الرئيسية (EAs) والستة المقابل لها في العديد من المنتجات الغذائية10.
تشكل EAs عائلة من المستقلبات الثانوية السامة التي تنتجها مجموعة واسعة من الفطريات ، خاصة من عائلة Clavicipitaceae (على سبيل المثال ، Claviceps purpurea ، أهم منتج للخيول البنية التحتية نظرا لنطاقها الواسع من المضيفين) ، ولكن أيضا Trichocomaceae ، والتي يمكن أن تتطفل على رأس بذور النباتات الحية (مثل الجاودار والشعير والقمح والشوفان) في وقت الإزهار11 ، 12. في ظل ظروف معينة ، وخاصة درجة الحرارة والنشاط المائي ، يمكن أن تنتج فطريات Claviceps EAs تتراكم في الأجسام المثمرة ، والمعروفة باسم التصلب أو الإرغوت ، في المحصول المضيف. إلى حد ما ، يمكن أن تتحمل المستشارين الخبراء معالجة المواد الخام حتى الوصول إلى المنتج النهائي ؛ لذلك ، اقتحام السلسلة الغذائية. يمكن أن يؤدي تناول الطعام الملوث إلى تسمم EA ، المعروف باسم الإرغوتية ، والذي يظهر مع أعراض حادة مثل آلام البطن والقيء والإحساس بالحرقان في الجلد والأرق والهلوسة13. لتقليل تأثير EAs على صحة الإنسان ، حددت المفوضية الأوروبية المستويات القصوى (MLs) في العديد من الأطعمة لمجموع EAs الرئيسية: R-epimers ergometrine (Em) ، Ergotamine (Et) ، ergosine (Es) ، ergocristine (Ecr) ، ergokryptine (Ekr) ، و ergocornine (Eco) و S-epimers المقابلة لها: ergometrinnine (Emn) ، ergosinine (Esn) ، ergotaminine (Etn) ، ergocorninine (Econ) ، ergokryptinine (Ekrn) ، و ergocristinine (Ecrn). يمكن أن تتحول هذه المركبات من أشكال R إلى S والعكس صحيح ، خاصة تحت التعرض للضوء القوي أو التخزين المطول أو ملامسة بعض المذيبات عند درجة الحموضة العالية أو المنخفضة 12. على الرغم من أن نسبة نماذج R و S قد تختلف في ظل ظروف مختلفة ، إلا أن لجنة EFSA CONTAM أبلغت عن حدوث أعلى لنماذج R من نماذج S بعد مراجعة الأدبيات المتاحة حول الاستمارات في المنتجات الغذائية14. ومن ثم ، تختلف MLs اعتمادا على عدة عوامل ، مثل قابلية المحصول أو درجة المعالجة أو تكرار الاستهلاك. وفي إطار الاتحاد الأوروبي، حددت المؤلفات العليا للمنتجات المطحونة من الشعير والقمح والحنطة والشوفان عند 50 أو 150 ميكروغرام/كغ (حسب محتوى الرماد الأقل أو الأعلى من 900 مغ/100 غرام، على التوالي)، في حين أن الحبوب المخصصة للاستهلاك البشري مباشرة تخضع لكمية من 150 ميكروغرام/كغ، باستثناء أغذية الأطفال القائمة على الحبوب، حيث يتم تقليل ML إلى 20 ميكروغرام / كجم10.
يتطلب هذا التشريع الصارم منهجيات تحليلية حساسة بما يكفي لتحديد مستويات التركيز النزرة (ميكروغرام / كجم) مع تحديد الكيانات الخبيرة المنظمة بشكل صحيح والعناصر المقابلة لها ، حيث يمكن العثور على كلا الشكلين ، أيزومرات R و S ، معا في عينات ملوثة. تمثل هذه المهمة تحديا كبيرا لأن كل زوج من السموم في نفس نمط الكتلة والتجزئة بالضبط. بالإضافة إلى ذلك ، قد يكون الفصل الكروماتوغرافي المناسب بين كلا المركبين معقدا. لذلك ، يلزم وجود تدرجات LC محسنة جيدا لتجنب التقدير الخاطئ عندما تحدث epimers EA في عينات الطعام. على الرغم من أن العديد من الدراسات قد أبلغت عن طرق LC-MS لتحديد لا لبس فيه ل EAs15،16،17،18 ، إلا أنه يجب دراسة الطريقة الكروماتوغرافية على نطاق واسع لتحقيق الفصل الكافي للقمم الكروماتوغرافية لتحديد EAs بشكل لا لبس فيه. ومع ذلك ، فإن هذا غير ممكن عادة للطرق متعددة الفئات التي يتم فيها تحديد الملوثات التي تنتمي إلى عائلات كيميائية مختلفة في وقت واحد. في هذا السياق ، أفادت دراسة حديثة أجراها Carbonell-Rozas و Hernández-Mesa et al.19 عن طريقة LC-IMS-MS للقياس الكمي ل EAs في عينات القمح والشعير ، باستخدام أداتين مختلفتين ل TWIMS توفران قيم احتجاز ثاني أكسيد الكربون وتخزينه وحدود منخفضة للقياس الكمي (LOQs) للكشف عن أي عدم امتثال وفقا للتشريعات الحالية. لذلك ، فإن الهدف من هذا البروتوكول هو إظهار كيف يساهم تكامل IMS في تدفقات عمل LC-MS في فصل EAs الأيزومرية ، مما يعزز انتقائية الطريقة التحليلية. بالإضافة إلى ذلك ، يوضح كيف أن إنشاء مكتبات احتجاز ثاني أكسيد الكربون وتخزينه من خلال توصيف المعايير التحليلية يوفر ثقة أعلى لتحديد السموم الفطرية. تم تصميم هذا البروتوكول لشرح فوائد تطبيق نظام الإدارة المتكاملة في تحليل سلامة الأغذية بوضوح، مع الأخذ على سبيل المثال تحديد المستشارين الخبراء في الحبوب. يتناول هذا البروتوكول معالجة العينة بناء على إجراء QuEChERS ، وتحليل العينة بواسطة LC-TIMS-MS ، واستخراج بيانات IMS وتفسيرها.
Protocol
1. إعداد المخزون والحلول القياسية المتوسطة والعاملة
ملاحظة: استخدم قفازات النتريل ومعطف المختبر ونظارات السلامة.
- قم بإعداد محاليل مخزون فردية ل 12 EAs (انظر جدول المواد) عند 10,000 نانوغرام / مل في قوارير زجاجية كهرمانية سعة 4 مل باستخدام الأسيتونيتريل. تم تصنيف أشكال R (-ine) سابقا في أجزاء 25,000 ng ، بينما تم توزيع أشكال S (-inine) في 10,000 ng أجزاء. بدأت هذه الدراسة بهذه الحصص ، حيث وصلت إلى تركيزات 10,000 نانوغرام / مل عن طريق تخفيف الشكلين R و S في 2.5 و 1 مل من الأسيتونيتريل ، على التوالي ، متبوعا بالدوامة لمدة دقيقتين.
- قم بإعداد محلول مخزون وسيط عند 1,000 نانوغرام / مل من إجمالي EAs (83.33 نانوغرام / مل من كل منهما) في قارورة زجاجية كهرمانية سعة 12 مل عن طريق إضافة 65 ميكرولتر من كل محلول قلويد فردي و 7.02 مل من الأسيتونيتريل.
ملاحظة: بمجرد تحضير محلول المخزون الوسيط ، يجب تجفيف محاليل المخزون الفردية وتخزينها عند -20 درجة مئوية مغطاة بورق الألمنيوم لتجنب إزالة الشعر. - قم بإعداد حلول قياسية عاملة من محلول المخزون الوسيط عن طريق سحب ماصات 2.7 و 1.8 و 0.9 مل في أنابيب زجاجية كهرمانية سعة 4 مل. خذها إلى الجفاف تحت تيار النيتروجين اللطيف وأعد تعليقها في 600 ميكرولتر من الأسيتونيتريل.
ملاحظة: تم تحديد التركيزات الناتجة لتصل إلى 1.5 و 1 و 0.5 ضعف مل (150 نانوغرام / جم) عند إضافة 50 ميكرولتر إلى 1 جم من العينة. يتم اختيارها كمستويات تركيز لدراسات التحقق من الصحة (أي التعافي ، والتكرار ، وما إلى ذلك). - قسم 600 ميكرولتر من كل محلول قياسي للعمل إلى ثلاث قوارير زجاجية كهرمانية سعة 2 مل عن طريق سحب 200 ميكرولتر وأخذها حتى تصبح جافة.
ملاحظة: يتم شرح الخطوات من 1.2 إلى 1.4 بشكل تخطيطي في الشكل 1. من خلال تقسيم وتجفيف المحاليل القياسية للعمل، من الممكن التحصين ثلاث نسخ في ثلاثة أيام مختلفة، كما هو مطلوب في دراسة التحقق من الصحة، دون فقدان السلامة الكيميائية للمستشارين الخبيرين. - في كل يوم من أيام التحقق، أعد تعليق قارورة زجاجية كهرمانية سعة 2 مل من كل مستوى تحصين في 200 ميكرولتر من الأسيتونيتريل.
ملاحظة: سيتم تقييم كل مستوى من مستويات التحصين بثلاث نسخ باستخدام 50 ميكرولتر لكل عينة. لذلك ، سيتم استخدام ما مجموعه 150 ميكرولتر من المحلول.
2. تحضير الكواشف والحلول
ملاحظة: استخدم قفازات النتريل ومعطف المختبر ونظارات السلامة.
- تحضير محلول كربونات الأمونيوم 5 ملي مولار بوزن 24.02 مجم من كربونات الأمونيوم وإذابتها في 50 مل من الماء. تزن 24.02 مجم من كربونات الأمونيوم في دورق وأضف حوالي 5 مل من الماء. قم بإذابة كربونات الأمونيوم عن طريق تحريك المحلول يدويا برفق ، ثم انقله إلى قارورة حجمية سعة 50 مل. للوصول إلى الحجم النهائي البالغ 50 مل ، اشطف الدورق بماء إضافي وانقل الارتفاع إلى القارورة الحجمية.
- تحضير 250 مل من محلول الاستخلاص [الأسيتونيتريل: 5 ملي مولار كربونات الأمونيوم (85:15 ، حجم / حجم)] عن طريق خلط 212.5 مل من الأسيتونيتريل و 37.5 مل من محلول الأمونيوم المحضر في الخطوة 2.1.
- تحضير 100 مل من خليط الميثانول: الماء (1: 1 ، حجم / حجم) لإعادة تعليق مستخلصات العينة (الخطوة 8.8).
- لكل عينة ، تزن 150 مجم من مادة الطور الصلب المشتتة C18: خليط المواد الماصة القائمة على الزركونيا (1: 1 ، وزن / وزن) في أنابيب طرد مركزي سعة 15 مل لمرحلة التنظيف المشتت (الخطوة 8.5).
- تحضير المذيبات للفصل الكروماتوغرافي في زجاجتين مختلفتين ، وهما 1 لتر من الماء عالي النقاء (المذيب أ) والميثانول (المذيب ب) ، وكلاهما يحتوي على 0.3٪ (حجم / حجم) حمض الفورميك. لتحقيق هذا التركيز ، تمت إضافة 3.03 مل من حمض الفورميك (نقاء 99٪) إلى الزجاجات.
ملاحظة: يجب تحضير مذيبات المرحلة المتنقلة قبل إجراء تحليلات LC-IMS-MS مباشرة.
3. تحديد المعلمات الآلية
ملاحظة: كانت الأداة المستخدمة لإجراء دراسة LC-IMS-MS هذه عبارة عن UHPLC مقترن ب IM-HRMS ، ومجهز بمصدر تأين بالرش الكهربائي المسخن (VIP-HESI) المعزول بالفراغ. تم تشغيل الأداة في الوضع الإيجابي.
- قم بإنشاء طريقة كروماتوغرافية باستخدام برنامج الاستحواذ لفصل التحليلات عن طريق تعيين تدرج الشطف التالي: 0 دقيقة ، 10٪ B ؛ 2 دقيقة ، 10٪ ب ؛ 4.5 دقيقة ، 40٪ ب ؛ 9 دقائق ، 45٪ ب ؛ 11 دقيقة ، 95٪ ب ؛ 12 دقيقة ، 95٪ ب ؛ 13 دقيقة ، 10٪ ب ؛ 16 دقيقة ، 10٪ ب.
- اضبط معدل تدفق الطور المتحرك على 0.4 مل / دقيقة ، ودرجة حرارة العمود عند 35 درجة مئوية ، وحجم الحقن عند 5 ميكرولتر. إذا أمكن ، احتفظ بدرجة حرارة ثابتة تبلغ 10 درجات مئوية داخل جهاز أخذ العينات التلقائي.
- اضبط معلمات IMS على النحو التالي: قيم التنقل (1/K0)، من 0.1 إلى 1.5 فولت ثانية/سم2؛ وقت المنحدر ، 100 مللي ثانية ؛ وقت الدقة ، 10 مللي ثانية ؛ دورة العمل ، 10٪ ؛ ومعدل المنحدر ، 9.05 هرتز.
- قم بتعيين معلمات مصدر الأيونات للكشف عن MS على النحو التالي: الجهد الشعري ، 2,500 فولت ؛ ضغط البخاخات ، 2.5 بار ؛ معدل تدفق الغاز الجاف ، 8 لتر / دقيقة ؛ درجة حرارة الغاز الجاف ، 200 درجة مئوية ؛ درجة حرارة غاز الغمد ، 450 درجة مئوية ؛ معدل تدفق غاز الغمد ، 4 لتر / دقيقة. لاكتساب MS ، حدد المعلمات التالية ، مع مراعاة حدثي مسح: مسح كامل للطيف الكتلي بأكمله مع m / z من 20 إلى 1,300 متبوعا ب bbCID (التفكك الناجم عن الاصطدام عريض النطاق) ، والذي يولد أيونات المنتج من أي سلائف عند ثلاث طاقة تصادم ثابتة تبلغ 24 و 36 و 50 فولت. إجراء التأين والحصول على البيانات في وضع القطبية الإيجابية.
- احفظ ملف طريقة الاكتساب هذا لمزيد من الاستخدام.
4. الحصول على البيانات من المعايير التحليلية للمستشارين الخبراء
ملاحظة: استخدم قفازات النتريل ومعطف المختبر ونظارات السلامة للخطوة 4.1 فقط.
- قم بإعداد قارورتين كهرمانيتين سعة 1.5 مل مع 500 ميكرولتر من المحلول الوسيط عند 1,000 نانوغرام / مل وقارورة أخرى بمزيج من المذيبات A و B (1: 1 ، v / v) كمحلول غسيل.
- قم بمعايرة أداة timsTOF كما هو موضح من قبل الشركة المصنعة وحدد القطبية الإيجابية لكل من عمليات الاستحواذ IMS و MS.
- ضع العمود C18 (انظر جدول المواد) داخل فرن LC ، مع ضبط درجة الحرارة على 35 درجة مئوية كما هو موضح في ملف طريقة الاستحواذ المحفوظ في الخطوة 3.5.
ملاحظة: تأكد من شد كلا الطرفين جيدا. خلاف ذلك ، سيتم ملاحظة تسرب المرحلة المحمولة. - قم بتكييف عمود LC للسماح بمعدل تدفق طور متحرك يبلغ 0.1 مل / دقيقة وحدد نسبة خليط المذيب A و B 90:10 (٪) كنسبة تكوين المرحلة المتنقلة الأولية.
- انتظر حتى يستقر ضغط العمود (~ 130 بار).
- قم بزيادة معدل تدفق الطور المتنقل إلى 0.2 مل / دقيقة ، وانتظر حتى يستقر الضغط ، وزده مرة أخرى إلى 0.3 مل / دقيقة.
- بمجرد أن يستقر الضغط مرة أخرى ، اضبط معدل التدفق على 0.4 مل ، والذي سيكون معدل تدفق العمل كما هو مفصل في ملف طريقة الاستحواذ المحفوظ في الخطوة 3.5 ، وانتظر حتى يستقر الضغط حول 350 بار.
ملاحظة: من المهم عدم زيادة التدفق مباشرة من 0.2 إلى 0.4 مل / دقيقة. يؤدي التغيير القوي في التدفق إلى ظهور قمم الضغط العالي التي قد تضر بعمود الكروماتوغرافيا. - أثناء تكييف العمود، اكتب قائمة العمل، بما في ذلك عينتين تقابلان القارورتين اللتين تحتويان على محلول وسيط EAs عند 1,000 نانوغرام/مل، كما هو موضح في الخطوة 4.1، وقارورة الغسيل. قم بتحليل قارورة الغسيل مرتين ، في بداية ونهاية دفعة العينة.
- في عمود ملف الأسلوب في قائمة العمل، قم بتحميل ملف أسلوب الاكتساب المحفوظ مسبقا في الخطوة 3.5.
- قم بإنشاء مجلد لحفظ كافة ملفات البيانات التي تم الحصول عليها وتوجيه جميع العينات عن طريق تحديد المجلد الموجود في عمود نموذج المسار .
ملاحظة: تأكد من استخدام نفس المجلد لحفظ كافة الملفات التي تم إنشاؤها أثناء دراسة التحقق من الصحة لمزيد من المعالجة. أثناء تكييف العمود ، قد تختلف القيم التي يستقر عندها الضغط قليلا. ومع ذلك ، تأكد من استقرار الضغط قبل زيادة معدل التدفق مرة أخرى للحفاظ على سلامة العمود. علاوة على ذلك ، عند الوصول إلى معدل تدفق العمل ، يجب أن يكون الضغط مستقرا أيضا لتحقيق فصل كروماتوجرافي قابل للتكرار. - انتقل إلى شريط الأدوات العلوي للبرنامج وقم بتشغيل قائمة العمل.
5. معالجة البيانات لإنشاء طريقة القياس الكمي
- بمجرد تنفيذ قائمة العمل ، افتح البرنامج النوعي.
- قم بتحميل جميع العينات التي تم تحليلها بالنقر فوق ملف | افتح قائمة العمل.
- انقر بزر الماوس الأيمن فوق عينة تتوافق مع الحل الوسيط EAs بمعدل 1,000 نانوغرام / مل ، وانتقل إلى تحرير الرسم الكروماتوغرامي ، ثم حدد النوع | الكروماتوغرام الأيوني المستخرج ، وأدخل الكتلة الجزيئية النظرية للأيون البروتوني المتعلق بكل EA. ثم انقر فوق إضافة ، وأخيرا ، موافق. نظرا لأن مجموعة التحليلات تتكون من ستة EAs وepimers ذات الصلة التي تشترك في نفس الكتلة بالضبط ، فستظهر ستة كروماتوغرامات أيونية مستخرجة.
ملاحظة: تغير المعلمة العرض مدى ضيق النافذة m/z . يوصى بتحديد نافذة m / z واسعة بما فيه الكفاية في حالة وجود صعوبات في العثور على الذروة الكروماتوغرافية للتحليل محل الاهتمام. ومع ذلك ، ينصح بتعيين نوافذ ضيقة m / z لتجنب التداخلات المحتملة (أقل من 0.05 وحدة). - في كل كروماتوغرام أيوني مستخرج ، ستظهر قمتان كروماتوجرافيتان مرتبطتان بالمستشار الخبير الرئيسي وepimer الخاص به. انقر بزر الماوس الأيمن أثناء تحديد المساحة الكاملة لقمة واحدة. وبالتالي ، سيظهر طيف التنقل الأيوني أدناه مباشرة.
- انتقل إلى المحور x من طيف الحركة الأيونية ، وانقر بزر الماوس الأيمن ، ثم انقر فوق المقطع العرضي للتصادم. اكتب قيمة CCS.
ملاحظة: إذا لم تظهر قيم CCS تلقائيا، فانتقل إلى معايرة في شريط الأدوات العلوي، ثم حاسبة التنقل، واكتب قيمة التنقل يدويا للحصول على CCS المقابلة لها. - حدد المنطقة المقابلة للقمة الكروماتوغرافية الأخرى داخل نفس الكروماتوجرام الأيوني وكرر الخطوات 5.4. و 5.5.
- وبالمثل ، سيظهر نمط التجزئة أيضا بعد الخطوة 5.4. بناء على نمط التجزئة المبلغ عنه في الأدبيات وقواعد البيانات ، قارن واختر أيون المنتج الأكثر كثافة كنقطة تعريف تكميلية.
- اكتب وقت الاستبقاء وقيمة احتجاز الكربون وتخزينه والكتلة الدقيقة لمقرب الأيونات الرئيسي (عادة ما يكون الأيون البروتوني) لكل EA لإنشاء طريقة القياس الكمي.
- كرر الخطوات من 5.4 إلى 5.8. للتحليلات المتبقية.
- حدد جميع الكتل الجزيئية التي تم إنشاؤها في الخطوة 5.3 بالنقر عليها أثناء الضغط على Ctrl. ثم انقر بزر الماوس الأيمن وحدد نسخ. انتقل إلى العينة الأخرى المقابلة للحل الوسيط EAs ، وانقر بزر الماوس الأيمن فوقه وحدد لصق. سيتم استخراج الكروماتوغرامات الأيونية وأطياف التنقل تلقائيا.
- تحقق مرة أخرى من معلمات التعريف لجميع التحليلات في هذه العينة الثانية.
6. إنشاء طريقة معالجة البيانات للتحديد الروتيني لقلويدات الإرغوت
- افتح البرنامج وانقر على علامة التبويب "إدارة الأساليب ".
- انقر فوق إعدادات Analyte وأدخل اسم كل EA جنبا إلى جنب مع وقت الاحتفاظ به وقيمة CCS وكتلة المقاربات البروتونية التي تم جمعها في الخطوات 5.4. إلى 5.9. قم بتغيير تفاوت كل نقطة تعريف حسب الضرورة، على الرغم من أن الإعدادات الافتراضية موصى بها لتطبيق هذا البروتوكول.
ملاحظة: كلما ارتفعت قيم التسامح المحددة ، زادت إمكانية التعامل مع الإيجابيات الخاطئة ، حيث يتم قبول انحراف أكبر عن القيم النظرية. وبالمثل ، قد تؤدي قيم التسامح الصارمة للغاية إلى سلبيات خاطئة. يحدث هذا عندما يكون الانحراف عن القيمة النظرية ناتجا فقط عن أداء الأداة. - احفظ طريقة القياس الكمي لمزيد من الاستخدام.
7. أخذ العينات
- الحصول على عينات من القمح والشوفان في محلات السوبر ماركت ، ويفضل أن يكون ذلك في حاويات 1 كجم ، وفقا للإرشادات الخاصة بأخذ العينات التي وضعتها المفوضية الأوروبية20. إذا لم تكن عبوات 1 كجم متوفرة ، فتأكد فقط من وجود 50 جراما على الأقل من العينات لإكمال التحليل بالكامل.
- طحن العينات باستخدام مطحنة. في هذه الدراسة ، تم استخدام مطحنة شفرة لطحن المحتوى الكامل للعبوات ، والتي تم إعادتها بعد ذلك إلى عبواتها الأصلية للتجانس.
ملاحظة: نظف المطحنة جيدا بين العينات لتجنب التلوث المتبادل. استخدم معطف المختبر. - قم بتقسيم العينات المتجانسة في أنابيب طرد مركزي سعة 50 مل وتخزينها في ظروف باردة وجافة.
8. إعداد العينة
- إعداد جدول زمني لإجراء دراسة التحقق لمدة ثلاثة أيام غير متتالية (لتقييم قابلية التكرار الداخلي). لكل يوم ، قم بفحص ثلاثة مستويات تركيز عن طريق تقوية العينات عند 225 نانوغرام / غرام (1.5 مل) و 150 نانوغرام / غرام (مل) و 75 نانوغرام / غرام (0.5 مل). ادرس كل مستوى في ثلاث نسخ ، تمثل تسع عينات مسننة بالإضافة إلى ثلاث عينات فارغة أخرى يوميا.
ملاحظة: بالنظر إلى أيام التحقق الثلاثة ، ستكون هناك حاجة إلى ما مجموعه 36 عينة إلى جانب 8 عينات فارغة أخرى مخصصة لإعداد منحنى المعايرة المطابق للمصفوفة. استخدم قفازات النتريل ومعطف المختبر ونظارات السلامة لهذا القسم بأكمله من البروتوكول. - وزن 1 جم من العينة في أنبوب طرد مركزي سعة 50 مل.
ملاحظة: عند إجراء دراسة التحقق من الصحة، قم بتحصين العينات بعد وزنها مباشرة ب 50 ميكرولتر من محلول العمل القياسي المقابل المفصل في الخطوات 1.3. و 1.5. - أضف 4 مل من محلول الاستخراج [الأسيتونيتريل: محلول مائي كربونات الأمونيوم 5 ملي مولار (85:15 ، حجم / حجم)]. دوامة العينة لمدة 1 دقيقة.
- جهاز الطرد المركزي للعينة لمدة 5 دقائق عند 9,750 × جم و 4 درجات مئوية.
ملاحظة: قد تكون سعة جهاز الطرد المركزي عاملا مقيدا في الإجراء ، لذلك يوصى باستخراج العدد الدقيق للعينات التي تتناسب مع جهاز الطرد المركزي في نفس الوقت. - انقل المادة الطافية بالكامل إلى أنبوب الطرد المركزي سعة 15 مل الذي يحتوي على 150 مجم من خليط المادة الماصة للتنظيف (1: 1 ، وزن / وزن). دوامة العينة لمدة 1 دقيقة.
- جهاز الطرد المركزي للأنبوب لمدة 5 دقائق عند 9,750 × جم و 4 درجات مئوية.
- اجمع المادة الطافية وضعها في قارورة زجاجية كهرمانية سعة 4 مل. تبخر المستخلص تحت تيار لطيف من النيتروجين.
ملاحظة: يجب حفظ العينات جافة عند -20 درجة مئوية إذا لم يتم تحليلها في نفس اليوم. - أعد تكوين العينة في 750 ميكرولتر من خليط الميثانول: الماء (1: 1 ، حجم / حجم).
- انقل المستخلص إلى حقنة سعة 2 مل وقم بتصفيته من خلال مرشح نايلون 0.22 ميكرومتر إلى قارورة كروماتوجرافية كهرمانية سعة 1.5 مل.
- اجمع المستخلصات المعاد تكوينها من العينات الفارغة الثماني المخصصة لمنحنى المعايرة المتطابق مع المصفوفة في قارورة زجاجية كهرمانية سعة 12 مل (يتم تعليق كل عينة في 750 ميكرولتر ، وهو ما يمثل حجما إجماليا قدره 6 مل).
- الماصة 1 مل من المحلول الوسيط عند 1,000 نانوغرام/مل (83.33 نانوغرام/مل لكل قلويد الإرغوت) (الخطوة 1.2) في قارورة زجاجية كهرمانية سعة 2 مل، وتجفيف المذيب تحت تيار لطيف من النيتروجين، وإعادة تعليقه في 1 مل من مستخلص العينة الفارغة الذي تم جمعه مسبقا.
ملاحظة: سيتم استخدام هذا المزيج بتركيز 1,000 نانوغرام/مل (83.33 نانوغرام/مل لكل EA) لإعداد منحنى المعايرة المطابق للمصفوفة. - قم بإعداد عشر قوارير زجاجية كهرمانية سعة 2 مل وضع 450 ميكرولتر من مستخلص العينة الفارغة (الخطوة 8.10) في كل واحدة وقم بتمييزها بأرقام من 1 إلى 10. ستكون كل قارورة نقطة في منحنى المعايرة.
ملاحظة: في هذا البروتوكول ، تم استخدام 450 ميكرولتر لأنه كان أقل قيمة يمكن أن يصل إليها جهاز LC داخل القارورة دون استخدام الإدخالات. إذا لم تصل الإبرة إلى هذا الحد في القارورة ، فقم بزيادة الحجم ، وبالتالي احسب عدد العينات الفارغة الإضافية التي يجب استخراجها مع الأخذ في الاعتبار أن كل واحدة معلقة في 750 ميكرولتر من خليط الميثانول: الماء (1/1 ، v: v). - بناء منحنى المعايرة عن طريق التخفيف التسلسلي. انقل 450 ميكرولتر من المزيج المحضر في الخطوة 8.11. في قارورة 1 ، التي تحتوي بالفعل على 450 ميكرولتر من مستخلص العينة الفارغة ، لتحقيق تركيز 41.67 نانوغرام / مل (أعلى نقطة معايرة). دوامة القارورة لمدة 2 دقيقة.
ملاحظة: يجب أن يتطابق حجم المزيج مع حجم مستخلص العينة الفارغة لتخفيفه مرتين في كل خطوة. - انقل 450 ميكرولتر من القارورة 1 إلى القارورة 2 ، والتي تحتوي بالفعل على 450 ميكرولتر من مستخلص العينة الفارغة ، للوصول إلى تركيز 20.83 نانوغرام / مل (ثاني أعلى نقطة معايرة).
- كرر الخطوة 8.14 (أي من القارورة 2 إلى القارورة 3 ، وهكذا) واستمر لاحقا حتى يتم الحصول على نقاط المعايرة العشر. سيكون نطاق التركيز لكل EA عندئذ: 41.67 و 20.83 و 10.42 و 5.21 و 2.60 و 1.30 و 0.65 و 0.33 و 0.16 و 0.08 نانوغرام / مل.
- قم بإعداد خليط قياسي عند 1,000 نانوغرام / مل (83.33 نانوغرام / مل لكل EA) كما هو مفصل في الخطوة 8.11 ولكن باستخدام 1 مل من خليط الميثانول: الماء (1: 1 ، حجم / حجم).
- قم بإعداد منحنى معايرة قياسي كما هو مفصل في الخطوات من 8.13 إلى 8.15 ولكن باستخدام 450 ميكرولتر من خليط الميثانول: الماء (1: 1 ، حجم / حجم) للتخفيفات التسلسلية. سيتم استخدام منحنى المعايرة هذا لتقييم تأثير المصفوفة من خلال مقارنته بمنحنى المعايرة المتطابق مع المصفوفة.
9. معالجة البيانات الكمية
- قم بتهيئة الأداة وتشغيلها باتباع الإرشادات الموضحة في الخطوات 4.1. إلى 4.11. انظر الشكل 2 للحصول على قائمة العمل المستخدمة في هذا البروتوكول.
ملاحظة: عند كتابة قائمة العمل لمنحنيات المعايرة ، قم بحقنها قبل العينات المدعمة بدءا من منحنى المعايرة القياسي من أدنى تركيز إلى أعلى تركيز ، وقارورة غسيل تحتوي على الميثانول: الماء (1: 1 ، حجم / حجم) ، ومنحنى المعايرة المتطابق مع المصفوفة من أدنى تركيز إلى أعلى. - افتح البرنامج الكمي وانتقل إلى علامة التبويب TASQ Quick | استيراد الدفعة في أسفل اليسار.
- حدد المجلد الذي تم إنشاؤه في الخطوة 4.10. تحتوي على جميع البيانات الأولية (الملفات المتعلقة بالمعلومات التي تم الحصول عليها بعد تحليل LC-IMS-MS لجميع العينات المدرجة في قائمة العمل).
- بمجرد استيرادها إلى البرنامج ، انتقل إلى دفعة المعالجة ، أسفل دفعة الاستيراد مباشرة.
- اختر العينات المراد معالجتها (على سبيل المثال، العينات المسننة البالغ عددها 27 عينة، و9 الفراغات، ومنحنيات المعايرة) وطريقة معالجة البيانات التي تم إنشاؤها مسبقا في الخطوات 6.1. إلى 6.3. ستظهر نافذة بها معلمات مختلفة لتعيينها (أي نوع المتكامل لتقييم القمم الكروماتوغرافية أو نوع الإشارة التحليلية التي يجب مراعاتها، من بين أمور أخرى). قم بتغيير هذه المعلمات حسب الرغبة ، على الرغم من أن القيم الافتراضية مناسبة لتنفيذ هذا البروتوكول.
- انتقل إلى مراجعة الفحص بعد اكتمال معالجة البيانات وتحقق مما إذا كانت هناك أي مشكلات تتعلق بالتكامل التلقائي ، مثل تحديد القمم الكروماتوغرافية غير الصحيحة التي قد تكون قريبة جدا من بعضها البعض. إذا كان الأمر كذلك ، فقم بتضييق نطاق القيم التي تشير إلى تفاوت وقت الاستبقاء ، و / أو تفاوت قيم احتجاز الكربون وتخزينه ، و / أو الخطأ الجماعي الذي تم إنشاؤه في البداية في ملف الطريقة الكمية وإعادة معالجة البيانات. إذا كان التكامل التلقائي للذروة لا يزال يحدد القمم غير الصحيحة، فقم بدمج الذروة يدويا عن طريق تحديد المنطقة في الكروماتوگرام الذي يظهر في نافذة فحص المراجعة (للقيام بذلك، ضع في الاعتبار المعلمات التحليلية التي تم الحصول عليها لمعايير EA في القسم 5).
ملاحظة: من المهم جدا مراجعة كل عينة ، حيث أن بعض أزواج EA-epimer الرئيسية لها أوقات احتفاظ متشابهة جدا وقد يتم تحديدها بشكل خاطئ بواسطة البرنامج. - عندما يتم دمج جميع القمم بنجاح لجميع العينات ، انقر فوق علامة التبويب إدارة الدفعات في الزاوية اليسرى العليا وحدد نوع العينة المرتبطة بكل تحليل: مذيب أو فارغ أو مراقبة الجودة أو العينة أو نقطة المعايرة. في الحالة الأخيرة ، قم بتعيين كل نقطة معايرة على مستوى به رقم.
- في علامة التبويب إدارة الدفعات نفسها، انتقل إلى النافذة السفلية المسماة تركيز الدفعة وحدد قيمة تركيز لكل مستوى تم إنشاؤه في الخطوة السابقة. بمجرد الانتهاء من ذلك ، انقر فوق حفظ التركيزات.
- انقر فوق تحديد الدفعة وقم بتغيير المعلمات حسب الرغبة (على سبيل المثال ، النموذج ليناسب بيانات المعايرة ، والترجيح ، وما إذا كان النموذج مجبرا على عبور الصفر ، وما إلى ذلك). القيم الافتراضية مناسبة لتنفيذ هذا البروتوكول باستثناء ترجيح منحنيات المعايرة ، والتي تم تحويلها إلى 1 / x.
ملاحظة: نظرا لأن البرنامج يمكنه النظر في منحنى معايرة واحد فقط في كل مرة، فمن الضروري تكرار الخطوة 9.9 مرتين للحصول على معلومات حول منحنيات المعايرة القياسية ومطابقة المصفوفة. في هذا البروتوكول ، تم استخدام منحنيات المعايرة المتطابقة مع المصفوفة لقياس التحليلات ، لذلك تم تقييم منحنيات معايرة المذيبات أولا ، وتم استخراج بيانات المعايرة كما هو موضح لاحقا في الخطوة 9.13 ، وأخيرا ، تم اختيار منحنيات المعايرة المتطابقة مع المصفوفة لإجراء القياس الكمي للعينات. - بمجرد إجراء القياس الكمي لقلويدات الإرغوت وفقا لملف طريقة القياس الكمي ، انقر فوق علامة التبويب "القياس الكمي" في الجزء العلوي من الشاشة.
- إذا كانت المعلمات الافتراضية المحددة في الخطوة 9.9 لا توفر خطية ودقة جيدين ، فقم بضبط منحنيات المعايرة عن طريق تغيير التركيب والوزن بالنقر بزر الماوس الأيمن على الرسم البياني بهدف الحصول على نموذج خطي جيد (R2 > 0.99) بدقة كافية على كل مستوى معايرة (انحراف أقل من 20٪).
ملاحظة: سيقوم البرنامج بتمييز الخلايا باللون الأحمر من مستويات المعايرة التي لا توفر الدقة المناسبة. - بمجرد الانتهاء، انقر بزر الماوس الأيمن فوق المجلد الدفعي في أقصى يسار الشاشة وحدد إنشاء تقرير. ثم حدد التحليل الكمي لتصدير التقرير إلى التنسيق المطلوب.
النتائج
أولا ، تم حقن الحلول القياسية العاملة في أداة LC-IMS-MS للحصول على جميع ميزات التعريف (أي وقت الاستبقاء ، و CCS ، وأطياف الكتلة) لكل EA تم تحليله هنا. نظرا لأن معلمات التعريف ، باستثناء الكتلة الدقيقة ، كانت غير معروفة في البداية ، فقد استندت طريقة الاستحواذ إلى حدث من مسحتين ، بد...
Discussion
يعتمد الاستخدام الناجح لهذا البروتوكول على تحسين إجراء الاستخراج ، الذي تم تنفيذه سابقا بواسطة Carbonell-Rozas et al.17 ، الذي نفذ استخدام مذيب استخلاص فعال بما يكفي لاستخراج EAs من مصفوفات غذائية معقدة مثل الشعير والقمح ، والتنظيف الذي يوفر قيم SSE منخفضة نسبيا. يمثل اخ...
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للإفصاح عنه.
Acknowledgements
تم تمويل هذا البحث من قبل Consejería de Universidad ، Investigación e Innovación - Junta de Andalucía (PROYEXCEL_00195) ومنحة ما بعد الدكتوراه المقدمة من Generalitat Valenciana والصندوق الاجتماعي الأوروبي + (CIAPOS / 2022/049). يشكر المؤلفون "Centro de Instrumentación Científica (CIC)" في جامعة غرناطة على توفير الوصول إلى الأجهزة التحليلية المستخدمة في هذا البروتوكول.
Materials
| Name | Company | Catalog Number | Comments |
| Acetonitrile | VWR | 83640.32 | |
| Amber glass tubes 4 mL | VWR | 548-0052 | |
| Amber glass tubes 12 mL | VWR | 548-0903 | |
| Amber vials 1.5 mL | Agilent | 5190-9063 | |
| Ammonium carbonate | Fluka | 9716 | |
| Analytical balance BAS 31 | Boeco | 4400519 | |
| Balance CP 323 S | Sartorius | 23-84182 | |
| C18 | Supelco | 52604-U | |
| Centrifuge tubes, 15 mL | VWR | 525-1082 | |
| Centrifuge tubes, 50 mL | VWR | 525-0155 | |
| Centrifuge Universal 320 R | Hettich | 1406 | |
| Compass HyStar | Bruker | Acquisition software | |
| DataAnalysis | Bruker | Qualitative software | |
| Elute PLUS UHPLC | Bruker | ||
| EVA EC-S evaporator | VLM | V830.012.12 | |
| Formic acid GR for analysis ACS, Reag. Ph Eur | Merck | 100264 | |
| Grinder TitanMill300 | Cecotec | 1559 | |
| Methanol | VWR | 83638.32 | |
| Milli-Q water purification system (18.2 MΩ cm) | Millipore | ZD5211584 | |
| Pipette tips 1- 5 mL | Labortecnic | 162005 | |
| Pipette tips 100 - 1000 µL | Labortecnic | 1622222 | |
| Pipette tips 5 - 200 µL | Labortecnic | 162001 | |
| Pippette Transferpette S variable, DE-M 10 - 100 µL | BRAND | 704774 | |
| Pippette Transferpette S variable, DE-M 100 - 1000 µL | BRAND | 704780 | |
| Pippette Transferpette S variable, DE-M 500 - 5000 µL | BRAND | 704782 | |
| Syringe 2 mL | VWR | 613-2003 | |
| Syringe Filter 13 mm, 0.22µm | Phenomenex | AF-8-7707-12 | |
| TASQ | Bruker | Quantitative software | |
| timsTOFPro2 IM-HRMS | Bruker | ||
| Vortex Genie 2 | Scientific Industries | 15547335 | |
| Zorbax Eclipse Plus RRHD C18 column (50 x 2.1 mm, 1.8 µm particle size) | Agilent | 959757-902 | |
| Z-Sep+ | Supelco | 55299-U | Zirconia-based sorbent |
| Ergot alkaloids | CAS registry sorbent | ||
| Ergocornine (Eco) | Techno Spec | E178 | 564-36-3 |
| Ergocorninine (Econ) | Techno Spec | E130 | 564-37-4 |
| Ergocristine (Ecr) | Techno Spec | E180 | 511-08-0 |
| Ergocristinine (Ecrn) | Techno Spec | E188 | 511-07-9 |
| Ergokryptine (Ekr) | Techno Spec | E198 | 511-09-1 |
| Ergopkryptinine (Ekrn) | Techno Spec | E190 | 511-10-4 |
| Ergometrine (Em) | Romer Labs | "002067" | 60-79-7 |
| Ergometrinine (Emn) | Romer Labs | LMY-090-5ML | 479-00-5 |
| Ergosine (Es) | Techno Spec | E184 | 561-94-4 |
| Ergosinine (Esn) | Techno Spec | E194 | 596-88-3 |
| Ergotamine (Et) | Romer Labs | "002069" | 113-15-5 |
| Ergotaminine (Etn) | Romer Labs | "002075" | 639-81-6 |
References
- Kanu, A. B., Dwivedi, P., Tam, M., Matz, L., Hill, H. H. Ion mobility-mass spectrometry. J Mass Spectrom. 43 (1), 1-22 (2008).
- Gabelica, V., et al. Recommendations for reporting ion mobility Mass spectrometry measurements. Mass Spectrom Rev. 38 (3), 291-320 (2019).
- Feuerstein, M. L., et al. Comparability of steroid collision cross sections using three different IM-HRMS technologies: An interplatform study. J Am Soc Mass Spectrom. 33 (10), 1951-1959 (2022).
- Regueiro, J., Negreira, N., Berntssen, M. H. G. Ion-mobility-derived collision cross section as an additional identification point for multiresidue screening of pesticides in fish feed. Anal Chem. 88 (22), 11169-11177 (2016).
- Regueiro, J., Negreira, N., Hannisdal, R., Berntssen, M. H. G. Targeted approach for qualitative screening of pesticides in salmon feed by liquid chromatography coupled to traveling-wave ion mobility/quadrupole time-of-flight mass spectrometry. Food Control. 78, 116-125 (2017).
- Hernández-Mesa, M., Monteau, F., Le Bizec, B., Dervilly-Pinel, G. Potential of ion mobility-mass spectrometry for both targeted and non-targeted analysis of phase II steroid metabolites in urine. Anal Chim Acta: X. 1, 100006 (2019).
- George, A. C., et al. Interplatform comparison between three ion mobility techniques for human plasma lipid collision cross sections. Anal Chim Acta. 1304, 342535 (2024).
- Mairinger, T., Causon, T. J., Hann, S. The potential of ion mobility-mass spectrometry for non-targeted metabolomics. Curr Opin Chem Biol. 42, 9-15 (2018).
- Hernández-Mesa, M., Escourrou, A., Monteau, F., Le Bizec, B., Dervilly-Pinel, G. Current applications and perspectives of ion mobility spectrometry to answer chemical food safety issues. TrAC Trend Anal Chem. 94, 39-53 (2017).
- European, C. Commission Regulation (EU) 2023/915 of 25 April 2023 on maximum levels for certain contaminants in food and repealing Regulation (EC) No 1881/2006. Off J Eur Union. 119, 103-157 (2023).
- Carbonell-Rozas, L., et al. Occurrence of egot alkaloids in major and minor cereals from Northern Italy: A three harvesting years scenario. J Agricl Food Chem. 71 (42), 15821-15828 (2023).
- Arroyo-Manzanares, N., Gámiz-Gracia, L., García-Campaña, A. M., Diana Di Mavungu, J., De Saeger, S., Jean-Michel Mérillon, J. -. M., Ramawat, K. G. . Fungal Metabolites. , (2016).
- van Dongen, P., de Groot, A. History of ergot alkaloids from ergotism to ergometrine. Eur J Obstet Gynecol Reprod Biol. 60 (2), 109-116 (1995).
- European Food Safety Authority. Human and animal dietary exposure to ergot alkaloids. EFSA J. 15 (7), e04902 (2017).
- Nam, M., Kim, D., Kim, M. -. S. Simultaneous determination of total ergot alkaloids in wheat flour by Orbitrap mass spectrometry. Food Chem. 441, 138363 (2024).
- García-Juan, A., León, N., Armenta, S., Pardo, O. Development and validation of an analytical method for the simultaneous determination of 12 ergot, 2 tropane, and 28 pyrrolizidine alkaloids in cereal-based food by LC-MS/MS. Food Res Int. 174 (Pt 1), 113614 (2023).
- Carbonell-Rozas, L., Mahdjoubi, C. K., Arroyo-Manzanares, N., García-Campaña, A. M., Gámiz-Gracia, L. Occurrence of ergot alkaloids in barley and wheat from Algeria. Toxins. 13 (5), 316 (2021).
- Carbonell-Rozas, L., Gámiz-Gracia, L., Lara, F. J., García-Campaña, A. M. Determination of the main ergot alkaloids and their epimers in oat-based functional foods by ultra-high performance liquid chromatography tandem mass spectrometry. Molecules. 26 (12), 3717 (2021).
- Carbonell-Rozas, L., et al. Ion mobility-mass spectrometry to extend analytical performance in the determination of ergot alkaloids in cereal samples. J Chromatogr A. 1682, 463502 (2022).
- European Commission. Commission Implementing Regulation (EU) 2023/2782 of 14 December 2023 laying down the methods of sampling and analysis for the control of the levels of mycotoxins in food and repealing Regulation (EC) No 401/2006. Off J Eur Union. , (2023).
- Carbonell-Rozas, L., Vander Cruyssen, L., Dall'Asta, C., Leggieri, M. C., Battilani, P. Fit-for-purpose method development to determine co-occurring multiclass mycotoxins in apple and apple puree samples. Food Anal Methods. 16 (8), 1403-1412 (2023).
- Laouni, C., et al. Emerging mycotoxin occurrence in chicken feed and eggs from Algeria. Mycotoxin Res. 40, 447-456 (2024).
- Ben Hassouna, K., et al. Mycotoxin occurrence in milk and durum wheat samples from Tunisia using dispersive liquid-liquid microextraction and liquid chromatography with fluorescence detection. Toxins. 15 (11), 633 (2023).
- Narváez, A., et al. Occurrence and exposure assessment of mycotoxins in ready-to-eat tree nut products through ultra-high performance liquid chromatography coupled with high resolution Q-orbitrap mass spectrometry. Metabolites. 10 (9), 344 (2020).
- Arroyo-Manzanares, N., Rodríguez-Estévez, V., García-Campaña, A. M., Castellón-Rendón, E., Gámiz-Gracia, L. Determination of principal ergot alkaloids in swine feeding. J Sci Food Agric. 101 (12), 5214-5224 (2021).
- Pereira, V. L., Fernandes, J. O., Cunha, S. C. Comparative assessment of three cleanup procedures after QuEChERS extraction for determination of trichothecenes (type A and type B) in processed cereal-based baby foods by GC-MS. Food Chem. 182, 143-149 (2015).
- Tuzimski, T., Szubartowski, S. Method development for selected bisphenols analysis in sweetened condensed milk from a can and breast milk samples by HPLC-DAD and HPLC-QqQ-MS: Comparison of sorbents (Z-SEP, Z-SEP Plus, PSA, C18, chitin and EMR-lipid) for clean-up of QuEChERS extract. Molecules. 24 (11), 2093 (2019).
- Łozowicka, B., Rutkowska, E., Jankowska, M. Influence of QuEChERS modifications on recovery and matrix effect during the multi-residue pesticide analysis in soil by GC/MS/MS and GC/ECD/NPD. Environ Sci Pollut Res. 24 (8), 7124-7138 (2017).
- Schummer, C., Xandonella, I., van Nieuwenhuyse, A., Moris, G. Epimerization of ergot alkaloids in feed. Heliyon. 6 (6), e04336 (2020).
- Cherewyk, J. E., Grusie-Ogilvie, T. J., Parker, S. E., Blakley, B. R., Al-Dissi, A. M. The impact of storage temperature and time on ergot alkaloid concentrations. Toxins. 15 (8), 497 (2023).
- Silva, &. #. 1. 9. 4. ;., Mateus, A. R., Barros, S. C., Silva, A. S. Ergot alkaloids on cereals and seeds: Analytical methods, occurrence, and future perspectives. Molecules. 28 (20), 7233 (2023).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved