Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Обнаружение регулируемых алкалоидов спорыньи в пищевых матрицах с помощью жидкостной хроматографии-спектрометрии подвижности ионов-времяпролетной масс-спектрометрии
В этой статье
Резюме
В этом протоколе представлен валидированный метод жидкостной хроматографии, ионной подвижности и масс-спектрометрии высокого разрешения для определения присутствия алкалоидов спорыньи в пищевых продуктах в соответствии с недавно выпущенным Регламентом Комиссии (ЕС) 2023/915.
Аннотация
Масс-спектрометрия ионной подвижности (IMS) выступает в качестве дополнительного разделительного измерения при интеграции в рабочие процессы жидкостной хроматографии-масс-спектрометрии (LC-MS). Методы LC-IMS-MS обеспечивают более высокое пиковое разрешение, улучшенное разделение изобарических и изомерных соединений и улучшенное отношение сигнал/шум (S/N) по сравнению с традиционными методами LC-MS. IMS обеспечивает еще одну молекулярную характеристику для идентификации аналитов, а именно параметр сечения столкновений (CCS), снижая количество ложноположительных результатов. Таким образом, методы LC-IMS-MS решают важные аналитические задачи в области безопасности пищевых продуктов (т.е. обнаружение соединений на следовых уровнях в сложных пищевых матрицах и однозначная идентификация изобарических и изомерных молекул).
Алкалоиды спорыньи (ЭА) — это семейство микотоксинов, вырабатываемых грибами, которые атакуют широкий спектр видов трав, включая мелкие злаки, такие как рожь, тритикале, пшеница, ячмень, просо и овес. Максимальные уровни (МЛ) этих микотоксинов были установлены в нескольких пищевых продуктах, как подробно описано в Регламенте Комиссии EC/2023/915. Это новое законодательство включает в себя шесть основных ЭА и соответствующие им эпимеры, поэтому требуется эффективная методология для правильного различения этих изомерных молекул с учетом их совместного возникновения.
Таким образом, цель данного протокола состоит в том, чтобы показать, как интеграция IMS в рабочие процессы LC-MS способствует разделению изомерных ЭА, повышая селективность аналитического метода. Кроме того, в нем показано, как создание библиотек CCS путем определения характеристик аналитических стандартов обеспечивает более высокую достоверность идентификации микотоксинов. Этот протокол призван четко объяснить преимущества внедрения МСМ в области безопасности пищевых продуктов на примере определения ЭА в зерновых культурах. Экстракция на основе QuEChERS с последующей спектрометрией подвижности ионов с захватом LC (TIMS)-MS позволила получить пределы количественного определения в диапазоне от 0,65 до 2,6 нг/г с приемлемой точностью (хотя и с низким восстановлением эрготаминина) при 1,5x, 1x и 0,5x ML и продемонстрировала незначительный матричный эффект.
Введение
Масс-спектрометрия ионной подвижности (IMS) становится все более широко используемым аналитическим методом, часто представляемым в виде дополнительного разделительного измерения, интегрированного в традиционную жидкостно-газовую хроматографию (LC/GC) в сочетании с рабочими процессами MS. IMS состоит из разделения молекул вдоль подвижной ячейки, заполненной буферным газом, под действием электрического поля и при атмосферном давлении1. В зависимости от отношения массы к заряду (m/z) и геометрической конформации, ионизированная молекула будет взаимодействовать с буферным газом при движении по ячейке подвижности, что отражено в параметре подвижности ионов (K)2 и рассчитано с помощью следующего уравнения:
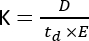
где D — общая длина дрейфа, td — общее время дрейфа, а E — электрическое поле. Следовательно, К измеряется в м2 В−1 с−1, хотя по практическим причинам его часто выражают каксм 2 В−1 с−1. Внутренняя способность к перемещению по подвижной ячейке может быть измерена по времени дрейфа, а затем преобразована в так называемое значение поперечного сечения столкновения (CCS), которое является высоковоспроизводимым параметром для каждой молекулы независимо от прибора IMS3. CCS может быть получен из мобильности по следующему уравнению:
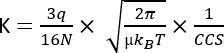
q - заряд иона; N - числовая плотность буферного газа; μ уменьшенной массы партнеров по столкновению буферного газа-иона; kB — постоянная Больцмана; и T — температура буферного газа. Таким образом, IMS предоставляет дополнительную информацию, дополняющую аналитические данные, полученные в результате хроматографии и анализа МС.
Показано, что реализация IMS в платформах LC-MS повышает достоверность аналитических определений, особенно при работе с соединениями, находящимися в следовых концентрациях. В нескольких исследованиях сообщалось, что методы LC-IMS-MS улучшают качество масс-спектров за счет снижения фонового шума, который в конечном итоге влияет на чувствительность метода, и снижают частоту ложноположительных и отрицательных результатов, обеспечиваемых методологиями LC-MS с несколькими остатками 4,5,6. Кроме того, воспроизводимость значений CCS позволяет сравнивать не только различные приборы, использующие одну и ту же технологию, но и различные технологии ионной подвижности, а именно спектрометрию ионной подвижности бегущей волны (TWIMS), спектрометрию подвижности захваченных ионов (TIMS) и спектрометрию подвижности ионов с дрейфовой трубкой (DTIMS)2,7, которые являются наиболее часто используемыми системами 1. Таким образом, замечательным следствием потенциала CCS в качестве идентификационного параметра является возможность создания библиотек CCS, что отражается в ее применимости в исследованиях метаболомики8. Тем не менее, одной из наиболее мощных особенностей IMS является способность разделять изомерные и изобарические соединения, которые могут быть недостаточно разрешены методами LC-MS. Это может иметь место при работе с большими наборами аналитов, представляющих интерес в сложных матрицах, что является обычной ситуацией в анализе окружающей среды и продуктов питания. В этом контексте предложены методы ЖХ-ИМС-МС для мониторинга пестицидов и, в меньшей степени, ветеринарных препаратов и микотоксинов в пищевых продуктах9.
Благодаря своей высокой разрешающей способности и селективности, платформы LC/GC-IMS-MS являются наиболее полезными инструментами для решения некоторых текущих проблем в области безопасности пищевых продуктов, особенно тех, которые связаны с изомерными смесями. Забота о здоровье, связанная с изомерными смесями в качестве загрязнителей пищевых продуктов, отражена в действующем европейском законодательстве, которое, например, ограничивает максимальную концентрацию шести основных алкалоидов спорыньи (ЭА) и соответствующих им шести эпимеров в некоторых пищевых продуктах10.
EA представляют собой семейство токсичных вторичных метаболитов, продуцируемых широким спектром грибов, в основном семейства Clavicipitaceae (например, Claviceps purpurea, наиболее важным продуцентом EA из-за его широкого диапазона хозяев), но также и Trichocomaceae, которые могут паразитировать на семенной головке живых растений (таких как рожь, ячмень, пшеница и овес) во время цветения. 12. При определенных условиях, особенно при температуре и активности воды, грибы Claviceps могут производить EA, которые накапливаются в плодовых телах, известных как склероции или спорыньи, в культуре-хозяине. В определенной степени ЭА выдерживают обработку сырья до достижения конечного продукта; Следовательно, прорываясь в пищевую цепочку. Употребление зараженной пищи может привести к интоксикации ЭА, известной как эрготизм, которая проявляется острыми симптомами, такими как боль в животе, рвота, ощущение жжения кожи, бессонница и галлюцинации. Чтобы снизить влияние ЭА на здоровье человека, Европейская комиссия установила максимальные уровни (МД) в нескольких продуктах питания для суммы основных ЭА: R-эпимеры эргометрин (Em), эрготамин (Et), эргозин (Es), эргокристин (Ecr), эргокриптин (Ekr) и эргокорнин (Eco) и соответствующие им S-эпимеры: эргометринин (Emn), эргозинин (Esn), эрготаминин (Etn), эргокорнинин (Econ), эргокриптонин (Ekrn), и эргокристинин (Ecrn). Эти соединения могут эпимеризоваться из R в S формы и наоборот, особенно при воздействии сильного света, длительном хранении или контакте с некоторыми растворителями при высоком или низком pH 12. Несмотря на то, что доля форм R и S может варьироваться в зависимости от условий, группа EFSA CONTAM сообщила о более высокой частоте встречаемости форм R, чем форм S, после обзора доступной литературы о EA впищевых продуктах. Следовательно, ML варьируются в зависимости от нескольких факторов, таких как восприимчивость культуры, степень обработки или частота потребления. В рамках ЕС ML для продуктов помола ячменя, пшеницы, полбы и овса установлено на уровне 50 или 150 мкг/кг (в зависимости от содержания золы ниже или выше 900 мг/100 г соответственно), в то время как для злаков, предназначенных непосредственно для потребления человеком, ML составляет 150 мкг/кг, за исключением детского питания на основе зерновых. при котором МЛ снижается до 20 мкг/кг10.
Это строгое законодательство требует достаточно чувствительных аналитических методологий для определения уровней следовых концентраций (мкг/кг) при правильной идентификации регулируемых ЭА и соответствующих им эпимеров, поскольку обе формы, R- и S-изомеры, могут быть обнаружены вместе в загрязненных образцах. Эта задача представляет собой серьезную проблему, поскольку каждая пара токсин-эпимер имеет одну и ту же точную массу и характер фрагментации. Кроме того, правильное хроматографическое разделение между обоими соединениями может быть сложным. Таким образом, необходимы хорошо оптимизированные градиенты LC, чтобы избежать неправильной количественной оценки, когда эпимеры EA одновременно встречаются в образцах пищевых продуктов. Несмотря на то, что в нескольких исследованиях сообщалось о методах ЖХ-МС для однозначного определения ЭА 15,16,17,18, хроматографический метод должен быть тщательно изучен для достижения адекватного разделения хроматографических пиков для однозначной идентификации ЭА. Однако это обычно неосуществимо для многоклассовых методов, в которых одновременно определяются загрязнители, принадлежащие к различным химическим семействам. В этом контексте в недавнем исследовании, проведенном Carbonell-Rozas, Hernández-Mesa et al.19, сообщалось о методе LC-IMS-MS для количественной оценки EAs в образцах пшеницы и ячменя с использованием двух различных инструментов TWIMS, которые обеспечивают воспроизводимые значения CCS и низкие пределы количественной оценки (LOQ) для выявления любых несоответствий в соответствии с действующим законодательством. Таким образом, цель данного протокола состоит в том, чтобы показать, как интеграция IMS в рабочие процессы LC-MS способствует разделению изомерных ЭА, повышая селективность аналитического метода. Кроме того, в нем показано, как создание библиотек CCS путем определения характеристик аналитических стандартов обеспечивает более высокую достоверность идентификации микотоксинов. Этот протокол призван наглядно объяснить преимущества внедрения ИСМ в анализе безопасности пищевых продуктов на примере определения ЭА в зерновых. Этот протокол предусматривает обработку образцов на основе процедуры QuEChERS, анализ образцов с помощью LC-TIMS-MS, а также извлечение и интерпретацию данных IMS.
протокол
1. Подготовка исходных, промежуточных и рабочих типовых растворов
ПРИМЕЧАНИЕ: Используйте нитриловые перчатки, лабораторный халат и защитные очки.
- Приготовьте отдельные исходные растворы 12 ЭА (см. Таблицу материалов) в концентрации 10 000 нг/мл во флаконах из янтарного стекла объемом 4 мл с использованием ацетонитрила. R-формы (-ine) ранее были аликвотированы в порциях по 25 000 нг, в то время как S-формы (-inine) были распределены в порциях по 10 000 нг. Данное исследование началось с этих аликвот, достигая концентраций 10 000 нг/мл путем разведения R- и S-форм в 2,5 и 1 мл ацетонитрила соответственно, с последующим вортексированием в течение 2 минут.
- Приготовьте промежуточный исходный раствор в концентрации 1000 нг/мл ЭА (83,33 нг/мл каждого) в флаконе из янтарного стекла объемом 12 мл, добавив 65 мкл каждого отдельного раствора алкалоида и 7,02 мл ацетонитрила.
ПРИМЕЧАНИЕ: После приготовления промежуточного исходного раствора отдельные исходные растворы необходимо высушить и хранить при температуре -20 °C, накрыв алюминиевой фольгой, чтобы избежать эпимеризации. - Готовьте рабочие стандартные растворы из промежуточного исходного раствора методом пипетирования по 2,7, 1,8 и 0,9 мл в пробирках из янтарного стекла объемом 4 мл. Доведите их до сухости под слабой струей азота и повторно суспендируйте в 600 мкл ацетонитрила.
ПРИМЕЧАНИЕ: Установлено, что полученные концентрации достигают 1,5, 1 и 0,5x от мл (150 нг/г) при добавлении 50 мкл к 1 г образца. Они выбираются в качестве уровней концентрации для валидационных исследований (т.е. извлечения, повторяемости и т.д.). - Разделите по 600 мкл каждого рабочего стандартного раствора на три флакона из янтарного стекла по 2 мл пипетированием по 200 мкл и доведите их до полного высыхания.
ПРИМЕЧАНИЕ: Шаги с 1.2 по 1.4 схематически объяснены на рисунке 1. Разделяя и высушивая рабочие стандартные растворы, можно укреплять в трех экземплярах в течение трех разных дней, как того требует валидационное исследование, без потери химической целостности ЭА. - В каждый день валидации повторно суспендируйте один флакон из янтарного стекла объемом 2 мл каждого уровня обогащения в 200 мкл ацетонитрила.
ПРИМЕЧАНИЕ: Каждый уровень обогащения будет оцениваться в трех экземплярах с использованием 50 μл на образец; таким образом, будет использовано в общей сложности 150 μл раствора.
2. Приготовление реагентов и растворов
ПРИМЕЧАНИЕ: Используйте нитриловые перчатки, лабораторный халат и защитные очки.
- Приготовьте 5 мМ раствор карбоната аммония, взвесив 24,02 мг карбоната аммония и растворив его в 50 мл воды. Взвесьте в стакан 24,02 мг карбоната аммония и добавьте примерно 5 мл воды. Растворите карбонат аммония, осторожно перемешивая раствор вручную, затем переложите его в мерную колбу объемом 50 мл. Чтобы достичь конечного объема в 50 мл, промойте стакан дополнительной водой и перенесите подъем в мерную колбу.
- Приготовьте 250 мл экстракционного раствора [ацетонитрил:5 мМ карбоната аммония (85:15, v/v)], смешав 212,5 мл ацетонитрила и 37,5 мл раствора аммония, приготовленного на шаге 2.1.
- Приготовьте 100 мл смеси метанол и вода (1:1, v/v) для ресуспендирования образцовых экстрактов (шаг 8.8).
- Для каждого образца взвесьте 150 мг дисперсионного твердофазного материала C18:смесь сорбента на основе диоксида циркония (1:1, масса) в центрифужные пробирки объемом 15 мл для этапа дисперсионной очистки (шаг 8.5).
- Подготовьте растворители для хроматографической сепарации в двух разных бутылках, а именно в 1 л сверхчистой воды (растворитель А) и метанола (растворитель В), содержащих 0,3% (v/v) муравьиной кислоты. Для достижения этой концентрации в бутылки добавляли 3,03 мл муравьиной кислоты (чистотой 99%).
ПРИМЕЧАНИЕ: Растворители для подвижной фазы должны быть подготовлены непосредственно перед проведением анализов LC-IMS-MS.
3. Настройка инструментальных параметров
ПРИМЕЧАНИЕ: Инструмент, использованный для проведения данного исследования LC-IMS-MS, представлял собой СВЭЖХ в сочетании с IM-HRMS, оснащенным источником ионизации электрораспылением с вакуумной изоляцией зонда (VIP-HESI). Прибор работал в положительном режиме.
- Создать хроматографический метод с использованием программного обеспечения для сбора данных для разделения аналитов путем установки следующего градиента элюирования: 0 мин, 10% В; 2 мин, 10% В; 4,5 мин, 40% В; 9 мин, 45% В; 11 мин, 95% В; 12 мин, 95% В; 13 мин, 10% В; 16 мин, 10% В.
- Установите расход подвижной фазы на уровне 0,4 мл/мин, температуру колонки на уровне 35 °C и объем впрыска на уровне 5 μл. По возможности поддерживайте фиксированную температуру 10 °C внутри автосамплера.
- Установите следующие параметры IMS: значения подвижности (1/K0), от 0,1 до 1,5 В·с/см2; время нарастания, 100 мс; время точности, 10 мс; рабочий цикл, 10%; и скорость нарастания, 9,05 Гц.
- Установите следующие параметры источника ионов для детектирования МС: капиллярное напряжение, 2 500 В; давление в небулайзере, 2,5 бар; расход сухого газа, 8 л/мин; температура сухого газа, 200 °C; температура газов оболочки, 450 °С; расход газа оболочки, 4 л/мин. Для регистрации МС необходимо выбрать следующие параметры, принимая во внимание два события сканирования: полное сканирование всего масс-спектра с m/z от 20 до 1300 с последующим bbCID (широкополосная диссоциация, вызванная столкновением), при которой генерируются ионы продукта из любого предшественника с тремя фиксированными энергиями столкновения 24, 36 и 50 эВ. Выполнение ионизации и сбора данных в режиме положительной полярности.
- Сохраните этот файл метода получения для дальнейшего использования.
4. Получение данных из аналитических стандартов экспертов
ПРИМЕЧАНИЕ: Используйте нитриловые перчатки, лабораторный халат и защитные очки только для шага 4.1.
- Приготовьте два янтарных флакона объемом 1,5 мл с 500 мкл промежуточного раствора в концентрации 1000 нг/мл и еще один флакон со смесью растворителей А и В (1:1, v/v) в качестве моющего раствора.
- Откалибруйте прибор timsTOF в соответствии с указаниями производителя и выберите положительную полярность для получения данных IMS и MS.
- Поместите столбец C18 (см. Таблицу материалов) внутрь печи LC с температурой, установленной на 35 °C, как указано в файле метода получения, сохраненном на шаге 3.5.
ПРИМЕЧАНИЕ: Убедитесь, что оба конца хорошо затянуты; В противном случае будет наблюдаться утечка подвижной фазы. - Кондиционируйте колонку LC таким образом, чтобы обеспечить скорость потока подвижной фазы 0,1 мл/мин , и выберите соотношение смеси растворителей А и В 90:10 (%) в качестве исходного соотношения состава подвижной фазы.
- Подождите, пока давление в столбе не станет стабильным (~130 бар).
- Увеличьте расход подвижной фазы до 0,2 мл/мин, дождитесь стабилизации давления и снова увеличьте его до 0,3 мл/мин.
- Как только давление снова стабилизируется, установите расход на 0,4 мл, что будет рабочим расходом, как указано в файле метода сбора, сохраненном на шаге 3.5, и подождите, пока давление не стабилизируется около 350 бар.
ПРИМЕЧАНИЕ: Важно не увеличивать расход напрямую с 0,2 до 0,4 мл/мин. Сильное изменение потока провоцирует пики высокого давления, которые могут повредить хроматографическую колонку. - Пока колонка кондиционируется, напишите рабочий список, включающий два образца, соответствующие двум флаконам, содержащим промежуточный раствор EAs в концентрации 1000 нг/мл, как указано на шаге 4.1, и промывочный флакон. Проанализируйте промывочный флакон дважды, в начале и в конце партии образца.
- В столбце Файл метода рабочего списка загрузите файл метода получения, ранее сохраненный на шаге 3.5.
- Создайте папку для сохранения всех полученных файлов данных и маршрутизируйте все выборки, выбрав папку в столбце Путь к образцу .
ПРИМЕЧАНИЕ: Обязательно используйте одну и ту же папку для сохранения всех файлов, сгенерированных во время проверочного исследования, для дальнейшей обработки. Во время кондиционирования колонны значения, на которых стабилизируется давление, могут незначительно изменяться. Тем не менее, убедитесь, что давление стабильно, прежде чем снова увеличивать расход, чтобы сохранить целостность колонны. Кроме того, при достижении рабочего потока давление также должно быть стабильным для достижения воспроизводимой хроматографической сепарации. - Перейдите на верхнюю панель инструментов программного обеспечения и запустите рабочий список.
5. Обработка данных для создания метода количественной оценки
- После того, как рабочий список будет выполнен, откройте качественное программное обеспечение.
- Загрузите все проанализированные сэмплы, нажав Файл | Откройте рабочий список.
- Щелкните правой кнопкой мыши по образцу, соответствующему промежуточному раствору EAs с концентрацией 1 000 нг/мл, перейдите в раздел «Редактировать хроматограмму», затем выберите «Тип | Извлекаем ионную хроматограмму и вводим теоретическую молекулярную массу протонированного иона, относящегося к каждому ЭА. Затем нажмите « Добавить» и, наконец, OK. Поскольку набор аналитов состоит из шести ЭА и связанных с ними эпимеров, которые имеют одинаковую точную массу, появятся шесть выделенных ионных хроматограмм.
ПРИМЕЧАНИЕ: Параметр Ширина изменяет степень узкости окна m/z . Рекомендуется выбирать достаточно широкое m/z окно в случае затруднений с нахождением хроматографического пика исследуемого аналита. Тем не менее, рекомендуется устанавливать узкие m/z окна, чтобы избежать возможных помех (ниже 0,05 единиц). - На каждой выделенной ионной хроматограмме будут отображаться два хроматографических пика, относящихся к основному ЭА и его эпимеру. Щелкните правой кнопкой мыши при выделении всей площади одной вершины. Следовательно, спектр подвижности ионов появится прямо внизу.
- Перейдите к оси x спектра подвижности ионов, щелкните правой кнопкой мыши, а затем нажмите на Collision Cross Section. Запишите значение CCS.
ПРИМЕЧАНИЕ: Если значения CCS не отображаются автоматически, перейдите в раздел «Калибровка» на верхней панели инструментов, затем в раздел «Калькулятор мобильности» и вручную введите значение мобильности, чтобы получить соответствующие значения CCS. - Выберите область, соответствующую другому хроматографическому пику в пределах той же ионной хроматограммы, и повторите шаги 5.4. и 5.5.
- Аналогичным образом, паттерн фрагментации также появится после шага 5.4. Основываясь на характере фрагментации, описанном в литературе и базах данных, сравните и выберите наиболее интенсивный продукт в качестве дополнительной точки идентификации.
- Запишите время удержания, значение CCS и точную массу основного ионного аддукта (обычно протонированного иона) каждого советника, чтобы создать метод количественной оценки.
- Повторите шаги с 5.4 по 5.8. для остальных аналитов.
- Выделите все молекулярные массы, сгенерированные на шаге 5.3, щелкнув по ним, удерживая нажатой клавишу Ctrl. Затем щелкните правой кнопкой мыши и выберите «Копировать». Переходим к другому примеру, соответствующему промежуточному решению советников, кликаем по нему правой кнопкой мыши и выбираем Вставить. Ионные хроматограммы и спектры подвижности будут выделены автоматически.
- Перепроверьте идентификационные параметры для всех аналитов во втором образце.
6. Создание метода обработки данных для рутинного определения алкалоидов спорыньи
- Откройте программное обеспечение и перейдите на вкладку «Управление методами ».
- Нажмите на « Настройки аналита » и введите имя каждого советника, а также время хранения, значение CCS и массу протонированных аддуктов, собранных на шагах 5.4. к 5.9. При необходимости измените допуск каждой точки идентификации, хотя для применения этого протокола рекомендуется использовать настройки по умолчанию.
ПРИМЕЧАНИЕ: Чем выше установленные значения допуска, тем выше вероятность работы с ложными срабатываниями, так как допускается большее отклонение от теоретических значений. Аналогичным образом, слишком строгие значения допуска могут привести к ложноотрицательным результатам. Это происходит, когда отклонение от теоретического значения вызвано исключительно производительностью прибора. - Сохраните метод количественной оценки для дальнейшего использования.
7. Отбор проб
- Приобретайте образцы пшеницы и овса в супермаркетах, желательно в контейнерах по 1 кг, следуя рекомендациям по отбору проб, установленным Европейской комиссией20. Если упаковки по 1 кг недоступны, просто убедитесь, что у вас есть не менее 50 г образцов для завершения всего анализа.
- Измельчите образцы с помощью кофемолки. В этом исследовании для измельчения всего содержимого упаковок использовалась ножевая мельница, которая затем возвращалась в исходные упаковки для гомогенизации.
ПРИМЕЧАНИЕ: Тщательно очищайте кофемолку между образцами, чтобы избежать перекрестного загрязнения. Используйте лабораторный халат. - Поместите гомогенизированные образцы в центрифужные пробирки объемом 50 мл и храните их в прохладных и сухих условиях.
8. Подготовка образцов
- Подготовьте график проведения валидационного исследования в течение трех дней подряд (для оценки воспроизводимости собственными силами). Для каждого дня определяйте три уровня концентрации, укрепляя образцы на уровне 225 нг/г (1,5 мл), 150 нг/г (ML) и 75 нг/г (0,5 мл). Изучайте каждый уровень в трех экземплярах, представляя девять образцов с шипами плюс еще три пустых образца в день.
ПРИМЕЧАНИЕ: С учетом 3 дней валидации потребуется в общей сложности 36 образцов наряду с еще 8 пустыми образцами, предназначенными для подготовки калибровочной кривой, согласованной с матрицей. Используйте нитриловые перчатки, лабораторный халат и защитные очки для всего этого раздела протокола. - Взвесьте 1 г образца в центрифужную пробирку объемом 50 мл.
ПРИМЕЧАНИЕ: При проведении валидационного исследования укрепите образцы сразу после взвешивания 50 мкл соответствующего рабочего стандартного раствора, подробно описанного в шагах 1.3. и 1.5. - Добавьте 4 мл раствора для экстракции [ацетонитрил:5 мМ водного раствора карбоната аммония (85:15, v/v)]. Сделайте образец вихревым в течение 1 минуты.
- Центрифугируйте образец в течение 5 минут при 9 750 × г и 4 °C.
ПРИМЕЧАНИЕ: Производительность центрифуги может быть ограничивающим фактором в процедуре, поэтому рекомендуется одновременно извлекать только то количество образцов, которое поместится в центрифуге. - Перенесите всю надосадочную жидкость в центрифужную пробирку объемом 15 мл, содержащую 150 мг смеси очищающего сорбента (1:1, масса). Сделайте образец вихревым в течение 1 минуты.
- Центрифугируйте пробирку в течение 5 минут при 9 750 × г и 4 °C.
- Соберите надосадочную жидкость и поместите ее во флакон из янтарного стекла объемом 4 мл. Выпарить экстракт под слабой струей азота.
ПРИМЕЧАНИЕ: Образцы должны храниться в сухом состоянии при температуре -20 °C, если анализ не был проведен в тот же день. - Восстановите образец в 750 мкл смеси метанол:вода (1:1, v/v).
- Перелейте экстракт в шприц объемом 2 мл и отфильтруйте его через нейлоновый фильтр 0,22 мкм в янтарный хроматографический флакон объемом 1,5 мл.
- Соберите восстановленные экстракты из восьми пустых образцов, предназначенных для калибровочной кривой, согласованной с матрицей, в флакон из янтарного стекла объемом 12 мл (каждый образец ресуспендирован в 750 μл, что соответствует общему объему 6 мл).
- Пипетку 1 мл промежуточного раствора в концентрации 1000 нг/мл (83,33 нг/мл для каждого алкалоида спорыньи) (шаг 1.2) в флакон из янтарного стекла объемом 2 мл, высушить растворитель под слабой струей азота и повторно суспендировать в 1 мл предварительно собранного экстракта пустого образца.
ПРИМЕЧАНИЕ: Эта смесь в концентрации 1000 нг/мл (83,33 нг/мл для каждого ЭА) будет использоваться для подготовки калибровочной кривой, согласованной с матрицей. - Приготовьте десять флаконов из янтарного стекла объемом 2 мл и поместите в каждый из них 450 мкл пустого экстракта образца (шаг 8.10) и обозначьте их цифрами от 1 до 10. Каждый флакон будет точкой калибровочной кривой.
ПРИМЕЧАНИЕ: В этом протоколе использовалось 450 μL, так как это было наименьшее значение, которое устройство LC могло достичь внутри флакона без использования вкладышей. Если игла не проникает так глубоко во флакон, увеличьте объем и, следовательно, рассчитайте, сколько дополнительных пустых образцов необходимо извлечь, учитывая, что каждый из них ресуспендирован в 750 мкл смеси метанол:вода (1/1, v:v). - Постройте калибровочную кривую путем последовательного разведения. Перелейте 450 мкл смеси, приготовленной на шаге 8.11. во флакон 1, который уже содержит 450 мкл экстракта пустого образца, для достижения концентрации 41,67 нг/мл (самая высокая калибровочная точка). Перебейте флакон в течение 2 минут.
ПРИМЕЧАНИЕ: Объем смеси должен соответствовать объему экстракта пустого образца, который необходимо разбавлять два раза на каждом этапе. - Перелейте 450 мкл из флакона 1 во флакон 2, который уже содержит 450 мкл экстракта пустого образца, чтобы достичь концентрации 20,83 нг/мл (вторая по величине точка калибровки).
- Повторите шаг 8.14 (т.е. от флакона 2 к флакону 3 и т.д.) и продолжайте до тех пор, пока не будут получены десять калибровочных точек. Диапазон концентраций для каждого советника будет следующим: 41,67, 20,83, 10,42, 5,21, 2,60, 1,30, 0,65, 0,33, 0,16 и 0,08 нг/мл.
- Приготовьте стандартную смесь в концентрации 1 000 нг/мл (83,33 нг/мл для каждого EA), как описано в шаге 8.11, но используя 1 мл смеси метанол:вода (1:1, v/v).
- Подготовьте стандартную калибровочную кривую, как описано в шагах с 8.13 по 8.15, но с использованием 450 мкл смеси метанол:вода (1:1, v/v) для серийных разведений. Эта калибровочная кривая будет использоваться для оценки эффекта матрицы путем сравнения его с калибровочной кривой, согласованной с матрицей.
9. Обработка количественных данных
- Инициализируйте и запустите прибор, следуя инструкциям, описанным в шагах 4.1. к 4.11. На рисунке 2 показан рабочий список, используемый в этом протоколе.
ПРИМЕЧАНИЕ: При составлении рабочего списка для калибровочных кривых вводите их перед укрепленными образцами, начиная со стандартной калибровочной кривой от самой низкой до самой высокой концентрации, промывочной пробирки, содержащей метанол:вода (1:1, v/v), и калибровочной кривой, согласованной с матрицей, от самой низкой до самой высокой концентрации. - Откройте программное обеспечение для количественного анализа и перейдите на вкладку TASQ Quick | Импортируйте партию в левом нижнем углу.
- Выберите папку, созданную на шаге 4.10. содержащие все исходные данные (файлы, относящиеся к информации, полученной после анализа LC-IMS-MS для всех образцов, включенных в рабочий список).
- После импорта в программное обеспечение перейдите в раздел «Обработать пакет», прямо под «Импортировать пакет».
- Выберите образцы для обработки (т. е. 27 образцов с шипами, 9 заготовок и обе калибровочные кривые) и метод обработки данных, ранее созданный на шагах 6.1. к 6.3. Появится окно с различными параметрами, которые нужно задать (например, тип интегратора для оценки хроматографических пиков или тип аналитического сигнала, который следует учитывать, среди прочего). Измените эти параметры по мере необходимости, хотя значения по умолчанию подходят для выполнения этого протокола.
- После завершения обработки данных перейдите в раздел Просмотр скрининга и проверьте, нет ли проблем, связанных с автоматической интеграцией, таких как выбор неправильных хроматографических пиков, которые могут находиться слишком близко друг к другу. Если это так, сузьте значения, относящиеся к допуску по времени хранения, допуску значений CCS и/или массовой ошибке, первоначально установленной в файле количественного метода, и повторно обработайте данные. Если автоматическое интегрирование пиков по-прежнему выделяет неверные пики, то вручную интегрируйте пик, выделив область на хроматограмме, которая появится в окне просмотра скрининга (для этого учитывайте аналитические параметры, полученные для стандартов EA в разделе 5).
ПРИМЕЧАНИЕ: Очень важно рассмотреть каждый образец, так как некоторые основные пары EA-эпимер имеют очень похожее время удержания и могут быть неправильно идентифицированы программным обеспечением. - Когда все пики будут успешно интегрированы для всех образцов, перейдите на вкладку «Управление партиями » в верхнем левом углу и укажите тип образца, связанного с каждым анализом: растворитель, заготовка, контроль качества, образец или точка калибровки. В последнем случае назначьте каждой точке калибровки уровень с номером.
- На той же вкладке Управление партиями перейдите в нижнее окно под названием Концентрация партии и укажите значение концентрации для каждого уровня, установленного на предыдущем шаге. Как только это будет сделано, нажмите « Сохранить концентрации».
- Нажмите « Количественная партия » и измените параметры по своему усмотрению (т. е. модель в соответствии с данными калибровки, взвешивание, принудительно ли модель пересекает ноль и т. д.). Значения по умолчанию подходят для выполнения этого протокола, за исключением взвешивания калибровочных кривых, которое было изменено на 1/x.
ПРИМЕЧАНИЕ: Поскольку программное обеспечение может рассматривать только одну калибровочную кривую за раз, необходимо повторить шаг 9.9 дважды, чтобы получить информацию о стандартных и матрично-согласованных калибровочных кривых. В этом протоколе для количественного определения аналитов использовались калибровочные кривые, согласованные с матрицей, поэтому сначала оценивались калибровочные кривые растворителя, извлекались калибровочные данные, как описано далее на шаге 9.13, и, наконец, для количественного определения образцов выбирались калибровочные кривые, согласованные с матрицей. - После того, как количественное определение алкалоидов спорыньи было выполнено в соответствии с файлом метода количественной оценки, нажмите на вкладку «Количественная оценка » в верхней части экрана.
- Если параметры по умолчанию, установленные на шаге 9.9, не обеспечивают хорошей линейности и точности, отрегулируйте калибровочные кривые, изменив подгонку и вес, щелкнув правой кнопкой мыши по графику, чтобы получить хорошую линейную модель (R2 > 0,99) с достаточной точностью на каждом уровне калибровки (отклонение менее 20%).
ПРИМЕЧАНИЕ: Программное обеспечение пометит красным цветом ячейки из тех калибровочных уровней, которые не обеспечивают должной точности. - После завершения щелкните правой кнопкой мыши папку пакета в левом углу экрана и выберите «Создать отчет». Затем выберите «Количественное определение аналитики », чтобы экспортировать отчет в нужный формат.
Результаты
Во-первых, в прибор LC-IMS-MS были введены рабочие стандартные растворы для получения всех идентификационных признаков (т.е. времени удержания, CCS и масс-спектров) каждого анализируемого здесь эксперта. Поскольку параметры идентификации, за исключением точной массы, изнач...
Обсуждение
Успешное использование этого протокола основано на оптимизации процедуры экстракции, ранее проведенной Carbonell-Rozas et al.17, которые реализовали использование растворителя для экстракции, достаточно эффективного для извлечения EA из сложных пищевых матриц, т?...
Раскрытие информации
У авторов нет конфликта интересов, который можно было бы раскрыть.
Благодарности
Это исследование было профинансировано Consejería de Universidad, Investigación e Innovación - Junta de Andalucía (PROYEXCEL_00195) и грантом на постдокторскую степень, предоставленным Женералитатом Валенсианы и Европейским социальным фондом+ (CIAPOS/2022/049). Авторы благодарят "Centro de Instrumentación Científica (CIC)" при Университете Гранады за предоставление доступа к аналитическим инструментам, используемым в этом протоколе.
Материалы
| Name | Company | Catalog Number | Comments |
| Acetonitrile | VWR | 83640.32 | |
| Amber glass tubes 4 mL | VWR | 548-0052 | |
| Amber glass tubes 12 mL | VWR | 548-0903 | |
| Amber vials 1.5 mL | Agilent | 5190-9063 | |
| Ammonium carbonate | Fluka | 9716 | |
| Analytical balance BAS 31 | Boeco | 4400519 | |
| Balance CP 323 S | Sartorius | 23-84182 | |
| C18 | Supelco | 52604-U | |
| Centrifuge tubes, 15 mL | VWR | 525-1082 | |
| Centrifuge tubes, 50 mL | VWR | 525-0155 | |
| Centrifuge Universal 320 R | Hettich | 1406 | |
| Compass HyStar | Bruker | Acquisition software | |
| DataAnalysis | Bruker | Qualitative software | |
| Elute PLUS UHPLC | Bruker | ||
| EVA EC-S evaporator | VLM | V830.012.12 | |
| Formic acid GR for analysis ACS, Reag. Ph Eur | Merck | 100264 | |
| Grinder TitanMill300 | Cecotec | 1559 | |
| Methanol | VWR | 83638.32 | |
| Milli-Q water purification system (18.2 MΩ cm) | Millipore | ZD5211584 | |
| Pipette tips 1- 5 mL | Labortecnic | 162005 | |
| Pipette tips 100 - 1000 µL | Labortecnic | 1622222 | |
| Pipette tips 5 - 200 µL | Labortecnic | 162001 | |
| Pippette Transferpette S variable, DE-M 10 - 100 µL | BRAND | 704774 | |
| Pippette Transferpette S variable, DE-M 100 - 1000 µL | BRAND | 704780 | |
| Pippette Transferpette S variable, DE-M 500 - 5000 µL | BRAND | 704782 | |
| Syringe 2 mL | VWR | 613-2003 | |
| Syringe Filter 13 mm, 0.22µm | Phenomenex | AF-8-7707-12 | |
| TASQ | Bruker | Quantitative software | |
| timsTOFPro2 IM-HRMS | Bruker | ||
| Vortex Genie 2 | Scientific Industries | 15547335 | |
| Zorbax Eclipse Plus RRHD C18 column (50 x 2.1 mm, 1.8 µm particle size) | Agilent | 959757-902 | |
| Z-Sep+ | Supelco | 55299-U | Zirconia-based sorbent |
| Ergot alkaloids | CAS registry sorbent | ||
| Ergocornine (Eco) | Techno Spec | E178 | 564-36-3 |
| Ergocorninine (Econ) | Techno Spec | E130 | 564-37-4 |
| Ergocristine (Ecr) | Techno Spec | E180 | 511-08-0 |
| Ergocristinine (Ecrn) | Techno Spec | E188 | 511-07-9 |
| Ergokryptine (Ekr) | Techno Spec | E198 | 511-09-1 |
| Ergopkryptinine (Ekrn) | Techno Spec | E190 | 511-10-4 |
| Ergometrine (Em) | Romer Labs | "002067" | 60-79-7 |
| Ergometrinine (Emn) | Romer Labs | LMY-090-5ML | 479-00-5 |
| Ergosine (Es) | Techno Spec | E184 | 561-94-4 |
| Ergosinine (Esn) | Techno Spec | E194 | 596-88-3 |
| Ergotamine (Et) | Romer Labs | "002069" | 113-15-5 |
| Ergotaminine (Etn) | Romer Labs | "002075" | 639-81-6 |
Ссылки
- Kanu, A. B., Dwivedi, P., Tam, M., Matz, L., Hill, H. H. Ion mobility-mass spectrometry. J Mass Spectrom. 43 (1), 1-22 (2008).
- Gabelica, V., et al. Recommendations for reporting ion mobility Mass spectrometry measurements. Mass Spectrom Rev. 38 (3), 291-320 (2019).
- Feuerstein, M. L., et al. Comparability of steroid collision cross sections using three different IM-HRMS technologies: An interplatform study. J Am Soc Mass Spectrom. 33 (10), 1951-1959 (2022).
- Regueiro, J., Negreira, N., Berntssen, M. H. G. Ion-mobility-derived collision cross section as an additional identification point for multiresidue screening of pesticides in fish feed. Anal Chem. 88 (22), 11169-11177 (2016).
- Regueiro, J., Negreira, N., Hannisdal, R., Berntssen, M. H. G. Targeted approach for qualitative screening of pesticides in salmon feed by liquid chromatography coupled to traveling-wave ion mobility/quadrupole time-of-flight mass spectrometry. Food Control. 78, 116-125 (2017).
- Hernández-Mesa, M., Monteau, F., Le Bizec, B., Dervilly-Pinel, G. Potential of ion mobility-mass spectrometry for both targeted and non-targeted analysis of phase II steroid metabolites in urine. Anal Chim Acta: X. 1, 100006 (2019).
- George, A. C., et al. Interplatform comparison between three ion mobility techniques for human plasma lipid collision cross sections. Anal Chim Acta. 1304, 342535 (2024).
- Mairinger, T., Causon, T. J., Hann, S. The potential of ion mobility-mass spectrometry for non-targeted metabolomics. Curr Opin Chem Biol. 42, 9-15 (2018).
- Hernández-Mesa, M., Escourrou, A., Monteau, F., Le Bizec, B., Dervilly-Pinel, G. Current applications and perspectives of ion mobility spectrometry to answer chemical food safety issues. TrAC Trend Anal Chem. 94, 39-53 (2017).
- European, C. Commission Regulation (EU) 2023/915 of 25 April 2023 on maximum levels for certain contaminants in food and repealing Regulation (EC) No 1881/2006. Off J Eur Union. 119, 103-157 (2023).
- Carbonell-Rozas, L., et al. Occurrence of egot alkaloids in major and minor cereals from Northern Italy: A three harvesting years scenario. J Agricl Food Chem. 71 (42), 15821-15828 (2023).
- Arroyo-Manzanares, N., Gámiz-Gracia, L., García-Campaña, A. M., Diana Di Mavungu, J., De Saeger, S., Jean-Michel Mérillon, J. -. M., Ramawat, K. G. . Fungal Metabolites. , (2016).
- van Dongen, P., de Groot, A. History of ergot alkaloids from ergotism to ergometrine. Eur J Obstet Gynecol Reprod Biol. 60 (2), 109-116 (1995).
- European Food Safety Authority. Human and animal dietary exposure to ergot alkaloids. EFSA J. 15 (7), e04902 (2017).
- Nam, M., Kim, D., Kim, M. -. S. Simultaneous determination of total ergot alkaloids in wheat flour by Orbitrap mass spectrometry. Food Chem. 441, 138363 (2024).
- García-Juan, A., León, N., Armenta, S., Pardo, O. Development and validation of an analytical method for the simultaneous determination of 12 ergot, 2 tropane, and 28 pyrrolizidine alkaloids in cereal-based food by LC-MS/MS. Food Res Int. 174 (Pt 1), 113614 (2023).
- Carbonell-Rozas, L., Mahdjoubi, C. K., Arroyo-Manzanares, N., García-Campaña, A. M., Gámiz-Gracia, L. Occurrence of ergot alkaloids in barley and wheat from Algeria. Toxins. 13 (5), 316 (2021).
- Carbonell-Rozas, L., Gámiz-Gracia, L., Lara, F. J., García-Campaña, A. M. Determination of the main ergot alkaloids and their epimers in oat-based functional foods by ultra-high performance liquid chromatography tandem mass spectrometry. Molecules. 26 (12), 3717 (2021).
- Carbonell-Rozas, L., et al. Ion mobility-mass spectrometry to extend analytical performance in the determination of ergot alkaloids in cereal samples. J Chromatogr A. 1682, 463502 (2022).
- European Commission. Commission Implementing Regulation (EU) 2023/2782 of 14 December 2023 laying down the methods of sampling and analysis for the control of the levels of mycotoxins in food and repealing Regulation (EC) No 401/2006. Off J Eur Union. , (2023).
- Carbonell-Rozas, L., Vander Cruyssen, L., Dall'Asta, C., Leggieri, M. C., Battilani, P. Fit-for-purpose method development to determine co-occurring multiclass mycotoxins in apple and apple puree samples. Food Anal Methods. 16 (8), 1403-1412 (2023).
- Laouni, C., et al. Emerging mycotoxin occurrence in chicken feed and eggs from Algeria. Mycotoxin Res. 40, 447-456 (2024).
- Ben Hassouna, K., et al. Mycotoxin occurrence in milk and durum wheat samples from Tunisia using dispersive liquid-liquid microextraction and liquid chromatography with fluorescence detection. Toxins. 15 (11), 633 (2023).
- Narváez, A., et al. Occurrence and exposure assessment of mycotoxins in ready-to-eat tree nut products through ultra-high performance liquid chromatography coupled with high resolution Q-orbitrap mass spectrometry. Metabolites. 10 (9), 344 (2020).
- Arroyo-Manzanares, N., Rodríguez-Estévez, V., García-Campaña, A. M., Castellón-Rendón, E., Gámiz-Gracia, L. Determination of principal ergot alkaloids in swine feeding. J Sci Food Agric. 101 (12), 5214-5224 (2021).
- Pereira, V. L., Fernandes, J. O., Cunha, S. C. Comparative assessment of three cleanup procedures after QuEChERS extraction for determination of trichothecenes (type A and type B) in processed cereal-based baby foods by GC-MS. Food Chem. 182, 143-149 (2015).
- Tuzimski, T., Szubartowski, S. Method development for selected bisphenols analysis in sweetened condensed milk from a can and breast milk samples by HPLC-DAD and HPLC-QqQ-MS: Comparison of sorbents (Z-SEP, Z-SEP Plus, PSA, C18, chitin and EMR-lipid) for clean-up of QuEChERS extract. Molecules. 24 (11), 2093 (2019).
- Łozowicka, B., Rutkowska, E., Jankowska, M. Influence of QuEChERS modifications on recovery and matrix effect during the multi-residue pesticide analysis in soil by GC/MS/MS and GC/ECD/NPD. Environ Sci Pollut Res. 24 (8), 7124-7138 (2017).
- Schummer, C., Xandonella, I., van Nieuwenhuyse, A., Moris, G. Epimerization of ergot alkaloids in feed. Heliyon. 6 (6), e04336 (2020).
- Cherewyk, J. E., Grusie-Ogilvie, T. J., Parker, S. E., Blakley, B. R., Al-Dissi, A. M. The impact of storage temperature and time on ergot alkaloid concentrations. Toxins. 15 (8), 497 (2023).
- Silva, &. #. 1. 9. 4. ;., Mateus, A. R., Barros, S. C., Silva, A. S. Ergot alkaloids on cereals and seeds: Analytical methods, occurrence, and future perspectives. Molecules. 28 (20), 7233 (2023).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены