需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
通过液相色谱-捕获离子迁移谱-飞行时间质谱法检测食品基质中受管制的麦角生物碱
摘要
该方案提出了一种经过验证的液相色谱-离子淌度-高分辨率质谱方法,以根据最近发布的委员会法规 (EU) 2023/915 确定食品中麦角生物碱的存在。
摘要
离子淌度质谱 (IMS) 集成到液相色谱-质谱 (LC-MS) 工作流程中时,可作为额外的分离维度。与传统的 LC-MS 方法相比,LC-IMS-MS 方法具有更高的峰分离度,增强了同量异位和异构体化合物的分离,并提高了信噪比 (S/N)。IMS 为分析物的鉴定提供了另一个分子特性,即碰撞截面 (CCS) 参数,可减少假阳性结果。因此,LC-IMS-MS 方法解决了食品安全领域的重要分析挑战(即检测复杂食品基质中痕量水平的化合物以及明确鉴定同分异位和异构体分子)。
麦角生物碱 (EAs) 是由真菌产生的霉菌毒素家族,可攻击多种草种,包括黑麦、黑小麦、小麦、大麦、小米和燕麦等小谷物。这些霉菌毒素的最大含量 (ML) 已在多种食品中确定,如欧盟委员会法规 EC/2023/915 中所述。这项新法规包括六种主要的 EA 及其相应的差向异构体,因此需要一种有效的方法来正确区分这些异构体分子,考虑到它们的共现。
因此,本方案的目标是展示将 IMS 集成到 LC-MS 工作流程中如何有助于分离异构体 EA,从而提高分析方法的选择性。此外,它还说明了通过分析标准品表征生成 CCS 谱库如何为霉菌毒素的鉴定提供更高的可信度。该协议旨在清楚地解释在食品安全中实施 IMS 的好处,以谷物中 EA 的测定为例。基于 QuEChERS 的萃取,然后进行液相色谱捕获离子淌度质谱 (TIMS)-MS 分析,在 1.5 倍、1 倍和 0.5 倍 ML 下,定量限范围为 0.65 至 2.6 ng/g,准确度可接受(尽管麦角胺的回收率较低),并且表现出可忽略不计的基质效应。
引言
离子淌度质谱 (IMS) 正在成为一种越来越常用的分析技术,通常作为集成到传统液/气相色谱 (LC/GC) 与 MS 工作流程联用的附加分离维度。IMS 包括在电场和大气压1 下沿充满缓冲气体的迁移池分离分子。根据质荷比 (m/z) 和几何构象,电离分子在穿过淌度池时将与缓冲气体相互作用,这反映在离子淌度 (K) 参数2 中,并通过以下公式计算:
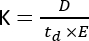
其中 D 表示总漂移长度, td 是 总漂移时间, E 是 电场。因此,K 以 m2 V-1 s-1 为单位进行测量,尽管出于实际原因,它通常表示为 cm2 V-1 s-1。通过漂移时间可以测量在淌度池中移动的内在能力,然后转换为所谓的碰撞截面 (CCS) 值,这是每个分子的高度可重现参数,独立于 IMS 仪器3。CCS 可以按照以下公式从迁移率中得出:
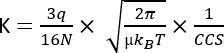
q 是离子的电荷; N 缓冲气体数密度; μ 碰撞伙伴缓冲气体离子的质量减少; kB 玻尔兹曼常数; T 为缓冲气体温度。因此,IMS 提供了对色谱和 MS 分析产生的分析数据的补充信息。
研究表明,在 LC-MS 平台中实施 IMS 可以提高分析测定的可靠性,尤其是在处理痕量浓度的化合物时。多项研究报道,LC-IMS-MS 方法通过降低背景噪音来提高质谱质量,背景噪音最终会影响方法的灵敏度,并降低多残留 LC-MS 方法提供的假阳性和假阴性率 4,5,6。此外,CCS 值的重现性不仅可以在使用相同技术的不同仪器之间进行比较,还可以比较不同的离子淌度技术,即行波离子淌度质谱 (TWIMS)、囚禁离子淌度质谱 (TIMS) 和漂移管离子淌度质谱 (DTIMS)2,7,它们是最常用的系统1.因此,CCS 作为识别参数的潜力的一个显著结果在于构建 CCS 库的可能性,这反映在其在代谢组学研究中的适用性8。尽管如此,IMS 最强大的功能之一是能够分离 LC-MS 方法可能无法充分分离的异构体和同量异位化合物。在复杂基质中处理大量目标分析物时,可能会出现这种情况,这是环境和食品分析中的常见情况。在此背景下,有人提出了 LC-IMS-MS 方法用于监测食品中的农药,并在较小程度上监测食品中的兽药和霉菌毒素9。
由于其高分离能力和选择性,LC/GC-IMS-MS 平台成为解决当前食品安全挑战(尤其是与异构体混合物相关的挑战)的最有用工具。与作为食品污染物的异构体混合物相关的健康问题已反映在现行的欧洲立法中,例如,该立法限制了几种食品中六种主要麦角生物碱 (EA) 及其相应的六种差向异构体的最大浓度10。
EAs 构成了由多种真菌产生的有毒次生代谢产物家族,主要是 Clavicipitaceae 科(例如, Claviceps purpurea, 由于其广泛的宿主范围,是最重要的 EA 生产者),但也包括 毛滴虫科,它可以在开花时寄生在活植物(如黑麦、大麦、小麦和燕麦)的种子头上11,12.在特定条件下,尤其是温度和水活度, Claviceps 真菌可以产生 EA,这些 EA 积累在寄主作物的子实体中,称为 菌核 或麦角。在一定程度上,EA 可以承受原材料的加工直到达到最终产品;因此,闯入食物链。摄入受污染的食物会导致 EA 中毒,称为麦角症,表现为急性症状,如腹痛、呕吐、皮肤灼热感、失眠和幻觉13。为了减少 EA 对人类健康的影响,欧盟委员会为几种食物中的主要 EA 的总和设定了最高水平 (ML): R-差向异向异构体麦角新碱 (Em)、麦角胺 (Et)、麦角新碱 (Es)、麦角新碱 (Ecr)、麦角黄素 (Ekr) 和麦角黄素 (Eco) 及其相应的 S-差向异构体:麦角新三醇 (Emn)、麦角氨酸 (Esn)、麦角胺 (Etn)、麦角角碱 (Econ)、麦角氪碱 (Ekrn)、 和麦角新碱 (Ecrn)。这些化合物可以从 R 形式变为 S 形式, 反之亦然,尤其是在强光照射、长时间储存或与某些高 pH 值或低 pH 值 12 的溶剂接触的情况下。尽管 R 和 S 形式的比例在不同条件下可能有所不同,但 EFSA CONTAM 小组在审查了有关食品中 EA 的现有文献后报告称, R 形式的出现率高于 S 形式14。因此,ML 取决于几个因素,例如作物的敏感性、加工程度或消费频率。在欧盟框架中,大麦、小麦、斯佩尔特小麦和燕麦碾磨产品的 ML 设定为 50 或 150 μg/kg(分别取决于灰分含量低于或高于 900 mg/100 g),而直接供人类食用的谷物的 ML 为 150 μg/kg,谷物基婴儿食品除外, 其中 ML 降至 20 μg/kg10。
这项严格的法规要求分析方法足够灵敏,以确定痕量浓度 (μg/kg) 水平,同时正确识别受管制的 EA 及其相应的差向异构体,因为 R 和 S-异构体这两种形式都可以在受污染的样品中同时找到。这项任务是一项重大挑战,因为每个毒素-差向异构体对具有相同的精确质量和碎裂模式。此外,两种化合物之间的适当色谱分离可能很复杂。因此,需要经过充分优化的液相色谱梯度,以避免在食品样品中同时出现 EA 差向异构体时出现错误定量。尽管有多项研究报道了 LC-MS 方法可以明确测定 EA15、16、17、18,但必须对色谱方法进行广泛研究,以实现色谱峰的充分分离,从而明确鉴定 EA。然而,这对于同时测定属于不同化学家族的污染物的多类方法来说通常不可行。在此背景下,Carbonell-Rozas、Hernández-Mesa 等人19 最近进行的一项研究报告了一种用于定量小麦和大麦样品中 EA 的 LC-IMS-MS 方法,该方法使用两种不同的 TWIMS 仪器,可提供可重现的 CCS 值和定量低限 (LOQ),以根据现行法规检测任何不合规情况。因此,本方案的目标是展示将 IMS 集成到 LC-MS 工作流程中如何有助于分离异构体 EA,从而提高分析方法的选择性。此外,它还说明了通过分析标准品表征生成 CCS 谱库如何为霉菌毒素鉴定提供更高的可信度。该协议旨在清楚地解释在食品安全分析中实施 IMS 的好处,例如谷物中 EA 的测定。该方案解决了基于 QuEChERS 程序的样品处理、通过 LC-TIMS-MS 进行的样品分析以及 IMS 数据提取和解释的问题。
研究方案
1. 储备液、中间液和工作标准液的制备
注意:使用丁腈手套、实验室外套和安全眼镜。
- 使用乙腈在 4 mL 琥珀色玻璃样品瓶中制备 12 种 EA 的单独储备液,浓度为 10,000 ng/mL(参见 材料表)。 R 型 (-ine) 以前以 25,000 ng 份量分装,而 S 型 (-inine) 以 10,000 ng 份量分配。本研究从这些等分试样开始,分别在 2.5 mL 和 1 mL 乙腈中稀释 R 和 S 型,然后涡旋 2 min,达到 10,000 ng/mL 的浓度。
- 在 12 mL 琥珀色玻璃样品瓶中加入 65 μL 每种生物碱溶液和 7.02 mL 乙腈,制备 1,000 ng/mL 总 EA(每种 83.33 ng/mL)的中间储备液。
注:制备中间储备溶液后,必须将单个储备溶液干燥并储存在 -20 °C 下,并用铝箔覆盖以避免差向异构化。 - 在 4 mL 琥珀色玻璃管中移液 2.7、1.8 和 0.9 mL,从中间储备液制备工作标准溶液。在温和的氮气流下将它们干燥,然后重悬于 600 μL 乙腈中。
注:向 1 g 样品中加入 50 μL 时,所得浓度达到 mL (150 ng/g) 的 1.5、1 和 0.5 倍。这些被选为验证研究的浓度水平(即回收率、重现性等)。 - 用 200 μL 移液器将每种工作标准溶液的 600 μL 分装在三个 2 mL 琥珀色玻璃样品瓶中,然后干燥。
注意:步骤 1.2 到 1.4 在 图 1 中进行了示意性说明。通过分样和干燥工作标准溶液,可以根据验证研究的要求,在三个不同的日期一式三份进行强化,而不会失去 EA 的化学完整性。 - 在每个验证日,将每个强化水平的 2 mL 琥珀色玻璃样品瓶重悬于 200 μL 乙腈中。
注意:每个强化水平将一式三份进行评估,每个样品 50 μL;因此,总共将使用 150 μL 的溶液。
2. 试剂和溶液的制备
注意:使用丁腈手套、实验室外套和安全眼镜。
- 称取 24.02 mg 碳酸铵并将其溶解在 50 mL 水中,制备 5 mM 碳酸铵溶液。称取 24.02 mg 碳酸铵放入烧杯中,加入约 5 mL 水。通过手动轻轻搅拌溶液来溶解碳酸铵,然后将其转移到 50 mL 容量瓶中。要达到 50 mL 的最终体积,请用额外的水冲洗烧杯,然后将上升液转移到容量瓶中。
- 将 212.5 mL 乙腈和 37.5 mL 步骤 2.1 中制备的铵溶液混合,制备 250 mL 萃取溶液 [乙腈:5 mM 碳酸铵 (85:15, v/v)]。
- 准备 100 mL 甲醇:水混合物 (1:1, v/v) 以重悬样品提取物(步骤 8.8)。
- 对于每个样品,称取 150 mg 分散固相材料 C18:氧化锆基吸附剂混合物(1: 1,w/w)放入 15 mL 离心管中,用于分散净化阶段(步骤 8.5)。
- 在两个不同的瓶子中制备用于色谱分离的溶剂,即 1 L 超纯水(溶剂 A)和甲醇(溶剂 B),均含有 0.3% (v/v) 甲酸。为了达到该浓度,向瓶子中加入 3.03 mL 甲酸(纯度 99%)。
注:应在运行 LC-IMS-MS 分析之前制备流动相溶剂。
3. 设置仪器参数
注:用于执行本 LC-IMS-MS 研究的仪器是与 IM-HRMS 联用的 UHPLC,配备真空绝缘探针加热电喷雾电离 (VIP-HESI) 源。仪器在正离子模式下运行。
- 使用采集软件设置以下洗脱梯度,创建用于分离分析物的色谱方法:0 min,10% B;2 分钟,10% B;4.5 分钟,40% B;9 分钟,维生素 B的 45%;11 分钟,95% B;12 分钟,95% B;13 分钟,10% B;16 分钟,10% B。
- 将流动相流速设置为 0.4 mL/min,将柱温设置为 35 °C,将进样体积设置为 5 μL。如果可能,请在自动进样器内保持 10 °C 的固定温度。
- 按如下方式设置 IMS 参数:迁移率值 (1/K0),从 0.1 到 1.5 V·s/cm2;斜坡时间,100 毫秒;精度时间,10 毫秒;占空比,10%;和斜坡速率,9.05 Hz。
- 将 MS 检测的离子源参数设置如下:毛细管电压,2,500 V;雾化器压力,2.5 bar;干燥气体流速,8 L/min;干燥气体温度,200°C;护套气体温度,450 °C;鞘气流速,4 L/min。对于 MS 采集,选择以下参数,同时考虑两个扫描事件:使用 m/z 从 20 到 1,300 对整个质谱进行全扫描,然后进行 bbCID(宽带碰撞诱导解离),以 24、36 和 50 eV 的三种固定碰撞能量从任何母离子产生子离子。在正极性模式下执行电离和数据采集。
- 保存此采集方法文件以供进一步使用。
4. 从 EA 分析标准中获取数据
注意:仅在步骤 4.1 中使用丁腈手套、实验室外套和安全眼镜。
- 制备两个 1.5 mL 琥珀色样品瓶,其中含有 500 μL 1,000 ng/mL 的中间溶液,另一个样品瓶含有溶剂 A 和 B 混合物(1: 1,v/v)作为洗涤液。
- 按照制造商的说明校准 timsTOF 仪器,并为 IMS 和 MS 采集选择正极性。
- 将 C18 色谱柱(参见 材料表)放入 LC 柱温箱中,温度设置为 35 °C,如步骤 3.5 中保存的采集方法文件中所示。
注意: 确保两端拧紧;否则,将观察到流动相泄漏。 - 对液相色谱柱进行活化,使流动相流速为 0.1 mL/min ,并选择溶剂 A 和 B 混合比 90:10 (%) 作为初始流动相组成比。
- 等待柱压稳定 (~130 bar)。
- 将流动相流速提高至 0.2 mL/min,等待压力稳定后,再次增加至 0.3 mL/min。
- 压力再次稳定后,将流速设置为 0.4 mL,这将是步骤 3.5 中保存的采集方法文件中详述的工作流速,然后等待压力稳定在 350 bar 左右。
注:重要的是不要直接将流速从 0.2 mL/min 增加到 0.4 mL/min。流速的强烈变化会引发高压峰,这可能会损坏色谱柱。 - 在对色谱柱进行活化时,写下工作列表,包括对应于两个样品瓶的两个样品瓶,其中含有 1,000 ng/mL 的 EAs 中间溶液,如步骤 4.1 所示,以及洗涤样品瓶。在样品批次的开始和结束时分析洗涤瓶两次。
- 在工作列表的 Method file (方法文件 ) 列中,加载之前在步骤 3.5 中保存的采集方法文件。
- 通过在 Sample path(样品路径 )列中选择文件夹,创建一个文件夹以保存所有采集的数据文件并路由所有样品。
注意:请务必使用同一文件夹保存验证研究期间生成的所有文件,以便进一步处理。在色谱柱调节期间,压力稳定值可能略有不同。尽管如此,在再次增加流速之前,请确保压力稳定,以保持色谱柱的完整性。此外,当达到工作流速时,压力也必须稳定,以实现可重现的色谱分离。 - 转到软件的上方工具栏并运行工作列表。
5. 用于创建定量方法的数据处理
- 执行工作列表后,打开定性软件。
- 通过单击 File (文件) |打开工作列表。
- 右键单击与 1,000 ng/mL 的 EAs 中间溶液相对应的样品,转到 Edit chromatogram(编辑色谱图),然后选择 Type(类型)|提取离子色谱图,并输入与每个 EA 相关的质子化离子的理论分子量。然后,单击 Add,最后单击 OK。由于分析物组由具有相同精确质量的 6 个 EA 及其相关差向异构体形成,因此将出现 6 张提取的离子色谱图。
注意: Width 参数可更改 m/z 窗口的窄度。建议选择足够宽的 m/z 窗口,以防难以找到目标分析物的色谱峰。但是,建议设置较窄的 m/z 窗口以避免可能的干扰(低于 0.05 个单位)。 - 在每个提取的离子色谱图中,将出现与主 EA 及其差向异构体相关的两个色谱峰。右键单击,同时选择一个峰的整个区域。因此,离子淌度谱图将弹出正下方。
- 转到离子淌度谱图的 x 轴,右键单击,然后单击 Collision Cross Section(碰撞横截面)。记下 CCS 值。
注意:如果 CCS 值未自动显示,请转到上方工具栏中的 Calibrate ,然后转到 Mobility calculator,然后手动键入迁移率值以获取相应的 CCS。 - 选择与同一离子色谱图中另一个色谱峰对应的区域,然后重复步骤 5.4。和 5.5.
- 同样,碎片模式也将在步骤 5.4 之后出现。根据文献和数据库中报道的碎裂模式,比较并选择最强的子离子作为互补鉴定点。
- 记下每个 EA 的主离子加合物(通常是质子化离子)的保留时间、CCS 值和精确质量数,以创建定量方法。
- 重复步骤 5.4 到 5.8。对于剩余的分析物。
- 通过在按住 Ctrl 键的同时单击它们来选择步骤 5.3 中生成的所有分子量。然后,右键单击并选择 Copy (复制)。转到与 EA 中间解决方案对应的另一个示例,右键单击它并选择 Paste。离子色谱图和迁移谱图将自动提取。
- 仔细检查第二个样品中所有分析物的鉴定参数。
6. 创建用于麦角生物碱常规测定的数据处理方法
- 打开软件,然后单击 Method Management(方法管理 )选项卡。
- 单击 分析物设置 ,然后输入每个 EA 的名称及其保留时间、CCS 值和步骤 5.4 中收集的质子化加合物的质量。更改为 5.9。根据需要更改每个标识点的容差,但建议对此协议的应用使用默认设置。
注意:设置的容差值越高,处理误报的可能性就越高,因为接受的与理论值的偏差更大。同样,过于严格的容差值可能会导致假阴性。当与理论值的偏差完全由仪器的性能引起时,就会发生这种情况。 - 保存定量方法以供进一步使用。
7. 采样
- 按照欧盟委员会20 制定的采样指南,在超市获取小麦和燕麦样品,最好使用 1 公斤容器。如果没有 1 kg 的包装,只需确保至少有 50 g 的样品来完成整个分析。
- 使用研磨机研磨样品。在这项研究中,使用刀片研磨机研磨包装的全部内容物,然后将其返回其原始包装进行均质化。
注:在样品之间彻底清洁研磨机,以避免交叉污染。使用实验室外套。 - 将匀浆样品分装在 50 mL 离心管中,并储存在阴凉干燥的条件下。
8. 样品制备
- 准备一个计划,进行为期三天的验证研究(以评估内部重现性)。每天,通过以 225 ng/g (1.5 mL)、150 ng/g (ML) 和 75 ng/g (0.5 mL) 强化样品来测定三个浓度水平。研究每个水平一式三份,代表每天 9 个加标样品和另外 3 个空白样品。
注:考虑到 3 个验证日,总共需要 36 个样品以及另外 8 个空白样品,用于制备基质匹配的校准曲线。在方案的整个部分使用丁腈手套、实验室外套和安全眼镜。 - 称取 1 g 样品放入 50 mL 离心管中。
注:进行验证研究时,在称量 50 μL 相应工作标准溶液后,立即强化样品,如步骤 1.3 中所述。和 1.5. - 加入 4 mL 提取溶液 [乙腈:5 mM 碳酸铵水溶液 (85:15, v/v)]。涡旋样品 1 分钟。
- 将样品在 9,750 × g 和 4 °C 下离心 5 分钟。
注:离心机的容量可能是程序中的一个限制因素,因此建议同时仅提取适合离心机的确切样品数量。 - 将整个上清液转移到含有 150 mg 净化吸附剂(1: 1,w/w)混合物的 15 mL 离心管中。涡旋样品 1 分钟。
- 将试管在 9,750 × g 和 4 °C 下离心 5 分钟。
- 收集上清液并将其置于 4 mL 琥珀色玻璃瓶中。在温和的氮气流下蒸发提取物。
注:如果当天未分析样品,则必须在 -20 °C 下保持干燥。 - 在 750 μL 甲醇:水 (1:1, v/v) 混合物中复溶样品。
- 将提取物转移到 2 mL 注射器中,并通过 0.22 μm 尼龙过滤器过滤到 1.5 mL 琥珀色色谱样品瓶中。
- 将用于基质匹配校准曲线的 8 个空白样品的复溶提取物收集到 12 mL 琥珀色玻璃样品瓶中(每个样品重悬于 750 μL 中,代表总体积为 6 mL)。
- 将 1 mL 1,000 ng/mL(每种麦角生物碱为 83.33 ng/mL)的中间溶液(步骤 1.2)移液到 2 mL 琥珀色玻璃瓶中,在温和的氮气流下干燥溶剂,然后重悬于 1 mL 先前收集的空白样品提取物中。
注:这种浓度为 1,000 ng/mL(每个 EA 为 83.33 ng/mL)的混合物将用于制备基质匹配的校准曲线。 - 准备 10 个 2 mL 琥珀色玻璃样品瓶,在每个样品瓶中放入 450 μL 空白样品提取物(步骤 8.10),并用 1 到 10 的数字标记。每个样品瓶都是校准曲线的一个点。
注:在本方案中,使用了 450 μL,因为这是液相色谱设备在不使用插件的情况下可以达到样品瓶内的最低值。如果针头没有深入样品瓶中,则增加体积,并计算应提取多少额外的空白样品,同时将每个样品重悬于 750 μL 甲醇:水 (1/1, v:v) 混合物中。 - 通过连续稀释构建校准曲线。转移 450 μL 在步骤 8.11 中制备的混合物。将已包含 450 μL 空白样品提取物的小瓶 1 中,达到 41.67 ng/mL 的浓度(最高校准点)。涡旋样品瓶 2 分钟。
注:混合物的体积必须与空白样品提取物的体积相匹配,以便在每个步骤中稀释两次。 - 将 450 μL 样品瓶 1 转移到样品瓶 2 中,样品瓶 2 中已包含 450 μL 空白样品提取物,浓度达到 20.83 ng/mL(第二高校准点)。
- 重复步骤 8.14(即,从样品瓶 2 到样品瓶 3,依此类推),然后继续,直到获得 10 个校准点。每个 EA 的浓度范围为:41.67、20.83、10.42、5.21、2.60、1.30、0.65、0.33、0.16 和 0.08 ng/mL。
- 如步骤 8.11 中所述,制备 1,000 ng/mL(每个 EA 为 83.33 ng/mL)的标准混合物,但使用 1 mL 甲醇:水 (1:1, v/v) 混合物。
- 按照步骤 8.13 至 8.15 中的详细说明制备标准校准曲线,但使用 450 μL 甲醇:水 (1:1, v/v) 混合物进行连续稀释。该校准曲线将用于通过与基质匹配的校准曲线进行比较来评估基质效应。
9. 定量数据处理
- 按照步骤 4.1 中描述的说明初始化并运行仪器。更改为 4.11。有关此协议中使用的工作列表,请参见 图 2 。
注:编写校准曲线的工作列表时,应将其进样到强化样品之前,从最低浓度到最高浓度的标准校准曲线开始,加入含有甲醇:水 (1:1, v/v) 的洗涤瓶,以及从最低浓度到最高浓度的基质匹配校准曲线。 - 打开定量软件并导航到 TASQ Quick 选项卡 | Import batch 位于左下角。
- 选择在步骤 4.10 中创建的文件夹。包含所有原始数据(与工作列表中包含的所有样品的 LC-IMS-MS 分析后采集的信息相关的文件)。
- 导入软件后,转到 Import batch (导入批次) 正下方的 Process batch(处理批次)。
- 选择要处理的样品(即 27 个加标样品、9 个空白样品和两条校准曲线)和先前在步骤 6.1 中创建的数据处理方法。更改为 6.3。将弹出一个窗口,其中包含要设置的不同参数(即,评估色谱峰的积分器类型或要考虑的分析信号类型等)。根据需要更改这些参数,尽管默认值适合执行此协议。
- 数据处理完成后,转到 Review screening(查看筛选 ),检查是否存在与自动积分相关的任何问题,例如选择可能彼此过于接近的错误色谱峰。如果是这样,请缩小与保留时间容差、CCS 值容差和/或定量方法文件中最初建立的质量数误差相关的值,然后重新处理数据。如果自动峰积分仍然选择不正确的峰,请通过在 "查看筛选" 窗口中显示的色谱图中选择区域来手动积分峰(为此,请考虑第 5 节中为 EA 标准品获得的分析参数)。
注:查看每个样品非常重要,因为一些主要的 EA-差向异构体对具有非常相似的保留时间,可能会被软件错误识别。 - 成功整合所有样品的所有峰后,单击左上角的 "批次管理"选项卡 ,并指示与每种分析相关的样品类型:溶剂、空白、质量控制、样品或校准点。在后一种情况下,为级别上的每个校准点分配一个数字。
- 在同一 Batch management 选项卡中,导航到名为 Batch concentration 的底部窗口,并为上一步中建立的每个级别指定浓度值。完成后,单击 Save concentrations(保存浓度)。
- 单击 Quantify batch 并根据需要更改参数(即,模型拟合校准数据、加权、模型是否被迫过零等)。默认值适用于此协议的执行,但校准曲线的加权已切换到 1/x。
注意:由于软件一次只能考虑一条校准曲线,因此需要重复步骤 9.9 两次,以获得有关标准和基质匹配校准曲线的信息。在该方案中,使用基质匹配的校准曲线对分析物进行定量,因此首先评估溶剂校准曲线,按照后面的步骤 9.13 中的说明提取校准数据,最后,选择基质匹配的校准曲线进行样品定量。 - 根据定量方法文件对麦角生物碱进行定量后,单击屏幕上部的 "定量 "选项卡。
- 如果在步骤 9.9 中设置的默认参数不能提供良好的线性度和精度,请通过右键单击图表来更改拟合和权重来调整校准曲线,以获得良好的线性模型 (R2 > 0.99),在每个校准级别上具有足够的精度(偏差低于 20%)。
注意:软件将用红色标记那些校准级别中无法提供适当精度的单元格。 - 完成后,右键单击屏幕最左侧的批处理文件夹,然后选择 Generate report。然后,选择 Analyte quantitation(分析物定量 )以将报告导出为所需的格式。
结果
首先,将工作标准溶液注入LC-IMS-MS仪器中,以获得此处分析的每种EA的所有鉴定特征(即保留时间、CCS和质谱)。由于除精确质量外的识别参数最初是未知的,因此采集方法基于两次扫描事件,从整个质谱的全扫描开始,然后是 bbCID。Q-TOF 高分辨率质谱仪实现了进行这项研究的回顾性方式,该质谱仪无需任何输入或有关分析物的先验信息即可获取和生成数据。在采集的数?...
讨论
该方案的成功使用基于先前由 Carbonell-Rozas 等人17 进行的提取程序的优化,他们实施了使用足够有效的提取溶剂从复杂的食品基质(如大麦和小麦)中提取 EAs,以及提供相对较低的 SSE 值的清理。萃取溶剂的选择是一个关键步骤,要考虑分析物的化学特性以及 EA 对分解和差向异构化的不稳定性,但同时要考虑待分析基质的组成。在这种情况下,当选择使...
披露声明
作者没有需要披露的利益冲突。
致谢
这项研究由安达卢西亚军政府大学研究和创新委员会 (PROYEXCEL_00195) 以及瓦伦西亚政府和欧洲社会基金+ (CIAPOS/2022/049) 提供的博士后资助。作者感谢格拉纳达大学的"Centro de Instrumentación Científica (CIC)"提供对本协议中使用的分析仪器的访问。
材料
| Name | Company | Catalog Number | Comments |
| Acetonitrile | VWR | 83640.32 | |
| Amber glass tubes 4 mL | VWR | 548-0052 | |
| Amber glass tubes 12 mL | VWR | 548-0903 | |
| Amber vials 1.5 mL | Agilent | 5190-9063 | |
| Ammonium carbonate | Fluka | 9716 | |
| Analytical balance BAS 31 | Boeco | 4400519 | |
| Balance CP 323 S | Sartorius | 23-84182 | |
| C18 | Supelco | 52604-U | |
| Centrifuge tubes, 15 mL | VWR | 525-1082 | |
| Centrifuge tubes, 50 mL | VWR | 525-0155 | |
| Centrifuge Universal 320 R | Hettich | 1406 | |
| Compass HyStar | Bruker | Acquisition software | |
| DataAnalysis | Bruker | Qualitative software | |
| Elute PLUS UHPLC | Bruker | ||
| EVA EC-S evaporator | VLM | V830.012.12 | |
| Formic acid GR for analysis ACS, Reag. Ph Eur | Merck | 100264 | |
| Grinder TitanMill300 | Cecotec | 1559 | |
| Methanol | VWR | 83638.32 | |
| Milli-Q water purification system (18.2 MΩ cm) | Millipore | ZD5211584 | |
| Pipette tips 1- 5 mL | Labortecnic | 162005 | |
| Pipette tips 100 - 1000 µL | Labortecnic | 1622222 | |
| Pipette tips 5 - 200 µL | Labortecnic | 162001 | |
| Pippette Transferpette S variable, DE-M 10 - 100 µL | BRAND | 704774 | |
| Pippette Transferpette S variable, DE-M 100 - 1000 µL | BRAND | 704780 | |
| Pippette Transferpette S variable, DE-M 500 - 5000 µL | BRAND | 704782 | |
| Syringe 2 mL | VWR | 613-2003 | |
| Syringe Filter 13 mm, 0.22µm | Phenomenex | AF-8-7707-12 | |
| TASQ | Bruker | Quantitative software | |
| timsTOFPro2 IM-HRMS | Bruker | ||
| Vortex Genie 2 | Scientific Industries | 15547335 | |
| Zorbax Eclipse Plus RRHD C18 column (50 x 2.1 mm, 1.8 µm particle size) | Agilent | 959757-902 | |
| Z-Sep+ | Supelco | 55299-U | Zirconia-based sorbent |
| Ergot alkaloids | CAS registry sorbent | ||
| Ergocornine (Eco) | Techno Spec | E178 | 564-36-3 |
| Ergocorninine (Econ) | Techno Spec | E130 | 564-37-4 |
| Ergocristine (Ecr) | Techno Spec | E180 | 511-08-0 |
| Ergocristinine (Ecrn) | Techno Spec | E188 | 511-07-9 |
| Ergokryptine (Ekr) | Techno Spec | E198 | 511-09-1 |
| Ergopkryptinine (Ekrn) | Techno Spec | E190 | 511-10-4 |
| Ergometrine (Em) | Romer Labs | "002067" | 60-79-7 |
| Ergometrinine (Emn) | Romer Labs | LMY-090-5ML | 479-00-5 |
| Ergosine (Es) | Techno Spec | E184 | 561-94-4 |
| Ergosinine (Esn) | Techno Spec | E194 | 596-88-3 |
| Ergotamine (Et) | Romer Labs | "002069" | 113-15-5 |
| Ergotaminine (Etn) | Romer Labs | "002075" | 639-81-6 |
参考文献
- Kanu, A. B., Dwivedi, P., Tam, M., Matz, L., Hill, H. H. Ion mobility-mass spectrometry. J Mass Spectrom. 43 (1), 1-22 (2008).
- Gabelica, V., et al. Recommendations for reporting ion mobility Mass spectrometry measurements. Mass Spectrom Rev. 38 (3), 291-320 (2019).
- Feuerstein, M. L., et al. Comparability of steroid collision cross sections using three different IM-HRMS technologies: An interplatform study. J Am Soc Mass Spectrom. 33 (10), 1951-1959 (2022).
- Regueiro, J., Negreira, N., Berntssen, M. H. G. Ion-mobility-derived collision cross section as an additional identification point for multiresidue screening of pesticides in fish feed. Anal Chem. 88 (22), 11169-11177 (2016).
- Regueiro, J., Negreira, N., Hannisdal, R., Berntssen, M. H. G. Targeted approach for qualitative screening of pesticides in salmon feed by liquid chromatography coupled to traveling-wave ion mobility/quadrupole time-of-flight mass spectrometry. Food Control. 78, 116-125 (2017).
- Hernández-Mesa, M., Monteau, F., Le Bizec, B., Dervilly-Pinel, G. Potential of ion mobility-mass spectrometry for both targeted and non-targeted analysis of phase II steroid metabolites in urine. Anal Chim Acta: X. 1, 100006 (2019).
- George, A. C., et al. Interplatform comparison between three ion mobility techniques for human plasma lipid collision cross sections. Anal Chim Acta. 1304, 342535 (2024).
- Mairinger, T., Causon, T. J., Hann, S. The potential of ion mobility-mass spectrometry for non-targeted metabolomics. Curr Opin Chem Biol. 42, 9-15 (2018).
- Hernández-Mesa, M., Escourrou, A., Monteau, F., Le Bizec, B., Dervilly-Pinel, G. Current applications and perspectives of ion mobility spectrometry to answer chemical food safety issues. TrAC Trend Anal Chem. 94, 39-53 (2017).
- European, C. Commission Regulation (EU) 2023/915 of 25 April 2023 on maximum levels for certain contaminants in food and repealing Regulation (EC) No 1881/2006. Off J Eur Union. 119, 103-157 (2023).
- Carbonell-Rozas, L., et al. Occurrence of egot alkaloids in major and minor cereals from Northern Italy: A three harvesting years scenario. J Agricl Food Chem. 71 (42), 15821-15828 (2023).
- Arroyo-Manzanares, N., Gámiz-Gracia, L., García-Campaña, A. M., Diana Di Mavungu, J., De Saeger, S., Jean-Michel Mérillon, J. -. M., Ramawat, K. G. . Fungal Metabolites. , (2016).
- van Dongen, P., de Groot, A. History of ergot alkaloids from ergotism to ergometrine. Eur J Obstet Gynecol Reprod Biol. 60 (2), 109-116 (1995).
- European Food Safety Authority. Human and animal dietary exposure to ergot alkaloids. EFSA J. 15 (7), e04902 (2017).
- Nam, M., Kim, D., Kim, M. -. S. Simultaneous determination of total ergot alkaloids in wheat flour by Orbitrap mass spectrometry. Food Chem. 441, 138363 (2024).
- García-Juan, A., León, N., Armenta, S., Pardo, O. Development and validation of an analytical method for the simultaneous determination of 12 ergot, 2 tropane, and 28 pyrrolizidine alkaloids in cereal-based food by LC-MS/MS. Food Res Int. 174 (Pt 1), 113614 (2023).
- Carbonell-Rozas, L., Mahdjoubi, C. K., Arroyo-Manzanares, N., García-Campaña, A. M., Gámiz-Gracia, L. Occurrence of ergot alkaloids in barley and wheat from Algeria. Toxins. 13 (5), 316 (2021).
- Carbonell-Rozas, L., Gámiz-Gracia, L., Lara, F. J., García-Campaña, A. M. Determination of the main ergot alkaloids and their epimers in oat-based functional foods by ultra-high performance liquid chromatography tandem mass spectrometry. Molecules. 26 (12), 3717 (2021).
- Carbonell-Rozas, L., et al. Ion mobility-mass spectrometry to extend analytical performance in the determination of ergot alkaloids in cereal samples. J Chromatogr A. 1682, 463502 (2022).
- European Commission. Commission Implementing Regulation (EU) 2023/2782 of 14 December 2023 laying down the methods of sampling and analysis for the control of the levels of mycotoxins in food and repealing Regulation (EC) No 401/2006. Off J Eur Union. , (2023).
- Carbonell-Rozas, L., Vander Cruyssen, L., Dall'Asta, C., Leggieri, M. C., Battilani, P. Fit-for-purpose method development to determine co-occurring multiclass mycotoxins in apple and apple puree samples. Food Anal Methods. 16 (8), 1403-1412 (2023).
- Laouni, C., et al. Emerging mycotoxin occurrence in chicken feed and eggs from Algeria. Mycotoxin Res. 40, 447-456 (2024).
- Ben Hassouna, K., et al. Mycotoxin occurrence in milk and durum wheat samples from Tunisia using dispersive liquid-liquid microextraction and liquid chromatography with fluorescence detection. Toxins. 15 (11), 633 (2023).
- Narváez, A., et al. Occurrence and exposure assessment of mycotoxins in ready-to-eat tree nut products through ultra-high performance liquid chromatography coupled with high resolution Q-orbitrap mass spectrometry. Metabolites. 10 (9), 344 (2020).
- Arroyo-Manzanares, N., Rodríguez-Estévez, V., García-Campaña, A. M., Castellón-Rendón, E., Gámiz-Gracia, L. Determination of principal ergot alkaloids in swine feeding. J Sci Food Agric. 101 (12), 5214-5224 (2021).
- Pereira, V. L., Fernandes, J. O., Cunha, S. C. Comparative assessment of three cleanup procedures after QuEChERS extraction for determination of trichothecenes (type A and type B) in processed cereal-based baby foods by GC-MS. Food Chem. 182, 143-149 (2015).
- Tuzimski, T., Szubartowski, S. Method development for selected bisphenols analysis in sweetened condensed milk from a can and breast milk samples by HPLC-DAD and HPLC-QqQ-MS: Comparison of sorbents (Z-SEP, Z-SEP Plus, PSA, C18, chitin and EMR-lipid) for clean-up of QuEChERS extract. Molecules. 24 (11), 2093 (2019).
- Łozowicka, B., Rutkowska, E., Jankowska, M. Influence of QuEChERS modifications on recovery and matrix effect during the multi-residue pesticide analysis in soil by GC/MS/MS and GC/ECD/NPD. Environ Sci Pollut Res. 24 (8), 7124-7138 (2017).
- Schummer, C., Xandonella, I., van Nieuwenhuyse, A., Moris, G. Epimerization of ergot alkaloids in feed. Heliyon. 6 (6), e04336 (2020).
- Cherewyk, J. E., Grusie-Ogilvie, T. J., Parker, S. E., Blakley, B. R., Al-Dissi, A. M. The impact of storage temperature and time on ergot alkaloid concentrations. Toxins. 15 (8), 497 (2023).
- Silva, &. #. 1. 9. 4. ;., Mateus, A. R., Barros, S. C., Silva, A. S. Ergot alkaloids on cereals and seeds: Analytical methods, occurrence, and future perspectives. Molecules. 28 (20), 7233 (2023).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。