A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
זיהוי אלקלואידים ארגוטיים מוסדרים במטריצות מזון על ידי ספקטרומטריית ניידות יונים לכודים בכרומטוגרפיה נוזלית-ספקטרומטריית מסה בזמן טיסה
In This Article
Summary
פרוטוקול זה מציג שיטת ספקטרומטריית מסה מאומתת של כרומטוגרפיה נוזלית - ניידות יון ברזולוציה גבוהה כדי לקבוע את נוכחותם של אלקלואידים ארגוט במזון בהתאם לתקנה של הנציבות (EU) 2023/915 שפורסמה לאחרונה.
Abstract
ספקטרומטריית מסה של ניידות יונים (IMS) פועלת כממד הפרדה נוסף כאשר היא משולבת בזרימות עבודה של ספקטרומטריית מסות כרומטוגרפיה נוזלית (LC-MS). שיטות LC-IMS-MS מספקות רזולוציית שיא גבוהה יותר, הפרדה משופרת של תרכובות איזובריות ואיזומריות ויחס אות לרעש (S/N) משופר בהשוואה לשיטות LC-MS מסורתיות. IMS מספק מאפיין מולקולרי נוסף לזיהוי אנליטים, כלומר פרמטר חתך התנגשות (CCS), הפחתת תוצאות חיוביות שגויות. לכן, שיטות LC-IMS-MS נותנות מענה לאתגרים אנליטיים חשובים בתחום בטיחות המזון (כלומר, איתור תרכובות ברמות קורט במטריצות מזון מורכבות וזיהוי חד משמעי של מולקולות איזובריות ואיזומריות).
אלקלואידים של ארגוט (שם מדעי: Ergot alkaloids) הם משפחה של מיקוטוקסינים המיוצרים על ידי פטריות התוקפות מגוון רחב של מיני עשב, כולל דגנים קטנים כמו שיפון, טריטיקל, חיטה, שעורה, דוחן ושיבולת שועל. רמות מקסימליות (MLs) של מיקוטוקסינים אלה נקבעו במספר מצרכי מזון, כמפורט בתקנה EC/2023/915 של הנציבות. חקיקה חדשה זו כוללת שישה EAs עיקריים ואת האפימרים המתאימים להם, ולכן נדרשת מתודולוגיה יעילה כדי להבחין כראוי בין מולקולות איזומריות אלה בהתחשב בהופעתן המשותפת.
לכן, המטרה של פרוטוקול זה היא להראות כיצד שילוב IMS בזרימות עבודה LC-MS תורם להפרדה של EAs איזומריים, שיפור הסלקטיביות של השיטה האנליטית. בנוסף, הוא ממחיש כיצד יצירת ספריות CCS באמצעות אפיון סטנדרטים אנליטיים מספקת ביטחון גבוה יותר לזיהוי מיקוטוקסינים. פרוטוקול זה נועד להסביר בבירור את היתרונות של יישום IMS בבטיחות מזון, תוך לקיחת כדוגמה את הקביעה של EAs בדגנים. חילוץ מבוסס QuEChERS ואחריו ספקטרומטריית ניידות יונים לכודה LC (TIMS)-MS סיפקו גבולות כימות שנעו בין 0.65 ל -2.6 ננוגרם/גרם עם דיוק מקובל (אם כי התאוששות נמוכה עבור ארגוטמנין) ב 1.5x, 1x ו- 0.5x ML והציגו אפקט מטריצה זניח.
Introduction
ספקטרומטריית מסה של ניידות יונים (IMS) הופכת לטכניקה אנליטית בשימוש הולך וגובר, המוצגת לעתים קרובות כממד הפרדה נוסף המשולב בכרומטוגרפיה מסורתית של נוזל/גז (LC/GC) המשולבת בזרימות עבודה של טרשת נפוצה. IMS מורכב מהפרדת מולקולות לאורך תא ניידות, מלא בגז חיץ, תחת שדה חשמלי ובלחץ אטמוספרי1. בהתאם ליחס המסה-מטען (m/z) והקונפורמציה הגיאומטרית, מולקולה מייננת תתקשר עם גז החיץ כשהוא נע על פני תא הניידות, דבר המשתקף בפרמטר ניידות היונים (K)2 ומחושב באמצעות המשוואה הבאה:
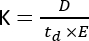
כאשר D מייצג את אורך הסחיפה הכולל, td הוא זמן הסחיפה הכולל, ו - E הוא השדה החשמלי. לכן, K נמדד ב-m2 V−1 s−1, אם כי מסיבות מעשיות הוא מבוטא לעתים קרובות כס"מ2 V−1 s−1. היכולת הפנימית לנוע על פני תא הניידות ניתנת למדידה על ידי זמן הסחף ולאחר מכן מומרת למה שמכונה ערך חתך התנגשות (CCS), שהוא פרמטר הניתן לשחזור עבור כל מולקולה בנפרד ממכשיר IMS3. ניתן לגזור את CCS מהניידות בעקבות המשוואה הבאה:
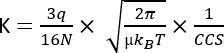
Q להיות המטען של היון; N צפיפות מספר גז החיץ; μ המסה המופחתת של שותפי ההתנגשות חוצצת גז-יון; kB קבוע בולצמן; ו-T טמפרטורת גז החיץ. לכן, IMS מספק מידע נוסף המשלים לנתונים האנליטיים הנובעים מניתוחי כרומטוגרפיה וטרשת נפוצה.
יישום IMS בפלטפורמות LC-MS הוכח כמגביר את האמינות של קביעות אנליטיות, במיוחד כאשר עובדים עם תרכובות שנמצאות בריכוזי עקבות. מספר מחקרים דיווחו כי שיטות LC-IMS-MS משפרות את איכות ספקטרום המסה על ידי הפחתת רעשי רקע, מה שמשפיע בסופו של דבר על רגישות השיטה, ומפחית את שיעור התוצאות החיוביות והשליליות הכוזבות המסופקות על ידי מתודולוגיות LC-MS מרובות שאריות 4,5,6. יתר על כן, יכולת השחזור של ערכי CCS מאפשרת השוואה לא רק בין מכשירים שונים המשתמשים באותה טכנולוגיה, אלא גם בין טכנולוגיות ניידות יונים שונות, כלומר ספקטרומטריית ניידות יוני גל נודד (TWIMS), ספקטרומטריית ניידות יונים לכודים (TIMS) וספקטרומטריית ניידות יוני צינור סחף (DTIMS)2,7, שהן המערכות הנפוצות ביותר1. לפיכך, תוצאה יוצאת דופן של הפוטנציאל של CCS כפרמטר זיהוי טמונה באפשרות לבנות ספריות CCS, הבאה לידי ביטוי ביישומו במחקרי מטבולומיקה8. עם זאת, אחת התכונות החזקות ביותר של IMS היא היכולת להפריד תרכובות איזומריות ואיזובריות שעשויות שלא להיפתר מספיק בשיטות LC-MS. זה עשוי להיות המקרה כאשר עובדים עם קבוצות גדולות של אנליטים של עניין מטריצות מורכבות, שהוא מצב נפוץ בניתוח סביבתי ומזון. בהקשר זה הוצעו שיטות LC-IMS-MS לניטור חומרי הדברה, ובמידה פחותה תרופות וטרינריות ומיקוטוקסינים במזון9.
בשל כוח הרזולוציה הגבוה והסלקטיביות שלהן, פלטפורמות LC/GC-IMS-MS מתגלות ככלים השימושיים ביותר להתמודדות עם כמה מהאתגרים הנוכחיים בבטיחות מזון, במיוחד אלה הקשורים לתערובות איזומריות. החשש הבריאותי הקשור לתערובות איזומריות כמזהמי מזון בא לידי ביטוי בחקיקה האירופית הנוכחית, המגבילה, למשל, את הריכוז המרבי של שישה אלקלואידים עיקריים של ארגוט (EAs) ואת ששת האפימרים המתאימים להם במספר מוצרי מזון10.
EAs מהווים משפחה של מטבוליטים משניים רעילים המיוצרים על ידי מגוון רחב של פטריות, בעיקר ממשפחת Clavicipitaceae (למשל, Claviceps purpurea, יצרנית EA החשובה ביותר בשל טווח המאכסן הרחב שלה), אך גם Trichocomaceae, אשר יכול לטפיל את ראש הזרעים של צמחים חיים (כגון שיפון, שעורה, חיטה ושיבולת שועל) בזמן הפריחה11, 12. בתנאים מסוימים, במיוחד טמפרטורה ופעילות מים, פטריות Claviceps יכולות לייצר EAs המצטברים בגופי פרי, הידועים בשם סקלרוטיה או ארגוט, ביבול המארח. במידה מסוימת, EAs יכול לעמוד בעיבוד של חומר הגלם עד הגעה למוצר הסופי; לכן, פריצה לשרשרת המזון. בליעה של מזון מזוהם יכול להוביל שיכרון EA, המכונה ארגואיזם, אשר מציג עם תסמינים חריפים כגון כאבי בטן, הקאות, תחושת צריבה של העור, נדודי שינה, הזיות13. כדי להפחית את ההשפעה של EAs על בריאות האדם, הנציבות האירופית קבעה רמות מקסימליות (MLs) במספר מזונות עבור סכום של EAs העיקריים: R-epimers ergometrine (Em), ergotamine (Et), ergosine (Es), ergocristine (Ecr), ergokryptine (Ekr), ו ergocornine (Eco) ואת ה- S אפימרים המתאימים שלהם: ארגומטרנין (Emn), ארגוזנין (Esn), ergotaminine (Etn), ergocorninine (Econ), ergokryptinine (Ekrn), וארגוקריסטינין (Ecrn). תרכובות אלה יכולות להתפשט מצורות R ל- S ולהיפך, במיוחד תחת חשיפה לאור חזק, אחסון ממושך, או מגע עם ממיסים מסוימים ב- pH גבוה או נמוך 12. למרות שחלקם של צורות R ו- S עשוי להשתנות בתנאים שונים, פאנל EFSA CONTAM דיווח על הופעה גבוהה יותר של צורות R מאשר צורות S לאחר סקירת הספרות הזמינה על EAs במוצרי מזון14. לפיכך, MLs להשתנות בהתאם למספר גורמים, כגון הרגישות של היבול, מידת העיבוד, או תדירות הצריכה. במסגרת האיחוד האירופי, MLs עבור מוצרים טחונים של שעורה, חיטה, כוסמין ושיבולת שועל נקבעו על 50 או 150 מיקרוגרם / ק"ג (בהתאם לתכולת אפר נמוכה או גבוהה מ 900 מ"ג / 100 גרם, בהתאמה), בעוד דגנים המיועדים ישירות למאכל אדם כפופים ML של 150 מיקרוגרם / ק"ג, למעט מזון תינוקות מבוסס דגנים, שבו ML מופחת ל 20 מיקרוגרם / ק"ג10.
חקיקה מחמירה זו דורשת מתודולוגיות אנליטיות רגישות מספיק כדי לקבוע את רמות ריכוז העקבות (מק"ג/ק"ג) תוך זיהוי נכון של EAs מוסדרים והאפימרים המתאימים להם, שכן ניתן למצוא את שתי הצורות, איזומרים R ו-S, יחד בדגימות מזוהמות. משימה זו מהווה אתגר גדול מכיוון שכל זוג רעלן-אפימר חולק את אותה מסה ודפוס פיצול בדיוק. בנוסף, הפרדה כרומטוגרפית נכונה בין שתי התרכובות עשויה להיות מורכבת. לכן, נדרשים שיפועי LC אופטימליים היטב כדי למנוע כימות שגוי כאשר אפימרים של EA מופיעים יחד בדגימות מזון. למרות שמספר מחקרים דיווחו על שיטות LC-MS לקביעה חד משמעית של EAs 15,16,17,18, יש לחקור את השיטה הכרומטוגרפית בהרחבה כדי להשיג הפרדה נאותה של הפסגות הכרומטוגרפיות כדי לזהות באופן חד משמעי EAs. עם זאת, זה בדרך כלל לא אפשרי עבור שיטות מרובות מחלקות שבו מזהמים השייכים למשפחות כימיות שונות נקבעים בו זמנית. בהקשר זה, מחקר שנערך לאחרונה על ידי Carbonell-Rozas, Hernández-Mesa, et al.19 דיווח על שיטת LC-IMS-MS לכימות של EAs בדגימות חיטה ושעורה, תוך שימוש בשני מכשירי TWIMS שונים שסיפקו ערכי CCS הניתנים לשחזור וגבולות נמוכים של כימות (LOQs) כדי לזהות כל אי ציות בהתאם לחקיקה הנוכחית. לכן, המטרה של פרוטוקול זה היא להראות כיצד שילוב IMS בזרימות עבודה LC-MS תורם להפרדה של EAs איזומריים, שיפור הסלקטיביות של השיטה האנליטית. בנוסף, הוא ממחיש כיצד יצירת ספריות CCS באמצעות אפיון סטנדרטים אנליטיים מספקת ביטחון גבוה יותר לזיהוי מיקוטוקסין. פרוטוקול זה נועד להסביר בבירור את היתרונות של יישום IMS בניתוח בטיחות מזון, תוך לקיחת כדוגמה את הקביעה של EAs בדגנים. פרוטוקול זה מתייחס לטיפול לדוגמה המבוסס על הליך QuEChES, ניתוח דגימה על ידי LC-TIMS-MS וחילוץ ופירוש נתוני IMS.
Protocol
1. הכנת פתרונות מלאי, ביניים וסטנדרט עבודה
הערה: יש להשתמש בכפפות ניטריל, מעיל מעבדה ומשקפי בטיחות.
- הכן תמיסות מלאי נפרדות של 12 EAs (ראה טבלת חומרים) ב- 10,000 ng/mL בבקבוקוני זכוכית ענבר 4 מ"ל באמצעות אצטוניטריל. צורות ה-R (-ine) חולקו בעבר במנות של 25,000 ננוגרם, ואילו צורות ה-S (-inine) חולקו במנות של 10,000 ננוגרם. מחקר זה החל עם aliquots אלה, והגיע לריכוזים של 10,000 ng/mL על ידי דילול צורות R ו - S ב 2.5 ו 1 מ"ל של acetonitrile, בהתאמה, ולאחר מכן מערבולות במשך 2 דקות.
- הכינו תמיסת מלאי ביניים ב-1,000 ננוגרם/מ"ל מסך EAs (83.33 ננוגרם/מ"ל מכל אחד) בבקבוקון זכוכית ענבר של 12 מ"ל על ידי הוספת 65 מיקרוליטר של כל תמיסת אלקלואיד בודדת ו-7.02 מ"ל של אצטוניטריל.
הערה: לאחר הכנת תמיסת מלאי הביניים, יש לייבש ולאחסן תמיסות מלאי בודדות בטמפרטורה של -20°C המכוסה ברדיד אלומיניום כדי למנוע אפימריזציה. - הכן פתרונות סטנדרטיים לעבודה מתמיסת מלאי הביניים על ידי פיפטציה של 2.7, 1.8 ו- 0.9 מ"ל בצינורות זכוכית ענבר 4 מ"ל. קח אותם ליובש תחת זרם חנקן עדין והשהה מחדש ב 600 מיקרוליטר של אצטוניטריל.
הערה: הריכוזים שהתקבלו נקבעו כדי להגיע 1.5, 1, ו 0.5x mL (150 ng / g) בעת הוספת 50 μL ל 1 גרם של הדגימה. אלה נבחרים כרמות ריכוז למחקרי תיקוף (כלומר, התאוששות, חזרתיות וכו '). - חלק את 600 μL של כל פתרון סטנדרטי עובד בשלושה בקבוקוני זכוכית ענבר 2 מ"ל על ידי pipetting 200 μL ולקחת אותם ליובש.
הערה: שלבים 1.2 עד 1.4 מוסברים באופן סכמטי באיור 1. על ידי חלוקה וייבוש של פתרונות תקן העבודה, ניתן לחזק במשולש בשלושה ימים שונים, כנדרש על ידי מחקר התיקוף, מבלי לאבד את השלמות הכימית של EAs. - בכל יום אימות, יש להשהות בקבוקון זכוכית ענבר אחד בנפח 2 מ"ל מכל רמת ביצור ב-200 מיקרוליטר אצטוניטריל.
הערה: כל רמת ביצור תוערך בשילוש באמצעות 50 μL לדגימה; לכן, סך של 150 μL של הפתרון ישמש.
2. הכנת ריאגנטים ופתרונות
הערה: יש להשתמש בכפפות ניטריל, מעיל מעבדה ומשקפי בטיחות.
- הכינו תמיסת אמוניום פחמתי 5 מ"מ במשקל 24.02 מ"ג אמוניום פחמתי והמסתו ב-50 מ"ל מים. שוקלים 24.02 מ"ג אמוניום פחמתי לתוך ומוסיפים כ 5 מ"ל מים. ממיסים את האמוניום הפחמתי על ידי תסיסה עדינה של התמיסה באופן ידני, ולאחר מכן מעבירים אותה לצלוחית נפחית של 50 מ"ל. כדי להגיע לנפח הסופי של 50 מ"ל, שוטפים את הכד במים נוספים ומעבירים את העלייה לצלוחית הנפחית.
- הכן 250 מ"ל של תמיסת המיצוי [אצטוניטריל:5 מ"מ אמוניום קרבונט (85:15, v/v)] על ידי ערבוב 212.5 מ"ל של אצטוניטריל ו-37.5 מ"ל של תמיסת האמוניום שהוכנה בשלב 2.1.
- הכינו 100 מ"ל של תערובת מתנול:מים (1:1, v/v) כדי להשהות מחדש את תמציות הדגימה (שלב 8.8).
- עבור כל דגימה, יש לשקול 150 מ"ג של חומר שלב מוצק מפזר C18:תערובת סורבנט מבוססת זירקוניה (1:1, w/w) לתוך צינורות צנטריפוגות 15 מ"ל לשלב ניקוי פיזור (שלב 8.5).
- הכינו את הממסים להפרדה כרומטוגרפית בשני בקבוקים שונים, כלומר 1 ליטר מים אולטרה-טהורים (ממס A) ומתנול (ממס B), שניהם מכילים 0.3% (v/v) חומצה פורמית. כדי להשיג ריכוז זה, 3.03 מ"ל של חומצה פורמית (99% טוהר) נוסף לבקבוקים.
הערה: יש להכין ממיסים לשלב הנייד ממש לפני הפעלת ניתוחי LC-IMS-MS.
3. הגדרת פרמטרים אינסטרומנטליים
הערה: המכשיר ששימש לביצוע מחקר LC-IMS-MS זה היה UHPLC בשילוב עם IM-HRMS, מצויד במקור יינון אלקטרוספריי מחומם בוואקום (VIP-HESI). המכשיר הופעל במצב חיובי.
- צור שיטה כרומטוגרפית באמצעות תוכנת הרכישה להפרדת האנליטים על ידי הגדרת שיפוע האלוציה הבא: 0 דקות, 10% B; 2 דקות, 10% B; 4.5 דקות, 40% B; 9 דקות, 45% B; 11 דקות, 95% B; 12 דקות, 95% B; 13 דקות, 10% B; 16 דקות, 10% B.
- הגדר את קצב זרימת הפאזה הנייד על 0.4 מ"ל לדקה, את טמפרטורת העמודה על 35 ° C ואת נפח ההזרקה על 5 μL. במידת האפשר, שמור על טמפרטורה קבועה של 10 ° C בתוך הדוגם האוטומטי.
- הגדר את פרמטרי IMS באופן הבא: ערכי ניידות (1/K0), מ- 0.1 עד 1.5 V·s/cm2; זמן רמפה, 100 אלפיות השנייה; זמן דיוק, 10 אלפיות השנייה; מחזור עבודה, 10%; וקצב רמפה, 9.05 הרץ.
- הגדר את פרמטרי מקור היונים לזיהוי MS באופן הבא: מתח נימי, 2,500 וולט; לחץ נבולייזר, 2.5 בר; קצב זרימת גז יבש, 8 ליטר/דקה; טמפרטורת גז יבש, 200 °C; טמפרטורת גז נדן, 450 °C; קצב זרימת גז מעטפת, 4 ליטר/דקה. עבור רכישת MS, בחר את הפרמטרים הבאים, תוך התחשבות בשני אירועי סריקה: סריקה מלאה של כל ספקטרום המסה עם m/z מ 20 עד 1,300 ואחריו bbCID (דיסוציאציה הנגרמת על ידי התנגשות בפס רחב), אשר מייצר יוני מוצר מכל קודמן בשלוש אנרגיית התנגשות קבועה של 24, 36, ו 50 eV. בצע יינון ורכישת נתונים במצב קוטביות חיובית.
- שמור קובץ שיטת רכישה זה לשימוש נוסף.
4. איסוף נתונים מסטנדרטים אנליטיים של EAs
הערה: יש להשתמש בכפפות ניטריל, חלוק מעבדה ומשקפי בטיחות לשלב 4.1 בלבד.
- הכינו שני בקבוקוני ענבר של 1.5 מ"ל עם 500 מיקרוליטר של תמיסת ביניים ב-1,000 ננוגרם/מ"ל ובקבוקון נוסף עם תערובת של ממסים A ו-B (1:1, v/v) כתמיסת כביסה.
- כייל את מכשיר timsTOF כפי שצוין על ידי היצרן ובחר קוטביות חיובית עבור רכישות IMS ו- MS.
- הניחו את עמודת C18 (ראו טבלת חומרים) בתוך תנור LC, כשהטמפרטורה מוגדרת ל-35°C כפי שמצוין בקובץ שיטות הרכישה שנשמר בשלב 3.5.
הערה: ודא ששני הקצוות מהודקים היטב; אחרת, תיצפה דליפת פאזה ניידת. - התנה את עמודת LC כך שתאפשר קצב זרימת פאזה נייד של 0.1 מ"ל/דקה ובחר יחס תערובת ממס A ו- B 90:10 (%) כיחס הרכב הפאזה הנייד ההתחלתי.
- המתן עד שלחץ העמודה יציב (~ 130 בר).
- הגדל את קצב זרימת הפאזה הניידת ל - 0.2 מ"ל/דקה, המתן עד שהלחץ יתייצב והגדל אותו שוב ל- 0.3 מ"ל/דקה.
- לאחר שהלחץ מתייצב שוב, כוונו את קצב הזרימה ל-0.4 מ"ל, שיהיה קצב זרימת העבודה כמפורט בקובץ שיטת הרכישה שנשמר בשלב 3.5, והמתינו עד שהלחץ יתייצב סביב 350 בר.
הערה: חשוב לא להגדיל ישירות את הזרימה מ-0.2 ל-0.4 מ"ל/דקה. שינוי חזק בזרימה מעורר פסגות לחץ גבוה שעלולות לפגוע בעמוד הכרומטוגרפיה. - בזמן שהעמודה מותנית, כתוב את רשימת העבודה, כולל שתי דוגמאות המתאימות לשני הבקבוקונים המכילים את תמיסת הביניים EAs ב- 1,000 ננוגרם/מ"ל, כפי שמצוין בשלב 4.1, ובקבוקון השטיפה. לנתח את בקבוקון לשטוף פעמיים, בתחילת ובסוף אצווה המדגם.
- בעמודה קובץ שיטה של רשימת העבודה, טען את קובץ שיטת הרכישה שנשמר בעבר בשלב 3.5.
- צור תיקייה כדי לשמור את כל קובצי הנתונים שנרכשו ולנתב את כל הדגימות על-ידי בחירת התיקיה בעמודה נתיב לדוגמה .
הערה: הקפד להשתמש באותה תיקיה כדי לשמור את כל הקבצים שנוצרו במהלך מחקר האימות לעיבוד נוסף. במהלך מיזוג העמודה, הערכים שבהם הלחץ מתייצב עשויים להשתנות מעט. עם זאת, ודא שהלחץ יציב לפני שתגביר שוב את קצב הזרימה כדי לשמור על שלמות העמודה. יתר על כן, כאשר מגיעים לקצב זרימת העבודה, הלחץ חייב להיות יציב גם כדי להשיג הפרדה כרומטוגרפית ניתנת לשחזור. - עבור אל סרגל הכלים העליון של התוכנה והפעל את רשימת העבודה.
5. טיפול בנתונים ליצירת שיטת כימות
- לאחר ביצוע רשימת העבודה, פתח את התוכנה האיכותית.
- טען את כל הדגימות שנותחו על-ידי לחיצה על קובץ | פתח רשימת עבודה.
- לחץ לחיצה ימנית על דגימה המתאימה לפתרון הביניים של EAs ב- 1,000 ננוגרם/מ"ל, עבור אל ערוך כרומטוגרמה ולאחר מכן בחר סוג | מוציאים כרומטוגרמה של יונים, ומזינים את המסה המולקולרית התיאורטית של היון הפרוטוני הקשור לכל EA. לאחר מכן, לחץ על הוסף, ולסיום, אישור. מכיוון שקבוצת האנליטים נוצרת על ידי שישה EAs והאפימרים הקשורים אליהם החולקים את אותה מסה בדיוק, יופיעו שישה כרומטוגרמות יונים שחולצו.
הערה: הפרמטר רוחב משנה את הצרה של חלון m/z . מומלץ לבחור חלון m/z רחב מספיק במקרה של קשיים במציאת השיא הכרומטוגרפי של האנליזה המעניינת. עם זאת, מומלץ להגדיר חלונות m/z צרים כדי למנוע הפרעות אפשריות (מתחת ל-0.05 יחידות). - בכל כרומטוגרמה של יונים שחולצו יופיעו שתי פסגות כרומטוגרפיות הקשורות ל-EA הראשי ולאפימר שלו. לחץ באמצעות לחצן העכבר הימני תוך בחירת כל האזור של פסגה אחת. כתוצאה מכך, ספקטרום ניידות היונים יופיע ממש מתחת.
- עבור אל ציר ה- x של ספקטרום ניידות היונים, לחץ באמצעות לחצן העכבר הימני ולאחר מכן לחץ על חתך התנגשות. רשום את הערך CCS.
הערה: אם ערכי CCS אינם מופיעים באופן אוטומטי, עבור אל כיול בסרגל הכלים העליון, ולאחר מכן מחשבון ניידות, והקלד ידנית את ערך הניידות כדי להשיג את CCS המתאים שלהם. - בחר את האזור המתאים לשיא הכרומטוגרפי האחר באותה כרומטוגרמה של יונים וחזור על שלבים 5.4. ו-5.5.
- באופן דומה, תבנית הפיצול תופיע גם לאחר שלב 5.4. בהתבסס על דפוס הפיצול המדווח בספרות ובמאגרי מידע, השוו ובחרו את יון המכפלה האינטנסיבי ביותר כנקודת זיהוי משלימה.
- רשום את זמן השמירה, ערך CCS והמסה המדויקת של צינור היונים הראשי (בדרך כלל היון הפרוטוני) של כל EA כדי ליצור שיטת כימות.
- חזור על שלבים 5.4 עד 5.8. לשאר האנליטים.
- בחר את כל המסות המולקולריות שנוצרו בשלב 5.3 על ידי לחיצה עליהן תוך כדי הקשה על Ctrl. לאחר מכן, לחץ באמצעות לחצן העכבר הימני ובחר העתק. עבור אל המדגם השני המתאים לפתרון הביניים EAs, לחץ עליו באמצעות לחצן העכבר הימני ובחר הדבק. כרומטוגרמות היונים וספקטרום הניידות יחולצו באופן אוטומטי.
- בדוק שוב את פרמטרי הזיהוי עבור כל האנליטים במדגם שני זה.
6. יצירת שיטת עיבוד נתונים לקביעה שגרתית של אלקלואידים ארגוט
- פתח את התוכנה ולחץ על הכרטיסייה ניהול שיטות .
- לחץ על הגדרות Analyte והזן את השם של כל EA לצד זמן השמירה שלו, ערך CCS והמסה של האדוקטים הפרוטונים שנאספו בשלבים 5.4. ל-5.9. שנה את הסיבולת של כל נקודת זיהוי לפי הצורך, אם כי הגדרות ברירת המחדל מומלצות ליישום פרוטוקול זה.
הערה: ככל שערכי הסיבולת שנקבעו גבוהים יותר, כך גדלה האפשרות להתמודד עם תוצאות חיוביות שגויות, שכן מתקבלת סטייה גדולה יותר מהערכים התיאורטיים. באופן דומה, ערכי סובלנות מחמירים מדי עלולים להוביל לתוצאות שליליות שגויות. זה קורה כאשר הסטייה מהערך התיאורטי נגרמת אך ורק על ידי ביצועי המכשיר. - שמור את שיטת הכמות לשימוש נוסף.
7. דגימה
- לרכוש דגימות של חיטה ושיבולת שועל במרכולים, רצוי במיכלים של 1 ק"ג, בהתאם להנחיות הדגימה שנקבעו על ידי הנציבות האירופית20. אם חבילות של 1 ק"ג אינן זמינות, רק וודא שיש לך, לפחות, 50 גרם של דגימות כדי להשלים את כל הניתוח.
- טוחנים את הדגימות באמצעות מטחנה. במחקר זה נעשה שימוש במטחנת להבים כדי לטחון את כל תכולת החבילות, שהוחזרו לאחר מכן לאריזות המקוריות שלהן לצורך הומוגניזציה.
הערה: נקו היטב את המטחנה בין הדגימות כדי למנוע זיהום צולב. השתמשו במעיל מעבדה. - Aliquot את הדגימות הומוגניות בצינורות צנטריפוגות 50 מ"ל ולאחסן אותם בתנאים קרירים ויבשים.
8. הכנת מדגם
- הכינו לוח זמנים לביצוע מחקר התיקוף במשך שלושה ימים לא רצופים (כדי להעריך את יכולת השחזור הפנימית). עבור כל יום, יש לבדוק שלוש רמות ריכוז על ידי חיזוק הדגימות ב-225 ננוגרם/גרם (1.5 מ"ל), 150 ננוגרם/גרם (מ"ל) ו-75 נ"ג/גרם (0.5 מ"ל). למד כל רמה במשולש, המייצג תשע דגימות ספייק ועוד שלוש דגימות ריקות ביום.
הערה: בהתחשב בשלושת ימי האימות, יידרשו בסך הכל 36 דגימות לצד 8 דגימות ריקות נוספות המיועדות להכנת עקומת הכיול תואמת המטריצה. השתמשו בכפפות ניטריל, מעיל מעבדה ומשקפי בטיחות לכל החלק הזה של הפרוטוקול. - שוקלים 1 גרם דגימה לתוך צינור צנטריפוגה 50 מ"ל.
הערה: בעת ביצוע מחקר התיקוף, חזק את הדגימות מיד לאחר השקילה עם 50 μL של פתרון תקן העבודה המתאים המפורט בשלבים 1.3. ו-1.5. - הוסף 4 מ"ל של תמיסת המיצוי [אצטוניטריל:5 mM תמיסה מימית אמוניום קרבונט (85:15, v/v)]. מערבלים את הדגימה למשך דקה.
- צנטריפוגה את הדגימה במשך 5 דקות ב 9,750 × גרם ו 4 ° C.
הערה: קיבולת הצנטריפוגה עשויה להיות גורם מגביל בהליך, ולכן מומלץ לחלץ בו זמנית רק את המספר המדויק של הדגימות שיתאימו לצנטריפוגה. - מעבירים את כל הסופרנאטנט לצינור הצנטריפוגה בנפח 15 מ"ל המכיל 150 מ"ג מתערובת סופג הניקוי (1:1, w/w). מערבלים את הדגימה למשך דקה.
- צנטריפוגה את הצינור למשך 5 דקות ב 9,750 × גרם ו 4 ° C.
- אוספים את הסופרנאטנט ומניחים אותו בבקבוקון זכוכית ענבר 4 מ"ל. יש לאדות את התמצית תחת זרם עדין של חנקן.
הערה: יש לשמור את הדגימות מיובשות בטמפרטורה של -20°C אם לא נותחו באותו יום. - הרכיבו מחדש את הדגימה בתערובת מתנול:מים (1:1, v/v).
- מעבירים את התמצית למזרק 2 מ"ל ומסננים אותה דרך מסנן ניילון 0.22 מיקרומטר לבקבוקון כרומטוגרפי ענברי 1.5 מ"ל.
- אספו את התמציות המשוחזרות של שמונה הדגימות הריקות המיועדות לעקומת הכיול התואמת מטריצה לבקבוקון זכוכית ענבר של 12 מ"ל (כל דגימה תלויה מחדש ב-750 מיקרוליטר, המייצג נפח כולל של 6 מ"ל).
- פיפטה 1 מ"ל של תמיסת הביניים ב-1,000 ננוגרם/מ"ל (83.33 ננוגרם/מ"ל עבור כל אלקלואיד ארגו) (שלב 1.2) לתוך בקבוקון זכוכית ענבר של 2 מ"ל, יבשה את הממס תחת זרם עדין של חנקן, והשהתה מחדש ב-1 מ"ל של תמצית הדגימה הריקה שנאספה קודם לכן.
הערה: תערובת זו בריכוז של 1,000 ננוגרם/מ"ל (83.33 ננוגרם/מ"ל עבור כל EA) תשמש להכנת עקומת הכיול תואמת המטריצה. - הכינו עשרה בקבוקוני זכוכית ענבר 2 מ"ל והניחו 450 מיקרוליטר של תמצית דגימה ריקה (שלב 8.10) בכל אחד מהם וסמנו אותם במספרים מ-1 עד 10. כל בקבוקון יהיה נקודה בעקומת הכיול.
הערה: בפרוטוקול זה, נעשה שימוש ב- 450 μL מכיוון שזה היה הערך הנמוך ביותר שמכשיר LC יכול היה להגיע אליו בתוך הבקבוקון ללא שימוש בתוספות. אם המחט אינה מגיעה כל כך רחוק לתוך הבקבוקון, להגדיל את נפח, וכתוצאה מכך, לחשב כמה דגימות ריקות נוספות יש לחלץ בהתחשב בכך שכל אחד מהם הוא resuspended ב 750 μL של מתנול:מים (1/1, v:v) תערובת. - בנה את עקומת הכיול על ידי דילול סדרתי. העבר 450 μL של תערובת מוכן בשלב 8.11. לתוך בקבוקון 1, אשר כבר מכיל 450 μL של תמצית דגימה ריקה, כדי להשיג ריכוז של 41.67 ng / mL (נקודת הכיול הגבוהה ביותר). מערבבים את הבקבוקון במשך 2 דקות.
הערה: נפח התערובת חייב להתאים לנפח של תמצית דגימה ריקה כדי לדלל פעמיים בכל שלב. - העבירו 450 μL מבקבוקון 1 לבקבוקון 2, שכבר מכיל 450 μL של תמצית דגימה ריקה, כדי להגיע לריכוז של 20.83 ng/mL (נקודת הכיול השנייה בגובהה).
- חזור על שלב 8.14 (כלומר, מבקבוקון 2 לבקבוקון 3, וכן הלאה) והמשך לאחר מכן עד לקבלת עשר נקודות כיול. טווח הריכוז עבור כל EA יהיה: 41.67, 20.83, 10.42, 5.21, 2.60, 1.30, 0.65, 0.33, 0.16 ו- 0.08 ננוגרם/מ"ל.
- הכינו תערובת סטנדרטית במינון של 1,000 נ"ג/מ"ל (83.33 נ"ג/מ"ל עבור כל EA) כמפורט בשלב 8.11, אך השתמשו בתערובת מתנול:מים (1:1, v/v).
- הכן עקומת כיול סטנדרטית כמפורט בשלבים 8.13 עד 8.15 אך באמצעות תערובת מתנול:מים (1:1, v/v) של 450 μL עבור הדילולים הטוריים. עקומת כיול זו תשמש להערכת אפקט המטריצה על ידי השוואתו לעקומת הכיול התואמת למטריצה.
9. טיפול בנתונים כמותיים
- אתחל והפעל את המכשיר בהתאם להוראות המתוארות בשלבים 4.1. ל-4.11. ראה איור 2 עבור רשימת העבודה המשמשת בפרוטוקול זה.
הערה: בעת כתיבת רשימת העבודה עבור עקומות כיול, הזריקו אותן לפני הדגימות המועשרות החל מעקומת הכיול הסטנדרטית מהריכוז הנמוך ביותר לגבוה ביותר, בקבוקון שטיפה המכיל מתנול:מים (1:1, v/v), ועקומת כיול תואמת מטריצה מהריכוז הנמוך ביותר לריכוז הגבוה ביותר. - פתח את התוכנה הכמותית ונווט אל הכרטיסיה המהירה TASQ | ייבוא אצווה בפינה הימנית התחתונה.
- בחר את התיקיה שנוצרה בשלב 4.10. המכיל את כל הנתונים הגולמיים (קבצים הקשורים למידע שנרכש לאחר ניתוח LC-IMS-MS עבור כל הדגימות הכלולות ברשימת העבודה).
- לאחר הייבוא לתוכנה, עבור אל אצווה תהליך, ממש מתחת לאצוות ייבוא.
- בחר את הדגימות לעיבוד (כלומר, את 27 הדגימות הקוצניות, 9 הריקות ואת שתי עקומות הכיול) ואת שיטת עיבוד הנתונים שנוצרה בעבר בשלבים 6.1. ל-6.3. יופיע חלון עם פרמטרים שונים להגדרה (כלומר, סוג האינטגרטור להערכת הפסגות הכרומטוגרפיות או סוג האות האנליטי שיש לקחת בחשבון, בין היתר). שנה פרמטרים אלה כרצונך, אם כי ערכי ברירת המחדל מתאימים לביצוע פרוטוקול זה.
- עבור אל סקירת סינון לאחר השלמת עיבוד הנתונים ובדוק אם יש בעיות הקשורות לאינטגרציה האוטומטית, כגון בחירה של פסגות כרומטוגרפיות שגויות שעשויות להיות קרובות מדי זו לזו. אם כן, צמצם את הערכים המתייחסים לסיבולת זמן שמירה, סובלנות ערכי CCS ו/או שגיאת מסה שנקבעו לראשונה בקובץ השיטה הכמותית ועבד מחדש את הנתונים. אם שילוב שיא אוטומטי עדיין בוחר פסגות שגויות, שלב ידנית את הפסגה על-ידי בחירת האזור בכרומטוגרמה המופיע בחלון Review Screening (לשם כך, קח בחשבון את הפרמטרים האנליטיים שהתקבלו עבור תקני EA בסעיף 5).
הערה: חשוב מאוד לסקור כל דגימה, מכיוון שלכמה זוגות EA-epimer עיקריים יש זמני שמירה דומים מאוד והם עשויים להיות מזוהים באופן שגוי על ידי התוכנה. - לאחר שכל הפסגות שולבו בהצלחה עבור כל הדגימות, לחץ על כרטיסיית ניהול אצווה בפינה השמאלית העליונה וציין את סוג הדגימה המשויכת לכל ניתוח: ממס, ריק, בקרת איכות, דגימה או נקודת כיול. במקרה האחרון, הקצה כל נקודת כיול ברמה עם מספר.
- באותה כרטיסיית ניהול אצווה , נווט לחלון התחתון שנקרא ריכוז אצווה וציין ערך ריכוז לכל רמה שנקבעה בשלב הקודם. ברגע שזה נעשה, לחץ על שמור ריכוזים.
- לחץ על Quantify אצווה ושנה את הפרמטרים לפי הצורך (כלומר, המודל כך שיתאים לנתוני הכיול, שקלול, האם המודל נאלץ לחצות את האפס וכו '). ערכי ברירת המחדל מתאימים לביצוע פרוטוקול זה למעט שקלול עקומות הכיול, שהוחלף ל- 1/x.
הערה: מכיוון שהתוכנה יכולה לשקול רק עקומת כיול אחת בכל פעם, יש צורך לחזור על שלב 9.9 פעמיים כדי לקבל מידע על עקומות כיול סטנדרטיות ותואמות מטריצה. בפרוטוקול זה שימשו עקומות כיול תואמות מטריצה לכימות אנליטים, כך שעקומות כיול הממס הוערכו תחילה, חולצו נתוני כיול כפי שהוסבר מאוחר יותר בשלב 9.13, ולבסוף, נבחרו עקומות הכיול תואמות המטריצה לביצוע כימות הדגימות. - לאחר ביצוע כימות אלקלואידים ארגוט על פי קובץ שיטת הכימות, לחץ על הכרטיסייה Quantitation בחלק העליון של המסך.
- אם פרמטרי ברירת המחדל שנקבעו בשלב 9.9 אינם מספקים ליניאריות ודיוק טובים, התאם את עקומות הכיול על ידי שינוי ההתאמה והמשקל על ידי לחיצה ימנית על הגרף במטרה לקבל מודל ליניארי טוב (R2 > 0.99) עם דיוק הולם בכל רמת כיול (סטייה מתחת ל- 20%).
הערה: התוכנה תסמן באדום את התאים מאותן רמות כיול שאינן מספקות דיוק נאות. - לאחר שתסיים, לחץ באמצעות לחצן העכבר הימני על תיקיית האצווה בקצה השמאלי של המסך ובחר צור דוח. לאחר מכן, בחר Analyte quantitation כדי לייצא את הדוח לתבנית הרצויה.
תוצאות
ראשית, פתרונות סטנדרטיים לעבודה הוזרקו למכשיר LC-IMS-MS כדי להשיג את כל תכונות הזיהוי (כלומר, זמן שמירה, CCS וספקטרום מסות) של כל EA שניתח כאן. מכיוון שפרמטרי הזיהוי, למעט המסה המדויקת, לא היו ידועים בתחילה, שיטת הרכישה התבססה על אירוע של שתי סריקות, החל מסריקה מלאה של כל ספקטרום ה...
Discussion
השימוש המוצלח בפרוטוקול זה מבוסס על אופטימיזציה של הליך המיצוי, שבוצע בעבר על ידי Carbonell-Rozas et al.17, שיישמו את השימוש בממס מיצוי יעיל מספיק כדי לחלץ EAs ממטריצות מזון מורכבות כגון שעורה וחיטה, וניקוי שסיפק ערכי SSE נמוכים יחסית. הבחירה של ממס מיצוי מייצג צעד קריטי ב...
Disclosures
למחברים אין ניגודי עניינים לחשוף.
Acknowledgements
מחקר זה מומן על ידי Consejería de Universidad, Investigación e Innovación - Junta de Andalucía (PROYEXCEL_00195) ומענק הפוסט-דוקטורט שניתן על ידי Generalitat Valenciana והקרן החברתית האירופית + (CIAPOS/2022/049). המחברים מודים ל-"Centro de Instrumentación Científica (CIC)" באוניברסיטת גרנדה על מתן גישה למכשור האנליטי המשמש בפרוטוקול זה.
Materials
| Name | Company | Catalog Number | Comments |
| Acetonitrile | VWR | 83640.32 | |
| Amber glass tubes 4 mL | VWR | 548-0052 | |
| Amber glass tubes 12 mL | VWR | 548-0903 | |
| Amber vials 1.5 mL | Agilent | 5190-9063 | |
| Ammonium carbonate | Fluka | 9716 | |
| Analytical balance BAS 31 | Boeco | 4400519 | |
| Balance CP 323 S | Sartorius | 23-84182 | |
| C18 | Supelco | 52604-U | |
| Centrifuge tubes, 15 mL | VWR | 525-1082 | |
| Centrifuge tubes, 50 mL | VWR | 525-0155 | |
| Centrifuge Universal 320 R | Hettich | 1406 | |
| Compass HyStar | Bruker | Acquisition software | |
| DataAnalysis | Bruker | Qualitative software | |
| Elute PLUS UHPLC | Bruker | ||
| EVA EC-S evaporator | VLM | V830.012.12 | |
| Formic acid GR for analysis ACS, Reag. Ph Eur | Merck | 100264 | |
| Grinder TitanMill300 | Cecotec | 1559 | |
| Methanol | VWR | 83638.32 | |
| Milli-Q water purification system (18.2 MΩ cm) | Millipore | ZD5211584 | |
| Pipette tips 1- 5 mL | Labortecnic | 162005 | |
| Pipette tips 100 - 1000 µL | Labortecnic | 1622222 | |
| Pipette tips 5 - 200 µL | Labortecnic | 162001 | |
| Pippette Transferpette S variable, DE-M 10 - 100 µL | BRAND | 704774 | |
| Pippette Transferpette S variable, DE-M 100 - 1000 µL | BRAND | 704780 | |
| Pippette Transferpette S variable, DE-M 500 - 5000 µL | BRAND | 704782 | |
| Syringe 2 mL | VWR | 613-2003 | |
| Syringe Filter 13 mm, 0.22µm | Phenomenex | AF-8-7707-12 | |
| TASQ | Bruker | Quantitative software | |
| timsTOFPro2 IM-HRMS | Bruker | ||
| Vortex Genie 2 | Scientific Industries | 15547335 | |
| Zorbax Eclipse Plus RRHD C18 column (50 x 2.1 mm, 1.8 µm particle size) | Agilent | 959757-902 | |
| Z-Sep+ | Supelco | 55299-U | Zirconia-based sorbent |
| Ergot alkaloids | CAS registry sorbent | ||
| Ergocornine (Eco) | Techno Spec | E178 | 564-36-3 |
| Ergocorninine (Econ) | Techno Spec | E130 | 564-37-4 |
| Ergocristine (Ecr) | Techno Spec | E180 | 511-08-0 |
| Ergocristinine (Ecrn) | Techno Spec | E188 | 511-07-9 |
| Ergokryptine (Ekr) | Techno Spec | E198 | 511-09-1 |
| Ergopkryptinine (Ekrn) | Techno Spec | E190 | 511-10-4 |
| Ergometrine (Em) | Romer Labs | "002067" | 60-79-7 |
| Ergometrinine (Emn) | Romer Labs | LMY-090-5ML | 479-00-5 |
| Ergosine (Es) | Techno Spec | E184 | 561-94-4 |
| Ergosinine (Esn) | Techno Spec | E194 | 596-88-3 |
| Ergotamine (Et) | Romer Labs | "002069" | 113-15-5 |
| Ergotaminine (Etn) | Romer Labs | "002075" | 639-81-6 |
References
- Kanu, A. B., Dwivedi, P., Tam, M., Matz, L., Hill, H. H. Ion mobility-mass spectrometry. J Mass Spectrom. 43 (1), 1-22 (2008).
- Gabelica, V., et al. Recommendations for reporting ion mobility Mass spectrometry measurements. Mass Spectrom Rev. 38 (3), 291-320 (2019).
- Feuerstein, M. L., et al. Comparability of steroid collision cross sections using three different IM-HRMS technologies: An interplatform study. J Am Soc Mass Spectrom. 33 (10), 1951-1959 (2022).
- Regueiro, J., Negreira, N., Berntssen, M. H. G. Ion-mobility-derived collision cross section as an additional identification point for multiresidue screening of pesticides in fish feed. Anal Chem. 88 (22), 11169-11177 (2016).
- Regueiro, J., Negreira, N., Hannisdal, R., Berntssen, M. H. G. Targeted approach for qualitative screening of pesticides in salmon feed by liquid chromatography coupled to traveling-wave ion mobility/quadrupole time-of-flight mass spectrometry. Food Control. 78, 116-125 (2017).
- Hernández-Mesa, M., Monteau, F., Le Bizec, B., Dervilly-Pinel, G. Potential of ion mobility-mass spectrometry for both targeted and non-targeted analysis of phase II steroid metabolites in urine. Anal Chim Acta: X. 1, 100006 (2019).
- George, A. C., et al. Interplatform comparison between three ion mobility techniques for human plasma lipid collision cross sections. Anal Chim Acta. 1304, 342535 (2024).
- Mairinger, T., Causon, T. J., Hann, S. The potential of ion mobility-mass spectrometry for non-targeted metabolomics. Curr Opin Chem Biol. 42, 9-15 (2018).
- Hernández-Mesa, M., Escourrou, A., Monteau, F., Le Bizec, B., Dervilly-Pinel, G. Current applications and perspectives of ion mobility spectrometry to answer chemical food safety issues. TrAC Trend Anal Chem. 94, 39-53 (2017).
- European, C. Commission Regulation (EU) 2023/915 of 25 April 2023 on maximum levels for certain contaminants in food and repealing Regulation (EC) No 1881/2006. Off J Eur Union. 119, 103-157 (2023).
- Carbonell-Rozas, L., et al. Occurrence of egot alkaloids in major and minor cereals from Northern Italy: A three harvesting years scenario. J Agricl Food Chem. 71 (42), 15821-15828 (2023).
- Arroyo-Manzanares, N., Gámiz-Gracia, L., García-Campaña, A. M., Diana Di Mavungu, J., De Saeger, S., Jean-Michel Mérillon, J. -. M., Ramawat, K. G. . Fungal Metabolites. , (2016).
- van Dongen, P., de Groot, A. History of ergot alkaloids from ergotism to ergometrine. Eur J Obstet Gynecol Reprod Biol. 60 (2), 109-116 (1995).
- European Food Safety Authority. Human and animal dietary exposure to ergot alkaloids. EFSA J. 15 (7), e04902 (2017).
- Nam, M., Kim, D., Kim, M. -. S. Simultaneous determination of total ergot alkaloids in wheat flour by Orbitrap mass spectrometry. Food Chem. 441, 138363 (2024).
- García-Juan, A., León, N., Armenta, S., Pardo, O. Development and validation of an analytical method for the simultaneous determination of 12 ergot, 2 tropane, and 28 pyrrolizidine alkaloids in cereal-based food by LC-MS/MS. Food Res Int. 174 (Pt 1), 113614 (2023).
- Carbonell-Rozas, L., Mahdjoubi, C. K., Arroyo-Manzanares, N., García-Campaña, A. M., Gámiz-Gracia, L. Occurrence of ergot alkaloids in barley and wheat from Algeria. Toxins. 13 (5), 316 (2021).
- Carbonell-Rozas, L., Gámiz-Gracia, L., Lara, F. J., García-Campaña, A. M. Determination of the main ergot alkaloids and their epimers in oat-based functional foods by ultra-high performance liquid chromatography tandem mass spectrometry. Molecules. 26 (12), 3717 (2021).
- Carbonell-Rozas, L., et al. Ion mobility-mass spectrometry to extend analytical performance in the determination of ergot alkaloids in cereal samples. J Chromatogr A. 1682, 463502 (2022).
- European Commission. Commission Implementing Regulation (EU) 2023/2782 of 14 December 2023 laying down the methods of sampling and analysis for the control of the levels of mycotoxins in food and repealing Regulation (EC) No 401/2006. Off J Eur Union. , (2023).
- Carbonell-Rozas, L., Vander Cruyssen, L., Dall'Asta, C., Leggieri, M. C., Battilani, P. Fit-for-purpose method development to determine co-occurring multiclass mycotoxins in apple and apple puree samples. Food Anal Methods. 16 (8), 1403-1412 (2023).
- Laouni, C., et al. Emerging mycotoxin occurrence in chicken feed and eggs from Algeria. Mycotoxin Res. 40, 447-456 (2024).
- Ben Hassouna, K., et al. Mycotoxin occurrence in milk and durum wheat samples from Tunisia using dispersive liquid-liquid microextraction and liquid chromatography with fluorescence detection. Toxins. 15 (11), 633 (2023).
- Narváez, A., et al. Occurrence and exposure assessment of mycotoxins in ready-to-eat tree nut products through ultra-high performance liquid chromatography coupled with high resolution Q-orbitrap mass spectrometry. Metabolites. 10 (9), 344 (2020).
- Arroyo-Manzanares, N., Rodríguez-Estévez, V., García-Campaña, A. M., Castellón-Rendón, E., Gámiz-Gracia, L. Determination of principal ergot alkaloids in swine feeding. J Sci Food Agric. 101 (12), 5214-5224 (2021).
- Pereira, V. L., Fernandes, J. O., Cunha, S. C. Comparative assessment of three cleanup procedures after QuEChERS extraction for determination of trichothecenes (type A and type B) in processed cereal-based baby foods by GC-MS. Food Chem. 182, 143-149 (2015).
- Tuzimski, T., Szubartowski, S. Method development for selected bisphenols analysis in sweetened condensed milk from a can and breast milk samples by HPLC-DAD and HPLC-QqQ-MS: Comparison of sorbents (Z-SEP, Z-SEP Plus, PSA, C18, chitin and EMR-lipid) for clean-up of QuEChERS extract. Molecules. 24 (11), 2093 (2019).
- Łozowicka, B., Rutkowska, E., Jankowska, M. Influence of QuEChERS modifications on recovery and matrix effect during the multi-residue pesticide analysis in soil by GC/MS/MS and GC/ECD/NPD. Environ Sci Pollut Res. 24 (8), 7124-7138 (2017).
- Schummer, C., Xandonella, I., van Nieuwenhuyse, A., Moris, G. Epimerization of ergot alkaloids in feed. Heliyon. 6 (6), e04336 (2020).
- Cherewyk, J. E., Grusie-Ogilvie, T. J., Parker, S. E., Blakley, B. R., Al-Dissi, A. M. The impact of storage temperature and time on ergot alkaloid concentrations. Toxins. 15 (8), 497 (2023).
- Silva, &. #. 1. 9. 4. ;., Mateus, A. R., Barros, S. C., Silva, A. S. Ergot alkaloids on cereals and seeds: Analytical methods, occurrence, and future perspectives. Molecules. 28 (20), 7233 (2023).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved