このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
液体クロマトグラフィートラップイオン移動度分析飛行時間型質量分析による食品マトリックス中の制御された麦角アルカロイドの検出
要約
このプロトコルは、最近発表された欧州委員会規則(EU)2023/915に準拠して、食品中の麦角アルカロイドの存在を決定するための検証済みの液体クロマトグラフィー-イオン移動度-高分解能質量分析法を提供します。
要約
イオンモビリティー質量分析(IMS)は、液体クロマトグラフィー-質量分析(LC-MS)ワークフローに統合すると、追加の分離次元として機能します。LC-IMS-MS 分析法は、従来の LC-MS 分析法と比較して、より高いピーク分離、同重体化合物と異性体化合物の分離の向上、S/N 比(S/N)の向上を実現します。IMSは、分析物の同定に別の分子特性、すなわち衝突断面積(CCS)パラメータを提供し、偽陽性の結果を減らします。したがって、LC-IMS-MS 分析法は、食品安全の分野における重要な分析課題(すなわち、複雑な食品マトリックス中の微量化合物の検出、および同重体および異性体分子の明確な同定)に対処します。
麦角アルカロイド(EA)は、ライ麦、ライコムギ、小麦、大麦、キビ、オート麦などの小粒を含む多種多様な草種を攻撃する真菌によって産生されるマイコトキシンのファミリーです。これらのマイコトキシンの最大レベル(ML)は、欧州委員会規則EC/2023/915に詳述されているように、いくつかの食品で確立されています。この新しい法律には、6つの主要なEAとそれに対応するエピマーが含まれているため、これらの異性体分子を共起を考慮して適切に区別するための効率的な方法論が必要です。
したがって、このプロトコールの目標は、LC-MS ワークフローにおける IMS の統合が異性体 EA の分離にどのように寄与するかを示し、分析法の選択性を高めることです。さらに、分析用標準品の特性評価によるCCSライブラリーの作製により、マイコトキシンの同定の信頼性がどのように向上するかを示しています。このプロトコルは、食品の安全性にIMSを実装する利点を明確に説明するために設計されており、例として穀物中のEAの測定を取り上げます。QuEChERS ベースの抽出とそれに続く LC トラップイオンモビリティー分光法(TIMS)-MS 分析では、ML の 1.5 倍、1 倍、0.5 倍で 0.65 から 2.6 ng/g の定量限界が得られました(ただし、エルゴタミンの回収率は低い)。マトリックス効果はごくわずかでした。
概要
イオンモビリティー質量分析(IMS)は、ますます使用される分析手法になりつつあり、多くの場合、MSワークフローに結合された従来の液体/ガスクロマトグラフィー(LC/GC)に統合された追加の分離次元として提示されます。IMSは、緩衝ガスで満たされた移動度セルに沿って、電界下および大気圧1で分子を分離することからなる。質量電荷比(m/z)と幾何学的コンフォメーションに応じて、イオン化された分子は、移動度セル上を移動するときにバッファーガスと相互作用し、これはイオン移動度(K)パラメータ2 に反映され、次の式で計算されます。
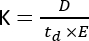
ここで、Dはドリフトの合計長、tdはドリフト時間の合計 、Eは電界 です。したがって、Kはm2 V-1 s-1で測定されますが、実用的な理由から、多くの場合、cm2 V-1 s-1として表されます。移動細胞上を移動する固有の能力は、ドリフト時間によって測定され、後で、IMS装置3とは無関係に各分子の再現性の高いパラメータである、いわゆる衝突断面積(CCS)値に変換することができる。CCS は、次の式に従って移動度から導き出すことができます。
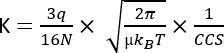
q はイオンの電荷です。 N はバッファガス数密度。 μ 衝突相手の減少した質量はガスイオンを緩衝します。 kB ボルツマン定数。 T は緩衝ガス温度。したがって、IMS は、クロマトグラフィーおよび MS 分析から得られる分析データを補完する追加情報を提供します。
LC-MS プラットホームに IMS を導入すると、特に微量濃度の化合物を扱う場合に、分析測定の信頼性が向上することが示されています。いくつかの研究で、LC-IMS-MS 分析法は、最終的に分析法の感度に影響を与えるバックグラウンドノイズを低減することで質量スペクトルの品質を向上させ、マルチ残留物 LC-MS 分析法による偽陽性および偽陰性の割合を低下させることが報告されています 4,5,6。また、CCS値の再現性により、同一技術を用いた異なる装置間だけでなく、最も利用頻度の高いシステムである進行波イオンモビリティー分光法(TWIMS)、トラップド・イオンモビリティー分光法(TIMS)、ドリフトチューブイオンモビリティー分光法(DTIMS)2,7など、異なるイオンモビリティー技術間の比較も可能となります1.したがって、同定パラメータとしてのCCSの可能性の顕著な結果は、メタボロミクス研究8への適用性に反映されているCCSライブラリの構築の可能性にあります。それにもかかわらず、IMS の最も強力な機能の 1 つは、LC-MS メソッドでは十分に分離できない可能性のある異性体化合物と同重体化合物を分離できることです。これは、複雑なマトリックスで目的の分析種の大規模なセットを扱う場合に当てはまる可能性があり、これは環境分析や食品分析で一般的な状況です。これに関連して、LC-IMS-MS 法は、食品中の農薬、および程度は低いが動物用医薬品およびマイコトキシンのモニタリングのために提案されています9。
LC/GC-IMS-MSプラットフォームは、その高い分離能と選択性により、食品の安全性における現在の課題、特に異性体混合物に関連する課題に対処するための最も有用なツールとして浮上しています。食品汚染物質としての異性体混合物に関連する健康上の懸念は、現在のヨーロッパの法律に反映されており、たとえば、いくつかの食品中の6つの主要な麦角アルカロイド(EA)とそれらに対応する6つのエピマーの最大濃度を制限しています10。
EAは、主にClavicipitaceae科(例えば、Claviceps purpurea、その広い宿主範囲のために最も重要なEA生産者)だけでなく、開花時に生きている植物(ライ麦、大麦、小麦、オート麦など)の種子頭に寄生することができるTrichocomaceaeの広い範囲の真菌によって産生される有毒な二次代謝産物のファミリーを構成します11、12.特定の条件、特に温度と水分活性の下で、クラビセプス菌類は、宿主作物の菌核または麦角として知られる子実体に蓄積するEAを生成する可能性があります。ある程度まで、EAは最終製品に到達するまで原材料の処理に耐えることができます。したがって、食物連鎖に侵入します。汚染された食品の摂取は、腹痛、嘔吐、皮膚の灼熱感、不眠症、幻覚などの急性症状を呈する、エルゴチズムとして知られるEA中毒につながる可能性があります13。EAが人間の健康に与える影響を減らすために、欧州委員会は、主要なEAの合計に対していくつかの食品の最大レベル(ML)を設定しました:R-エピマーエルゴメトリン(Em)、エルゴタミン(Et)、エルゴシン(Es)、エルゴクリスチン(Ecr)、エルゴクリプチン(Ekr)、エルゴコーニン(Eco)およびそれらに対応するS-エピマー:エルゴメトリニン(Emn)、エルゴシニン(Esn)、エルゴタミニン(Etn)、エルゴコルニニン(Econ)、エルゴクリプチニン(Ekrn)、 およびエルゴクリスチニン(Ecrn)。これらの化合物は、特に強い光にさらされたり、長期間保存されたり、高pHまたは低pH 12の一部の溶媒と接触したりすると、R型からS型に、またはその逆にエピマー化する可能性があります。R型とS型の割合は異なる条件下で異なる可能性があるが、EFSA CONTAMパネルは、食品中のEAに関する入手可能な文献を検討した後、S型よりもR型の発生率が高いと報告した14。したがって、MLは、作物の感受性、加工の程度、消費の頻度など、いくつかの要因によって異なります。EUの枠組みでは、大麦、小麦、スペルト小麦、オーツ麦の製粉製品のMLは50または150μg/kg(灰分含有量がそれぞれ900mg/100g未満または高)に設定されていますが、人間が直接消費することを目的としたシリアルは、シリアルベースのベビーフードを除き、150μg/kgのMLの対象となります。 MLが20μg/kg10に減少します。
この厳しい法律により、微量濃度(μg/kg)レベルを決定するのに十分な感度を持つ分析方法論が必要であり、また、汚染されたサンプルには R異 性体と S異性体の両方の形態が一緒に見つかるため、規制対象のEAとそれに対応するエピマーを適切に同定する必要があります。この課題は、各毒素とエピマーのペアが正確に同じ質量とフラグメンテーションパターンを共有しているため、大きな課題を表しています。さらに、両化合物間の適切なクロマトグラフィー分離は複雑になる場合があります。したがって、EA エピマーが食品サンプル中に共起する際の誤定量を避けるために、十分に最適化された LC グラジエントが必要です。EA15、16、17、18 を明確に測定するための LC-MS 分析法はいくつかの研究で報告されていますが、クロマトグラフィーピークを適切に分離して EA を明確に同定するには、クロマトグラフィー分析法を広範囲に研究する必要があります。ただし、これは通常、異なる化学ファミリーに属する汚染物質が同時に測定されるマルチクラスメソッドでは実行可能ではありません。これに関連して、Carbonell-Rozas、Hernández-Mesaらが実施した最近の研究では19 、小麦および大麦サンプル中のEAを定量するためのLC-IMS-MS法が報告されており、再現性のあるCCS値と低定量限界(LOQ)を提供する2つの異なるTWIMS装置を使用して、現行の法律に従って不適合を検出します。したがって、このプロトコールの目標は、LC-MS ワークフローにおける IMS の統合が異性体 EA の分離にどのように寄与するかを示し、分析法の選択性を高めることです。さらに、分析用標準品の特性評価による CCS ライブラリーの作製により、マイコトキシンの同定の信頼性がどのように向上するかを示しています。このプロトコルは、食品中のEAの測定を例にとり、食品安全性分析にIMSを実装する利点を明確に説明するように設計されています。このプロトコルは、QuEChERS手順に基づくサンプル処理、LC-TIMS-MSによるサンプル分析、およびIMSデータの抽出と解釈に対応します。
プロトコル
1. ストック溶液、中間溶液、および作業用標準溶液の調製
注意: ニトリル手袋、白衣、安全メガネを使用してください。
- アセトニトリルを使用して、4 mLの琥珀色ガラスバイアルに10,000 ng/mLの12 EA( 材料表を参照)の個々のストック溶液を調製します。 R型(-ine)は以前は25,000 ngの部分で分注されていましたが、 S型(-inine)は10,000 ngの部分で配布されていました。この試験は、これらのアリコートから開始し、 R型と S型をそれぞれ2.5 mLと1 mLのアセトニトリルで希釈し、続いて2分間ボルテックスすることで10,000 ng/mLの濃度に達しました。
- 12 mLの琥珀色のガラスバイアルに1,000 ng/mLの総EA数(各83.33 ng/mL)の中間原液を調製し、各アルカロイド溶液65 μLとアセトニトリル7.02 mLを加えます。
注:中間原液を調製したら、エピマー化を避けるために、個々の原液を乾燥させ、アルミホイルで覆った-20°Cで保存する必要があります。 - 4 mLの琥珀色のガラス管に2.7、1.8、0.9 mLをピペッティングして、中間ストック溶液から作業用標準溶液を調製します。穏やかな窒素流下で乾燥させ、600μLのアセトニトリルに再懸濁します。
注:得られた濃度は、サンプル1 gに50 μLを添加すると、mL(150 ng / g)の1.5倍、1倍、および0.5倍に達するように確立されました。これらは、バリデーション研究の濃度レベル(すなわち、回収率、再現性など)として選択されます。 - 各作業用標準溶液600 μLを2 mLの琥珀色のガラスバイアル3本に200 μL分をピペッティングして分し、乾燥させます。
注: ステップ 1.2 から 1.4 は、 図 1 で概略的に説明されています。作業標準溶液を分割して乾燥させることにより、EAの化学的完全性を失うことなく、検証研究で必要とされる3つの異なる日に3回強化することが可能です。 - 各バリデーション日に、各強化レベルの2 mLの琥珀色のガラスバイアル1本を200 μLのアセトニトリルに再懸濁します。
注:各強化レベルは、サンプルあたり50μLを使用して3回で評価されます。したがって、合計150μLの溶液が使用されます。
2. 試薬および溶液の調製
注意: ニトリル手袋、白衣、安全メガネを使用してください。
- 24.02 mgの炭酸アンモニウムを秤量し、50 mLの水に溶解して、5 mMの炭酸アンモニウム溶液を調製します。ビーカーに24.02mgの炭酸アンモニウムを秤量し、約5mLの水を加えます。溶液を手動で穏やかに攪拌して炭酸アンモニウムを溶解し、50mLメスフラスコに移します。最終容量の50 mLに達するには、ビーカーを追加の水ですすぎ、上昇をメスフラスコに移します。
- ステップ2.1で調製したアセトニトリル212.5 mLとアンモニウム溶液37.5 mLを混合して、抽出液[アセトニトリル:5 mM 炭酸アンモニウム(85:15, v/v)]250 mLを調製します。
- メタノール:水混合物(1:1、 v / v)100 mLを調製して、サンプル抽出物を再懸濁します(ステップ8.8)。
- 各サンプルについて、150 mgの分散型固相材料C18:ジルコニアベースの吸着剤混合物(1:1、 w / w)を15 mLの遠心分離チューブに秤量し、分散クリーンアップ段階(ステップ8.5)に使用します。
- クロマトグラフィー分離用の溶媒を、0.3%(v/v)ギ酸を含む 1 L の超純水(溶媒 A)とメタノール(溶媒 B)の 2 種類のボトルで調製します。この濃度を達成するために、3.03 mLのギ酸(純度99%)をボトルに添加しました。
注:移動相用の溶媒は、LC-IMS-MS 分析を実行する直前に調製する必要があります。
3. インストゥルメンタルパラメータの設定
注:このLC-IMS-MS研究の実施に使用された装置は、真空絶縁プローブ加熱エレクトロスプレーイオン化(VIP-HESI)源を備えたIM-HRMSと組み合わせたUHPLCでした。装置はポジティブモードで操作されました。
- 分析種を分離するためのアクイジションソフトウェアを使用してクロマトグラフィーメソッドを作成するには、次の溶出グラジエントを設定します:0 分、10% B。2分、10%B;4.5分、40%B;9分、45%B;11分、95%B;12分、95%B;13分、10%B;16分、10%B。
- 移動相の流速を 0.4 mL/min、カラム温度を 35 °C、注入量を 5 μL に設定します。可能であれば、オートサンプラー内の温度を10°Cに固定してください。
- IMSパラメータを次のように設定します:移動度値(1/K0)、0.1〜1.5 V·s/cm2;ランプ時間、100ミリ秒。精度時間、10ミリ秒。デューティサイクル、10%;およびランプレート、9.05 Hz。
- MS検出のイオン源パラメータを次のように設定します:キャピラリー電圧、2,500 V;ネブライザー圧力、2.5バール。乾燥ガス流量、8 L / min;乾燥ガス温度、200°C;シースガス温度、450°C;シースガス流量、4 L/min。MS取得では、2つのスキャンイベントを考慮して、次のパラメータを選択します:m/zが20〜1,300の質量スペクトルの全フルスキャンと、24、36、および50 eVの3つの固定衝突エネルギーで任意のプリカーサーから生成イオンを生成するbbCID(広帯域衝突誘起解離)です。イオン化とデータ取得を正極性モードで実行します。
- この取得方法ファイルを保存して、後で使用します。
4. EA分析標準物質からのデータ取得
注意: ニトリル手袋、白衣、および安全メガネは、手順4.1でのみ使用してください。
- 1,000 ng/mL の中間溶液 500 μL を含む 1.5 mL の琥珀色のバイアル 2 本と、溶媒 A と B の混合物 (1:1、 v/v) を洗浄液として別のバイアルを調製します。
- メーカーの指示に従ってtimsTOF装置を校正し、IMSとMSの両方の取得に対して正の極性を選択します。
- C18カラム( 材料表を参照)をLCオーブン内に入れ、ステップ3.5で保存した取り込みメソッドファイルに示されている温度を35°Cに設定します。
注意: 両端がしっかりと締められていることを確認してください。そうしないと、移動相の漏れが観察されます。 - 移動相の流速が 0.1 mL/min になるように LC カラムを調整し、初期移動相組成比として溶媒 A と B の混合比 90:10(%)を選択します。
- カラム圧力が安定するまで待ちます(~130 bar)。
- 移動相の流量を 0.2 mL/minに増やし、圧力が安定するまで待ってから、再度 0.3 mL/minまで増やします。
- 圧力が再び安定したら、流速を 0.4 mL(ステップ3.5で保存した取得メソッドファイルに詳述されている作業流量)に設定し、圧力が約 350 barで安定するまで待ちます。
注:流量を0.2mL/minから0.4mL/minに直接増やさないことが重要です。フローの強い変化は、クロマトグラフィーカラムに害を及ぼす可能性のある高圧ピークを引き起こします。 - カラムのコンディショニング中に、ステップ 4.1 で示した 1,000 ng/mL の EA 中間溶液を含む 2 つのバイアルに対応する 2 つのサンプルと、洗浄バイアルを含むワークリストを書き込みます。サンプルバッチの開始時と終了時に、洗浄バイアルを2回分析します。
- ワークリストの [メソッドファイル ]列に、ステップ3.5で保存した取得メソッドファイルをロードします。
- 集録したすべてのデータファイルを保存するフォルダを作成し、 サンプルパス 列でフォルダを選択してすべてのサンプルをルーティングします。
注:検証スタディ中に生成されたすべてのファイルを同じフォルダに保存し、さらに処理してください。カラムコンディショニング中、圧力が安定する値はわずかに異なる場合があります。それでも、カラムの完全性を維持するために、流量を再度増やす前に圧力が安定していることを確認してください。さらに、ワーキングフローレートに達した場合、再現性のあるクロマトグラフィー分離を達成するためには、圧力も安定している必要があります。 - ソフトウェアの上部ツールバーに移動し、ワークリストを実行します。
5. 定量法作成のためのデータハンドリング
- ワークリストが実行されたら、定性的なソフトウェアを開きます。
- 分析されたすべてのサンプルをロードするには、[ ファイル] |ワークリストを開きます。
- 1,000 ng/mL の EA 中間溶液に対応するサンプルを右クリックし、[ クロマトグラムの編集]に進み、[ タイプ] |抽出したイオンクロマトグラムに、各EAに関連するプロトン化イオンの理論分子量を入力します。次に、[ 追加]をクリックし、最後に [OK]をクリックします。分析種のセットは、同じ正確な質量を共有する 6 つの EA とそれに関連するエピマーによって形成されるため、6 つの抽出イオンクロマトグラムが表示されます。
注: [幅] パラメータは、 m/z ウィンドウの幅を変更します。目的の分析種のクロマトグラフィーピークを見つけるのが難しい場合に備えて、十分に広い m/z ウィンドウを選択することをお勧めします。ただし、干渉を避けるために、 m/z ウィンドウを狭く設定することをお勧めします(0.05単位未満)。 - 抽出された各イオンクロマトグラムには、メイン EA とそのエピマーに関連する 2 つのクロマトグラフィーピークが表示されます。1つのピークの全領域を選択しながら右クリックします。その結果、イオンモビリティースペクトルがすぐ下にポップアップ表示されます。
- イオンモビリティースペクトルのx軸に移動し、右クリックして、 Collision Cross Sectionをクリックします。CCS 値を書き留めます。
注意: CCS値が自動的に表示されない場合は、上部ツールバーの [キャリブレーション ]に移動し、[ モビリティカリキュレータ]に移動し、モビリティ値を手動で入力して対応するCCSを取得します。 - 同じイオンクロマトグラム内の他のクロマトグラフィーピークに対応する領域を選択し、ステップ 5.4 を繰り返します。および 5.5.
- 同様に、フラグメンテーションパターンもステップ5.4の後に表示されます。文献やデータベースで報告されているフラグメンテーションパターンに基づいて、最も強度の高いプロダクトイオンを比較し、補完的な同定ポイントとして選択します。
- 各EAのメインイオン付加体(通常はプロトン化イオン)の保持時間、CCS値、および正確な質量を書き留めて、定量法を作成します。
- 手順5.4から5.8を繰り返します。残りの分析物用。
- ステップ5.3で生成されたすべての分子質量を 、Ctrlキーを押しながらクリックして選択します。次に、右クリックして[ コピー]を選択します。EAの中間溶液に対応する他のサンプルに移動し、それを右クリックして [貼り付け]を選択します。イオンクロマトグラムと移動度スペクトルは自動的に抽出されます。
- この 2 番目のサンプルに含まれるすべての分析種の同定パラメーターを再確認してください。
6. 麦角アルカロイドの定量のためのデータ処理法の創成
- ソフトウェアを開き、[ メソッド管理 ]タブをクリックします。
- [Analyte settings]をクリックし、各EAの名前と、その保持時間、CCS値、およびステップ5.4で収集されたプロトン化付加物の質量を入力します。5.9に。必要に応じて各識別ポイントの許容誤差を変更しますが、このプロトコルの適用にはデフォルト設定が推奨されます。
注:許容値を設定するほど、理論値からの大きな偏差が許容されるため、誤検出に対処する可能性が高くなります。同様に、許容値が厳しすぎると、偽陰性が発生する可能性があります。これは、理論値からの逸脱が機器の性能のみによって引き起こされる場合に発生します。 - さらに使用するために、定量メソッドを保存します。
7. サンプリング
- 小麦とオート麦のサンプルは、欧州委員会によって確立されたサンプリングのガイドラインに従って、できれば1kgの容器で、スーパーマーケットで取得します20。1 kgのパッケージが利用できない場合は、全体の分析を完了するために、少なくとも50 gのサンプルがあることを確認してください。
- グラインダーを使用してサンプルを粉砕します。この研究では、ブレードグラインダーを使用してパッケージの全内容物をフライス加工し、その後、均質化のために元のパッケージに戻しました。
注意: グラインダーを徹底的に清掃しますampクロスコンタミネーションを避けるためにampファイル。白衣を使用してください。 - 均質化したサンプルを50 mLの遠心分離チューブに分注し、低温で乾燥した状態で保管します。
8. サンプル調製
- 連続しない3日間の検証試験を実施するスケジュールを準備します(社内の再現性を評価するため)。毎日、225 ng/g(1.5 mL)、150 ng/g(ML)、75 ng/g(0.5 mL)でサンプルを強化して、3つの濃度レベルをアッセイします。各レベルを 3 回に分けて学習し、1 日あたり 9 つのスパイク サンプルと 3 つのブランク サンプルを表します。
注:3日間の検証日を考慮すると、合計36個のサンプルと、マトリックスマッチド検量線の準備を目的とした別の8個のブランクサンプルが必要になります。プロトコルのこのセクション全体に、ニトリル手袋、白衣、および安全メガネを使用してください。 - 1 gのサンプルを50 mLの遠心チューブに秤量します。
注:バリデーション研究を実施するときは、ステップ1.3で詳述した対応する作業標準溶液50μLで秤量した直後にサンプルを強化します。および1.5。 - 抽出液[アセトニトリル:5 mM炭酸アンモニウム水溶液(85:15, v/v)]を4 mL加えます。サンプルを1分間ボルテックスします。
- サンプルを9,750 × g 、4°Cで5分間遠心分離します。
注:遠心分離機の容量が手順の制限要因となる可能性があるため、遠心分離機に収まる正確な数のサンプルのみを同時に抽出することをお勧めします。 - 全体の上清を、150 mgのクリーンアップ吸着剤(1:1、 w / w)混合物を含む15 mLの遠心分離チューブに移します。.サンプルを1分間ボルテックスします。
- チューブを9,750 × g 、4°Cで5分間遠心分離します。
- 上清を集め、4mLの琥珀色のガラス瓶に入れます。抽出物を穏やかな窒素の流れの下で蒸発させます。
注:サンプルを同日に分析しない場合は、-20°Cで乾燥させておく必要があります。 - サンプルをメタノール:水(1:1、 v / v)混合物の750μLに再構成します。
- 抽出物を2 mLシリンジに移し、0.22 μmナイロンフィルターでろ過し、1.5 mLの琥珀色のクロマトグラフィーバイアルに入れます。
- マトリックスマッチド検量線用の8つのブランクサンプルの再溶解抽出物を12 mLの琥珀色のガラスバイアルに集めます(各サンプルを750 μLに再懸濁し、合計容量は6 mLに相当します)。
- 1 mLの中間溶液を1,000 ng/mL(麦角アルカロイドごとに83.33 ng/mL)(ステップ1.2)で2 mLの琥珀色のガラスバイアルにピペットで移し、穏やかな窒素の流れで溶媒を乾燥させ、以前に収集したブランクサンプル抽出物1 mLに再懸濁します。
注:この混合物を1,000 ng/mL(各EAで83.33 ng/mL)の濃度で調製し、マトリックスマッチド検量線を調製します。 - 2 mLの琥珀色のガラスバイアルを10本調製し、それぞれに450 μLのブランクサンプル抽出物(ステップ8.10)を入れ、1から10までの数字で印を付けます。各バイアルは、検量線の点になります。
注:このプロトコルでは、LCデバイスがインサートを使用せずにバイアル内に到達できる最低値であったため、450μLを使用しました。針がバイアルの奥まで届かない場合は、容量を増やし、その結果、各サンプルが750 μLのメタノール:水(1/1、 v:v)混合物に再懸濁されることを考慮して、抽出する余分なブランクサンプルの数を計算します。 - 段階希釈による検量線を作成します。ステップ8.11で調製した混合物450μLを移します。すでに 450 μL のブランクサンプル抽出物が含まれているバイアル 1 にバイアル 1 に注入すると、濃度は 41.67 ng/mL (最高キャリブレーションポイント) になります。バイアルを2分間ボルテックスします。
注:混合物の量は、各ステップで2回希釈するためにブランクサンプル抽出物の量と一致する必要があります。 - バイアル 1 から 450 μL をバイアル 2 に移し、バイアル 2 にはすでに 450 μL のブランクサンプル抽出物が含まれており、濃度が 20.83 ng/mL (2 番目に高いキャリブレーションポイント) に達します。
- ステップ8.14を繰り返し(つまり、バイアル2からバイアル3へなど)、10個のキャリブレーションポイントが得られるまで続けます。各 EA の濃度範囲は、41.67、20.83、10.42、5.21、2.60、1.30、0.65、0.33、0.16、および 0.08 ng/mL になります。
- ステップ 8.11 で詳述したように、1,000 ng/mL(各 EA あたり 83.33 ng/mL)の標準混合物を調製しますが、1 mL のメタノール:水(1:1、 v/v)混合物を使用します。
- ステップ8.13から8.15で詳述した標準検量線を調製しますが、段階希釈には450 μLのメタノール:水(1:1、 v / v)混合物を使用します。この検量線は、マトリックスマッチド検量線と比較することにより、マトリックス効果を評価するために使用されます。
9. 定量的なデータの取り扱い
- 手順4.1で説明されている手順に従って、機器を初期化して実行します。4.11に。このプロトコルで使用されるワークリストについては、 図 2 を参照してください。
注:検量線のワークリストを作成するときは、最低濃度から最高濃度までの標準検量線、メタノール:水(1:1、 v/v)を含む洗浄バイアル、および最低濃度から最高濃度までのマトリックスマッチド検量線から始めて、強化サンプルの前に検量線を注入します。 - 定量ソフトウェアを開き、 TASQクイック タブに移動します|左下にある バッチをインポートし ます。
- 手順4.10で作成したフォルダを選択します。すべての生データ(ワークリストに含まれるすべてのサンプルについて、LC-IMS-MS分析後に取得した情報に関連するファイル)が含まれています。
- ソフトウェアにインポートしたら、インポートバッチのすぐ下にあるプロセスバッチに移動します。
- 処理するサンプル(つまり、27個のスパイクサンプル、9個のブランク、および両方の検量線)と、ステップ6.1で以前に作成したデータ処理方法を選択します。6.3 に。ウィンドウがポップアップ表示され、設定するさまざまなパラメーター(クロマトグラフィーピークを評価するインテグレーターのタイプや、考慮すべき分析シグナルのタイプなど)が表示されます。これらのパラメーターは必要に応じて変更しますが、デフォルト値はこのプロトコルの実行に適しています。
- データ解析の完了後に レビュースクリーニング に進み、互いに近すぎる可能性のある誤ったクロマトグラフィーピークの選択など、自動波形解析に関連する問題がないか確認してください。その場合は、定量分析法ファイルで最初に設定された保持時間許容誤差、CCS 値許容誤差、質量誤差を参照して値を絞り込み、データを再解析します。自動ピーク波形解析で誤ったピークが選択される場合は、 レビュースクリーニング ウィンドウに表示されるクロマトグラムの領域を選択して、手動でピークを波形解析します(これを行うには、セクション 5 の EA 標準試料について得られた分析パラメーターを考慮に入れます)。
注:一部の主要なEAとエピマーのペアは非常に類似した保持時間を持ち、ソフトウェアによって誤識別される可能性があるため、各サンプルを確認することは非常に重要です。 - すべてのサンプルについてすべてのピークが正常に統合されたら、左上隅の [Batch management]タブ をクリックし、各分析に関連するサンプルのタイプ(溶媒、ブランク、品質管理、サンプル、またはキャリブレーションポイント)を指定します。後者の場合は、各キャリブレーションポイントを番号付きのレベルに割り当てます。
- 同じ [バッチ管理 ] タブで、[ バッチ濃度 ] という下部のウィンドウに移動し、前の手順で設定した各レベルの濃度値を指定します。これが完了したら、[ Save concentrations]をクリックします。
- [バッチの定量化]をクリックし、必要に応じてパラメータを変更します(つまり、キャリブレーションデータに適合するモデル、重み付け、モデルがゼロを交差させることが強制されているかどうかなど)。デフォルト値は、1/x に切り替えられた検量線の重み付けを除き、このプロトコルの実行に適しています。
注:ソフトウェアは一度に1つの検量線しか考慮できないため、標準検量線とマトリックスマッチド検量線に関する情報を得るためには、手順9.9を2回繰り返す必要があります。このプロトコルでは、マトリックスマッチド検量線を分析種の定量に使用したため、最初に溶媒検量線を評価し、ステップ9.13で後述するようにキャリブレーションデータを抽出し、最後にサンプルの定量を行うためにマトリックスマッチド検量線を選択しました。 - 麦角アルカロイドの定量が定量メソッドファイルに従って実行されたら、画面上部の [定量 ]タブをクリックします。
- 手順9.9で設定したデフォルトのパラメータで良好な線形性と精度が得られない場合は、グラフ上で右クリックしてフィッティングと重みを変更して検量線を調整し、各キャリブレーションレベル(偏差が20%未満)で適切な精度を持つ良好な線形モデル(R2 > 0.99)が得られるようにします。
注意: ソフトウェアは、適切な精度を提供しないキャリブレーションレベルのセルを赤でマークします。 - 終了したら、画面の左端にあるバッチフォルダを右クリックして、[ レポートの生成]を選択します。次に、[ Analyte quantitation ]を選択して、レポートを目的の形式にエクスポートします。
結果
まず、作業用標準溶液を LC-IMS-MS 装置に注入して、ここで分析した各 EA のすべての同定特徴(保持時間、CCS、質量スペクトル)を取得しました。正確な質量を除く同定パラメータは最初は不明であったため、取得方法は、全質量スペクトルのフルスキャンから始まり、その後にbbCIDを行う2回のスキャンイベントに基づいていました。この研究に取り組むレトロスペクテ?...
ディスカッション
このプロトコルの使用が成功したのは、大麦や小麦などの複雑な食品マトリックスからEAを抽出するのに十分な効果を持つ抽出溶媒の使用と、比較的低いSSE値を提供するクリーンアップを実装したCarbonell-Rozasら17によって以前に実施された抽出手順の最適化に基づいています。抽出溶媒の選択は、分析種の化学的特性とEAの分解およびエピマー化に対...
開示事項
著者には、開示すべき利益相反はありません。
謝辞
本研究は、Consejería de Universidad, Investigación e Innovación - Junta de Andalucía (PROYEXCEL_00195) と、バレンシア州政府およびEuropean Social Fund+(CIAPOS/2022/049)のポスドク助成金から資金提供を受けました。著者らは、このプロトコルで使用される分析機器へのアクセスを提供してくれたグラナダ大学の「Centro de Instrumentación Científica(CIC)」に感謝します。
資料
| Name | Company | Catalog Number | Comments |
| Acetonitrile | VWR | 83640.32 | |
| Amber glass tubes 4 mL | VWR | 548-0052 | |
| Amber glass tubes 12 mL | VWR | 548-0903 | |
| Amber vials 1.5 mL | Agilent | 5190-9063 | |
| Ammonium carbonate | Fluka | 9716 | |
| Analytical balance BAS 31 | Boeco | 4400519 | |
| Balance CP 323 S | Sartorius | 23-84182 | |
| C18 | Supelco | 52604-U | |
| Centrifuge tubes, 15 mL | VWR | 525-1082 | |
| Centrifuge tubes, 50 mL | VWR | 525-0155 | |
| Centrifuge Universal 320 R | Hettich | 1406 | |
| Compass HyStar | Bruker | Acquisition software | |
| DataAnalysis | Bruker | Qualitative software | |
| Elute PLUS UHPLC | Bruker | ||
| EVA EC-S evaporator | VLM | V830.012.12 | |
| Formic acid GR for analysis ACS, Reag. Ph Eur | Merck | 100264 | |
| Grinder TitanMill300 | Cecotec | 1559 | |
| Methanol | VWR | 83638.32 | |
| Milli-Q water purification system (18.2 MΩ cm) | Millipore | ZD5211584 | |
| Pipette tips 1- 5 mL | Labortecnic | 162005 | |
| Pipette tips 100 - 1000 µL | Labortecnic | 1622222 | |
| Pipette tips 5 - 200 µL | Labortecnic | 162001 | |
| Pippette Transferpette S variable, DE-M 10 - 100 µL | BRAND | 704774 | |
| Pippette Transferpette S variable, DE-M 100 - 1000 µL | BRAND | 704780 | |
| Pippette Transferpette S variable, DE-M 500 - 5000 µL | BRAND | 704782 | |
| Syringe 2 mL | VWR | 613-2003 | |
| Syringe Filter 13 mm, 0.22µm | Phenomenex | AF-8-7707-12 | |
| TASQ | Bruker | Quantitative software | |
| timsTOFPro2 IM-HRMS | Bruker | ||
| Vortex Genie 2 | Scientific Industries | 15547335 | |
| Zorbax Eclipse Plus RRHD C18 column (50 x 2.1 mm, 1.8 µm particle size) | Agilent | 959757-902 | |
| Z-Sep+ | Supelco | 55299-U | Zirconia-based sorbent |
| Ergot alkaloids | CAS registry sorbent | ||
| Ergocornine (Eco) | Techno Spec | E178 | 564-36-3 |
| Ergocorninine (Econ) | Techno Spec | E130 | 564-37-4 |
| Ergocristine (Ecr) | Techno Spec | E180 | 511-08-0 |
| Ergocristinine (Ecrn) | Techno Spec | E188 | 511-07-9 |
| Ergokryptine (Ekr) | Techno Spec | E198 | 511-09-1 |
| Ergopkryptinine (Ekrn) | Techno Spec | E190 | 511-10-4 |
| Ergometrine (Em) | Romer Labs | "002067" | 60-79-7 |
| Ergometrinine (Emn) | Romer Labs | LMY-090-5ML | 479-00-5 |
| Ergosine (Es) | Techno Spec | E184 | 561-94-4 |
| Ergosinine (Esn) | Techno Spec | E194 | 596-88-3 |
| Ergotamine (Et) | Romer Labs | "002069" | 113-15-5 |
| Ergotaminine (Etn) | Romer Labs | "002075" | 639-81-6 |
参考文献
- Kanu, A. B., Dwivedi, P., Tam, M., Matz, L., Hill, H. H. Ion mobility-mass spectrometry. J Mass Spectrom. 43 (1), 1-22 (2008).
- Gabelica, V., et al. Recommendations for reporting ion mobility Mass spectrometry measurements. Mass Spectrom Rev. 38 (3), 291-320 (2019).
- Feuerstein, M. L., et al. Comparability of steroid collision cross sections using three different IM-HRMS technologies: An interplatform study. J Am Soc Mass Spectrom. 33 (10), 1951-1959 (2022).
- Regueiro, J., Negreira, N., Berntssen, M. H. G. Ion-mobility-derived collision cross section as an additional identification point for multiresidue screening of pesticides in fish feed. Anal Chem. 88 (22), 11169-11177 (2016).
- Regueiro, J., Negreira, N., Hannisdal, R., Berntssen, M. H. G. Targeted approach for qualitative screening of pesticides in salmon feed by liquid chromatography coupled to traveling-wave ion mobility/quadrupole time-of-flight mass spectrometry. Food Control. 78, 116-125 (2017).
- Hernández-Mesa, M., Monteau, F., Le Bizec, B., Dervilly-Pinel, G. Potential of ion mobility-mass spectrometry for both targeted and non-targeted analysis of phase II steroid metabolites in urine. Anal Chim Acta: X. 1, 100006 (2019).
- George, A. C., et al. Interplatform comparison between three ion mobility techniques for human plasma lipid collision cross sections. Anal Chim Acta. 1304, 342535 (2024).
- Mairinger, T., Causon, T. J., Hann, S. The potential of ion mobility-mass spectrometry for non-targeted metabolomics. Curr Opin Chem Biol. 42, 9-15 (2018).
- Hernández-Mesa, M., Escourrou, A., Monteau, F., Le Bizec, B., Dervilly-Pinel, G. Current applications and perspectives of ion mobility spectrometry to answer chemical food safety issues. TrAC Trend Anal Chem. 94, 39-53 (2017).
- European, C. Commission Regulation (EU) 2023/915 of 25 April 2023 on maximum levels for certain contaminants in food and repealing Regulation (EC) No 1881/2006. Off J Eur Union. 119, 103-157 (2023).
- Carbonell-Rozas, L., et al. Occurrence of egot alkaloids in major and minor cereals from Northern Italy: A three harvesting years scenario. J Agricl Food Chem. 71 (42), 15821-15828 (2023).
- Arroyo-Manzanares, N., Gámiz-Gracia, L., García-Campaña, A. M., Diana Di Mavungu, J., De Saeger, S., Jean-Michel Mérillon, J. -. M., Ramawat, K. G. . Fungal Metabolites. , (2016).
- van Dongen, P., de Groot, A. History of ergot alkaloids from ergotism to ergometrine. Eur J Obstet Gynecol Reprod Biol. 60 (2), 109-116 (1995).
- European Food Safety Authority. Human and animal dietary exposure to ergot alkaloids. EFSA J. 15 (7), e04902 (2017).
- Nam, M., Kim, D., Kim, M. -. S. Simultaneous determination of total ergot alkaloids in wheat flour by Orbitrap mass spectrometry. Food Chem. 441, 138363 (2024).
- García-Juan, A., León, N., Armenta, S., Pardo, O. Development and validation of an analytical method for the simultaneous determination of 12 ergot, 2 tropane, and 28 pyrrolizidine alkaloids in cereal-based food by LC-MS/MS. Food Res Int. 174 (Pt 1), 113614 (2023).
- Carbonell-Rozas, L., Mahdjoubi, C. K., Arroyo-Manzanares, N., García-Campaña, A. M., Gámiz-Gracia, L. Occurrence of ergot alkaloids in barley and wheat from Algeria. Toxins. 13 (5), 316 (2021).
- Carbonell-Rozas, L., Gámiz-Gracia, L., Lara, F. J., García-Campaña, A. M. Determination of the main ergot alkaloids and their epimers in oat-based functional foods by ultra-high performance liquid chromatography tandem mass spectrometry. Molecules. 26 (12), 3717 (2021).
- Carbonell-Rozas, L., et al. Ion mobility-mass spectrometry to extend analytical performance in the determination of ergot alkaloids in cereal samples. J Chromatogr A. 1682, 463502 (2022).
- European Commission. Commission Implementing Regulation (EU) 2023/2782 of 14 December 2023 laying down the methods of sampling and analysis for the control of the levels of mycotoxins in food and repealing Regulation (EC) No 401/2006. Off J Eur Union. , (2023).
- Carbonell-Rozas, L., Vander Cruyssen, L., Dall'Asta, C., Leggieri, M. C., Battilani, P. Fit-for-purpose method development to determine co-occurring multiclass mycotoxins in apple and apple puree samples. Food Anal Methods. 16 (8), 1403-1412 (2023).
- Laouni, C., et al. Emerging mycotoxin occurrence in chicken feed and eggs from Algeria. Mycotoxin Res. 40, 447-456 (2024).
- Ben Hassouna, K., et al. Mycotoxin occurrence in milk and durum wheat samples from Tunisia using dispersive liquid-liquid microextraction and liquid chromatography with fluorescence detection. Toxins. 15 (11), 633 (2023).
- Narváez, A., et al. Occurrence and exposure assessment of mycotoxins in ready-to-eat tree nut products through ultra-high performance liquid chromatography coupled with high resolution Q-orbitrap mass spectrometry. Metabolites. 10 (9), 344 (2020).
- Arroyo-Manzanares, N., Rodríguez-Estévez, V., García-Campaña, A. M., Castellón-Rendón, E., Gámiz-Gracia, L. Determination of principal ergot alkaloids in swine feeding. J Sci Food Agric. 101 (12), 5214-5224 (2021).
- Pereira, V. L., Fernandes, J. O., Cunha, S. C. Comparative assessment of three cleanup procedures after QuEChERS extraction for determination of trichothecenes (type A and type B) in processed cereal-based baby foods by GC-MS. Food Chem. 182, 143-149 (2015).
- Tuzimski, T., Szubartowski, S. Method development for selected bisphenols analysis in sweetened condensed milk from a can and breast milk samples by HPLC-DAD and HPLC-QqQ-MS: Comparison of sorbents (Z-SEP, Z-SEP Plus, PSA, C18, chitin and EMR-lipid) for clean-up of QuEChERS extract. Molecules. 24 (11), 2093 (2019).
- Łozowicka, B., Rutkowska, E., Jankowska, M. Influence of QuEChERS modifications on recovery and matrix effect during the multi-residue pesticide analysis in soil by GC/MS/MS and GC/ECD/NPD. Environ Sci Pollut Res. 24 (8), 7124-7138 (2017).
- Schummer, C., Xandonella, I., van Nieuwenhuyse, A., Moris, G. Epimerization of ergot alkaloids in feed. Heliyon. 6 (6), e04336 (2020).
- Cherewyk, J. E., Grusie-Ogilvie, T. J., Parker, S. E., Blakley, B. R., Al-Dissi, A. M. The impact of storage temperature and time on ergot alkaloid concentrations. Toxins. 15 (8), 497 (2023).
- Silva, &. #. 1. 9. 4. ;., Mateus, A. R., Barros, S. C., Silva, A. S. Ergot alkaloids on cereals and seeds: Analytical methods, occurrence, and future perspectives. Molecules. 28 (20), 7233 (2023).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved