Method Article
العدوى التجريبية للفئران بالديدان الخيطية الطفيلية Strongyloides ratti
In This Article
Summary
Strongyloides ratti هي ديدان خيطية طفيلية تسبب التهابات عابرة في فئران المختبر ، وتظهر مراحل هجرة الأنسجة والحياة المعوية. هنا ، نقدم بروتوكولا للحفاظ على دورة الطفيليات في الفئران والعدوى التجريبية للفئران ، بما في ذلك القياس الكمي للطفيليات في الرأس والرئة والأمعاء.
Abstract
Strongyloides ratti هي ديدان خيطية طفيلية تصيب الفئران البرية بشكل طبيعي. ومع ذلك ، فإن معظم سلالات الفئران والفئران المختبرية معرضة تماما للعدوى. تنهي الفئران ذات الكفاءة المناعية BALB / c و C57BL / 6 عدوى المكورات العنقودية الفئران في غضون شهر في سياق الاستجابة المناعية من النوع 2 المتعارف عليها وتظل شبه مقاومة لإعادة العدوى. ويمكن تقسيم مسار العدوى إلى ثلاث مراحل: (أ) مرحلة هجرة الأنسجة ليرقات المرحلة الثالثة المعدية خلال اليومين الأولين؛ (ب) مرحلة هجرة الأنسجة في المرحلة الثالثة المعدية خلال اليومين الأولين؛ (ب) مرحلة هجرة الأنسجة في المرحلة الثالثة المعدية خلال اليومين الأولين؛ (ب) مرحلة هجرة الأنسجة في المرحلة الثالثة المعدية خلال اليومين الأولين؛ (ب) مرحلة هجرة الأنسجة في المرحلة الثالثة المعدية خلال اليومين الأولين؛ (ب) (ب) المرحلة المعوية المبكرة، بما في ذلك طرح الطفيليات البالغة والاندماج في الغشاء المخاطي للأمعاء في الأيام من 3 إلى 6 بعد العدوى مع بدء التكاثر في اليوم 5 إلى 6 بعد العدوى؛ (ج) المرحلة المعوية اللاحقة التي تنتهي بإزالة الطفيليات تماما. تتيح العدوى التجريبية للفئران المكورات العنقودية الفئران من الدراسة الدقيقة للتفاعلات بين الطفيليات المضيفة طوال دورة الحياة بأكملها في مواقع العدوى المختلفة ، بالإضافة إلى استراتيجيات التهرب المناعي التي يستخدمها الطفيلي. يصف البروتوكول المقدم هنا الحفاظ على الطفيلي في فئران الويستار ، وإصابة فئران المختبر ، والكشف عن طفيليات S . ratti وقياسها في مرحلة هجرة الأنسجة وأثناء المرحلة المعوية.
Introduction
تسبب الديدان الطفيلية المنقولة عن طريق التربة Strongyloidisis داء القوى ، وهو مرض يشار إليه غالبا على أنه الأكثر إهمالا بين أمراض المناطق المدارية المهملة1. تشير التقديرات من عام 2020 إلى 600 مليون إصابة ب S. stercoralis في جميع أنحاءالعالم 2. الأبحاث المعملية المستندة إلى الفرضيات على S. stercoralis محدودة لأن الديدان الطفيلية غير قادرة على التطور بعد يرقات المرحلة الثالثة (L3) في الفئران3،4. ومن ثم ، فإن الديدان الخيطية الخاصة بالقوارض Strongyloides ratti تستخدم بشكل شائع في دراسات العدوى في الجسم الحي في فئران المختبر5،6. S. ratti هو طفيلي طبيعي للفئران البرية ، لكن معظم سلالات الفئران المختبرية معرضة تماما للعدوى7. يتيح ذلك دراسة التفاعل بين المضيف والممرض والاستجابات المناعية في جميع أنحاء الأنسجة المختلفة والمراحل الحية من الديدان الطفيلية.
يمكن تقسيم الدورة المختبرية ل S. ratti في الفئران إلى ثلاث مراحل رئيسية. بعد الحقن تحت الجلد لعدد محدد من يرقات المرحلة الثالثة المعدية (iL3) ، عادة من 1000 إلى 2000 ، تهاجر غالبية (حوالي 90٪) من L3 الباقية على قيد الحياة إلى رأس الفئران خلال اليومين الأولين من الإصابة ، ويتم استرداد جزء صغير جدا فقط (حوالي 10٪) في الرئة8. S. ratti يخترق بنشاط جلد مضيف القوارض. من الممكن تقليد مسار العدوى الطبيعي هذا في المختبر عن طريق وضع قطرة ماء تحتوي على iL3 على جلد الفئران والسماح بالعدوى النشطة عن طريقالجلد 9. ومع ذلك ، فإن فعالية العدوى أقل بكثير ، ولا يمكن التحكم في جرعة العدوى الدقيقة. لا يزال مسار الهجرة الدقيق الذي يسلكه S. ratti iL3 ، إما بعد العدوى عن طريق الجلد أو تحت الجلد (s.c.) ، غير معروف. ومع ذلك ، نظرا لعدم وجود الحمض النووي ل S. ratti لا يمكن الكشف عنه في الدم أو الأعضاء المزودة جيدا بالدم ، مثل كليتي الفئرانالمصابة 8 ، فقد لا يشمل طريق الهجرة الأساسي مجرى الدم. ومع ذلك ، فإن S. ratti لا يهاجر بشكل عشوائي في جميع أنحاء الأنسجة. بدلا من ذلك ، فإن العديد من الدراسات التي تستخدم علم الأنسجة في الفئران3،10 والجرذان11 أو القياس الكمي للحياةL3 و S. الحمض النووي المشتق من الراتي المستخرج من الأنسجةالمختلفة 8 تقدم دليلا على أن S. ratti L3 يهاجر من موقع العدوى مباشرة عبر الجلد والأنسجة العضلية في الغالب إلى المنطقة الأنفية الأمامية للرأس.
ما يقرب من 10٪ من اليرقات المحقونة تنجو من هجرة الأنسجة وتصل إلى الرأس في الفئران C57BL / 6 و BALB / c التي تعرض أرقام L3 قابلة للمقارنة في أنسجةالرأس 12. يعتقد أن اليرقات تبتلع لتصل إلى الأمعاء بحلول اليوم الثالث بعد الإصابة (p.i). ينحصون في الغشاء المخاطي للأمعاء الدقيقة ، ويذوبون إلى الطفيليات الأنثوية البالغة ، ويبدأون في التكاثر عن طريق التوالد العذري بحلول اليوم 5 إلى اليوم 6 ص 13. يتم إطلاق البيض ، ولكن في الغالب يرقات المرحلة الأولى (L1) ، في الأمعاء ويتم إفرازها بالبراز. يتم الوصول إلى ذروة عدد الإناث البالغات في حوالي اليوم 6 ص 14. ومن المثير للاهتمام أن الفئران C57BL / 6 تعرض عبئا طفيليا معويا أعلى من 2 إلى 5 أضعاف من الفئران BALB / c على الرغم من الأعداد المماثلة من L3 المهاجر للأنسجة في الرأس في كلتا سلالات الفئران12. خلال الأسبوع الأول ، يتشابه عبء الطفيليات المعوية في الفئران C57BL / 6 ذات الكفاءة المناعية والفئران بالضربة القاضية RAG1 (KO) التي تفتقر إلى الخلايا B و T ، مما يشير إلى أن السيطرة المبكرة على الطفيليات يتم التوسط فيها من خلال المناعة الفطرية12،15. في المرحلة الأخيرة ، يتم طرد الطفيليات من الأمعاء في غضون 2 إلى 4 أسابيع في الفئران ذات الكفاءة المناعية (تمت مراجعتها في6). فئران RAG1 KO غير قادرة على التخلص من العدوى وتحتوي على أعداد قليلة من الإناث البالغات القابلة للحياة والتكاثر في الأمعاء الدقيقة لمدة تصل إلى عامواحد و 12.
بعد العدوى الأولى أو التحصين باستخدام L3 المشع ، تكون الفئران ذات الكفاءة المناعية C57BL / 6 و BALB / c شبه مقاومة لإعادة العدوى. فقط 1٪ من iL3 الملقح الأولي يصل إلى الرأس ، ويمكن استرداد ما يقرب من 1-5 طفيليات بالغة فقط من الأمعاء خلال عدوى ثانية8. وبالتالي ، فإن استخدام العدوى المختبرية للفئران ب S. ratti يوفر أداة لدراسة تأثير الجهاز المناعي الفطري والتكيفي خلال دورة الحياة الكاملة للديدان الخيطية المعوية مع مراحل هجرة الأنسجة.
في هذه المخطوطة ، نقدم وصفا مفصلا للحفاظ على دورة حياة S. ratti في فئران الويستار بالإضافة إلى العدوى التجريبية للفئران والقياس الكمي لعبء الطفيلي في مواقع الإصابة المختلفة. من خلال القياس الكمي الدقيق ل S. ratti عبء طفيلي في أنسجة الرأس والرئة وكذلك في أمعاء الفئران التجريبية ، من الممكن تشريح دور بعض المؤثرات المناعية ضد مرحلة الحياة المعوية أو الهجرة للأنسجة لهذه الديدان الخيطية الطفيلية. يمكن مقارنة الاستجابات المناعية في الفئران والفئران البرية التي تفتقر إلى خلايا مستجيبة مناعية محددة أو مستقبلات أو وسطاء محل اهتمام كما هو موضح بالتفصيل في المناقشة5،6.
Protocol
أجريت التجارب على وفقا لقانون رعاية الألماني ، وتمت الموافقة على البروتوكولات التجريبية من قبل السلطة الألمانية (Behörde für Gesundheit und Verbraucherschutz) في ولاية هامبورغ. يقدم الشكل 1 لمحة عامة عن الحفاظ على دورة حياة S. ratti في فئران الويستار وإنتاج iL3 لإصابة الفئران أو الفئران التجريبية.
1. تحضير اليرقات المعدية
- قم بإعداد جهاز Baermann كما هو موضح في الشكل 1. أغلق الجزء السفلي من الخرطوم بمشبك بزاوية مائلة وضع مناديل في المنخل. املأ بالماء الفاتر (حوالي 35-37 درجة مئوية) حتى يتم تغطية المنخل بالماء.
- املأ المنخل بمزيج البراز والفحم المحضر كما هو موضح أدناه (الخطوة 6). يجب تغطية المزيج بالكامل بالماء.
- قم بتشغيل الضوء خلف جهاز Baermann مباشرة. سوف ينتقل تطبيق iL3 بنشاط من خلال المسح.
- بعد 30 دقيقة ، استقرت اليرقات فوق المشبك ، اجمعها في أنبوب سعة 50 مل عن طريق فتح المشبك قريبا. اجمع الحبيبات بأكملها, ولكن تأكد من أن الحجم صغير قدر الإمكان.
- املأ الأنبوب سعة 50 مل ب PBS الذي يحتوي على 1٪ Penicillin-Streptomycin (PBS / Pen-Strep) واترك اليرقات تستقر في قاع الأنبوب عن طريق الجاذبية عند 4 درجات مئوية لمدة 30 دقيقة. قم بإزالة المادة الطافية بعناية باستخدام ماصة وكرر خطوة الغسيل 3x.
- بعد خطوة الغسيل الثالثة ، أعد تعليق الحبيبات في 30 إلى 50 مل PBS / Pen-Strep ، اعتمادا على حجم الحبيبات. انقل 1 ميكرولتر قطرات من المحلول إلى شريحة الفحص المجهري. حرك المحلول مباشرة قبل سحب العينة لأن iL3 يستقر بسرعة.
- افحص القطرات تحت المجهر العكسي بتكبير 40 ضعفا. يجب أن يتحرك iL3 بوضوح. عد iL3 لكل قطرة 1 ميكرولتر في 5 إلى 10 مكررات واحسب المتوسط لكل ميكرولتر.
2. إصابة الفئران
ملاحظة: يمكن تخزين iL3 المحضر في PBS / Pen-Strep عند 4 درجات مئوية في أنبوب سعة 50 مل يجب الاحتفاظ به أفقيا لتجنب إتلاف iL3. الجدوى في المختبر المشار إليها بالحركة الحية ل iL3 لم تتغير لمدة تصل إلى أسبوع واحد في أيدينا. نظرا لعدم وجود مقارنة منهجية لعدوى L3 بعد أوقات تخزين مختلفة ، فإننا نستخدم iL3 المحضر حديثا ومخزن iL3 لمدة أقصاها 24 ساعة بعد التحضير كمعيار داخلي. من الممكن حدوث عدوى بدفعات iL3 القديمة. ومع ذلك ، فمن الضروري استخدام نفس دفعة iL3 لإصابة مجموعات مختلفة في تجربة واحدة. يفضل أن يتم إجراء عدوى الفئران من قبل شخصين ، حيث يمسك شخص بالفأر ويقوم آخر بالحقن.
- قم بإعداد أنبوب طرد مركزي واحد سعة 1.5 مل لكل فأر يحتوي على ما مجموعه 1000 iL3 (C57BL / 6) أو 2000 iL3 (BALB / c) محسوبة كما هو موضح أعلاه في الخطوة 1.7 في PBS / Pen-Strep التي تم إعدادها باستخدام جهاز Baermann كما هو موضح أعلاه (الخطوة 1). قم بتحريك الماصة جيدا بين خطوات سحب العينة حيث يستقر iL3 بسرعة.
- دع iL3 يستقر عن طريق الجاذبية لمدة 20-30 دقيقة في درجة حرارة الغرفة (RT) وشفط المادة الطافية بحقنة 0.5 مل بأكبر قدر ممكن من الاكتمال ، مع ترك حوالي 30 ميكرولتر من تعليق iL3 في الأنبوب. أعد تعليق iL3 بحقنة 0.5 مل (28 جم) أو عن طريق النقر على الأنبوب واستنشاق التعليق المتبقي.
ملاحظة: من غير المرجح أن تلتصق iL3 بالبلاستيك الرطب من المحقنة الجافة. وبالتالي ، من المفيد استخدام نفس المحقنة لخلع المادة الطافية. - لا تحتاج الفئران إلى التخدير للعدوى. التقط الفئران مع القفص وامسك بقدم واحدة مؤخرة من الفئران. استخدم C57BL / 6 للإناث والذكور لأكثر من 8 أسابيع من العمر ووزن لا يقل عن 20 جم. حقن المحلول بالكامل الذي يحتوي على iL3 تحت الجلد في وسادة القدم بزاوية مسطحة. اسحب المحقنة ببطء لتجنب انسكاب تعليق اليرقات من موقع البزل. سوف تتشكل قبة صغيرة جدا تحتوي على السائل. سيتم امتصاص هذا من تلقاء نفسه.
ملاحظة: العدوى تحت الجلد في وسادة القدم بدلا من الجناح أو مؤخرة العنق تحاكي العدوى الطبيعية بواسطة iL3 ، التي تعيش في أرض رطبة مخصبة بالبراز وتخترق الجلد السليم بنشاط. أيضا ، يتم تعريف العقدة الليمفاوية الأولى (LN) على أنها LN المأبضي. يمكن استخدام LN هذا لتحليل التغيرات المناعية المبكرة (أي اليوم 2 p.i) ، على سبيل المثال ، توسع الخلايا التائية التنظيمية Foxp3 + استجابة للعدوى ، كما هو موضح في16.
3. عد iL3 في رأس ورئة الفئران المصابة
- لتحليل عبء اليرقات في الأنسجة ، قم بالتضحية بالفئران في اليوم 1-3 p.i. حيث أن ذروة عبء اليرقات هي في اليوم 2 p.i.8،12. إجراء القتل الرحيم عن طريق جرعة زائدة من ثاني أكسيد الكربون2. بعد غياب القرنية وردود الفعل بين الأصابع ، قم بإجراء خلع عنق الرحم.
- رش البطن والرقبة بمطهر تجاري وقطع الجلد فوق البطن بالمقص. اسحب الجلد للخلف للكشف عن جدار البطن الأمامي واقطع على طول خط الوسط لفتح التجويف البريتوني. قطع الحجاب الحاجز وقطع الضلوع على كلا الجانبين لكشف الرئة في التجويف الجنبي.
- اجمع فصوص الرئة في صفيحة من 24 بئرا مقسومة على خطوط تحتوي على 1 مل من ماء الصنبور. ارسم أو اطبع الخطوط على اللوحة على مسافة حوالي 4 مم. يجب أن تتيح المسافة بين الخطين رؤية كلا الخطين في نفس الوقت بتكبير 40x.
- قطع الرئة بأكملها إلى ست قطع حوالي 0.75 سم × 0.75 سم.
- قطع الرأس بمقص العظام. قم بإزالة الجلد والفراء باستخدام الأصابع. حاول إزالة أقل قدر ممكن من الأنسجة العضلية.
- قم بتشريح الرأس الكامل (بما في ذلك الدماغ والعظام) إلى أربعة أرباع خلف العينين وطوليا عبر منتصف الرأس (انظر الشكل 2 ج). ضع الأرباع الأمامية والخلفية في بئر من صفيحة مكونة من 6 آبار تتميز بخطوط تحتوي على 2 مل من ماء الصنبور. ضع الأنسجة بحيث تكون الجروح متجهة لأسفل في الماء.
ملاحظة: عادة ما يعطي هذا النهج تسجيلا دقيقا لأعداد اليرقات المهاجرة لأنسجة الرأس. إذا كانت هناك حاجة إلى تحليل منفصل لأرقام L3 في الدماغ ، فقد يتم تضمين الخطوة 3.7. - إذا كنت ترغب في إجراء تحليل منفصل للدماغ ، فقم بإزالة الجلد من الرأس باستخدام الأصابع. ثم استخدم المقص لحفر القلنسوة بين العينين. من هذا الشق ، افتح الجزء العلوي من السهمية للجمجمة بمقص غير مستخدم أو نظيف تماما. لفضح الدماغ ، افتح القلنسوة اليمنى واليسرى باستخدام ملقط. استخدم ملعقة لرفع الدماغ من الجانب الأمامي لأعلى ويتم قطع الحبال العصبية بمقص نظيف. قم بإزالة الدماغ وانقله إلى صفيحة مكونة من 24 بئرا تتميز بخطوط تحتوي على ماء الصنبور.
- ضع الأطباق في حاضنة على حرارة 37 درجة مئوية. احتضن لمدة 3 ساعات أثناء تحريك الألواح كل ساعة (ساعة) 10x. بعد الحضانة ، قم بالتدوير مرة أخيرة ، وقم بإزالة أجزاء الأنسجة المتبقية بالملقط من الآبار ، وتخلص من الأنسجة.
- عد تماما كل يرقات في المياه المتبقية في الآبار تحت مجهر مقلوب بتكبير 40 ضعفا عن طريق التحرك على طول الخطوط المرسومة على قيعان الآبار. عد اليرقات المهاجرة للأنسجة في نفس اليوم لزيادة مسؤولية النتائج.
4. عد طفيليات المكورات العنقودية الفئران في أمعاء الفئران المصابة
- لتحليل عبء الطفيليات في الأمعاء ، قم بالتضحية بالفئران في اليوم الذي أهمته ، استخدم اليوم 3-21 p.i. للحصول على حركية كاملة. تبلغ ذروة عبء الطفيليات في الفئران C57BL / 6 و BALB / c داخل الأمعاء الدقيقة في اليوم 6 p.i.14. إجراء القتل الرحيم عن طريق جرعة زائدة من ثاني أكسيد الكربون2 . بعد عدم وجود القرنية وردود الفعل بين الأصابع ، قم بإجراء خلع عنق الرحم.
- انقع منطقة البطن من الفئران في مطهر وقطع الجلد فوق البطن. اسحب الجلد للخلف للكشف عن جدار البطن الأمامي واقطع على طول خط الوسط لفتح التجويف البريتوني.
- قم بإزالة الأمعاء بأكملها عن طريق القطع بين المعدة والاثني عشر القريب ، وكذلك بين القولون وفتحة الشرج (انظر الشكل 3 ب). اسحب الأمعاء برفق بأصابعها وضعها في طبق بتري يحتوي على ماء الصنبور.
- اقطع الأمعاء مفتوحة طوليا واغسل البراز والمخاط عن طريق رجها بقوة في ماء الصنبور لمدة 10 ثوان على الأقل. سيتم غسل جزء بسيط من الطفيليات البالغة وبعض L1 ، ولكن طفيليات L4 والطفيليات العنقودية البالغة قابلة للحياة مغروسة في الغشاء المخاطي للأمعاء في الفئران البرية (WT) ولن تتم إزالتها بخطوة الغسيل هذه.
- إذا كان الأمر مفيدا ، فقم بتقسيم الأمعاء بشكل أكبر كما هو موضح أدناه.
- اعزل الاثني عشر عن طريق شق بعد رقعة باير الثانية (حوالي 2-3 سم). اعزل الدقاق بشقين ، أحدهما في الأول والآخر في رقعة باير الثانية (حوالي 1-2 سم). اعزل الصائم بعد عزل الاثني عشر والدقاق لأن هذا هو القسم المتبقي.
- قسم الصائم إلى ثلاثة أقسام متساوية للسماح بتعريف دقيق للغاية لتوطين الطفيليات. عزل الأع بين الدقاق والقولون. اعزل القولون عن طريق القطع بعد الغيم. يمكن العثور على غالبية الطفيليات البالغة في الثلث الأول من الأمعاء الدقيقة (انظر الشكل 3 ب).
- انقل الأجزاء المعوية التي تم تنظيفها إلى أنابيب سعة 50 مل تحتوي على 20 مل من ماء الصنبور. ضعها أفقيا في حاضنة 37 درجة مئوية لمدة 3 ساعات. رج العبوة بقوة شديدة لمدة 10 ثوان كل ساعة.
- بعد 3 ساعات من الحضانة ، قم بإزالة الأنسجة من الماء. ضع الأنابيب عموديا عند RT ، وترسيب الطفيليات بالجاذبية في 30 دقيقة.
- قم بإزالة المادة الطافية حتى يتبقى حوالي 5 مل من الماء. املأ ما يصل إلى 25 مل بماء الصنبور لتكرار خطوة الغسيل. لتحليل الأمعاء الدقيقة ، كرر خطوة الغسيل هذه مرة أخرى للحصول على رؤية جيدة تحت المجهر.
- عندما يتم تحقيق رؤية جيدة ، قم بشفط المادة الطافية حتى يتبقى حوالي 5 مل من الماء وانقل السائل إلى بئرين لكل أمعاء فأر في صفيحة مكونة من 6 آبار مميزة بخطوط ، كما هو موضح لعد اليرقات في الرأس.
- عد الطفيليات الأنثوية البالغة تحت مجهر مقلوب بتكبير 40 ضعفا عن طريق التحرك على طول الخطوط المرسومة على قيعان الآبار. عد الطفيليات في يوم الضحية. عد الطفيليات في أسرع وقت ممكن ، لأن الحضانة المطولة في الماء ستؤدي إلى موتها وتفككها.
ملاحظة: بالإضافة إلى يرقات المرحلة الرابعة والطفيليات البالغة ، يمكن أيضا اكتشاف L1 هنا من حوالي اليوم 5 p.i. هذه أصغر بكثير وأكثر وفرة من L4 والطفيليات البالغة ويجب تمييزها بسهولة.
5. صيانة S. ratti في فئران الويستار
ملاحظة: يفضل أن يتم إجراء عدوى الفئران من قبل شخصين ، حيث يقوم شخص واحد بممسك الفئران ويقوم آخر بالحقن. للحفاظ على دورة الطفيليات ، تصاب فئران الويستار البالغة من العمر 4-8 أسابيع.
- قم بإعداد أنبوب طرد مركزي واحد سعة 1.5 مل لكل فأر يحتوي على 2500 iL3 في PBS / Pen-Strep باستخدام جهاز Baermann كما هو موضح من قبل. حرك جيدا بين خطوات سحب العينات حيث تستقر اليرقات بسرعة.
- دع اليرقات تستقر عن طريق الجاذبية لمدة 20-30 دقيقة (RT) وشفط المادة الطافية في حقنة 0.5 مل (28 جم) حتى يتبقى حوالي 200 ميكرولتر من تعليق اليرقات.
- بالنسبة للعدوى ، ضع الفئران في ذراع شخص واحد وقم بإصلاح الرأس برفق وبعناية هناك. يمسك الشخص الآخر بلطف بجانب الجرذ ويحقن معلق iL3 المعلق تحت الجلد في الطية القفوية.
6. ثقافة الفحم
- احتجاز الفئران المصابة في أقفاص تحتوي على عدة طبقات من السليلوز وأقل من القمامة بدءا من اليومين 5 و 12 بعد الإصابة. يتم تبادل القمامة لعدة طبقات من السليلوز من أجل تسهيل جمع البراز مقارنة بجمع البراز من القمامة
- في الأيام 6-8 و 13-15 p.i. ، انقل الفئران إلى قفص جديد واجمع كل البراز من القفص القديم عن طريق التقاط حبيبات البراز من الأقفاص بعد نقل الفئران إلى أقفاص جديدة وتجميعها من قفص واحد إلى أنبوب سعة 50 مل. اجمع البراز لمدة أسبوعين من قبل إنشاء الاستجابة المناعية يقلل من عبء اليرقات في البراز. بعد 2 أسابيع p.i. يتم القتل الرحيم للفئران عن طريق جرعة زائدة من ثاني أكسيد الكربون2 الخدير. بعد عدم وجود القرنية وردود الفعل بين الأصابع ، قم بإجراء خلع عنق الرحم.
ملاحظة: الفئران التي تعاني من نقص المناعة والجربوع المنغولية تحافظ على عدوى S. ratti لفترات أطول17،18. دراسة الاستجابة المناعية والتعديل المناعي أثناء عدوى S. ratti ، قررنا الحفاظ على الدورة في المضيفين ذوي الكفاءة المناعية للحفاظ على ضغط اختيار مناعة المضيف السليمة. - استخدم عينات البراز التي تم جمعها لتحضير مزارع الفحم ، مما سيسمح بتطوير iL3 من L1 الموجود في البراز.
- نقع الفحم بماء الصنبور. قبل استخدام الفحم للثقافات ، املأه في غربال واغسله تحت ماء الصنبور الجاري حتى يصبح الماء صافيا. حافظ على رطوبة الفحم في جميع الأوقات. انقع الفحم لمدة 24 ساعة على الأقل قبل الاستخدام.
- امزج البراز مع الفحم المنشط المنقوع مسبقا بنسبة 1: 1 تقريبا. رتبي الخليط بتدرج قطريا وغطيه بطبقة أخرى من الفحم المنشط في دورق زجاجي مسطح للوصول إلى النسبة النهائية 1: 2.
ملاحظة: حضانة البراز بالفحم المنشط المنقوع مسبقا تحاكي التربة الرطبة التي يتطور فيها iL3 في الطبيعة مع منع التلوث الفطري المفرط. - قم بتغطية الوعاء الزجاجي بغشاء شفاف. تأكد من وجود بعض فتحات الهواء للسماح بتدوير الهواء.
- احتضن لمدة 6-7 أيام عند 25 درجة مئوية عند حوالي 90٪ رطوبة بدون ثاني أكسيد الكربون2. تأكد من أن الحاضنة تحتوي على وعاء مائي للحفاظ على رطوبة الثقافات. احتفظ بالمزارع لمدة تصل إلى 14 يوما عند 25 درجة مئوية إذا لزم الأمر. سوف يتطور iL3 إما بشكل مباشر أو غير مباشر19 ويبقى معتقلا في مرحلة iL3 حتى الإصابة.
النتائج
يهاجر S. ratti من موقع العدوى في الغالب إلى الرأس ثم إلى الأمعاء على طريق غير محدد بدقة. للتحقيق في التوطين الدقيق في أنسجة الرأس والأمعاء ، أصيبت الفئران C57BL / 6 ب 1000 iL3 في وسادة القدم الخلفية اليسرى. تم التضحية بالفئران في اليوم 1 إلى اليوم 14 p.i. تم قياس طفيليات الفئران في الرأس الأمامي والخلفي والدماغ والرئة (الشكل 2) وكذلك في الاثني عشر ، الصائم ، الدقاق ، الرأس ، والقولون (الشكل 3).
في اليوم 1 p.i. ، وصل أول L3 إلى الرأس ، مما يدل على توزيع موحد (الشكل 2 أ). بالإضافة إلى ذلك ، تم استرداد جزء صغير من اليرقات في الرئتين في اليوم 1 p.i. (الشكل 2 ب). زادت أرقام L3 بشكل ملحوظ في اليوم 2 ب 1 إلى متوسط 174 L3 ± 13 في الرأس ومتوسط 17 ± 1.7 في الرئة. وبالتالي ، يتم استرداد غالبية L3 (حوالي 90٪) من الرأس وحوالي 10٪ فقط من الرئتين. كانت معظم L3 (متوسط 93 ± 13.3) موضعية في الجانب الأمامي من الرأس ، ولكن أيضا حوالي 41 ± 4.7 L3 كانت اليرقات موضعية في الجانب الخلفي من الرأس وحوالي 39 ± 5.8 في الدماغ. تماشيا مع هذه الملاحظة ، تم الإبلاغ عن وجود L3 في الدماغ والسائل النخاعي عند 24 ساعة في السنة وبحد أقصى عند 48 ساعة في السنة في الفئران C57BL / 6 بعد العدوى عن طريق الجلد20. لوحظ انخفاض واضح في إجمالي أعداد L3 في اليوم 3 p.i. مقارنة بعبء اليرقات في اليوم 2 p.i. ولم يتم استرداد L3 من أنسجة الرأس في اليوم 4 p.i. (الشكل 2 أ). وفقا لذلك ، تم اكتشاف وصول S. ratti الطفيليات في الأمعاء في اليوم 4 p.i. (الشكل 3 أ). للسماح بتعريف دقيق لتوطين الطفيليات ، تم تقسيم الأمعاء إلى أجزاء متميزة ، مثل الاثني عشر ، الصائم ، الدقاق ، القيكوم ، والقولون (الشكل 3 ب). في اليوم 4 ، p.i. ، غالبية S. الطفيليات الفئران تم توطينها في الاثني عشر والثلثين الأولين من الصائم (الشكل 3 أ). كان هذا التوطين ثابتا حتى اليوم 6 مساء. من اليوم 7 p.i. فصاعدا ، غالبية S. الفئران تم توطين البالغين في الرأس ، حيث استمروا حتى اليوم 9 p.i. (الشكل 3 أ). انخفضت أعداد الطفيليات في السيكوم بحلول اليوم 11 سنويا إلى حوالي 20 وإلى 0 بحلول اليوم 14 سنويا. لم نسترد أعدادا كبيرة من الطفيليات من القولون المتبقي في أي نقطة زمنية تم تحليلها باستثناء ما يقرب من 5-11 طفيليا بحلول اليوم 11 دقيقة. بينما توطين المكورات العنقودية الفئران تغير من اليوم 4 إلى اليوم 9 في المائة وتم طرد غالبية البالغين من الأمعاء الدقيقة بعد اليوم 7 ، ظلت الأعداد الإجمالية المسترجعة من الأمعاء كلها ثابتة حتى اليوم 9. لم يتم تحديد كمية L1 القابل للتطبيق ولكن يمكن اكتشافه من اليوم 4 إلى اليوم 11 ، مع ذروته في اليوم 6 (البيانات غير معروضة).
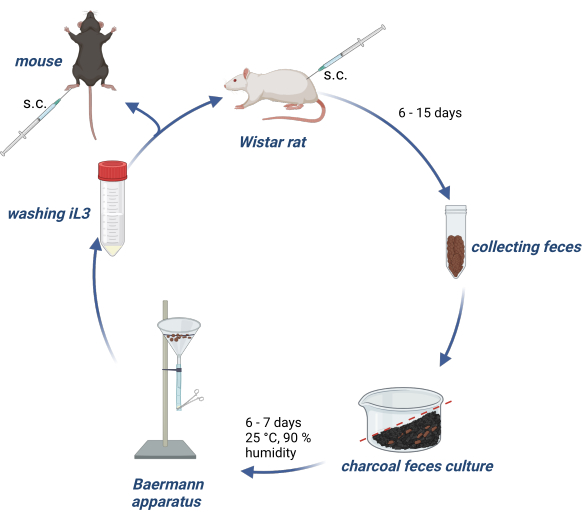
الشكل 1: الحفاظ على S. ratti دورة حياة في الفئران والفئران. يتم حقن فئران الويستار في الطية القفوية ب 2500 iL3. بعد 6-15 يوما ، p.i. يتم جمع برازها ، وخلطها بالفحم المنشط المنقوع بالماء ، مرتبة بتدرج وتغطيتها بغشاء شفاف ، بما في ذلك فتحات الهواء. يتم تحضين هذه الثقافة لمدة 6-7 أيام عند 25 درجة مئوية و 90٪ رطوبة. يتم عزل iL3 باستخدام جهاز Baermann وغسلها 3x باستخدام PBS / Pen-Strep. يتم حقن الفئران التجريبية ب 1000 iL3 تحت الجلد في وسادة القدم الخلفية. تم إنشاؤه باستخدام BioRender.com. تم إنشاء الشكل 1 في BioRender. لينمان ، ل. (2024) https://BioRender.com/g80l370. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
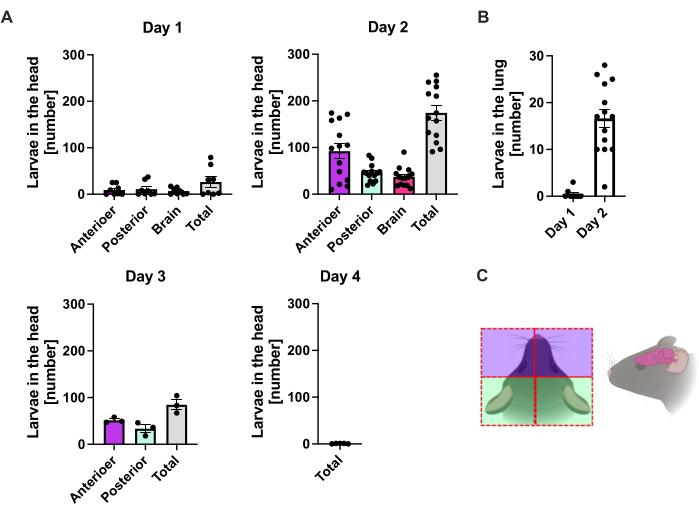
الشكل 2: القياس الكمي ل S. ratti في أنسجة الرئة والرأس بمرور الوقت. تم حقن الفئران C57BL / 6 ب 1000 iL3 في وسادة القدم الخلفية. تم التضحية بالفئران في النقاط الزمنية المحددة ، وتم إحصاء طفيليات S. ratti في الرأس (A) و (B) الرئة. يمثل كل رمز L3 تهم الماوس الفردي. يوضح الرسم البياني الشريطي متوسط القيمة ، وتشير أشرطة الخطأ إلى التسويق عبر محرك البحث. تظهر الرسوم البيانية بيانات مجمعة من التجارب الفردية. اليوم 1: تجربتان مستقلتان مع n = 4 لكل نقطة زمنية وتجربة. اليوم 2: أربع تجارب مستقلة مع n = 4 و n = 4 و n = 6 و n = 3 ؛ اليوم 3: تجربتان مستقلتان مع n = 4 و n = 3 ؛ اليوم 4: تجربة واحدة مع n = 5. (ج) رسم كاريكاتوري تخطيطي يوضح المناطق الفردية من الرأس المستخدمة في العزل. يشير الخط الأحمر المتقطع إلى مسار الشق. تم إنشاء الشكل 2C في BioRender. لينمان ، ل. (2024) https://BioRender.com/t83e660. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
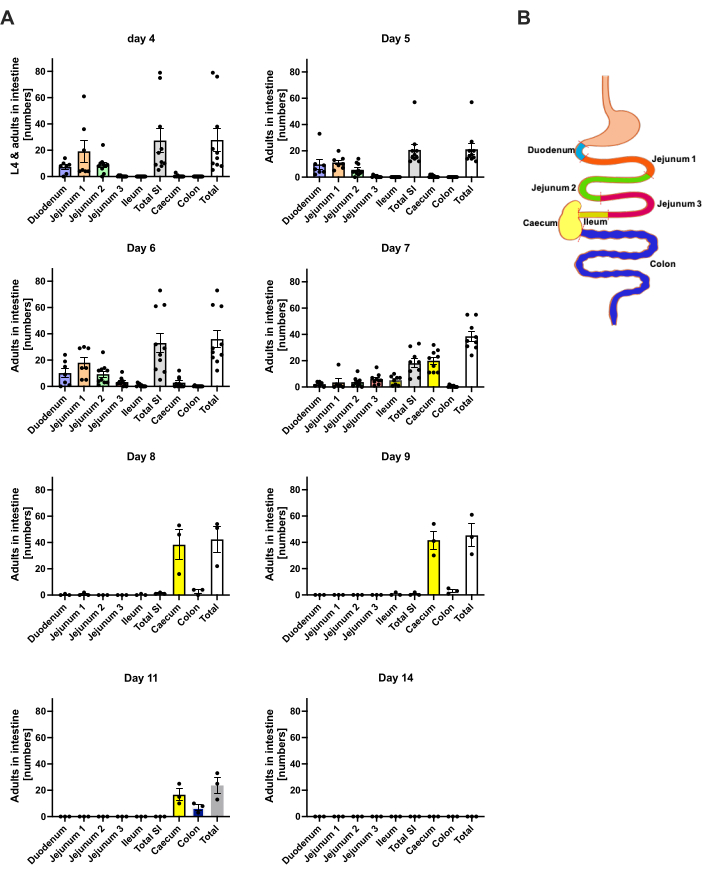
الشكل 3: القياس الكمي للمكورات العنقودية الفئران في مناطق الأمعاء بمرور الوقت. تم حقن ذكور الفئران C57BL / 6 ب 1000 iL3 في وسادة القدم الخلفية. (أ) تم التضحية بالفئران في النقاط الزمنية المحددة ، وتم إحصاء طفيليات S. ratti باستثناء L1 في المناطق التالية: الاثني عشر ، الصائم 1-3 ، الدقاق ، العرق ، والقولون. (ب) نظرة عامة تخطيطية لمناطق الأمعاء المختلفة. يمثل كل رمز عدد الطفيليات للفأر الفردي. يوضح الرسم البياني الشريطي المتوسط ، وتشير أشرطة الخطأ إلى SEM. يظهر البيانات المجمعة من التجارب الفردية. اليوم 4: تجربتان مستقلتان مع n = 4 و n = 6 فئران. اليوم 5: تجربتان مستقلتان مع n = 4 و n = 6 ؛ اليوم 6: تجربتان مستقلتان مع n = 4 و n = 6 ؛ اليوم 7: تجربتان مستقلتان مع n = 6 و n = 3 ؛ الأيام من 8 إلى 14: تجربة واحدة مع n = 3. SI: الأمعاء الدقيقة. تم إنشاء الشكل 3 ب في BioRender. لينمان ، ل. (2024) https://BioRender.com/h27y297. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
تمثل إصابة الفئران التجريبية بالمكورات العنقودية الفئران نموذجا ممتازا لدراسة طبيعة الاستجابات المناعية الوقائية لعدوى الديدان الطفيلية في مواقع ومراحل متعددة من المناعة. باستخدام خطوط فأر KO المختلفة ونماذج استنفاد الخلايا أو السيتوكينات ، يمكن دراسة دور الخلايا المناعية أو الوسطاء أو المستقبلات المحددة في نموذج عدوى الديدان الطفيلية الحادة. توفر إمكانية تحديد عبء الطفيلي في الرأس وكذلك في الأمعاء إمكانية التمييز بين دور الخلايا المناعية والمؤثرات في الأنسجة والمراحل المختلفة خلال دورة حياة الطفيلي. يسمح استنفاد أنواع معينة من الخلايا من خلال حقن الأجسام المضادة بدراسة دورها ، وتحديدا أثناء الاستجابة المناعية المعوية إذا بدأ العلاج المستنفد بعد اكتمال مرحلة هجرة الأنسجة. إذا رغبت في ذلك ، يمكن تقسيم الأمعاء إلى الاثني عشر ، الصائم ، الدقاق ، العرق ، والقولون للكشف عن التحولات الطفيفة في توطين الطفيليات أو حركية التطهير. وتجدر الإشارة إلى أن التباين بين التجارب وداخلها في تجارب العدوى هذه ، حتى في الفئران الفطرية ، مرتفع إلى حد ما ، مما يعكس التباين الناتج عن تفاعل الطفيلي والمضيف بالإضافة إلى دفعات مختلفة من S. ratti L3 تظهر فعالية عدوى مختلفة (انظر الشكل 2 والشكل 3). لتقليل التباين ، يجب أن يكون عمر وجنس الفئران التجريبية متشابهين. علاوة على ذلك ، إذا تمت مقارنة الفئران KO و WT ، فمن المستحسن بشدة استخدام أدوات التحكم في القمامة بدلا من الفئران WT المشتقة من مستعمرة تربية مستقلة. ومع ذلك ، إذا تم استخدام أحجام عينات كافية ، فمن الممكن توليد نتائج موثوقة تقارن عبء الطفيليات في الفئران التي تعاني من نقص أو مؤهل لبعض المؤثرات ، مما يؤدي إلى صورة واضحة للمؤثرات المناعية المشاركة في الاستجابة المناعية الوقائية ل S. ratti (تمت مراجعتها في 6).
السمة المميزة الرئيسية ل S. ratti مقارنة بنماذج عدوى الديدان الخيطية الأخرى ، مثل S. venezuelensis أو N. brasiliensis ، هي الطريق الفريد للهجرة لليرقات داخل المضيف. على عكس N. brasiliensis و S. venezuelensis ، اللذين تحتوي دورات حياتهما على مرحلة رئوية21،22،23 S. ratti يتجاوز الرئة بشكل أساسي ويهاجر عبر العضلات وأنسجة الجلد إلىالرأس 8،12. تم العثور على ما يقرب من 10٪ فقط من الطفيليات الباقية في اليوم 2 في الرئتين. وفي الوقت نفسه ، فإن موقع S. ratti في الرأس يركز على المنطقة الأنفية الجبهي ، بما يتماشى مع الدراسات السابقة8. هذه الخصائص تجعل S. ratti نموذجا قيما لدراسة التفاعلات بين الطفيليات المضيفة ، وتحديدا في أنسجة الجلد والعضلات وكذلك في الأنسجة التي تستنزف الغدد الليمفاوية وتمكن من إجراء دراسات حول الاستجابات المناعية التي قد تكون محجوبة أو معقدة بسبب تورط رئوي ممتد كما هو الحال في نماذج عدوى الديدان الخيطية الأخرى. اللافت للنظر ، S. ratti L3 يتم استرداده أيضا من السائل النخاعي20 والدماغ (الشكل 2 أ) ، على الرغم من أن الأعراض العصبية الناجمة عن العدوى أو الوفاة نادرة نسبيا ولم يتم ملاحظتها مطلقا في منشأتنا الحيوانية. قد توضح الأبحاث المستقبلية ما إذا كانت هذه الطفيليات الموضعية في الدماغ محاصرة أو ما إذا كان هناك مسار إلى الأمعاء.
يتمتع جنس Strongyloides أيضا بقدرة فريدة على تكوين أجيال تعيش بحرية بين الأجيال الطفيلية24. هذه المرحلة الحرة من S. ratti ، بالإضافة إلى تكاثرها عن طريق التسبب في المرض ، تسهل أيضا توليد اليرقات المعدلة وراثيا. مكن استخدام الحقن المجهري للإناث التي تعيش بحرية من توليد يرقات تعبر عن مستضدات نموذجية مثل 2W1S مدمجة في بروتين فلوري أخضر. بينما فقد التعبير عن الحاتمة أثناء طرح الريش للبالغين ، فقد مكن من تتبع وتوصيف الخلايا التائية CD4 + الخاصة بالرنويات في الرئة والغدد الليمفاوية المنصف التي تستنزف الرئة25. يوفر هذا النهج أداة ممتازة لدراسة بيولوجيا الخلايا التائية CD4 + في سياق عدوى الديدان الطفيلية وتطوير اللقاح المضاد للديدان الطفيلية.
S. ratti هو كائن حي نموذجي متعدد الاستخدامات للأبحاث المناعية لطفيليات الديدان الطفيلية التي تعرض هجرة الأنسجة ومراحل الحياة المعوية بشكل عام. تتميز عدوى المكورات العنقودية السترجائية البشرية بالمزمنة الشديدة بسبب العدوى الذاتية التي تحدث ، والتي قد تؤدي أيضا إلى متلازمة فرط العدوى لدى المضيفين المثبطين للمناعة ، ومعظمهم من المرضى الذين يتلقون العلاج بالجلوكوكورتيكويد بعد الزرع26. وتجدر الإشارة إلى أن هذا الجانب من العدوى الذاتية وفرط العدوى يصعب نمذجته في الفئران. لا المصابة ب S. ratti RAG1 KO ولا الفئران العارية5،27 معرضة للإصابة بفرط العدوى. وتجدر الإشارة إلى أن نموذجا واحدا من الفئران لفرط العدوى ب S. stercoralis تم إنشاؤه باستخدام الفئران التي تعاني من نقص المناعة الشديد المعالجة بالجلوكوكورتيكوستيرويد (NOD.Cg-PrkdcscidIl2rgtm1Wjl / SzJ) ، والتي قد تسمح بتحليل جوانب متلازمة فرط العدوى على الأقل في الفئران في نهايةالمطاف 28.
ومع ذلك ، أظهرت الدراسات التي استخدمت عدوى S. ratti في الفئران أن الحمضات والعدلات تلعب دورا غير زائد عن الحاجة في القضاء على اليرقات المهاجرة للأنسجة. أدى استنفاد أو غياب الفئران المعدلة وراثيا إلى ارتفاع أرقام L3 في الرأس8. في حين أن الخلايا البدينة والخلايا الحبيبية القاعدية كانت قابلة للاستغناء عنها خلال مرحلة هجرة الأنسجة ، ساهمت كل من الخلايا البدينة والخلايا القاعدية في السيطرة على عبء الطفيليات المعوية. لم يؤثر غيابهم على أرقام L3 في الأنسجة ولكنه رفع أعداد طفيليات S. ratti البالغة في الأمعاء في اليوم 6 p.i.12،29. كشف مزيد من التحليل أن غياب الخلايا القاعدية أو الخلايا البدينة للنسيج الضام بشكل انتقائي سمح بإنهاء العدوى بحركية WT. على النقيض من ذلك ، ظلت الفئران التي تفتقر إلى النسيج الضام والخلايا البدينة المخاطية مصابة لمدة 20 أسبوعا12. كشفت هذه النتائج عن دور محوري للخلايا البدينة المخاطية في إنهاء العدوى النهائي ، مما يؤكد قيمة نموذج العدوى هذا في توضيح وظيفة الخلايا البدينة المخاطية أثناء عدوى الديدان الطفيلية. سيساعد التعريف الإضافي للتغيرات المحتملة في توطين الأمعاء لطفيليات S. ratti في غياب بعض الخلايا المستجيبة المناعية في تحديد وظيفتها في المناعة المضادة للديدان الطفيلية بشكل أكثر دقة.
علاوة على ذلك ، يمكن دراسة آليات المراوغة المناعية التي تستخدمها الديدان الطفيلية لتسهيل بقائها على قيد الحياة في هذا النظام. لقد تبين أن استنفاد الخلايا التائية التنظيمية Foxp3 + أو حذف مستقبلات تنظيمية على الخلايا التائية المستجيبة ، والتي تم إحداثها أثناء عدوى S. ratti ، قلل من عبء الطفيليات في اليوم 6 p.i. وإخراج اليرقات طوال فترة العدوى15،16،30،31. علاوة على ذلك ، كان من الممكن تعريف الأمعاء على أنها الأنسجة المستهدفة بالتهرب المناعي وتنشيط الخلايا البدينة بوساطة IL-9 حيث يتم قمع المسار المناعي. أخيرا ، يمكن دراسة آلية بدء مناعة النوع 2 بوساطة ILC2 بواسطة السيتوكينات المثيرة للقلق المشتقة من الأنسجة مثل IL-33 باستخدام مثبطات ومعززات IL-3332 الذاتية.
يوفر عزل أعداد كبيرة من iL3 عبر Baermann إمكانية إجراء مزيد من الدراسات في المختبر . تتيح الثقافات المشتركة ل L3 مع الخلايا المناعية أو الأدوية المرشحة المحتملة التحقيق المباشر للتأثيرات على قابلية L3 للبقاء والحركة. يوفر إعادة التحفيز خارج الجسم الحي للخلايا المعزولة من الفئران المصابة بمستضد المكورات العنقودية الروطان أو L3 القابل للحياة منصة لدراسة إنتاج السيتوكين عبر أنواع الخلايا المختلفة. أخيرا ، يمكن استخدام أجزاء البروتين والدهون من L3 لتحديد الأنماط الجزيئية المرتبطة بمسببات الأمراض المشتقة من الفصير أو جزيئات المستجيب المناعي
وبما أن عدوى الديدان الطفيلية لا تزال تشكل عبئا صحيا كبيرا على الصعيد العالمي، فإن البحوث الرامية إلى زيادة توضيح الاستجابات المناعية التي تسببها الديدان الطفيلية وآلية التهرب التي تستخدمها الطفيليات لا تزال محورية لتحسين خيارات العلاج وتطوير استراتيجيات وقائية مثل التطعيمات. تقدم عدوى الفئران المكورات العنقودية في الفئران نموذجا متعدد الاستخدامات للبحث عن تفاعلات الديدان الطفيلية والمضيف أثناء نموذج العدوى الحادة.
Disclosures
المؤلفون ليس لديهم تضارب في المصالح. تم استخدام نموذج اللغة Perplexity الذكاء الاصطناعي 2024 لمراجعة مسودات النص وتحسين الصيغ.
Acknowledgements
تم دعم هذا العمل من قبل مؤسسة Jürgen Manchot وجمعية الأبحاث الألمانية (Grant BRE 3754 / 6-1 و BRE 3754 / 10-1). تم إنشاء الأشكال 1 و 2C و 3B في BioRender.com.
Materials
| Name | Company | Catalog Number | Comments |
| 50 ml tubes | Sarstedt, N mbrecht, DE mbrecht, DE | 6,25,47,254 | 50 ml https://www.sarstedt.com/produkte/labor/reagenz-zentrifugenroehren/roehren/produkt/62.547.254/ |
| BD Micro-Fine U100 Insulin 0.5 ml | BD Bioscience | 7468077 | 0.5 ml https://www.bestimed.de/bd-micro-fine-insulinspritze-05-ml-u100-8-mm-100x05ml-324825.html |
| centrifugeation tubes | Sarstedt, Nümbrecht, DE | 72,706 | 1.5 ml https://www.sarstedt.com/produkte/labor/mikro-schraubroehren-reagiergefaesse/reagiergefaesse/produkt/72.706/ |
| Charcoal | Roth | 0998.3 | 5 kg https://www.carlroth.com/de/de/aktivkohle/aktivkohle/p/0998.3 |
| Falcon 6-well Clear Flat Bottom, not treated cell multiwell culture plate, with Lid, sterile | Corning | 351146 | 6-well https://www.corning.com/emea/de/search.html?_cookie=false &searchText=351146&search-initialcatalog =Corporate+Communications& initialResultType=products |
| Freezer & Refrigerator | Liebherr-Hausgeräte, Rostock, DE | ||
| Greiner Bio-One 24-Well-Platten für Zellkulturen aus Polystyrol | Fisher Scientific | 10177380 | 24-well https://www.fishersci.de/shop/products/polystyrene-24-well-cell-culture-multiwell-plate/10177380#?keyword=24-well |
| Incidin Premium Wipes | Ecolab Healthcare | 100 10 279 | https://www.ecolabhealthcare.de/website/seiten/produkte/flaechendesinfektion/tuecher/incidin_premium_wipes.php |
| Incubator 25°C | Heraeus Instruments, Hanau, DE | ||
| Incubator 37°C | Heraeus Instruments, Hanau, DE | ||
| Microscope | Helmut Hund, Wetzlar, DE | 4 x objectiv lens, 10 x ocular lens | |
| Parafilm M | Parafilm | 11772644 | 4 in. X 125 ft. https://www.fishersci.de/shop/products/parafilm-m-laboratory-wrapping-film-2/11772644 |
| Penicillin/Streptomycin (Pen-Strep) | Capricorn | PS-B | 100x https://www.capricorn-scientific.com/en/shop/penicillin-streptomycin-pen-strep-100x~p1205 |
| ROTI Fair 10x PBS 7.4 | Roth | 1105.1 | https://www.carlroth.com/de/de/fertigloesungen-tabletten-portionsbeutel/rotifair-10x-pbs-7-4/p/1105.1 |
References
- Olsen, A., et al. Strongyloidiasis - the most neglected of the neglected tropical diseases. Trans Royal Soc Tropical Med Hygiene. 103 (10), 967-972 (2009).
- Buonfrate, D., et al. The global prevalence of Strongyloides stercoralis infection. Pathogens. 9 (6), 468 (2020).
- Dawkins, H. J. S., Grove, D. I. Attempts to establish infections with Strongyloides stercoralis in mice and other laboratory animals. J Helminthol. 56 (1), 23-26 (1982).
- Abraham, D., et al. Strongyloides stercoralis: protective immunity to third-stage larvae inBALB/cByJ mice. Exp Parasitol. 80 (2), 297-307 (1995).
- Breloer, M., Abraham, D. Strongyloides infection in rodents: immune response and immune regulation. Parasitology. 144 (3), 295-315 (2017).
- Breloer, M., Linnemann, L. Strongyloides ratti infection in mice: immune response and immune modulation. Philosophical Trans Royal Society B. 379 (1894), 20220440 (2024).
- Dawkins, H. J. S., Grove, D. I., Dunsmore, J. D., Mitchell, G. F. Strongyloides ratti: Susceptibility to infection and resistance to reinfection in inbred strains of mice as assessed by excretion of larvae. Int J Parasitol. 10 (2), 125-129 (1980).
- Ehrens, A., et al. Eosinophils and neutrophils eliminate migrating Strongyloides ratti larvae at the site of infection in the context of extracellular DNA trap formation. Front Immunol. 12, 715766 (2021).
- Eschbach, M. L., et al. Strongyloides ratti infection induces transient nematode-specific Th2 response and reciprocal suppression of IFN-γ production in mice. Parasite Immunol. 32 (5), 370-383 (2010).
- Dawkins, H., Muir, G., Grove, D. Histopathological appearances in primary and secondary infections with Strongyloides ratti in mice. Int J Parasitol. 11 (1), 97-103 (1981).
- Tada, I., Mimori, T., Nakai, M. Migration route of Strongyloides ratti in albino rats. Jap J Parasit. 28 (4), 219-227 (1979).
- Reitz, M., et al. Mucosal mast cells are indispensable for the timely termination of Strongyloides ratti infection. Mucosal Immunol. 10 (2), 481-492 (2017).
- Viney, M. E., Lok, J. B. The biology of Strongyloides spp. WormBook. , 1-17 (2018).
- Reitz, M., et al. Interleukin-9 promotes early mast cell-mediated expulsion of Strongyloides ratti but is dispensable for generation of protective memory. Sci Rep. 8 (1), 8636 (2018).
- Breloer, M., et al. Cutting edge: The BTLA-HVEM regulatory pathway interferes with protective immunity to intestinal Helminth infection. J Immunol. 194 (4), 1413-1416 (2015).
- Blankenhaus, B., et al. Foxp3+ regulatory T cells delay expulsion of intestinal nematodes by suppression of IL-9-driven mast cell activation in BALB/c but not in C57BL/6 mice. PLoS Pathogens. 10 (2), e1003913 (2014).
- Niamatali, S., Nolan, T. J., Schad, G. A. . Can Autoinfection be Provoked in the Strongyloides ratt/-infected Gerbil, Meriones unguiculatus. 59 (2), 149-152 (1992).
- Gardner, M. P., Gems, D., Viney, M. E. Extraordinary plasticity in aging in Strongyloides ratti implies a gene-regulatory mechanism of lifespan evolution. Aging Cell. 5 (4), 315-323 (2006).
- Viney, M. E. Developmental switching in the parasitic nematode Strongyloides ratti. Proc Biol Sci. 263 (1367), 201-208 (1996).
- Dawkins, H. J., Thomason, H. J., Grove, D. I. The occurrence of Strongyloides ratti in the tissues of mice after percutaneous infection. J Helminthol. 56 (1), 45-50 (1982).
- Takamure, A. Migration route of Strongyloides venezuelensis in rodents. Int J Parasitol. 25 (8), 907-911 (1995).
- Filbey, K., Bouchery, T., Le Gros, G. The role of ILC 2 in hookworm infection. Parasite Immunol. 40 (2), e12429 (2018).
- Allen, J. E., Sutherland, T. E. Host protective roles of type 2 immunity: Parasite killing and tissue repair, flip sides of the same coin. Semin Immunol. 26 (4), 329-340 (2014).
- Dulovic, A., Puller, V., Streit, A. Optimizing culture conditions for free-living stages of the nematode parasite Strongyloides ratti. Exp Parasitol. 168, 25-30 (2016).
- Douglas, B., et al. Transgenic expression of a T cell epitope in Strongyloides ratti reveals that helminth-specific CD4+ T cells constitute both Th2 and Treg populations. PLOS Pathogens. 17 (7), e1009709 (2021).
- Vadlamudi, R. S., Chi, D. S., Krishnaswamy, G. Intestinal strongyloidiasis and hyperinfection syndrome. Clin Mol Allergy. 4 (1), 8 (2006).
- Viney, M., Kikuchi, T. Strongyloides ratti and S. venezuelensis- rodent models of Strongyloides infection. Parasitology. 144 (3), 285-294 (2017).
- Patton, J. B., et al. Methylprednisolone acetate induces, and Δ7-dafachronic acid suppresses, Strongyloides stercoralis hyperinfection in NSG mice. Proc Natl Acad Sci. 115 (1), 204-209 (2018).
- Reitz, M., Brunn, M. L., Voehringer, D., Breloer, M. Basophils are dispensable for the establishment of protective adaptive immunity against primary and challenge infection with the intestinal helminth parasite Strongyloides ratti. PLOS Neglected Trop Dis. 12 (11), e000699 (2018).
- Blankenhaus, B., et al. Strongyloides ratti infection induces expansion of Foxp3+ regulatory T cells that interfere with immune response and parasite clearance in BALB/c Mice. J Immunol. 186 (7), 4295-4305 (2011).
- Hartmann, W., Blankenhaus, B., Brunn, M. L., Meiners, J., Breloer, M. Elucidating different pattern of immunoregulation in BALB/c and C57BL/6 mice and their F1 progeny. Sci Rep. 11 (1), 1536 (2021).
- Meiners, J., et al. IL-33 facilitates rapid expulsion of the parasitic nematode Strongyloides ratti from the intestine via ILC2- and IL-9-driven mast cell activation. PLOS Pathogens. 16 (12), e1009121 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved