Method Article
זיהום ניסיוני של עכברים בנמטודה הטפילית Strongyloides ratti
In This Article
Summary
סטרונגילואידס ראטי היא נמטודה טפילית הגורמת לזיהומים חולפים בעכברי מעבדה, ומציגה שלבי נדידת רקמות וחיי מעיים. כאן, אנו מציגים פרוטוקול לשמירה על מחזור הטפילים בחולדות והדבקה ניסיונית בעכברים, כולל כימות טפילים בראש, בריאות ובמעי.
Abstract
Strongyloides ratti היא נמטודה טפילית המדביקה באופן טבעי חולדות בר. עם זאת, רוב זני חולדות ועכברי המעבדה רגישים לחלוטין לזיהום. עכברי BALB/c ו-C57BL/6 בעלי יכולת חיסונית מסיימים זיהומים של S. ratti תוך חודש בהקשר של תגובה חיסונית קנונית מסוג 2 ונשארים עמידים למחצה לזיהום חוזר. ניתן לחלק את מהלך ההדבקה לשלושה שלבים: (א) שלב נדידת הרקמות של זחלי השלב השלישי המדביקים במהלך היומיים הראשונים; (B) שלב המעי המוקדם, כולל ההיתוך לטפילים הבוגרים והטבעה ברירית המעי בימים 3 עד 6 לאחר ההדבקה עם רבייה החל מהיום החמישי עד השישי לאחר ההדבקה; (ג) שלב המעי המאוחר המסתיים בפינוי מוחלט של הטפילים. זיהומים ניסיוניים של עכברים עם S. ratti מאפשרים מחקר מדויק של אינטראקציות פונדקאי-טפיל לאורך כל מחזור החיים באתרי ההדבקה השונים, כמו גם אסטרטגיות התחמקות חיסונית המופעלות על ידי הטפיל. הפרוטוקול המוצג כאן מתאר את שימור הטפיל בחולדות Wistar, הדבקה של עכברי מעבדה, ואיתור וכימות של טפילי S. ratti בשלב נדידת הרקמות ובשלב המעי.
Introduction
הלמינת'ס סטרונגילואידס סטרקוראליס המועבר בקרקע גורם לסטרונגילואידיאזיס, מחלה המכונה לעתים קרובות המוזנחת ביותר מבין המחלות הטרופיות המוזנחות1. הערכות משנת 2020 מצביעות על 600 מיליון זיהומים ב-S. stercoralis ברחבי העולם2. מחקר מעבדה מונחה השערות על S. stercoralis מוגבל מכיוון שהלמינת'ס אינו מסוגל להתפתח מעבר לזחלי השלב השלישי (L3) בעכברים 3,4. לפיכך, הנמטודה הספציפית למכרסמים Strongyloides ratti משמשת בדרך כלל למחקרי זיהום in vivo בעכברי מעבדה 5,6. S. ratti הוא טפיל טבעי של חולדות בר, אך רוב זני עכברי המעבדה רגישים לחלוטין לזיהום7. זה מאפשר לחקור אינטראקציה בין מארח-פתוגן ותגובות חיסוניות ברקמות שונות ובשלבים חיים של ההלמינת'ס.
ניתן לחלק את מחזור המעבדה של S. ratti בעכברים לשלושה שלבים עיקריים. לאחר הזרקה תת-עורית של מספר מוגדר של זחלי שלב שלישי זיהומיים (iL3), בדרך כלל בין 1000 ל-2000, רוב (כ-90%) מה-L3 ששרדו נודדים לראש העכברים במהלך היומיים הראשונים להדבקה, ורק חלק קטן מאוד (כ-10%) נשלףבריאה. S. ratti חודר באופן פעיל לעור של מארח המכרסמים שלו. ניתן לחקות את מסלול ההדבקה הטבעי הזה במעבדה על ידי הנחת טיפת מים המכילה iL3 על עור העכברים ומתן אפשרות לזיהום מלעורי פעיל9. עם זאת, יעילות ההדבקה נמוכה בהרבה, ושליטה במינון הזיהום המדויק אינה אפשרית. מסלול הנדידה המדויק שלקח S. ratti iL3, לאחר זיהום מלעורי או תת עורי (s.c.) נותר לא ידוע. עם זאת, מכיוון שלא ניתן לזהות DNA של S. ratti בדם או באיברים המסופקים היטב בדם, כמו הכליות של עכברים נגועים8, ייתכן שמסלול הנדידה העיקרי לא יכלול את זרם הדם. ובכל זאת, S. ratti אינו נודד באופן אקראי בכל הרקמות. במקום זאת, מספר מחקרים המשתמשים בהיסטולוגיה בעכברים 3,10 וחולדות11 או בכימות של DNA בר-קיימא שמקורו ב-L3 ו-S. ratti שנשלף מרקמות שונות8 מספקים ראיות לכך ש-S. ratti L3 נודד מאתר הזיהום ישירות דרך רקמת העור והשריר בעיקר לאזור האף של הראש.
כ-10% מהזחלים המוזרקים שורדים את נדידת הרקמות ומגיעים לראש בעכברי C57BL/6 ו-BALB/c המציגים מספרי L3 דומים ברקמת הראש12. מאמינים שהזחלים נבלעים כדי להגיע למעי ביום השלישי לאחר ההדבקה (p.i). הם נטמעים ברירית המעי הדק, נמסים לטפילים נקבות בוגרות, ומתחילים להתרבות על ידי פרתנוגנזה ביום 5 עד יום 6 p.i.13. ביצים, אך לרוב זחלי שלב ראשון שכבר בקעו (L1), משתחררות למעי ומופרשות עם צואה. שיא מספר הנקבות הבוגרות מגיע בסביבות היום השישי p.i.14. מעניין שעכברי C57BL/6 מציגים עומס טפילי מעיים גבוה פי 2 עד 5 מאשר עכברי BALB/c למרות מספרים דומים של L3 נודד רקמות בראש בשני זני העכברים12. במהלך השבוע הראשון, עומס טפילי המעיים בעכברי C57BL/6 בעלי יכולת חיסונית ועכברי נוק-אאוט RAG1 (KO) חסרי תאי B ו-T הוא דומה, מה שמצביע על כך שהדברה מוקדמת של טפילים מתווכת באמצעות חסינות מולדת12,15. בשלב האחרון, הטפילים נפלטים מהמעי תוך 2 עד 4 שבועות p.i. בעכברים בעלי יכולת חיסונית (נסקר ב6). עכברי RAG1 KO אינם מסוגלים לנקות את הזיהום ומכילים מספרים נמוכים של נקבות בוגרות ברות קיימא ומתרבות במעי הדק עד שנה12.
לאחר הדבקה ראשונה או חיסון עם L3 מוקרן, עכברי C57BL/6 ו-BALB/c בעלי יכולת חיסונית עמידים למחצה להדבקה חוזרת. רק 1% מה-iL3 הראשוני שחוסן מגיע לראש, ורק כ-1-5 טפילים בוגרים יכולים להישלף מהמעיבמהלך הדבקה שנייה. לפיכך, השימוש בזיהום מעבדתי של עכברים ב-S. ratti מספק כלי לחקר ההשפעה של מערכת החיסון המולדת והנרכשת במהלך מחזור החיים המלא של נמטודת מעיים עם שלבי נדידת רקמות.
בכתב יד זה, אנו מספקים תיאור מפורט של שימור מחזור החיים של S. ratti בחולדות Wistar, כמו גם זיהום ניסיוני של עכברים וכימות עומס הטפילים באתרי ההדבקה השונים. על ידי כימות מדויק של עומס הטפיל של S. ratti ברקמת הראש והריאות כמו גם במעי של עכברי ניסוי, ניתן לנתח את תפקידם של אפקטורים חיסוניים מסוימים כנגד נמטודה נודדת או מעיים של נמטודה טפילית זו. ניתן להשוות תגובות חיסוניות בעכברים מסוג בר ובעכברים חסרי תאי אפקטור חיסוניים ספציפיים, קולטנים או מתווכים מעניינים כפי שהוסבר בפירוט בדיון 5,6.
Protocol
ניסויים בבעלי חיים נערכו בהתאם לחוק רווחת בעלי החיים הגרמני, ופרוטוקולים של ניסויים אושרו על ידי הרשות הגרמנית (Behörde für Gesundheit und Verbraucherschutz) של מדינת המבורג. איור 1 מספק סקירה כללית של תחזוקת מחזור החיים של S. ratti בחולדות Wistar וייצור iL3 להדבקה של עכברים או חולדות ניסוי.
1. הכנת זחלים זיהומיים
- הכן את מנגנון ברמן כפי שמוצג באיור 1. סגור את תחתית הצינור בעזרת מהדק בזווית אלכסונית והניח מגבון רקמות במסננת. ממלאים במים פושרים (כ-35-37 מעלות צלזיוס) עד שהמסננת מכוסה במים.
- מלאו את המסננת בתערובת הצואה-פחם שהוכנה כמתואר להלן (שלב 6). התערובת צריכה להיות מכוסה לחלוטין במים.
- הפעל את האור ישירות מאחורי מנגנון ברמן. Viable iL3 יעבור באופן פעיל דרך המחיקה.
- לאחר 30 דקות הזחלים התיישבו מעל המהדק, אספו אותם לצינור של 50 מ"ל על ידי פתיחת המהדק בקרוב. אסוף את כל הגלולה, אך ודא שהנפח קטן ככל האפשר.
- מלאו את שפופרת ה-50 מ"ל ב-PBS המכיל 1% פניצילין-סטרפטומיצין (PBS/Pen-Strep) ותנו לזחלים להתיישב בתחתית הצינור על ידי כוח הכבידה ב-4 מעלות צלזיוס למשך 30 דקות. הסר בזהירות את הסופרנטנט בעזרת פיפטה וחזור על שלב הכביסה פי 3.
- לאחר שלב הכביסה השלישי, השעו מחדש את הגלולה ב-30 עד 50 מ"ל PBS/Pen-Strep, בהתאם לגודל הגלולה. מעבירים טיפות של 1 מיקרוליטר מהתמיסה לשקופית מיקרוסקופיה. ערבב את התמיסה מיד לפני הפיפטה מכיוון שה-iL3 מתייצב במהירות.
- בדוק את הטיפות תחת מיקרוסקופ הפוך בהגדלה של פי 40. ה-iL3 אמור לנוע בצורה חיה. ספרו את ה-iL3 לכל טיפה של 1 מיקרוליטר ב-5 עד 10 שכפולים וחישבו את הממוצע למיקרוליטר.
2. זיהום של עכברים
הערה: ניתן לאחסן iL3 מוכן ב-PBS/Pen-Strep ב-4 מעלות צלזיוס בצינור של 50 מ"ל שיש לשמור אופקית כדי למנוע נזק ל-iL3. הכדאיות במבחנה המצוינת על ידי התנועה החיה של iL3 אינה משתנה עד שבוע בידינו. מכיוון שאין השוואה שיטתית של ההדבקה של L3 לאחר זמני אחסון שונים, אנו משתמשים ב-iL3 טרי ומאוחסנים ב-iL3 למשך 24 שעות לכל היותר לאחר ההכנה כתקן פנימי. זיהומים באצוות iL3 ישנות יותר אפשריים. עם זאת, חובה להשתמש באותה אצווה iL3 להדבקה של קבוצות שונות בניסוי אחד. רצוי לבצע הדבקות בעכברים על ידי שני אנשים, כאשר אדם אחד מחזיק את העכבר ואחר מבצע את ההזרקה.
- הכן צינור צנטריפוגה אחד של 1.5 מ"ל לכל עכבר המכיל בסך הכל 1000 iL3 (C57BL/6) או 2000 iL3 (BALB/c) שנספרו כמתואר לעיל בשלב 1.7 ב-PBS/Pen-Strep שהוכנו באמצעות מכשיר Baermann כפי שהוסבר לעיל (שלב 1). ערבב היטב בין שלבי הפיפטינג כאשר ה-iL3 מתייצב במהירות.
- תן ל-iL3 להתיישב בכוח הכבידה במשך 20-30 דקות בטמפרטורת החדר (RT) ולשאוף את הסופרנטנט עם מזרק של 0.5 מ"ל בצורה מלאה ככל האפשר, ולהשאיר כ-30 מיקרוליטר של מתלה iL3 בצינור. השעו מחדש את ה-iL3 עם מזרק של 0.5 מ"ל (28G) או על ידי לחיצה על הצינור ושאיפת המתלה שנותר.
הערה: ה-iL3 נוטים פחות להיצמד לפלסטיק רטוב מאשר המזרק היבש. לפיכך, כדאי להשתמש באותו מזרק כדי להוריד את הסופרנטנט. - עכברים אינם צריכים להיות מורדמים לזיהום. הרם את העכברים עם הקשקוש ותפס רגל אחורית אחת של העכברים. השתמש בנקבה וזכר C57BL/6 מעל גיל 8 שבועות ובמשקל של לפחות 20 גרם. יש להזריק את כל התמיסה המכילה את ה-iL3 באופן תת עורי לתוך כרית כף הרגל בזווית שטוחה. החזר לאט את המזרק כדי למנוע שפיכת תרחיף זחלים ממקום הניקוב. תיווצר כיפה קטנה מאוד המכילה את הנוזל. זה ייספג מעצמו.
הערה: זיהום תת עורי בכרית כף הרגל ולא באגף או בעורף מחקה את הזיהום הטבעי על ידי iL3, החי באדמה לחה מופרית בצואה וחודר באופן פעיל לעור השלם. כמו כן, בלוטת הלימפה המנקזת הראשונה (LN) מוגדרת כ-LN פופליטאלי. ניתן להשתמש ב-LN זה לניתוח שינויים אימונולוגיים מוקדמים (כלומר, יום 2 p.i), למשל, התרחבות של תאי T רגולטוריים של Foxp3+ בתגובה לזיהום, כפי שמוצגב-16.
3. ספירת iL3 בראש ובריאה של עכברים נגועים
- לניתוח עומס הזחלים ברקמה, הקריבו את העכברים ביום 1-3 p.i. מכיוון ששיא עומס הזחלים הוא ביום 2 p.i.8,12. בצע המתת חסד על ידי נרקוזה ממנת יתר של CO2. לאחר היעדר קרנית ורפלקסים בין-דיגיטליים, בצע פריקת צוואר הרחם.
- מרססים את הבטן והצוואר בחומר חיטוי מסחרי וחותכים את העור מעל הבטן במספריים. משוך את העור לאחור כדי לחשוף את דופן הבטן הקדמית וחתוך לאורך קו האמצע כדי לפתוח את חלל הצפק. חותכים את הסרעפת וחותכים את הצלעות לשני הצדדים כדי לחשוף את הריאה בחלל הצדר.
- אוספים את אונות הריאה בצלחת של 24 בארות המחולקת בקווים המכילים 1 מ"ל מי ברז. צייר או הדפס את הקווים על הצלחת במרחק של כ -4 מ"מ. המרחק בין הקווים אמור לאפשר לראות את שני הקווים בו זמנית בהגדלה של פי 40.
- חותכים את הריאה כולה לשש חתיכות בגודל של כ- 0.75 ס"מ על 0.75 ס"מ.
- חותכים את הראש במספריים עצם. הסר את העור והפרווה בעזרת האצבעות. נסה להסיר כמה שפחות רקמת שריר.
- חתכו את הראש השלם (כולל המוח והעצמות) לארבעה רבעים מאחורי העיניים ולאורך דרך אמצע הראש (ראו איור 2C). הנח את הרבעים הקדמיים והאחוריים בבאר של צלחת בת 6 בארות המסומנת בקווים המכילים 2 מ"ל מי ברז. מניחים את הטישו כשהחתכים פונים כלפי מטה לתוך המים.
הערה: בדרך כלל, גישה זו נותנת רישום מדויק של מספר הזחלים הנודדים ברקמת הראש. אם יש צורך בניתוח נפרד של מספרי L3 במוח, ניתן לכלול את שלב 3.7. - אם רוצים ניתוח נפרד של המוח, הסירו את העור מהראש בעזרת האצבעות. לאחר מכן, השתמש במספריים כדי לקדוח דרך הכיפה בין העיניים. מהחתך הזה, פתח את החלק העליון של סגיטל הגולגולת עם מספריים שאינם בשימוש או מנוקים היטב. כדי לחשוף את המוח, פתחו את הכיפה הימנית והשמאלית בעזרת פינצטה. השתמש במרית כדי להרים את המוח מהצד הקדמי כלפי מעלה ומיתרי העצב נחתכים במספריים נקיים. הסירו את המוח והעבירו אותו לצלחת של 24 בארות המסומנות בקווים המכילים מי ברז.
- מניחים את הצלחות בחממה בטמפרטורה של 37 מעלות צלזיוס. דגירה במשך 3 שעות תוך כדי סיבוב הצלחות כל שעה (שעה) פי 10. לאחר הדגירה יש לסובב בפעם האחרונה, להסיר את חלקי הרקמה הנותרים בעזרת מלקחיים מהבארות ולהשליך את הרקמה.
- ספרו לחלוטין את כל הזחלים במים שנותרו בבארות תחת מיקרוסקופ הפוך עם הגדלה של פי 40 על ידי תנועה לאורך הקווים המצוירים על קרקעית הבאר. ספרו את הזחלים הנודדים רקמות באותו יום כדי להגדיל את האחריות לתוצאות.
4. ספירת טפילי S. ratti במעי של עכברים נגועים
- לניתוח עומס הטפילים במעי להקריב את העכברים ביום המעניין, השתמש ביום 3-21 p.i. לקינטי מלא. שיא נטל הטפילים בעכברי C57BL/6 ו-BALB/c במעי הדק הוא ביום 6 p.i.14. בצע המתת חסד על ידי נרקוזה ממנת יתר של CO2 . לאחר היעדר קרנית ורפלקסים בין-דיגיטליים, בצע פריקת צוואר הרחם.
- משרים את אזור הבטן של העכברים בחומר חיטוי וחותכים את העור מעל הבטן. משוך את העור לאחור כדי לחשוף את דופן הבטן הקדמית וחתוך לאורך קו האמצע כדי לפתוח את חלל הצפק.
- הסירו את המעי כולו על ידי חיתוך בין הקיבה לתריסריון הפרוקסימלי, כמו גם בין המעי הגס לפי הטבעת (ראו איור 3B). שולפים בעדינות את המעי בעזרת האצבעות ומניחים אותו בצלחת פטרי המכילה מי ברז.
- חותכים את המעי פתוח לאורך ושוטפים את הצואה והריר על ידי ניעור נמרץ במי ברז למשך 10 שניות לפחות. חלק קטן של טפילים בוגרים וחלק מ-L1 יישטפו, אך טפילי L4 ו-S. ratti בוגרים מוטמעים ברירית המעי בעכברים מסוג בר (WT) ולא יוסרו בשלב שטיפה זה.
- אם מעניין, חלק את המעי עוד יותר כמתואר להלן.
- בודד את התריסריון על ידי חתך לאחר תיקון פייר השני (כ-2-3 ס"מ). בודד את האילאום בשני חתכים, אחד בראשון והשני בתיקון פייר השני (כ-1-2 ס"מ). בודד את הג'ג'ונום לאחר בידוד התריסריון והאילאום מכיוון שזהו החלק הנותר.
- חלקו את הג'ג'ונום לשלושה חלקים שווים כדי לאפשר הגדרה מדויקת מאוד של לוקליזציה של טפילים. בודד את הקיקום בין האילאום למעי הגס. בודד את המעי הגס על ידי חיתוך אחרי הקקום. רוב הטפילים הבוגרים יכולים להימצא בשליש הראשון של המעי הדק (ראו איור 3B).
- העבירו את חלקי המעי הנקיים לצינורות של 50 מ"ל המכילים 20 מ"ל מי ברז. מניחים אופקית בחממה של 37 מעלות צלזיוס למשך 3 שעות. לנער במרץ רב במשך 10 שניות בכל שעה.
- לאחר 3 שעות של דגירה, הסר את הרקמה מהמים. הנח את הצינורות אנכית ב-RT, ואת הטפילים משקעים בכוח הכבידה תוך 30 דקות.
- הסר את הסופרנטנט עד שנותר כ-5 מ"ל מים. מלאו עד 25 מ"ל במי ברז כדי לחזור על שלב הכביסה. לניתוח המעי הדק, חזור על שלב שטיפה זה פעם נוספת כדי לקבל ראות טובה במיקרוסקופ.
- כאשר מושגת ראות טובה, שאפו את הסופרנטנט עד שנותרו כ-5 מ"ל מים והעבירו את הנוזל לשתי בארות לכל מעי עכבר בצלחת של 6 בארות המסומנות בקווים, כפי שהוסבר לספירת זחלים בראש.
- ספרו את הטפילים הבוגרים תחת מיקרוסקופ הפוך עם הגדלה של פי 40 על ידי תנועה לאורך הקווים המצוירים על קרקעית הבאר. ספרו טפילים ביום ההקרבה. ספרו את הטפילים במהירות האפשרית, שכן דגירה ממושכת במים תוביל למותם ולהתפוררותם.
הערה: בנוסף לזחלים בשלב הרביעי וטפילים בוגרים, ניתן לזהות כאן גם L1 מסביבות היום החמישי. אלה קטנים בהרבה והרבה יותר נפוצים מ-L4 וטפילים בוגרים ויש להבחין ביניהם בקלות.
5. תחזוקת S. ratti בחולדות Wistar
הערה: רצוי לבצע זיהומים בחולדות על ידי שני אנשים, כאשר אדם אחד מחזיק את החולדות ואחר מבצע את הזריקה. כדי לשמור על מחזור הטפילים, חולדות וויסטאר בנות 4-8 שבועות נגועות.
- הכן צינור צנטריפוגה אחד של 1.5 מ"ל לכל חולדה המכיל 2500 iL3 ב-PBS/Pen-Strep באמצעות מנגנון ברמן כפי שהוסבר קודם. ערבבו היטב בין שלבי הפיפטינג כשהזחלים מתיישבים במהירות.
- הניחו לזחלים להתיישב בכוח הכבידה במשך 20-30 דקות (RT) ושאבו את הסופרנטנט במזרק של 0.5 מ"ל (28G) עד שנותר כ-200 מיקרוליטר של תרחיף זחלים.
- לזיהומים, הניחו את החולדות בזרוע של אדם אחד וקבעו שם את הראש בעדינות ובזהירות. האדם השני אוחז בעדינות באגף החולדה ומזריק את תרחיף ה-iL3 התלוי תת עורי לקפל העורפי.
6. תרבות פחם
- החזיקו חולדות נגועות בכלובים המכילים מספר שכבות של תאית ופחות המלטה החל מהימים 5 ו-12 לאחר ההדבקה. החלפת המלטה הזו בכמה שכבות של תאית נעשית על מנת להקל על איסוף הצואה בהשוואה לאיסוף צואה מהמלטה
- בימים 6-8 ו-13-15 p.i., העבירו את החולדות לכלוב חדש ואספו את כל הצואה מהכלוב הישן על ידי איסוף כדורי הצואה מהכלובים לאחר העברת החולדות לכלובים טריים ואיגום אותן מכלוב אחד לצינור של 50 מ"ל. איסוף צואה למשך שבועיים לפני התבססות התגובה החיסונית מפחית את עומס הזחלים בצואה. לאחר שבועיים p.i. החולדות מורדמות באמצעות נרקוזה של מנת יתרשל CO2 . לאחר היעדר קרנית ורפלקסים בין-דיגיטליים, בצע פריקת צוואר הרחם.
הערה: חולדות מדוכאות חיסון וגרבילים מונגוליים שומרים על זיהומי S. ratti לתקופות ארוכות יותר17,18. בחקר התגובה החיסונית והאימונומודולציה במהלך זיהום S. ratti, החלטנו לשמור על המחזור במארחים בעלי יכולת חיסונית כדי לשמור על לחץ הברירה של חסינות מארח שלמה. - השתמש בדגימות הצואה שנאספו להכנת תרביות פחם, שיאפשרו התפתחות של iL3 מה-L1 הקיים בצואה.
- משרים את הפחם במי ברז. לפני השימוש בפחם לתרביות, מלאו אותו במסננת ושטפו אותו תחת מי ברז זורמים עד שהמים צלולים. שמור על הפחם לח כל הזמן. משרים את הפחם לפחות 24 שעות לפני השימוש.
- מערבבים את הצואה עם פחם פעיל ספוג מראש ביחס של כ-1:1. מסדרים את התערובת בשיפוע באלכסון ומכסים אותה בשכבה נוספת של פחם פעיל בכוס זכוכית שטוחה כדי להגיע ליחס סופי של 1:2.
הערה: דגירה של הצואה עם פחם פעיל ספוג מראש מחקה את האדמה הלחה שבה iL3 מתפתח בטבע תוך מניעת זיהום פטרייתי מוגזם. - מכסים את כלי הזכוכית בסרט שקוף. ודא שיש כמה חורי אוויר כדי לאפשר זרימת אוויר.
- דגירה במשך 6-7 ימים בטמפרטורה של 25 מעלות צלזיוס בסביבות 90% לחות ללא CO2. ודא שהחממה מכילה כלי מים כדי לשמור על לחות התרביות. יש לשמור את התרביות עד 14 יום בטמפרטורה של 25 מעלות צלזיוס במידת הצורך. iL3 יתפתח באופן ישיר או עקיף19 ויישאר עצור בשלב iL3 עד להדבקה.
תוצאות
S. ratti נודד ממקום ההדבקה בעיקר לראש ובהמשך למעי במסלול שאינו מוגדר בדיוק. כדי לחקור את הלוקליזציה המדויקת ברקמת הראש ובמעי, עכברי C57BL/6 נדבקו ב-1000 iL3 לתוך כרית כף הרגל האחורית השמאלית. עכברים הוקרבו ביום הראשון עד היום ה-14 p.i., וטפילי S. ratti כומתו בראש, במוח ובריאה הקדמיים והאחוריים (איור 2), כמו גם בתריסריון, בג'ג'ונום, באילאום, בקאקום ובמעי הגס (איור 3).
ביום הראשון p.i., ה-L3 הראשון הגיע לראש, והראה פיזור אחיד (איור 2A). נוסף על כך, חלק קטן מהזחלים נלקח בריאות ביום הראשון p.i. (איור 2B). מספרי L3 עלו באופן ניכר ביום השני לממוצע של 174 L3 ±-13 בראש וממוצע של 17 ±-1.7 בריאה. לפיכך, רוב ה-L3 (כ-90%) נלקח מהראש ורק כ-10% מהריאות. רוב זחלי L3 (ממוצע 93 ±-13.3) היו ממוקמים בצד הקדמי של הראש, אך גם כ-41 ±-4.7 זחלי L3 היו ממוקמים בצד האחורי של הראש וכ-39 ±-5.8 במוח. בהתאם לתצפית זו, נוכחות של L3 במוח ובנוזל המוח השדרתי דווחה ב-24 שעות p.i. ועם מקסימום ב-48 שעות p.i. בעכברי C57BL/6 לאחר זיהום מלעורי20. ירידה מובהקת במספרי L3 הכוללים נצפתה ביום השלישי p.i. בהשוואה לעומס הזחלים ביום השני p.i. ולא נלקחו L3 מרקמת הראש ביום הרביעי p.i. (איור 2A). בהתאם לכך, הגעתם של טפילי S. ratti התגלתה במעי ביום הרביעי p.i. (איור 3A). כדי לאפשר הגדרה מדויקת של לוקליזציה של טפילים, המעי חולק למקטעים נפרדים, כלומר, תריסריון, ג'ג'ונום, אילאום, קקום ומעי גס (איור 3B). ביום הרביעי, p.i., רוב טפילי S. ratti היו ממוקמים בתריסריון ובשני השלישים הראשונים של הג'ג'ונום (איור 3A). לוקליזציה זו הייתה עקבית עד היום השישי p.i. מהיום השביעי ואילך, רוב הבוגרים של S. ratti היו ממוקמים ב-caecum, שם הם המשיכו להתקיים עד היום התשיעי p.i. (איור 3A). מספר הטפילים בקיקום ירד ביום ה-11 לסביבות 20 ול-0 ביום ה-14. לא החזרנו מספר משמעותי של טפילים מהמעי הגס הנותר בשום נקודת זמן שנותחה למעט כ-5-11 טפילים עד ליום ה-11 p.i. בעוד שהלוקליזציה של טפילי S. ratti השתנתה מיום 4 ליום 9 p.i. ורוב הבוגרים נפלטו מהמעי הדק לאחר יום 7 p.i., המספרים הכוללים שנלקחו מהמעי כולו נשארו קבועים עד היום התשיעי. L1 בר קיימא לא כומת אך ניתן לזיהוי מהיום הרביעי עד היום ה-11, עם שיא ביום השישי (הנתונים לא מוצגים).
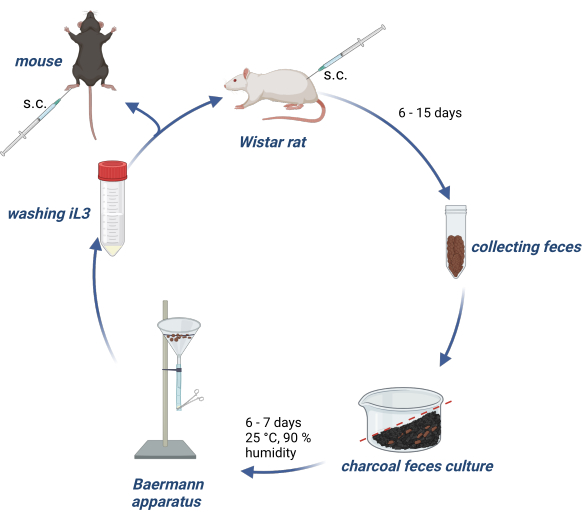
איור 1: תחזוקה של מחזור החיים של S. ratti בחולדות ובעכברים. חולדות וויסטאר מוזרקות s.c. לקפל העורפי עם 2500 iL3. לאחר 6-15 יום, הצואה שלהם נאספת, מעורבבת עם פחם פעיל ספוג במים, מסודרת בשיפוע ומכוסה בסרט שקוף, כולל חורי אוויר. תרבות זו מודגרת במשך 6-7 ימים בטמפרטורה של 25 מעלות צלזיוס ו-90% לחות. ה-iL3 מבודדים באמצעות מכשיר ברמן ונשטפים פי 3 עם PBS/Pen-Strep. עכברי ניסוי מוזרקים עם 1000 iL3 תת עורי לתוך כרית כף הרגל האחורית. נוצר עם BioRender.com. איור 1 נוצר ב-BioRender. לינמן, ל '(2024) https://BioRender.com/g80l370. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
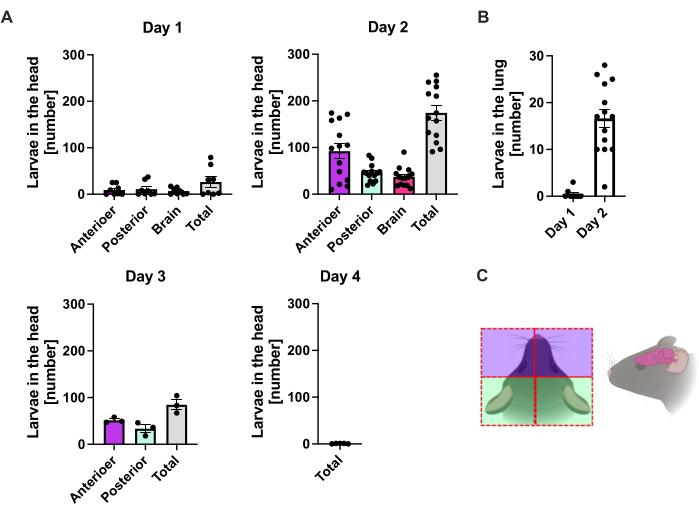
איור 2: כימות של S. ratti ברקמת הריאה והראש לאורך זמן. עכברי C57BL/6 הוזרקו עם 1000 iL3 בכרית כף הרגל האחורית. עכברים הוקרבו בנקודות הזמן שצוינו, וטפילי S. ratti בראש (A) ובריאה (B) נספרו. כל סמל מייצג את ספירת L3 של עכבר בודד; גרף העמודות מציג את הערך הממוצע, וקווי השגיאה מציינים SEM. הגרפים מציגים נתונים משולבים מניסויים בודדים. יום 1: שני ניסויים בלתי תלויים עם n=4 לנקודת זמן וניסוי; יום 2: ארבעה ניסויים בלתי תלויים עם n=4, n=4, n=6 ו-n=3; יום 3: שני ניסויים בלתי תלויים עם n=4 ו-n=3; יום 4: ניסוי אחד עם n=5. (C) קריקטורה סכמטית המציגה את האזורים הבודדים של הראש המשמשים לבידוד. הקו המקווקו האדום מציין את נתיב החתך. איור 2C נוצר ב-BioRender. לינמן, ל. (2024) https://BioRender.com/t83e660. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
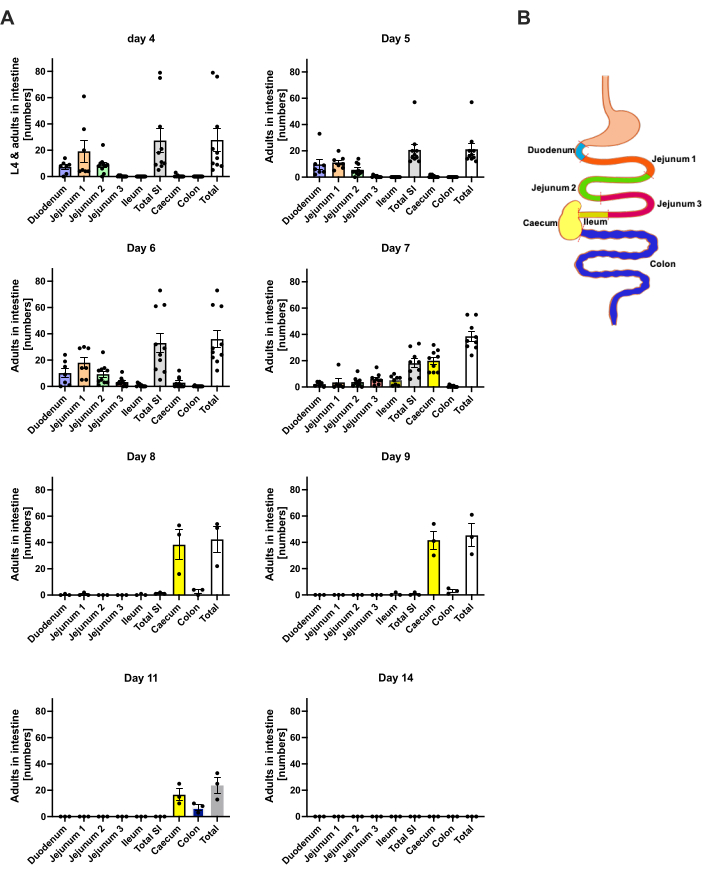
איור 3: כימות של S. ratti באזורי המעי לאורך זמן. עכברי C57BL/6 זכרים הוזרקו עם 1000 iL3 בכרית כף הרגל האחורית. (A) עכברים הוקרבו בנקודות הזמן שצוינו, וטפילי S. ratti מלבד L1 נספרו באזורים הבאים: תריסריון, ג'ג'ונום 1-3, אילאום, קקום ומעי גס. (B) סקירה סכמטית של אזורי המעיים השונים. כל סמל מייצג את ספירת הטפילים של עכבר בודד; גרף העמודות מציג את הממוצע, וקווי השגיאה מציינים SEM. מוצגים נתונים משולבים מניסויים בודדים. יום 4: שני ניסויים עצמאיים עם n=4 ו-n=6 עכברים; יום 5: שני ניסויים עצמאיים עם n=4 ו-n=6; יום 6: שני ניסויים עצמאיים עם n=4 ו-n=6; יום 7: שני ניסויים בלתי תלויים עם n=6 ו-n=3; ימים 8 עד 14: ניסוי אחד עם n=3. SI: מעי דק. איור 3B נוצר ב-BioRender. לינמן, ל. (2024) https://BioRender.com/h27y297. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
Discussion
ההדבקה של עכברי ניסוי ב-S. ratti מייצגת מודל מצוין לחקר אופי התגובות החיסוניות המגנות לזיהומי הלמינת'ס במספר אתרים ושלבי חסינות. באמצעות קווי עכבר KO שונים ומודלים של דלדול תאים או ציטוקינים, ניתן לחקור את תפקידם של תאים חיסוניים, מתווכים או קולטנים ספציפיים במודל זיהום הלמינת'ס חריף. האפשרות לכמת את עומס הטפילים בראש כמו גם במעי מציעה אפשרות להבדיל את תפקידם של תאי מערכת החיסון והאפקטורים ברקמות ובשלבים שונים במהלך מחזור החיים של הטפיל. דלדול סוגי תאים ספציפיים באמצעות הזרקות נוגדנים מאפשר לחקור את תפקידם, במיוחד במהלך התגובה החיסונית של המעי אם הטיפול המדלדל מתחיל לאחר השלמת שלב נדידת הרקמות. אם תרצה, ניתן לחלק את המעי עוד יותר לתריסריון, ג'ג'ונום, אילאום, קקום ומעי גס כדי לזהות אפילו שינויים קלים בלוקליזציה של הטפיל או בקינטיקה של הפינוי. יש לציין כי השונות הבין-ניסויים והתוך-ניסויים בניסויי זיהום אלה, אפילו בעכברים מולדים, היא גבוהה למדי, ומשקפת את השונות שנוצרה על ידי האינטראקציה של הטפיל והפונדקאי כמו גם קבוצות שונות של S. ratti L3 המציגות יעילות זיהום שונה (ראה איור 2 ואיור 3). כדי להפחית את השונות, הגיל והמין של עכברי הניסוי צריכים להיות דומים. יתר על כן, אם משווים בין עכברי KO ו-WT, מומלץ מאוד להשתמש בבקרות המלטה במקום בעכברי WT שמקורם במושבת רבייה עצמאית. עם זאת, אם משתמשים בכמות מדגמית מספקת, ניתן להפיק תוצאות אמינות המשווים את עומס הטפילים בעכברים חסרים או מוכשרים לאפקטורים מסוימים, מה שמוביל לתמונה ברורה של אפקטורים חיסוניים המעורבים בתגובה החיסונית המגנה ל-S. ratti (נסקר ב-6).
מאפיין ייחודי מרכזי של S. ratti בהשוואה למודלים אחרים של זיהום נמטודות, כגון S. venezuelensis או N. brasiliensis, הוא נתיב הנדידה הייחודי של הזחלים בתוך הפונדקאי. בניגוד ל-N. brasiliensis ו-S. venezuelensis, שמחזורי החיים שלהם מכילים שלב ריאתי 21,22,23 S. ratti עוקף בעיקר את הריאה ונודד דרך רקמת השריר והעור לראש, 8,12. רק כ-10% מהטפילים ששרדו ביום השני לספירה נמצאים בריאות. בינתיים, מיקומו של S. ratti בראש מתמקד באזור האף-פרונטלי, בהתאם למחקרים קודמים8. מאפיינים אלה הופכים את S. ratti למודל רב ערך לחקר האינטראקציות בין הפונדקאי לטפיל, במיוחד ברקמת העור והשריר כמו גם ברקמה המנקזת את בלוטות הלימפה ומאפשר מחקרים על התגובות החיסוניות שעלולות להיות מטושטשות או מסובכות על ידי מעורבות ריאתית ממושכת כמו במודלים אחרים של זיהום נמטודות. באופן מדהים, S. ratti L3 נלקח גם מהנוזל השדרתי20 ומהמוח (איור 2A), אף על פי שתסמינים נוירולוגיים או מוות הנגרמים על ידי זיהום הם נדירים יחסית ומעולם לא נצפו במתקן החי שלנו. מחקר עתידי עשוי להבהיר אם הטפילים המקומיים במוח לכודים או אם קיים נתיב למעי.
לסוג Strongyloides יש גם יכולת ייחודית ליצור דורות חיים חופשיים בין הדורות הטפילים24. שלב החיים החופשי של S. ratti, כמו גם רבייתו על ידי פתוגנזה, מקלים בנוסף על יצירת זחלים טרנסגניים. השימוש במיקרו-הזרקות לנקבות חופשיות איפשר יצירת זחלים המבטאים אנטיגנים מודלים כמו 2W1S שהתמזגו לחלבון פלואורסצנטי ירוק. בעוד שביטוי האפיטופ אבד במהלך ההיתוך למבוגרים, הוא איפשר מעקב ואפיון של תאי CD4+ T ספציפיים ל-S. ratti בבלוטות הלימפה המנקזות את הריאות והריאות25. גישה זו מספקת כלי מצוין לחקר הביולוגיה של תאי CD4+ T בהקשר של זיהומי הלמינת'ס ופיתוח חיסון נגד הלמינת'ס.
S. ratti הוא אורגניזם מודל רב-תכליתי למחקר אימונולוגי של טפילי הלמינת'ס המציגים רקמות נודדות ושלבי חיים במעיים באופן כללי. זיהומי S. stercoralis אנושיים מאופיינים בכרוניות קיצונית עקב הזיהום העצמי המתרחש, מה שעלול להוביל גם לתסמונת זיהום יתר במארחים מדוכאי חיסון, בעיקר חולים המקבלים טיפול גלוקוקורטיקואיד לאחר ההשתלה26. יש לציין כי היבט זה של זיהום עצמי וזיהום יתר קשה למודל בעכברים. לא RAG1 KO נגוע ב-S. ratti ולא עכברים עירומים 5,27 רגישים לזיהום יתר. יש לציין כי מודל עכברי אחד של זיהום יתר ב-S. stercoralis הוקם באמצעות עכברים מדוכאי חיסון חמורים שטופלו בגלוקוקורטיקוסטרואידים (NOD.Cg-PrkdcscidIl2rgtm1Wjl/SzJ), מה שעשוי לאפשר ניתוח של לפחות היבטים של תסמונת ההיפר-זיהום בעכברים בסופו של דבר28.
עם זאת, מחקרים שהשתמשו בזיהום S. ratti בעכברים הראו כי אאוזינופילים ונויטרופילים ממלאים תפקיד לא מיותר במיגור זחלים נודדי רקמות. הדלדול או ההיעדרות בעכברים מהונדסים גנטית הביאו לעלייה במספרי L3 בראש8. בעוד שתאי פיטום וגרנולוציטים בזופילים היו ניתנים לחלוקה בשלב נדידת הרקמות, גם תאי פיטום וגם בזופילים תרמו לשליטה בעומס טפילי המעי. היעדרם לא השפיע על מספרי L3 ברקמה אך העלה את מספר טפילי S. ratti הבוגרים במעי ביום 6 p.i.12,29. ניתוח נוסף גילה כי היעדר בזופילים או תאי פיטום סלקטיביים של רקמת חיבור איפשר סיום זיהום עם קינטיקה של WT. לעומת זאת, עכברים חסרי רקמת חיבור ותאי פיטום ריריים נשארו נגועים במשך 20 שבועות12. ממצאים אלה חשפו תפקיד מרכזי לתאי פיטום ריריים בסיום הזיהום הסופי, והדגישו את ערכו של מודל זיהום זה בהבהרת תפקודם של תאי פיטום ריריים במהלך זיהום הלמינת'ס. הגדרה נוספת של שינויים פוטנציאליים בלוקליזציה של טפילי S. ratti במעי בהיעדר תאי אפקטור אימונולוגיים מסוימים תעזור להגדיר את תפקודם בחסינות נגד הלמינת'ס בצורה מדויקת עוד יותר.
יתר על כן, ניתן לחקור מנגנונים חמקמקים ממערכת החיסון המופעלים על ידי הלמינת'ס כדי להקל על הישרדותם במערכת זו. הוכח כי דלדול של תאי T רגולטוריים של Foxp3+ או מחיקת קולטן רגולטורי על תאי T אפקטיביים, ששניהם הושרו במהלך זיהום S. ratti, הפחיתו את עומס הטפילים ביום 6 p.i. ואת תפוקת הזחלים לאורך ההדבקה 15,16,30,31. יתר על כן, ניתן היה להגדיר את המעי כרקמה הממוקדת על ידי התחמקות חיסונית והפעלת תאי פיטום בתיווך IL-9 כאשר המסלול החיסוני מדוכא. לבסוף, ניתן לחקור את המנגנון של התחלת חסינות מסוג 2 בתיווך ILC2 על ידי ציטוקינים אזעקה שמקורם ברקמות כגון IL-33 באמצעות מדכאים ומשפרים של IL-3332 אנדוגני.
הבידוד של מספרים גדולים של iL3 באמצעות הברמן מציג אפשרות למחקרי מבחנה נוספים. תרביות משותפות של L3 עם תאים חיסוניים או מועמדים פוטנציאליים לתרופות מאפשרות חקירה ישירה של ההשפעות על הכדאיות והתנועתיות של L3. גירוי ex vivo של תאים שבודדו מעכברים נגועים עם S. ratti antigen lysate או L3 בר קיימא מספק פלטפורמה לחקר ייצור ציטוקינים בסוגי תאים שונים. לבסוף, ניתן להשתמש בשברי חלבון ושומנים של L3 לזיהוי דפוסים מולקולריים הקשורים לפתוגן שמקורו ב-S. ratti או מולקולות אפקטור אימונומודולטוריות
מכיוון שזיהומי הלמינת'ס עדיין מהווים נטל בריאותי גדול ברחבי העולם, מחקר להבהרת התגובות החיסוניות הנגרמות על ידי הלמינת'ס ומנגנון ההתחמקות המופעל על ידי הטפילים נותר חיוני לשיפור אפשרויות הטיפול ולפיתוח אסטרטגיות מניעה כגון חיסונים. זיהום S. ratti בעכברים מציג מודל רב-תכליתי למחקר על אינטראקציות הלמינת'ס-מארח במהלך מודל זיהום חריף.
Disclosures
למחברים אין ניגוד אינטרסים. מודל השפה Perplexity AI 2024 שימש לתיקון טיוטות טקסט ושיפור ניסוחים.
Acknowledgements
עבודה זו נתמכה על ידי קרן יורגן מנצ'וט ואיגוד המחקר הגרמני (Grant BRE 3754/6-1 ו-BRE 3754/10-1). איורים 1, 2C ו-3B נוצרו ב-BioRender.com.
Materials
| Name | Company | Catalog Number | Comments |
| 50 ml tubes | Sarstedt, N mbrecht, DE mbrecht, DE | 6,25,47,254 | 50 ml https://www.sarstedt.com/produkte/labor/reagenz-zentrifugenroehren/roehren/produkt/62.547.254/ |
| BD Micro-Fine U100 Insulin 0.5 ml | BD Bioscience | 7468077 | 0.5 ml https://www.bestimed.de/bd-micro-fine-insulinspritze-05-ml-u100-8-mm-100x05ml-324825.html |
| centrifugeation tubes | Sarstedt, Nümbrecht, DE | 72,706 | 1.5 ml https://www.sarstedt.com/produkte/labor/mikro-schraubroehren-reagiergefaesse/reagiergefaesse/produkt/72.706/ |
| Charcoal | Roth | 0998.3 | 5 kg https://www.carlroth.com/de/de/aktivkohle/aktivkohle/p/0998.3 |
| Falcon 6-well Clear Flat Bottom, not treated cell multiwell culture plate, with Lid, sterile | Corning | 351146 | 6-well https://www.corning.com/emea/de/search.html?_cookie=false &searchText=351146&search-initialcatalog =Corporate+Communications& initialResultType=products |
| Freezer & Refrigerator | Liebherr-Hausgeräte, Rostock, DE | ||
| Greiner Bio-One 24-Well-Platten für Zellkulturen aus Polystyrol | Fisher Scientific | 10177380 | 24-well https://www.fishersci.de/shop/products/polystyrene-24-well-cell-culture-multiwell-plate/10177380#?keyword=24-well |
| Incidin Premium Wipes | Ecolab Healthcare | 100 10 279 | https://www.ecolabhealthcare.de/website/seiten/produkte/flaechendesinfektion/tuecher/incidin_premium_wipes.php |
| Incubator 25°C | Heraeus Instruments, Hanau, DE | ||
| Incubator 37°C | Heraeus Instruments, Hanau, DE | ||
| Microscope | Helmut Hund, Wetzlar, DE | 4 x objectiv lens, 10 x ocular lens | |
| Parafilm M | Parafilm | 11772644 | 4 in. X 125 ft. https://www.fishersci.de/shop/products/parafilm-m-laboratory-wrapping-film-2/11772644 |
| Penicillin/Streptomycin (Pen-Strep) | Capricorn | PS-B | 100x https://www.capricorn-scientific.com/en/shop/penicillin-streptomycin-pen-strep-100x~p1205 |
| ROTI Fair 10x PBS 7.4 | Roth | 1105.1 | https://www.carlroth.com/de/de/fertigloesungen-tabletten-portionsbeutel/rotifair-10x-pbs-7-4/p/1105.1 |
References
- Olsen, A., et al. Strongyloidiasis - the most neglected of the neglected tropical diseases. Trans Royal Soc Tropical Med Hygiene. 103 (10), 967-972 (2009).
- Buonfrate, D., et al. The global prevalence of Strongyloides stercoralis infection. Pathogens. 9 (6), 468 (2020).
- Dawkins, H. J. S., Grove, D. I. Attempts to establish infections with Strongyloides stercoralis in mice and other laboratory animals. J Helminthol. 56 (1), 23-26 (1982).
- Abraham, D., et al. Strongyloides stercoralis: protective immunity to third-stage larvae inBALB/cByJ mice. Exp Parasitol. 80 (2), 297-307 (1995).
- Breloer, M., Abraham, D. Strongyloides infection in rodents: immune response and immune regulation. Parasitology. 144 (3), 295-315 (2017).
- Breloer, M., Linnemann, L. Strongyloides ratti infection in mice: immune response and immune modulation. Philosophical Trans Royal Society B. 379 (1894), 20220440 (2024).
- Dawkins, H. J. S., Grove, D. I., Dunsmore, J. D., Mitchell, G. F. Strongyloides ratti: Susceptibility to infection and resistance to reinfection in inbred strains of mice as assessed by excretion of larvae. Int J Parasitol. 10 (2), 125-129 (1980).
- Ehrens, A., et al. Eosinophils and neutrophils eliminate migrating Strongyloides ratti larvae at the site of infection in the context of extracellular DNA trap formation. Front Immunol. 12, 715766 (2021).
- Eschbach, M. L., et al. Strongyloides ratti infection induces transient nematode-specific Th2 response and reciprocal suppression of IFN-γ production in mice. Parasite Immunol. 32 (5), 370-383 (2010).
- Dawkins, H., Muir, G., Grove, D. Histopathological appearances in primary and secondary infections with Strongyloides ratti in mice. Int J Parasitol. 11 (1), 97-103 (1981).
- Tada, I., Mimori, T., Nakai, M. Migration route of Strongyloides ratti in albino rats. Jap J Parasit. 28 (4), 219-227 (1979).
- Reitz, M., et al. Mucosal mast cells are indispensable for the timely termination of Strongyloides ratti infection. Mucosal Immunol. 10 (2), 481-492 (2017).
- Viney, M. E., Lok, J. B. The biology of Strongyloides spp. WormBook. , 1-17 (2018).
- Reitz, M., et al. Interleukin-9 promotes early mast cell-mediated expulsion of Strongyloides ratti but is dispensable for generation of protective memory. Sci Rep. 8 (1), 8636 (2018).
- Breloer, M., et al. Cutting edge: The BTLA-HVEM regulatory pathway interferes with protective immunity to intestinal Helminth infection. J Immunol. 194 (4), 1413-1416 (2015).
- Blankenhaus, B., et al. Foxp3+ regulatory T cells delay expulsion of intestinal nematodes by suppression of IL-9-driven mast cell activation in BALB/c but not in C57BL/6 mice. PLoS Pathogens. 10 (2), e1003913 (2014).
- Niamatali, S., Nolan, T. J., Schad, G. A. . Can Autoinfection be Provoked in the Strongyloides ratt/-infected Gerbil, Meriones unguiculatus. 59 (2), 149-152 (1992).
- Gardner, M. P., Gems, D., Viney, M. E. Extraordinary plasticity in aging in Strongyloides ratti implies a gene-regulatory mechanism of lifespan evolution. Aging Cell. 5 (4), 315-323 (2006).
- Viney, M. E. Developmental switching in the parasitic nematode Strongyloides ratti. Proc Biol Sci. 263 (1367), 201-208 (1996).
- Dawkins, H. J., Thomason, H. J., Grove, D. I. The occurrence of Strongyloides ratti in the tissues of mice after percutaneous infection. J Helminthol. 56 (1), 45-50 (1982).
- Takamure, A. Migration route of Strongyloides venezuelensis in rodents. Int J Parasitol. 25 (8), 907-911 (1995).
- Filbey, K., Bouchery, T., Le Gros, G. The role of ILC 2 in hookworm infection. Parasite Immunol. 40 (2), e12429 (2018).
- Allen, J. E., Sutherland, T. E. Host protective roles of type 2 immunity: Parasite killing and tissue repair, flip sides of the same coin. Semin Immunol. 26 (4), 329-340 (2014).
- Dulovic, A., Puller, V., Streit, A. Optimizing culture conditions for free-living stages of the nematode parasite Strongyloides ratti. Exp Parasitol. 168, 25-30 (2016).
- Douglas, B., et al. Transgenic expression of a T cell epitope in Strongyloides ratti reveals that helminth-specific CD4+ T cells constitute both Th2 and Treg populations. PLOS Pathogens. 17 (7), e1009709 (2021).
- Vadlamudi, R. S., Chi, D. S., Krishnaswamy, G. Intestinal strongyloidiasis and hyperinfection syndrome. Clin Mol Allergy. 4 (1), 8 (2006).
- Viney, M., Kikuchi, T. Strongyloides ratti and S. venezuelensis- rodent models of Strongyloides infection. Parasitology. 144 (3), 285-294 (2017).
- Patton, J. B., et al. Methylprednisolone acetate induces, and Δ7-dafachronic acid suppresses, Strongyloides stercoralis hyperinfection in NSG mice. Proc Natl Acad Sci. 115 (1), 204-209 (2018).
- Reitz, M., Brunn, M. L., Voehringer, D., Breloer, M. Basophils are dispensable for the establishment of protective adaptive immunity against primary and challenge infection with the intestinal helminth parasite Strongyloides ratti. PLOS Neglected Trop Dis. 12 (11), e000699 (2018).
- Blankenhaus, B., et al. Strongyloides ratti infection induces expansion of Foxp3+ regulatory T cells that interfere with immune response and parasite clearance in BALB/c Mice. J Immunol. 186 (7), 4295-4305 (2011).
- Hartmann, W., Blankenhaus, B., Brunn, M. L., Meiners, J., Breloer, M. Elucidating different pattern of immunoregulation in BALB/c and C57BL/6 mice and their F1 progeny. Sci Rep. 11 (1), 1536 (2021).
- Meiners, J., et al. IL-33 facilitates rapid expulsion of the parasitic nematode Strongyloides ratti from the intestine via ILC2- and IL-9-driven mast cell activation. PLOS Pathogens. 16 (12), e1009121 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved