Method Article
Экспериментальное заражение мышей паразитической нематодой Strongyloides ratti
В этой статье
Резюме
Strongyloides ratti — паразитическая нематода, вызывающая транзиторные инфекции у лабораторных мышей, демонстрируя миграцию тканей и кишечные жизненные стадии. Здесь мы представляем протокол поддержания цикла паразитов у крыс и экспериментальное заражение мышей, включая количественное определение паразитов в голове, легких и кишечнике.
Аннотация
Strongyloides ratti — паразитическая нематода, которая естественным образом заражает диких крыс. Тем не менее, большинство лабораторных линий крыс и мышей полностью восприимчивы к инфекции. Иммунокомпетентные мыши BALB/c и C57BL/6 прекращают инфекцию S. ratti в течение месяца в контексте канонического иммунного ответа типа 2 и остаются полурезистентными к повторному заражению. Течение инфекции можно разделить на три фазы: (а) фаза миграции в ткани инфекционных личинок третьей стадии в течение первых двух дней; (b) ранняя кишечная фаза, включая линьку до взрослых паразитов и внедрение в слизистую оболочку кишечника на 3-6-й день после заражения с размножением, начинающимся на 5-6-й день после заражения; в) более поздняя фаза кишечника, заканчивающаяся полным очищением от паразитов. Экспериментальные инфекции мышей S. ratti позволяют точно изучить взаимодействие хозяина и паразита на протяжении всего жизненного цикла в различных местах инфекции, а также стратегии уклонения от иммунитета, используемые паразитом. Представленный здесь протокол описывает поддержание паразита у крыс линии Wistar, заражение лабораторных мышей, а также обнаружение и количественное определение паразитов S. ratti в фазе миграции тканей и во время кишечной фазы.
Введение
Гельминт, передающийся через почву, Strongyloides stercoralis вызывает стронгилоидоз – болезнь, которую часто называют наиболее забытой среди забытых тропических болезней1. По оценкам за 2020 г., во всем мире насчитывается 600 миллионов случаев инфицирования S. stercoralis 2. Лабораторные исследования S. stercoralis, основанные на гипотезах, ограничены, поскольку гельминт не способен развиваться дальше личинок третьей стадии (L3) у мышей 3,4. Следовательно, специфичная для грызунов нематода Strongyloides ratti обычно используется для исследований инфекции in vivo на лабораторных мышах 5,6. S. ratti является естественным паразитом диких крыс, но большинство лабораторных линий мышей полностью восприимчивы к инфекции7. Это позволяет изучать взаимодействие хозяина и патогена и иммунные реакции в различных тканях и живых стадиях гельминта.
Лабораторный цикл S. ratti у мышей можно разделить на три основные фазы. После подкожного введения определенного количества инфекционных личинок третьей стадии (iL3), обычно от 1000 до 2000, большинство (около 90 %) выживших L3 мигрируют в голову мышей в течение первых двух дней инфекции, и только очень небольшая часть (около 10 %) извлекается влегкие. S. ratti активно проникает в кожу своего хозяина-грызуна. Можно имитировать этот естественный путь заражения в лаборатории, поместив каплю воды, содержащей iL3, на кожу мышей и позволив ей активно заболеть чрескожной инфекцией. Однако эффективность инфекции значительно ниже, и контроль точной дозы инфекции невозможен. Точный путь миграции S. ratti iL3 после чрескожной или подкожной инфекции остается неизвестным. Однако, поскольку ДНК S. ratti не может быть обнаружена в крови или органах, хорошо снабжаемых кровью, таких как почкиинфицированных мышей8, основной путь миграции может не включать кровоток. Тем не менее, S. ratti не мигрирует случайным образом по тканям. Скорее, несколько исследований с использованием гистологии на мышах 3,10 икрысах 11 или количественной оценки жизнеспособной ДНК L3 и S. ratti, полученной из различныхтканей8, свидетельствуют о том, что S. ratti L3 мигрирует из места инфекции непосредственно через кожу и мышечную ткань преимущественно в нософронтальную область головы.
Примерно 10 % введенных личинок выживают после миграции тканей и достигают головы у мышей C57BL/6 и BALB/c, которые демонстрируют сопоставимые числа L3 в тканях головы12. Считается, что личинки проглатываются и попадают в кишечник на 3-й день после заражения (p.i.). Они встраиваются в слизистую оболочку тонкой кишки, линяют до взрослых самок паразитов и начинают размножаться путем партеногенеза к 5-6 дню 13 года. Яйца, но в основном уже вылупившиеся личинки первой стадии (L1), попадают в кишечник и выделяются с калом. Пик численности взрослых самок достигается примерно на 6 день 14 дня. Интересно, что мыши C57BL/6 демонстрируют в 2-5 раз более высокую кишечную паразитарную нагрузку, чем мыши BALB/c, несмотря на сопоставимое количество мигрирующих тканей L3 в голове у обеих линий мышей12. В течение первой недели нагрузка кишечных паразитов у иммунокомпетентных мышей C57BL/6 и мышей с нокаутом (KO) RAG1, у которых отсутствуют В- и Т-клетки, одинакова, что позволяет предположить, что ранний контроль над паразитами опосредован врожденным иммунитетом12,15. На последней фазе паразиты выводятся из кишечника в течение 2-4 недель у иммунокомпетентных мышей (рассмотрено впункте 6). Мыши RAG1 KO не способны избавиться от инфекции и содержат небольшое количество жизнеспособных и размножающихся взрослых самок в тонком кишечнике в течение 1 года12 лет.
После разрешения первой инфекции или иммунизации облученным L3 иммунокомпетентные мыши C57BL/6 и BALB/c становятся полуустойчивыми к повторному заражению. Только 1 % первоначально привитого iL3 достигает головы, и только примерно 1-5 взрослых паразитов могут быть извлечены из кишечника во время второй инфекции8. Таким образом, использование лабораторной инфекции мышей S. ratti дает инструмент для изучения влияния врожденной, а также адаптивной иммунной системы на полный жизненный цикл кишечной нематоды с фазами миграции тканей.
В данной рукописи мы подробно описываем поддержание жизненного цикла S. ratti у крыс линии Wistar, а также экспериментальное заражение мышей и количественную оценку паразитарной нагрузки в различных местах заражения. Путем точной количественной оценки концентрации паразита S. ratti в голове и легочной ткани, а также в кишечнике подопытных мышей можно проанализировать роль определенных иммунных эффекторов в отношении мигрирующей в ткани или кишечной стадии жизни этой паразитической нематоды. Иммунные реакции у мышей дикого типа и мышей, у которых отсутствуют специфические иммунные эффекторные клетки, рецепторы или медиаторы, представляющие интерес, могут быть сравнены, как подробно описано в обсуждении 5,6.
протокол
Эксперименты на животных проводились в соответствии с Законом о защите животных, а протоколы экспериментов были одобрены немецким органом власти (Behörde für Gesundheit und Verbraucherschutz) земли Гамбург. На рисунке 1 представлен обзор поддержания жизненного цикла S. ratti у крыс линии Wistar и производства iL3 для инфицирования подопытных мышей или крыс.
1. Подготовка инфекционных личинок
- Подготовьте аппарат Бермана, как показано на рисунке 1. Закройте дно шланга хомутом под косым углом и поместите в сито салфетку. Наполните теплой водой (примерно 35-37 °C) до тех пор, пока сито не покроется водой.
- Заполните сито фекально-угольной смесью, приготовленной, как описано ниже (шаг 6). Смесь должна быть полностью покрыта водой.
- Включите свет непосредственно за аппаратом Бермана. Жизнеспособный iL3 будет активно мигрировать через вайп.
- Через 30 мин личинки оседают над зажимом, соберите их в пробирку объемом 50 мл, коротко открыв зажим. Соберите всю гранулу, но убедитесь, что объем как можно меньше.
- Заполните пробирку объемом 50 мл PBS, содержащей 1% пенициллин-стрептомицина (PBS/Pen-Strep), и дайте личинкам осесть на дне пробирки под действием силы тяжести при 4 °C в течение 30 минут. Осторожно удалите надосадочную жидкость с помощью пипетки и повторите этап промывания 3 раза.
- После третьего этапа промывки повторно суспендируйте гранулу в дозе от 30 до 50 мл PBS/Pen-Strep, в зависимости от размера гранул. Перенесите 1 мкл капель раствора на предметное стекло для микроскопии. Перемешивайте раствор непосредственно перед пипетированием, так как iL3 быстро оседает.
- Осмотрите капли под инверсным микроскопом при 40-кратном увеличении. iL3 должен двигаться ярко. Подсчитайте iL3 на 1 мкл капли в 5–10 повторениях и рассчитайте среднее значение на мкл.
2. Заражение мышей
ПРИМЕЧАНИЕ: Подготовленный iL3 можно хранить в PBS/Pen-Strep при температуре 4 °C в пробирке объемом 50 мл, которую следует держать горизонтально, чтобы не повредить iL3. Жизнеспособность in vitro , о которой свидетельствует яркое движение iL3, остается неизменной в течение 1 недели в наших руках. Поскольку систематического сравнения инфекционности L3 после разного времени хранения не проводится, мы используем свежеприготовленный iL3 и хранящийся iL3 в течение максимум 24 часов после приготовления в качестве внутреннего стандарта. Возможны случаи заражения более старыми партиями iL3. Тем не менее, обязательно использование одной и той же партии iL3 для заражения разных групп в рамках одного эксперимента. Инфицирование мышей предпочтительно проводить вдвоем, причем один человек держит мышь, а другой выполняет инъекцию.
- Приготовьте одну центрифужную пробирку объемом 1,5 мл на каждую мышь, содержащую в общей сложности 1000 мл3 (C57BL/6) или 2000 мл3 (BALB/c), как описано выше на шаге 1.7, в PBS/Pen-Strep, которые были приготовлены с использованием устройства Бермана, как описано выше (шаг 1). Тщательно перемешивайте между этапами пипетирования, так как iL3 быстро оседает.
- Дайте iL3 отстояться под действием силы тяжести в течение 20-30 минут при комнатной температуре (RT) и отасуньте надосадочную жидкость с помощью шприца объемом 0,5 мл как можно полнее, оставив в пробирке около 30 μл суспензии iL3. Ресуспендируйте iL3 с помощью шприца объемом 0,5 мл (28G) или щелкнув по трубке, и аспирируйте оставшуюся суспензию.
ПРИМЕЧАНИЕ: iL3 с меньшей вероятностью прилипнут к влажному пластику, чем сухой шприц. Следовательно, выгодно использовать один и тот же шприц для снятия надосадочной жидкости. - Мышей не нужно обезболивать от инфекции. Возьмите мышей за загривок и возьмитесь за одну заднюю лапу мышей. Используйте женский и мужской C57BL/6 в возрасте старше 8 недель и весом не менее 20 г. Введите весь раствор, содержащий iL3, подкожно в подушечку стопы под плоским углом. Медленно втяните шприц, чтобы избежать выливания личиночной суспензии из места прокола. Образуется очень маленький купол, содержащий жидкость. Это будет поглощено само собой.
ПРИМЕЧАНИЕ: Подкожная инфекция в подушечку стопы, а не в бок или затылок имитирует естественную инфекцию iL3, которая живет во влажной земле, удобренной фекалиями, и активно проникает в неповрежденную кожу. Кроме того, первый дренирующий лимфатический узел (ЛН) определяется как подколенный ЛН. Этот LN может быть использован для анализа ранних (т.е. на 2-й день) иммунологических изменений, например, экспансии регуляторных Т-клеток Foxp3+ в ответ на инфекцию, как показано нарисунке 16.
3. Подсчет iL3 в голове и легких инфицированных мышей
- Для анализа нагрузки личинок в тканях умерщвляйте мышей в день 1-3, так как пик нагрузки личинок приходится на день 2 p.i.8,12. Проводят эвтаназию при передозировкеСО2 наркозом. После отсутствия роговицы и межпальцевых рефлексов выполняют вывих шейки матки.
- Опрыскайте живот и шею коммерческим дезинфицирующим средством и разрежьте кожу над животом ножницами. Оттяните кожу назад, чтобы открыть переднюю брюшную стенку, и разрежьте по средней линии, чтобы открыть брюшинную полость. Разрежьте диафрагму и разрежьте ребра с обеих сторон, чтобы обнажить легкое в плевральной полости.
- Соберите доли легких в 24-луночный планшет, разделенный линиями, содержащими 1 мл водопроводной воды. Нарисуйте или распечатайте линии на пластине на расстоянии около 4 мм. Расстояние между линиями должно позволять видеть обе линии одновременно при 40-кратном увеличении.
- Разрежьте все легкое на шесть частей примерно 0,75 см х 0,75 см.
- Отрежьте голову ножницами для кости. Снимите кожу и шерсть с помощью пальцев. Старайтесь удалять как можно меньше мышечной ткани.
- Расчлените всю голову (включая мозг и кости) на четыре четверти позади глаз и в продольном направлении через середину головы (см. рисунок 2C). Поместите передний и задний квадранты в лунку из 6-луночной пластины, отмеченную линиями, содержащими 2 мл водопроводной воды. Положите салфетку разрезами вниз в воду.
ПРИМЕЧАНИЕ: Обычно этот подход дает точную запись количества личинок, мигрирующих из тканей головы. Если необходим отдельный анализ чисел L3 в мозге, можно включить шаг 3.7. - Если требуется отдельный анализ мозга, удалите кожу с головы с помощью пальцев. Затем с помощью ножниц просверлите тюбетейку между глазами. Из этого разреза вскройте верхнюю часть сагиттала черепа неиспользованными или тщательно вычищенными ножницами. Чтобы обнажить мозг, вскройте пинцетом правую и левую тюбетейки. С помощью шпателя приподнимают мозг с передней стороны вверх, а нервные канатики перерезают чистыми ножницами. Извлеките мозг и перенесите его в 24-луночную пластину, отмеченную линиями, содержащими водопроводную воду.
- Поместите планшеты в инкубатор при температуре 37 °C. Инкубировать в течение 3 ч, вращая планшеты каждый час (ч) 10 раз. После инкубации проведите в последний раз, щипцами удалите оставшиеся части ткани из лунок, а ткани выбросьте.
- Полностью подсчитайте каждую личинку в оставшейся воде в колодцах под перевернутым микроскопом с 40-кратным увеличением, двигаясь по линиям, нарисованным на дне скважины. Подсчитайте личинки, мигрирующие в ткани, в один и тот же день, чтобы повысить вероятность результатов.
4. Подсчет паразитов S. ratti в кишечнике инфицированных мышей
- Для анализа концентрации паразитов в кишечнике мышей в интересующий их день используют день 3-21.i. для полной кинетики. Пик паразитарной нагрузки у мышей C57BL/6 и BALB/c в тонком кишечнике приходится на 6-й день p.i.14. Проводят эвтаназию при передозировкеСО2 наркозом. После отсутствия роговицы и межпальцевых рефлексов выполняют шейный вывих.
- Смочите брюшную область мышей в дезинфицирующем средстве и разрежьте кожу над животом. Оттяните кожу назад, чтобы открыть переднюю брюшную стенку, и разрежьте по средней линии, чтобы открыть брюшинную полость.
- Удалите весь кишечник, разрезав между желудком и проксимальным отделом двенадцатиперстной кишки, а также между толстой кишкой и анусом (см. рисунок 3B). Аккуратно вытащите кишечник пальцами и поместите его в чашку Петри с водой из-под крана.
- Разрежьте кишечник, раскройте в продольном направлении и промойте кал и слизь, энергично встряхивая в водопроводной воде не менее 10 с. Незначительная часть взрослых паразитов и некоторое количество L1 будут вымыты, но жизнеспособные L4 и взрослые паразиты S. ratti внедряются в слизистую оболочку кишечника мышей дикого типа (WT) и не будут удалены на этом этапе промывания.
- Если есть интерес, разделите кишечник дальше, как описано ниже.
- Изолируйте двенадцатиперстную кишку разрезом после второго пейерова пятна (примерно 2-3 см). Изолируйте подвздошную кишку двумя разрезами, один на первом, а другой на втором пейеровом пятне (примерно 1-2 см). Изолируйте тощую кишку после выделения двенадцатиперстной кишки и подвздошной кишки, так как это оставшийся участок.
- Разделите тощую кишку на три равные части, чтобы можно было очень точно определить локализацию паразита. Изолируйте слепую кишку между подвздошной и толстой кишкой. Изолируйте толстую кишку, разрезав после слепой кишки. Большинство взрослых паразитов могут быть обнаружены в первой трети тонкой кишки (см. рисунок 3B).
- Переложите очищенные части кишечника в пробирки объемом 50 мл, содержащие 20 мл водопроводной воды. Поместите горизонтально в инкубатор при температуре 37 °C на 3 часа. Очень энергично встряхивайте в течение 10 с каждый час.
- Через 3 ч инкубации извлеките ткань из воды. Поместите трубки вертикально в точку RT, и паразиты осядут под действием силы тяжести через 30 минут.
- Удалите надосадочную жидкость, пока не останется около 5 мл воды. Наполните до 25 мл водой из-под крана, чтобы повторить этап промывки. Для анализа тонкой кишки повторите этот шаг промывания еще раз, чтобы иметь хорошую видимость под микроскопом.
- Когда будет достигнута хорошая видимость, аспирируйте надосадочную жидкость до тех пор, пока не останется около 5 мл воды, и перелейте жидкость в две лунки на кишечник мыши в 6-луночной пластине, отмеченной линиями, как описано для подсчета личинок в голове.
- Подсчитайте взрослых самок паразитов под перевернутым микроскопом с 40-кратным увеличением, двигаясь по линиям, нарисованным на дне лунки. Подсчитайте паразитов в день жертвоприношения. Подсчитайте паразитов нужно как можно быстрее, так как длительное высиживание в воде приведет к их гибели и распаду.
ПРИМЕЧАНИЕ: В дополнение к личинкам четвертой стадии и взрослым паразитам, L1 также может быть обнаружен здесь примерно с 5-го дня вечера. Они намного меньше и гораздо более многочисленны, чем L4 и взрослые паразиты, и их следует легко отличить.
5. Содержание S. ratti у крыс линии Wistar
ПРИМЕЧАНИЕ: Инфекции крыс предпочтительно проводить вдвоем, причем один человек держит крыс, а другой выполняет инъекцию. Для поддержания цикла паразитов заражают 4-8-недельных крыс Вистар.
- Приготовьте одну центрифужную пробирку объемом 1,5 мл на каждую крысу, содержащую 2500 мл3 в PBS/Pen-Strep, используя аппарат Бермана, как описано выше. Тщательно перемешивайте между этапами пипетирования, так как личинки быстро оседают.
- Дайте личинкам осесть под действием силы тяжести в течение 20-30 минут (RT) и отсасывайте надосадочную жидкость в шприце объемом 0,5 мл (28G) до тех пор, пока не останется около 200 μл суспензии личинок.
- При инфекциях поместите крыс в сгиб руки одного человека и аккуратно и осторожно зафиксируйте там голову. Другой человек осторожно берет крысу за бок и вводит ресуспендированную суспензию iL3 подкожно в затылочную складку.
6. Выращивание древесного угля
- Держите инфицированных крыс в клетках с несколькими слоями целлюлозы и меньшим количеством подстилки, начиная с 5 и 12 дней после заражения. Такая замена помета на несколько слоев целлюлозы производится для того, чтобы сделать сбор кала более легким по сравнению со сбором кала из помета
- На 6-8 и 13-15 дни пересадите крыс в свежую клетку и соберите все фекалии из старой клетки, собрав гранулы кала из клеток после переноса крыс в свежие клетки и объединив их из одной клетки в пробирку объемом 50 мл. Сбор кала в течение 2 недель до установления иммунного ответа снижает личиночную нагрузку в кале. Через 2 недели крыс усыпляют с помощью наркоза от передозировки CO2 . После отсутствия роговицы и межпальцевых рефлексов выполняют шейный вывих.
ПРИМЕЧАНИЕ: У крыс с ослабленным иммунитетом и монгольских песчанок инфекция S. ratti сохраняется в течение более длительных периодов времени17,18. Изучая иммунный ответ и иммуномодуляцию при инфекции S. ratti, мы решили поддерживать цикл у иммунокомпетентных хозяев для поддержания давления отбора интактного иммунитета хозяина. - Используйте собранные образцы кала для приготовления культур древесного угля, которые позволят развить iL3 из L1, присутствующего в кале.
- Смочите древесный уголь в водопроводной воде. Прежде чем использовать древесный уголь для культур, засыпьте его в сито и промойте под проточной водой из-под крана, пока вода не станет прозрачной. Всегда держите уголь влажным. Перед использованием замочите уголь не менее чем на 24 часа.
- Смешайте каловые массы с предварительно замоченным активированным углем в соотношении примерно 1:1. Разложите смесь с градиентом по диагонали и покройте ее еще одним слоем активированного угля в плоском стеклянном стакане, чтобы достичь конечного соотношения 1:2.
ПРИМЕЧАНИЕ: Инкубация кала с предварительно замоченным активированным углем имитирует влажную почву, в которой iL3 развивается в природе, предотвращая при этом чрезмерное грибковое заражение. - Накройте стеклянный сосуд прозрачной пленкой. Убедитесь, что есть несколько отверстий для циркуляции воздуха.
- Инкубировать в течение 6-7 дней при температуре 25 °C при влажности около 90 % без CO2. Убедитесь, что в инкубаторе есть сосуд для воды, чтобы культуры оставались влажными. При необходимости храните культуры до 14 дней при температуре 25 °C. iL3 будет развиваться прямо или косвенно19 и оставаться остановленным на стадии iL3 до тех пор, пока инфекция не будет инфицирована.
Результаты
S. ratti мигрирует из места инфекции преимущественно в голову, а затем в кишечник по точно не определенному пути. Чтобы исследовать точную локализацию в тканях головы и кишечнике, мышей C57BL/6 инфицировали 1000 мл3 в левую заднюю подушечку лапы. Мышей умерщвляли с 1-го по 14-й день, а паразитов S. ratti количественно определяли в передней и задней части головы, головном мозге и легких (рис. 2), а также в двенадцатиперстной кишке, тощей кишке, подвздошной кишке, слепой кишке и толстой кишке (рис. 3).
В день 1 первого дня первый L3 достиг головы, демонстрируя равномерное распределение (рисунок 2A). Кроме того, небольшая фракция личинок была извлечена в легких на 1-й день (рис. 2B). Количество L3 заметно увеличилось на 2-й день p.i. в среднем до 174 L3 ± 13 в голове и в среднем 17 ± 1,7 в легких. Таким образом, большая часть L3 (около 90%) выводится из головы и только около 10% из легких. Большинство L3 (в среднем 93 ± 13,3) были локализованы в передней части головы, но также около 41 ± 4,7 личинок L3 были локализованы в задней части головы и около 39 ± 5,8 в мозге. В соответствии с этим наблюдением, наличие L3 в мозге и спинномозговой жидкости было зарегистрировано через 24 часа и с максимумом в 48 часов у мышей C57BL/6 после чрескожной инфекции20. Отчетливое снижение общего количества L3 наблюдалось на 3-й день p.i. по сравнению с нагрузкой личинок на 2-й день, и L3 не было извлечено из тканей головы на 4-й день p.i. (Рисунок 2A). Соответственно, поступление паразитов S. ratti было обнаружено в кишечнике на 4-е сутки (рис. 3А). Чтобы можно было точно определить локализацию паразита, кишечник был разделен на отдельные сегменты, т.е. двенадцатиперстную кишку, тощую кишку, подвздошную кишку, слепую кишку и толстую кишку (рис. 3B). На 4-й день жизни большинство паразитов S. ratti было локализовано в двенадцатиперстной кишке и первых двух третях тощей кишки (рис. 3А). Такая локализация сохранялась до 6 дня p.i. Начиная с 7-го дня дня и далее, большинство взрослых особей S. ratti локализовались в слепой кишке, где они сохранялись до 9-го дня (рис. 3A). Количество паразитов в слепой кишке снизилось к 11-му дню до примерно 20 и до 0 к 14-му дню. Мы не извлекали значительного количества паразитов из оставшейся толстой кишки ни в один из анализируемых моментов времени, за исключением примерно 5-11 паразитов к 11-му дню исследования. В то время как локализация паразитов S. ratti изменилась с 4-го по 9-й день и большинство взрослых особей были выброшены из тонкой кишки после 7-го дня, общее количество, извлеченное из всей кишки, оставалось неизменным до 9-го дня. Жизнеспособный L1 не был количественно определен, но обнаруживается с 4-го по 11-й день, с пиком на 6-й день (данные не показаны).
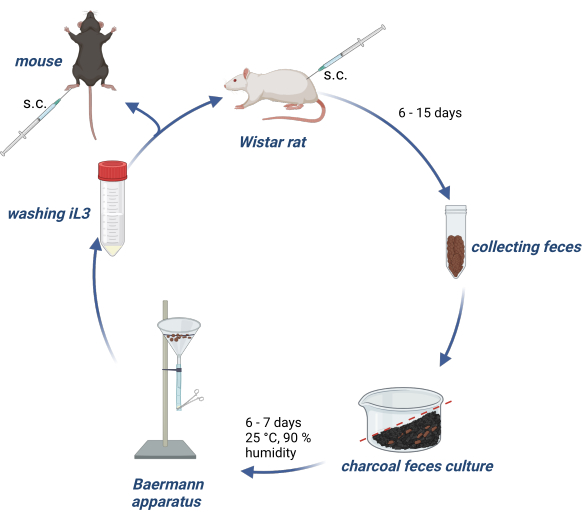
Рисунок 1: Поддержание жизненного цикла S. ratti у крыс и мышей. Крысам Вистар вводят в/к в затылочную складку 2500 мл3. Через 6-15 дней их кал собирают, смешивают с пропитанным водой активированным углем, располагают градиентом и накрывают прозрачной пленкой, включая отверстия для воздуха. Эту культуру инкубируют в течение 6-7 дней при температуре 25 °C и влажности 90%. iL3 изолируют с помощью аппарата Бермана и 3 раза промывают PBS/Pen-Strep. Экспериментальным мышам вводят 1000 мл3 подкожно в заднюю подушечку лапы. Создано с помощью BioRender.com. Рисунок 1 был создан в BioRender. Линнеманн, Л. (2024) https://BioRender.com/g80l370. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
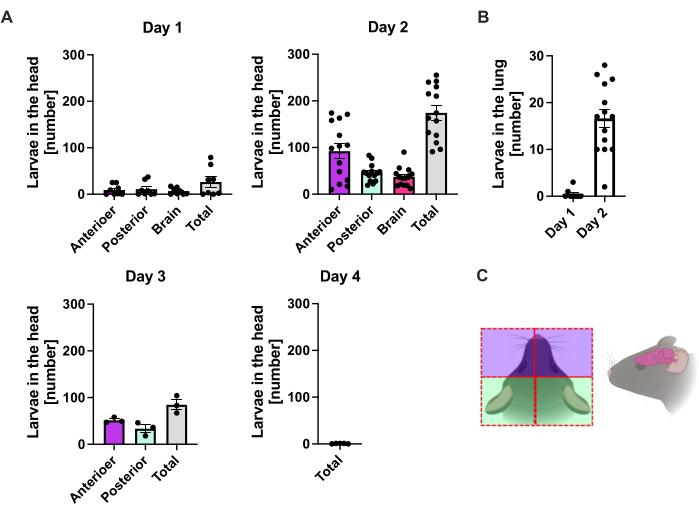
Рисунок 2: Количественная оценка S. ratti в тканях легких и головы с течением времени. Мышам C57BL/6 вводили 1000 мл3 в заднюю подушечку лапы. Мышей умерщвляли в указанные моменты времени, а также подсчитывали паразитов S. ratti в голове (А) и (В) легких. Каждый символ представляет собой L3 счета отдельной мыши; столбчатая диаграмма показывает среднее значение, а полосы погрешностей указывают на SEM. На графиках представлены объединенные данные отдельных экспериментов. День 1: два независимых эксперимента с n=4 на каждую временную точку и эксперимент; День 2: четыре независимых эксперимента с n=4, n=4, n=6 и n=3; День 3: два независимых эксперимента с n=4 и n=3; День 4: Один эксперимент с n=5. (В) Схематический мультфильм с изображением отдельных областей головы, используемых для изоляции. Красной пунктирной линией обозначен путь разреза. Рисунок 2C был создан в BioRender. Линнеманн, Л. (2024) https://BioRender.com/t83e660. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
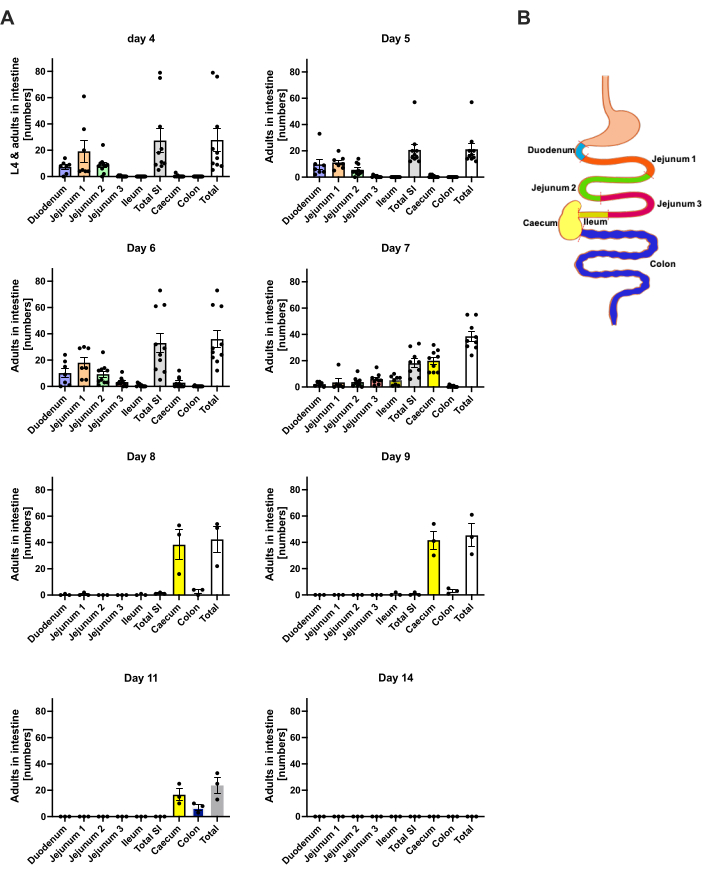
Рисунок 3: Количественное определение S. ratti в областях кишечника с течением времени. Самцам мышей C57BL/6 вводили 1000 мл3 в заднюю подушечку лапы. (А) Мышей умерщвляли в указанные моменты времени, а паразитов S. ratti , за исключением L1, подсчитывали в следующих областях: двенадцатиперстная кишка, тощая кишка 1-3, подвздошная кишка, слепая кишка и толстая кишка. (Б) Схематический обзор различных областей кишечника. Каждый символ представляет собой количество паразитов отдельной мыши; столбчатая диаграмма показывает среднее значение, а полосы погрешности указывают на SEM. Показаны объединенные данные отдельных экспериментов. День 4: два независимых эксперимента с n=4 и n=6 мышами; День 5: два независимых эксперимента с n=4 и n=6; День 6: два независимых эксперимента с n=4 и n=6; День 7: два независимых эксперимента с n=6 и n=3; Дни с 8 по 14: по одному эксперименту с n=3. МВ: тонкая кишка. Рисунок 3B был создан в BioRender. Линнеманн, Л. (2024) https://BioRender.com/h27y297. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Обсуждение
Заражение подопытных мышей S. ratti представляет собой прекрасную модель для изучения природы защитных иммунных реакций на гельминтозы на различных участках и стадиях иммунитета. Используя различные линии мышей KO и модели истощения клеток или цитокинов, роль специфических иммунных клеток, медиаторов или рецепторов может быть изучена в модели острой гельминтной инфекции. Возможность количественной оценки концентрации паразитов в голове, а также в кишечнике дает возможность дифференцировать роль иммунных клеток и эффекторов в различных тканях и фазах жизненного цикла паразита. Истощение определенных типов клеток с помощью инъекций антител позволяет изучить их роль, в частности, во время кишечного иммунного ответа, если истощение начинается после завершения фазы миграции тканей. При желании кишечник может быть дополнительно разделен на двенадцатиперстную кишку, тощую кишку, подвздошную киску, слепую кишку и толстую кишку, чтобы обнаружить даже незначительные сдвиги в локализации паразита или кинетике клиренса. Следует отметить, что меж- и внутриэкспериментальная вариабельность в этих экспериментах с инбредными инфекциями, даже у инбредных мышей, довольно высока, отражая вариацию, вносимую взаимодействием паразита и хозяина, а также различными партиями S. ratti L3, демонстрирующими различную эффективность инфекции (см. рис. 2 и рис. 3). Чтобы уменьшить вариабельность, возраст и пол подопытных мышей должны быть схожими. Более того, если сравнивать мышей KO и WT, крайне рекомендуется использовать контрольные группы однопометников, а не мышей WT, полученных из независимой гнездящейся колонии. Тем не менее, если использовать достаточные размеры выборки, можно получить надежные результаты, сравнивающие паразитарную нагрузку у мышей с дефицитом или компетенцией к определенным эффекторам, что приводит к четкой картине иммунных эффекторов, участвующих в защитном иммунном ответе на S. ratti (рассмотрено в пункте 6).
Ключевой отличительной чертой S. ratti по сравнению с другими моделями инфекции нематод, такими как близкородственная S. venezuelensis или N. brasiliensis, является уникальный маршрут миграции личинок внутри хозяина. В отличие от N. brasiliensis и S. venezuelensis, жизненные циклы которых включают легочную фазу 21,22,23, S. ratti в первую очередь обходит легкие и мигрирует через мышечную и кожную ткань к голове 8,12. Только примерно 10% выживших паразитов на 2-й день обнаруживаются в легких. Между тем, расположение S. ratti в голове сосредоточено на нософронтальной области, в соответствии с предыдущими исследованиями8. Эти характеристики делают S. ratti ценной моделью для изучения взаимодействия хозяина и паразита, особенно в коже и мышечной ткани, а также в тканях, дренирующих лимфатические узлы, и позволяют изучать иммунные реакции, которые могут быть затемнены или осложнены длительным поражением легких, как в других моделях инфекции нематод. Поразительно, но S. ratti L3 также извлекается из спинномозговой жидкости20 и головного мозга (рис. 2А), хотя неврологические симптомы или смерть, вызванные инфекцией, относительно редки и никогда не наблюдались в наших животноводческих учреждениях. Будущие исследования могут прояснить, находятся ли эти локализованные в мозге паразиты в ловушке или существует ли путь к кишечнику.
Род Strongyloides также обладает уникальной способностью образовывать свободноживущие поколения между паразитическими поколениями24. Эта свободноживущая стадия S. ratti, а также ее размножение патогенезом, кроме того, способствуют образованию трансгенных личинок. Использование микроинъекций свободноживущим самкам позволило получить личинки, экспрессирующие модельные антигены, такие как 2W1S, слитые с зеленым флуоресцентным белком. В то время как экспрессия эпитопа была утрачена во время линьки у взрослых особей, это позволило отслеживать и характеризовать специфичные для S. ratti CD4+ Т-клетки в легких и дренирующие легкие медиастинальные лимфатические узлы25. Такой подход является отличным инструментом для изучения биологии CD4+ Т-клеток в контексте гельминтозов и разработки противогельминтных вакцин.
S. ratti является универсальным модельным организмом для иммунологических исследований гельминтозов-паразитов, которые демонстрируют миграцию тканей и стадии жизни кишечника в целом. Инфекции S. stercoralis человека характеризуются крайней хронизацией из-за происходящей аутоинфекции, которая также может привести к синдрому гиперинфекции у хозяев с ослабленным иммунитетом, в основном у пациентов, получающих терапию глюкокортикоидами после трансплантации26. Следует отметить, что этот аспект аутоинфекции и гиперинфекции трудно смоделировать на мышах. Ни инфицированный S. ratti RAG1 KO, ни голые мыши 5,27 не подвержены гиперинфекции. Следует отметить, что одна мышиная модель гиперинфекции S. stercoralis была создана с использованием мышей с сильно ослабленным иммунитетом, получавших глюкокортикостероиды (NOD.Cg-PrkdcscidIl2rgtm1Wjl/SzJ), что может позволитьв конечном итоге проанализировать, по крайней мере, аспекты синдрома гиперинфекции у мышей.
Тем не менее, исследования с использованием инфекции S. ratti у мышей показали, что эозинофилы и нейтрофилы играют неизбыточную роль в уничтожении личинок, мигрирующих из тканей. Истощение или отсутствие у генетически модифицированных мышей приводило к повышенному количеству L3 в голове8. В то время как тучные клетки и базофильные гранулоциты были незаменимы во время фазы миграции тканей, как тучные клетки, так и базофилы вносили свой вклад в контроль нагрузки кишечных паразитов. Их отсутствие не влияло на количество L3 в тканях, но повышало количество взрослых паразитов S. ratti в кишечнике на 6-й день p.i.12,29. Дальнейший анализ показал, что отсутствие базофилов или селективно соединительнотканных тучных клеток позволяет прекратить инфекцию с помощью кинетики WT. Напротив, мыши, у которых отсутствовали соединительная ткань и тучные клетки слизистой оболочки, оставались инфицированными в течение 20 недель12. Эти результаты выявили ключевую роль тучных клеток слизистой оболочки в окончательном прекращении инфекции, подчеркнув ценность этой модели инфекции в выяснении функции тучных клеток слизистой оболочки во время гельминтной инфекции. Дальнейшее определение потенциальных изменений кишечной локализации паразитов S. ratti в отсутствие определенных иммунологических эффекторных клеток поможет еще точнее определить их функцию в противогельминтном иммунитете.
Кроме того, в этой системе могут быть изучены механизмы уклонения от иммунитета, используемые гельминтами для облегчения их выживания. Было показано, что истощение Foxp3+ регуляторных Т-клеток или делеция регуляторного рецептора на эффекторных Т-клетках, которые были индуцированы во время инфекции S. ratti, снижают паразитарную нагрузку на 6-й день и выход личинок на протяжении всей инфекции 15,16,30,31. Кроме того, стало возможным определить кишечник как ткань, на которую нацелено уклонение от иммунитета и IL-9-опосредованная активация тучных клеток, поскольку иммунный путь подавлен. Наконец, механизм ILC2-опосредованной инициации иммунитета 2 типа тканевыми аларминовыми цитокинами, такими как IL-33, может быть изучен с использованием супрессоров и энхансеров эндогенного IL-3332.
Выделение большого количества iL3 с помощью метода Бермана дает возможность для дальнейших исследований in vitro . Кокультуры L3 с иммунными клетками или потенциальными кандидатами в лекарственные препараты позволяют напрямую исследовать влияние на жизнеспособность и подвижность L3. Рестимуляция ex vivo клеток, выделенных от инфицированных мышей лизатом антигена S. ratti или жизнеспособным L3, обеспечивает платформу для изучения продукции цитокинов в различных типах клеток. Наконец, белковые и липидные фракции L3 могут быть использованы для идентификации патоген-ассоциированных молекулярных структур S. ratti или молекул иммуномодулирующих эффекторов
Поскольку гельминтозы по-прежнему представляют собой серьезную угрозу для здоровья во всем мире, исследования с целью дальнейшего выяснения иммунных реакций, индуцированных гельминтами, и механизма уклонения, используемого паразитами, по-прежнему имеют решающее значение для улучшения вариантов лечения и разработки профилактических стратегий, таких как вакцинация. Инфекция S. ratti у мышей представляет собой универсальную модель для исследования взаимодействия гельминтов и хозяина во время модели острой инфекции.
Раскрытие информации
У авторов отсутствует конфликт интересов. Языковая модель Perplexity AI 2024 использовалась для доработки текстовых черновиков и улучшения формулировок.
Благодарности
Эта работа была поддержана Фондом Юргена Маншота и Немецким научно-исследовательским обществом (гранты BRE 3754/6-1 и BRE 3754/10-1). Рисунки 1, 2C и 3B были созданы в BioRender.com.
Материалы
| Name | Company | Catalog Number | Comments |
| 50 ml tubes | Sarstedt, N mbrecht, DE mbrecht, DE | 6,25,47,254 | 50 ml https://www.sarstedt.com/produkte/labor/reagenz-zentrifugenroehren/roehren/produkt/62.547.254/ |
| BD Micro-Fine U100 Insulin 0.5 ml | BD Bioscience | 7468077 | 0.5 ml https://www.bestimed.de/bd-micro-fine-insulinspritze-05-ml-u100-8-mm-100x05ml-324825.html |
| centrifugeation tubes | Sarstedt, Nümbrecht, DE | 72,706 | 1.5 ml https://www.sarstedt.com/produkte/labor/mikro-schraubroehren-reagiergefaesse/reagiergefaesse/produkt/72.706/ |
| Charcoal | Roth | 0998.3 | 5 kg https://www.carlroth.com/de/de/aktivkohle/aktivkohle/p/0998.3 |
| Falcon 6-well Clear Flat Bottom, not treated cell multiwell culture plate, with Lid, sterile | Corning | 351146 | 6-well https://www.corning.com/emea/de/search.html?_cookie=false &searchText=351146&search-initialcatalog =Corporate+Communications& initialResultType=products |
| Freezer & Refrigerator | Liebherr-Hausgeräte, Rostock, DE | ||
| Greiner Bio-One 24-Well-Platten für Zellkulturen aus Polystyrol | Fisher Scientific | 10177380 | 24-well https://www.fishersci.de/shop/products/polystyrene-24-well-cell-culture-multiwell-plate/10177380#?keyword=24-well |
| Incidin Premium Wipes | Ecolab Healthcare | 100 10 279 | https://www.ecolabhealthcare.de/website/seiten/produkte/flaechendesinfektion/tuecher/incidin_premium_wipes.php |
| Incubator 25°C | Heraeus Instruments, Hanau, DE | ||
| Incubator 37°C | Heraeus Instruments, Hanau, DE | ||
| Microscope | Helmut Hund, Wetzlar, DE | 4 x objectiv lens, 10 x ocular lens | |
| Parafilm M | Parafilm | 11772644 | 4 in. X 125 ft. https://www.fishersci.de/shop/products/parafilm-m-laboratory-wrapping-film-2/11772644 |
| Penicillin/Streptomycin (Pen-Strep) | Capricorn | PS-B | 100x https://www.capricorn-scientific.com/en/shop/penicillin-streptomycin-pen-strep-100x~p1205 |
| ROTI Fair 10x PBS 7.4 | Roth | 1105.1 | https://www.carlroth.com/de/de/fertigloesungen-tabletten-portionsbeutel/rotifair-10x-pbs-7-4/p/1105.1 |
Ссылки
- Olsen, A., et al. Strongyloidiasis - the most neglected of the neglected tropical diseases. Trans Royal Soc Tropical Med Hygiene. 103 (10), 967-972 (2009).
- Buonfrate, D., et al. The global prevalence of Strongyloides stercoralis infection. Pathogens. 9 (6), 468 (2020).
- Dawkins, H. J. S., Grove, D. I. Attempts to establish infections with Strongyloides stercoralis in mice and other laboratory animals. J Helminthol. 56 (1), 23-26 (1982).
- Abraham, D., et al. Strongyloides stercoralis: protective immunity to third-stage larvae inBALB/cByJ mice. Exp Parasitol. 80 (2), 297-307 (1995).
- Breloer, M., Abraham, D. Strongyloides infection in rodents: immune response and immune regulation. Parasitology. 144 (3), 295-315 (2017).
- Breloer, M., Linnemann, L. Strongyloides ratti infection in mice: immune response and immune modulation. Philosophical Trans Royal Society B. 379 (1894), 20220440 (2024).
- Dawkins, H. J. S., Grove, D. I., Dunsmore, J. D., Mitchell, G. F. Strongyloides ratti: Susceptibility to infection and resistance to reinfection in inbred strains of mice as assessed by excretion of larvae. Int J Parasitol. 10 (2), 125-129 (1980).
- Ehrens, A., et al. Eosinophils and neutrophils eliminate migrating Strongyloides ratti larvae at the site of infection in the context of extracellular DNA trap formation. Front Immunol. 12, 715766 (2021).
- Eschbach, M. L., et al. Strongyloides ratti infection induces transient nematode-specific Th2 response and reciprocal suppression of IFN-γ production in mice. Parasite Immunol. 32 (5), 370-383 (2010).
- Dawkins, H., Muir, G., Grove, D. Histopathological appearances in primary and secondary infections with Strongyloides ratti in mice. Int J Parasitol. 11 (1), 97-103 (1981).
- Tada, I., Mimori, T., Nakai, M. Migration route of Strongyloides ratti in albino rats. Jap J Parasit. 28 (4), 219-227 (1979).
- Reitz, M., et al. Mucosal mast cells are indispensable for the timely termination of Strongyloides ratti infection. Mucosal Immunol. 10 (2), 481-492 (2017).
- Viney, M. E., Lok, J. B. The biology of Strongyloides spp. WormBook. , 1-17 (2018).
- Reitz, M., et al. Interleukin-9 promotes early mast cell-mediated expulsion of Strongyloides ratti but is dispensable for generation of protective memory. Sci Rep. 8 (1), 8636 (2018).
- Breloer, M., et al. Cutting edge: The BTLA-HVEM regulatory pathway interferes with protective immunity to intestinal Helminth infection. J Immunol. 194 (4), 1413-1416 (2015).
- Blankenhaus, B., et al. Foxp3+ regulatory T cells delay expulsion of intestinal nematodes by suppression of IL-9-driven mast cell activation in BALB/c but not in C57BL/6 mice. PLoS Pathogens. 10 (2), e1003913 (2014).
- Niamatali, S., Nolan, T. J., Schad, G. A. . Can Autoinfection be Provoked in the Strongyloides ratt/-infected Gerbil, Meriones unguiculatus. 59 (2), 149-152 (1992).
- Gardner, M. P., Gems, D., Viney, M. E. Extraordinary plasticity in aging in Strongyloides ratti implies a gene-regulatory mechanism of lifespan evolution. Aging Cell. 5 (4), 315-323 (2006).
- Viney, M. E. Developmental switching in the parasitic nematode Strongyloides ratti. Proc Biol Sci. 263 (1367), 201-208 (1996).
- Dawkins, H. J., Thomason, H. J., Grove, D. I. The occurrence of Strongyloides ratti in the tissues of mice after percutaneous infection. J Helminthol. 56 (1), 45-50 (1982).
- Takamure, A. Migration route of Strongyloides venezuelensis in rodents. Int J Parasitol. 25 (8), 907-911 (1995).
- Filbey, K., Bouchery, T., Le Gros, G. The role of ILC 2 in hookworm infection. Parasite Immunol. 40 (2), e12429 (2018).
- Allen, J. E., Sutherland, T. E. Host protective roles of type 2 immunity: Parasite killing and tissue repair, flip sides of the same coin. Semin Immunol. 26 (4), 329-340 (2014).
- Dulovic, A., Puller, V., Streit, A. Optimizing culture conditions for free-living stages of the nematode parasite Strongyloides ratti. Exp Parasitol. 168, 25-30 (2016).
- Douglas, B., et al. Transgenic expression of a T cell epitope in Strongyloides ratti reveals that helminth-specific CD4+ T cells constitute both Th2 and Treg populations. PLOS Pathogens. 17 (7), e1009709 (2021).
- Vadlamudi, R. S., Chi, D. S., Krishnaswamy, G. Intestinal strongyloidiasis and hyperinfection syndrome. Clin Mol Allergy. 4 (1), 8 (2006).
- Viney, M., Kikuchi, T. Strongyloides ratti and S. venezuelensis- rodent models of Strongyloides infection. Parasitology. 144 (3), 285-294 (2017).
- Patton, J. B., et al. Methylprednisolone acetate induces, and Δ7-dafachronic acid suppresses, Strongyloides stercoralis hyperinfection in NSG mice. Proc Natl Acad Sci. 115 (1), 204-209 (2018).
- Reitz, M., Brunn, M. L., Voehringer, D., Breloer, M. Basophils are dispensable for the establishment of protective adaptive immunity against primary and challenge infection with the intestinal helminth parasite Strongyloides ratti. PLOS Neglected Trop Dis. 12 (11), e000699 (2018).
- Blankenhaus, B., et al. Strongyloides ratti infection induces expansion of Foxp3+ regulatory T cells that interfere with immune response and parasite clearance in BALB/c Mice. J Immunol. 186 (7), 4295-4305 (2011).
- Hartmann, W., Blankenhaus, B., Brunn, M. L., Meiners, J., Breloer, M. Elucidating different pattern of immunoregulation in BALB/c and C57BL/6 mice and their F1 progeny. Sci Rep. 11 (1), 1536 (2021).
- Meiners, J., et al. IL-33 facilitates rapid expulsion of the parasitic nematode Strongyloides ratti from the intestine via ILC2- and IL-9-driven mast cell activation. PLOS Pathogens. 16 (12), e1009121 (2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены