Method Article
Infezione sperimentale di topi con il nematode parassita Strongyloides ratti
In questo articolo
Riepilogo
Strongyloides ratti è un nematode parassita che causa infezioni transitorie nei topi di laboratorio, mostrando fasi di migrazione dei tessuti e di vita intestinale. Qui, presentiamo un protocollo per il mantenimento del ciclo del parassita nei ratti e l'infezione sperimentale dei topi, inclusa la quantificazione del parassita nella testa, nel polmone e nell'intestino.
Abstract
Lo Strongyloides ratti è un nematode parassita che infetta naturalmente i ratti selvatici. Tuttavia, la maggior parte dei ceppi di ratti e topi da laboratorio sono completamente suscettibili all'infezione. I topi immunocompetenti BALB/c e C57BL/6 terminano le infezioni da S. ratti entro un mese nel contesto di una risposta immunitaria canonica di tipo 2 e rimangono semi-resistenti a una reinfezione. Il decorso dell'infezione può essere suddiviso in tre fasi: (a) la fase di migrazione tissutale delle larve infettive del terzo stadio durante i primi due giorni; b) la fase intestinale iniziale, compresa la muta ai parassiti adulti e l'inserimento nella mucosa intestinale nei giorni 3-6 dopo l'infezione, con inizio della riproduzione entro il giorno 5-6 dopo l'infezione; c) la fase intestinale successiva che termina con la completa eliminazione dei parassiti. Le infezioni sperimentali di topi con S. ratti consentono lo studio preciso delle interazioni ospite-parassita durante l'intero ciclo di vita nei diversi siti di infezione, nonché le strategie di evasione immunitaria impiegate dal parassita. Il protocollo qui presentato descrive il mantenimento del parassita nei ratti Wistar, l'infezione dei topi di laboratorio e l'individuazione e la quantificazione dei parassiti S. ratti nella fase di migrazione dei tessuti e durante la fase intestinale.
Introduzione
L'elminto trasmesso dal suolo Strongyloides stercoralis causa la strongiloidasi, una malattia spesso indicata come la più trascurata tra le malattie tropicali trascurate1. Le stime del 2020 suggeriscono 600 milioni di infezioni da S. stercoralis in tutto il mondo2. La ricerca di laboratorio basata su ipotesi su S. stercoralis è limitata poiché l'elminto non è in grado di svilupparsi oltre le larve del terzo stadio (L3) nei topi 3,4. Pertanto, il nematode specifico per il roditore Strongyloides ratti è comunemente usato per studi di infezione in vivo nei topi di laboratorio 5,6. S. ratti è un parassita naturale dei ratti selvatici, ma la maggior parte dei ceppi di topi da laboratorio sono completamente suscettibili all'infezione7. Ciò consente lo studio dell'interazione ospite-patogeno e delle risposte immunitarie in diversi tessuti e stadi vivi dell'elminto.
Il ciclo di laboratorio di S. ratti nei topi può essere suddiviso in tre fasi principali. Dopo l'iniezione sottocutanea di un numero definito di larve infettive al terzo stadio (iL3), di solito da 1000 a 2000, la maggior parte (circa il 90 %) delle L3 sopravvissute migra verso la testa dei topi durante i primi due giorni di infezione, e solo una frazione molto piccola (circa il 10 %) viene recuperata nel polmone8. S. ratti penetra attivamente nella pelle del suo ospite roditore. È possibile imitare questa via naturale di infezione in laboratorio posizionando una goccia d'acqua contenente iL3 sulla pelle dei topi e consentendo l'infezione percutanea attiva9. Tuttavia, l'efficacia dell'infezione è molto più bassa e non è possibile controllare l'esatta dose di infezione. L'esatta via di migrazione intrapresa da S. ratti iL3, sia dopo infezione percutanea che sottocutanea (s.c.), rimane sconosciuta. Tuttavia, poiché il DNA di S. ratti non può essere rilevato nel sangue o negli organi ben riforniti di sangue, come i reni dei topi infetti8, la via di migrazione primaria potrebbe non includere il flusso sanguigno. Tuttavia, S. ratti non migra casualmente attraverso i tessuti. Piuttosto, diversi studi che utilizzano l'istologia nei topi 3,10 e nei ratti11 o la quantificazione del DNA vitale derivato da L3 e S. ratti recuperato da vari tessuti8 forniscono la prova che S. ratti L3 migra dal sito di infezione direttamente attraverso la pelle e il tessuto muscolare prevalentemente nella regione nasofrontale della testa.
Circa il 10 % delle larve iniettate sopravvive alla migrazione tissutale e raggiunge la testa nei topi C57BL/6 e BALB/c che mostrano numeri L3 comparabili nel tessuto della testa12. Si pensa che le larve vengano ingerite per raggiungere l'intestino entro il giorno 3 dopo l'infezione (p.i.). Si incorporano nella mucosa dell'intestino tenue, mutano in parassiti femmine adulte e iniziano a riprodursi per partenogenesi dal giorno 5 al giorno 6 p.i.13. Le uova, ma per lo più le larve già schiuse al primo stadio (L1), vengono rilasciate nell'intestino e secrete con le feci. Il picco del numero di femmine adulte viene raggiunto intorno al giorno 6 p.i.14. È interessante notare che i topi C57BL/6 mostrano un carico di parassiti intestinali da 2 a 5 volte superiore rispetto ai topi BALB/c, nonostante un numero comparabile di L3 che migra nei tessuti nella testa in entrambi i ceppi di topi12. Durante la prima settimana, il carico di parassiti intestinali nei topi immunocompetenti C57BL/6 e nei topi knock-out (KO) RAG1 privi di cellule B e T è simile, suggerendo che il controllo precoce dei parassiti è mediato dall'immunità innata12,15. Nell'ultima fase, i parassiti vengono espulsi dall'intestino entro 2-4 settimane p.i. nei topi immunocompetenti (rivisto in6). I topi RAG1 KO non sono in grado di eliminare l'infezione e contengono un basso numero di femmine adulte vitali e riproduttive nell'intestino tenue per un massimo di 1 anno12.
Dopo una prima infezione risolta o immunizzazione con L3 irradiato, i topi immunocompetenti C57BL/6 e BALB/c sono semi-resistenti alla reinfezione. Solo l'1% dell'iL3 inizialmente inoculato raggiunge la testa e solo circa 1-5 parassiti adulti possono essere recuperati dall'intestino durante una seconda infezione8. Pertanto, l'uso dell'infezione di laboratorio di topi con S. ratti fornisce uno strumento per studiare l'impatto del sistema immunitario innato e adattativo durante l'intero ciclo di vita di un nematode intestinale con fasi di migrazione tissutale.
In questo manoscritto, forniamo una descrizione dettagliata del mantenimento del ciclo di vita di S. ratti nei ratti Wistar, nonché l'infezione sperimentale dei topi e la quantificazione del carico di parassiti nei diversi siti di infezione. Con l'esatta quantificazione del carico del parassita S. ratti nella testa e nel tessuto polmonare e nell'intestino di topi sperimentali, è possibile analizzare il ruolo di alcuni effettori immunitari contro la migrazione dei tessuti o la fase di vita intestinale di questo nematode parassita. Le risposte immunitarie nei topi wildtype e nei topi privi di specifiche cellule effettrici immunitarie, recettori o mediatori di interesse possono essere confrontate come spiegato in dettaglio nella discussione 5,6.
Protocollo
Gli esperimenti sugli animali sono stati condotti in conformità con la legge tedesca sul benessere degli animali e i protocolli sperimentali sono stati approvati dall'autorità tedesca (Behörde für Gesundheit und Verbraucherschutz) dello Stato di Amburgo. La Figura 1 fornisce una panoramica del mantenimento del ciclo di vita di S. ratti nei ratti Wistar e della produzione di iL3 per l'infezione di topi o ratti sperimentali.
1. Preparazione delle larve infettive
- Preparare l'apparato Baermann come mostrato nella Figura 1. Chiudere il fondo del tubo con una fascetta ad angolo obliquo e posizionare una salvietta di fazzoletti nel setaccio. Riempire con acqua tiepida (circa 35-37 °C) fino a coprire il setaccio d'acqua.
- Riempi il setaccio con la miscela di feci e carbone preparata come descritto di seguito (passaggio 6). La miscela deve essere completamente coperta da acqua.
- Accendere la luce direttamente dietro l'apparecchio Baermann. L3 valido migrerà attivamente attraverso la cancellazione.
- Dopo 30 minuti le larve si sono depositate sopra la pinza, raccoglierle in una provetta da 50 ml aprendo brevemente la pinza. Raccogli l'intero pellet, ma assicurati che il volume sia il più piccolo possibile.
- Riempire la provetta da 50 ml con PBS contenente l'1% di penicillina-streptomicina (PBS/Pen-Streptomyc) e lasciare che le larve si depositino sul fondo della provetta per gravità a 4 °C per 30 minuti. Rimuovere con cautela il surnatante con una pipetta e ripetere il passaggio di lavaggio 3 volte.
- Dopo la terza fase di lavaggio, risospendere il pellet in 30-50 mL di PBS/Pen-Strep, a seconda delle dimensioni del pellet. Trasferire 1 μL di gocce della soluzione in un vetrino per microscopia. Agitare la soluzione immediatamente prima del pipettaggio, poiché l'iL3 si deposita rapidamente.
- Ispezionare le goccioline al microscopio inverso con un ingrandimento di 40x. L'iL3 dovrebbe muoversi in modo vivido. Contare l'iL3 per 1 μL di gocciolina in 5-10 repliche e calcolare la media per μL.
2. Infezione dei topi
NOTA: L3 preparato può essere conservato in PBS/Pen-Strep a 4 °C in una provetta da 50 ml che deve essere tenuta orizzontalmente per evitare di danneggiare iL3. La vitalità in vitro indicata dal movimento vivido di iL3 è invariata fino a 1 settimana nelle nostre mani. Poiché non esiste un confronto sistematico dell'infettività di L3 dopo diversi tempi di conservazione, utilizziamo iL3 appena preparato e conservato iL3 per un massimo di 24 ore dopo la preparazione come standard interno. Sono possibili infezioni con vecchi lotti di iL3. Tuttavia, è obbligatorio utilizzare lo stesso lotto di iL3 per l'infezione di gruppi diversi all'interno di un esperimento. Le infezioni dei topi devono essere preferibilmente eseguite da due persone, con una persona che tiene il topo e un'altra che esegue l'iniezione.
- Preparare una provetta da centrifugazione da 1,5 mL per topo contenente un totale di 1000 iL3 (C57BL/6) o 2000 iL3 (BALB/c) contati come descritto sopra nella fase 1.7 in PBS/Pen-Strep che sono stati preparati utilizzando l'apparato di Baermann come spiegato sopra (fase 1). Agitare accuratamente tra le fasi di pipettaggio poiché l'iL3 si stabilizza rapidamente.
- Lasciare riposare l'iL3 per gravità per 20-30 minuti a temperatura ambiente (RT) e aspirare il surnatante con una siringa da 0,5 ml il più completamente possibile, lasciando circa 30 μl di sospensione di iL3 nella provetta. Risospendere l'iL3 con una siringa da 0,5 mL (28G) o muovendo il tubo e aspirare la sospensione rimanente.
NOTA: È meno probabile che l'iL3 si attacchi alla plastica bagnata rispetto alla siringa asciutta. Pertanto, è vantaggioso utilizzare la stessa siringa per rimuovere il surnatante. - I topi non hanno bisogno di essere anestetizzati per l'infezione. Raccogli i topi con la collottola e afferra una zampa posteriore dei topi. Utilizzare femmina e maschio C57BL/6 di età superiore a 8 settimane e di almeno 20 g di peso. Iniettare l'intera soluzione contenente iL3 per via sottocutanea nel cuscinetto plantare con un angolo piatto. Ritrarre lentamente la siringa per evitare di fuoriuscire la sospensione larvale dal sito di puntura. Si formerà una cupola molto piccola contenente il liquido. Questo sarà assorbito da solo.
NOTA: L'infezione sottocutanea nel cuscinetto del piede piuttosto che nel fianco o nella nuca imita l'infezione naturale da iL3, che vive nella terra umida fertilizzata con le feci e penetra attivamente nella pelle intatta. Inoltre, il primo linfonodo drenante (LN) è definito come LN popliteo. Questo LN può essere utilizzato per l'analisi di cambiamenti immunologici precoci (cioè giorno 2 p.i.), ad esempio l'espansione delle cellule T regolatorie Foxp3+ in risposta all'infezione, come mostrato in16.
3. Conteggio di iL3 nella testa e nel polmone di topi infetti
- Per l'analisi del carico larvale nel tessuto, sacrificare i topi al giorno 1-3 p.i. poiché il picco del carico larvale è al giorno 2 p.i.8,12. Eseguire l'eutanasia mediante narcosi da sovradosaggio di CO2. Dopo l'assenza di cornea e riflessi interdigitali, eseguire la lussazione cervicale.
- Spruzzare l'addome e il collo con un disinfettante commerciale e tagliare la pelle sopra l'addome con le forbici. Tirare indietro la pelle per rivelare la parete addominale anteriore e tagliare lungo la linea mediana per aprire la cavità peritoneale. Tagliare il diaframma e aprire le costole su entrambi i lati per esporre il polmone nella cavità pleurica.
- Raccogliere i lobi polmonari in una piastra a 24 pozzetti divisa per linee contenenti 1 ml di acqua di rubinetto. Disegna o stampa le linee sulla lastra a una distanza di circa 4 mm. La distanza tra le linee dovrebbe consentire di vedere entrambe le linee contemporaneamente con un ingrandimento di 40x.
- Tagliare l'intero polmone in sei pezzi di circa 0,75 cm x 0,75 cm.
- Taglia la testa con le forbici per l'osso. Rimuovere la pelle e il pelo usando le dita. Cerca di rimuovere il minor numero possibile di tessuto muscolare.
- Sezionare l'intera testa (compresi il cervello e le ossa) in quattro quarti dietro gli occhi e longitudinalmente attraverso il centro della testa (vedere Figura 2C). Posizionare i quadranti anteriore e posteriore in un pozzetto di una piastra a 6 pozzetti contrassegnata da linee contenenti 2 ml di acqua di rubinetto. Metti il fazzoletto con i tagli rivolti verso il basso nell'acqua.
NOTA: Di solito, questo approccio fornisce una registrazione esatta del numero di larve che migrano nel tessuto della testa. Se è necessaria un'analisi separata dei numeri L3 nel cervello, può essere incluso il passaggio 3.7. - Se si desidera un'analisi separata del cervello, rimuovere la pelle dalla testa usando le dita. Quindi, usa le forbici per perforare la calotta cranica tra gli occhi. Da questa incisione, aprire la parte superiore del cranio sagittale con le forbici inutilizzate o accuratamente pulite. Per esporre il cervello, apri le calotte craniche destra e sinistra con una pinzetta. Usa una spatola per sollevare il cervello dal lato anteriore verso l'alto e le corde nervose vengono tagliate con forbici pulite. Rimuovere il cervello e trasferirlo in una piastra a 24 pozzetti contrassegnata da linee contenenti acqua di rubinetto.
- Porre le piastre in un'incubatrice a 37 °C. Incubare per 3 ore facendo roteare le piastre ogni ora (h) 10x. Dopo l'incubazione, agitare un'ultima volta, rimuovere le parti di tessuto rimanenti con una pinza dai pozzetti e scartare il tessuto.
- Conta completamente tutte le larve nell'acqua rimanente nei pozzetti al microscopio invertito con un ingrandimento di 40x muovendoti lungo le linee tracciate sul fondo del pozzo. Contare le larve che migrano nei tessuti lo stesso giorno per aumentare la responsabilità dei risultati.
4. Conteggio dei parassiti S. ratti nell'intestino di topi infetti
- Per l'analisi del carico di parassiti nell'intestino, sacrificare i topi nel giorno di interesse, utilizzare il giorno 3-21 p.i. per una cinetica completa. Il picco del carico di parassiti nei topi C57BL/6 e BALB/c all'interno dell'intestino tenue è al giorno 6 p.i.14. Eseguire l'eutanasia mediante narcosi da sovradosaggio di CO2 . Dopo l'assenza di cornea e riflessi interdigitali, eseguire una lussazione cervicale.
- Immergere la regione addominale dei topi nel disinfettante e tagliare la pelle sopra l'addome. Tirare indietro la pelle per rivelare la parete addominale anteriore e tagliare lungo la linea mediana per aprire la cavità peritoneale.
- Rimuovere l'intero intestino tagliando tra lo stomaco e il duodeno prossimale, nonché tra il colon e l'ano (vedi Figura 3B). Estrarre delicatamente l'intestino con le dita e metterlo in una capsula di Petri contenente acqua di rubinetto.
- Tagliare l'intestino longitudinalmente e lavare via le feci e il muco agitando energicamente in acqua di rubinetto per almeno 10 s. Una piccola frazione di parassiti adulti e un po' di L1 verranno lavati via, ma i parassiti vitali L4 e S. ratti adulti sono incorporati nella mucosa dell'intestino nei topi wild-type (WT) e non verranno rimossi da questa fase di lavaggio.
- Se di interesse, dividere ulteriormente l'intestino come descritto di seguito.
- Isolare il duodeno mediante un'incisione dopo il secondo cerotto di Peyer (circa 2-3 cm). Isolare l'ileo con due incisioni, una alla prima e l'altra alla seconda chiazza di Peyer (circa 1-2 cm). Isolare il digiuno dopo l'isolamento del duodeno e dell'ileo poiché questa è la sezione rimanente.
- Dividi il digiuno in tre sezioni uguali per consentire una definizione molto precisa della localizzazione del parassita. Isolare il cieco tra l'ileo e il colon. Isolare il colon tagliando dopo il cieco. La maggior parte dei parassiti adulti si trova nel primo terzo dell'intestino tenue (vedi Figura 3B).
- Trasferire le parti intestinali pulite in provette da 50 ml contenenti 20 ml di acqua di rubinetto. Mettere orizzontalmente nell'incubatrice a 37 °C per 3 ore. Agitare molto energicamente per 10 s ogni ora.
- Dopo 3 ore di incubazione, rimuovere il fazzoletto dall'acqua. Posizionare i tubi verticalmente a RT e i parassiti sedimentano per gravità in 30 minuti.
- Rimuovere il surnatante fino a quando rimangono circa 5 ml di acqua. Riempire fino a 25 ml con acqua di rubinetto per ripetere la fase di lavaggio. Per l'analisi dell'intestino tenue, ripetere questa fase di lavaggio un'altra volta per avere una buona visibilità al microscopio.
- Quando si ottiene una buona visibilità, aspirare il surnatante fino a quando rimangono circa 5 ml di acqua e trasferire il liquido in due pozzetti per intestino di topo in una piastra a 6 pozzetti contrassegnata da linee, come spiegato per il conteggio delle larve nella testa.
- Conta i parassiti femmine adulte sotto un microscopio invertito con un ingrandimento di 40x muovendoti lungo le linee tracciate sul fondo del pozzo. Conta i parassiti nel giorno del sacrificio. Conta i parassiti il più rapidamente possibile, poiché l'incubazione prolungata in acqua porterà alla loro morte e disintegrazione.
NOTA: Oltre alle larve del quarto stadio e ai parassiti adulti, qui è possibile rilevare anche L1 a partire dal giorno 5 p.i circa. Questi sono molto più piccoli e molto più abbondanti dei parassiti L4 e adulti e dovrebbero essere distinti facilmente.
5. Mantenimento di S. ratti nei ratti Wistar
NOTA: Le infezioni dei ratti dovrebbero essere preferibilmente eseguite da due persone, con una persona che tiene i ratti e un'altra che esegue l'iniezione. Per mantenere il ciclo del parassita, i ratti Wistar di 4-8 settimane vengono infettati.
- Preparare una provetta da centrifugazione da 1,5 mL per ratto contenente 2500 iL3 in PBS/Pen-Strep utilizzando l'apparato di Baermann come spiegato in precedenza. Agitare accuratamente tra le fasi di pipettaggio poiché le larve si depositano rapidamente.
- Lasciare riposare le larve per gravità per 20-30 minuti (RT) e aspirare il surnatante in una siringa da 0,5 ml (28 G) fino a quando rimangono circa 200 μl di sospensione larvale.
- Per le infezioni, posiziona i ratti nell'incavo del braccio di una persona e fissa la testa delicatamente e con attenzione lì. L'altra persona afferra delicatamente il fianco del ratto e inietta la sospensione iL3 risospesa per via sottocutanea nella piega nucale.
6. Coltura del carbone
- Tenere i ratti infetti in gabbie contenenti diversi strati di cellulosa e meno lettiera a partire dai giorni 5 e 12 dopo l'infezione. Questo scambio di lettiera con diversi strati di cellulosa viene effettuato al fine di rendere più facile la raccolta delle feci rispetto alla raccolta delle feci dalla lettiera
- Nei giorni 6-8 e 13-15 p.i., trasferisci i ratti in una gabbia fresca e raccogli tutte le feci dalla vecchia gabbia raccogliendo i pellet di feci dalle gabbie dopo aver trasferito i ratti in gabbie fresche e raccogliendoli da una gabbia in una provetta da 50 ml. Raccogliere le feci per 2 settimane p.i. prima che l'instaurazione della risposta immunitaria riduca il carico larvale nelle feci. Dopo 2 settimane p.i. i ratti vengono soppressi tramite narcosi da overdose di CO2 . Dopo l'assenza di cornea e riflessi interdigitali, eseguire una lussazione cervicale.
NOTA: I ratti immunocompromessi e i gerbilli della Mongolia mantengono le infezioni da S. ratti per periodi più lunghi17,18. Studiando la risposta immunitaria e l'immunomodulazione durante l'infezione da S. ratti, abbiamo deciso di mantenere il ciclo in ospiti immunocompetenti per mantenere la pressione selettiva dell'immunità dell'ospite intatto. - Utilizzare i campioni di feci raccolti per preparare colture di carbone, che consentiranno lo sviluppo di iL3 dalla L1 presente nelle feci.
- Immergere il carbone con acqua di rubinetto. Prima di utilizzare il carbone per le colture, versalo in un setaccio e lavalo sotto l'acqua corrente del rubinetto fino a quando l'acqua non diventa limpida. Mantieni il carbone sempre umido. Immergere il carbone per almeno 24 ore prima dell'uso.
- Mescolare le feci con carbone attivo preimbevuto in un rapporto di circa 1:1. Disporre il composto con una sfumatura in diagonale e coprirlo con un altro strato di carbone attivo in un bicchiere di vetro piano fino a raggiungere un rapporto finale di 1:2.
NOTA: L'incubazione delle feci con carbone attivo preimbevuto imita il terreno umido in cui iL3 si sviluppa in natura, prevenendo un'eccessiva contaminazione fungina. - Coprire il recipiente di vetro con una pellicola trasparente. Assicurarsi che ci siano alcuni fori per l'aria per consentire la circolazione dell'aria.
- Incubare per 6-7 giorni a 25 °C a circa il 90 % di umidità senza CO2. Assicurati che l'incubatrice contenga un recipiente d'acqua per mantenere umide le colture. Se necessario, conservare le colture per un massimo di 14 giorni a 25 °C. iL3 si svilupperà direttamente o indirettamente19 e rimarrà arrestato nello stadio iL3 fino all'infezione.
Risultati
S. ratti migra dal sito di infezione prevalentemente verso la testa e successivamente verso l'intestino su un percorso che non è esattamente definito. Per studiare l'esatta localizzazione nel tessuto della testa e nell'intestino, i topi C57BL/6 sono stati infettati con 1000 iL3 nel cuscinetto del piede posteriore sinistro. I topi sono stati sacrificati dal giorno 1 al giorno 14 p.i. e i parassiti S. ratti sono stati quantificati nella testa, nel cervello e nel polmone anteriori e posteriori (Figura 2), nonché nel duodeno, digiuno, ileo, cieco e colon (Figura 3).
Al giorno 1 p.i., il primo L3 ha raggiunto la testa, mostrando una distribuzione uniforme (Figura 2A). Inoltre, una piccola frazione di larve è stata recuperata nei polmoni il giorno 1 p.i. (Figura 2B). I numeri di L3 sono aumentati notevolmente il giorno 2 p.i. a una media di 174 L3 ± 13 nella testa e una media di 17 ± 1,7 nel polmone. Pertanto, la maggior parte dell'L3 (circa il 90%) viene recuperata dalla testa e solo circa il 10% dai polmoni. La maggior parte delle L3 (media 93 ± 13,3) erano localizzate nella parte anteriore della testa, ma anche circa 41 ± 4,7 larve di L3 erano localizzate nella parte posteriore della testa e circa 39 ± 5,8 nel cervello. In linea con questa osservazione, la presenza di L3 nel cervello e nel liquido cerebrospinale è stata riportata a 24 h p.i. e con un massimo a 48 h p.i. nei topi C57BL/6 dopo infezione percutanea20. Una netta diminuzione del numero totale di L3 è stata osservata il giorno 3 p.i. rispetto al carico larvale del giorno 2 p.i. e nessun L3 è stato recuperato dal tessuto della testa il giorno 4 p.i. (Figura 2A). Di conseguenza, l'arrivo dei parassiti S. ratti è stato rilevato nell'intestino il giorno 4 p.i. (Figura 3A). Per consentire una definizione precisa della localizzazione del parassita, l'intestino è stato suddiviso in segmenti distinti, cioè duodeno, digiuno, ileo, cieco e colon (Figura 3B). Il giorno 4, p.i., la maggior parte dei parassiti di S. ratti erano localizzati nel duodeno e nei primi due terzi del digiuno (Figura 3A). Questa localizzazione è stata coerente fino al giorno 6 p.i. Dal giorno 7 p.i. in poi, la maggior parte degli adulti di S. ratti si è localizzata nel cieco, dove è persistita fino al giorno 9 p.i. (Figura 3A). Il numero di parassiti nel cieco è sceso entro il giorno 11 p.i. a circa 20 e a 0 entro il giorno 14 p.i. Non abbiamo recuperato un numero significativo di parassiti dal colon rimanente in nessun momento analizzato, ad eccezione di circa 5-11 parassiti entro l'11° giorno 11 p.i. Mentre la localizzazione dei parassiti S. ratti è cambiata dal giorno 4 al giorno 9 p.i. e la maggior parte degli adulti è stata espulsa dall'intestino tenue dopo il giorno 7 p.i., il numero totale recuperato dall'intero intestino è rimasto costante fino al giorno 9. La L1 vitale non è stata quantificata ma è rilevabile dal giorno 4 al giorno 11, con picco il giorno 6 (dati non mostrati).
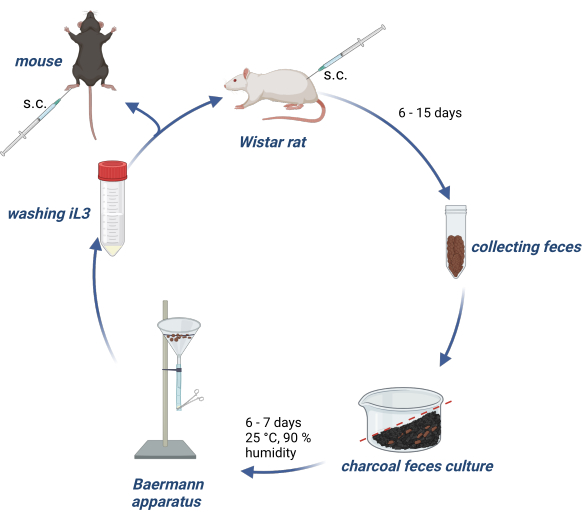
Figura 1: Mantenimento del ciclo di vita di S. ratti in ratti e topi. I ratti Wistar vengono iniettati s.c. nella piega nucale con 2500 iL3. Dopo 6-15 giorni, p.i. le loro feci vengono raccolte, mescolate con carbone attivo imbevuto d'acqua, disposte con una sfumatura e ricoperte da una pellicola trasparente, compresi i fori per l'aria. Questa coltura viene incubata per 6-7 giorni a 25 °C e 90% di umidità. Gli iL3 sono isolati utilizzando l'apparato di Baermann e lavati 3 volte con PBS/Pen-Strep. Ai topi sperimentali viene iniettato 1000 iL3 per via sottocutanea nel cuscinetto del piede posteriore. Creato con BioRender.com. La Figura 1 è stata creata in BioRender. Linnemann, L. (2024) https://BioRender.com/g80l370. Clicca qui per visualizzare una versione più grande di questa figura.
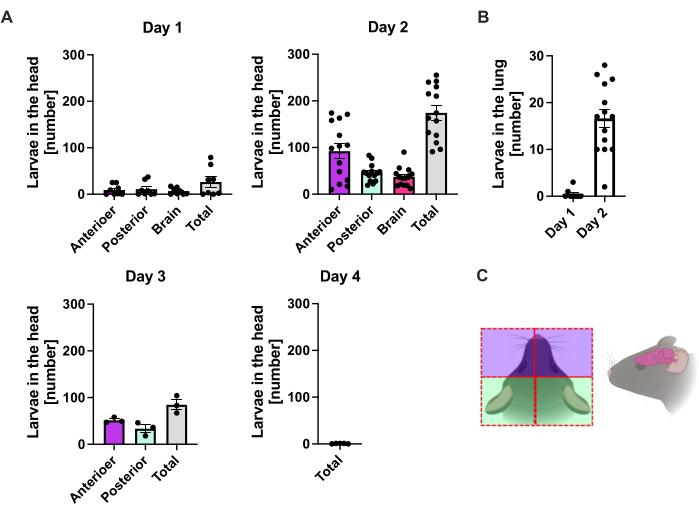
Figura 2: Quantificazione di S. ratti nel tessuto polmonare e cranico nel tempo. Ai topi C57BL/6 è stato iniettato s.c. 1000 iL3 nel cuscinetto del piede posteriore. I topi sono stati sacrificati nei punti temporali indicati e sono stati contati i parassiti S. ratti nella testa (A) e nel polmone (B). Ogni simbolo rappresenta i conteggi L3 di un singolo mouse; il grafico a barre mostra il valore medio e le barre di errore indicano il SEM. I grafici mostrano i dati combinati dei singoli esperimenti. Giorno 1: due esperimenti indipendenti con n=4 per punto temporale ed esperimento; Giorno 2: quattro esperimenti indipendenti con n=4, n=4, n=6 e n=3; Giorno 3: due esperimenti indipendenti con n=4 e n=3; Giorno 4: Un esperimento con n=5. (C) Cartone animato schematico che mostra le singole regioni della testa utilizzate per l'isolamento. La linea tratteggiata rossa indica il percorso dell'incisione. La Figura 2C è stata creata in BioRender. Linnemann, L. (2024) https://BioRender.com/t83e660. Clicca qui per visualizzare una versione più grande di questa figura.
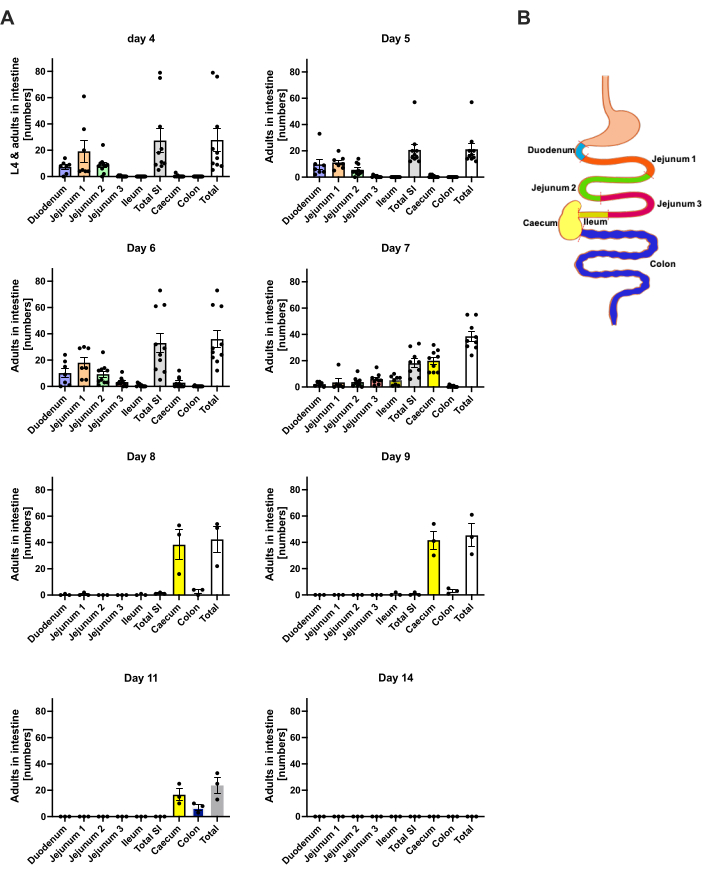
Figura 3: Quantificazione di S. ratti nelle regioni intestinali nel tempo. Ai topi maschi C57BL/6 è stato iniettato in c.s. 1000 iL3 nel cuscinetto del piede posteriore. (A) I topi sono stati sacrificati nei punti temporali indicati e i parassiti di S. ratti , ad eccezione di L1, sono stati contati nelle seguenti regioni: duodeno, digiuno 1-3, ileo, cieco e colon. (B) Panoramica schematica delle diverse regioni intestinali. Ogni simbolo rappresenta il conteggio dei parassiti di un singolo topo; il grafico a barre mostra la media e le barre di errore indicano il SEM. Sono mostrati i dati combinati dei singoli esperimenti. Giorno 4: due esperimenti indipendenti con topi n=4 e n=6; Giorno 5: due esperimenti indipendenti con n=4 e n=6; Giorno 6: due esperimenti indipendenti con n=4 e n=6; Giorno 7: due esperimenti indipendenti con n=6 e n=3; Giorni da 8 a 14: un esperimento con n=3. SI: intestino tenue. La Figura 3B è stata creata in BioRender. Linnemann, L. (2024) https://BioRender.com/h27y297. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
L'infezione di topi sperimentali con S. ratti rappresenta un modello eccellente per studiare la natura delle risposte immunitarie protettive alle infezioni da elminti in più siti e stadi di immunità. Utilizzando diverse linee di topi KO e modelli di deplezione cellulare o citochina, il ruolo di specifiche cellule immunitarie, mediatori o recettori può essere studiato in un modello di infezione acuta da elminti. La possibilità di quantificare il carico di parassiti nella testa e nell'intestino offre la possibilità di differenziare il ruolo delle cellule immunitarie e degli effettori in vari tessuti e fasi durante il ciclo di vita del parassita. La deplezione di specifici tipi di cellule attraverso iniezioni di anticorpi consente di studiare il loro ruolo, in particolare durante la risposta immunitaria intestinale se il trattamento di depleting inizia dopo il completamento della fase di migrazione dei tessuti. Se lo si desidera, l'intestino può essere ulteriormente suddiviso in duodeno, digiuno, ileo, cieco e colon per rilevare anche piccoli cambiamenti nella localizzazione del parassita o nella cinetica di eliminazione. Va notato che la variazione inter- e intra-sperimentale in questi esperimenti di infezione, anche nei topi consanguinei, è piuttosto elevata, riflettendo la variazione introdotta dall'interazione tra parassita e ospite, nonché diversi lotti di S. ratti L3 che mostrano una diversa efficacia nell'infezione (vedi Figura 2 e Figura 3). Per ridurre la variabilità, l'età e il sesso dei topi sperimentali dovrebbero essere simili. Inoltre, se si confrontano topi KO e WT, è altamente consigliabile utilizzare i controlli dei compagni di cucciolata invece dei topi WT derivati da una colonia riproduttiva indipendente. Tuttavia, se vengono utilizzate campionesse di dimensioni sufficienti, è possibile generare risultati affidabili confrontando il carico di parassiti in topi carenti o competenti per determinati effettori, portando a un quadro chiaro degli effettori immunitari coinvolti nella risposta immunitaria protettiva a S. ratti (rivisto in 6).
Una caratteristica distintiva chiave di S. ratti rispetto ad altri modelli di infezione da nematodi, come S. venezuelensis o N. brasiliensis, è la via di migrazione unica delle larve all'interno dell'ospite. A differenza di N. brasiliensis e S. venezuelensis, i cui cicli vitali contengono entrambi una fase polmonare 21,22,23, S. ratti bypassa principalmente il polmone e migra attraverso il muscolo e il tessuto cutaneo fino alla testa 8,12. Solo circa il 10% dei parassiti sopravvissuti al giorno 2 p.i. si trova nei polmoni. Nel frattempo, la posizione di S. ratti nella testa si concentra sulla regione nasofrontale, in linea con studi precedenti8. Queste caratteristiche rendono S. ratti un modello prezioso per lo studio delle interazioni ospite-parassita, in particolare nella cute e nel tessuto muscolare e nei linfonodi drenanti tissutali e consente studi sulle risposte immunitarie che possono essere oscurate o complicate da un coinvolgimento polmonare esteso come in altri modelli di infezione da nematodi. Sorprendentemente, S. ratti L3 viene recuperato anche dal liquido cerebrospinale20 e dal cervello (Figura 2A), sebbene i sintomi neurologici indotti dall'infezione o la morte siano relativamente rari e non siano mai stati osservati nella nostra struttura per animali. Ricerche future potrebbero chiarire se questi parassiti localizzati nel cervello sono intrappolati o se esiste un percorso verso l'intestino.
Il genere Strongyloides ha anche la capacità unica di formare generazioni a vita libera tra le generazioni parassitarie24. Questo stadio di vita libera di S. ratti, così come la sua riproduzione per patogenesi, facilita inoltre la generazione di larve transgeniche. L'uso di microiniezioni in femmine che vivono libere ha permesso la generazione di larve che esprimono antigeni modello come 2W1S fusi a una proteina fluorescente verde. Sebbene l'espressione dell'epitopo sia andata persa durante la muta negli adulti, ha permesso il tracciamento e la caratterizzazione delle cellule T CD4+ specifiche di S. ratti nei linfonodi mediastinici polmonaridrenanti 25. Questo approccio fornisce uno strumento eccellente per studiare la biologia delle cellule T CD4+ nel contesto delle infezioni da elminti e dello sviluppo di vaccini anti-elminti.
S. ratti è un organismo modello versatile per la ricerca immunologica dei parassiti elminti che mostrano la migrazione dei tessuti e le fasi di vita intestinale in generale. Le infezioni umane da S. stercoralis sono caratterizzate da un'estrema cronicità dovuta all'autoinfezione in atto, che può anche portare alla sindrome da iperinfezione negli ospiti immunodepressi, per lo più pazienti sottoposti a terapia con glucocorticoidi dopo il trapianto26. Va notato che questo aspetto dell'autoinfezione e dell'iperinfezione è difficile da modellare nei topi. Né il RAG1 KO infetto da S. rattti né i topi nudi 5,27 sono suscettibili all'iperinfezione. Da notare che un modello murino di iperinfezione da S. stercoralis è stato stabilito utilizzando topi gravemente immunocompromessi trattati con glucocorticosteroidi (NOD.Cg-PrkdcscidIl2rgtm1Wjl/SzJ), che potrebbe consentire l'analisi di almeno alcuni aspetti della sindrome da iperinfezione nei topi eventualmente28.
Tuttavia, gli studi che utilizzano l'infezione da S. ratti nei topi hanno dimostrato che eosinofili e neutrofili svolgono un ruolo non ridondante nell'eradicazione delle larve che migrano nei tessuti. La deplezione o l'assenza nei topi geneticamente modificati ha provocato un elevato numero di L3 nella testa8. Mentre i mastociti e i granulociti basofili erano superflui durante la fase di migrazione dei tessuti, sia i mastociti che i basofili hanno contribuito a controllare il carico di parassiti intestinali. La loro assenza non ha influenzato il numero di L3 nel tessuto, ma ha elevato il numero di parassiti adulti di S. ratti nell'intestino il giorno 6 p.i.12,29. Ulteriori analisi hanno rivelato che l'assenza di basofili o di mastociti selettivi del tessuto connettivo ha permesso la cessazione dell'infezione con la cinetica del WT. Al contrario, i topi privi di tessuto connettivo e mastociti mucosi sono rimasti infetti per 20 settimane12. Questi risultati hanno svelato un ruolo fondamentale per i mastociti della mucosa nella terminazione finale dell'infezione, sottolineando il valore di questo modello di infezione nel chiarire la funzione dei mastociti della mucosa durante l'infezione da elminti. L'ulteriore definizione di potenziali cambiamenti nella localizzazione intestinale dei parassiti S. ratti in assenza di alcune cellule effettrici immunologiche aiuterà a definire la loro funzione nell'immunità anti-elminti in modo ancora più preciso.
Inoltre, in questo sistema possono essere studiati i meccanismi immuno-evasivi impiegati dagli elminti per facilitare la loro sopravvivenza. È stato dimostrato che la deplezione delle cellule T regolatorie di Foxp3+ o la delezione di un recettore regolatorio sulle cellule T effettrici, entrambe indotte durante l'infezione da S. ratti, hanno ridotto il carico di parassiti al giorno 6 p.i. e la produzione larvale durante l'infezione 15,16,30,31. Inoltre, è stato possibile definire l'intestino come il tessuto bersaglio dell'evasione immunitaria e l'attivazione dei mastociti mediata da IL-9 come via immunitaria soppressa. Infine, il meccanismo dell'inizio dell'immunità di tipo 2 mediato da ILC2 da parte di citochine allarminiche derivate da tessuti come IL-33 può essere studiato utilizzando soppressori e potenziatori di IL-33 endogena32.
L'isolamento di un gran numero di iL3 tramite il Baermann offre la possibilità di ulteriori studi in vitro . Le co-colture di L3 con cellule immunitarie o potenziali candidati farmaci consentono di studiare direttamente gli effetti sulla vitalità e sulla motilità di L3. La restimolazione ex vivo di cellule isolate da topi infetti con lisato dell'antigene di S. ratti o L3 vitale fornisce una piattaforma per studiare la produzione di citochine in vari tipi di cellule. Infine, le frazioni proteiche e lipidiche di L3 possono essere utilizzate per l'identificazione di pattern molecolari associati a patogeni derivati da S. rattti o di molecole effettrici immunomodulatorie
Poiché le infezioni da elminti rappresentano ancora un grave onere sanitario a livello globale, la ricerca per chiarire ulteriormente le risposte immunitarie indotte dagli elminti e il meccanismo di evasione impiegato dai parassiti rimane fondamentale per migliorare le opzioni di trattamento e sviluppare strategie preventive come le vaccinazioni. L'infezione da S. ratti nei topi presenta un modello versatile per la ricerca sulle interazioni elminto-ospite durante un modello di infezione acuta.
Divulgazioni
Gli autori non hanno alcun conflitto di interessi. Il modello linguistico Perplexity AI 2024 è stato utilizzato per rivedere le bozze di testo e migliorare le formulazioni.
Riconoscimenti
Questo lavoro è stato sostenuto dalla Fondazione Jürgen Manchot e dall'Associazione tedesca per la ricerca (Grant BRE 3754/6-1 e BRE 3754/10-1). Le figure 1, 2C e 3B sono state create nel BioRender.com.
Materiali
| Name | Company | Catalog Number | Comments |
| 50 ml tubes | Sarstedt, N mbrecht, DE mbrecht, DE | 6,25,47,254 | 50 ml https://www.sarstedt.com/produkte/labor/reagenz-zentrifugenroehren/roehren/produkt/62.547.254/ |
| BD Micro-Fine U100 Insulin 0.5 ml | BD Bioscience | 7468077 | 0.5 ml https://www.bestimed.de/bd-micro-fine-insulinspritze-05-ml-u100-8-mm-100x05ml-324825.html |
| centrifugeation tubes | Sarstedt, Nümbrecht, DE | 72,706 | 1.5 ml https://www.sarstedt.com/produkte/labor/mikro-schraubroehren-reagiergefaesse/reagiergefaesse/produkt/72.706/ |
| Charcoal | Roth | 0998.3 | 5 kg https://www.carlroth.com/de/de/aktivkohle/aktivkohle/p/0998.3 |
| Falcon 6-well Clear Flat Bottom, not treated cell multiwell culture plate, with Lid, sterile | Corning | 351146 | 6-well https://www.corning.com/emea/de/search.html?_cookie=false &searchText=351146&search-initialcatalog =Corporate+Communications& initialResultType=products |
| Freezer & Refrigerator | Liebherr-Hausgeräte, Rostock, DE | ||
| Greiner Bio-One 24-Well-Platten für Zellkulturen aus Polystyrol | Fisher Scientific | 10177380 | 24-well https://www.fishersci.de/shop/products/polystyrene-24-well-cell-culture-multiwell-plate/10177380#?keyword=24-well |
| Incidin Premium Wipes | Ecolab Healthcare | 100 10 279 | https://www.ecolabhealthcare.de/website/seiten/produkte/flaechendesinfektion/tuecher/incidin_premium_wipes.php |
| Incubator 25°C | Heraeus Instruments, Hanau, DE | ||
| Incubator 37°C | Heraeus Instruments, Hanau, DE | ||
| Microscope | Helmut Hund, Wetzlar, DE | 4 x objectiv lens, 10 x ocular lens | |
| Parafilm M | Parafilm | 11772644 | 4 in. X 125 ft. https://www.fishersci.de/shop/products/parafilm-m-laboratory-wrapping-film-2/11772644 |
| Penicillin/Streptomycin (Pen-Strep) | Capricorn | PS-B | 100x https://www.capricorn-scientific.com/en/shop/penicillin-streptomycin-pen-strep-100x~p1205 |
| ROTI Fair 10x PBS 7.4 | Roth | 1105.1 | https://www.carlroth.com/de/de/fertigloesungen-tabletten-portionsbeutel/rotifair-10x-pbs-7-4/p/1105.1 |
Riferimenti
- Olsen, A., et al. Strongyloidiasis - the most neglected of the neglected tropical diseases. Trans Royal Soc Tropical Med Hygiene. 103 (10), 967-972 (2009).
- Buonfrate, D., et al. The global prevalence of Strongyloides stercoralis infection. Pathogens. 9 (6), 468 (2020).
- Dawkins, H. J. S., Grove, D. I. Attempts to establish infections with Strongyloides stercoralis in mice and other laboratory animals. J Helminthol. 56 (1), 23-26 (1982).
- Abraham, D., et al. Strongyloides stercoralis: protective immunity to third-stage larvae inBALB/cByJ mice. Exp Parasitol. 80 (2), 297-307 (1995).
- Breloer, M., Abraham, D. Strongyloides infection in rodents: immune response and immune regulation. Parasitology. 144 (3), 295-315 (2017).
- Breloer, M., Linnemann, L. Strongyloides ratti infection in mice: immune response and immune modulation. Philosophical Trans Royal Society B. 379 (1894), 20220440 (2024).
- Dawkins, H. J. S., Grove, D. I., Dunsmore, J. D., Mitchell, G. F. Strongyloides ratti: Susceptibility to infection and resistance to reinfection in inbred strains of mice as assessed by excretion of larvae. Int J Parasitol. 10 (2), 125-129 (1980).
- Ehrens, A., et al. Eosinophils and neutrophils eliminate migrating Strongyloides ratti larvae at the site of infection in the context of extracellular DNA trap formation. Front Immunol. 12, 715766 (2021).
- Eschbach, M. L., et al. Strongyloides ratti infection induces transient nematode-specific Th2 response and reciprocal suppression of IFN-γ production in mice. Parasite Immunol. 32 (5), 370-383 (2010).
- Dawkins, H., Muir, G., Grove, D. Histopathological appearances in primary and secondary infections with Strongyloides ratti in mice. Int J Parasitol. 11 (1), 97-103 (1981).
- Tada, I., Mimori, T., Nakai, M. Migration route of Strongyloides ratti in albino rats. Jap J Parasit. 28 (4), 219-227 (1979).
- Reitz, M., et al. Mucosal mast cells are indispensable for the timely termination of Strongyloides ratti infection. Mucosal Immunol. 10 (2), 481-492 (2017).
- Viney, M. E., Lok, J. B. The biology of Strongyloides spp. WormBook. , 1-17 (2018).
- Reitz, M., et al. Interleukin-9 promotes early mast cell-mediated expulsion of Strongyloides ratti but is dispensable for generation of protective memory. Sci Rep. 8 (1), 8636 (2018).
- Breloer, M., et al. Cutting edge: The BTLA-HVEM regulatory pathway interferes with protective immunity to intestinal Helminth infection. J Immunol. 194 (4), 1413-1416 (2015).
- Blankenhaus, B., et al. Foxp3+ regulatory T cells delay expulsion of intestinal nematodes by suppression of IL-9-driven mast cell activation in BALB/c but not in C57BL/6 mice. PLoS Pathogens. 10 (2), e1003913 (2014).
- Niamatali, S., Nolan, T. J., Schad, G. A. . Can Autoinfection be Provoked in the Strongyloides ratt/-infected Gerbil, Meriones unguiculatus. 59 (2), 149-152 (1992).
- Gardner, M. P., Gems, D., Viney, M. E. Extraordinary plasticity in aging in Strongyloides ratti implies a gene-regulatory mechanism of lifespan evolution. Aging Cell. 5 (4), 315-323 (2006).
- Viney, M. E. Developmental switching in the parasitic nematode Strongyloides ratti. Proc Biol Sci. 263 (1367), 201-208 (1996).
- Dawkins, H. J., Thomason, H. J., Grove, D. I. The occurrence of Strongyloides ratti in the tissues of mice after percutaneous infection. J Helminthol. 56 (1), 45-50 (1982).
- Takamure, A. Migration route of Strongyloides venezuelensis in rodents. Int J Parasitol. 25 (8), 907-911 (1995).
- Filbey, K., Bouchery, T., Le Gros, G. The role of ILC 2 in hookworm infection. Parasite Immunol. 40 (2), e12429 (2018).
- Allen, J. E., Sutherland, T. E. Host protective roles of type 2 immunity: Parasite killing and tissue repair, flip sides of the same coin. Semin Immunol. 26 (4), 329-340 (2014).
- Dulovic, A., Puller, V., Streit, A. Optimizing culture conditions for free-living stages of the nematode parasite Strongyloides ratti. Exp Parasitol. 168, 25-30 (2016).
- Douglas, B., et al. Transgenic expression of a T cell epitope in Strongyloides ratti reveals that helminth-specific CD4+ T cells constitute both Th2 and Treg populations. PLOS Pathogens. 17 (7), e1009709 (2021).
- Vadlamudi, R. S., Chi, D. S., Krishnaswamy, G. Intestinal strongyloidiasis and hyperinfection syndrome. Clin Mol Allergy. 4 (1), 8 (2006).
- Viney, M., Kikuchi, T. Strongyloides ratti and S. venezuelensis- rodent models of Strongyloides infection. Parasitology. 144 (3), 285-294 (2017).
- Patton, J. B., et al. Methylprednisolone acetate induces, and Δ7-dafachronic acid suppresses, Strongyloides stercoralis hyperinfection in NSG mice. Proc Natl Acad Sci. 115 (1), 204-209 (2018).
- Reitz, M., Brunn, M. L., Voehringer, D., Breloer, M. Basophils are dispensable for the establishment of protective adaptive immunity against primary and challenge infection with the intestinal helminth parasite Strongyloides ratti. PLOS Neglected Trop Dis. 12 (11), e000699 (2018).
- Blankenhaus, B., et al. Strongyloides ratti infection induces expansion of Foxp3+ regulatory T cells that interfere with immune response and parasite clearance in BALB/c Mice. J Immunol. 186 (7), 4295-4305 (2011).
- Hartmann, W., Blankenhaus, B., Brunn, M. L., Meiners, J., Breloer, M. Elucidating different pattern of immunoregulation in BALB/c and C57BL/6 mice and their F1 progeny. Sci Rep. 11 (1), 1536 (2021).
- Meiners, J., et al. IL-33 facilitates rapid expulsion of the parasitic nematode Strongyloides ratti from the intestine via ILC2- and IL-9-driven mast cell activation. PLOS Pathogens. 16 (12), e1009121 (2020).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon