Method Article
Experimentelle Infektion von Mäusen mit dem parasitären Fadenwurm Strongyloides ratti
In diesem Artikel
Zusammenfassung
Strongyloides ratti ist ein parasitärer Fadenwurm, der bei Labormäusen vorübergehende Infektionen verursacht und gewebemigrierende und intestinale Lebensstadien aufweist. Hier stellen wir ein Protokoll für die Aufrechterhaltung des Parasitenzyklus bei Ratten und die experimentelle Infektion von Mäusen vor, einschließlich der Parasitenquantifizierung im Kopf, in der Lunge und im Darm.
Zusammenfassung
Strongyloides ratti ist ein parasitärer Fadenwurm, der wilde Ratten auf natürliche Weise infiziert. Die meisten Labor-Ratten- und Mausstämme sind jedoch vollständig anfällig für Infektionen. Immunkompetente BALB/c- und C57BL/6-Mäuse beenden S. ratti-Infektionen innerhalb eines Monats im Rahmen einer kanonischen Typ-2-Immunantwort und bleiben semi-resistent gegen eine erneute Infektion. Der Infektionsverlauf kann in drei Phasen unterteilt werden: a) die Gewebemigrationsphase der infektiösen Larven im dritten Stadium während der ersten zwei Tage; b) die frühe Darmphase, einschließlich der Häutung zu den adulten Parasiten und der Einbettung in die Darmschleimhaut an den Tagen 3 bis 6 nach der Infektion, wobei die Fortpflanzung am 5. bis 6. Tag nach der Infektion beginnt; c) die spätere Darmphase, die mit der vollständigen Beseitigung der Parasiten endet. Experimentelle Infektionen von Mäusen mit S. ratti ermöglichen die genaue Untersuchung der Wirt-Parasit-Interaktionen über den gesamten Lebenszyklus an den verschiedenen Infektionsorten sowie der vom Parasiten angewandten Immunevasionsstrategien. Das hier vorgestellte Protokoll beschreibt die Aufrechterhaltung des Parasiten bei Wistar-Ratten, die Infektion von Labormäusen sowie den Nachweis und die Quantifizierung von S. ratti-Parasiten in der Gewebemigrationsphase und während der Darmphase.
Einleitung
Der durch den Boden übertragene Helminthen Strongyloides stercoralis verursacht Strongyloidiasis, eine Krankheit, die oft als die am meisten vernachlässigte unter den vernachlässigten Tropenkrankheiten bezeichnetwird 1. Schätzungen aus dem Jahr 2020 gehen von 600 Millionen Infektionen mit S. stercoralis weltweit aus2. Die hypothesengetriebene Laborforschung an S. stercoralis ist begrenzt, da der Helminth bei Mäusen nicht in der Lage ist, sich über die Larven des dritten Stadiums (L3) hinaus zu entwickeln 3,4. Daher wird der nagetierspezifische Nematode Strongyloides ratti häufig für in vivo Infektionsstudien an Labormäusen verwendet 5,6. S. ratti ist ein natürlicher Parasit wilder Ratten, aber die meisten Labormausstämme sind vollständig anfällig für eine Infektion7. Dies ermöglicht die Untersuchung der Wirt-Erreger-Interaktion und der Immunantworten in verschiedenen Geweben und lebenden Stadien des Helminthens.
Der Laborzyklus von S. ratti bei Mäusen kann in drei Hauptphasen unterteilt werden. Nach subkutaner Injektion einer definierten Anzahl infektiöser Larven im dritten Stadium (iL3), in der Regel 1000 bis 2000, wandert die Mehrheit (etwa 90 %) der überlebenden L3 in den ersten zwei Tagen der Infektion in den Kopf der Mäuse, und nur ein sehr kleiner Teil (etwa 10 %) wird in der Lunge gewonnen8. S. ratti dringt aktiv in die Haut seines Nagetierwirts ein. Es ist möglich, diesen natürlichen Infektionsweg im Labor nachzuahmen, indem ein iL3-haltiger Wassertropfen auf die Haut von Mäusen aufgetragen wird und eine aktive perkutane Infektion ermöglichtwird 9. Die Wirksamkeit der Infektion ist jedoch viel geringer, und eine Kontrolle der genauen Infektionsdosis ist nicht möglich. Der genaue Migrationsweg von S. ratti iL3, entweder nach perkutaner oder subkutaner (s.c.) Infektion, ist nicht bekannt. Da jedoch keine S. ratti-DNA im Blut oder in gut durchbluteten Organen wie den Nieren infizierter Mäuse nachgewiesen werden kann8, umfasst der primäre Migrationsweg möglicherweise nicht den Blutkreislauf. Dennoch wandert S. ratti nicht zufällig durch das Gewebe. Vielmehrliefern mehrere Studien, in denen Histologie an Mäusen3, 10 und Ratten11 oder die Quantifizierung lebensfähiger L3- und S. ratti-abgeleiteter DNA, die aus verschiedenen Geweben entnommen wurde, verwendet wurden, 8 den Nachweis, dass S. ratti L3 von der Infektionsstelle direkt durch Haut- und Muskelgewebe überwiegend in die nasofrontale Region des Kopfes wandert.
Etwa 10 % der injizierten Larven überleben die Gewebemigration und erreichen den Kopf bei C57BL/6- und BALB/c-Mäusen, die vergleichbare L3-Zahlen im Kopfgewebe aufweisen12. Es wird angenommen, dass die Larven verschluckt werden, um den Darm am Tag 3 nach der Infektion zu erreichen (p.i.). Sie nisten sich in die Schleimhaut des Dünndarms ein, häuten sich zu erwachsenen weiblichen Parasiten und beginnen sich durch Parthenogenese zwischen Tag 5 und Tag 6 zu vermehren p.i.13. Eier, meist aber auch bereits geschlüpfte Larven im ersten Stadium (L1), werden in den Darm abgegeben und mit dem Kot abgesondert. Der Höhepunkt der Anzahl adulter Weibchen wird um den 6. Tag p.i.14 erreicht. Interessanterweise weisen C57BL/6-Mäuse eine 2- bis 5-fach höhere Darmparasitenlast auf als BALB/c-Mäuse, trotz vergleichbarer Mengen an gewebemigrierendem L3 im Kopf in beiden Mausstämmen12. Während der ersten Woche war die intestinale Parasitenlast bei immunkompetenten C57BL/6-Mäusen und RAG1-Knock-out (KO)-Mäusen, denen B- und T-Zellen fehlen, gleich, was darauf hindeutet, dass die frühe Parasitenkontrolle durch angeborene Immunität vermittelt wird12,15. In der letzten Phase werden die Parasiten bei immunkompetenten Mäusen innerhalb von 2 bis 4 Wochen p.i. aus dem Darm ausgeschieden (Review in6). RAG1 KO-Mäuse sind nicht in der Lage, die Infektion zu beseitigen und enthalten bis zu 1 Jahr lang eine geringe Anzahl lebensfähiger und sich fortpflanzender weiblicher adulter Mäuse im Dünndarm12.
Nach einer überstandenen Erstinfektion oder Immunisierung mit bestrahltem L3 sind immunkompetente C57BL/6- und BALB/c-Mäuse semiresistent gegen eine erneute Infektion. Nur 1 % des initial geimpften iL3 erreicht den Kopf, und bei einer zweiten Infektion können nur etwa 1-5 adulte Parasiten aus dem Darm entnommen werden8. Die Verwendung der Laborinfektion von Mäusen mit S. ratti bietet somit ein Werkzeug, um den Einfluss des angeborenen sowie des adaptiven Immunsystems während des gesamten Lebenszyklus eines Darmfadenwurms mit Gewebemigrationsphasen zu untersuchen.
In diesem Manuskript liefern wir eine detaillierte Beschreibung der Aufrechterhaltung des S. ratti-Lebenszyklus bei Wistar-Ratten sowie der experimentellen Infektion von Mäusen und der Quantifizierung der Parasitenlast an den verschiedenen Infektionsstellen. Durch die exakte Quantifizierung der S. ratti-Parasitenlast im Kopf- und Lungengewebe sowie im Darm von Versuchsmäusen ist es möglich, die Rolle bestimmter Immuneffektoren gegenüber dem gewebemigrierenden oder dem intestinalen Lebensstadium dieses parasitären Nematoden zu entschlüsseln. Immunantworten bei Wildtyp-Mäusen und Mäusen, denen spezifische Immuneffektorzellen, Rezeptoren oder Mediatoren von Interesse fehlen, können verglichen werden, wie in der Diskussion ausführlich erläutert 5,6.
Protokoll
Die Tierversuche wurden nach dem deutschen Tierschutzgesetz durchgeführt und die Versuchsprotokolle von der Behörde für Gesundheit und Verbraucherschutz des Landes Hamburg genehmigt. Abbildung 1 gibt einen Überblick über die Aufrechterhaltung des Lebenszyklus von S. ratti bei Wistar-Ratten und die Produktion von iL3 zur Infektion von Versuchsmäusen oder -ratten.
1. Vorbereitung von infektiösen Larven
- Bereiten Sie das Baermann-Gerät wie in Abbildung 1 gezeigt vor. Verschließen Sie den Boden des Schlauchs mit einer Klemme in einem schrägen Winkel und legen Sie ein Taschentuchtuch in das Sieb. Mit lauwarmem Wasser (ca. 35-37 °C) auffüllen, bis das Sieb mit Wasser bedeckt ist.
- Füllen Sie das Sieb mit der wie unten (Schritt 6) vorbereiteten Kot-Holzkohle-Mischung. Die Mischung muss vollständig mit Wasser bedeckt sein.
- Schalten Sie das Licht direkt hinter dem Baermann-Gerät ein. Viable iL3 wird aktiv durch den Wipe migriert.
- Nach 30 min haben sich die Larven über der Klammer niedergelassen, sammeln Sie sie in einem 50 mL Röhrchen, indem Sie die Klammer kurz öffnen. Sammeln Sie das gesamte Pellet, aber stellen Sie sicher, dass das Volumen so klein wie möglich ist.
- Füllen Sie das 50-ml-Röhrchen mit PBS, das 1 % Penicillin-Streptomycin (PBS/Pen-Streptomycin) enthält, und lassen Sie die Larven 30 Minuten lang durch Schwerkraft bei 4 °C am Boden des Röhrchens absetzen. Entfernen Sie vorsichtig den Überstand mit einer Pipette und wiederholen Sie den Waschschritt 3x.
- Nach dem dritten Waschschritt resuspendieren Sie das Pellet in 30 bis 50 mL PBS/Pen-Strep, je nach Pelletgröße. Übertragen Sie 1 μl Tropfen der Lösung auf einen Mikroskopie-Objektträger. Rühren Sie die Lösung unmittelbar vor dem Pipettieren auf, da sich der iL3 schnell absetzt.
- Untersuchen Sie die Tröpfchen unter einem inversen Mikroskop bei 40-facher Vergrößerung. Der iL3 sollte sich lebhaft bewegen. Zählen Sie den iL3 pro 1 μl Tröpfchen in 5 bis 10 Wiederholungen und berechnen Sie den Mittelwert pro μl.
2. Infektion von Mäusen
HINWEIS: Vorbereiteter iL3 kann in PBS/Pen-Strep bei 4 °C in einem 50-ml-Röhrchen gelagert werden, das horizontal aufbewahrt werden sollte, um eine Beschädigung des iL3 zu vermeiden. Die Lebensfähigkeit in vitro , die durch die lebhafte Bewegung von iL3 angezeigt wird, ist in unseren Händen bis zu 1 Woche lang unverändert. Da es keinen systematischen Vergleich der Infektiosität von L3 nach unterschiedlichen Lagerzeiten gibt, verwenden wir als internen Standard frisch aufbereitetes iL3 und gelagertes iL3 für maximal 24 h nach der Aufbereitung. Infektionen mit älteren iL3-Chargen sind möglich. Es ist jedoch zwingend erforderlich, dieselbe iL3-Charge für die Infektion verschiedener Gruppen innerhalb eines Experiments zu verwenden. Infektionen von Mäusen sollten vorzugsweise von zwei Personen durchgeführt werden, wobei eine Person die Maus hält und eine andere die Injektion durchführt.
- Bereiten Sie ein 1,5-ml-Zentrifugationsröhrchen pro Maus vor, das insgesamt 1000 iL3 (C57BL/6) oder 2000 iL3 (BALB/c) enthält, die wie oben in Schritt 1.7 in PBS/Pen-Strep beschrieben gezählt wurden, die mit dem Baermann-Gerät wie oben beschrieben (Schritt 1) hergestellt wurden. Rühren Sie zwischen den Pipettierschritten gründlich um, da sich der iL3 schnell setzt.
- Lassen Sie das iL3 20-30 Minuten lang bei Raumtemperatur (RT) durch die Schwerkraft absetzen und aspirieren Sie den Überstand mit einer 0,5-ml-Spritze so vollständig wie möglich, wobei etwa 30 μl iL3-Suspension im Röhrchen verbleiben. Resuspendieren Sie das iL3 mit einer 0,5-ml-Spritze (28 G) oder durch Schnippen des Schlauchs und aspirieren Sie die restliche Suspension.
HINWEIS: Bei der iL3 ist die Wahrscheinlichkeit, dass sie an nassem Kunststoff haftet, geringer als bei der Trockenspritze. Daher ist es vorteilhaft, die gleiche Spritze zu verwenden, um den Überstand zu entfernen. - Mäuse müssen wegen einer Infektion nicht betäubt werden. Heben Sie die Mäuse mit dem Genick auf und greifen Sie einen Hinterfuß der Mäuse. Verwenden Sie weibliches und männliches C57BL/6, das älter als 8 Wochen ist und mindestens 20 g wiegt. Injizieren Sie die gesamte Lösung, die das iL3 enthält, subkutan in einem flachen Winkel in das Fußpolster. Ziehen Sie die Spritze langsam zurück, um zu vermeiden, dass Larvensuspension von der Einstichstelle verschüttet wird. Es bildet sich eine sehr kleine Kuppel, die die Flüssigkeit enthält. Diese wird von selbst absorbiert.
HINWEIS: Die subkutane Infektion des Fußballens und nicht der Flanke oder des Nackens ahmt die natürliche Infektion durch iL3 nach, das in feuchter, mit Kot gedüngter Erde lebt und aktiv in die intakte Haut eindringt. Auch der erste drainierende Lymphknoten (LN) wird als Kniekehle LN definiert. Dieser LN kann für die Analyse früher (d. h. Tag 2 p.i.) immunologischer Veränderungen verwendet werden, z. B. der Expansion von Foxp3+ regulatorischen T-Zellen als Reaktion auf eine Infektion, wie in16 gezeigt.
3. Zählung von iL3 im Kopf und in der Lunge infizierter Mäuse
- Für die Analyse der Larvenbelastung im Gewebe werden die Mäuse an Tag 1-3 p.i. getötet, da der Höhepunkt der Larvenbelastung an Tag 2 p.i.8,12 liegt. Führen Sie Sterbehilfe durch CO2 -Überdosis Narkose durch. Nach dem Fehlen von Hornhaut und interdigitalen Reflexen ist eine Zervixluxation durchzuführen.
- Besprühen Sie Bauch und Hals mit einem handelsüblichen Desinfektionsmittel und schneiden Sie die Haut über dem Bauch mit einer Schere ein. Ziehen Sie die Haut zurück, um die vordere Bauchdecke freizulegen, und schneiden Sie entlang der Mittellinie, um die Bauchhöhle zu öffnen. Schneiden Sie das Zwerchfell ab und schneiden Sie die Rippen zu beiden Seiten auf, um die Lunge in der Pleurahöhle freizulegen.
- Sammeln Sie die Lungenlappen in einer 24-Well-Platte, die durch Leitungen mit 1 ml Leitungswasser unterteilt ist. Zeichnen oder drucken Sie die Linien in einem Abstand von ca. 4 mm auf die Platte. Der Abstand zwischen den Linien soll es ermöglichen, beide Linien gleichzeitig bei 40-facher Vergrößerung zu sehen.
- Schneiden Sie die gesamte Lunge in sechs Stücke von ca. 0,75 cm x 0,75 cm.
- Den Kopf mit einer Knochenschere abschneiden. Entfernen Sie die Haut und das Fell mit den Fingern. Versuchen Sie, so wenig Muskelgewebe wie möglich zu entfernen.
- Präparieren Sie den gesamten Kopf (einschließlich Gehirn und Knochen) in vier Viertel hinter den Augen und in Längsrichtung durch die Mitte des Kopfes (siehe Abbildung 2C). Legen Sie den vorderen und hinteren Quadranten in eine Vertiefung einer 6-Well-Platte, die durch Linien mit 2 ml Leitungswasser gekennzeichnet ist. Legen Sie das Taschentuch mit den Schnitten nach unten ins Wasser.
HINWEIS: In der Regel liefert dieser Ansatz eine genaue Erfassung der Anzahl der Larven, die das Kopfgewebe migrieren. Wenn eine separate Analyse der L3-Zahlen im Gehirn erforderlich ist, kann Schritt 3.7 einbezogen werden. - Wenn eine separate Analyse des Gehirns gewünscht ist, entfernen Sie die Haut vom Kopf mit den Fingern. Bohren Sie dann mit einer Schere durch die Schädeldecke zwischen den Augen. Von diesem Schnitt aus öffnen Sie die Oberseite des Schädels sagittal mit einer unbenutzten oder gründlich gereinigten Schere. Um das Gehirn freizulegen, öffnen Sie die rechte und linke Schädeldecke mit einer Pinzette. Heben Sie das Gehirn mit einem Spatel von der vorderen Seite nach oben an und schneiden Sie die Nervenstränge mit einer sauberen Schere durch. Entnehmen Sie das Gehirn und geben Sie es auf eine 24-Well-Platte, die durch Linien mit Leitungswasser gekennzeichnet ist.
- Stellen Sie die Platten in einen 37 °C heißen Inkubator. 3 h inkubieren, dabei die Platten stündlich (h) 10x schwenken. Nach der Inkubation ein letztes Mal schwenken, die restlichen Gewebeteile mit einer Pinzette aus den Vertiefungen entfernen und das Gewebe entsorgen.
- Zählen Sie alle Larven im restlichen Wasser in den Brunnen unter einem inversen Mikroskop mit 40-facher Vergrößerung vollständig ab, indem Sie sich entlang der auf den Brunnenböden gezeichneten Linien bewegen. Zählen Sie die gewebemigrierenden Larven am selben Tag, um die Aussagekraft der Ergebnisse zu erhöhen.
4. Zählung von S. ratti-Parasiten im Darm infizierter Mäuse
- Für die Analyse der Parasitenbelastung im Darm opfern die Mäuse am Tag p.i. von Interesse, verwenden Sie Tag 3-21 p.i. für eine vollständige Kinetik. Der Höhepunkt der Parasitenlast in C57BL/6- und BALB/c-Mäusen im Dünndarm liegt an Tag 6 p.i.14. Führen Sie Sterbehilfe durch CO2 -Überdosis Narkose durch. Nach dem Fehlen der Hornhaut und der Interdigitalreflexe ist eine zervikale Luxation durchzuführen.
- Tränken Sie die Bauchregion der Mäuse in Desinfektionsmittel und schneiden Sie die Haut über dem Bauch. Ziehen Sie die Haut zurück, um die vordere Bauchdecke freizulegen, und schneiden Sie entlang der Mittellinie, um die Bauchhöhle zu öffnen.
- Der gesamte Darm wird entfernt, indem zwischen dem Magen und dem proximalen Zwölffingerdarm sowie zwischen dem Dickdarm und dem Anus geschnitten wird (siehe Abbildung 3B). Ziehen Sie den Darm vorsichtig mit den Fingern heraus und legen Sie ihn in eine Petrischale mit Leitungswasser.
- Schneiden Sie den Darm in Längsrichtung auf und waschen Sie den Kot und Schleim aus, indem Sie ihn mindestens 10 s lang kräftig in Leitungswasser schütteln. Ein kleiner Teil der adulten Parasiten und etwas L1 werden ausgewaschen, aber lebensfähige L4- und adulte S. ratti-Parasiten sind in der Darmschleimhaut von Wildtyp-Mäusen (WT) eingebettet und werden durch diesen Waschschritt nicht entfernt.
- Falls interessiert, teilen Sie den Darm weiter wie unten beschrieben.
- Isolieren Sie den Zwölffingerdarm durch einen Schnitt nach dem zweiten Peyer-Pflaster (ca. 2-3 cm). Isolieren Sie das Ileum durch zwei Schnitte, einen am ersten und den anderen am zweiten Peyer-Fleck (ca. 1-2 cm). Isolieren Sie das Jejunum nach der Isolierung des Duodenums und des Ileums, da dies der verbleibende Abschnitt ist.
- Teilen Sie das Jejunum in drei gleich große Abschnitte, um eine sehr genaue Definition der Parasitenlokalisation zu ermöglichen. Isolieren Sie den Blinddarm zwischen dem Ileum und dem Dickdarm. Isolieren Sie den Dickdarm, indem Sie nach dem Blinddarm schneiden. Die Mehrzahl der adulten Parasiten ist im ersten Drittel des Dünndarms zu finden (siehe Abbildung 3B).
- Füllen Sie die gereinigten Darmteile in 50-ml-Röhrchen mit 20 mL Leitungswasser um. Horizontal für 37 °C in den 37 °C Inkubator stellen. Jede Stunde 10 s lang sehr kräftig schütteln.
- Entfernen Sie nach 3 Stunden Inkubation das Gewebe aus dem Wasser. Platzieren Sie die Röhrchen senkrecht bei RT, und die Parasiten sedimentieren durch die Schwerkraft in 30 Minuten.
- Entfernen Sie den Überstand, bis etwa 5 ml Wasser übrig sind. Füllen Sie bis zu 25 mL mit Leitungswasser, um den Waschschritt zu wiederholen. Wiederholen Sie für die Analyse des Dünndarms diesen Waschschritt ein weiteres Mal, um eine gute Sicht unter dem Mikroskop zu haben.
- Wenn eine gute Sicht erreicht ist, saugen Sie den Überstand an, bis etwa 5 ml Wasser übrig sind, und geben Sie die Flüssigkeit in zwei Vertiefungen pro Mausdarm in einer durch Linien markierten 6-Well-Platte, wie für die Zählung von Larven im Kopf erklärt.
- Zählen Sie die erwachsenen weiblichen Parasiten unter einem inversen Mikroskop mit 40-facher Vergrößerung, indem Sie sich entlang der Linien bewegen, die auf den Brunnenböden gezeichnet sind. Zähle die Parasiten am Tag des Opfers. Zählen Sie die Parasiten so schnell wie möglich, da eine längere Inkubation im Wasser zu ihrem Tod und Zerfall führt.
HINWEIS: Neben Larven im vierten Stadium und adulten Parasiten kann hier ab etwa Tag 5 p.i. auch L1 nachgewiesen werden. Diese sind viel kleiner und viel häufiger als L4 und adulte Parasiten und sollten leicht zu unterscheiden sein.
5. Pflege von S. ratti bei Wistar-Ratten
HINWEIS: Ratteninfektionen sollten vorzugsweise von zwei Personen durchgeführt werden, wobei eine Person die Ratten hält und eine andere die Injektion durchführt. Um den Parasitenzyklus aufrechtzuerhalten, werden 4-8 Wochen alte Wistar-Ratten infiziert.
- Bereiten Sie ein 1,5-ml-Zentrifugationsröhrchen pro Ratte vor, das 2500 iL3 in PBS/Pen-Strep enthält, und verwenden Sie das Baermann-Gerät, wie zuvor beschrieben. Rühren Sie zwischen den Pipettierschritten gründlich um, da sich die Larven schnell ansiedeln.
- Lassen Sie die Larven 20-30 Minuten lang (RT) durch die Schwerkraft ruhen und aspirieren Sie den Überstand in einer 0,5-ml-Spritze (28 g), bis etwa 200 μl Larvensuspension übrig sind.
- Bei Infektionen legen Sie die Ratten in die Armbeuge einer Person und fixieren den Kopf dort vorsichtig und vorsichtig. Die andere Person greift sanft nach der Flanke der Ratte und injiziert die resuspendierte iL3-Suspension subkutan in die Nackenfalte.
6. Holzkohlekultur
- Halten Sie infizierte Ratten ab dem 5. und 12. Tag nach der Infektion in Käfigen, die mehrere Schichten Zellulose und weniger Einstreu enthalten. Dieser Tausch der Einstreu gegen mehrere Schichten Zellulose erfolgt, um die Kotsammlung im Vergleich zur Sammlung von Fäkalien aus der Einstreu zu erleichtern
- Setzen Sie die Ratten an den Tagen 6-8 und 13-15 p.i. in einen frischen Käfig um und sammeln Sie den gesamten Kot aus dem alten Käfig, indem Sie die Kotpellets aus den Käfigen aufnehmen, nachdem Sie die Ratten in frische Käfige gebracht und aus einem Käfig in ein 50-ml-Röhrchen gepoolt haben. Sammeln Sie den Kot für 2 Wochen p.i., bevor die Etablierung der Immunantwort die Larvenbelastung im Kot reduziert. Nach 2 Wochen p.i. werden die Ratten über eine CO2 -Überdosis Narkose euthanasiert. Nach dem Fehlen der Hornhaut und der Interdigitalreflexe ist eine zervikale Luxation durchzuführen.
HINWEIS: Immungeschwächte Ratten und mongolische Rennmäuse behalten S. ratti-Infektionen über längere Zeiträume aufrecht17,18. Bei der Untersuchung der Immunantwort und Immunmodulation während einer S. ratti-Infektion haben wir uns entschieden, den Zyklus in immunkompetenten Wirten aufrechtzuerhalten, um den Selektionsdruck der intakten Wirtsimmunität aufrechtzuerhalten. - Verwenden Sie die gesammelten Kotproben, um Holzkohlekulturen vorzubereiten, die die Entwicklung von iL3 aus dem im Kot vorhandenen L1 ermöglichen.
- Die Holzkohle mit Leitungswasser einweichen. Bevor Sie Holzkohle für Kulturen verwenden, füllen Sie sie in ein Sieb und waschen Sie sie unter fließendem Leitungswasser, bis das Wasser klar ist. Halten Sie die Holzkohle immer feucht. Die Holzkohle vor Gebrauch mindestens 24 h einweichen.
- Den Kot mit voreingeweichter Aktivkohle im Verhältnis ca. 1:1 vermischen. Ordnen Sie die Mischung mit einem Gefälle diagonal an und bedecken Sie sie mit einer weiteren Schicht Aktivkohle in einem flachen Glasbecherglas, um ein Endverhältnis von 1:2 zu erreichen.
HINWEIS: Die Inkubation des Kots mit eingeweichter Aktivkohle ahmt den feuchten Boden nach, in dem sich iL3 in der Natur entwickelt, und verhindert gleichzeitig eine übermäßige Pilzkontamination. - Decken Sie das Glasgefäß mit einer transparenten Folie ab. Stellen Sie sicher, dass einige Luftlöcher vorhanden sind, um die Luftzirkulation zu ermöglichen.
- 6-7 Tage bei 25 °C bei ca. 90 % Luftfeuchtigkeit ohne CO2 inkubieren. Stellen Sie sicher, dass der Inkubator ein Wassergefäß enthält, um die Kulturen feucht zu halten. Bewahren Sie die Kulturen bei Bedarf bis zu 14 Tage bei 25 °C auf. iL3 entwickelt sich entweder direkt oder indirekt19 und bleibt bis zur Infektion im iL3-Stadium verhaftet.
Ergebnisse
S. ratti wandert von der Infektionsstelle überwiegend in den Kopf und später in den Darm auf einem nicht genau definierten Weg. Um die genaue Lokalisation im Kopfgewebe und im Darm zu untersuchen, wurden C57BL/6 Mäuse mit 1000 iL3 in den linken hinteren Fußballen infiziert. Mäuse wurden an Tag 1 bis Tag 14 p.i. getötet und S. ratti-Parasiten wurden im vorderen und hinteren Kopf, Gehirn und in der Lunge quantifiziert (Abbildung 2) sowie im Zwölffingerdarm, Jejunum, Ileum, Blinddarm und Dickdarm (Abbildung 3).
An Tag 1 p.i. erreichte die erste L3 den Kopf und zeigte eine gleichmäßige Verteilung (Abbildung 2A). Darüber hinaus wurde ein kleiner Teil der Larven an Tag 1 p.i. in der Lunge entnommen (Abbildung 2B). Die L3-Zahlen stiegen an Tag 2 p.i. deutlich an und betrugen durchschnittlich 174 L3 ± 13 im Kopf und durchschnittlich 17 ± 1,7 in der Lunge. So wird der Großteil von L3 (ca. 90%) aus dem Kopf und nur etwa 10% aus der Lunge entnommen. Die meisten L3-Larven (Mittelwert 93 ± 13,3) waren in der vorderen Seite des Kopfes lokalisiert, aber auch etwa 41 ± 4,7 L3-Larven waren in der hinteren Seite des Kopfes und etwa 39 ± 5,8 im Gehirn lokalisiert. In Übereinstimmung mit dieser Beobachtung wurde das Vorhandensein von L3 im Gehirn und in der Zerebrospinalflüssigkeit bei 24 h p.i. und mit einem Maximum bei 48 h p.i. bei C57BL/6 Mäusen nach perkutaner Infektion berichtet20. An Tag 3 p.i. wurde eine deutliche Abnahme der L3-Gesamtzahlen im Vergleich zur Larvenbelastung an Tag 2 p.i. beobachtet, und an Tag 4 p.i. wurde kein L3 aus dem Kopfgewebe entnommen (Abbildung 2A). Dementsprechend wurde die Ankunft von S. ratti-Parasiten im Darm am Tag 4 p.i. nachgewiesen (Abbildung 3A). Um eine genaue Definition der Parasitenlokalisation zu ermöglichen, wurde der Darm in verschiedene Segmente unterteilt, d.h. Duodenum, Jejunum, Ileum, Caecum und Colon (Abbildung 3B). Am Tag 4 war die Mehrzahl der S. ratti-Parasiten im Zwölffingerdarm und in den ersten zwei Dritteln des Jejunums lokalisiert (Abbildung 3A). Diese Lokalisation war bis zum Tag 6 p.i. konsistent. Ab Tag 7 p.i. war die Mehrzahl der adulten S. ratti im Blinddarm lokalisiert, wo sie bis zum Tag 9 p.i. persistierten (Abbildung 3A). Die Anzahl der Parasiten im Blinddarm sank bis zum Tag 11 p.i. auf etwa 20 und bis zum Tag 14 p.i. auf 0. Wir haben zu keinem analysierten Zeitpunkt eine signifikante Anzahl von Parasiten aus dem verbleibenden Dickdarm entnommen, mit Ausnahme von etwa 5-11 Parasiten bis zum Tag 11 p.i. Während sich die Lokalisation der S. ratti-Parasiten von Tag 4 bis Tag 9 p.i. änderte und die Mehrheit der adulten Tiere nach Tag 7 p.i. aus dem Dünndarm ausgestoßen wurde, blieb die Gesamtzahl der aus dem gesamten Darm entnommenen Parasiten bis zum Tag 9 konstant. Lebensfähiges L1 wurde nicht quantifiziert, ist aber von Tag 4 bis Tag 11 nachweisbar, mit Höhepunkt an Tag 6 (Daten nicht gezeigt).
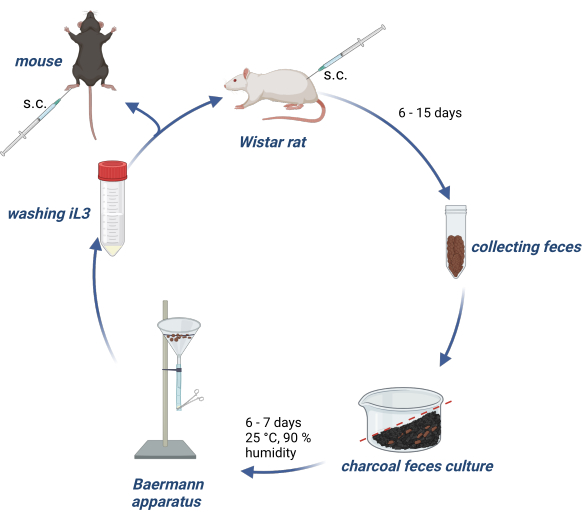
Abbildung 1: Aufrechterhaltung des Lebenszyklus von S. ratti bei Ratten und Mäusen. Wistar-Ratten werden s.c. mit 2500 iL3 in die Nackenfalte injiziert. Nach 6- 15 Tagen wird z.B. der Kot gesammelt, mit wassergetränkter Aktivkohle vermischt, mit einem Gefälle angeordnet und mit einer transparenten Folie bedeckt, einschließlich Luftlöchern. Diese Kultur wird 6-7 Tage lang bei 25 °C und 90 % Luftfeuchtigkeit inkubiert. Die iL3 werden mit dem Baermann-Apparat isoliert und 3x mit PBS/Pen-Strep gewaschen. Experimentellen Mäusen werden 1000 iL3 subkutan in den hinteren Fußballen injiziert. Erstellt mit BioRender.com. Abbildung 1 wurde in BioRender erstellt. Linnemann, L. (2024) https://BioRender.com/g80l370. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
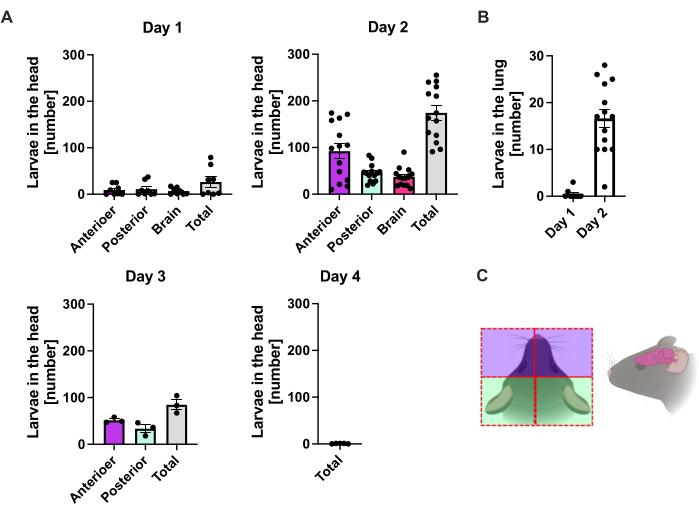
Abbildung 2: Quantifizierung von S. ratti im Lungen- und Kopfgewebe im Zeitverlauf. C57BL/6 Mäusen wurde s.c. 1000 iL3 in den hinteren Fußballen injiziert. Die Mäuse wurden zu den angegebenen Zeitpunkten getötet und die S. ratti-Parasiten im Kopf (A) und in der Lunge (B) gezählt. Jedes Symbol stellt die L3-Zählungen einer einzelnen Maus dar. Das Balkendiagramm zeigt den Mittelwert an, und die Fehlerbalken zeigen SEM an. Die Grafiken zeigen kombinierte Daten aus einzelnen Experimenten. Tag 1: zwei unabhängige Experimente mit n=4 pro Zeitpunkt und Experiment; Tag 2: vier unabhängige Experimente mit n=4, n=4, n=6 und n=3; Tag 3: zwei unabhängige Experimente mit n=4 und n=3; Tag 4: Ein Experiment mit n=5. (C) Schematische Karikatur, die die einzelnen Regionen des Kopfes zeigt, die für die Isolierung verwendet werden. Die rote gestrichelte Linie zeigt den Schnittpfad an. Abbildung 2C wurde in BioRender erstellt. Linnemann, L. (2024) https://BioRender.com/t83e660. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
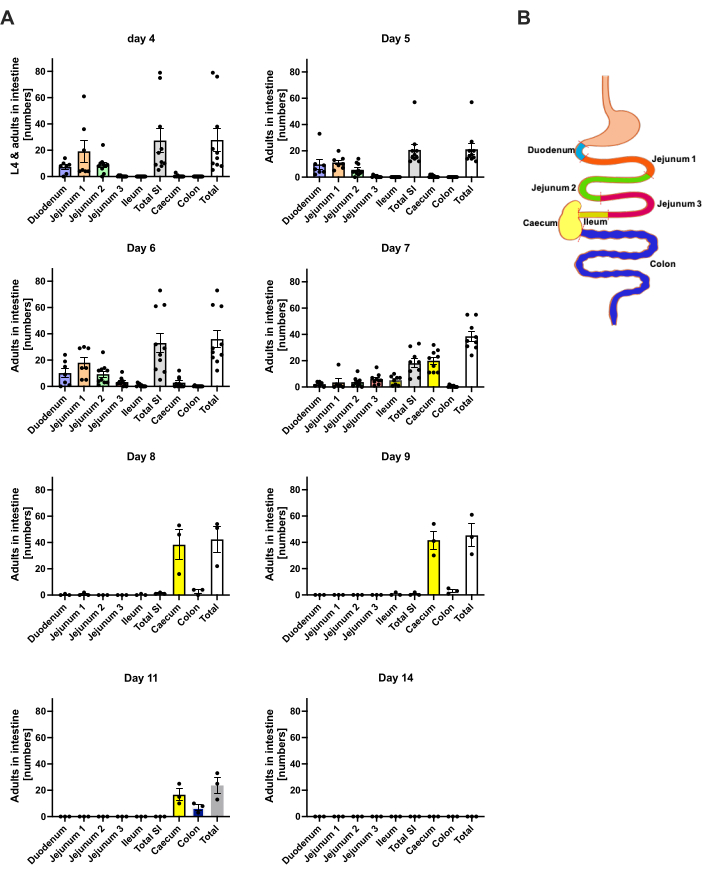
Abbildung 3: Quantifizierung von S. ratti in den Darmregionen im Zeitverlauf. Männlichen C57BL/6-Mäusen wurde s.c. 1000 iL3 in den Hinterfußballen injiziert. (A) Mäuse wurden zu den angegebenen Zeitpunkten getötet, und S. ratti-Parasiten mit Ausnahme von L1 wurden in den folgenden Regionen gezählt: Duodenum, Jejunum 1-3, Ileum, Caecum und Colon. (B) Schematische Übersicht der verschiedenen Darmregionen. Jedes Symbol stellt die Anzahl der Parasiten einer einzelnen Maus dar. Das Balkendiagramm zeigt den Mittelwert, und die Fehlerbalken zeigen das REM. Dargestellt sind kombinierte Daten aus einzelnen Experimenten. Tag 4: zwei unabhängige Experimente mit n=4 und n=6 Mäusen; Tag 5: zwei unabhängige Experimente mit n=4 und n=6; Tag 6: zwei unabhängige Experimente mit n=4 und n=6; Tag 7: zwei unabhängige Experimente mit n=6 und n=3; Tag 8 bis 14: ein Experiment mit n=3. SI: Dünndarm. Abbildung 3B wurde in BioRender erstellt. Linnemann, L. (2024) https://BioRender.com/h27y297. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Die Infektion von Versuchsmäusen mit S. ratti stellt ein hervorragendes Modell dar, um die Art der schützenden Immunantwort auf Wurminfektionen an mehreren Stellen und Stadien der Immunität zu untersuchen. Unter Verwendung verschiedener KO-Mauslinien und Zell- oder Zytokin-Depletionsmodellen kann die Rolle spezifischer Immunzellen, Mediatoren oder Rezeptoren in einem akuten Wurminfektionsmodell untersucht werden. Die Möglichkeit, die Parasitenlast sowohl im Kopf als auch im Darm zu quantifizieren, bietet die Möglichkeit, die Rolle von Immunzellen und Effektoren in verschiedenen Geweben und Phasen während des Lebenszyklus des Parasiten zu differenzieren. Die Depletion bestimmter Zelltypen durch Antikörperinjektionen ermöglicht die Untersuchung ihrer Rolle, insbesondere während der intestinalen Immunantwort, wenn die depletierende Behandlung nach Abschluss der Gewebemigrationsphase beginnt. Falls gewünscht, kann der Darm weiter in Duodenum, Jejunum, Ileum, Caecum und Colon unterteilt werden, um auch geringfügige Verschiebungen in der Parasitenlokalisation oder Clearance-Kinetik zu erkennen. Es ist zu beachten, dass die inter- und intraexperimentelle Variation in diesen Infektionsexperimenten selbst bei Inzuchtmäusen ziemlich hoch ist, was die Variation widerspiegelt, die durch die Interaktion von Parasit und Wirt sowie durch verschiedene Chargen von S. ratti L3 mit unterschiedlicher Infektionswirksamkeit hervorgerufen wird (siehe Abbildung 2 und Abbildung 3). Um die Variabilität zu reduzieren, sollten Alter und Geschlecht der Versuchsmäuse ähnlich sein. Darüber hinaus ist es beim Vergleich von KO- und WT-Mäusen sehr ratsam, Wurfgeschwister-Kontrollen anstelle von WT-Mäusen aus einer unabhängigen Zuchtkolonie zu verwenden. Nichtsdestotrotz ist es bei ausreichenden Stichprobengrößen möglich, zuverlässige Ergebnisse zum Vergleich der Parasitenlast bei Mäusen zu erzielen, die für bestimmte Effektoren defizitär oder kompetent sind, was zu einem klaren Bild der Immuneffektoren führt, die an der schützenden Immunantwort auf S. ratti beteiligt sind (überprüft in 6).
Ein wesentliches Unterscheidungsmerkmal von S. ratti im Vergleich zu anderen Nematodeninfektionsmodellen, wie dem eng verwandten S. venezuelensis oder N. brasiliensis, ist der einzigartige Migrationsweg der Larven innerhalb des Wirts. Im Gegensatz zu N. brasiliensis und S. venezuelensis, deren Lebenszyklen beide eine Lungenphase enthalten 21,22,23, umgeht S. ratti in erster Linie die Lunge und wandert durch das Muskel- und Hautgewebe zum Kopf 8,12. Nur ca. 10% der am Tag 2 p.i. überlebenden Parasiten befinden sich in der Lunge. In der Zwischenzeit konzentriert sich die Lokalisation von S. ratti im Kopf auf die nasofrontale Region, in Übereinstimmung mit früheren Studien8. Diese Eigenschaften machen S. ratti zu einem wertvollen Modell für die Untersuchung der Wirt-Parasiten-Interaktionen, insbesondere im Haut- und Muskelgewebe sowie im gewebedrainierenden Lymphknoten, und ermöglichen Studien über Immunantworten, die durch eine ausgedehnte Lungenbeteiligung verdeckt oder erschwert werden können, wie dies bei anderen Nematodeninfektionsmodellen der Fall ist. Auffallend ist, dass S. ratti L3 auch aus der Zerebrospinalflüssigkeit20 und dem Gehirn gewonnen wird (Abbildung 2A), obwohl infektionsinduzierte neurologische Symptome oder der Tod relativ selten sind und in unserer Tierhaltung noch nie beobachtet wurden. Zukünftige Forschungen könnten aufklären, ob diese im Gehirn lokalisierten Parasiten gefangen sind oder ob es einen Weg zum Darm gibt.
Die Gattung Strongyloides hat auch die einzigartige Fähigkeit, zwischen den parasitären Generationenfreilebende Generationen zu bilden 24. Dieses freilebende Stadium von S. ratti sowie seine Vermehrung durch Pathogenese erleichtern darüber hinaus die Bildung transgener Larven. Der Einsatz von Mikroinjektionen in freilebende Weibchen ermöglichte die Erzeugung von Larven, die Modellantigene wie 2W1S exprimieren, die mit einem grün fluoreszierenden Protein fusioniert sind. Während die Expression des Epitops während der Häutung bei Erwachsenen verloren ging, ermöglichte es die Verfolgung und Charakterisierung von S. ratti-spezifischen CD4+ T-Zellen in der Lunge und den lungendrainierenden mediastinalen Lymphknoten25. Dieser Ansatz bietet ein hervorragendes Werkzeug für die Untersuchung der CD4+ T-Zellbiologie im Zusammenhang mit Wurminfektionen und der Entwicklung von Anti-Wurm-Impfstoffen.
S. ratti ist ein vielseitiger Modellorganismus für die immunologische Erforschung von Helminthenparasiten, die die Gewebemigration und die intestinalen Lebensstadien im Allgemeinen aufweisen. Humane S. stercoralis-Infektionen sind aufgrund der auftretenden Autoinfektion durch eine extreme Chronizität gekennzeichnet, die auch bei immunsupprimierten Wirten, meist Patienten, die nach der Transplantation eine Glukokortikoidtherapie erhalten, zu einem Hyperinfektionssyndrom führen kann26. Es sollte beachtet werden, dass dieser Aspekt der Autoinfektion und Hyperinfektion bei Mäusen schwer zu modellieren ist. Weder S. ratti-infizierte RAG1 KO noch Nacktmäuse 5,27 sind anfällig für Hyperinfektionen. Bemerkenswert ist, dass ein Mausmodell der Hyperinfektion mit S. stercoralis unter Verwendung von Glukokortikosteroiden-behandelten, stark immungeschwächten Mäusen (NOD.Cg-PrkdcscidIl2rg tm1Wjl/SzJ) etabliert wurde, das möglicherweise die Analyse zumindest von Aspekten des Hyperinfektionssyndroms bei Mäusen ermöglicht28.
Nichtsdestotrotz zeigten Studien, die eine S. ratti-Infektion bei Mäusen verwendeten, dass Eosinophile und Neutrophile eine nicht redundante Rolle bei der Ausrottung von gewebemigrierenden Larven spielen. Die Erschöpfung bzw. Abwesenheit bei genetisch veränderten Mäusen führte zu erhöhten L3-Zahlen im Kopf8. Während Mastzellen und basophile Granulozyten während der Gewebemigrationsphase entbehrlich waren, trugen sowohl Mastzellen als auch Basophile zur Kontrolle der Parasitenlast im Darm bei. Ihr Fehlen hatte keinen Einfluss auf die L3-Zahlen im Gewebe, erhöhte jedoch die Anzahl adulter S. ratti-Parasiten im Darm an Tag 6 p.i.12,29. Weitere Analysen zeigten, dass das Fehlen von Basophilen oder selektiven Bindegewebsmastzellen eine Infektionsbeendigung mit WT-Kinetik ermöglichte. Im Gegensatz dazu blieben Mäuse ohne Bindegewebe und Schleimhautmastzellen 20 Wochen lang infiziert12. Diese Ergebnisse enthüllten eine zentrale Rolle für mukosale Mastzellen bei der endgültigen Beendigung der Infektion, was den Wert dieses Infektionsmodells für die Aufklärung der Funktion von mukosalen Mastzellen während einer Wurminfektion unterstreicht. Die weitere Definition möglicher Veränderungen in der intestinalen Lokalisation von S. ratti-Parasiten in Abwesenheit bestimmter immunologischer Effektorzellen wird dazu beitragen, ihre Funktion bei der Anti-Helminthen-Immunität noch genauer zu definieren.
Darüber hinaus können immunevasive Mechanismen, die von Helminthen eingesetzt werden, um ihr Überleben zu erleichtern, in diesem System untersucht werden. Es wurde gezeigt, dass die Depletion von Foxp3+ regulatorischen T-Zellen oder die Deletion eines regulatorischen Rezeptors auf Effektor-T-Zellen, die beide während einer S. ratti-Infektion induziert wurden, die Parasitenlast am Tag 6 p.i. und die Larvenproduktion während der Infektion reduzierte 15,16,30,31. Darüber hinaus war es möglich, den Darm als das Gewebe zu definieren, auf das die Immunevasion abzielt, und die IL-9-vermittelte Mastzellaktivierung als unterdrückten Immunweg. Schließlich kann der Mechanismus der ILC2-vermittelten Initiierung der Typ-2-Immunität durch gewebeabgeleitete Alarmin-Zytokine wie IL-33 unter Verwendung von Suppressoren und Verstärkern von endogenem IL-3332 untersucht werden.
Die Isolierung großer Mengen von iL3 über das Baermann stellt die Möglichkeit für weitere in vitro Studien dar. Co-Kulturen von L3 mit Immunzellen oder potenziellen Wirkstoffkandidaten ermöglichen eine direkte Untersuchung der Auswirkungen auf die Lebensfähigkeit und Motilität von L3. Die Ex-vivo-Restimulation von Zellen, die aus infizierten Mäusen mit S. ratti-Antigenlysat oder lebensfähigem L3 isoliert wurden, bietet eine Plattform zur Untersuchung der Zytokinproduktion in verschiedenen Zelltypen. Schließlich können Protein- und Lipidfraktionen von L3 zur Identifizierung von S. ratti-abgeleiteten pathogenassoziierten molekularen Mustern oder immunmodulatorischen Effektormolekülen verwendet werden
Da Helmintheninfektionen weltweit nach wie vor eine große Gesundheitsbelastung darstellen, ist die Forschung zur weiteren Aufklärung der durch Helminthen induzierten Immunreaktionen und des von den Parasiten eingesetzten Evasionsmechanismus nach wie vor von entscheidender Bedeutung, um die Behandlungsmöglichkeiten zu verbessern und Präventionsstrategien wie Impfungen zu entwickeln. Die S. ratti-Infektion bei Mäusen stellt ein vielseitiges Modell für die Erforschung von Helminthen-Wirt-Interaktionen während eines akuten Infektionsmodells dar.
Offenlegungen
Die Autoren haben keinen Interessenkonflikt. Das Sprachmodell Perplexity AI 2024 wurde genutzt, um Textentwürfe zu überarbeiten und Formulierungen zu verbessern.
Danksagungen
Diese Arbeit wurde gefördert durch die Jürgen Manchot Stiftung und die Deutsche Forschungsgemeinschaft (Grant BRE 3754/6-1 und BRE 3754/10-1). Die Abbildungen 1, 2C und 3B wurden im BioRender.com erstellt.
Materialien
| Name | Company | Catalog Number | Comments |
| 50 ml tubes | Sarstedt, N mbrecht, DE mbrecht, DE | 6,25,47,254 | 50 ml https://www.sarstedt.com/produkte/labor/reagenz-zentrifugenroehren/roehren/produkt/62.547.254/ |
| BD Micro-Fine U100 Insulin 0.5 ml | BD Bioscience | 7468077 | 0.5 ml https://www.bestimed.de/bd-micro-fine-insulinspritze-05-ml-u100-8-mm-100x05ml-324825.html |
| centrifugeation tubes | Sarstedt, Nümbrecht, DE | 72,706 | 1.5 ml https://www.sarstedt.com/produkte/labor/mikro-schraubroehren-reagiergefaesse/reagiergefaesse/produkt/72.706/ |
| Charcoal | Roth | 0998.3 | 5 kg https://www.carlroth.com/de/de/aktivkohle/aktivkohle/p/0998.3 |
| Falcon 6-well Clear Flat Bottom, not treated cell multiwell culture plate, with Lid, sterile | Corning | 351146 | 6-well https://www.corning.com/emea/de/search.html?_cookie=false &searchText=351146&search-initialcatalog =Corporate+Communications& initialResultType=products |
| Freezer & Refrigerator | Liebherr-Hausgeräte, Rostock, DE | ||
| Greiner Bio-One 24-Well-Platten für Zellkulturen aus Polystyrol | Fisher Scientific | 10177380 | 24-well https://www.fishersci.de/shop/products/polystyrene-24-well-cell-culture-multiwell-plate/10177380#?keyword=24-well |
| Incidin Premium Wipes | Ecolab Healthcare | 100 10 279 | https://www.ecolabhealthcare.de/website/seiten/produkte/flaechendesinfektion/tuecher/incidin_premium_wipes.php |
| Incubator 25°C | Heraeus Instruments, Hanau, DE | ||
| Incubator 37°C | Heraeus Instruments, Hanau, DE | ||
| Microscope | Helmut Hund, Wetzlar, DE | 4 x objectiv lens, 10 x ocular lens | |
| Parafilm M | Parafilm | 11772644 | 4 in. X 125 ft. https://www.fishersci.de/shop/products/parafilm-m-laboratory-wrapping-film-2/11772644 |
| Penicillin/Streptomycin (Pen-Strep) | Capricorn | PS-B | 100x https://www.capricorn-scientific.com/en/shop/penicillin-streptomycin-pen-strep-100x~p1205 |
| ROTI Fair 10x PBS 7.4 | Roth | 1105.1 | https://www.carlroth.com/de/de/fertigloesungen-tabletten-portionsbeutel/rotifair-10x-pbs-7-4/p/1105.1 |
Referenzen
- Olsen, A., et al. Strongyloidiasis - the most neglected of the neglected tropical diseases. Trans Royal Soc Tropical Med Hygiene. 103 (10), 967-972 (2009).
- Buonfrate, D., et al. The global prevalence of Strongyloides stercoralis infection. Pathogens. 9 (6), 468 (2020).
- Dawkins, H. J. S., Grove, D. I. Attempts to establish infections with Strongyloides stercoralis in mice and other laboratory animals. J Helminthol. 56 (1), 23-26 (1982).
- Abraham, D., et al. Strongyloides stercoralis: protective immunity to third-stage larvae inBALB/cByJ mice. Exp Parasitol. 80 (2), 297-307 (1995).
- Breloer, M., Abraham, D. Strongyloides infection in rodents: immune response and immune regulation. Parasitology. 144 (3), 295-315 (2017).
- Breloer, M., Linnemann, L. Strongyloides ratti infection in mice: immune response and immune modulation. Philosophical Trans Royal Society B. 379 (1894), 20220440 (2024).
- Dawkins, H. J. S., Grove, D. I., Dunsmore, J. D., Mitchell, G. F. Strongyloides ratti: Susceptibility to infection and resistance to reinfection in inbred strains of mice as assessed by excretion of larvae. Int J Parasitol. 10 (2), 125-129 (1980).
- Ehrens, A., et al. Eosinophils and neutrophils eliminate migrating Strongyloides ratti larvae at the site of infection in the context of extracellular DNA trap formation. Front Immunol. 12, 715766 (2021).
- Eschbach, M. L., et al. Strongyloides ratti infection induces transient nematode-specific Th2 response and reciprocal suppression of IFN-γ production in mice. Parasite Immunol. 32 (5), 370-383 (2010).
- Dawkins, H., Muir, G., Grove, D. Histopathological appearances in primary and secondary infections with Strongyloides ratti in mice. Int J Parasitol. 11 (1), 97-103 (1981).
- Tada, I., Mimori, T., Nakai, M. Migration route of Strongyloides ratti in albino rats. Jap J Parasit. 28 (4), 219-227 (1979).
- Reitz, M., et al. Mucosal mast cells are indispensable for the timely termination of Strongyloides ratti infection. Mucosal Immunol. 10 (2), 481-492 (2017).
- Viney, M. E., Lok, J. B. The biology of Strongyloides spp. WormBook. , 1-17 (2018).
- Reitz, M., et al. Interleukin-9 promotes early mast cell-mediated expulsion of Strongyloides ratti but is dispensable for generation of protective memory. Sci Rep. 8 (1), 8636 (2018).
- Breloer, M., et al. Cutting edge: The BTLA-HVEM regulatory pathway interferes with protective immunity to intestinal Helminth infection. J Immunol. 194 (4), 1413-1416 (2015).
- Blankenhaus, B., et al. Foxp3+ regulatory T cells delay expulsion of intestinal nematodes by suppression of IL-9-driven mast cell activation in BALB/c but not in C57BL/6 mice. PLoS Pathogens. 10 (2), e1003913 (2014).
- Niamatali, S., Nolan, T. J., Schad, G. A. . Can Autoinfection be Provoked in the Strongyloides ratt/-infected Gerbil, Meriones unguiculatus. 59 (2), 149-152 (1992).
- Gardner, M. P., Gems, D., Viney, M. E. Extraordinary plasticity in aging in Strongyloides ratti implies a gene-regulatory mechanism of lifespan evolution. Aging Cell. 5 (4), 315-323 (2006).
- Viney, M. E. Developmental switching in the parasitic nematode Strongyloides ratti. Proc Biol Sci. 263 (1367), 201-208 (1996).
- Dawkins, H. J., Thomason, H. J., Grove, D. I. The occurrence of Strongyloides ratti in the tissues of mice after percutaneous infection. J Helminthol. 56 (1), 45-50 (1982).
- Takamure, A. Migration route of Strongyloides venezuelensis in rodents. Int J Parasitol. 25 (8), 907-911 (1995).
- Filbey, K., Bouchery, T., Le Gros, G. The role of ILC 2 in hookworm infection. Parasite Immunol. 40 (2), e12429 (2018).
- Allen, J. E., Sutherland, T. E. Host protective roles of type 2 immunity: Parasite killing and tissue repair, flip sides of the same coin. Semin Immunol. 26 (4), 329-340 (2014).
- Dulovic, A., Puller, V., Streit, A. Optimizing culture conditions for free-living stages of the nematode parasite Strongyloides ratti. Exp Parasitol. 168, 25-30 (2016).
- Douglas, B., et al. Transgenic expression of a T cell epitope in Strongyloides ratti reveals that helminth-specific CD4+ T cells constitute both Th2 and Treg populations. PLOS Pathogens. 17 (7), e1009709 (2021).
- Vadlamudi, R. S., Chi, D. S., Krishnaswamy, G. Intestinal strongyloidiasis and hyperinfection syndrome. Clin Mol Allergy. 4 (1), 8 (2006).
- Viney, M., Kikuchi, T. Strongyloides ratti and S. venezuelensis- rodent models of Strongyloides infection. Parasitology. 144 (3), 285-294 (2017).
- Patton, J. B., et al. Methylprednisolone acetate induces, and Δ7-dafachronic acid suppresses, Strongyloides stercoralis hyperinfection in NSG mice. Proc Natl Acad Sci. 115 (1), 204-209 (2018).
- Reitz, M., Brunn, M. L., Voehringer, D., Breloer, M. Basophils are dispensable for the establishment of protective adaptive immunity against primary and challenge infection with the intestinal helminth parasite Strongyloides ratti. PLOS Neglected Trop Dis. 12 (11), e000699 (2018).
- Blankenhaus, B., et al. Strongyloides ratti infection induces expansion of Foxp3+ regulatory T cells that interfere with immune response and parasite clearance in BALB/c Mice. J Immunol. 186 (7), 4295-4305 (2011).
- Hartmann, W., Blankenhaus, B., Brunn, M. L., Meiners, J., Breloer, M. Elucidating different pattern of immunoregulation in BALB/c and C57BL/6 mice and their F1 progeny. Sci Rep. 11 (1), 1536 (2021).
- Meiners, J., et al. IL-33 facilitates rapid expulsion of the parasitic nematode Strongyloides ratti from the intestine via ILC2- and IL-9-driven mast cell activation. PLOS Pathogens. 16 (12), e1009121 (2020).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten