Method Article
小鼠用寄生线虫 Strongyloides ratti 感染的实验性
摘要
Strongyloides ratti 是一种寄生线虫,可在实验室小鼠中引起短暂感染,表现出组织迁移和肠道生命阶段。在这里,我们提出了一种维持大鼠寄生虫周期和小鼠实验感染的方案,包括头部、肺和肠道中的寄生虫定量。
摘要
Strongyloides ratti 是一种寄生线虫,自然感染野生大鼠。然而,大多数实验室大鼠和小鼠品系完全易受感染。免疫功能正常的 BALB/c 和 C57BL/6 小鼠在典型的 2 型免疫反应的情况下在一个月内终止 S. ratti 感染,并且对再次感染保持半耐药性。感染过程可分为三个阶段:(a) 感染性第三阶段幼虫在前两天的组织迁移阶段;(b) 早期肠道阶段,包括感染后第 3 至 6 天蜕皮为成虫寄生虫和嵌入肠道粘膜,感染后第 5 至 6 天开始繁殖;(c) 肠道后期以寄生虫的完全清除结束。小鼠的实验性感染 S. ratti 能够精确研究不同感染部位在整个生命周期中宿主-寄生虫的相互作用,以及寄生虫采用的免疫逃避策略。这里介绍的方案描述了 Wistar 大鼠中寄生虫的维持、实验室小鼠的感染以及组织迁移期和肠道期 S. ratti 寄生虫的检测和定量。
引言
土壤传播的蠕虫 Strongyloides stercoralis 会导致类圆线虫病,这种疾病通常被称为被忽视的热带病中最容易被忽视的疾病1。2020 年的估计表明,全球有 6 亿人感染粪类链球菌 2。对 S. stercoralis 的假设驱动的实验室研究是有限的,因为蠕虫无法发育超过小鼠的第三阶段幼虫 (L3) 3,4。因此,啮齿动物特异性线虫 Strongyloides ratti 通常用于实验室小鼠的体内感染研究 5,6。S. ratti 是野生大鼠的天然寄生虫,但大多数实验室小鼠品系完全易受感染7。这使得能够研究蠕虫不同组织和活体阶段的宿主-病原体相互作用和免疫反应。
小鼠 S. ratti 的实验室周期可分为三个主要阶段。皮下注射规定数量的感染性第三阶段幼虫 (iL3) 后,通常为 1000 至 2000 只,大部分(约 90%)存活的 L3 在感染的前两天迁移到小鼠的头部,只有极小的一部分(约 10%)在肺中回收8。S. ratti 积极渗透其啮齿动物宿主的皮肤。在实验室中,可以通过在小鼠的皮肤上滴一滴含有 iL3 的水并允许活动性经皮感染来模拟这种自然感染途径9。然而,感染效力要低得多,并且无法控制确切的感染剂量。S. ratti iL3 在经皮或皮下 (s.c.) 感染后采取的确切迁移途径仍然未知。然而,由于在血液或血液供应充足的器官(如受感染小鼠的肾脏)中无法检测到 S. ratti DNA,因此主要迁移途径可能不包括血液。尽管如此,S. ratti 不会在整个组织中随机迁移。相反,几项使用小鼠 3,10 和大鼠11 的组织学研究或从各种组织中检索到的活的 L3 和 S. ratti 衍生的 DNA的定量 8 提供了证据,证明 S. ratti L3 从感染部位直接通过皮肤和肌肉组织迁移到头部的鼻额区域。
大约 10% 的注射幼虫在组织迁移中存活下来,并在 C57BL/6 和 BALB/c 小鼠中到达头部,它们在头部组织中显示出相当的 L3 数12。幼虫被认为在感染后第 3 天 (p.i.) 被吞下以到达肠道。它们嵌入小肠粘膜,蜕皮为成年雌性寄生虫,并在第 5 天至第 6 天通过孤雌生殖开始繁殖 p.i.13。虫卵,但大多数已经孵化的第一阶段幼虫 (L1) 被释放到肠道中,并与粪便一起分泌。成年雌性的数量在第 6 天 p.i.14 左右达到高峰。有趣的是,C57BL/6 小鼠的肠道寄生虫负荷比 BALB/c 小鼠高 2 到 5 倍,尽管两种小鼠品系中头部的组织迁移 L3 数量相当12。在第一周,免疫功能正常的 C57BL/6 小鼠和缺乏 B 细胞和 T 细胞的 RAG1 敲除 (KO) 小鼠的肠道寄生虫负荷相似,这表明早期寄生虫控制是通过先天免疫介导的12,15。在最后阶段,免疫功能正常的小鼠在 2 至 4 周内将寄生虫从肠道中排出(6 中已论述)。RAG1 KO 小鼠无法清除感染,并且在长达 1 年内在小肠中包含少量活的和可繁殖的雌性成体12。
在解决第一次感染或用辐照的 L3 免疫后,免疫功能正常的 C57BL/6 和 BALB/c 小鼠对再次感染具有半抗性。最初接种的 iL3 中只有 1% 到达头部,在第二次感染期间,只有大约 1-5 个成虫可以从肠道中取出8。因此,使用小鼠的实验室感染 S. ratti 提供了一种工具,可以研究先天性和适应性免疫系统在肠道线虫的整个生命周期中对组织迁移阶段的影响。
在本手稿中,我们详细描述了 Wistar 大鼠 S. ratti 生命周期的维持以及小鼠的实验感染和不同感染部位寄生虫负荷的量化。通过精确定量实验小鼠头部和肺组织以及肠道中的 S. ratti 寄生虫负荷,可以剖析某些免疫效应子对这种寄生线虫的组织迁移或肠道生活阶段的作用。野生型小鼠和缺乏特异性免疫效应细胞、受体或感兴趣介质的小鼠的免疫反应可以按照讨论中详细解释的情况进行比较 5,6。
研究方案
动物实验根据德国动物福利法进行,实验方案由德国汉堡州当局 (Behörde für Gesundheit und Verbraucherschutz) 批准。 图 1 概述了 Wistar 大鼠中 S. ratti 生命周期 的维持以及用于实验小鼠或大鼠感染的 iL3 的产生。
1. 感染性幼虫的制备
- 如图 1 所示准备 Baermann 装置。用斜角的夹子关闭软管底部,然后将组织擦拭布放入筛子中。装满温水(约 35-37 °C),直到筛子被水覆盖。
- 用如下所述制备的粪便-木炭混合物填充筛子(步骤 6)。混合物需要完全被水覆盖。
- 打开 Baermann 装置正后面的灯。可行的 iL3 将通过擦除主动迁移。
- 30 分钟后,幼虫在夹具上方安定下来,快速打开夹具将其收集到 50 mL 试管中。收集整个沉淀,但要确保体积尽可能小。
- 用含有 1% 青霉素-链霉素 (PBS/Pen-Strep) 的 PBS 填充 50 mL 试管,让幼虫在 4 °C 下重力沉淀在试管底部 30 分钟。用移液管小心地去除上清液,然后重复洗涤步骤 3 次。
- 在第三个洗涤步骤后,根据沉淀大小,将沉淀重悬于 30 至 50 mL PBS/Pen-Strep 中。将 1 μL 溶液滴至显微镜载玻片上。在移液前立即搅拌溶液,因为 iL3 会迅速稳定下来。
- 在反向显微镜下以 40 倍放大倍率检查液滴。iL3 应该移动得生动。分 5 至 10 次重复计数每 1 μL 液滴的 iL3,并计算每 μL 的平均值。
2. 小鼠感染
注:制备的 iL3 可以在 4 °C 的 PBS/Pen-Strep 中储存在 50 mL 试管中,该试管应水平放置以避免损坏 iL3。iL3 的生动运动表明 的体外 活力在我们手中长达 1 周内保持不变。由于没有对不同储存时间后 L3 的传染性进行系统比较,因此我们使用新鲜制备的 iL3 并在制备后储存 iL3 最多保存 24 小时作为内标。旧批次的 iL3 感染是可能的。然而,在一个实验中,必须使用相同的 iL3 批次来感染不同的组。小鼠的感染最好由两个人进行,一个人拿着老鼠,另一个人进行注射。
- 每只小鼠制备一个 1.5 mL 离心管,其中含有总共 1000 个 iL3 (C57BL/6) 或 2000 个 iL3 (BALB/c),如上文步骤 1.7 中所述在 PBS/Pen-Strep 中计数,如上所述使用 Baermann 装置制备(步骤 1)。在移液步骤之间彻底搅拌,因为 iL3 会快速稳定。
- 让 iL3 在室温 (RT) 下重力沉降 20-30 分钟,并用 0.5 mL 注射器尽可能完全吸出上清液,在管中留下约 30 μL 的 iL3 悬浮液。用 0.5 mL 注射器 (28G) 或轻弹试管重悬 iL3 并吸出剩余的悬浮液。
注意:与干注射器相比,iL3 不太可能粘附在湿塑料上。因此,使用相同的注射器去除上清液是有利的。 - 小鼠不需要因感染而麻醉。用 scruff 捡起老鼠,抓住老鼠的一个后脚。使用年龄超过 8 周且体重至少 20 克的女性和男性 C57BL/6。将含有 iL3 的整个溶液以平角皮下注射到脚垫中。慢慢缩回注射器,以避免幼虫悬浮液从穿刺部位溢出。将形成一个包含液体的非常小的圆顶。这将被自身吸收。
注意:皮下感染到脚垫而不是颈部或颈背类似于 iL3 的自然感染,iL3 生活在用粪便施肥的潮湿土壤中,并积极渗透到完整的皮肤中。此外,第一个引流淋巴结 (LN) 被定义为腘窝 LN。该 LN 可用于分析早期(即第 2 天 p.i.)免疫变化,例如,响应感染而扩增的 Foxp3 + 调节性 T 细胞,如16 所示。
3. 感染小鼠头部和肺中 iL3 的计数
- 为了分析组织中的幼虫负荷,在第 1-3 天 pi 处死小鼠,因为幼虫负荷的峰值在第 2 天 p.i.8,12。通过 CO2 过量麻醉进行安乐死。在角膜和指间反射消失后,进行颈椎脱位手术。
- 用市售消毒剂喷洒腹部和颈部,然后用剪刀剪开腹部的皮肤。将皮肤向后拉,露出前腹壁,并沿中线切开腹膜腔。切开隔膜,切开两侧的肋骨,露出胸膜腔中的肺。
- 将肺叶收集在 24 孔板中,按含有 1 mL 自来水的线分隔。在印版上以大约 4 毫米的距离绘制或打印线条。线之间的距离应该可以在40倍放大倍率下同时看到两条线。
- 将整个肺切成六块,每块约 0.75 厘米 x 0.75 厘米。
- 用骨剪刀剪掉头部。用手指去除皮肤和毛皮。尝试尽可能少地去除肌肉组织。
- 将整个头部(包括大脑和骨骼)解剖成眼睛后面的四个季度,并纵向穿过头部中间(见 图 2C)。将前象限和后象限放入 6 孔板的孔中,标有含有 2 mL 自来水的线。将切口朝下的纸巾放入水中。
注意:通常,这种方法可以准确记录头部组织迁移幼虫的数量。如果需要单独分析大脑中的 L3 数字,则可以包括步骤 3.7。 - 如果需要对大脑进行单独分析,请用手指去除头部的皮肤。然后,用剪刀钻穿眼睛之间的黄盖骨。从这个切口开始,用未使用或彻底清洁的剪刀打开颅骨矢状面的顶部。要暴露大脑,请用镊子打开左右颅骨。用抹刀将大脑从前侧向上提起,然后用干净的剪刀剪断神经索。取出大脑并将其转移到 24 孔板中,该板由含有自来水的线条标记。
- 将板置于 37 °C 的培养箱中。 孵育 3 小时,同时每小时 (h) 10 次旋转板。孵育后,最后一次旋转,用镊子从孔中取出剩余的组织部分,然后丢弃组织。
- 沿着井底绘制的线条移动,在倒置显微镜下以 40 倍放大倍数井中剩余水中的每一只幼虫。在同一天对组织迁移的幼虫进行计数,以增加结果的可靠性。
4. 感染小鼠肠道中 S. ratti 寄生虫的计数
- 为了分析肠道中的寄生虫负荷,在感兴趣的 pi 上牺牲小鼠,使用第 3-21 天 pi 以获得完整的动力学。小肠内 C57BL/6 和 BALB/c 小鼠的寄生虫负荷峰值在第 6 天 p.i.14。通过 CO2 过量麻醉进行安乐死。在角膜和指间反射消失后,进行颈椎脱位。
- 将小鼠的腹部浸泡在消毒剂中,并切开腹部的皮肤。将皮肤向后拉,露出前腹壁,并沿中线切开腹膜腔。
- 通过在胃和近端十二指肠之间以及结肠和肛门之间切开来去除整个肠道(见 图3B)。用手指轻轻拉出肠子,然后将其放入装有自来水的培养皿中。
- 将肠道纵向切开,并在自来水中剧烈摇晃至少 10 秒,洗掉粪便和粘液。一小部分成虫和一些 L1 将被洗掉,但活的 L4 和成虫 S. ratti 寄生虫嵌入野生型 (WT) 小鼠的肠道粘膜中,不会通过此洗涤步骤去除。
- 如果感兴趣,请按照以下说明进一步分割肠道。
- 在第二个 Peyer 补片(约 2-3 厘米)后通过切口隔离十二指肠。通过两个切口隔离回肠,一个在第一个切口,另一个在第二个 Peyer 补片(约 1-2 厘米)。在分离十二指肠和回肠后分离空肠,因为这是剩余的部分。
- 将空肠分成三个相等的部分,以便对寄生虫定位进行非常精确的定义。分离回肠和结肠之间的盲肠。通过在盲肠后切割来隔离结肠。大多数成虫寄生虫可以在小肠的前三分之一中找到(见 图 3B)。
- 将清洁后的肠道部分转移到装有 50 mL 自来水的 20 mL 试管中。水平放置在 37 °C 培养箱中 3 小时。每小时非常剧烈地摇晃 10 秒。
- 孵育 3 小时后,从水中取出组织。将试管垂直置于 RT 中,寄生虫在 30 分钟内通过重力沉淀。
- 去除上清液,直到剩下约 5 mL 的水。用自来水填充至 25 mL,重复洗涤步骤。为了分析小肠,请再次重复此洗涤步骤,以便在显微镜下具有良好的可见度。
- 当获得良好的可见度时,吸出上清液直到剩下约 5 mL 水,然后将液体转移到每个小鼠肠道的两个孔中,在 6 孔板中用线条标记,如对头部幼虫计数所述。
- 在倒置显微镜下以 40 倍放大倍率沿着井底绘制的线条移动,对成年雌性寄生虫进行计数。在圣化当天数点寄生虫。尽快计数寄生虫,因为长时间在水中孵化会导致它们死亡和分解。
注意:除了第四阶段的幼虫和成虫寄生虫外,还可以从第 5 天左右开始在这里检测到 L1。这些比 L4 和成虫寄生虫小得多,数量也多得多,应该很容易区分。
5. Wistar 大鼠的 S. ratti 维护
注意:大鼠感染最好由两个人进行,一个人抱着老鼠,另一个人进行注射。为了维持寄生虫周期,感染 4-8 周龄的 Wistar 大鼠。
- 如前所述,使用 Baermann 装置为每只大鼠准备一根 1.5 mL 离心管,其中含有 2500 iL3 的 PBS/Pen-Strep 溶液。在移液步骤之间彻底搅拌,因为幼虫会迅速沉淀。
- 让幼虫在重力下沉降 20-30 分钟 (RT),并在 0.5 mL 注射器 (28G) 中吸出上清液,直到留下约 200 μL 的幼虫悬浮液。
- 对于感染,将大鼠放在一个人的臂弯中,并轻轻小心地将头部固定在那里。另一个人轻轻抓住大鼠的侧面,将重悬的 iL3 悬液皮下注射到颈皱襞中。
6. 木炭培养
- 从感染后第 5 天和第 12 天开始,将受感染的大鼠关在含有几层纤维素和较少垫料的笼子中。这种将垫料交换为几层纤维素是为了与从垫料中收集粪便相比更容易收集粪便
- 在第 6-8 天和第 13-15 天,将大鼠转移到新鲜笼中,在将大鼠转移到新鲜笼子中并将它们从一个笼子中汇集到 50 mL 管中后,从笼子中收集粪便颗粒,从旧笼子中收集所有粪便。在建立免疫反应之前,将粪便收集 2 周,以减少粪便中的幼虫负荷。2 周后,通过 CO2 过量麻醉对大鼠实施安乐死。在角膜和指间反射消失后,进行颈椎脱位。
注意:免疫功能低下的大鼠和蒙古沙鼠保持 S. ratti 感染的时间更长17,18。研究 S. ratti 感染期间的免疫反应和免疫调节,我们决定在免疫功能正常的宿主中维持循环,以维持完整宿主免疫的选择压力。 - 使用收集的粪便样品制备木炭培养物,这将允许从粪便中存在的 L1 中产生 iL3。
- 用自来水预浸泡木炭。在使用木炭进行培养之前,请将其装入筛子中,并在流动的自来水下清洗,直到水变清为止。始终保持木炭湿润。使用前将木炭浸泡至少 24 小时。
- 将粪便与预先浸泡的活性炭混合,比例约为 1:1。将混合物沿对角线梯度排列,并在平板玻璃烧杯中用另一层活性炭覆盖,以达到 1:2 的最终比例。
注意:粪便与预先浸泡的活性炭一起孵育模拟了 iL3 在自然界中生长的潮湿土壤,同时防止了过度的真菌污染。 - 用透明薄膜覆盖玻璃容器。确保有一些气孔以允许空气流通。
- 在 25 °C 下,湿度约为 90 %,无 CO2 孵育 6-7 天。确保培养箱包含水容器以保持培养物湿润。如果需要,将培养物在 25 °C 下保存长达 14 天。iL3 将直接或间接发展19 并在 iL3 阶段保持停滞直至感染。
结果
S. ratti 鼠 状链球菌从感染部位主要迁移到头部,然后迁移到肠道,其途径并不明确。为了研究头部组织和肠道中的确切定位,C57BL/6 小鼠用 1000 iL3 感染左后足垫。在第 1 天至第 14 天 p.i. 处死小鼠,并在头部前部和后部、大脑和肺中量化 S. ratti 寄生虫(图 2)以及十二指肠、空肠、回肠、盲肠和结肠(图 3)。
在第 1 天 p.i.,第一个 L3 到达头部,显示出均匀的分布(图 2A)。此外,在第 1 天 pi 在肺部回收了一小部分幼虫(图 2B)。第 2 天 p.i. 的 L3 数值显著增加,头部 L3 平均 174 ± 13 次,肺部平均 17 ± 1.7 次。因此,大部分 L3(约 90%)是从头部回收的,只有大约 10% 是从肺部回收的。大多数 L3 (平均 93 ± 13.3) 位于头部前侧,但也约有 41 ± 4.7 只 L3 幼虫位于头部后侧,大约 39 ± 5.8 只位于大脑中。根据这一观察结果,据报道,经皮感染后 C57BL/6 小鼠在 24 h p.i. 时大脑和脑脊液中存在 L3,在 48 h p.i. 时达到最大值20。与第 2 天的幼虫负荷相比,第 3 天 p.i. 观察到总 L3 数量明显减少,并且在第 4 天 p.i. 没有从头部组织中回收 L3(图 2A)。因此,在第 4 天在肠道中检测到 S. ratti 寄生虫的到来(图 3A)。为了准确定义寄生虫定位,肠道被细分为不同的部分,即十二指肠、空肠、回肠、盲肠和结肠(图 3B)。在第 4 天,pi,大多数 S. ratti 寄生虫位于十二指肠和空肠的前三分之二(图 3A)。这种定位一直持续到第 6 天 p.i.从第 7 天 p.i. 开始,大多数 S. ratti 成虫位于盲肠中,在那里它们持续到第 9 天 p.i.(图 3A)。盲肠中的寄生虫数量在第 11 天 p.i. 下降到 20 左右,到第 14 天 p.i. 下降到 0。在分析的任何时间点,我们都没有从剩余的结肠中检索到大量寄生虫,除了到第 11 天 pi 时大约 5-11 个寄生虫。虽然 S. ratti 寄生虫的定位从第 4 天到第 9 天 p.i. 发生了变化,并且大多数成虫在第 7 天 p.i. 后从小肠中排出,但从全肠中回收的总数保持不变,直到第 9 天。活的 L1 未被量化,但在第 4 天至第 11 天可检测到,在第 6 天达到峰值(数据未显示)。
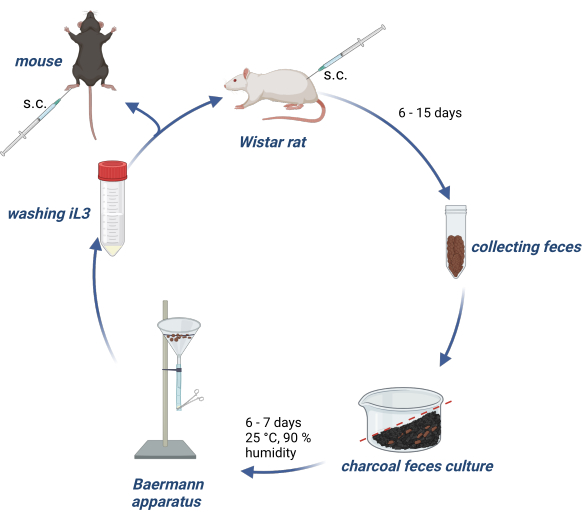
图 1:大鼠和小鼠 S. ratti 生命周期的维持。 将Wistar大鼠皮下注射到含有2500 iL 3 的颈皱襞中。6-15 天后,收集它们的粪便,与浸水的活性炭混合,以梯度排列并覆盖有透明薄膜,包括气孔。该培养物在 25 °C 和 90% 湿度下孵育 6-7 天。使用 Baermann 装置分离 iL3 并用 PBS/Pen-Strep 洗涤 3 次。将实验小鼠皮下注射 1000 iL 3 到后足垫中。使用 BioRender.com 创建。图 1 是在 BioRender 中创建的。林尼曼,L. (2024) https://BioRender.com/g80l370。请单击此处查看此图的较大版本。
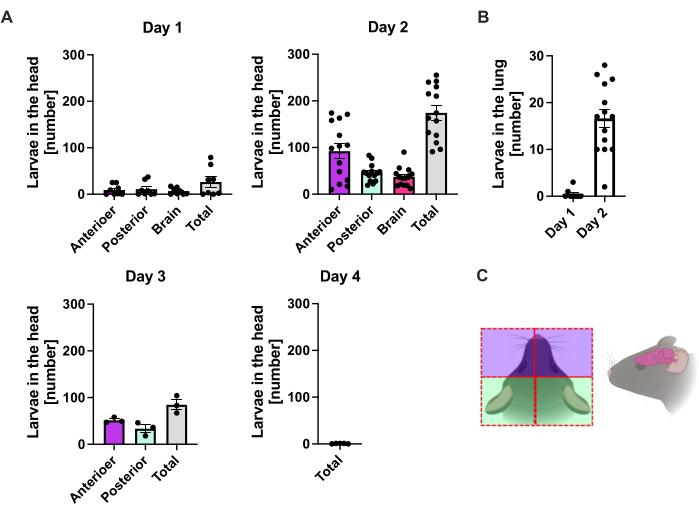
图 2:肺和头部组织中 S. ratti 随时间变化的定量。 将 C57BL/6 小鼠的后足垫皮下注射 1000 iL3。在指定的时间点处死小鼠,计数 (A) 头部和 (B) 肺中的 S. ratti 寄生虫。每个符号代表单个鼠标的 L3 计数;条形图显示平均值,误差条表示 SEM。这些图表显示了来自各个实验的组合数据。第 1 天:两个独立实验,每个时间点 n=4 和实验;第 2 天:n=4、n=4、n=6 和 n=3 的四次独立实验;第 3 天:n=4 和 n=3 的两个独立实验;第 4 天:1 次实验,n=5。(C) 显示用于隔离的头部各个区域的图解卡通。红色虚线表示切口路径。图 2C 是在 BioRender 中创建的。林尼曼,L. (2024) https://BioRender.com/t83e660。请单击此处查看此图的较大版本。
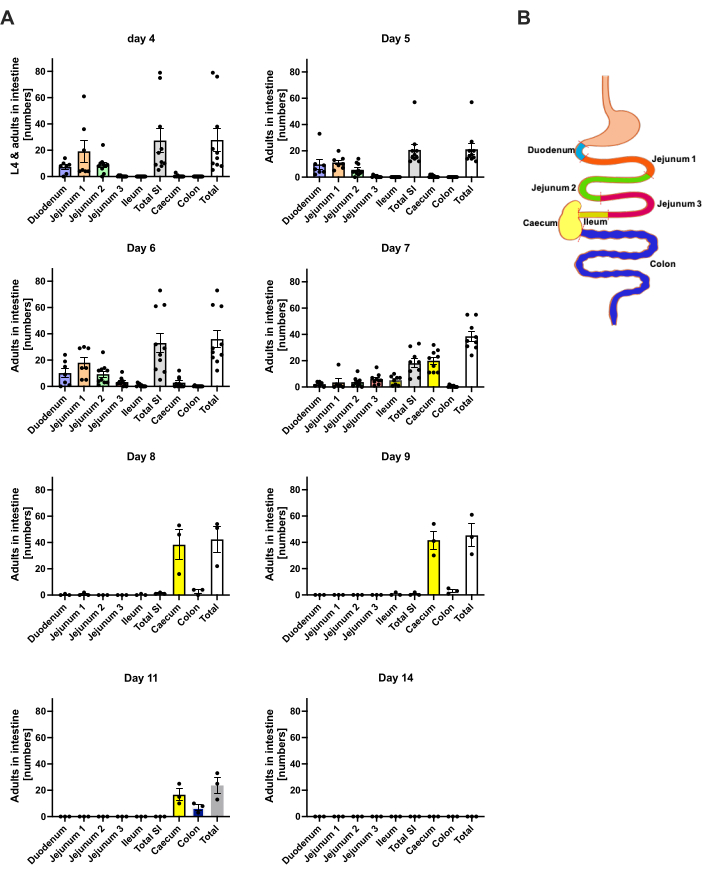
图 3:随着时间的推移,肠道区域 S. ratti 的定量。雄性 C57BL/6 小鼠在后足垫皮下注射 1000 iL3。(A) 在指定的时间点处死小鼠,并在以下区域计数除 L1 外的 S. ratti 寄生虫:十二指肠、空肠 1-3、回肠、盲肠和结肠。(B) 不同肠道区域的示意图概述。每个符号代表单个老鼠的寄生虫数量;条形图显示平均值,误差条表示 SEM。显示的是来自各个实验的组合数据。第 4 天:对 n=4 和 n=6 小鼠进行两次独立实验;第 5 天:两个独立实验,n=4 和 n=6;第 6 天:两个独立实验,n=4 和 n=6;第 7 天:两个独立实验,n=6 和 n=3;第 8 至 14 天:1 次 n=3 的实验。SI: 小肠。图 3B 是在 BioRender 中创建的。林尼曼,L. (2024) https://BioRender.com/h27y297。请单击此处查看此图的较大版本。
讨论
实验小鼠感染 S. ratti 代表了研究在多个免疫部位和阶段对蠕虫感染的保护性免疫反应性质的极好模型。使用不同的 KO 小鼠品系和细胞或细胞因子耗竭模型,可以在急性蠕虫感染模型中研究特异性免疫细胞、介质或受体的作用。量化头部和肠道中寄生虫负荷的可能性为区分免疫细胞和效应子在寄生虫生命周期中各个组织和阶段中的作用提供了可能性。通过抗体注射去除特定细胞类型可以研究它们的作用,特别是在组织迁移阶段完成后开始消耗治疗时,特别是在肠道免疫反应期间。如果需要,肠道可以进一步细分为十二指肠、空肠、回肠、盲肠和结肠,以检测寄生虫定位或清除动力学的微小变化。应该注意的是,这些感染实验中的实验间和实验内差异,即使在近交小鼠中,也是相当高的,这反映了寄生虫和宿主的相互作用以及不同批次的 S. ratti L3 表现出不同的感染效果所引入的变化(见 图 2 和 图 3)。为了减少变异性,实验小鼠的年龄和性别应该相似。此外,如果比较 KO 和 WT 小鼠,强烈建议使用同窝对照而不是来自独立繁殖菌落的 WT 小鼠。然而,如果使用足够的样本量,则有可能产生可靠的结果,比较缺乏或有能力某些效应子的小鼠的寄生虫负荷,从而清楚地了解参与对 S. ratti 的保护性免疫反应的免疫效应子 (6 中已论述)。
与其他线虫感染模型(例如密切相关的 S. venezuelensis 或 N. brasiliensis)相比,S. ratti 的一个关键区别特征是幼虫在宿主内独特的迁移路线。与巴西猪笼草和委内瑞拉葡萄球菌的生命周期都包含肺期 21,22,23 不同,葡萄球菌主要绕过肺部,通过肌肉和皮肤组织迁移到头部 8,12。在第 2 天 p.i. 中,只有大约 10% 的存活寄生虫存在于肺部。同时,S. ratti 在头部的位置集中在鼻额区,与之前的研究一致8。这些特性使 S. ratti 成为研究宿主-寄生虫相互作用的宝贵模型,特别是在皮肤和肌肉组织以及组织引流淋巴结中,并能够研究免疫反应,这些免疫反应可能因其他线虫感染模型那样因肺部受累而变得模糊或复杂。引人注目的是,S. ratti L3 也从脑脊液20 和大脑中检索(图 2A),尽管感染引起的神经系统症状或死亡相对罕见,并且从未在我们的动物设施中观察到。未来的研究可能会阐明这些大脑定位的寄生虫是否被困住,或者是否存在通往肠道的途径。
类圆线虫属还具有在寄生世代之间形成自由生活世代的独特能力24。S. ratti 的这些自由生活阶段,以及它通过发病机制的繁殖,进一步促进了转基因幼虫的产生。对自由生活的雌性进行显微注射能够产生表达模型抗原的幼虫,如 2W1S 与绿色荧光蛋白融合。虽然表位的表达在蜕皮到成虫的过程中丢失,但它能够追踪和表征肺和肺引流纵隔淋巴结中的 S. ratti 特异性 CD4+ T 细胞25。这种方法为在蠕虫感染和抗蠕虫疫苗开发的情况下研究 CD4 + T 细胞生物学提供了极好的工具。
S. ratti 是一种多功能的模式生物,用于蠕虫寄生虫的免疫学研究,通常显示组织迁移和肠道生命阶段。由于发生的自身感染,人类粪类链球菌感染的特点是极度慢性,这也可能导致免疫抑制宿主出现重度感染综合征,大多数患者在移植后接受糖皮质激素治疗26。应该注意的是,自身感染和重度感染的这一方面很难在小鼠中建模。S. ratti 感染的 RAG1 KO 和裸鼠 5,27 都不易受到重度感染。值得注意的是,使用糖皮质激素处理的严重免疫功能低下的小鼠 (NOD.Cg-PrkdcscidIl2rgtm1Wjl/SzJ) 建立了一个粪链球菌过度感染的小鼠模型,这可能允许最终分析小鼠重度感染综合征的至少方面28.
然而,在小鼠中利用 S. ratti 感染的研究表明,嗜酸性粒细胞和中性粒细胞在根除组织迁移幼虫方面起着非冗余的作用。转基因小鼠的耗竭或缺失导致头部 L3 数升高8。虽然肥大细胞和嗜碱性粒细胞在组织迁移阶段是可有可无的,但肥大细胞和嗜碱性粒细胞都有助于控制肠道寄生虫负荷。它们的缺失不会影响组织中的 L3 数量,但在第 6 天 p.i.12,29 增加了肠道中成虫寄生虫的数量。进一步分析表明,缺乏嗜碱性粒细胞或选择性结缔组织肥大细胞允许以 WT 动力学终止感染。相比之下,缺乏结缔组织和粘膜肥大细胞的小鼠感染持续 20 周12。这些发现揭示了粘膜肥大细胞在最终感染终止中的关键作用,强调了这种感染模型在阐明蠕虫感染期间粘膜肥大细胞功能方面的价值。在没有某些免疫效应细胞的情况下,对 S. ratti 寄生虫肠道定位潜在变化的进一步定义将有助于更准确地定义它们在抗蠕虫免疫中的功能。
此外,可以在该系统中研究蠕虫为促进其生存而采用的免疫逃避机制。结果表明,在 S. ratti 感染期间诱导的 Foxp3 + 调节性 T 细胞的耗竭或效应 T 细胞上的调节受体缺失降低了整个感染过程中第 6 天的寄生虫负荷和幼虫输出 15,16,30,31。此外,可以将肠道定义为免疫逃避和 IL-9 介导的肥大细胞激活作为免疫途径抑制的目标组织。最后,可以使用内源性 IL-33 的抑制因子和增强子来研究组织来源的警报细胞因子(如 IL-33)介导的 ILC2 介导的 2 型免疫启动机制32。
通过 Baermann 分离大量 iL3 为进一步的体外研究提供了可能性。L3 与免疫细胞或潜在候选药物的共培养能够直接研究对 L3 活力和运动的影响。用 S. ratti 抗原裂解物或活的 L3 对从感染小鼠中分离的细胞进行离体再刺激,为研究各种细胞类型的细胞因子产生提供了一个平台。最后,L3 的蛋白质和脂质组分可用于鉴定 S. ratti 衍生的病原体相关分子模式或免疫调节效应分子
由于蠕虫感染仍然在全球范围内构成重大健康负担,因此进一步阐明蠕虫诱导的免疫反应和寄生虫采用的逃避机制的研究对于改进治疗方案和制定疫苗接种等预防策略仍然至关重要。小鼠的 S. ratti 感染为急性感染模型期间蠕虫-宿主相互作用的研究提供了一种通用模型。
披露声明
作者没有利益冲突。语言模型 Perplexity AI 2024 用于修改文本草稿和改进公式。
致谢
这项工作得到了 Jürgen Manchot 基金会和德国研究协会 (Grant BRE 3754/6-1 和 BRE 3754/10-1) 的支持。图 1、2C 和 3B 是在 BioRender.com 中创建的。
材料
| Name | Company | Catalog Number | Comments |
| 50 ml tubes | Sarstedt, N mbrecht, DE mbrecht, DE | 6,25,47,254 | 50 ml https://www.sarstedt.com/produkte/labor/reagenz-zentrifugenroehren/roehren/produkt/62.547.254/ |
| BD Micro-Fine U100 Insulin 0.5 ml | BD Bioscience | 7468077 | 0.5 ml https://www.bestimed.de/bd-micro-fine-insulinspritze-05-ml-u100-8-mm-100x05ml-324825.html |
| centrifugeation tubes | Sarstedt, Nümbrecht, DE | 72,706 | 1.5 ml https://www.sarstedt.com/produkte/labor/mikro-schraubroehren-reagiergefaesse/reagiergefaesse/produkt/72.706/ |
| Charcoal | Roth | 0998.3 | 5 kg https://www.carlroth.com/de/de/aktivkohle/aktivkohle/p/0998.3 |
| Falcon 6-well Clear Flat Bottom, not treated cell multiwell culture plate, with Lid, sterile | Corning | 351146 | 6-well https://www.corning.com/emea/de/search.html?_cookie=false &searchText=351146&search-initialcatalog =Corporate+Communications& initialResultType=products |
| Freezer & Refrigerator | Liebherr-Hausgeräte, Rostock, DE | ||
| Greiner Bio-One 24-Well-Platten für Zellkulturen aus Polystyrol | Fisher Scientific | 10177380 | 24-well https://www.fishersci.de/shop/products/polystyrene-24-well-cell-culture-multiwell-plate/10177380#?keyword=24-well |
| Incidin Premium Wipes | Ecolab Healthcare | 100 10 279 | https://www.ecolabhealthcare.de/website/seiten/produkte/flaechendesinfektion/tuecher/incidin_premium_wipes.php |
| Incubator 25°C | Heraeus Instruments, Hanau, DE | ||
| Incubator 37°C | Heraeus Instruments, Hanau, DE | ||
| Microscope | Helmut Hund, Wetzlar, DE | 4 x objectiv lens, 10 x ocular lens | |
| Parafilm M | Parafilm | 11772644 | 4 in. X 125 ft. https://www.fishersci.de/shop/products/parafilm-m-laboratory-wrapping-film-2/11772644 |
| Penicillin/Streptomycin (Pen-Strep) | Capricorn | PS-B | 100x https://www.capricorn-scientific.com/en/shop/penicillin-streptomycin-pen-strep-100x~p1205 |
| ROTI Fair 10x PBS 7.4 | Roth | 1105.1 | https://www.carlroth.com/de/de/fertigloesungen-tabletten-portionsbeutel/rotifair-10x-pbs-7-4/p/1105.1 |
参考文献
- Olsen, A., et al. Strongyloidiasis - the most neglected of the neglected tropical diseases. Trans Royal Soc Tropical Med Hygiene. 103 (10), 967-972 (2009).
- Buonfrate, D., et al. The global prevalence of Strongyloides stercoralis infection. Pathogens. 9 (6), 468 (2020).
- Dawkins, H. J. S., Grove, D. I. Attempts to establish infections with Strongyloides stercoralis in mice and other laboratory animals. J Helminthol. 56 (1), 23-26 (1982).
- Abraham, D., et al. Strongyloides stercoralis: protective immunity to third-stage larvae inBALB/cByJ mice. Exp Parasitol. 80 (2), 297-307 (1995).
- Breloer, M., Abraham, D. Strongyloides infection in rodents: immune response and immune regulation. Parasitology. 144 (3), 295-315 (2017).
- Breloer, M., Linnemann, L. Strongyloides ratti infection in mice: immune response and immune modulation. Philosophical Trans Royal Society B. 379 (1894), 20220440 (2024).
- Dawkins, H. J. S., Grove, D. I., Dunsmore, J. D., Mitchell, G. F. Strongyloides ratti: Susceptibility to infection and resistance to reinfection in inbred strains of mice as assessed by excretion of larvae. Int J Parasitol. 10 (2), 125-129 (1980).
- Ehrens, A., et al. Eosinophils and neutrophils eliminate migrating Strongyloides ratti larvae at the site of infection in the context of extracellular DNA trap formation. Front Immunol. 12, 715766 (2021).
- Eschbach, M. L., et al. Strongyloides ratti infection induces transient nematode-specific Th2 response and reciprocal suppression of IFN-γ production in mice. Parasite Immunol. 32 (5), 370-383 (2010).
- Dawkins, H., Muir, G., Grove, D. Histopathological appearances in primary and secondary infections with Strongyloides ratti in mice. Int J Parasitol. 11 (1), 97-103 (1981).
- Tada, I., Mimori, T., Nakai, M. Migration route of Strongyloides ratti in albino rats. Jap J Parasit. 28 (4), 219-227 (1979).
- Reitz, M., et al. Mucosal mast cells are indispensable for the timely termination of Strongyloides ratti infection. Mucosal Immunol. 10 (2), 481-492 (2017).
- Viney, M. E., Lok, J. B. The biology of Strongyloides spp. WormBook. , 1-17 (2018).
- Reitz, M., et al. Interleukin-9 promotes early mast cell-mediated expulsion of Strongyloides ratti but is dispensable for generation of protective memory. Sci Rep. 8 (1), 8636 (2018).
- Breloer, M., et al. Cutting edge: The BTLA-HVEM regulatory pathway interferes with protective immunity to intestinal Helminth infection. J Immunol. 194 (4), 1413-1416 (2015).
- Blankenhaus, B., et al. Foxp3+ regulatory T cells delay expulsion of intestinal nematodes by suppression of IL-9-driven mast cell activation in BALB/c but not in C57BL/6 mice. PLoS Pathogens. 10 (2), e1003913 (2014).
- Niamatali, S., Nolan, T. J., Schad, G. A. . Can Autoinfection be Provoked in the Strongyloides ratt/-infected Gerbil, Meriones unguiculatus. 59 (2), 149-152 (1992).
- Gardner, M. P., Gems, D., Viney, M. E. Extraordinary plasticity in aging in Strongyloides ratti implies a gene-regulatory mechanism of lifespan evolution. Aging Cell. 5 (4), 315-323 (2006).
- Viney, M. E. Developmental switching in the parasitic nematode Strongyloides ratti. Proc Biol Sci. 263 (1367), 201-208 (1996).
- Dawkins, H. J., Thomason, H. J., Grove, D. I. The occurrence of Strongyloides ratti in the tissues of mice after percutaneous infection. J Helminthol. 56 (1), 45-50 (1982).
- Takamure, A. Migration route of Strongyloides venezuelensis in rodents. Int J Parasitol. 25 (8), 907-911 (1995).
- Filbey, K., Bouchery, T., Le Gros, G. The role of ILC 2 in hookworm infection. Parasite Immunol. 40 (2), e12429 (2018).
- Allen, J. E., Sutherland, T. E. Host protective roles of type 2 immunity: Parasite killing and tissue repair, flip sides of the same coin. Semin Immunol. 26 (4), 329-340 (2014).
- Dulovic, A., Puller, V., Streit, A. Optimizing culture conditions for free-living stages of the nematode parasite Strongyloides ratti. Exp Parasitol. 168, 25-30 (2016).
- Douglas, B., et al. Transgenic expression of a T cell epitope in Strongyloides ratti reveals that helminth-specific CD4+ T cells constitute both Th2 and Treg populations. PLOS Pathogens. 17 (7), e1009709 (2021).
- Vadlamudi, R. S., Chi, D. S., Krishnaswamy, G. Intestinal strongyloidiasis and hyperinfection syndrome. Clin Mol Allergy. 4 (1), 8 (2006).
- Viney, M., Kikuchi, T. Strongyloides ratti and S. venezuelensis- rodent models of Strongyloides infection. Parasitology. 144 (3), 285-294 (2017).
- Patton, J. B., et al. Methylprednisolone acetate induces, and Δ7-dafachronic acid suppresses, Strongyloides stercoralis hyperinfection in NSG mice. Proc Natl Acad Sci. 115 (1), 204-209 (2018).
- Reitz, M., Brunn, M. L., Voehringer, D., Breloer, M. Basophils are dispensable for the establishment of protective adaptive immunity against primary and challenge infection with the intestinal helminth parasite Strongyloides ratti. PLOS Neglected Trop Dis. 12 (11), e000699 (2018).
- Blankenhaus, B., et al. Strongyloides ratti infection induces expansion of Foxp3+ regulatory T cells that interfere with immune response and parasite clearance in BALB/c Mice. J Immunol. 186 (7), 4295-4305 (2011).
- Hartmann, W., Blankenhaus, B., Brunn, M. L., Meiners, J., Breloer, M. Elucidating different pattern of immunoregulation in BALB/c and C57BL/6 mice and their F1 progeny. Sci Rep. 11 (1), 1536 (2021).
- Meiners, J., et al. IL-33 facilitates rapid expulsion of the parasitic nematode Strongyloides ratti from the intestine via ILC2- and IL-9-driven mast cell activation. PLOS Pathogens. 16 (12), e1009121 (2020).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。