Method Article
Farelerin Parazitik Nematod Strongyloides ratti ile Deneysel Enfeksiyonu
Bu Makalede
Özet
Strongyloides ratti , laboratuvar farelerinde geçici enfeksiyonlara neden olan, doku göçü ve bağırsak yaşam evrelerini gösteren parazitik bir nematoddur. Burada, sıçanlarda parazit döngüsünün sürdürülmesi ve kafa, akciğer ve bağırsakta parazit miktar tayini dahil olmak üzere farelerin deneysel enfeksiyonu için bir protokol sunuyoruz.
Özet
Strongyloides ratti , vahşi fareleri doğal olarak enfekte eden parazitik bir nematoddur. Bununla birlikte, çoğu laboratuvar sıçan ve fare suşu enfeksiyona karşı tamamen hassastır. İmmün yetmezliği olan BALB/c ve C57BL/6 fareleri, kanonik tip 2 immün yanıt bağlamında bir ay içinde S. ratti enfeksiyonlarını sonlandırır ve yeniden enfeksiyona karşı yarı dirençli kalır. Enfeksiyonun seyri üç aşamaya ayrılabilir: (a) ilk iki gün boyunca enfektif üçüncü aşama larvaların doku göç aşaması; (b) Enfeksiyondan sonraki 3 ila 6. günlerde yetişkin parazitlere deri dökümü ve bağırsak mukozasına gömülme dahil olmak üzere erken bağırsak evresi ve enfeksiyondan sonraki 5 ila 6. günde üreme ile üreme; (c) parazitlerin tamamen temizlenmesi ile sona eren sonraki bağırsak fazı. Farelerin S. ratti ile deneysel enfeksiyonları, farklı enfeksiyon bölgelerinde tüm yaşam döngüsü boyunca konakçı-parazit etkileşimlerinin yanı sıra parazit tarafından kullanılan bağışıklıktan kaçınma stratejilerinin hassas bir şekilde incelenmesini sağlar. Burada sunulan protokol, Wistar sıçanlarında parazitin korunmasını, laboratuvar farelerinin enfeksiyonunu ve doku göç fazında ve bağırsak fazında S. ratti parazitlerinin saptanmasını ve miktarının belirlenmesini açıklar.
Giriş
Toprakla bulaşan helmint Strongyloides stercoralis, ihmal edilen tropikal hastalıklar arasında en çok ihmal edilen bir hastalık olan Strongyloidiasis'e neden olur1. 2020 tahminleri, dünya çapında 600 milyon S. stercoralis enfeksiyonu olduğunu göstermektedir2. S. stercoralis ile ilgili hipoteze dayalı laboratuvar araştırmaları sınırlıdır, çünkü helmint farelerde üçüncü aşama larvaları (L3) geçemez, 3,4. Bu nedenle, kemirgenlere özgü nematod Strongyloides ratti, laboratuvar farelerinde in vivo enfeksiyon çalışmaları için yaygın olarak kullanılır 5,6. S. ratti, yabani sıçanların doğal bir parazitidir, ancak çoğu laboratuvar faresi türü enfeksiyona karşı tamamen hassastır7. Bu, helmintin farklı dokuları ve canlı aşamaları boyunca konak-patojen etkileşiminin ve bağışıklık tepkilerinin incelenmesini sağlar.
Farelerde S. ratti'nin laboratuvar döngüsü üç ana faza ayrılabilir. Genellikle 1000 ila 2000 arasında değişen belirli sayıda enfektif üçüncü aşama larvanın (iL3) deri altı enjeksiyonundan sonra, hayatta kalan L3'ün çoğunluğu (yaklaşık % 90'ı) enfeksiyonun ilk iki günü boyunca farelerin başına göç eder ve akciğerde sadece çok küçük bir kısmı (yaklaşık% 10) alınır8. S. ratti, kemirgen konakçısının derisine aktif olarak nüfuz eder. Farelerin cildine iL3 içeren bir damla su koyarak ve aktif perkütan enfeksiyona izin vererek bu doğal enfeksiyon yolunu laboratuvarda taklit etmek mümkündür9. Bununla birlikte, enfeksiyon etkinliği çok daha düşüktür ve kesin enfeksiyon dozunun kontrolü mümkün değildir. Perkütan veya deri altı (sc) enfeksiyondan sonra S. ratti iL3 tarafından alınan kesin göç yolu bilinmemektedir. Bununla birlikte, enfekte farelerinböbrekleri gibi kanda veya kanla iyi beslenen organlarda S. ratti DNA'sı tespit edilemediğinden8, birincil göç yolu kan dolaşımını içermeyebilir. Yine de, S. ratti dokular boyunca rastgele göç etmez. Daha ziyade, farelerde 3,10 ve sıçanlarda11 histoloji veya çeşitli dokulardan8 alınan canlı L3 ve S. ratti'den türetilmiş DNA'nın nicelleştirilmesini kullanan birkaç çalışma, S. ratti L3'ün enfeksiyon bölgesinden doğrudan cilt ve kas dokusu yoluyla ağırlıklı olarak başın nazofrontal bölgesine göç ettiğine dair kanıt sağlar.
Enjekte edilen larvaların yaklaşık %10'u doku göçünden sağ çıkar ve kafa dokusunda karşılaştırılabilir L3 sayıları gösteren C57BL/6 ve BALB/c farelerindebaşa ulaşır 12. Larvaların, enfeksiyondan sonraki 3. güne kadar bağırsağa ulaşmak için yutulduğu düşünülmektedir (p.i.). İnce bağırsağın mukozasına gömülürler, yetişkin dişi parazitlere dönüşürler ve 5. günden 6. güne kadar partenogenez ile üremeye başlarlar.13. Yumurtalar, ancak çoğunlukla yumurtadan çıkmış birinci aşama larvalar (L1), bağırsağa salınır ve dışkı ile salgılanır. Yetişkin kadın sayısının zirvesine saat 6:14 civarında ulaşılır. İlginç bir şekilde, C57BL / 6 fareleri, her iki fare suşundada kafada karşılaştırılabilir sayıda doku göç eden L3'e rağmen, BALB / c farelerinden 2 ila 5 kat daha yüksek bağırsak parazit yükü gösterir 12. İlk hafta boyunca, immünokompetan C57BL/6 farelerinde ve B ve T hücrelerinden yoksun RAG1 nakavt (KO) farelerde bağırsak parazit yükü aynıdır, bu da erken parazit kontrolüne doğuştan gelen bağışıklık aracılık ettiğini düşündürmektedir12,15. Son aşamada, parazitler immünokompetan farelerde 2 ila 4 hafta içinde bağırsaktan atılır (6'da gözden geçirilmiştir). RAG1 KO fareleri enfeksiyonu temizleyemez ve ince bağırsakta 1 yıla kadar düşük sayıda canlı ve üreyen dişi yetişkin içerir12.
Işınlanmış L3 ile çözülmüş bir ilk enfeksiyon veya bağışıklamadan sonra, immünokompetan C57BL / 6 ve BALB / c fareleri yeniden enfeksiyona karşı yarı dirençlidir. İlk aşılanan iL3'ün sadece %1'i başa ulaşır ve ikinci bir enfeksiyon sırasında bağırsaktan sadece yaklaşık 1-5 yetişkin parazit alınabilir8. Bu nedenle, farelerin S. ratti ile laboratuvar enfeksiyonunun kullanılması, doku göç evreleri olan bir bağırsak nematodunun tüm yaşam döngüsü boyunca doğuştan gelen ve adaptif bağışıklık sisteminin etkisini incelemek için bir araç sağlar.
Bu yazıda, Wistar sıçanlarında S. ratti yaşam döngüsünün sürdürülmesinin yanı sıra farelerin deneysel enfeksiyonu ve farklı enfeksiyon bölgelerindeki parazit yükünün miktarının belirlenmesinin ayrıntılı bir tanımını sunuyoruz. Baş ve akciğer dokusunda ve ayrıca deneysel farelerin bağırsaklarında S. ratti parazit yükünün tam olarak ölçülmesiyle, bu parazitik nematodun doku göçü veya bağırsak yaşam evresine karşı belirli bağışıklık efektörlerinin rolünü incelemek mümkündür. Yabani tip farelerde ve spesifik immün efektör hücreleri, reseptörleri veya ilgilenilen mediatörleri olmayan farelerdeki immün yanıtlar, tartışma 5,6'da ayrıntılı olarak açıklandığı gibi karşılaştırılabilir.
Protokol
Hayvan deneyleri Alman Hayvan Refahı Yasası'na uygun olarak yapıldı ve deney protokolleri Hamburg Eyaleti'nin Alman makamı (Behörde für Gesundheit und Verbraucherschutz) tarafından onaylandı. Şekil 1 , Wistar sıçanlarında S. ratti'nin yaşam döngüsünün sürdürülmesine ve deneysel farelerin veya sıçanların enfeksiyonu için iL3 üretimine genel bir bakış sağlar.
1. Enfeksiyöz larvaların hazırlanması
- Baermann cihazını Şekil 1'de gösterildiği gibi hazırlayın. Hortumun altını eğik bir açıyla bir kelepçe ile kapatın ve elek içine bir mendil yerleştirin. Elek suyla kaplanana kadar ılık suyla (yaklaşık 35-37 °C) doldurun.
- Süzgeci aşağıda anlatıldığı gibi hazırlanan dışkı-odun kömürü karışımıyla doldurun (6. adım). Karışımın tamamen su ile kaplanması gerekir.
- Baermann cihazının hemen arkasındaki ışığı açın. Uygun iL3, silme işlemi boyunca aktif olarak hareket edecektir.
- 30 dakika sonra larvalar kelepçenin üzerine yerleşir, kelepçeyi kısa süre açarak 50 mL'lik bir tüpe toplayın. Tüm peleti toplayın, ancak hacmin mümkün olduğunca küçük olduğundan emin olun.
- 50 mL'lik tüpü %1 Penisilin-Streptomisin (PBS/Pen-Strep) içeren PBS ile doldurun ve larvaların 30 dakika boyunca 4 °C'de yerçekimi ile tüpün dibine yerleşmesine izin verin. Süpernatanı bir pipetle dikkatlice çıkarın ve yıkama adımını 3 kez tekrarlayın.
- Üçüncü yıkama adımından sonra, pelet boyutuna bağlı olarak peleti 30 ila 50 mL PBS/Pen-Strep içinde yeniden süspanse edin. Çözeltinin 1 μL damlasını bir mikroskopi slaytına aktarın. iL3 hızlı bir şekilde yerleştiği için pipetlemeden hemen önce çözeltiyi çalkalayın.
- Damlacıkları ters mikroskop altında 40x büyütmede inceleyin. iL3 canlı bir şekilde hareket ediyor olmalıdır. 1 μL'lik damlacık başına iL3'ü 5 ila 10 kopyada sayın ve μL başına ortalamayı hesaplayın.
2. Farelerin enfeksiyonu
NOT: Hazırlanan iL3, iL3'e zarar vermemek için yatay olarak tutulması gereken 50 mL'lik bir tüpte 4 °C'de PBS/Pen-Strep'te saklanabilir. iL3'ün canlı hareketi ile gösterilen in vitro canlılık, ellerimizde 1 haftaya kadar değişmeden kalır. Farklı saklama sürelerinden sonra L3'ün enfektivitesinin sistematik bir karşılaştırması olmadığından, taze hazırlanmış iL3 ve depolanmış iL3'ü hazırlandıktan sonra maksimum 24 saat dahili standart olarak kullanıyoruz. Daha eski iL3 partileriyle enfeksiyonlar mümkündür. Bununla birlikte, bir deneyde farklı grupların enfeksiyonu için aynı iL3 partisini kullanmak zorunludur. Farelerin enfeksiyonları tercihen iki kişi tarafından yapılmalıdır, bir kişi fareyi tutarken diğeri enjeksiyonu gerçekleştirir.
- PBS/Pen-Strep'te yukarıda adım 1.7'de açıklandığı gibi sayılan toplam 1000 iL3 (C57BL/6) veya 2000 iL3 (BALB/c) içeren fare başına bir adet 1.5 mL santrifüj tüpü hazırlayın ve yukarıda açıklandığı gibi Baermann aparatı kullanılarak hazırlandı (1. adım). iL3 hızlı bir şekilde yerleşirken pipetleme adımları arasında iyice çalkalayın.
- iL3'ün oda sıcaklığında (RT) 20-30 dakika boyunca yerçekimi ile çökmesine izin verin ve süpernatanı 0.5 mL'lik bir şırınga ile mümkün olduğunca tamamen aspire edin ve tüpte yaklaşık 30 μL iL3 süspansiyonu bırakın. iL3'ü 0.5 mL'lik bir şırınga (28G) ile veya tüpü hafifçe vurarak ve kalan süspansiyonu aspire ederek yeniden süspanse edin.
NOT: iL3'ün ıslak plastiğe yapışma olasılığı kuru şırıngaya göre daha düşüktür. Bu nedenle, süpernatanı çıkarmak için aynı şırıngayı kullanmak avantajlıdır. - Farelerin enfeksiyon için anestezi almasına gerek yoktur. Fareleri tırnakla toplayın ve farelerin bir arka ayağını tutun. 8 haftalıktan büyük ve en az 20 g ağırlığında kadın ve erkek C57BL / 6 kullanın. iL3 içeren tüm solüsyonu deri altından ayak tabanına düz bir açıyla enjekte edin. Delinme bölgesinden larva süspansiyonunun dökülmesini önlemek için şırıngayı yavaşça geri çekin. Sıvıyı içeren çok küçük bir kubbe oluşacaktır. Bu kendi kendine emilecektir.
NOT: Boynun yan veya ense yerine ayak yastığına giren deri altı enfeksiyonu, dışkı ile döllenmiş nemli toprakta yaşayan ve sağlam cilde aktif olarak nüfuz eden iL3'ün doğal enfeksiyonunu taklit eder. Ayrıca, ilk drene olan lenf nodu (LN) popliteal LN olarak tanımlanır. Bu LN,16'da gösterildiği gibi, enfeksiyona yanıt olarak Foxp3 + düzenleyici T hücrelerinin genişlemesi gibi erken (yani 2. gün p.i.) immünolojik değişikliklerin analizi için kullanılabilir.
3. Enfekte farelerin baş ve akciğerinde iL3 sayımı
- Dokudaki larva yükünün analizi için, larva yükünün zirvesi 2. gün p.i.8,12 olduğundan, fareleri 1-3. günde sakri edin. CO2 aşırı doz narkozu ile ötenazi yapın. Kornea ve interdigital reflekslerin yokluğundan sonra, servikal çıkık yapın.
- Karın ve boyna ticari bir dezenfektan püskürtün ve cildi karın üzerinde makasla kesin. Karın ön duvarını ortaya çıkarmak için cildi geri çekin ve periton boşluğunu açmak için orta hat boyunca kesin. Diyaframı kesin ve plevral boşluktaki akciğeri ortaya çıkarmak için kaburgaları her iki tarafa doğru kesin.
- Akciğer loblarını, 1 mL musluk suyu içeren çizgilere bölünmüş 24 oyuklu bir plakada toplayın. Çizgileri plaka üzerine yaklaşık 4 mm mesafeden çizin veya yazdırın. Çizgiler arasındaki mesafe, her iki çizgiyi de 40x büyütmede aynı anda görmeyi mümkün kılmalıdır.
- Tüm akciğeri yaklaşık 0,75 cm x 0,75 cm'lik altı parçaya kesin.
- Kafayı kemik makasıyla kesin. Parmaklarınızı kullanarak cildi ve kürkü çıkarın. Mümkün olduğunca az kas dokusu çıkarmaya çalışın.
- Başın tamamını (beyin ve kemikler dahil) gözlerin arkasında dört çeyreğe ve başın ortasından uzunlamasına inceleyin (bkz. Şekil 2C). Ön ve arka kadranları, 2 mL musluk suyu içeren çizgilerle işaretlenmiş 6 oyuklu bir plakanın kuyusuna yerleştirin. Mendili, kesikler suya bakacak şekilde yerleştirin.
NOT: Genellikle, bu yaklaşım kafa dokusu göç eden larvaların sayılarının tam bir kaydını verir. Beyindeki L3 sayılarının ayrı bir analizine ihtiyaç duyulursa, adım 3.7 dahil edilebilir. - Beynin ayrı bir analizi isteniyorsa, parmaklarınızı kullanarak cildi kafadan çıkarın. Ardından, gözler arasındaki takkeyi delmek için makas kullanın. Bu kesiden, kullanılmayan veya iyice temizlenmiş makasla kafatası sagitalinin üst kısmını açın. Beyni ortaya çıkarmak için sağ ve sol takke kapaklarını bir cımbızla açın. Beyni ön taraftan yukarı doğru kaldırmak için bir spatula kullanın ve sinir telleri temiz bir makasla kesilir. Beyni çıkarın ve musluk suyu içeren çizgilerle işaretlenmiş 24 oyuklu bir plakaya aktarın.
- Plakaları 37 °C'de bir inkübatöre yerleştirin. Plakaları her saat (h) 10x döndürürken 3 saat inkübe edin. İnkübasyondan sonra, son bir kez döndürün, kalan doku parçalarını forseps ile kuyucuklardan çıkarın ve dokuyu atın.
- Kuyularda kalan sudaki her larvayı, kuyu diplerine çizilen çizgiler boyunca hareket ederek 40x büyütme ile ters mikroskop altında tamamen sayın. Sonuçların sorumluluğunu artırmak için doku göç eden larvaları aynı gün sayın.
4. Enfekte farelerin bağırsaklarında S. ratti parazitlerinin sayımı
- Bağırsaktaki parazit yükünün analizi için, ilgilenilen gün fareleri kurban edin, tam bir kinetik için 3-21 gün öğleden sonra kullanın. İnce bağırsaktaki C57BL / 6 ve BALB / c farelerinde parazit yükünün zirvesi 6. gündür p.i.14. CO2 aşırı doz narkozu ile ötenazi yapın. Kornea ve interdigital reflekslerin yokluğundan sonra, servikal çıkık yapın.
- Farelerin karın bölgesini dezenfektana batırın ve cildi karın üzerinden kesin. Karın ön duvarını ortaya çıkarmak için cildi geri çekin ve periton boşluğunu açmak için orta hat boyunca kesin.
- Mide ile proksimal duodenum arasında ve ayrıca kolon ve anüs arasında keserek tüm bağırsağı çıkarın (bkz. Şekil 3B). Bağırsakları parmaklarınızla nazikçe dışarı çekin ve musluk suyu içeren bir Petri kabına yerleştirin.
- Bağırsakları uzunlamasına kesin ve musluk suyunda en az 10 saniye kuvvetlice çalkalayarak dışkı ve mukusu yıkayın. Yetişkin parazitlerin küçük bir kısmı ve bazı L1'ler yıkanır, ancak canlı L4 ve yetişkin S. ratti parazitleri, vahşi tip (WT) farelerde bağırsak mukozasına gömülür ve bu yıkama aşaması ile uzaklaştırılmaz.
- İlgileniyorsanız, bağırsağı aşağıda açıklandığı gibi daha fazla bölün.
- İkinci Peyer yamasından sonra (yaklaşık 2-3 cm) duodenumu bir kesi ile izole edin. İleumu, biri birincide ve diğeri ikinci Peyer yamasında (yaklaşık 1-2 cm) olmak üzere iki kesi ile izole edin. Duodenum ve ileumun izolasyonundan sonra jejunumu izole edin, çünkü bu kalan bölümdür.
- Parazit lokalizasyonunun çok kesin bir tanımını sağlamak için jejunumu üç eşit bölüme ayırın. İleum ve kolon arasındaki çekumu izole edin. Çekumdan sonra keserek kolonu izole edin. Erişkin parazitlerin çoğu ince bağırsağın ilk üçte birlik kısmında bulunabilir (bkz. Şekil 3B).
- Temizlenmiş bağırsak parçalarını 20 mL musluk suyu içeren 50 mL'lik tüplere aktarın. 37 °C inkübatöre 3 saat boyunca yatay olarak yerleştirin. Her saat başı 10 saniye boyunca çok kuvvetli bir şekilde çalkalayın.
- 3 saatlik inkübasyondan sonra, dokuyu sudan çıkarın. Tüpleri RT'ye dikey olarak yerleştirin ve parazitler 30 dakika içinde yerçekimi ile çökelti.
- Yaklaşık 5 mL su kalana kadar süpernatanı çıkarın. Yıkama adımını tekrarlamak için 25 mL'ye kadar musluk suyuyla doldurun. İnce bağırsağın analizi için, mikroskop altında iyi bir görünürlük elde etmek için bu yıkama adımını bir kez daha tekrarlayın.
- İyi bir görünürlük elde edildiğinde, süpernatanı yaklaşık 5 mL su kalana kadar aspire edin ve sıvıyı, kafadaki larvaları saymak için açıklandığı gibi, çizgilerle işaretlenmiş 6 oyuklu bir plakada fare bağırsağı başına iki kuyuya aktarın.
- Kuyu diplerine çizilen çizgiler boyunca hareket ederek 40x büyütme ile ters çevrilmiş bir mikroskop altında yetişkin dişi parazitleri sayın. Kurban gününde parazitleri sayın. Parazitleri olabildiğince çabuk sayın, çünkü suda uzun süre inkübasyon ölümlerine ve parçalanmalarına yol açacaktır.
NOT: Dördüncü evre larvalara ve yetişkin parazitlere ek olarak, L1 burada saat 17:00 civarından itibaren de tespit edilebilir. Bunlar L4 ve yetişkin parazitlerden çok daha küçük ve çok daha bol miktarda bulunur ve kolayca ayırt edilmelidir.
5. Wistar sıçanlarında S. ratti bakımı
NOT: Sıçan enfeksiyonları tercihen iki kişi tarafından yapılmalı, bir kişi fareleri tutarken diğeri enjeksiyonu gerçekleştirir. Parazit döngüsünü sürdürmek için 4-8 haftalık Wistar sıçanları enfekte olur.
- Daha önce açıklandığı gibi Baermann aparatını kullanarak PBS/Pen-Strep'te 2500 iL3 içeren sıçan başına bir 1,5 mL santrifüj tüpü hazırlayın. Larvalar hızlı bir şekilde yerleşirken pipetleme adımları arasında iyice çalkalayın.
- Larvaların yerçekimi ile 20-30 dakika (RT) yerleşmesine izin verin ve süpernatanı yaklaşık 200 μL larva süspansiyonu kalana kadar 0.5 mL'lik bir şırıngada (28G) aspire edin.
- Enfeksiyonlar için, fareleri bir kişinin kol kıvrımına yerleştirin ve kafayı nazikçe ve dikkatlice oraya sabitleyin. Diğer kişi, farenin yan tarafını nazikçe kavrar ve yeniden askıya alınan iL3 süspansiyonunu deri altından ense kıvrımına enjekte eder.
6. Kömür kültürü
- Enfekte fareleri, enfeksiyondan sonraki 5. ve 12. günlerden başlayarak birkaç kat selüloz ve daha az çöp içeren kafeslerde tutun. Birkaç selüloz tabakası için bu çöp değişimi, dışkı toplamayı, dışkı toplamayı çöpten toplamaya kıyasla daha kolay hale getirmek için yapılır
- 6-8 ve 13-15. günlerde, fareleri taze bir kafese aktarın ve fareleri taze kafeslere aktardıktan ve bir kafesten 50 mL'lik bir tüpe topladıktan sonra kafeslerden dışkı peletlerini alarak eski kafesteki tüm dışkıları toplayın. Dışkı toplayın, 2 hafta boyunca p.i. bağışıklık tepkisinin kurulmasından önce dışkıdaki larva yükünü azaltır. 2 hafta sonra p.i. sıçanlar CO2 aşırı doz narkozu ile ötenazi yapılır. Kornea ve interdigital reflekslerin yokluğundan sonra, servikal çıkık yapın.
NOT: İmmün sistemi baskılanmış sıçanlar ve Moğol gerbilleri, S. ratti enfeksiyonlarını daha uzun süre korur17,18. S. ratti enfeksiyonu sırasında immün yanıtı ve immünomodülasyonu inceleyerek, sağlam konak bağışıklığının seçim baskısını sürdürmek için immünokompetan konakçılarda döngüyü sürdürmeye karar verdik. - Toplanan dışkı örneklerini, dışkıda bulunan L1'den iL3'ün gelişmesine izin verecek kömür kültürleri hazırlamak için kullanın.
- Kömürü musluk suyuyla önceden ıslatın. Kültürler için odun kömürü kullanmadan önce, bir elek içine doldurun ve su berraklaşana kadar akan musluk suyu altında yıkayın. Kömürü her zaman nemli tutun. Kullanmadan önce kömürü en az 24 saat ıslatın.
- Dışkıyı önceden ıslatılmış aktif kömürle yaklaşık 1:1 oranında karıştırın. Karışımı çapraz olarak bir gradyan ile düzenleyin ve 1:2'lik bir nihai orana ulaşmak için düz bir cam beherde başka bir aktif kömür tabakası ile kaplayın.
NOT: Dışkının önceden ıslatılmış aktif kömür ile inkübe edilmesi, aşırı mantar kontaminasyonunu önlerken iL3'ün doğada geliştiği nemli toprağı taklit eder. - Cam kabı şeffaf bir filmle örtün. Hava sirkülasyonuna izin vermek için bazı hava delikleri olduğundan emin olun.
- CO2 olmadan yaklaşık% 90 nemde 25 ° C'de 6-7 gün inkübe edin. Kültürleri nemli tutmak için inkübatörün bir su kabı içerdiğinden emin olun. Gerekirse kültürleri 25 ° C'de 14 güne kadar saklayın. iL3 doğrudan veya dolaylı olarak19 gelişecek ve enfeksiyona kadar iL3 aşamasında tutuklanacaktır.
Sonuçlar
S. ratti , enfeksiyon bölgesinden ağırlıklı olarak başa ve daha sonra tam olarak tanımlanmamış bir rota ile bağırsağa göç eder. Kafa dokusu ve bağırsaktaki tam lokalizasyonu araştırmak için, C57BL / 6 fareleri sol arka ayak pedine 1000 iL3 ile enfekte edildi. Fareler 1. günden 14. güne kadar sakrifiye edildi ve S. ratti parazitleri ön ve arka baş, beyin ve akciğerde (Şekil 2) ve ayrıca duodenum, jejunum, ileum, çekum ve kolonda ölçüldü (Şekil 3).
Saat 1. günde, ilk L3 başa ulaştı ve düzgün bir dağılım gösterdi (Şekil 2A). Ek olarak, saat 13:00'te akciğerlerde larvaların küçük bir kısmı elde edildi (Şekil 2B). L3 sayıları 2. günde belirgin bir şekilde artarak kafada ortalama 174 L3 ± 13'e ve akciğerde ortalama 17 ± 1.7'ye yükseldi. Bu nedenle, L3'ün çoğunluğu (yaklaşık% 90) kafadan ve sadece% 10'u akciğerlerden alınır. Çoğu L3 (ortalama 93 ± 13.3) başın ön tarafında lokalizeydi, ancak aynı zamanda yaklaşık 41 ± 4.7 L3 larvaları başın arka tarafında ve yaklaşık 39 ± 5.8 beyinde lokalizeydi. Bu gözlem doğrultusunda, beyinde ve beyin omurilik sıvısında L3 varlığı, perkütan enfeksiyondan sonra C57BL / 6 farelerde 24 saat PI'de ve maksimum 48 saat PI'de bildirilmiştir20. Toplam L3 sayılarında, saat 3. günde, saat 2. gündeki larva yüküne kıyasla belirgin bir azalma gözlendi ve saat 4: 4. günde kafa dokusundan L3 alınmadı (Şekil 2A). Buna göre, bağırsakta S. ratti parazitlerinin gelişi p.i. 4. günde tespit edildi (Şekil 3A). Parazit lokalizasyonunun kesin bir tanımına izin vermek için bağırsak, duodenum, jejunum, ileum, çekum ve kolon gibi farklı segmentlere ayrıldı (Şekil 3B). 4. günde, S. ratti parazitlerinin çoğu duodenumda ve jejunumun ilk üçte ikisinde lokalize idi (Şekil 3A). Bu yerelleştirme akşam 6. güne kadar tutarlıydı. Akşam 7. günden itibaren, S. ratti yetişkinlerinin çoğunluğu çekumda lokalize olmuş ve burada saat 9.00'a kadar devam etmişlerdir (Şekil 3A). Çekumdaki parazit sayıları saat 11:00'de yaklaşık 20'ye ve akşam 14:0'te 0'a düştü. Saat 11:00'e kadar yaklaşık 5-11 parazit dışında, analiz edilen herhangi bir zaman noktasında kalan kolondan önemli sayıda parazit almadık. S. ratti parazitlerinin lokalizasyonu 4. günden 9. güne değişirken ve yetişkinlerin çoğu saat 7'den sonra ince bağırsaktan çıkarılırken, tüm bağırsaktan alınan toplam sayılar 9. güne kadar sabit kaldı. Uygulanabilir L1 ölçülmemiştir, ancak 4. günden 11. güne kadar tespit edilebilir ve 6. günde zirve yapmıştır (veriler gösterilmemiştir).
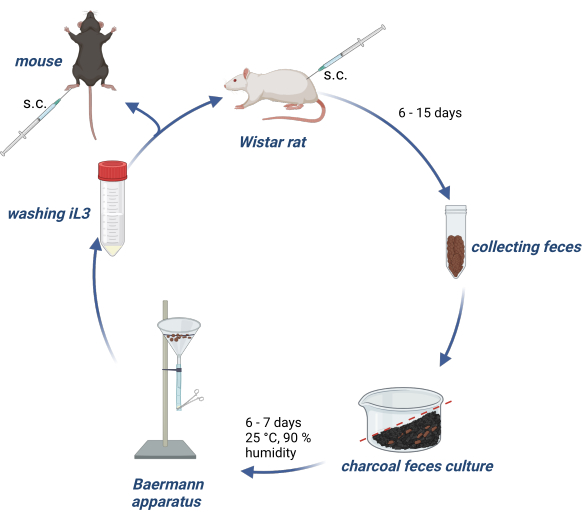
Şekil 1: Sıçanlarda ve farelerde S. ratti yaşam döngüsünün sürdürülmesi. Wistar sıçanlarına 2500 iL3 ile ense kıvrımına s.c. enjekte edilir. 6-15 gün sonra, p.i. dışkıları toplanır, suya batırılmış aktif odun kömürü ile karıştırılır, bir gradyan ile düzenlenir ve hava delikleri de dahil olmak üzere şeffaf bir film ile kaplanır. Bu kültür, 25 ° C'de ve% 90 nemde 6-7 gün inkübe edilir. iL3, Baermann aparatı kullanılarak izole edilir ve 3 kez PBS/Pen-Strep ile yıkanır. Deneysel farelere 1000 iL3 deri altından arka ayak pedine enjekte edilir. BioRender.com ile oluşturuldu. Şekil 1 BioRender'da oluşturulmuştur. Linnemann, L. (2024) https://BioRender.com/g80l370. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
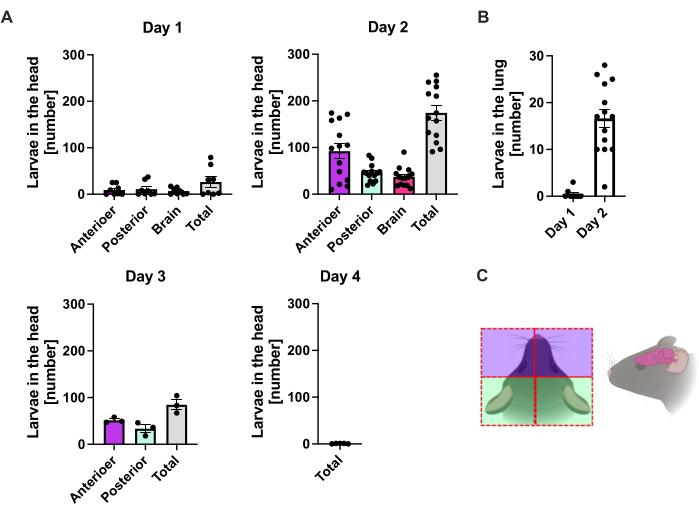
Şekil 2: Zaman içinde akciğer ve kafa dokusunda S. ratti'nin miktar tayini. C57BL / 6 farelere sc arka ayak pedine 1000 iL3 enjekte edildi. Fareler belirtilen zaman noktalarında sakrifiye edildi ve (A) baş ve (B) akciğerdeki S. ratti parazitleri sayıldı. Her sembol, tek bir farenin L3 sayılarını temsil eder; çubuk grafik ortalama değeri, hata çubukları ise SEM'i gösterir. Grafikler, bireysel deneylerden elde edilen birleştirilmiş verileri gösterir. 1. Gün: zaman noktası ve deney başına n=4 olan iki bağımsız deney; 2. Gün: n=4, n=4, n=6 ve n=3 ile dört bağımsız deney; 3. Gün: n=4 ve n=3 ile iki bağımsız deney; 4. Gün: N = 5 ile bir deney. (C) İzolasyon için kullanılan başın bireysel bölgelerini gösteren şematik karikatür. Kırmızı kesikli çizgi, kesi yolunu gösterir. Şekil 2C, BioRender'da oluşturulmuştur. Linnemann, L. (2024) https://BioRender.com/t83e660. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
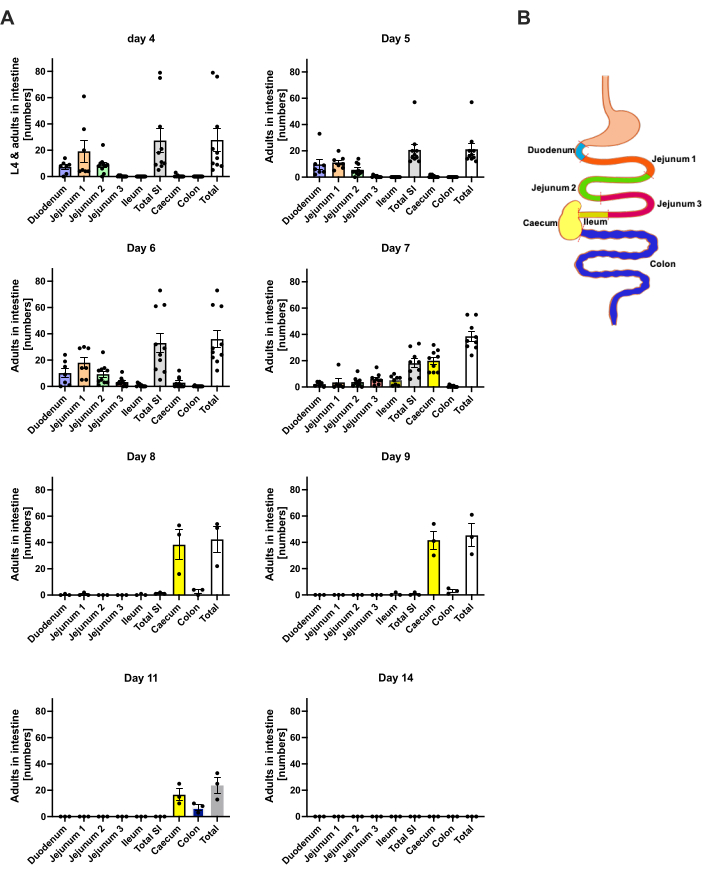
Şekil 3: Zaman içinde bağırsak bölgelerinde S. ratti'nin miktar tayini. Erkek C57BL / 6 farelere sc arka ayak pedine 1000 iL3 enjekte edildi. (A) Fareler belirtilen zaman noktalarında sakrifiye edildi ve L1 dışındaki S. ratti parazitleri aşağıdaki bölgelerde sayıldı: duodenum, jejunum 1-3, ileum, caecum ve kolon. (B) Farklı bağırsak bölgelerine şematik genel bakış. Her sembol, tek bir farenin parazit sayılarını temsil eder; çubuk grafik ortalamayı gösterir ve hata çubukları SEM'i gösterir. Gösterilen, bireysel deneylerden elde edilen veriler birleştirilmiştir. 4. Gün: n=4 ve n=6 fare ile iki bağımsız deney; 5. Gün: n=4 ve n=6 ile iki bağımsız deney; 6. Gün: n=4 ve n=6 ile iki bağımsız deney; 7. Gün: n=6 ve n=3 ile iki bağımsız deney; 8 ila 14. günler: n = 3 ile bir deney. SI: ince bağırsak. Şekil 3B , BioRender'da oluşturulmuştur. Linnemann, L. (2024) https://BioRender.com/h27y297. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Deneysel farelerin S. ratti ile enfeksiyonu, birden fazla bağışıklık bölgesinde ve aşamasında helmint enfeksiyonlarına karşı koruyucu bağışıklık tepkilerinin doğasını incelemek için mükemmel bir modeli temsil eder. Farklı KO fare hatları ve hücre veya sitokin tükenme modelleri kullanılarak, spesifik bağışıklık hücrelerinin, mediatörlerin veya reseptörlerin rolü bir akut helmint enfeksiyonu modelinde incelenebilir. Bağırsakta olduğu kadar kafada da parazit yükünü ölçme imkanı, parazitin yaşam döngüsü boyunca çeşitli doku ve fazlarda bağışıklık hücrelerinin ve efektörlerin rolünü ayırt etme imkanı sunar. Antikor enjeksiyonları yoluyla spesifik hücre tiplerinin tükenmesi, doku göç aşaması tamamlandıktan sonra tükenme tedavisi başlarsa, özellikle bağırsak bağışıklık tepkisi sırasındaki rollerinin incelenmesine izin verir. İstenirse, bağırsak ayrıca parazit lokalizasyonu veya klerens kinetiğindeki küçük kaymaları bile tespit etmek için duodenum, jejunum, ileum, çekum ve kolona bölünebilir. Bu enfeksiyon deneylerindeki deneyler arası ve deney içi varyasyonun, akraba içi farelerde bile, parazit ve konakçının etkileşiminin yanı sıra farklı enfeksiyon etkinliği gösteren farklı S. ratti L3 partilerinin etkileşimiyle ortaya çıkan varyasyonu yansıttığı belirtilmelidir (bkz. Şekil 2 ve Şekil 3). Değişkenliği azaltmak için, deney farelerinin yaşı ve cinsiyeti benzer olmalıdır. Ayrıca, KO ve WT fareleri karşılaştırılırsa, bağımsız bir üreme kolonisinden elde edilen WT fareleri yerine littermat kontrollerinin kullanılması şiddetle tavsiye edilir. Bununla birlikte, yeterli numune büyüklükleri kullanılırsa, belirli efektörler için eksik veya yetkin farelerde parazit yükünü karşılaştıran güvenilir sonuçlar elde etmek mümkündür, bu da S. ratti'ye karşı koruyucu immün yanıtta yer alan immün efektörlerin net bir resmine yol açar ( 6'da gözden geçirilmiştir).
S. ratti'nin yakından ilişkili S. venezuelensis veya N. brasiliensis gibi diğer nematod enfeksiyon modellerine kıyasla önemli bir ayırt edici özelliği, larvaların konakçı içindeki benzersiz göç yoludur. Her ikisi de yaşam döngüleripulmoner faz 21,22,23 içeren N. brasiliensis ve S. venezuelensis'in aksine, S. ratti öncelikle akciğeri atlar ve kas ve cilt dokusundan başageçer 8,12. Saat 2. günde hayatta kalan parazitlerin sadece yaklaşık %10'u akciğerlerde bulunur. Bu arada, S. ratti'nin kafadaki yeri, önceki çalışmalara paralel olarak nazofrontal bölgeye odaklanır8. Bu özellikler, S. ratti'yi özellikle deri ve kas dokusunda ve ayrıca lenf düğümlerini boşaltan dokuda konak-parazit etkileşimlerini incelemek için değerli bir model haline getirir ve diğer nematod enfeksiyon modellerinde olduğu gibi uzun süreli pulmoner tutulum ile gizlenebilecek veya komplike olabilecek immün yanıtlar üzerinde çalışmalara olanak tanır. Çarpıcı bir şekilde, S. ratti L3 ayrıca beyin omurilik sıvısından20 ve beyinden de alınır (Şekil 2A), ancak enfeksiyona bağlı nörolojik semptomlar veya ölüm nispeten nadirdir ve hayvan tesisimizde hiç gözlenmemiştir. Gelecekteki araştırmalar, bu beyin lokalize parazitlerin sıkışıp sıkışmadığını veya bağırsağa giden bir yol olup olmadığını açıklayabilir.
Strongyloides cinsi ayrıca parazitik nesiller arasında serbest yaşayan nesiller oluşturma konusunda eşsiz bir yeteneğe sahiptir24. S. ratti'nin bu serbest yaşam evresi ve patogenez yoluyla çoğalması, ayrıca transgenik larvaların oluşumunu kolaylaştırır. Serbest yaşayan dişilere mikroenjeksiyonların kullanılması, yeşil bir floresan proteine kaynaşmış 2W1S gibi model antijenleri ifade eden larvaların oluşumunu sağladı. Yetişkinlerde kalıplama sırasında epitopun ekspresyonu kaybolurken, akciğer ve akciğeri boşaltan mediastinal lenf nodlarında S. ratti'ye özgü CD4+ T hücrelerinin izlenmesini ve karakterizasyonunu sağlamıştır25. Bu yaklaşım, helmint enfeksiyonları ve anti-helmint aşısı geliştirme bağlamında CD4+ T hücre biyolojisini incelemek için mükemmel bir araç sağlar.
S. ratti, genel olarak doku göçü ve bağırsak yaşam evrelerini gösteren helmint parazitlerinin immünolojik araştırmaları için çok yönlü bir model organizmadır. İnsan S. stercoralis enfeksiyonları, meydana gelen otoenfeksiyon nedeniyle aşırı kroniklik ile işaretlenir, bu da immünosuprese konakçılarda, çoğunlukla transplantasyon sonrası glukokortikoid tedavisi alan hastalarda hiperenfeksiyon sendromuna yol açabilir26. Otoenfeksiyon ve hiperenfeksiyonun bu yönünün farelerde modellenmesinin zor olduğu unutulmamalıdır. Ne S. ratti ile enfekte RAG1 KO ne de çıplak fareler 5,27 hiperenfeksiyona duyarlı değildir. Dikkat çekici bir şekilde, S. stercoralis ile hiperenfeksiyonun bir fare modeli, glukokortikosteroid ile tedavi edilen ciddi şekilde immün sistemi baskılanmış fareler (NOD.Cg-PrkdcscidIl2rgtm1Wjl / SzJ) kullanılarak oluşturulmuştur, bu da farelerde hiperenfeksiyon sendromunun en azından yönlerinin analizine izin verebilir28.
Bununla birlikte, farelerde S. ratti enfeksiyonunu kullanan çalışmalar, eozinofillerin ve nötrofillerin doku göç eden larvaların yok edilmesinde gereksiz bir rol oynadığını göstermiştir. Genetik olarak modifiye edilmiş farelerde tükenme veya yokluk, kafa8'de L3 sayılarının yükselmesine neden oldu. Doku göçü fazında mast hücreleri ve bazofilik granülositler vazgeçilebilirken, hem mast hücreleri hem de bazofiller bağırsak parazit yükünün kontrolüne katkıda bulunmuştur. Onların yokluğu dokudaki L3 sayılarını etkilemedi, ancak 6. gün p.i.12,29'da bağırsaktaki yetişkin S. ratti parazitlerinin sayısını artırdı. Daha ileri analizler, bazofillerin veya seçici bağ dokusu mast hücrelerinin yokluğunun WT kinetiği ile enfeksiyonun sonlandırılmasına izin verdiğini ortaya koydu. Buna karşılık, bağ dokusu ve mukozal mast hücrelerinden yoksun fareler 20 hafta boyunca enfekte kaldı12. Bu bulgular, nihai enfeksiyonun sonlandırılmasında mukozal mast hücreleri için çok önemli bir rol ortaya koydu ve bu enfeksiyon modelinin helmint enfeksiyonu sırasında mukozal mast hücrelerinin işlevini aydınlatmadaki değerini vurguladı. Bazı immünolojik efektör hücrelerin yokluğunda S. ratti parazitlerinin bağırsak lokalizasyonundaki potansiyel değişikliklerin daha fazla tanımlanması, anti-helmint bağışıklığındaki işlevlerinin daha kesin bir şekilde tanımlanmasına yardımcı olacaktır.
Ayrıca, helmintlerin hayatta kalmalarını kolaylaştırmak için kullandıkları bağışıklıktan kaçınma mekanizmaları bu sistemde incelenebilir. Her ikisi de S. ratti enfeksiyonu sırasında indüklenen Foxp3+ düzenleyici T hücrelerinin tükenmesinin veya efektör T hücreleri üzerindeki düzenleyici bir reseptörün silinmesinin, enfeksiyon 15,16,30,31 boyunca parazit yükünü 6. gün ve larva çıkışını azalttığı gösterilmiştir. Ayrıca, bağırsağı, immün kaçırma ve IL-9 aracılı mast hücre aktivasyonu ile hedeflenen doku olarak immün yolağın baskılanması olarak tanımlamak mümkün olmuştur. Son olarak, IL-33 gibi doku kaynaklı alarmin sitokinleri tarafından tip 2 bağışıklığın ILC2 aracılı başlatılması mekanizması, endojen IL-3332'nin baskılayıcıları ve arttırıcıları kullanılarak incelenebilir.
Baermann aracılığıyla çok sayıda iL3'ün izolasyonu, daha ileri in vitro çalışmalar için olasılık sunar. L3'ün immün hücreler veya potansiyel ilaç adayları ile ko-kültürleri, L3 canlılığı ve motilitesi üzerindeki etkilerin doğrudan araştırılmasını sağlar. Enfekte farelerden izole edilen hücrelerin S. ratti antijen lizat veya canlı L3 ile ex vivo olarak yeniden uyarılması, çeşitli hücre tiplerinde sitokin üretimini incelemek için bir platform sağlar. Son olarak, L3'ün protein ve lipid fraksiyonları, S. ratti'den türetilmiş patojenle ilişkili moleküler modellerin veya immünomodülatör efektör moleküllerin tanımlanması için kullanılabilir
Helmint enfeksiyonları küresel olarak hala önemli bir sağlık yükü oluşturduğundan, helmintlerin neden olduğu bağışıklık tepkilerini ve parazitler tarafından kullanılan kaçınma mekanizmasını daha da aydınlatmaya yönelik araştırmalar, tedavi seçeneklerinin iyileştirilmesi ve aşılar gibi önleyici stratejilerin geliştirilmesi için çok önemli olmaya devam etmektedir. Farelerde S. ratti enfeksiyonu, akut enfeksiyon modeli sırasında helmint-konak etkileşimleri üzerine araştırmalar için çok yönlü bir model sunar.
Açıklamalar
Yazarların herhangi bir çıkar çatışması yoktur. Metin taslaklarını revize etmek ve formülasyonları geliştirmek için Perplexity AI 2024 dil modeli kullanıldı.
Teşekkürler
Bu çalışma Jürgen Manchot Vakfı ve Alman Araştırma Derneği tarafından desteklenmiştir (Grant BRE 3754/6-1 ve BRE 3754/10-1). Şekil 1, 2C ve 3B BioRender.com'de oluşturulmuştur.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 50 ml tubes | Sarstedt, N mbrecht, DE mbrecht, DE | 6,25,47,254 | 50 ml https://www.sarstedt.com/produkte/labor/reagenz-zentrifugenroehren/roehren/produkt/62.547.254/ |
| BD Micro-Fine U100 Insulin 0.5 ml | BD Bioscience | 7468077 | 0.5 ml https://www.bestimed.de/bd-micro-fine-insulinspritze-05-ml-u100-8-mm-100x05ml-324825.html |
| centrifugeation tubes | Sarstedt, Nümbrecht, DE | 72,706 | 1.5 ml https://www.sarstedt.com/produkte/labor/mikro-schraubroehren-reagiergefaesse/reagiergefaesse/produkt/72.706/ |
| Charcoal | Roth | 0998.3 | 5 kg https://www.carlroth.com/de/de/aktivkohle/aktivkohle/p/0998.3 |
| Falcon 6-well Clear Flat Bottom, not treated cell multiwell culture plate, with Lid, sterile | Corning | 351146 | 6-well https://www.corning.com/emea/de/search.html?_cookie=false &searchText=351146&search-initialcatalog =Corporate+Communications& initialResultType=products |
| Freezer & Refrigerator | Liebherr-Hausgeräte, Rostock, DE | ||
| Greiner Bio-One 24-Well-Platten für Zellkulturen aus Polystyrol | Fisher Scientific | 10177380 | 24-well https://www.fishersci.de/shop/products/polystyrene-24-well-cell-culture-multiwell-plate/10177380#?keyword=24-well |
| Incidin Premium Wipes | Ecolab Healthcare | 100 10 279 | https://www.ecolabhealthcare.de/website/seiten/produkte/flaechendesinfektion/tuecher/incidin_premium_wipes.php |
| Incubator 25°C | Heraeus Instruments, Hanau, DE | ||
| Incubator 37°C | Heraeus Instruments, Hanau, DE | ||
| Microscope | Helmut Hund, Wetzlar, DE | 4 x objectiv lens, 10 x ocular lens | |
| Parafilm M | Parafilm | 11772644 | 4 in. X 125 ft. https://www.fishersci.de/shop/products/parafilm-m-laboratory-wrapping-film-2/11772644 |
| Penicillin/Streptomycin (Pen-Strep) | Capricorn | PS-B | 100x https://www.capricorn-scientific.com/en/shop/penicillin-streptomycin-pen-strep-100x~p1205 |
| ROTI Fair 10x PBS 7.4 | Roth | 1105.1 | https://www.carlroth.com/de/de/fertigloesungen-tabletten-portionsbeutel/rotifair-10x-pbs-7-4/p/1105.1 |
Referanslar
- Olsen, A., et al. Strongyloidiasis - the most neglected of the neglected tropical diseases. Trans Royal Soc Tropical Med Hygiene. 103 (10), 967-972 (2009).
- Buonfrate, D., et al. The global prevalence of Strongyloides stercoralis infection. Pathogens. 9 (6), 468 (2020).
- Dawkins, H. J. S., Grove, D. I. Attempts to establish infections with Strongyloides stercoralis in mice and other laboratory animals. J Helminthol. 56 (1), 23-26 (1982).
- Abraham, D., et al. Strongyloides stercoralis: protective immunity to third-stage larvae inBALB/cByJ mice. Exp Parasitol. 80 (2), 297-307 (1995).
- Breloer, M., Abraham, D. Strongyloides infection in rodents: immune response and immune regulation. Parasitology. 144 (3), 295-315 (2017).
- Breloer, M., Linnemann, L. Strongyloides ratti infection in mice: immune response and immune modulation. Philosophical Trans Royal Society B. 379 (1894), 20220440 (2024).
- Dawkins, H. J. S., Grove, D. I., Dunsmore, J. D., Mitchell, G. F. Strongyloides ratti: Susceptibility to infection and resistance to reinfection in inbred strains of mice as assessed by excretion of larvae. Int J Parasitol. 10 (2), 125-129 (1980).
- Ehrens, A., et al. Eosinophils and neutrophils eliminate migrating Strongyloides ratti larvae at the site of infection in the context of extracellular DNA trap formation. Front Immunol. 12, 715766 (2021).
- Eschbach, M. L., et al. Strongyloides ratti infection induces transient nematode-specific Th2 response and reciprocal suppression of IFN-γ production in mice. Parasite Immunol. 32 (5), 370-383 (2010).
- Dawkins, H., Muir, G., Grove, D. Histopathological appearances in primary and secondary infections with Strongyloides ratti in mice. Int J Parasitol. 11 (1), 97-103 (1981).
- Tada, I., Mimori, T., Nakai, M. Migration route of Strongyloides ratti in albino rats. Jap J Parasit. 28 (4), 219-227 (1979).
- Reitz, M., et al. Mucosal mast cells are indispensable for the timely termination of Strongyloides ratti infection. Mucosal Immunol. 10 (2), 481-492 (2017).
- Viney, M. E., Lok, J. B. The biology of Strongyloides spp. WormBook. , 1-17 (2018).
- Reitz, M., et al. Interleukin-9 promotes early mast cell-mediated expulsion of Strongyloides ratti but is dispensable for generation of protective memory. Sci Rep. 8 (1), 8636 (2018).
- Breloer, M., et al. Cutting edge: The BTLA-HVEM regulatory pathway interferes with protective immunity to intestinal Helminth infection. J Immunol. 194 (4), 1413-1416 (2015).
- Blankenhaus, B., et al. Foxp3+ regulatory T cells delay expulsion of intestinal nematodes by suppression of IL-9-driven mast cell activation in BALB/c but not in C57BL/6 mice. PLoS Pathogens. 10 (2), e1003913 (2014).
- Niamatali, S., Nolan, T. J., Schad, G. A. . Can Autoinfection be Provoked in the Strongyloides ratt/-infected Gerbil, Meriones unguiculatus. 59 (2), 149-152 (1992).
- Gardner, M. P., Gems, D., Viney, M. E. Extraordinary plasticity in aging in Strongyloides ratti implies a gene-regulatory mechanism of lifespan evolution. Aging Cell. 5 (4), 315-323 (2006).
- Viney, M. E. Developmental switching in the parasitic nematode Strongyloides ratti. Proc Biol Sci. 263 (1367), 201-208 (1996).
- Dawkins, H. J., Thomason, H. J., Grove, D. I. The occurrence of Strongyloides ratti in the tissues of mice after percutaneous infection. J Helminthol. 56 (1), 45-50 (1982).
- Takamure, A. Migration route of Strongyloides venezuelensis in rodents. Int J Parasitol. 25 (8), 907-911 (1995).
- Filbey, K., Bouchery, T., Le Gros, G. The role of ILC 2 in hookworm infection. Parasite Immunol. 40 (2), e12429 (2018).
- Allen, J. E., Sutherland, T. E. Host protective roles of type 2 immunity: Parasite killing and tissue repair, flip sides of the same coin. Semin Immunol. 26 (4), 329-340 (2014).
- Dulovic, A., Puller, V., Streit, A. Optimizing culture conditions for free-living stages of the nematode parasite Strongyloides ratti. Exp Parasitol. 168, 25-30 (2016).
- Douglas, B., et al. Transgenic expression of a T cell epitope in Strongyloides ratti reveals that helminth-specific CD4+ T cells constitute both Th2 and Treg populations. PLOS Pathogens. 17 (7), e1009709 (2021).
- Vadlamudi, R. S., Chi, D. S., Krishnaswamy, G. Intestinal strongyloidiasis and hyperinfection syndrome. Clin Mol Allergy. 4 (1), 8 (2006).
- Viney, M., Kikuchi, T. Strongyloides ratti and S. venezuelensis- rodent models of Strongyloides infection. Parasitology. 144 (3), 285-294 (2017).
- Patton, J. B., et al. Methylprednisolone acetate induces, and Δ7-dafachronic acid suppresses, Strongyloides stercoralis hyperinfection in NSG mice. Proc Natl Acad Sci. 115 (1), 204-209 (2018).
- Reitz, M., Brunn, M. L., Voehringer, D., Breloer, M. Basophils are dispensable for the establishment of protective adaptive immunity against primary and challenge infection with the intestinal helminth parasite Strongyloides ratti. PLOS Neglected Trop Dis. 12 (11), e000699 (2018).
- Blankenhaus, B., et al. Strongyloides ratti infection induces expansion of Foxp3+ regulatory T cells that interfere with immune response and parasite clearance in BALB/c Mice. J Immunol. 186 (7), 4295-4305 (2011).
- Hartmann, W., Blankenhaus, B., Brunn, M. L., Meiners, J., Breloer, M. Elucidating different pattern of immunoregulation in BALB/c and C57BL/6 mice and their F1 progeny. Sci Rep. 11 (1), 1536 (2021).
- Meiners, J., et al. IL-33 facilitates rapid expulsion of the parasitic nematode Strongyloides ratti from the intestine via ILC2- and IL-9-driven mast cell activation. PLOS Pathogens. 16 (12), e1009121 (2020).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır