Method Article
Infección experimental de ratones con el nematodo parásito Strongyloides ratti
En este artículo
Resumen
Strongyloides ratti es un nematodo parásito que causa infecciones transitorias en ratones de laboratorio, mostrando etapas de migración de tejidos y vida intestinal. Aquí, presentamos un protocolo para el mantenimiento del ciclo del parásito en ratas y la infección experimental de ratones, incluyendo la cuantificación del parásito en la cabeza, el pulmón y el intestino.
Resumen
Strongyloides ratti es un nematodo parásito que infecta naturalmente a las ratas salvajes. Sin embargo, la mayoría de las cepas de ratas y ratones de laboratorio son totalmente susceptibles a la infección. Los ratones inmunocompetentes BALB/c y C57BL/6 terminan las infecciones por S. ratti en el plazo de un mes en el contexto de una respuesta inmunitaria canónica de tipo 2 y siguen siendo semirresistentes a una reinfección. El curso de la infección puede dividirse en tres fases: a) la fase de migración tisular de las larvas infecciosas del tercer estadio durante los dos primeros días; b) la fase intestinal temprana, incluida la muda a los parásitos adultos y la incrustación en la mucosa del intestino en los días 3 a 6 después de la infección, con la reproducción a partir de los días 5 a 6 después de la infección; c) la fase intestinal posterior que finaliza con la eliminación completa de los parásitos. Las infecciones experimentales de ratones con S. ratti permiten el estudio preciso de las interacciones huésped-parásito a lo largo de todo el ciclo de vida en los diferentes sitios de infección, así como las estrategias de evasión inmune empleadas por el parásito. El protocolo presentado aquí describe el mantenimiento del parásito en ratas Wistar, la infección de ratones de laboratorio y la detección y cuantificación de parásitos S. ratti en la fase de migración de tejidos y durante la fase intestinal.
Introducción
El helminto transmitido por el suelo Strongyloides stercoralis causa estrongiloidiasis, una enfermedad a menudo referida como la más descuidada entre las enfermedades tropicales desatendidas1. Las estimaciones de 2020 sugieren 600 millones de infecciones por S. stercoralis en todo el mundo2. La investigación de laboratorio basada en hipótesis sobre S. stercoralis es limitada ya que el helminto no puede desarrollarse más allá de las larvas de tercera etapa (L3) en ratones 3,4. Por lo tanto, el nematodo específico de roedores Strongyloides ratti se usa comúnmente para estudios de infección in vivo en ratones de laboratorio 5,6. S. ratti es un parásito natural de las ratas salvajes, pero la mayoría de las cepas de ratones de laboratorio son totalmente susceptibles a la infección7. Esto permite el estudio de la interacción huésped-patógeno y las respuestas inmunitarias a través de diferentes tejidos y estadios vivos del helminto.
El ciclo de laboratorio de S. ratti en ratones se puede dividir en tres fases principales. Después de la inyección subcutánea de un número definido de larvas infecciosas de tercer estadio (iL3), generalmente de 1000 a 2000, la mayoría (alrededor del 90 %) de las L3 supervivientes migran a la cabeza de los ratones durante los dos primeros días de la infección, y solo una fracción muy pequeña (alrededor del 10 %) se recupera en el pulmón8. S. ratti penetra activamente en la piel de su huésped roedor. Es posible imitar esta vía natural de infección en el laboratorio colocando una gota de agua que contiene iL3 en la piel de ratones y permitiendo la infección percutánea activa9. Sin embargo, la eficacia de la infección es mucho menor y no es posible controlar la dosis exacta de la infección. La ruta de migración exacta tomada por S. ratti iL3, ya sea después de una infección percutánea o subcutánea (s.c.), sigue siendo desconocida. Sin embargo, como no se puede detectar ADN de S. ratti en la sangre o en órganos bien abastecidos de sangre, como los riñones de ratones infectados8, la ruta de migración primaria puede no incluir el torrente sanguíneo. Aun así, S. ratti no migra aleatoriamente a través de los tejidos. Más bien, varios estudios que utilizan la histología en ratones 3,10 y ratas11 o la cuantificación de L3 viable y ADN derivado de S. ratti recuperado de varios tejidos8 proporcionan evidencia de que S. ratti L3 migra desde el sitio de la infección directamente a través de la piel y el tejido muscular predominantemente a la región nasofrontal de la cabeza.
Aproximadamente el 10 % de las larvas inyectadas sobreviven a la migración del tejido y alcanzan la cabeza en ratones C57BL/6 y BALB/c que muestran números L3 comparables en el tejido de la cabeza12. Se cree que las larvas se tragan para llegar al intestino el día 3 después de la infección (p.i.). Se incrustan en la mucosa del intestino delgado, mudan a parásitos hembra adultas y comienzan a reproducirse por partenogénesis entre el día 5 y el día 6 p.i.13. Los huevos, pero en su mayoría las larvas de primera etapa ya eclosionadas (L1), se liberan en el intestino y se secretan con las heces. El pico del número de hembras adultas se alcanza alrededor del día 6 p.i.14. Curiosamente, los ratones C57BL/6 muestran una carga de parásitos intestinales de 2 a 5 veces mayor que los ratones BALB/c, a pesar de un número comparable de L3 migratorio de tejido en la cabeza en ambas cepas de ratones12. Durante la primera semana, la carga de parásitos intestinales en ratones inmunocompetentes C57BL/6 y ratones RAG1 knock-out (KO) que carecen de células B y T es similar, lo que sugiere que el control temprano del parásito está mediado por la inmunidad innata12,15. En la última fase, los parásitos son expulsados del intestino en un plazo de 2 a 4 semanas p.i. en ratones inmunocompetentes (revisado en6). Los ratones RAG1 KO no son capaces de eliminar la infección y contienen un número bajo de hembras adultas viables y reproductoras en el intestino delgado durante un máximo de 1 año12.
Después de una primera infección resuelta o de una inmunización con L3 irradiada, los ratones inmunocompetentes C57BL/6 y BALB/c son semirresistentes a la reinfección. Solo el 1 % de los iL3 inicialmente inoculados llegan a la cabeza, y solo aproximadamente 1-5 parásitos adultos pueden recuperarse del intestino durante una segunda infección8. Por lo tanto, el uso de la infección de laboratorio de ratones con S. ratti proporciona una herramienta para estudiar el impacto del sistema inmune innato y adaptativo durante el ciclo de vida completo de un nematodo intestinal con fases de migración de tejidos.
En este manuscrito se describe detalladamente el mantenimiento del ciclo de vida de S. ratti en ratas Wistar, así como la infección experimental de ratones y la cuantificación de la carga parasitaria en los diferentes sitios de infección. Mediante la cuantificación exacta de la carga del parásito S. ratti en el tejido de la cabeza y los pulmones, así como en el intestino de ratones experimentales, es posible diseccionar el papel de ciertos efectores inmunitarios contra la etapa de migración de tejidos o de vida intestinal de este nematodo parásito. Las respuestas inmunitarias en ratones de tipo salvaje y ratones que carecen de células efectoras inmunitarias específicas, receptores o mediadores de interés pueden compararse como se explica en detalle en la discusión 5,6.
Protocolo
Los experimentos con animales se llevaron a cabo de acuerdo con la Ley Alemana de Bienestar Animal, y los protocolos experimentales fueron aprobados por la autoridad alemana (Behörde für Gesundheit und Verbraucherschutz) del Estado de Hamburgo. La Figura 1 proporciona una visión general del mantenimiento del ciclo de vida de S. ratti en ratas Wistar y la producción de iL3 para la infección de ratones experimentales o ratas.
1. Preparación de larvas infecciosas
- Prepare el aparato Baermann como se muestra en la Figura 1. Cierre la parte inferior de la manguera con una pinza en un ángulo oblicuo y coloque una toallita de papel en el tamiz. Llene con agua tibia (aproximadamente 35-37 °C) hasta que el tamiz esté cubierto de agua.
- Llene el tamiz con la mezcla de heces y carbón vegetal preparada como se describe a continuación (paso 6). La mezcla debe estar completamente cubierta por agua.
- Encienda la luz directamente detrás del aparato Baermann. El iL3 viable migrará activamente a través del borrado.
- Después de 30 minutos, las larvas se han asentado por encima de la pinza, recójalas en un tubo de 50 ml abriendo la pinza brevemente. Recoja todo el pellet, pero asegúrese de que el volumen sea lo más pequeño posible.
- Llene el tubo de 50 ml con PBS que contenga un 1% de penicilina-estreptomicina (PBS/Pen-Strep) y deje que las larvas se depositen en el fondo del tubo por gravedad a 4 °C durante 30 min. Retire con cuidado el sobrenadante con una pipeta y repita el paso de lavado 3 veces.
- Después del tercer paso de lavado, vuelva a suspender el pellet en 30 a 50 mL de PBS/Pen-Strep, dependiendo del tamaño del pellet. Transfiera 1 μL de gotas de la solución a un portaobjetos de microscopía. Agite la solución inmediatamente antes de pipetar, ya que el iL3 se asienta rápidamente.
- Inspeccione las gotas bajo un microscopio inverso con un aumento de 40x. El iL3 debería moverse vívidamente. Cuente el iL3 por gota de 1 μL en 5 a 10 repeticiones y calcule la media por μL.
2. Infección de ratones
NOTA: El iL3 preparado se puede almacenar en PBS/Pen-Strep a 4 °C en un tubo de 50 mL que debe mantenerse horizontalmente para evitar dañar el iL3. La viabilidad in vitro indicada por el movimiento vívido de iL3 no cambia hasta 1 semana en nuestras manos. Dado que no existe una comparación sistemática de la infectividad de L3 después de diferentes tiempos de almacenamiento, utilizamos iL3 recién preparado e iL3 almacenado durante un máximo de 24 horas después de la preparación como estándar interno. Es posible que se produzcan infecciones con lotes de iL3 más antiguos. Sin embargo, es obligatorio utilizar el mismo lote iL3 para la infección de diferentes grupos dentro de un experimento. Las infecciones de ratones deben ser realizadas preferiblemente por dos personas, con una persona sosteniendo el ratón y otra realizando la inyección.
- Prepare un tubo de centrifugación de 1,5 mL por ratón que contenga un total de 1000 iL3 (C57BL/6) o 2000 iL3 (BALB/c) contados como se describe anteriormente en el paso 1.7 en PBS/Pen-Strep que se prepararon utilizando el aparato de Baermann como se explicó anteriormente (paso 1). Agite bien entre los pasos de pipeteo a medida que el iL3 se asienta rápidamente.
- Deje que el iL3 se asiente por gravedad durante 20-30 minutos a temperatura ambiente (RT) y aspire el sobrenadante con una jeringa de 0,5 mL lo más completamente posible, dejando alrededor de 30 μL de suspensión iL3 en el tubo. Vuelva a suspender el iL3 con una jeringa de 0,5 ml (28 G) o moviendo el tubo y aspire la suspensión restante.
NOTA: Es menos probable que las iL3 se adhieran al plástico húmedo que la jeringa seca. Por lo tanto, es ventajoso usar la misma jeringa para quitar el sobrenadante. - Los ratones no necesitan ser anestesiados para la infección. Levanta a los ratones con el pescuezo y agarra una pata trasera de los ratones. Utilice hembras y machos C57BL/6 de más de 8 semanas de edad y al menos 20 g de peso. Inyecte toda la solución que contiene el iL3 por vía subcutánea en la almohadilla para los pies en un ángulo plano. Retraiga lentamente la jeringa para evitar derramar la suspensión de larvas desde el sitio de la punción. Se formará una cúpula muy pequeña que contendrá el líquido. Esto será absorbido por sí mismo.
NOTA: La infección subcutánea en la almohadilla del pie en lugar del flanco o la nuca imita la infección natural por iL3, que vive en tierra húmeda fertilizada con heces y penetra activamente en la piel intacta. Además, el primer ganglio linfático de drenaje (LN) se define como LN poplíteo. Esta LN se puede utilizar para el análisis de cambios inmunológicos tempranos (es decir, el día 2 p.i.), por ejemplo, la expansión de las células T reguladoras de Foxp3+ en respuesta a la infección, como se muestra en16.
3. Recuento de iL3 en la cabeza y el pulmón de ratones infectados
- Para el análisis de la carga de larvas en el tejido, sacrifique los ratones en el día 1-3 p.i. ya que el pico de la carga de larvas es en el día 2 p.i.8,12. Realizar la eutanasia por narcosis por sobredosis de CO2. Después de la ausencia de córnea y reflejos interdigitales, realizar la luxación cervical.
- Rocíe el abdomen y el cuello con un desinfectante comercial y corte la piel sobre el abdomen con unas tijeras. Tire de la piel hacia atrás para revelar la pared abdominal anterior y corte a lo largo de la línea media para abrir la cavidad peritoneal. Corta el diafragma y abre las costillas a ambos lados para exponer el pulmón en la cavidad pleural.
- Recoja los lóbulos pulmonares en una placa de 24 pocillos dividida por líneas que contengan 1 ml de agua del grifo. Dibuje o imprima las líneas en la placa a una distancia de unos 4 mm. La distancia entre las líneas debe permitir ver ambas líneas al mismo tiempo con un aumento de 40x.
- Corta todo el pulmón en seis pedazos de aproximadamente 0,75 cm x 0,75 cm.
- Corta la cabeza con unas tijeras para huesos. Retira la piel y el pelaje con los dedos. Trate de eliminar la menor cantidad de tejido muscular posible.
- Diseccione la cabeza completa (incluyendo el cerebro y los huesos) en cuatro cuartos detrás de los ojos y longitudinalmente a través de la mitad de la cabeza (véase la Figura 2C). Coloque los cuadrantes anterior y posterior en un pocillo de una placa de 6 pocillos marcados con líneas que contengan 2 ml de agua del grifo. Coloque el pañuelo con los cortes hacia abajo en el agua.
NOTA: Por lo general, este enfoque proporciona un registro exacto del número de larvas que migran el tejido de la cabeza. Si se necesita un análisis separado de los números de L3 en el cerebro, se puede incluir el paso 3.7. - Si se desea un análisis separado del cerebro, retire la piel de la cabeza con los dedos. Luego, use unas tijeras para perforar el casquete entre los ojos. A partir de esta incisión, abra la parte superior del cráneo sagital con unas tijeras sin usar o bien limpias. Para exponer el cerebro, abra las tapas derecha e izquierda con una pinza. Use una espátula para levantar el cerebro desde la parte anterior hacia arriba y los cordones nerviosos se cortan con tijeras limpias. Retire el cerebro y transfiéralo a una placa de 24 pocillos marcados con líneas que contienen agua del grifo.
- Coloque las placas en una incubadora a 37 °C. Incubar durante 3 h mientras se agitan las placas cada hora (h) 10x. Después de la incubación, agite por última vez, retire las partes de tejido restantes con pinzas de los pocillos y deseche el tejido.
- Cuente completamente cada larva en el agua restante en los pozos bajo un microscopio invertido con un aumento de 40x moviéndose a lo largo de las líneas dibujadas en el fondo de los pozos. Cuente las larvas que migran el tejido el mismo día para aumentar la fiabilidad de los resultados.
4. Recuento de parásitos S. ratti en el intestino de ratones infectados
- Para el análisis de la carga de parásitos en el sacrificio intestinal de los ratones en el día p.i. de interés, utilice el día 3-21 p.i. para obtener una cinética completa. El pico de la carga parasitaria en ratones C57BL/6 y BALB/c dentro del intestino delgado es el día 6 p.i.14. Realizar la eutanasia por narcosis por sobredosis de CO2 . Después de la ausencia de córnea y reflejos interdigitales, realizar una luxación cervical.
- Remojar la región abdominal de los ratones en desinfectante y cortar la piel sobre el abdomen. Tire de la piel hacia atrás para revelar la pared abdominal anterior y corte a lo largo de la línea media para abrir la cavidad peritoneal.
- Extraiga todo el intestino haciendo un corte entre el estómago y el duodeno proximal, así como entre el colon y el ano (véase la figura 3B). Extraiga suavemente el intestino con los dedos y colóquelo en una placa de Petri que contenga agua del grifo.
- Cortar el intestino longitudinalmente y lavar las heces y la mucosidad agitando vigorosamente en agua del grifo durante al menos 10 segundos. Una fracción menor de los parásitos adultos y algo de L1 se eliminarán, pero los parásitos L4 viables y S. ratti adultos están incrustados en la mucosa del intestino en ratones de tipo salvaje (WT) y no se eliminarán con este paso de lavado.
- Si le interesa, divida el intestino aún más como se describe a continuación.
- Aislar el duodeno mediante una incisión después del segundo parche de Peyer (aproximadamente 2-3 cm). Aislar el íleon mediante dos incisiones, una en la primera y otra en el segundo parche de Peyer (aproximadamente 1-2 cm). Aísle el yeyuno después del aislamiento del duodeno y el íleon, ya que esta es la sección restante.
- Divida el yeyuno en tres secciones iguales para permitir una definición muy precisa de la localización del parásito. Aísle el ciego entre el íleon y el colon. Aísle el colon cortando después del ciego. La mayoría de los parásitos adultos se pueden encontrar en el primer tercio del intestino delgado (véase la figura 3B).
- Transfiera las partes intestinales limpias a tubos de 50 ml que contengan 20 ml de agua del grifo. Colocar horizontalmente en la incubadora a 37 °C durante 3 h. Agitar muy vigorosamente durante 10 s cada hora.
- Después de 3 h de incubación, retire el tejido del agua. Coloque los tubos verticalmente a RT, y los parásitos sedimentarán por gravedad en 30 min.
- Retire el sobrenadante hasta que queden unos 5 mL de agua. Llene hasta 25 ml con agua del grifo para repetir el paso de lavado. Para el análisis del intestino delgado, repita este paso de lavado otra vez para tener una buena visibilidad bajo el microscopio.
- Cuando se logre una buena visibilidad, aspire el sobrenadante hasta que queden alrededor de 5 mL de agua y transfiera el líquido a dos pocillos por intestino de ratón en una placa de 6 pocillos marcada con líneas, como se explica para contar las larvas en la cabeza.
- Cuente los parásitos hembra adultos bajo un microscopio invertido con un aumento de 40x moviéndose a lo largo de las líneas dibujadas en el fondo de los pozos. Cuente los parásitos en el día del sacrificio. Cuente los parásitos lo más rápido posible, ya que la incubación prolongada en el agua provocará su muerte y desintegración.
NOTA: Además de las larvas de cuarta etapa y los parásitos adultos, L1 también se puede detectar aquí a partir del día 5 p.i. Estos son mucho más pequeños y mucho más abundantes que los parásitos L4 y adultos y deben distinguirse fácilmente.
5. Mantenimiento de S. ratti en ratas Wistar
NOTA: Las infecciones de ratas deben ser realizadas preferiblemente por dos personas, con una persona sosteniendo las ratas y otra realizando la inyección. Para mantener el ciclo del parásito, se infectan ratas Wistar de 4 a 8 semanas de edad.
- Prepare un tubo de centrifugación de 1,5 mL por rata que contenga 2500 iL3 en PBS/Pen-Strep utilizando el aparato de Baermann como se explicó anteriormente. Agite bien entre los pasos de pipeteo a medida que las larvas se asientan rápidamente.
- Dejar que las larvas se asienten por gravedad durante 20-30 min (RT) y aspirar el sobrenadante en una jeringa de 0,5 mL (28G) hasta que queden unos 200 μL de suspensión de larvas.
- Para las infecciones, coloque las ratas en el pliegue del brazo de una persona y fije la cabeza suave y cuidadosamente allí. La otra persona agarra suavemente el flanco de la rata e inyecta la suspensión iL3 resuspendida por vía subcutánea en el pliegue nucal.
6. Cultivo del carbón vegetal
- Mantenga a las ratas infectadas en jaulas que contengan varias capas de celulosa y menos arena a partir de los días 5 y 12 después de la infección. Este intercambio de arena por varias capas de celulosa se realiza para facilitar la recolección de heces en comparación con la recolección de heces fuera de la arena
- A los días 6-8 y 13-15 p.i., transfiera las ratas a una jaula nueva y recoja todas las heces de la jaula vieja recogiendo los gránulos de heces de las jaulas después de transferir las ratas a jaulas frescas y agruparlas de una jaula en un tubo de 50 mL. Recoja las heces durante 2 semanas p.i. antes de que el establecimiento de la respuesta inmune reduzca la carga larvaria en las heces. Después de 2 semanas p.i., las ratas son sacrificadas a través de la narcosis por sobredosis de CO2 . Después de la ausencia de córnea y reflejos interdigitales, realizar una luxación cervical.
NOTA: Las ratas inmunodeprimidas y los jerbos mongoles mantienen las infecciones por S. ratti durante períodos más largos17,18. Al estudiar la respuesta inmune y la inmunomodulación durante la infección por S. ratti, decidimos mantener el ciclo en huéspedes inmunocompetentes para mantener la presión de selección de la inmunidad intacta del huésped. - Utilice las muestras de heces recolectadas para preparar cultivos de carbón vegetal, lo que permitirá el desarrollo de iL3 a partir de la L1 presente en las heces.
- Remoja previamente el carbón con agua del grifo. Antes de usar carbón vegetal para cultivos, llénelo en un colador y lávelo con agua corriente del grifo hasta que el agua salga clara. Mantén el carbón húmedo en todo momento. Remoje el carbón durante al menos 24 horas antes de usarlo.
- Mezcle las heces con carbón activado previamente remojado en una proporción de aproximadamente 1:1. Coloque la mezcla con un degradado en diagonal y cúbrala con otra capa de carbón activado en un vaso de vidrio plano para alcanzar una proporción final de 1:2.
NOTA: La incubación de las heces con carbón activado previamente remojado imita el suelo húmedo en el que se desarrolla iL3 en la naturaleza, al tiempo que evita la contaminación excesiva por hongos. - Cubra el recipiente de vidrio con una película transparente. Asegúrese de que haya algunos orificios de aire para permitir la circulación del aire.
- Incubar durante 6-7 días a 25 °C a alrededor del 90 % de humedad sin CO2. Asegúrese de que la incubadora contenga un recipiente de agua para mantener los cultivos húmedos. Mantenga los cultivos hasta 14 días a 25 °C si es necesario. iL3 se desarrollará directa o indirectamente19 y permanecerá detenido en la etapa iL3 hasta la infección.
Resultados
S. ratti migra del sitio de la infección predominantemente a la cabeza y luego al intestino en una ruta que no está exactamente definida. Para investigar la localización exacta en el tejido de la cabeza y el intestino, se infectaron ratones C57BL/6 con 1000 iL3 en la almohadilla del pie trasero izquierdo. Los ratones se sacrificaron desde el día 1 hasta el día 14 p.i. y se cuantificaron los parásitos S. ratti en la cabeza anterior y posterior, el cerebro y el pulmón (Figura 2), así como en el duodeno, yeyuno, íleon, ciego y colon (Figura 3).
Al día 1 p.i., la primera L3 alcanzó la cabeza, mostrando una distribución uniforme (Figura 2A). Además, se recuperó una pequeña fracción de larvas en los pulmones el día 1 p.i. (Figura 2B). Los números de L3 aumentaron notablemente el día 2 p.i. a un promedio de 174 L3 ± 13 en la cabeza y un promedio de 17 ± 1,7 en el pulmón. Por lo tanto, la mayor parte de la L3 (alrededor del 90%) se recupera de la cabeza y solo alrededor del 10% de los pulmones. La mayoría de las L3 (media de 93 ± 13,3) se localizaron en la cara anterior de la cabeza, pero también alrededor del 41 ± 4,7 larvas de L3 se localizaron en la cara posterior de la cabeza y alrededor de 39 ± 5,8 en el cerebro. De acuerdo con esta observación, se reportó la presencia de L3 en el cerebro y en el líquido cefalorraquídeo a las 24 h p.i. y con un máximo a las 48 h p.i. en ratones C57BL/6 después de la infección percutánea20. Se observó una clara disminución en el número total de L3 el día 3 p.i. en comparación con la carga de larvas en el día 2 p.i. y no se recuperó L3 del tejido de la cabeza el día 4 p.i. (Figura 2A). En consecuencia, se detectó la llegada de parásitos S. ratti al intestino el día 4 p.i. (Figura 3A). Para permitir una definición precisa de la localización del parásito, el intestino se subdividió en segmentos distintos, es decir, duodeno, yeyuno, íleon, ciego y colon (Figura 3B). En el día 4, p.i., la mayoría de los parásitos de S. ratti se localizaron en el duodeno y los dos primeros tercios del yeyuno (Figura 3A). Esta localización fue constante hasta el día 6 p.i. A partir del día 7 p.i., la mayoría de los adultos de S. ratti se localizaron en el ciego, donde persistieron hasta el día 9 p.i. (Figura 3A). El número de parásitos en el ciego disminuyó el día 11 p.i. a alrededor de 20 y a 0 el día 14 p.i. No recuperamos un número significativo de parásitos del colon restante en ningún momento analizado, excepto aproximadamente 5-11 parásitos para el día 11 p.i. Si bien la localización de los parásitos S. ratti cambió del día 4 al día 9 p.i. y la mayoría de los adultos fueron expulsados del intestino delgado después del día 7 p.i., el número total recuperado de todo el intestino se mantuvo constante hasta el día 9. La L1 viable no se cuantificó, pero es detectable desde el día 4 hasta el día 11, con pico en el día 6 (datos no mostrados).
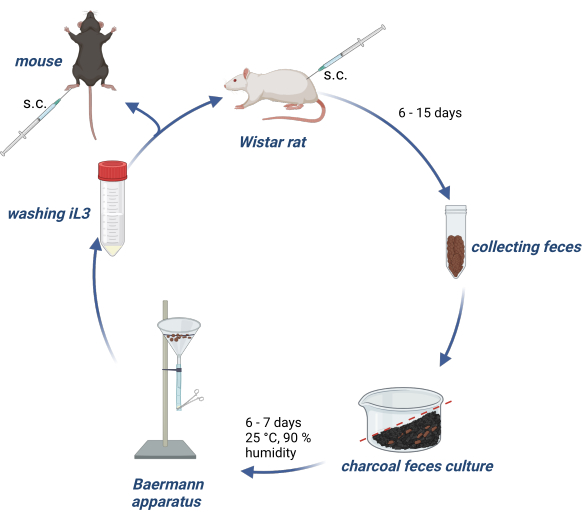
Figura 1: Mantenimiento del ciclo de vida de S. ratti en ratas y ratones. Las ratas Wistar se inyectan s.c. en el pliegue nucal con 2500 iL3. Después de 6 a 15 días, p.i. se recogen sus heces, se mezclan con carbón activado empapado en agua, se disponen con un degradado y se cubren con una película transparente, incluidos los orificios de aire. Este cultivo se incuba durante 6-7 días a 25 °C y 90% de humedad. Los iL3 se aíslan con el aparato de Baermann y se lavan 3 veces con PBS/Pen-Strep. A los ratones experimentales se les inyecta 1000 iL3 por vía subcutánea en la almohadilla de la pata trasera. Creado con BioRender.com. La Figura 1 fue creada en BioRender. Linnemann, L. (2024) https://BioRender.com/g80l370. Haga clic aquí para ver una versión más grande de esta figura.
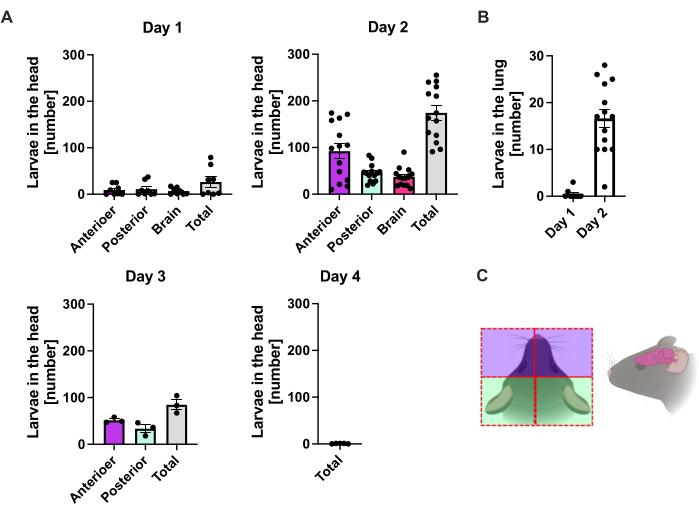
Figura 2: Cuantificación de S. ratti en el pulmón y el tejido cefálico a lo largo del tiempo. A los ratones C57BL/6 se les inyectó 1000 iL3 en la almohadilla del pie trasero. Los ratones fueron sacrificados en los momentos indicados, y se contaron los parásitos S. ratti en (A) cabeza y (B) pulmón. Cada símbolo representa los recuentos L3 de un ratón individual; el gráfico de barras muestra el valor medio y las barras de error indican SEM. Los gráficos muestran datos combinados de experimentos individuales. Día 1: dos experimentos independientes con n=4 por punto de tiempo y experimento; Día 2: cuatro experimentos independientes con n=4, n=4, n=6 y n=3; Día 3: dos experimentos independientes con n=4 y n=3; Día 4: Un experimento con n=5. (C) Caricatura esquemática que muestra las regiones individuales de la cabeza utilizadas para el aislamiento. La línea discontinua roja indica la trayectoria de la incisión. La Figura 2C se creó en BioRender. Linnemann, L. (2024) https://BioRender.com/t83e660. Haga clic aquí para ver una versión más grande de esta figura.
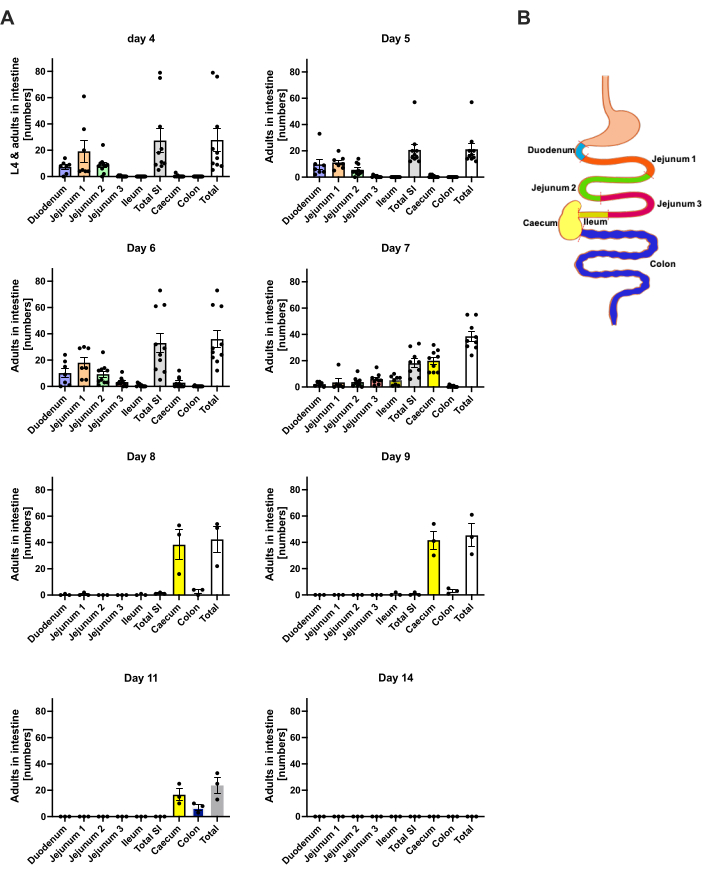
Figura 3: Cuantificación de S. ratti en las regiones intestinales a lo largo del tiempo. A los ratones machos C57BL/6 se les inyectó 1000 iL3 en la almohadilla del pie trasero. (A) Los ratones se sacrificaron en los momentos indicados, y los parásitos de S. ratti excepto L1 se contaron en las siguientes regiones: duodeno, yeyuno 1-3, íleon, ciego y colon. (B) Visión esquemática de las diferentes regiones intestinales. Cada símbolo representa los recuentos de parásitos de un ratón individual; el gráfico de barras muestra la media y las barras de error indican SEM. Se muestran datos combinados de experimentos individuales. Día 4: dos experimentos independientes con n=4 y n=6 ratones; Día 5: dos experimentos independientes con n=4 y n=6; Día 6: dos experimentos independientes con n=4 y n=6; Día 7: dos experimentos independientes con n=6 y n=3; Días 8 a 14: un experimento con n=3. SI: intestino delgado. La Figura 3B se creó en BioRender. Linnemann, L. (2024) https://BioRender.com/h27y297. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
La infección de ratones experimentales con S. ratti representa un excelente modelo para estudiar la naturaleza de las respuestas inmunitarias protectoras a las infecciones por helmintos en múltiples sitios y etapas de la inmunidad. Utilizando diferentes líneas de ratones KO y modelos de depleción de células o citocinas, se puede estudiar el papel de células inmunitarias, mediadores o receptores específicos en un modelo de infección aguda por helmintos. La posibilidad de cuantificar la carga del parásito tanto en la cabeza como en el intestino ofrece la posibilidad de diferenciar el papel de las células inmunitarias y los efectores en varios tejidos y fases durante el ciclo de vida del parásito. El agotamiento de tipos celulares específicos a través de inyecciones de anticuerpos permite estudiar su papel, específicamente durante la respuesta inmune intestinal si el tratamiento de depleción comienza después de que se completa la fase de migración del tejido. Si se desea, el intestino se puede subdividir en duodeno, yeyuno, íleon, ciego y colon para detectar incluso cambios menores en la localización del parásito o en la cinética de eliminación. Cabe señalar que la variación inter e intraexperimental en estos experimentos de infección, incluso en ratones endogámicos, es bastante alta, lo que refleja la variación introducida por la interacción del parásito y el huésped, así como por los diferentes lotes de S. ratti L3 que muestran diferente eficacia de infección (ver Figura 2 y Figura 3). Para reducir la variabilidad, la edad y el sexo de los ratones experimentales deben ser similares. Además, si se comparan ratones KO y WT, es muy recomendable utilizar controles de compañeros de camada en lugar de ratones WT derivados de una colonia de cría independiente. Sin embargo, si se utilizan tamaños de muestra suficientes, es posible generar resultados fiables comparando la carga de parásitos en ratones deficientes o competentes para ciertos efectores, lo que conduce a una imagen clara de los efectores inmunitarios implicados en la respuesta inmunitaria protectora a S. ratti (revisado en 6).
Una característica distintiva clave de S. ratti en comparación con otros modelos de infección por nematodos, como S. venezuelensis o N. brasiliensis, estrechamente relacionados, es la ruta única de migración de las larvas dentro del huésped. A diferencia de N. brasiliensis y S. venezuelensis, cuyos ciclos de vida contienen una fase pulmonar 21,22,23, S. ratti evita principalmente el pulmón y migra a través del tejido muscular y cutáneo hasta la cabeza 8,12. Solo aproximadamente el 10% de los parásitos que sobreviven en el día 2 p.i. se encuentran en los pulmones. Mientras tanto, la localización de S. ratti en la cabeza se centra en la región nasofrontal, en línea con estudios previos8. Estas características hacen de S. ratti un modelo valioso para el estudio de las interacciones huésped-parásito, específicamente en la piel y el tejido muscular, así como en el tejido drenante de los ganglios linfáticos, y permite estudios sobre las respuestas inmunitarias que pueden verse oscurecidas o complicadas por una afectación pulmonar prolongada como en otros modelos de infección por nematodos. Sorprendentemente, S. ratti L3 también se recupera del líquido cefalorraquídeo20 y del cerebro (Figura 2A), aunque los síntomas neurológicos inducidos por la infección o la muerte son relativamente raros y nunca se han observado en nuestro animalario. Investigaciones futuras pueden dilucidar si estos parásitos localizados en el cerebro están atrapados o si existe un camino hacia el intestino.
El género Strongyloides también tiene la capacidad única de formar generaciones de vida libre entre las generaciones parásitas24. Estas etapas de vida libre de S. ratti, así como su reproducción por patogénesis, facilitan además la generación de larvas transgénicas. El uso de microinyecciones en hembras de vida libre permitió la generación de larvas que expresan antígenos modelo como 2W1S fusionados con una proteína fluorescente verde. Si bien la expresión del epítopo se perdió durante la muda a los adultos, permitió el seguimiento y la caracterización de las células T CD4+ específicas de S. ratti en los ganglios linfáticos mediastínicos pulmonares y drenantes pulmonares25. Este enfoque proporciona una excelente herramienta para estudiar la biología de las células T CD4+ en el contexto de las infecciones por helmintos y el desarrollo de vacunas antihelmintos.
S. ratti es un organismo modelo versátil para la investigación inmunológica de parásitos helmintos que muestran la migración de tejidos y las etapas de vida intestinal en general. Las infecciones humanas por S. stercoralis se caracterizan por una cronicidad extrema debido a la autoinfección que se produce, lo que también puede conducir al síndrome de hiperinfección en huéspedes inmunodeprimidos, en su mayoría pacientes que reciben tratamiento con glucocorticoides después del trasplante26. Hay que tener en cuenta que este aspecto de la autoinfección e hiperinfección es difícil de modelar en ratones. Ni los RAG1 KO infectados por S. ratti ni los ratones desnudos 5,27 son susceptibles a la hiperinfección. Cabe destacar que se estableció un modelo murino de hiperinfección por S. stercoralis utilizando ratones gravemente inmunocomprometidos tratados con glucocorticosteroides (NOD.Cg-PrkdcscidIl2rgtm1Wjl/SzJ), lo que puede permitir el análisis de al menos aspectos del síndrome de hiperinfección en ratones eventualmente28.
Sin embargo, los estudios que utilizaron la infección por S. ratti en ratones demostraron que los eosinófilos y los neutrófilos desempeñan un papel no redundante en la erradicación de las larvas migratorias de tejidos. El agotamiento o ausencia en los ratones modificados genéticamente resultó en números elevados de L3 en la cabeza8. Si bien los mastocitos y los granulocitos basófilos fueron prescindibles durante la fase de migración de tejidos, tanto los mastocitos como los basófilos contribuyeron a controlar la carga parasitaria intestinal. Su ausencia no afectó el número de L3 en el tejido, pero elevó el número de parásitos adultos de S. ratti en el intestino el día 6 p.i.12,29. Un análisis posterior reveló que la ausencia de basófilos o mastocitos de tejido conectivo selectivo permitió la terminación de la infección con cinética de WT. Por el contrario, los ratones que carecían de tejido conectivo y mastocitos mucosos permanecieron infectados durante 20semanas. Estos hallazgos revelaron un papel fundamental de los mastocitos mucosos en la terminación final de la infección, lo que subraya el valor de este modelo de infección para dilucidar la función de los mastocitos mucosos durante la infección por helmintos. La definición más detallada de los cambios potenciales en la localización intestinal de los parásitos S. ratti en ausencia de ciertas células efectoras inmunológicas ayudará a definir su función en la inmunidad antihelmintos con mayor precisión.
Además, en este sistema se pueden estudiar los mecanismos inmunoevasivos empleados por los helmintos para facilitar su supervivencia. Se demostró que la depleción de los linfocitos T reguladores de Foxp3+ o la deleción de un receptor regulador en los linfocitos T efectores, ambos inducidos durante la infección por S. ratti, redujeron la carga parasitaria día 6 p.i. y la producción larvaria a lo largo de la infección 15,16,30,31. Además, fue posible definir el intestino como el tejido al que se dirige la evasión inmunitaria y la activación de mastocitos mediada por IL-9 a medida que se suprime la vía inmunitaria. Por último, el mecanismo de inicio de la inmunidad de tipo 2 mediada por ILC2 por citocinas alarminas derivadas de tejidos, como la IL-33, puede estudiarse utilizando supresores y potenciadores de la IL-33 endógena32.
El aislamiento de un gran número de iL3 a través de Baermann presenta la posibilidad de realizar más estudios in vitro . Los cocultivos de L3 con células inmunitarias o posibles candidatos a fármacos permiten la investigación directa de los efectos sobre la viabilidad y la motilidad de L3. La reestimulación ex vivo de células aisladas de ratones infectados con lisado de antígeno de S. ratti o L3 viable proporciona una plataforma para estudiar la producción de citocinas en varios tipos de células. Por último, las fracciones proteicas y lipídicas de L3 pueden utilizarse para la identificación de patrones moleculares asociados a patógenos derivados de S. ratti o moléculas efectoras inmunomoduladoras
Dado que las infecciones por helmintos siguen siendo una importante carga para la salud en todo el mundo, la investigación para dilucidar mejor las respuestas inmunitarias inducidas por los helmintos y el mecanismo de evasión empleado por los parásitos sigue siendo fundamental para mejorar las opciones de tratamiento y desarrollar estrategias preventivas como las vacunas. La infección por S. ratti en ratones presenta un modelo versátil para la investigación de las interacciones helminto-huésped durante un modelo de infección aguda.
Divulgaciones
Los autores no tienen ningún conflicto de intereses. Se utilizó el modelo lingüístico Perplexity AI 2024 para revisar los borradores de texto y mejorar las formulaciones.
Agradecimientos
Este trabajo fue apoyado por la Fundación Jürgen Manchot y la Asociación Alemana de Investigación (Beca BRE 3754/6-1 y BRE 3754/10-1). Las figuras 1, 2C y 3B se crearon en BioRender.com.
Materiales
| Name | Company | Catalog Number | Comments |
| 50 ml tubes | Sarstedt, N mbrecht, DE mbrecht, DE | 6,25,47,254 | 50 ml https://www.sarstedt.com/produkte/labor/reagenz-zentrifugenroehren/roehren/produkt/62.547.254/ |
| BD Micro-Fine U100 Insulin 0.5 ml | BD Bioscience | 7468077 | 0.5 ml https://www.bestimed.de/bd-micro-fine-insulinspritze-05-ml-u100-8-mm-100x05ml-324825.html |
| centrifugeation tubes | Sarstedt, Nümbrecht, DE | 72,706 | 1.5 ml https://www.sarstedt.com/produkte/labor/mikro-schraubroehren-reagiergefaesse/reagiergefaesse/produkt/72.706/ |
| Charcoal | Roth | 0998.3 | 5 kg https://www.carlroth.com/de/de/aktivkohle/aktivkohle/p/0998.3 |
| Falcon 6-well Clear Flat Bottom, not treated cell multiwell culture plate, with Lid, sterile | Corning | 351146 | 6-well https://www.corning.com/emea/de/search.html?_cookie=false &searchText=351146&search-initialcatalog =Corporate+Communications& initialResultType=products |
| Freezer & Refrigerator | Liebherr-Hausgeräte, Rostock, DE | ||
| Greiner Bio-One 24-Well-Platten für Zellkulturen aus Polystyrol | Fisher Scientific | 10177380 | 24-well https://www.fishersci.de/shop/products/polystyrene-24-well-cell-culture-multiwell-plate/10177380#?keyword=24-well |
| Incidin Premium Wipes | Ecolab Healthcare | 100 10 279 | https://www.ecolabhealthcare.de/website/seiten/produkte/flaechendesinfektion/tuecher/incidin_premium_wipes.php |
| Incubator 25°C | Heraeus Instruments, Hanau, DE | ||
| Incubator 37°C | Heraeus Instruments, Hanau, DE | ||
| Microscope | Helmut Hund, Wetzlar, DE | 4 x objectiv lens, 10 x ocular lens | |
| Parafilm M | Parafilm | 11772644 | 4 in. X 125 ft. https://www.fishersci.de/shop/products/parafilm-m-laboratory-wrapping-film-2/11772644 |
| Penicillin/Streptomycin (Pen-Strep) | Capricorn | PS-B | 100x https://www.capricorn-scientific.com/en/shop/penicillin-streptomycin-pen-strep-100x~p1205 |
| ROTI Fair 10x PBS 7.4 | Roth | 1105.1 | https://www.carlroth.com/de/de/fertigloesungen-tabletten-portionsbeutel/rotifair-10x-pbs-7-4/p/1105.1 |
Referencias
- Olsen, A., et al. Strongyloidiasis - the most neglected of the neglected tropical diseases. Trans Royal Soc Tropical Med Hygiene. 103 (10), 967-972 (2009).
- Buonfrate, D., et al. The global prevalence of Strongyloides stercoralis infection. Pathogens. 9 (6), 468 (2020).
- Dawkins, H. J. S., Grove, D. I. Attempts to establish infections with Strongyloides stercoralis in mice and other laboratory animals. J Helminthol. 56 (1), 23-26 (1982).
- Abraham, D., et al. Strongyloides stercoralis: protective immunity to third-stage larvae inBALB/cByJ mice. Exp Parasitol. 80 (2), 297-307 (1995).
- Breloer, M., Abraham, D. Strongyloides infection in rodents: immune response and immune regulation. Parasitology. 144 (3), 295-315 (2017).
- Breloer, M., Linnemann, L. Strongyloides ratti infection in mice: immune response and immune modulation. Philosophical Trans Royal Society B. 379 (1894), 20220440 (2024).
- Dawkins, H. J. S., Grove, D. I., Dunsmore, J. D., Mitchell, G. F. Strongyloides ratti: Susceptibility to infection and resistance to reinfection in inbred strains of mice as assessed by excretion of larvae. Int J Parasitol. 10 (2), 125-129 (1980).
- Ehrens, A., et al. Eosinophils and neutrophils eliminate migrating Strongyloides ratti larvae at the site of infection in the context of extracellular DNA trap formation. Front Immunol. 12, 715766 (2021).
- Eschbach, M. L., et al. Strongyloides ratti infection induces transient nematode-specific Th2 response and reciprocal suppression of IFN-γ production in mice. Parasite Immunol. 32 (5), 370-383 (2010).
- Dawkins, H., Muir, G., Grove, D. Histopathological appearances in primary and secondary infections with Strongyloides ratti in mice. Int J Parasitol. 11 (1), 97-103 (1981).
- Tada, I., Mimori, T., Nakai, M. Migration route of Strongyloides ratti in albino rats. Jap J Parasit. 28 (4), 219-227 (1979).
- Reitz, M., et al. Mucosal mast cells are indispensable for the timely termination of Strongyloides ratti infection. Mucosal Immunol. 10 (2), 481-492 (2017).
- Viney, M. E., Lok, J. B. The biology of Strongyloides spp. WormBook. , 1-17 (2018).
- Reitz, M., et al. Interleukin-9 promotes early mast cell-mediated expulsion of Strongyloides ratti but is dispensable for generation of protective memory. Sci Rep. 8 (1), 8636 (2018).
- Breloer, M., et al. Cutting edge: The BTLA-HVEM regulatory pathway interferes with protective immunity to intestinal Helminth infection. J Immunol. 194 (4), 1413-1416 (2015).
- Blankenhaus, B., et al. Foxp3+ regulatory T cells delay expulsion of intestinal nematodes by suppression of IL-9-driven mast cell activation in BALB/c but not in C57BL/6 mice. PLoS Pathogens. 10 (2), e1003913 (2014).
- Niamatali, S., Nolan, T. J., Schad, G. A. . Can Autoinfection be Provoked in the Strongyloides ratt/-infected Gerbil, Meriones unguiculatus. 59 (2), 149-152 (1992).
- Gardner, M. P., Gems, D., Viney, M. E. Extraordinary plasticity in aging in Strongyloides ratti implies a gene-regulatory mechanism of lifespan evolution. Aging Cell. 5 (4), 315-323 (2006).
- Viney, M. E. Developmental switching in the parasitic nematode Strongyloides ratti. Proc Biol Sci. 263 (1367), 201-208 (1996).
- Dawkins, H. J., Thomason, H. J., Grove, D. I. The occurrence of Strongyloides ratti in the tissues of mice after percutaneous infection. J Helminthol. 56 (1), 45-50 (1982).
- Takamure, A. Migration route of Strongyloides venezuelensis in rodents. Int J Parasitol. 25 (8), 907-911 (1995).
- Filbey, K., Bouchery, T., Le Gros, G. The role of ILC 2 in hookworm infection. Parasite Immunol. 40 (2), e12429 (2018).
- Allen, J. E., Sutherland, T. E. Host protective roles of type 2 immunity: Parasite killing and tissue repair, flip sides of the same coin. Semin Immunol. 26 (4), 329-340 (2014).
- Dulovic, A., Puller, V., Streit, A. Optimizing culture conditions for free-living stages of the nematode parasite Strongyloides ratti. Exp Parasitol. 168, 25-30 (2016).
- Douglas, B., et al. Transgenic expression of a T cell epitope in Strongyloides ratti reveals that helminth-specific CD4+ T cells constitute both Th2 and Treg populations. PLOS Pathogens. 17 (7), e1009709 (2021).
- Vadlamudi, R. S., Chi, D. S., Krishnaswamy, G. Intestinal strongyloidiasis and hyperinfection syndrome. Clin Mol Allergy. 4 (1), 8 (2006).
- Viney, M., Kikuchi, T. Strongyloides ratti and S. venezuelensis- rodent models of Strongyloides infection. Parasitology. 144 (3), 285-294 (2017).
- Patton, J. B., et al. Methylprednisolone acetate induces, and Δ7-dafachronic acid suppresses, Strongyloides stercoralis hyperinfection in NSG mice. Proc Natl Acad Sci. 115 (1), 204-209 (2018).
- Reitz, M., Brunn, M. L., Voehringer, D., Breloer, M. Basophils are dispensable for the establishment of protective adaptive immunity against primary and challenge infection with the intestinal helminth parasite Strongyloides ratti. PLOS Neglected Trop Dis. 12 (11), e000699 (2018).
- Blankenhaus, B., et al. Strongyloides ratti infection induces expansion of Foxp3+ regulatory T cells that interfere with immune response and parasite clearance in BALB/c Mice. J Immunol. 186 (7), 4295-4305 (2011).
- Hartmann, W., Blankenhaus, B., Brunn, M. L., Meiners, J., Breloer, M. Elucidating different pattern of immunoregulation in BALB/c and C57BL/6 mice and their F1 progeny. Sci Rep. 11 (1), 1536 (2021).
- Meiners, J., et al. IL-33 facilitates rapid expulsion of the parasitic nematode Strongyloides ratti from the intestine via ILC2- and IL-9-driven mast cell activation. PLOS Pathogens. 16 (12), e1009121 (2020).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados