Method Article
寄生性線虫Strongyloides rattiによるマウスの実験的感染
要約
Strongyloides ratti は、実験用マウスに一過性感染症を引き起こす寄生性線虫であり、組織移動および腸の生活段階を示します。ここでは、ラットの寄生虫サイクルの維持とマウスの実験的感染のためのプロトコルを紹介します。これには、頭部、肺、腸での寄生虫の定量化が含まれます。
要約
Strongyloides ratti は、野生のラットに自然に感染する寄生性線虫です。しかし、ほとんどの実験用ラットおよびマウス株は、完全に感染しやすいです。免疫適格なBALB/cおよびC57BL/6マウスは、標準的な2型免疫応答の文脈で1か月以内に S.ratti 感染を終了させ、再感染に対して半耐性を維持します。感染の経過は3つの段階に分けることができます:(a)最初の2日間の感染性第3段階の幼虫の組織移動期。(b)感染後3日目から6日目に成虫寄生虫への脱皮および腸粘膜への埋め込みを含む、感染後5日目から6日目までに生殖が開始される腸の初期段階。(c)寄生虫の完全なクリアランスで終わる後期の腸期。 S. ratti を用いたマウスの実験的感染により、さまざまな感染部位におけるライフサイクル全体にわたる宿主と寄生虫の相互作用、および寄生虫が採用する免疫回避戦略を正確に研究することができます。ここで提示されるプロトコルはWistarラットの寄生虫の維持、実験室のマウスの感染、および組織移動期および腸期の S. ratti 寄生虫の検出および定量を述べる。
概要
土壌伝播蠕虫Strongyloides stercoralisは、顧みられない熱帯病の中で最も無視されているとよく言われる病気であるStrongyloidiasisを引き起こします1。2020年の推計では、世界中で6億人がS. stercoralisに感染していることが示唆されています2。S. stercoralisに関する仮説主導の実験室研究は、マウスの蠕虫が第3段階の幼虫(L3)を超えて成長することができないため、限られています3,4。したがって、げっ歯類特異的線虫Strongyloides rattiは、実験用マウスの生体内感染研究に一般的に使用されている5,6。S. rattiは野生のネズミの天然寄生虫であるが、ほとんどの実験用マウス系統は感染に対して完全に感受性がある7。これにより、蠕虫のさまざまな組織や生段階における宿主と病原体の相互作用と免疫応答の研究が可能になります。
マウスにおけるS.rattiの実験室サイクルは、3つの主要なフェーズに分けることができます。規定数の感染性第3期幼虫(iL3)の皮下注射後、通常は1000〜2000匹、生き残ったL3の大部分(約90%)が感染の最初の2日間にマウスの頭部に移動し、肺ではごく一部(約10%)のみが回収される。S. rattiは、げっ歯類の宿主の皮膚に積極的に浸透します。実験室では、iL3を含む水をマウスの皮膚に一滴垂らし、活発な経皮的感染を可能にすることにより、この自然な感染経路を模倣することが可能である9。しかし、感染効果ははるかに低く、正確な感染量を制御することはできません。S. ratti iL3が経皮的または皮下(s.c.)感染後にたどった正確な移動経路は不明のままです。しかし、感染したマウスの腎臓のように、血液や血液が十分に供給された臓器からはS. ratti DNAが検出されないため8、主要な移動経路には血流が含まれていない可能性がある。それでも、S. rattiは組織全体にランダムに移動するわけではありません。むしろ、マウス3,10およびラット11における組織学を用いたいくつかの研究、または種々の組織から回収された生存可能なL3およびS.ratti由来DNAの定量化8は、S.ratti L3が感染部位から直接皮膚および筋肉組織を通じて主に頭部の鼻前頭領域に移動するという証拠を提供している。
注入された幼虫の約10%は、組織移動を生き延び、頭部組織12において同等のL3数を示すC57BL/6およびBALB/cマウスにおいて頭部に到達する。幼虫は、感染後3日目までに腸に到達するために飲み込まれると考えられています(p.i.)。彼らは小腸の粘膜に埋め込まれ、成虫の雌の寄生虫に脱皮し、5日目から6日目までに単為生殖によって繁殖を開始します。卵は、ほとんどがすでに孵化した第1段階の幼虫(L1)であり、腸に放出され、糞便とともに分泌されます。成体女性の数のピークは、p.i.14の6日目頃に達します。興味深いことに、C57BL/6マウスは、両マウス系統の頭部内の組織遊走L3の数が同等であるにもかかわらず、BALB/cマウスよりも2倍から5倍高い腸内寄生虫負荷を示す12。最初の1週間で、免疫適格C57BL/6マウスとB細胞とT細胞を欠損したRAG1ノックアウト(KO)マウスの腸内寄生虫負荷は同様であり、初期の寄生虫制御が自然免疫によって媒介されることを示唆している12,15。最後の段階では、免疫適格マウスでは、寄生虫は2〜4週間以内に腸から排出されます(6の文献でレビュー)。RAG1 KOマウスは、感染を取り除くことができず、最大1年間、小腸内に生存可能で繁殖する女性成体の数が少ない12。
最初の感染を解消するか、または照射したL3で免疫した後、免疫適格なC57BL/6およびBALB/cマウスは、再感染に対して半耐性を示します。最初に接種されたiL3のわずか1%が頭部に到達し、2回目の感染時に腸から回収できる成虫は約1〜5個だけである8。したがって、マウスのS . ratti の実験室感染の使用は、組織移動期を伴う腸内線虫の全ライフサイクルにおける自然免疫系および適応免疫系の影響を研究するためのツールを提供する。
この原稿では、WistarラットにおけるS. rattiのライフサイクルの維持、マウスの実験的感染、およびさまざまな感染部位での寄生虫負荷の定量化について詳細に説明しています。実験マウスの頭部および肺組織、ならびに腸におけるS. ratti寄生虫負荷の正確な定量化により、この寄生性線虫の組織移動または腸生活段階に対する特定の免疫エフェクターの役割を解剖することが可能です。野生型マウスと、特定の免疫エフェクター細胞、受容体、または目的のメディエテーターを欠くマウスの免疫応答は、議論5,6で詳細に説明されているように比較することができる。
プロトコル
動物実験はドイツ動物福祉法に従って行われ、実験プロトコルはハンブルク州のドイツ当局(Behörde für Gesundheit und Verbraucherschutz)によって承認されました。 図1 は、Wistarラットにおける S. ratti の生活環の維持と、実験マウスまたはラットの感染に対するiL3の産生の概要を示しています。
1.感染性幼虫の準備
- 図1に示すように、ベアマン装置を準備します。ホースの底をクランプで斜めに閉じ、ティッシュペーパーをふるいに入れます。ふるいが水で覆われるまで、ぬるま湯(約35〜37°C)で満たします。
- 以下に説明するように調製した糞便と木炭の混合物をふるいに充填します(ステップ6)。混合物は水で完全に覆われている必要があります。
- ベアマン装置のすぐ後ろにあるライトのスイッチを入れます。生存可能な iL3 は、ワイプを通じて積極的に移行します。
- 30分後、幼虫はクランプの上に落ち着き、クランプを短く開いて50mLチューブに集めます。ペレット全体を収集しますが、ボリュームはできるだけ小さくしてください。
- 50 mLチューブに1%ペニシリン-ストレプトマイシン(PBS/Pen-Strep)を含むPBSを入れ、幼虫を4°Cの重力で30分間チューブの底に沈殿させます。.ピペットで上清を慎重に取り除き、洗浄手順を3回繰り返します。
- 3回目の洗浄ステップの後、ペレットのサイズに応じて、ペレットを30〜50 mLのPBS/Pen-Strepに再懸濁します。溶液1μL滴を顕微鏡スライドに移します。ピペッティングの直前に溶液を攪拌すると、iL3はすぐに落ち着きます。
- 液滴を逆顕微鏡で40倍の倍率で検査します。iL3は鮮やかに動いているはずです。5 〜 10 回の反復で 1 μL 液滴あたりの iL3 をカウントし、μL あたりの平均を計算します。
2. マウスの感染
注:調製したiL3は、iL3の損傷を避けるために水平に保持する必要がある50mLチューブで4°CのPBS /Pen-Strepに保存できます。iL3の鮮やかな動きが示す in vitro での生存率は、私たちの手の中で最大1週間変化しません。異なる保存時間後のL3の感染力を体系的に比較することはできないため、調製したばかりのiL3と調製後最大24時間保存したiL3を内部標準として使用しています。古いiL3バッチによる感染は可能です。ただし、1つの実験で異なるグループを感染させるには、同じiL3バッチを使用することが必須です。マウスの感染は、できれば2人で行い、1人がマウスを持ち、もう1人が注射を行う必要があります。
- 上記のようにBaermann装置を使用して調製したPBS/Pen-Strepで、ステップ1.7で説明したようにカウントされた合計1000 iL3(C57BL/6)または2000 iL3(BALB/c)を含むマウス1匹につき1.5 mLの遠心分離チューブを1本調製します。ピペッティングステップ間で十分に攪拌すると、iL3がすぐに落ち着きます。
- iL3を室温(RT)で20〜30分間重力で沈降させ、0.5mLシリンジで上清をできるだけ完全に吸引し、チューブ内に約30μLのiL3懸濁液を残します。0.5 mLシリンジ(28 G)でiL3を再懸濁するか、チューブをフリックして残りの懸 ?? 液を吸引します。.
注:iL3は、乾いたシリンジよりも濡れたプラスチックにくっつく可能性が低くなります。したがって、同じ注射器を使用して上清を取り除くことが有利です。 - マウスは感染のために麻酔をかける必要はありません。首筋でマウスを拾い上げ、マウスの片方の後足をつかみます。生後8週間以上、体重が20g以上の女性と男性のC57BL/6を使用してください。iL3を含む溶液全体をフラットな角度でフットパッドに皮下注入します。.穿刺部位から幼虫懸濁液がこぼれないように、シリンジをゆっくりと引っ込めます。液体が入った非常に小さなドームが形成されます。これは自然に吸収されます。
注:首の脇腹やうなじではなく、フットパッドへの皮下感染は、糞便で受精した湿った土壌に生息し、無傷の皮膚に積極的に浸透するiL3による自然感染を模倣しています。また、最初のドレーンリンパ節(LN)は膝窩LNとして定義されます。このLNは、16に示すように、感染に応答したFoxp3+制御性T細胞の増殖など、早期(すなわち、2日目のp.i.)免疫学的変化の分析に使用することができます。
3. 感染マウスの頭部および肺におけるiL3のカウント
- 組織内の幼虫の負荷を分析するには、幼虫の負荷のピークが 2 日目 p.i.8,12 であるため、1 日目から 3 日目にマウスを犠牲にします。CO2の過剰摂取による安楽死を行います。角膜と指間反射がなくなった後、頸椎脱臼を行います。
- 腹部と首に市販の消毒剤をスプレーし、ハサミで腹部の皮膚を切開します。皮膚を後ろに引いて前腹壁を露出させ、正中線に沿って切って腹腔を開きます。横隔膜を切断し、両側のリブを切り開いて、胸膜腔内の肺を露出させます。
- 1 mLの水道水を含むラインで分割された24ウェルプレートに肺葉を収集します。プレートに線を約4mmの距離で描画または印刷します。線間の距離は、40倍の倍率で両方の線を同時に見ることができるようにする必要があります。
- 肺全体を約0.75cm×0.75cmの6つに切ります。
- 骨はさみで頭を切り落とします。指を使って皮膚と毛皮を取り除きます。筋肉組織をできるだけ取り除かないようにしてください。
- 頭全体(脳と骨を含む)を目の後ろと頭の中央を通る縦方向の4分の1に解剖します( 図2Cを参照)。前方と後方の象限を、2 mLの水道水を含む線でマークされた6ウェルプレートのウェルに入れます。切り傷を下に向けてティッシュを水に入れます。
注:通常、このアプローチでは、頭部組織を移動する幼虫の数を正確に記録できます。脳内のL3数の別の分析が必要な場合は、ステップ3.7を含めることができます。 - 脳の別の分析が必要な場合は、指を使用して頭から皮膚を取り除きます。次に、はさみを使用して、目の間の頭蓋骨に穴を開けます。この切開部から、未使用または完全に洗浄されたハサミで頭蓋骨矢状の上部を開きます。脳を露出させるには、ピンセットで左右の頭蓋骨を開きます。へらを使って脳を前面から上に持ち上げ、きれいなハサミで神経索を切断します。脳を取り出し、水道水を含む線でマークされた24ウェルプレートに移します。
- プレートを37°Cのインキュベーターに入れます。 プレートを1時間ごとに10回回転させながら、3時間インキュベートします。インキュベーション後、最後にもう一度渦巻き、残りの組織部分を鉗子でウェルから取り出し、組織を廃棄します。
- 井戸の底に描かれた線に沿って移動することにより、倒立顕微鏡で40倍の倍率で井戸に残っている水のすべての幼虫を完全に数えます。同じ日に組織を移動する幼虫を数えると、結果の信頼性が高まります。
4. 感染マウスの腸内における S. ratti 寄生虫の計数
- 腸内の寄生虫負荷の分析のために、関心のある日のp.i.にマウスを犠牲にし、完全な動態のために3-21 p.i.を使用してください。小腸内のC57BL/6およびBALB/cマウスにおける寄生虫負荷のピークは、p.i.14の6日目です。CO2 の過剰摂取による安楽死を行います。角膜と指間反射がなくなった後、頸部脱臼を行います。
- マウスの腹部を消毒剤に浸し、腹部の皮膚を切除します。皮膚を後ろに引いて前腹壁を露出させ、正中線に沿って切って腹腔を開きます。
- 胃と近位十二指腸の間、および結腸と肛門の間を切って、腸全体を切除します( 図3Bを参照)。指で腸をやさしく引き出し、水道水の入ったシャーレに入れます。
- 腸を縦方向に切り開き、水道水で少なくとも10秒間激しく振って糞便と粘液を洗い流します。成虫の寄生虫のごく一部と一部のL1は洗い流されますが、生存可能なL4および 成虫のS.ratti 寄生虫は野生型(WT)マウスの腸の粘膜に埋め込まれており、この洗浄ステップでは除去されません。
- 興味がある場合は、以下に説明するように腸をさらに分割します。
- 2番目のパイエルパッチ(約2〜3 cm)の後の切開によって十二指腸を分離します。回腸を2つの切開部、1つは1つ目、もう1つは2番目のパイエルパッチ(約1〜2 cm)で分離します。十二指腸と回腸の分離後、空腸を分離します。これは残りのセクションです。
- 空腸を3つの等しいセクションに分割して、寄生虫の局在を非常に正確に定義できるようにします。回腸と結腸の間の盲腸を分離します。盲腸の後を切って結腸を分離します。成虫の寄生虫の大部分は、小腸の最初の3分の1に見られます( 図3Bを参照)。
- 洗浄した腸内部分を水道水20mL入りの50mLチューブに移します。37°Cのインキュベーターに水平に3時間置きます。1時間ごとに10秒間非常に激しく振ってください。
- インキュベーションの3時間後、組織を水から取り出します。チューブをRTに垂直に置き、寄生虫は重力によって30分で沈殿します。
- 約5mLの水が残るまで上清を取り除きます。.水道水で最大25mLを満たして、洗浄手順を繰り返します。小腸の分析では、この洗浄ステップをもう一度繰り返して、顕微鏡下で良好な視認性を確保します。
- 良好な視認性が得られたら、約5 mLの水が残るまで上清を吸引し、頭の中の幼虫を数えるために説明したように、線でマークされた6ウェルプレート内のマウス腸ごとに2つのウェルに液体を移します。
- 倒立顕微鏡で40倍の倍率で成虫の雌寄生虫を数え、井戸の底に描かれた線に沿って移動します。犠牲の日に寄生虫を数えます。水中での長時間の潜伏はそれらの死と崩壊につながるので、できるだけ早く寄生虫を数えてください。
注:第4段階の幼虫と成虫の寄生虫に加えて、L1もここで5日目のp.i.頃から検出できます。これらは、L4や成虫の寄生虫よりもはるかに小さく、はるかに豊富であるため、簡単に区別する必要があります。
5. Wistarラットの S.ratti のメンテナンス
注:ラットの感染は、できれば2人で行い、1人がラットを持ち、もう1人が注射を行う必要があります。寄生虫の周期を維持するために、生後4〜8週齢のWistarラットが感染します。
- 前に説明したように、Baermann装置を使用して、PBS/Pen-Strepに2500 iL3を含むラット1匹あたり1.5 mLの遠心分離チューブを1本調製します。ピペッティングステップ間で十分に攪拌し、幼虫がすぐに落ち着きます。
- 幼虫を重力で20〜30分間沈殿させ(RT)、0.5mLシリンジ(28G)で上清を吸引し、約200μLの幼虫懸濁液が残るまで放置します。
- 感染症の場合は、ラットを1人の腕の曲がりくねった部分に置き、そこに頭を優しく慎重に固定します。もう一人はラットの脇腹を優しくつかみ、再懸濁したiL3懸濁液を鼻腔のひだに皮下注射します。
6.炭の文化
- 感染したラットを、感染後5日目と12日目からセルロースとトイレ砂を数層含むケージに保持します。このゴミのセルロース数層への交換は、ゴミから糞便を採取するのに比べて糞便の収集を容易にするために行われます
- 6-8日目および13-15 p.i.に、ラットを新鮮なケージに移し、ラットを新鮮なケージに移した後、ケージから糞便ペレットを拾い上げて古いケージからすべての糞便を収集します。免疫応答が確立される前に、2週間p.i.糞便を収集します。2週間後 p.i. ラットは CO2 過剰摂取昏睡症によって安楽死させます。角膜と指間反射がなくなった後、頸部脱臼を行います。
注:免疫不全のラットとモンゴルのスナネズミは、S. rattiの感染を長期間維持します17,18。S. ratti感染中の免疫応答と免疫調節を研究し、免疫適格宿主のサイクルを維持して、無傷の宿主免疫の選択圧を維持することを決定しました。 - 収集した糞便サンプルを使用して木炭培養物を調製し、糞便中に存在するL1からiL3を発生させることができます。
- 木炭を水道水にあらかじめ浸します。木炭を培養に使用する前に、ふるいにかけ、水が透明になるまで水道水で洗います。木炭は常に湿らせてください。使用前に少なくとも24時間木炭を浸してください。
- 糞便をあらかじめ浸した活性炭と約1:1の比率で混合します。混合物を斜めにグラデーションで配置し、平らなガラスビーカーで別の活性炭の層で覆い、最終的な比率が1:2になるようにします。
注:事前に浸した活性炭で糞便をインキュベートすると、過度の真菌汚染を防ぎながら、自然界でiL3が発生する湿った土壌を模倣します。 - ガラス容器を透明フィルムで覆います。空気の循環を可能にするために、いくつかの空気穴があることを確認してください。
- CO2を使用せずに、湿度約90%の25°Cで6〜7日間インキュベートします。培養物を湿らせておくために、インキュベーターに水容器が含まれていることを確認してください。必要に応じて、培養物を25°Cで最大14日間保管します。iL3は直接的または間接的に発症し、感染するまでiL3段階で停止したままになります。
結果
S. ratti は、感染部位から主に頭部に移動し、その後、正確には定義されていない経路で腸に移動します。頭部組織と腸の正確な局在を調べるために、C57BL/6マウスに1000 iL3を左後足パッドに感染させました。マウスを1日目から14日目に犠牲にしました p.i.および S.ratti 寄生虫は、前部および後部の頭部、脳、および肺(図2)、ならびに十二指腸、空腸、回腸、盲腸、および結腸(図3)で定量されました。
1日目のp.i.では、最初のL3が頭部に到達し、均一な分布を示しました(図2A)。さらに、幼虫のごく一部が1日目の肺で回収されました(図2B)。L3の数は、2日目のp.i.で著しく増加し、頭では平均174±13、肺では平均17±1.7でした。したがって、L3の大部分(約90%)は頭部から回収され、肺からは約10%しか回収されません。ほとんどのL3(平均9±3〜13.3)は頭部の前面に局在していましたが、約41±4.7のL3幼虫も頭部の後部に、脳に約39±5.8に局在していました。この観察結果に沿って、経皮的感染後のC57BL/6マウスでは、脳および脳脊髄液中のL3の存在が24時間p.i.で報告され、最大48時間p.i.で報告されました20。総L3数の合計の明らかな減少は、2日目の幼虫の負荷と比較して、3日目のp.i.で観察され、4日目のp.i.では頭部組織からL3は回収されませんでした(図2A)。したがって、 S. ratti 寄生虫の到着は、4日目のp.i.に腸内で検出されました(図3A)。寄生虫の局在を正確に定義できるように、腸は、十二指腸、空腸、回腸、盲腸、および結腸という明確なセグメントに細分されました(図3B)。4日目のp.i.では、S. ratti寄生虫の大部分は十二指腸と空腸の最初の3分の2に局在していました(図3A)。このローカリゼーションは、6日目のp.i.まで一貫していました。7 p.i.以降、 S. ratti の成虫の大部分は盲腸に局在し、9 p.i.まで持続しました(図3A)。盲腸中の寄生虫の数は、11 p.i.までに約20に減少し、14 p.i.までに0に減少しました。分析した時点で、残りの結腸から有意な数の寄生虫を回収しませんでした p.i.11日目までに約5〜11の寄生虫を除いて。 S. ratti 寄生虫の局在は4日目から9日目にかけて変化し、成虫の大部分は7日目以降に小腸から排出されましたが、全腸から回収された総数は9日目まで一定でした。生存可能なL1は定量化されていませんが、4日目から11日目まで検出可能で、ピークは6日目です(データは示されていません)。
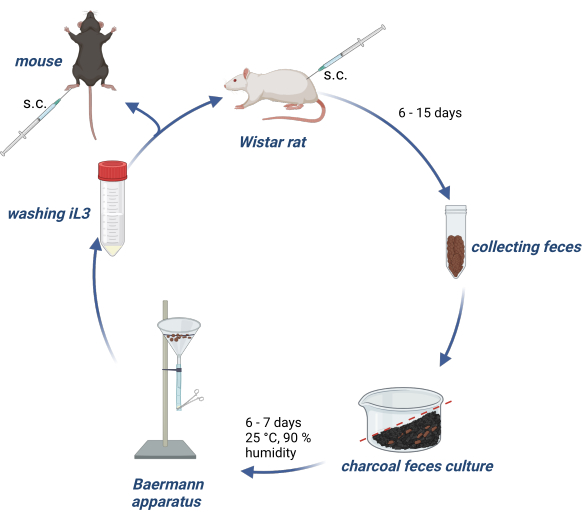
図1:ラットとマウスにおける S.ratti のライフサイクルの維持。 Wistarラットは、2500 iL3でnuchal foldにs.c.を注射されます。6〜15日後、p.i.それらの糞便は収集され、水に浸した活性炭と混合され、勾配で配置され、空気穴を含む透明なフィルムで覆われます。この培養物を25°C、湿度90%で6〜7日間インキュベートします。iL3はBaermann装置を使用して分離され、PBS/Pen-Strepで3回洗浄されます。実験マウスに1000 iL3を皮下注射します 後足パッド。BioRender.com で作成。図 1 は BioRender で作成しました。リンネマン、L.(2024)https://BioRender.com/g80l370。この図の拡大版を表示するには、ここをクリックしてください。
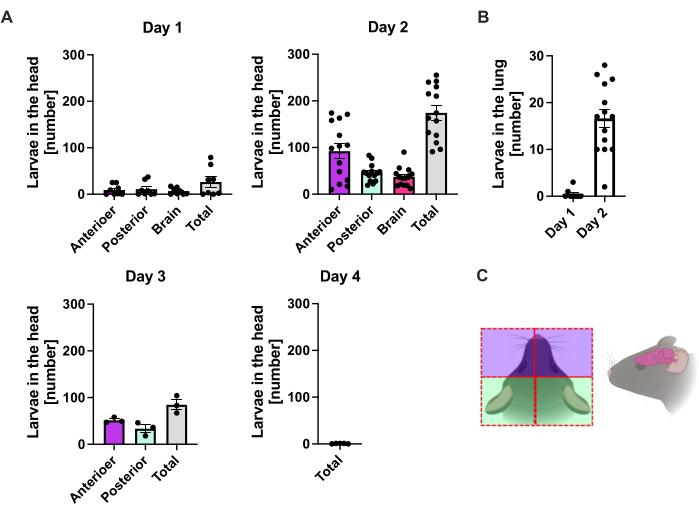
図2:肺および頭部組織におけるS.rattiの経時的な定量化。 C57BL/6マウスに1000 iL3を後足パッドに皮下注射しました。マウスを指定された時点で屠殺し、(A)頭部および(B)肺のS.ratti寄生虫をカウントした。各記号は、個々のマウスの L3 カウントを表します。棒グラフは平均値を示し、エラーバーはSEMを示します。グラフは、個々の実験から得られたデータを組み合わせたものです。1日目:時点ごとにn = 4の2つの独立した実験と実験。2日目:n = 4、n = 4、n = 6、およびn = 3の4つの独立した実験。3日目:n = 4とn = 3の2つの独立した実験。4日目:n = 5で1つの実験。(C)分離に使用される頭部の個々の領域を示す概略漫画。赤い破線は切開経路を示しています。図 2C は BioRender で作成しました。リンネマン、L. (2024) https://BioRender.com/t83e660.この図の拡大版を表示するには、ここをクリックしてください。
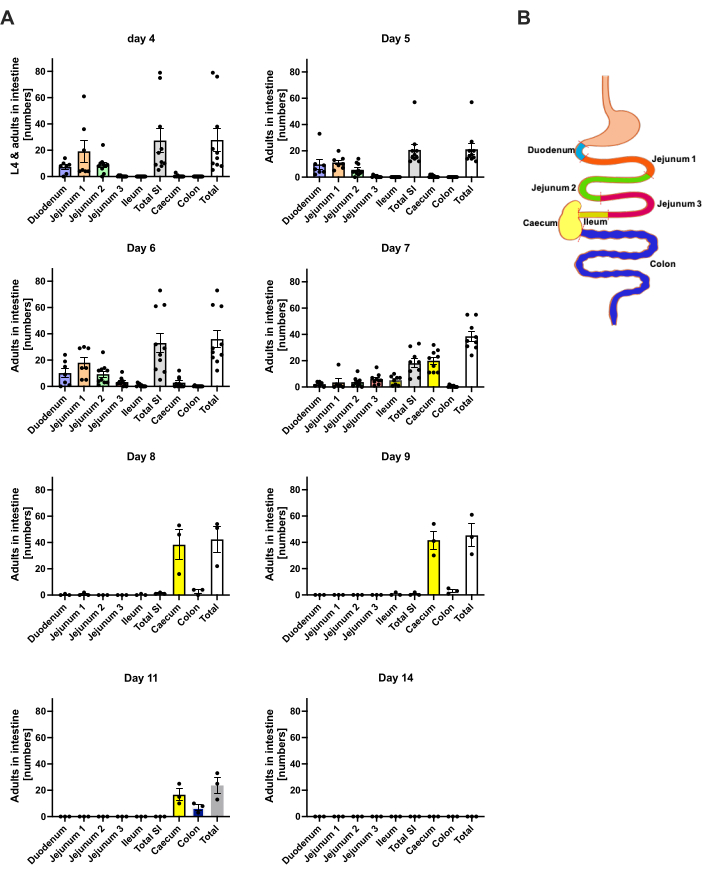
図3:腸領域における S.ratti の経時的な定量化。 雄のC57BL/6マウスに、後足パッドに1000 iL3を皮下投与しました。(A)マウスを指定された時点で犠牲にし、L1を除く S.ratti 寄生虫を次の領域でカウントしました:十二指腸、空腸1-3、回腸、盲腸、および結腸。(B)さまざまな腸領域の概略図の概要。各記号は、個々のマウスの寄生虫の数を表します。棒グラフは平均を示し、エラーバーはSEMを示します。示されているのは、個々の実験から得られたデータを組み合わせたものです。4日目:n = 4およびn = 6マウスを使用した2つの独立した実験。5日目:n = 4とn = 6の2つの独立した実験。6日目:n = 4とn = 6の2つの独立した実験。7日目:n = 6とn = 3の2つの独立した実験。8日目から14日目:n = 3の1つの実験。SI:小腸。図 3B は BioRender で作成しました。リンネマン、L.(2024)https://BioRender.com/h27y297。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
実験マウスの S. ratti への感染は、免疫の複数の部位と段階における蠕虫感染に対する防御免疫応答の性質を研究するための優れたモデルを表しています。異なるKOマウス系統と細胞またはサイトカイン枯渇モデルを用いて、特異的な免疫細胞、メディエーター、または受容体の役割を急性蠕虫感染モデルで研究することができます。頭部および腸内の寄生虫負荷を定量化する可能性は、寄生虫のライフサイクル中のさまざまな組織および相における免疫細胞およびエフェクターの役割を区別する可能性を提供します。抗体注射による特定の細胞タイプの枯渇により、組織移動期が完了した後に枯渇治療が開始された場合、特に腸管免疫応答中のそれらの役割を研究することができます。所望であれば、腸をさらに十二指腸、空腸、回腸、盲腸、および結腸に細分化して、寄生虫の局在またはクリアランス動態のわずかな変化さえも検出することができる。これらの感染実験における実験間および実験中の変動は、近交系マウスであっても、寄生虫と宿主の相互作用によってもたらされる変動を反映しており、異なる感染効果を示す S. ratti L3の異なるバッチを反映していることに注意する必要があります( 図2 および 図3を参照)。ばらつきを減らすためには、実験マウスの年齢と性別を近づける必要があります。さらに、KOマウスとWTマウスを比較する場合は、独立した繁殖コロニーに由来するWTマウスの代わりに同腹仔コントロールを使用することを強くお勧めします。それにもかかわらず、十分なサンプルサイズを使用すれば、特定のエフェクターが不足しているマウスまたは有能なマウスの寄生虫負荷を比較して信頼性の高い結果を生成することができ、 S. ratti に対する防御免疫応答に関与する免疫エフェクターの明確な図を描くことができる( 6の文献でレビュー)。
密接に関連するS. venezuelensisやN. brasiliensisなどの他の線虫感染モデルと比較したS. rattiの主な特徴は、宿主内での幼虫のユニークな移動経路です。N. brasiliensisおよびS. venezuelensisとは異なり、その生活環は両方とも肺期を含んでおり、21,22,23 S. rattiは主に肺を迂回し、筋肉および皮膚組織を通って頭部8,12に移動する。2日目のp.i.に生き残った寄生虫の約10%だけが肺に見つかります。一方、S. rattiの頭部内の位置は、先行研究8と同様に、鼻前頭部に焦点を当てている。これらの特性により、S. rattiは、特に皮膚組織や筋肉組織、リンパ節を排出する組織における宿主と寄生虫の相互作用を研究するための貴重なモデルとなり、他の線虫感染モデルのように、肺の長時間の関与によって不明瞭になったり複雑になったりする可能性のある免疫応答の研究を可能にします。驚くべきことに、S. ratti L3は脳脊髄液20と脳からも採取されます(図2A)が、感染による神経学的症状や死亡は比較的まれであり、私たちの動物施設では観察されたことがありません。今後の研究で、これらの脳に局在する寄生虫が捕らえられているのか、それとも腸への経路が存在するのかが解明されるかもしれません。
Strongyloides属は、寄生世代24の間に自由生活世代を形成する独自の能力も持っています。S. rattiのこれらの自由生活段階、および病因によるその繁殖は、トランスジェニック幼虫の生成をさらに促進します。自由生活の雌にマイクロインジェクションを行うことで、緑色蛍光タンパク質に融合した2W1Sのようなモデル抗原を発現する幼虫を作製することができました。エピトープの発現は成体への脱皮中に失われましたが、肺および肺を排出する縦隔リンパ節におけるS.ratti特異的CD4+ T細胞の追跡と特性評価を可能にしました25。このアプローチは、蠕虫感染症と抗蠕虫ワクチン開発の文脈でCD4+ T細胞生物学を研究するための優れたツールを提供します。
S. rattiは、組織の移動と腸の生活段階全般を示す蠕虫寄生虫の免疫学的研究のための汎用性の高いモデル生物です。ヒトのS. stercoralis感染症は、自己感染の発生により極端な慢性化を特徴とし、免疫抑制された宿主、主に移植後に糖質コルチコイド療法を受けている患者でも過感染症候群を引き起こす可能性がある26。自己感染と過感染のこの側面は、マウスでモデル化するのが難しいことに注意する必要があります。S. rattiに感染したRAG1 KOもヌードマウス5,27も過感染にかかりません。注目すべきは、S. stercoralisによる過感染の1つのマウスモデルが、グルココルチコステロイド治療された重度の免疫不全マウス(NOD.Cg-PrkdcscidIl2rgtm1Wjl/SzJ)を使用して確立され、これにより、最終的にマウスの過感染症候群の少なくとも側面の分析が可能になる可能性がある28。
それにもかかわらず、マウスでS.ratti感染を利用した研究では、好酸球と好中球が組織移動する幼虫を根絶する上で非冗長な役割を果たすことが示されました。遺伝子改変マウスにおける枯渇または不在は、頭部のL3数の増加をもたらした8。組織遊走期には肥満細胞と好塩基球顆粒球が欠用されましたが、肥満細胞と好塩基球の両方が腸内寄生虫の負担の制御に貢献しました。それらが存在しないことは組織内のL3数に影響を与えませんでしたが、6日目に腸内の成虫のS.ratti寄生虫の数を増加させましたp.i.12,29。さらなる解析により、好塩基球または選択的結合組織肥満細胞の欠如により、WT動態による感染終了が可能であることが明らかになった。対照的に、結合組織と粘膜肥満細胞を欠損したマウスは、20週間感染したままでした12。これらの知見は、最終的な感染終結における粘膜肥満細胞の重要な役割を明らかにし、蠕虫感染中の粘膜肥満細胞の機能を解明する上でのこの感染モデルの価値を強調しています。特定の免疫学的エフェクター細胞が存在しない状態でのS. ratti寄生虫の腸内局在における潜在的な変化のさらなる定義は、抗蠕虫免疫におけるそれらの機能をさらに正確に定義するのに役立つでしょう。
さらに、蠕虫が生存を促進するために用いる免疫回避機構も、このシステムで研究できる可能性があります。S. ratti感染中に誘発されたFoxp3+制御性T細胞の枯渇またはエフェクターT細胞上の調節性受容体の欠失は、感染15,16,30,31を通じて寄生虫の負荷を減少させることが示されました。さらに、免疫回避の標的組織として腸を定義し、免疫経路が抑制されるIL-9を介した肥満細胞の活性化を定義することができました。最後に、IL-33のような組織由来のアラームサイトカインによるILC2を介した2型免疫の開始のメカニズムは、内因性IL-33のサプレッサーとエンハンサーを用いて研究することができる32。
ベアマンによる多数のiL3の単離は、さらなるin vitro研究の可能性を示しています。L3を免疫細胞または潜在的な薬剤候補と共培養することで、L3の生存率と運動性への影響を直接調べることができます。感染マウスから単離した細胞をS. ratti抗原ライセートまたは生存可能なL3で単離した細胞のEx vivo再刺激は、さまざまな細胞タイプにわたるサイトカイン産生を研究するためのプラットフォームを提供します。最後に、L3のタンパク質および脂質画分は、S. ratti由来の病原体関連分子パターンまたは免疫調節エフェクター分子の同定に用いることができる
蠕虫感染症は依然として世界的に大きな健康負担となっているため、蠕虫が誘導する免疫応答と寄生虫が用いる回避メカニズムをさらに解明するための研究は、治療選択肢の改善とワクチン接種などの予防戦略の開発に極めて重要です。マウスにおける S. ratti 感染は、急性感染モデルにおける蠕虫と宿主の相互作用に関する研究のための汎用性の高いモデルを示しています。
開示事項
著者には利益相反はありません。言語モデルPerplexity AI 2024は、テキストドラフトの改訂と定式化の改善に使用されました。
謝辞
この研究は、ユルゲン・マンコット財団とドイツ研究協会(Grant BRE 3754/6-1 and BRE 3754/10-1)の支援を受けて行われました。図1、図2C、および図3Bは BioRender.com で作成されました。
資料
| Name | Company | Catalog Number | Comments |
| 50 ml tubes | Sarstedt, N mbrecht, DE mbrecht, DE | 6,25,47,254 | 50 ml https://www.sarstedt.com/produkte/labor/reagenz-zentrifugenroehren/roehren/produkt/62.547.254/ |
| BD Micro-Fine U100 Insulin 0.5 ml | BD Bioscience | 7468077 | 0.5 ml https://www.bestimed.de/bd-micro-fine-insulinspritze-05-ml-u100-8-mm-100x05ml-324825.html |
| centrifugeation tubes | Sarstedt, Nümbrecht, DE | 72,706 | 1.5 ml https://www.sarstedt.com/produkte/labor/mikro-schraubroehren-reagiergefaesse/reagiergefaesse/produkt/72.706/ |
| Charcoal | Roth | 0998.3 | 5 kg https://www.carlroth.com/de/de/aktivkohle/aktivkohle/p/0998.3 |
| Falcon 6-well Clear Flat Bottom, not treated cell multiwell culture plate, with Lid, sterile | Corning | 351146 | 6-well https://www.corning.com/emea/de/search.html?_cookie=false &searchText=351146&search-initialcatalog =Corporate+Communications& initialResultType=products |
| Freezer & Refrigerator | Liebherr-Hausgeräte, Rostock, DE | ||
| Greiner Bio-One 24-Well-Platten für Zellkulturen aus Polystyrol | Fisher Scientific | 10177380 | 24-well https://www.fishersci.de/shop/products/polystyrene-24-well-cell-culture-multiwell-plate/10177380#?keyword=24-well |
| Incidin Premium Wipes | Ecolab Healthcare | 100 10 279 | https://www.ecolabhealthcare.de/website/seiten/produkte/flaechendesinfektion/tuecher/incidin_premium_wipes.php |
| Incubator 25°C | Heraeus Instruments, Hanau, DE | ||
| Incubator 37°C | Heraeus Instruments, Hanau, DE | ||
| Microscope | Helmut Hund, Wetzlar, DE | 4 x objectiv lens, 10 x ocular lens | |
| Parafilm M | Parafilm | 11772644 | 4 in. X 125 ft. https://www.fishersci.de/shop/products/parafilm-m-laboratory-wrapping-film-2/11772644 |
| Penicillin/Streptomycin (Pen-Strep) | Capricorn | PS-B | 100x https://www.capricorn-scientific.com/en/shop/penicillin-streptomycin-pen-strep-100x~p1205 |
| ROTI Fair 10x PBS 7.4 | Roth | 1105.1 | https://www.carlroth.com/de/de/fertigloesungen-tabletten-portionsbeutel/rotifair-10x-pbs-7-4/p/1105.1 |
参考文献
- Olsen, A., et al. Strongyloidiasis - the most neglected of the neglected tropical diseases. Trans Royal Soc Tropical Med Hygiene. 103 (10), 967-972 (2009).
- Buonfrate, D., et al. The global prevalence of Strongyloides stercoralis infection. Pathogens. 9 (6), 468 (2020).
- Dawkins, H. J. S., Grove, D. I. Attempts to establish infections with Strongyloides stercoralis in mice and other laboratory animals. J Helminthol. 56 (1), 23-26 (1982).
- Abraham, D., et al. Strongyloides stercoralis: protective immunity to third-stage larvae inBALB/cByJ mice. Exp Parasitol. 80 (2), 297-307 (1995).
- Breloer, M., Abraham, D. Strongyloides infection in rodents: immune response and immune regulation. Parasitology. 144 (3), 295-315 (2017).
- Breloer, M., Linnemann, L. Strongyloides ratti infection in mice: immune response and immune modulation. Philosophical Trans Royal Society B. 379 (1894), 20220440 (2024).
- Dawkins, H. J. S., Grove, D. I., Dunsmore, J. D., Mitchell, G. F. Strongyloides ratti: Susceptibility to infection and resistance to reinfection in inbred strains of mice as assessed by excretion of larvae. Int J Parasitol. 10 (2), 125-129 (1980).
- Ehrens, A., et al. Eosinophils and neutrophils eliminate migrating Strongyloides ratti larvae at the site of infection in the context of extracellular DNA trap formation. Front Immunol. 12, 715766 (2021).
- Eschbach, M. L., et al. Strongyloides ratti infection induces transient nematode-specific Th2 response and reciprocal suppression of IFN-γ production in mice. Parasite Immunol. 32 (5), 370-383 (2010).
- Dawkins, H., Muir, G., Grove, D. Histopathological appearances in primary and secondary infections with Strongyloides ratti in mice. Int J Parasitol. 11 (1), 97-103 (1981).
- Tada, I., Mimori, T., Nakai, M. Migration route of Strongyloides ratti in albino rats. Jap J Parasit. 28 (4), 219-227 (1979).
- Reitz, M., et al. Mucosal mast cells are indispensable for the timely termination of Strongyloides ratti infection. Mucosal Immunol. 10 (2), 481-492 (2017).
- Viney, M. E., Lok, J. B. The biology of Strongyloides spp. WormBook. , 1-17 (2018).
- Reitz, M., et al. Interleukin-9 promotes early mast cell-mediated expulsion of Strongyloides ratti but is dispensable for generation of protective memory. Sci Rep. 8 (1), 8636 (2018).
- Breloer, M., et al. Cutting edge: The BTLA-HVEM regulatory pathway interferes with protective immunity to intestinal Helminth infection. J Immunol. 194 (4), 1413-1416 (2015).
- Blankenhaus, B., et al. Foxp3+ regulatory T cells delay expulsion of intestinal nematodes by suppression of IL-9-driven mast cell activation in BALB/c but not in C57BL/6 mice. PLoS Pathogens. 10 (2), e1003913 (2014).
- Niamatali, S., Nolan, T. J., Schad, G. A. . Can Autoinfection be Provoked in the Strongyloides ratt/-infected Gerbil, Meriones unguiculatus. 59 (2), 149-152 (1992).
- Gardner, M. P., Gems, D., Viney, M. E. Extraordinary plasticity in aging in Strongyloides ratti implies a gene-regulatory mechanism of lifespan evolution. Aging Cell. 5 (4), 315-323 (2006).
- Viney, M. E. Developmental switching in the parasitic nematode Strongyloides ratti. Proc Biol Sci. 263 (1367), 201-208 (1996).
- Dawkins, H. J., Thomason, H. J., Grove, D. I. The occurrence of Strongyloides ratti in the tissues of mice after percutaneous infection. J Helminthol. 56 (1), 45-50 (1982).
- Takamure, A. Migration route of Strongyloides venezuelensis in rodents. Int J Parasitol. 25 (8), 907-911 (1995).
- Filbey, K., Bouchery, T., Le Gros, G. The role of ILC 2 in hookworm infection. Parasite Immunol. 40 (2), e12429 (2018).
- Allen, J. E., Sutherland, T. E. Host protective roles of type 2 immunity: Parasite killing and tissue repair, flip sides of the same coin. Semin Immunol. 26 (4), 329-340 (2014).
- Dulovic, A., Puller, V., Streit, A. Optimizing culture conditions for free-living stages of the nematode parasite Strongyloides ratti. Exp Parasitol. 168, 25-30 (2016).
- Douglas, B., et al. Transgenic expression of a T cell epitope in Strongyloides ratti reveals that helminth-specific CD4+ T cells constitute both Th2 and Treg populations. PLOS Pathogens. 17 (7), e1009709 (2021).
- Vadlamudi, R. S., Chi, D. S., Krishnaswamy, G. Intestinal strongyloidiasis and hyperinfection syndrome. Clin Mol Allergy. 4 (1), 8 (2006).
- Viney, M., Kikuchi, T. Strongyloides ratti and S. venezuelensis- rodent models of Strongyloides infection. Parasitology. 144 (3), 285-294 (2017).
- Patton, J. B., et al. Methylprednisolone acetate induces, and Δ7-dafachronic acid suppresses, Strongyloides stercoralis hyperinfection in NSG mice. Proc Natl Acad Sci. 115 (1), 204-209 (2018).
- Reitz, M., Brunn, M. L., Voehringer, D., Breloer, M. Basophils are dispensable for the establishment of protective adaptive immunity against primary and challenge infection with the intestinal helminth parasite Strongyloides ratti. PLOS Neglected Trop Dis. 12 (11), e000699 (2018).
- Blankenhaus, B., et al. Strongyloides ratti infection induces expansion of Foxp3+ regulatory T cells that interfere with immune response and parasite clearance in BALB/c Mice. J Immunol. 186 (7), 4295-4305 (2011).
- Hartmann, W., Blankenhaus, B., Brunn, M. L., Meiners, J., Breloer, M. Elucidating different pattern of immunoregulation in BALB/c and C57BL/6 mice and their F1 progeny. Sci Rep. 11 (1), 1536 (2021).
- Meiners, J., et al. IL-33 facilitates rapid expulsion of the parasitic nematode Strongyloides ratti from the intestine via ILC2- and IL-9-driven mast cell activation. PLOS Pathogens. 16 (12), e1009121 (2020).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved