Method Article
Infection expérimentale de souris par le nématode parasite Strongyloides ratti
Dans cet article
Résumé
Strongyloides ratti est un nématode parasite qui provoque des infections transitoires chez les souris de laboratoire, présentant des stades de migration tissulaire et de vie intestinale. Ici, nous présentons un protocole pour le maintien du cycle parasitaire chez le rat et l’infection expérimentale de souris, y compris la quantification du parasite dans la tête, les poumons et l’intestin.
Résumé
Strongyloides ratti est un nématode parasite qui infecte naturellement les rats sauvages. Cependant, la plupart des souches de rats et de souris de laboratoire sont entièrement sensibles aux infections. Les souris immunocompétentes BALB/c et C57BL/6 mettent fin aux infections à S. ratti en un mois dans le cadre d’une réponse immunitaire canonique de type 2 et restent semi-résistantes à une réinfection. L’évolution de l’infection peut être divisée en trois phases : a) la phase de migration tissulaire des larves infectieuses du troisième stade au cours des deux premiers jours ; b) la phase intestinale précoce, y compris la mue des parasites adultes et l’encastrement dans la muqueuse de l’intestin dans les jours 3 à 6 après l’infection, la reproduction commençant les jours 5 et 6 après l’infection ; (c) la phase intestinale ultérieure se terminant par l’élimination complète des parasites. Les infections expérimentales de souris par S. ratti permettent d’étudier précisément les interactions hôte-parasite tout au long du cycle de vie aux différents sites d’infection, ainsi que les stratégies d’évasion immunitaire employées par le parasite. Le protocole présenté ici décrit le maintien du parasite chez le rat Wistar, l’infection des souris de laboratoire, ainsi que la détection et la quantification des parasites S. ratti dans la phase de migration tissulaire et pendant la phase intestinale.
Introduction
L’helminthe Strongyloides stercoralis transmis par le sol provoque la strongyloïdose, une maladie souvent considérée comme la plus négligée parmi les maladies tropicales négligées1. Selon les estimations de 2020, il y aurait 600 millions d’infections à S. stercoralis dans le monde2. Les recherches en laboratoire sur S. stercoralis sont limitées car l’helminthe n’est pas capable de se développer au-delà des larves du troisième stade (L3) chez les souris 3,4. Par conséquent, le nématode spécifique des rongeurs Strongyloides ratti est couramment utilisé pour les études d’infection in vivo chez les sourisde laboratoire 5,6. S. ratti est un parasite naturel des rats sauvages, mais la plupart des souches de souris de laboratoire sont entièrement sensibles aux infections7. Cela permet d’étudier l’interaction hôte-pathogène et les réponses immunitaires dans différents tissus et stades vivants de l’helminthe.
Le cycle de laboratoire de S. ratti chez la souris peut être divisé en trois phases principales. Après l’injection sous-cutanée d’un nombre défini de larves infectieuses de troisième stade (iL3), généralement de 1000 à 2000, la majorité (environ 90 %) des larves L3 survivantes migrent vers la tête des souris au cours des deux premiers jours de l’infection, et seule une très petite fraction (environ 10 %) est récupérée dans le poumon8. S. ratti pénètre activement dans la peau de son hôte rongeur. Il est possible d’imiter cette voie d’infection naturelle en laboratoire en plaçant une goutte d’eau contenant iL3 sur la peau de souris et en permettant une infection percutanée active9. Cependant, l’efficacité de l’infection est beaucoup plus faible et le contrôle de la dose exacte d’infection n’est pas possible. La voie de migration exacte empruntée par S. ratti iL3, soit après une infection percutanée, soit sous-cutanée (s.c.), reste inconnue. Cependant, comme aucun ADN de S. ratti ne peut être détecté dans le sang ou les organes bien alimentés en sang, comme les reins des souris infectées8, la voie de migration primaire peut ne pas inclure la circulation sanguine. Pourtant, S. ratti ne migre pas de manière aléatoire dans tous les tissus. Au contraire, plusieurs études utilisant l’histologie chez les souris3, 10 et les rats11 ou la quantification de l’ADN viable dérivé de L3 et de S. ratti récupéré dans divers tissus8 fournissent des preuves que S. ratti L3 migre du site d’infection directement à travers la peau et les tissus musculaires principalement vers la région nasofrontale de la tête.
Environ 10 % des larves injectées survivent à la migration tissulaire et atteignent la tête chez les souris C57BL/6 et BALB/c qui présentent des nombres L3 comparables dans le tissu de la tête12. On pense que les larves sont avalées pour atteindre l’intestin au jour 3 après l’infection (p.i.). Ils s’incrustent dans la muqueuse de l’intestin grêle, muent en parasites femelles adultes et commencent à se reproduire par parthénogenèse entre le jour 5 et le jour 6 p.i.13. Les œufs, mais la plupart des larves de premier stade (L1) déjà écloses, sont libérés dans l’intestin et sont sécrétés par des excréments. Le pic du nombre de femelles adultes est atteint vers le jour 6 p.i.14. Il est intéressant de noter que les souris C57BL/6 présentent une charge parasitaire intestinale 2 à 5 fois plus élevée que les souris BALB/c, malgré un nombre comparable de L3 migrant dans la tête chez les deux souchesde souris 12. Au cours de la première semaine, la charge parasitaire intestinale chez les souris C57BL/6 immunocompétentes et les souris knock-out RAG1 (KO) dépourvues de lymphocytes B et T est similaire, ce qui suggère que le contrôle précoce du parasite est médié par l’immunité innée12,15. Dans la dernière phase, les parasites sont expulsés de l’intestin en 2 à 4 semaines par an chez les souris immunocompétentes (examiné dans6). Les souris RAG1 KO ne sont pas en mesure d’éliminer l’infection et contiennent un faible nombre d’adultes femelles viables et reproductrices dans l’intestin grêle jusqu’à 1 an12.
Après une première infection résolue ou une immunisation par de la L3 irradiée, les souris immunocompétentes C57BL/6 et BALB/c sont semi-résistantes à la réinfection. Seulement 1 % de l’iL3 initialement inoculé atteint la tête, et seulement environ 1 à 5 parasites adultes peuvent être récupérés de l’intestin lors d’une deuxième infection8. Ainsi, l’utilisation de l’infection biologique de souris par S. ratti fournit un outil pour étudier l’impact du système immunitaire inné et adaptatif au cours du cycle de vie complet d’un nématode intestinal avec des phases de migration tissulaire.
Dans ce manuscrit, nous fournissons une description détaillée du maintien du cycle de vie de S. ratti chez les rats Wistar ainsi que de l’infection expérimentale des souris et de la quantification de la charge parasitaire aux différents sites d’infection. En quantifiant exactement la charge du parasite S. ratti dans les tissus de la tête et des poumons ainsi que dans l’intestin de souris expérimentales, il est possible de disséquer le rôle de certains effecteurs immunitaires contre le stade de migration tissulaire ou le stade de vie intestinal de ce nématode parasite. Les réponses immunitaires chez les souris de type sauvage et les souris dépourvues de cellules effectrices, de récepteurs ou de médiateurs immunitaires spécifiques d’intérêt peuvent être comparées, comme expliqué en détail dans la discussion 5,6.
Protocole
Les expériences sur les animaux ont été menées conformément à la loi allemande sur le bien-être des animaux, et les protocoles expérimentaux ont été approuvés par l’autorité allemande (Behörde für Gesundheit und Verbraucherschutz) de l’État de Hambourg. La figure 1 donne un aperçu du maintien du cycle de vie de S. ratti chez les rats Wistar et de la production d’iL3 pour l’infection de souris ou de rats expérimentaux.
1. Préparation des larves infectieuses
- Préparez l’appareil Baermann comme illustré à la figure 1. Fermez le bas du tuyau à l’aide d’une pince à angle oblique et placez une lingette en tissu dans le tamis. Remplissez d’eau tiède (environ 35-37 °C) jusqu’à ce que le tamis soit recouvert d’eau.
- Remplissez le tamis avec le mélange d’excréments et de charbon de bois préparé comme décrit ci-dessous (étape 6). Le mélange doit être complètement recouvert d’eau.
- Allumez la lumière directement derrière l’appareil Baermann. Viable iL3 migrera activement via l’effacement.
- Après 30 minutes, les larves se sont installées au-dessus de la pince, rassemblez-les dans un tube de 50 ml en ouvrant brièvement la pince. Récupérez la pastille entière, mais assurez-vous que le volume est aussi petit que possible.
- Remplissez le tube de 50 mL avec du PBS contenant 1 % de pénicilline-streptomycine (PBS/Pen-Streptocoque) et laissez les larves se déposer au fond du tube par gravité à 4 °C pendant 30 min. Retirez délicatement le surnageant à l’aide d’une pipette et répétez l’étape de lavage 3 fois.
- Après la troisième étape de lavage, remettre la pastille en suspension dans 30 à 50 mL de PBS/Pen-Strep, selon la taille de la pastille. Transférez 1 μL gouttes de la solution sur une lame de microscopie. Agitez la solution immédiatement avant le pipetage car l’iL3 se dépose rapidement.
- Inspectez les gouttelettes au microscope inverse à un grossissement de 40x. L’iL3 doit se déplacer de manière vive. Comptez l’iL3 par gouttelette de 1 μL en 5 à 10 répétitions et calculez la moyenne par μL.
2. Infection des souris
REMARQUE : L’iL3 préparé peut être stocké dans du PBS/Pen-Strep à 4 °C dans un tube de 50 mL qui doit être conservé horizontalement pour éviter d’endommager l’iL3. La viabilité in vitro indiquée par le mouvement vif d’iL3 est inchangée jusqu’à 1 semaine entre nos mains. Comme il n’existe pas de comparaison systématique de l’infectiosité du L3 après différentes durées de stockage, nous utilisons de l’iL3 fraîchement préparé et de l’iL3 stocké pendant un maximum de 24 heures après la préparation comme étalon interne. Des infections par des lots iL3 plus anciens sont possibles. Cependant, il est obligatoire d’utiliser le même lot d’iL3 pour l’infection de différents groupes au sein d’une même expérience. Les infections des souris doivent de préférence être faites par deux personnes, l’une tenant la souris et l’autre effectuant l’injection.
- Préparez un tube de centrifugation de 1,5 mL par souris contenant un total de 1000 iL3 (C57BL/6) ou 2000 iL3 (BALB/c) comptés comme décrit ci-dessus à l’étape 1.7 dans PBS/Pen-Strep qui ont été préparés à l’aide de l’appareil de Baermann comme expliqué ci-dessus (étape 1). Agitez soigneusement entre les étapes de pipetage car l’iL3 se dépose rapidement.
- Laissez l’iL3 se déposer par gravité pendant 20 à 30 min à température ambiante (RT) et aspirez le surnageant avec une seringue de 0,5 mL aussi complètement que possible, en laissant environ 30 μL de suspension iL3 dans le tube. Remettez l’iL3 en suspension à l’aide d’une seringue de 0,5 mL (28G) ou en agitant le tube et aspirez le reste de la suspension.
REMARQUE : Les iL3 sont moins susceptibles de coller au plastique humide que la seringue sèche. Par conséquent, il est avantageux d’utiliser la même seringue pour enlever le surnageant. - Les souris n’ont pas besoin d’être anesthésiées pour l’infection. Ramassez les souris avec la peau et attrapez l’un de leurs pieds arrière. Utiliser le C57BL/6 femelle et mâle âgé de plus de 8 semaines et pesant au moins 20 g. Injectez toute la solution contenant l’iL3 par voie sous-cutanée dans le coussinet plantaire à un angle plat. Rétractez lentement la seringue pour éviter de renverser la suspension de larves du site de ponction. Un très petit dôme contenant le liquide se formera. Celle-ci sera absorbée par elle-même.
REMARQUE : L’infection sous-cutanée dans le coussinet plantaire plutôt que dans le flanc ou la nuque imite l’infection naturelle par iL3, qui vit dans la terre humide fertilisée avec des excréments et pénètre activement la peau intacte. De plus, le premier ganglion lymphatique drainant (LN) est défini comme le LN poplité. Ce LN peut être utilisé pour l’analyse des changements immunologiques précoces (c’est-à-dire au jour 2 p.i.), par exemple, l’expansion des lymphocytes T régulateurs Foxp3+ en réponse à l’infection, comme le montrela figure 16.
3. Comptage de l’iL3 dans la tête et les poumons des souris infectées
- Pour l’analyse de la charge larvaire dans les tissus, sacrifiez les souris le jour 1-3 p.i., car le pic de charge larvaire se situe au jour 2 p.i.8,12. Effectuer l’euthanasie par narcose de surdosage de CO2. Après l’absence de cornée et de réflexes interdigitaux, effectuez une luxation cervicale.
- Vaporisez l’abdomen et le cou avec un désinfectant commercial et coupez la peau de l’abdomen avec des ciseaux. Tirez la peau vers l’arrière pour révéler la paroi abdominale antérieure et coupez le long de la ligne médiane pour ouvrir la cavité péritonéale. Coupez le diaphragme et ouvrez les côtes des deux côtés pour exposer le poumon dans la cavité pleurale.
- Prélever les lobes pulmonaires dans une plaque à 24 puits divisée par des lignes contenant 1 mL d’eau du robinet. Tracez ou imprimez les lignes sur la plaque à une distance d’environ 4 mm. La distance entre les lignes doit permettre de voir les deux lignes en même temps à un grossissement de 40x.
- Coupez le poumon entier en six morceaux d’environ 0,75 cm x 0,75 cm.
- Coupez la tête avec des ciseaux à os. Retirez la peau et la fourrure à l’aide des doigts. Essayez d’enlever le moins de tissu musculaire possible.
- Disséquez toute la tête (y compris le cerveau et les os) en quatre quartiers derrière les yeux et longitudinalement au milieu de la tête (voir la figure 2C). Placez les quadrants antérieur et postérieur dans un puits d’une plaque à 6 puits marquée par des lignes contenant 2 mL d’eau du robinet. Placez le mouchoir avec les coupures vers le bas dans l’eau.
REMARQUE : Habituellement, cette approche donne un enregistrement exact du nombre de larves migrant du tissu ciffau. Si une analyse distincte des nombres L3 dans le cerveau est nécessaire, l’étape 3.7 peut être incluse. - Si une analyse distincte du cerveau est souhaitée, retirez la peau de la tête à l’aide des doigts. Ensuite, utilisez des ciseaux pour percer la calotte crânienne entre les yeux. À partir de cette incision, ouvrez le haut du crâne sagittal avec des ciseaux inutilisés ou soigneusement nettoyés. Pour exposer le cerveau, ouvrez les calottes droite et gauche avec une pince à épiler. À l’aide d’une spatule, soulevez le cerveau de l’avant vers le haut et coupez les cordons nerveux avec des ciseaux propres. Retirez le cerveau et transférez-le dans une plaque à 24 puits marquée par des lignes contenant de l’eau du robinet.
- Placez les plaques dans un incubateur à 37 °C. Incuber pendant 3 h en remuant les assiettes toutes les heures (h) 10x. Après l’incubation, remuez une dernière fois, retirez les parties de tissu restantes avec une pince des puits et jetez le tissu.
- Comptez complètement toutes les larves dans l’eau restante dans les puits à l’aide d’un microscope inversé avec un grossissement de 40x en vous déplaçant le long des lignes tracées au fond du puits. Comptez les larves migratrices de tissus le même jour pour augmenter la responsabilité des résultats.
4. Comptage des parasites S. ratti dans l’intestin des souris infectées
- Pour l’analyse de la charge parasitaire dans le sacrifice intestinal des souris le jour p.i. d’intérêt, utilisez le jour 3-21 p.i. pour une cinétique complète. Le pic de la charge parasitaire chez les souris C57BL/6 et BALB/c dans l’intestin grêle se situe au jour 6 p.i.14. Effectuer l’euthanasie par narcose de surdosage de CO2 . Après l’absence de cornée et de réflexes interdigitaux, effectuez une luxation cervicale.
- Trempez la région abdominale des souris dans un désinfectant et coupez la peau de l’abdomen. Tirez la peau vers l’arrière pour révéler la paroi abdominale antérieure et coupez le long de la ligne médiane pour ouvrir la cavité péritonéale.
- Retirez tout l’intestin en coupant entre l’estomac et le duodénum proximal, ainsi qu’entre le côlon et l’anus (voir Figure 3B). Retirez doucement l’intestin avec les doigts et placez-le dans une boîte de Pétri contenant de l’eau du robinet.
- Ouvrez l’intestin longitudinalement et rincez les matières fécales et le mucus en secouant vigoureusement dans l’eau du robinet pendant au moins 10 s. Une fraction mineure des parasites adultes et une partie de L1 seront éliminées, mais les parasites viables L4 et S. ratti adultes sont intégrés dans la muqueuse de l’intestin chez les souris de type sauvage (WT) et ne seront pas éliminés par cette étape de lavage.
- Si vous vous intéressez, divisez davantage l’intestin comme décrit ci-dessous.
- Isolez le duodénum par une incision après la deuxième plaque de Peyer (environ 2-3 cm). Isolez l’iléon par deux incisions, l’une au niveau de la première et l’autre au niveau de la seconde plaque de Peyer (environ 1 à 2 cm). Isolez le jéjunum après avoir isolé le duodénum et l’iléon, car il s’agit de la section restante.
- Divisez le jéjunum en trois sections égales pour permettre une définition très précise de la localisation du parasite. Isolez le cæcum entre l’iléon et le côlon. Isolez le côlon en coupant après le cæcum. La majorité des parasites adultes se trouvent dans le premier tiers de l’intestin grêle (voir figure 3B).
- Transférez les parties intestinales nettoyées dans des tubes de 50 ml contenant 20 ml d’eau du robinet. Placer horizontalement dans l’incubateur à 37 °C pendant 3 h. Agitez très vigoureusement pendant 10 s toutes les heures.
- Après 3 h d’incubation, retirez le tissu de l’eau. Placez les tubes à la verticale à RT, et les parasites sédimentent par gravité en 30 min.
- Retirer le surnageant jusqu’à ce qu’il reste environ 5 ml d’eau. Remplissez jusqu’à 25 ml d’eau du robinet pour répéter l’étape de lavage. Pour l’analyse de l’intestin grêle, répétez cette étape de lavage une autre fois pour avoir une bonne visibilité au microscope.
- Lorsque la visibilité est bonne, aspirez le surnageant jusqu’à ce qu’il reste environ 5 ml d’eau et transférez le liquide dans deux puits par intestin de souris dans une plaque à 6 puits marquée par des lignes, comme expliqué pour compter les larves dans la tête.
- Comptez les parasites femelles adultes au microscope inversé avec un grossissement de 40x en vous déplaçant le long des lignes tracées au fond des puits. Comptez les parasites le jour du sacrifice. Comptez les parasites le plus rapidement possible, car une incubation prolongée dans l’eau entraînera leur mort et leur désintégration.
REMARQUE : En plus des larves du quatrième stade et des parasites adultes, L1 peut également être détecté ici à partir du 5e jour environ p.i. Ceux-ci sont beaucoup plus petits et beaucoup plus abondants que les parasites L4 et adultes et doivent être distingués facilement.
5. Entretien de S. ratti chez les rats Wistar
REMARQUE : Les infections chez les rats doivent de préférence être effectuées par deux personnes, une personne tenant les rats et une autre effectuant l’injection. Pour maintenir le cycle parasitaire, des rats Wistar âgés de 4 à 8 semaines sont infectés.
- Préparez un tube de centrifugation de 1,5 mL par rat contenant 2500 iL3 dans PBS/Pen-Strep en utilisant l’appareil de Baermann comme expliqué précédemment. Agitez soigneusement entre les étapes de pipetage car les larves se déposent rapidement.
- Laissez les larves se déposer par gravité pendant 20 à 30 minutes (RT) et aspirez le surnageant dans une seringue de 0,5 mL (28G) jusqu’à ce qu’il reste environ 200 μL de suspension de larves.
- Pour les infections, placez les rats dans le creux du bras d’une personne et fixez la tête doucement et soigneusement là. L’autre personne saisit doucement le flanc du rat et injecte la suspension iL3 en suspension par voie sous-cutanée dans le pli nucal.
6. Culture du charbon de bois
- Conservez les rats infectés dans des cages contenant plusieurs couches de cellulose et moins de litière à partir des jours 5 et 12 après l’infection. Cet échange de litière contre plusieurs couches de cellulose est effectué afin de faciliter la collecte des matières fécales par rapport à la collecte des matières fécales de la litière
- Aux jours 6 à 8 et 13 à 15 p.i., transférez les rats dans une cage fraîche et recueillez tous les excréments de l’ancienne cage en ramassant les granules d’excréments des cages après avoir transféré les rats dans des cages fraîches et les avoir regroupés d’une cage dans un tube de 50 ml. Recueillir les matières fécales pendant 2 semaines p.i. avant l’établissement de la réponse immunitaire réduit la charge larvaire dans les matières fécales. Après 2 semaines par jour, les rats sont euthanasiés par narcose de surdosage de CO2 . Après l’absence de cornée et de réflexes interdigitaux, effectuez une luxation cervicale.
REMARQUE : Les rats immunodéprimés et les gerbilles de Mongolie maintiennent des infections à S. ratti pendant de plus longues périodes17,18. En étudiant la réponse immunitaire et l’immunomodulation au cours de l’infection à S. ratti, nous avons décidé de maintenir le cycle chez les hôtes immunocompétents pour maintenir la pression de sélection de l’immunité intacte de l’hôte. - Utilisez les échantillons de matières fécales collectés pour préparer des cultures de charbon de bois, ce qui permettra le développement de l’iL3 à partir de la L1 présente dans les fèces.
- Prétrempez le charbon de bois avec de l’eau du robinet. Avant d’utiliser du charbon de bois pour les cultures, remplissez-le dans un tamis et lavez-le sous l’eau courante du robinet jusqu’à ce que l’eau soit claire. Gardez le charbon de bois humide en tout temps. Faites tremper le charbon de bois pendant au moins 24 h avant de l’utiliser.
- Mélangez les matières fécales avec du charbon actif pré-trempé dans un rapport d’environ 1:1. Disposez le mélange avec un dégradé en diagonale et couvrez-le d’une autre couche de charbon actif dans un bécher en verre plat pour atteindre un rapport final de 1:2.
REMARQUE : L’incubation des matières fécales avec du charbon actif pré-trempé imite le sol humide dans lequel iL3 se développe dans la nature tout en empêchant une contamination fongique excessive. - Couvrez le récipient en verre d’un film transparent. Assurez-vous qu’il y a des trous d’aération pour permettre la circulation de l’air.
- Incuber pendant 6 à 7 jours à 25 °C à environ 90 % d’humidité sans CO2. Assurez-vous que l’incubateur contient un récipient d’eau pour garder les cultures humides. Conservez les cultures jusqu’à 14 jours à 25 °C si nécessaire. iL3 se développera directement ou indirectement19 et restera arrêté au stade iL3 jusqu’à l’infection.
Résultats
S. ratti migre du site de l’infection principalement vers la tête et plus tard vers l’intestin par une voie qui n’est pas exactement définie. Pour étudier la localisation exacte dans le tissu de la tête et l’intestin, les souris C57BL/6 ont été infectées avec 1000 iL3 dans le coussinet du pied postérieur gauche. Les souris ont été sacrifiées du 1er au 14e jour et les parasites S. ratti ont été quantifiés dans la tête, le cerveau et les poumons antérieurs et postérieurs, le cerveau et les poumons (Figure 2) ainsi que dans le duodénum, le jéjunum, l’iléon, le cæcum et le côlon (Figure 3).
Au jour 1 p.i., la première L3 a atteint la tête, montrant une distribution uniforme (Figure 2A). De plus, une petite fraction des larves a été récupérée dans les poumons au jour 1 p.i. (figure 2B). Le nombre de L3 a augmenté de façon marquée au jour 2 p.i. pour atteindre une moyenne de 174 L3 ± 13 dans la tête et une moyenne de 17 ± 1,7 dans le poumon. Ainsi, la majorité de la L3 (environ 90 %) est prélevée dans la tête et seulement environ 10 % dans les poumons. La plupart des larves L3 (moyenne de 93 ± 13,3) étaient localisées dans la face antérieure de la tête, mais aussi environ 41 ± 4,7 larves de L3 étaient localisées dans la face postérieure de la tête et environ 39 ± 5,8 dans le cerveau. Dans la lignée de cette observation, la présence de L3 dans le cerveau et le liquide céphalo-rachidien a été rapportée à 24 h p.i. et avec un maximum à 48 h p.i. chez les souris C57BL/6 après infection percutanée20. Une diminution nette des nombres totaux de L3 a été observée au jour 3 p.i. par rapport à la charge larvaire au jour 2 p.i., et aucune L3 n’a été prélevée dans les tissus de la tête au jour 4 p.i. (figure 2A). En conséquence, l’arrivée des parasites S. ratti a été détectée dans l’intestin au jour 4 p.i. (Figure 3A). Pour permettre une définition précise de la localisation du parasite, l’intestin a été subdivisé en segments distincts, c’est-à-dire le duodénum, le jéjunum, l’iléon, le cæcum et le côlon (Figure 3B). Le jour 4, p.i., la majorité des parasites de S. ratti étaient localisés dans le duodénum et les deux premiers tiers du jéjunum (figure 3A). Cette localisation a été constante jusqu’au jour 6 p.i. À partir du jour 7 p.i., la majorité des adultes de S. ratti étaient localisés dans le cæcum, où ils ont persisté jusqu’au jour 9 p.i. (figure 3A). Le nombre de parasites dans le cæcum a chuté à environ 20 au jour 11 et à 0 au jour 14. Nous n’avons pas récupéré un nombre significatif de parasites dans le côlon restant à aucun moment analysé, à l’exception d’environ 5 à 11 parasites au jour 11 p.i. Bien que la localisation des parasites S. ratti ait changé entre le jour 4 et le jour 9 p.i. et que la majorité des adultes aient été éjectés de l’intestin grêle après le jour 7 p.i., le nombre total de personnes récupérées dans l’intestin entier est demeuré constant jusqu’au jour 9. La L1 viable n’a pas été quantifiée, mais elle est détectable du jour 4 au jour 11, avec un pic le jour 6 (données non présentées).
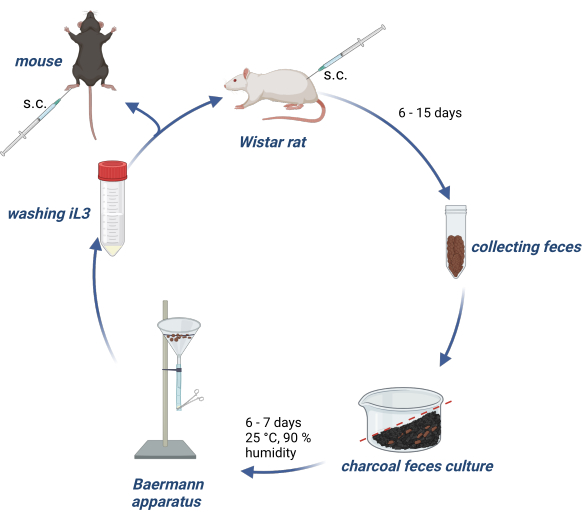
Figure 1 : Maintien du cycle de vie de S. ratti chez le rat et la souris. Les rats Wistar sont injectés s.c. dans le pli nucal avec 2500 iL3. Après 6 à 15 jours, leurs excréments sont recueillis, mélangés à du charbon actif imbibé d’eau, disposés avec un dégradé et recouverts d’un film transparent, y compris des trous d’air. Cette culture est incubée pendant 6 à 7 jours à 25 °C et 90 % d’humidité. Les iL3 sont isolés à l’aide de l’appareil de Baermann et lavés 3 fois avec du PBS/Pen-Strep. Des souris expérimentales sont injectées avec 1000 iL3 par voie sous-cutanée dans le coussinet du pied arrière. Créé avec BioRender.com. La figure 1 a été créée dans BioRender. Linnemann, L. (2024) https://BioRender.com/g80l370. Veuillez cliquer ici pour voir une version agrandie de cette figure.
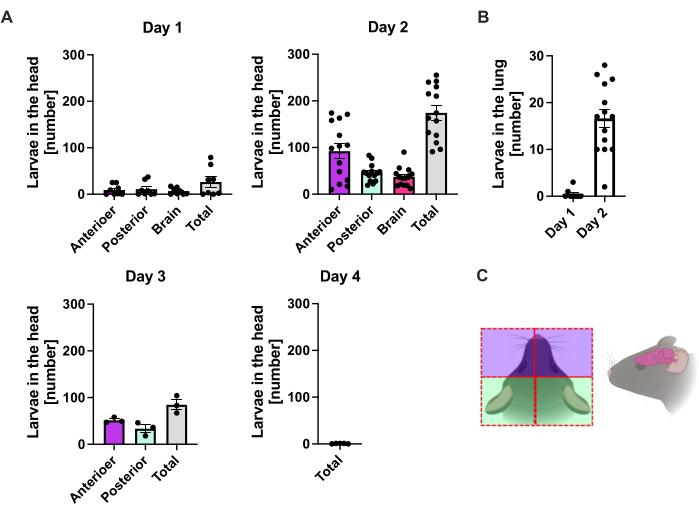
Figure 2 : Quantification de S. ratti dans les tissus pulmonaires et cintempestiques au fil du temps. Les souris C57BL/6 ont été injectées par voie s.c. avec 1000 iL3 dans le coussinet du pied arrière. Les souris ont été sacrifiées aux points temporels indiqués, et les parasites S. ratti dans la tête (A) et (B) les poumons ont été comptés. Chaque symbole représente le nombre de L3 d’une souris individuelle ; le graphique à barres indique la valeur moyenne et les barres d’erreur indiquent SEM. Les graphiques montrent des données combinées provenant d’expériences individuelles. Jour 1 : deux expériences indépendantes avec n=4 par point temporel et par expérience ; Jour 2 : Quatre expériences indépendantes avec n=4, n=4, n=6 et n=3 ; Jour 3 : Deux expériences indépendantes avec n=4 et n=3 ; Jour 4 : Une expérience avec n=5. (C) Dessin animé montrant les différentes régions de la tête utilisées pour l’isolement. La ligne pointillée rouge indique le chemin d’incision. La figure 2C a été créée dans BioRender. Linnemann, L. (2024) https://BioRender.com/t83e660. Veuillez cliquer ici pour voir une version agrandie de cette figure.
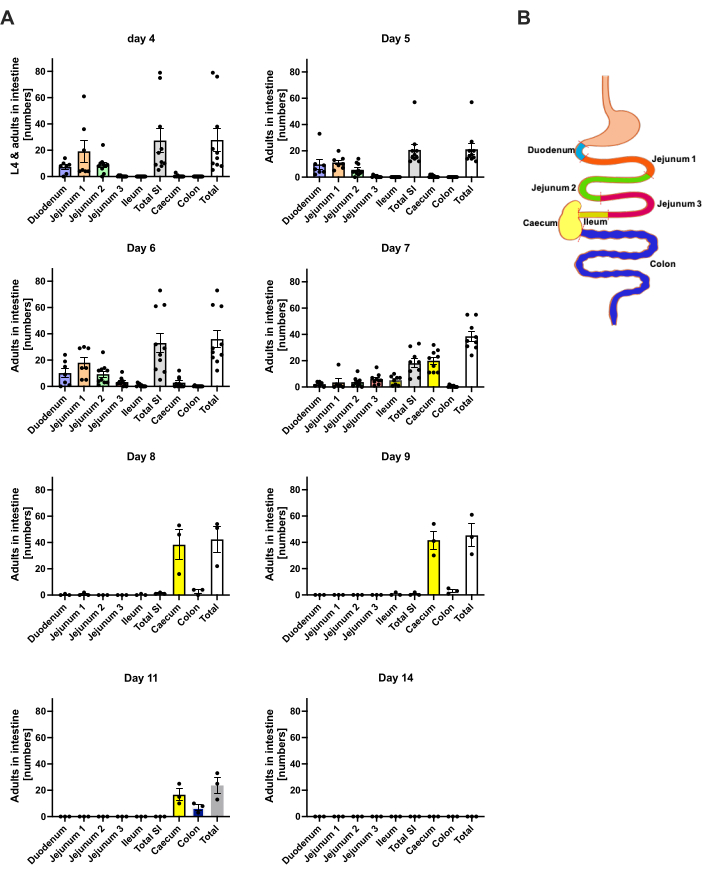
Figure 3 : Quantification de S. ratti dans les régions intestinales au fil du temps. Des souris C57BL/6 mâles ont reçu une injection s.c. de 1000 iL3 dans le coussinet du pied arrière. (A) Les souris ont été sacrifiées aux points temporels indiqués, et les parasites S. ratti, à l’exception de L1, ont été dénombrés dans les régions suivantes : duodénum, jéjunum 1-3, iléon, cæcum et côlon. (B) Vue d’ensemble schématique des différentes régions intestinales. Chaque symbole représente le nombre de parasites d’une souris individuelle ; le graphique à barres indique la moyenne, et les barres d’erreur indiquent le MEB. Jour 4 : deux expériences indépendantes avec des souris n=4 et n=6 ; Jour 5 : deux expériences indépendantes avec n=4 et n=6 ; Jour 6 : deux expériences indépendantes avec n=4 et n=6 ; Jour 7 : deux expériences indépendantes avec n=6 et n=3 ; Jours 8 à 14 : une expérience avec n=3. SI : intestin grêle. La figure 3B a été créée dans BioRender. Linnemann, L. (2024) https://BioRender.com/h27y297. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
L’infection de souris expérimentales par S. ratti représente un excellent modèle pour étudier la nature des réponses immunitaires protectrices aux infections par les helminthes à plusieurs sites et stades de l’immunité. À l’aide de différentes lignées de souris KO et de modèles de déplétion cellulaire ou cytokinique, le rôle de cellules immunitaires, de médiateurs ou de récepteurs spécifiques peut être étudié dans un modèle d’infection helminthique aiguë. La possibilité de quantifier la charge parasitaire dans la tête ainsi que dans l’intestin offre la possibilité de différencier le rôle des cellules immunitaires et des effecteurs dans divers tissus et phases du cycle de vie du parasite. L’appauvrissement de types cellulaires spécifiques par des injections d’anticorps permet d’étudier leur rôle, en particulier au cours de la réponse immunitaire intestinale si le traitement d’épuisement commence après la fin de la phase de migration tissulaire. Si vous le souhaitez, l’intestin peut être subdivisé en duodénum, jéjunum, iléon, cæcum et côlon pour détecter même des changements mineurs dans la localisation du parasite ou la cinétique d’élimination. Il convient de noter que la variation inter- et intra-expérimentale dans ces expériences d’infection, même chez les souris consanguines, est assez élevée, reflétant la variation introduite par l’interaction du parasite et de l’hôte ainsi que par différents lots de S. ratti L3 présentant une efficacité infectieuse différente (voir Figure 2 et Figure 3). Pour réduire la variabilité, l’âge et le sexe des souris expérimentales doivent être similaires. De plus, si l’on compare les souris KO et WT, il est fortement conseillé d’utiliser des témoins de portées au lieu de souris WT dérivées d’une colonie de reproduction indépendante. Néanmoins, si des tailles d’échantillon suffisantes sont utilisées, il est possible de générer des résultats fiables comparant la charge parasitaire chez les souris déficientes ou compétentes pour certains effecteurs, ce qui permet d’obtenir une image claire des effecteurs immunitaires impliqués dans la réponse immunitaire protectrice à S. ratti (examiné dans 6).
L’une des principales caractéristiques distinctives de S. ratti par rapport à d’autres modèles d’infection par des nématodes, tels que S. venezuelensis ou N. brasiliensis, est la voie de migration unique des larves à l’intérieur de l’hôte. Contrairement à N. brasiliensis et S. venezuelensis, dont les cycles de vie contiennent tous deux une phase pulmonaire 21,22,23, S. ratti contourne principalement les poumons et migre à travers les tissus musculaires et cutanés jusqu’à la tête 8,12. Seulement environ 10 % des parasites survivants au jour 2 p.i. se trouvent dans les poumons. Pendant ce temps, la localisation de S. ratti dans la tête se concentre sur la région nasofrontale, conformément aux études précédentes8. Ces caractéristiques font de S. ratti un modèle précieux pour l’étude des interactions hôte-parasite, en particulier dans la peau et les tissus musculaires ainsi que dans les tissus drainant les ganglions lymphatiques et permet d’étudier les réponses immunitaires qui peuvent être obscurcies ou compliquées par une atteinte pulmonaire prolongée comme dans d’autres modèles d’infection par les nématodes. Il est frappant de constater que S. ratti L3 est également extrait du liquide céphalo-rachidien20 et du cerveau (Figure 2A), bien que les symptômes neurologiques induits par l’infection ou la mort soient relativement rares et n’aient jamais été observés dans notre animalerie. Des recherches futures pourraient déterminer si ces parasites localisés dans le cerveau sont piégés ou s’il existe un chemin vers l’intestin.
Le genre Strongyloides a également la capacité unique de former des générations libres entre les générations parasites24. Ces stades de vie libre de S. ratti, ainsi que sa reproduction par pathogenèse, facilitent en outre la génération de larves transgéniques. L’utilisation de micro-injections chez des femelles libres a permis de générer des larves exprimant des antigènes modèles comme 2W1S fusionnés à une protéine fluorescente verte. Bien que l’expression de l’épitope ait été perdue pendant la mue chez les adultes, elle a permis de suivre et de caractériser les lymphocytes T CD4+ spécifiques de S. ratti dans le poumon et les ganglions lymphatiques médiastinaux drainantspulmonaires 25. Cette approche constitue un excellent outil pour étudier la biologie des lymphocytes T CD4+ dans le contexte des infections par les helminthes et de la mise au point d’un vaccin contre les helminthes.
S. ratti est un organisme modèle polyvalent pour la recherche immunologique sur les parasites helminthiques qui présentent des stades de migration tissulaire et de vie intestinale en général. Les infections humaines à S. stercoralis sont marquées par une chronicité extrême en raison de l’auto-infection qui se produit, qui peut également conduire au syndrome d’hyperinfection chez les hôtes immunodéprimés, principalement les patients recevant un traitement aux glucocorticoïdes après la transplantation26. Il convient de noter que cet aspect de l’auto-infection et de l’hyperinfection est difficile à modéliser chez la souris. Ni RAG1 KO infectée par S. ratti ni les souris nues 5,27 ne sont sensibles à l’hyperinfection. Il convient de noter qu’un modèle murin d’hyperinfection à S. stercoralis a été établi à l’aide de souris sévèrement immunodéprimées traitées aux glucocorticostéroïdes (NOD.Cg-PrkdcscidIl2rgtm1Wjl/SzJ), ce qui pourrait permettre d’analyser au moins des aspects du syndrome d’hyperinfection chez les souris28.
Néanmoins, des études utilisant l’infection à S. ratti chez la souris ont démontré que les éosinophiles et les neutrophiles jouent un rôle non redondant dans l’éradication des larves migratrices des tissus. L’épuisement ou l’absence chez les souris génétiquement modifiées a entraîné un nombre élevé de L3 dans la tête8. Alors que les mastocytes et les granulocytes basophiles étaient superflus pendant la phase de migration tissulaire, les mastocytes et les basophiles contribuaient tous deux à contrôler la charge parasitaire intestinale. Leur absence n’a pas affecté le nombre de L3 dans les tissus, mais a augmenté le nombre de parasites adultes S. ratti dans l’intestin au jour 6 p.i.12,29. Une analyse plus poussée a révélé que l’absence de basophiles ou de mastocytes sélectifs du tissu conjonctif permettait de mettre fin à l’infection avec la cinétique WT. En revanche, les souris dépourvues de tissu conjonctif et de mastocytes muqueux sont restées infectées pendant 20 semaines12. Ces résultats ont révélé un rôle central des mastocytes de la muqueuse dans la terminaison finale de l’infection, soulignant la valeur de ce modèle d’infection dans l’élucidation de la fonction des mastocytes de la muqueuse pendant l’infection par les helminthes. La définition plus poussée des modifications potentielles de la localisation intestinale des parasites S. ratti en l’absence de certaines cellules effectrices immunologiques aidera à définir encore plus précisément leur fonction dans l’immunité anti-helminthes.
De plus, les mécanismes d’évasion immunitaire employés par les helminthes pour faciliter leur survie peuvent être étudiés dans ce système. Il a été démontré que l’épuisement des lymphocytes T régulateurs Foxp3+ ou la délétion d’un récepteur régulateur sur les lymphocytes T effecteurs, qui étaient tous deux induits lors de l’infection à S. ratti, réduisaient la charge parasitaire au jour 6 p.i. et la production larvaire tout au long de l’infection 15,16,30,31. De plus, il a été possible de définir l’intestin comme le tissu ciblé par l’évasion immunitaire et l’activation des mastocytes médiée par l’IL-9 comme la voie immunitaire supprimée. Enfin, le mécanisme de l’initiation de l’immunité de type 2 médiée par l’ILC2 par des cytokines alarmines dérivées de tissus telles que l’IL-33 peut être étudié à l’aide de suppresseurs et d’amplificateurs de l’IL-3332 endogène.
L’isolement d’un grand nombre d’iL3 via le Baermann offre la possibilité d’études in vitro supplémentaires. Les co-cultures de L3 avec des cellules immunitaires ou des candidats médicaments potentiels permettent d’étudier directement les effets sur la viabilité et la motilité de la L3. La restimulation ex vivo de cellules isolées de souris infectées avec du lysat d’antigène de S. ratti ou de la L3 viable fournit une plate-forme pour étudier la production de cytokines dans divers types de cellules. Enfin, les fractions protéiques et lipidiques de L3 peuvent être utilisées pour l’identification de motifs moléculaires associés à des agents pathogènes dérivés de S. ratti ou de molécules effectrices immunomodulatrices
Alors que les infections par les helminthes représentent toujours un lourd fardeau pour la santé à l’échelle mondiale, la recherche visant à élucider davantage les réponses immunitaires induites par les helminthes et le mécanisme d’évasion employé par les parasites reste essentielle pour améliorer les options de traitement et développer des stratégies préventives telles que les vaccinations. L’infection à S. ratti chez la souris présente un modèle polyvalent pour la recherche sur les interactions helminthe-hôte au cours d’un modèle d’infection aiguë.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts. Le modèle de langage Perplexity AI 2024 a été utilisé pour réviser les brouillons de texte et améliorer les formulations.
Remerciements
Ce travail a été soutenu par la Fondation Jürgen Manchot et l’Association allemande de recherche (subventions BRE 3754/6-1 et BRE 3754/10-1). Les figures 1, 2C et 3B ont été créées en BioRender.com.
matériels
| Name | Company | Catalog Number | Comments |
| 50 ml tubes | Sarstedt, N mbrecht, DE mbrecht, DE | 6,25,47,254 | 50 ml https://www.sarstedt.com/produkte/labor/reagenz-zentrifugenroehren/roehren/produkt/62.547.254/ |
| BD Micro-Fine U100 Insulin 0.5 ml | BD Bioscience | 7468077 | 0.5 ml https://www.bestimed.de/bd-micro-fine-insulinspritze-05-ml-u100-8-mm-100x05ml-324825.html |
| centrifugeation tubes | Sarstedt, Nümbrecht, DE | 72,706 | 1.5 ml https://www.sarstedt.com/produkte/labor/mikro-schraubroehren-reagiergefaesse/reagiergefaesse/produkt/72.706/ |
| Charcoal | Roth | 0998.3 | 5 kg https://www.carlroth.com/de/de/aktivkohle/aktivkohle/p/0998.3 |
| Falcon 6-well Clear Flat Bottom, not treated cell multiwell culture plate, with Lid, sterile | Corning | 351146 | 6-well https://www.corning.com/emea/de/search.html?_cookie=false &searchText=351146&search-initialcatalog =Corporate+Communications& initialResultType=products |
| Freezer & Refrigerator | Liebherr-Hausgeräte, Rostock, DE | ||
| Greiner Bio-One 24-Well-Platten für Zellkulturen aus Polystyrol | Fisher Scientific | 10177380 | 24-well https://www.fishersci.de/shop/products/polystyrene-24-well-cell-culture-multiwell-plate/10177380#?keyword=24-well |
| Incidin Premium Wipes | Ecolab Healthcare | 100 10 279 | https://www.ecolabhealthcare.de/website/seiten/produkte/flaechendesinfektion/tuecher/incidin_premium_wipes.php |
| Incubator 25°C | Heraeus Instruments, Hanau, DE | ||
| Incubator 37°C | Heraeus Instruments, Hanau, DE | ||
| Microscope | Helmut Hund, Wetzlar, DE | 4 x objectiv lens, 10 x ocular lens | |
| Parafilm M | Parafilm | 11772644 | 4 in. X 125 ft. https://www.fishersci.de/shop/products/parafilm-m-laboratory-wrapping-film-2/11772644 |
| Penicillin/Streptomycin (Pen-Strep) | Capricorn | PS-B | 100x https://www.capricorn-scientific.com/en/shop/penicillin-streptomycin-pen-strep-100x~p1205 |
| ROTI Fair 10x PBS 7.4 | Roth | 1105.1 | https://www.carlroth.com/de/de/fertigloesungen-tabletten-portionsbeutel/rotifair-10x-pbs-7-4/p/1105.1 |
Références
- Olsen, A., et al. Strongyloidiasis - the most neglected of the neglected tropical diseases. Trans Royal Soc Tropical Med Hygiene. 103 (10), 967-972 (2009).
- Buonfrate, D., et al. The global prevalence of Strongyloides stercoralis infection. Pathogens. 9 (6), 468 (2020).
- Dawkins, H. J. S., Grove, D. I. Attempts to establish infections with Strongyloides stercoralis in mice and other laboratory animals. J Helminthol. 56 (1), 23-26 (1982).
- Abraham, D., et al. Strongyloides stercoralis: protective immunity to third-stage larvae inBALB/cByJ mice. Exp Parasitol. 80 (2), 297-307 (1995).
- Breloer, M., Abraham, D. Strongyloides infection in rodents: immune response and immune regulation. Parasitology. 144 (3), 295-315 (2017).
- Breloer, M., Linnemann, L. Strongyloides ratti infection in mice: immune response and immune modulation. Philosophical Trans Royal Society B. 379 (1894), 20220440 (2024).
- Dawkins, H. J. S., Grove, D. I., Dunsmore, J. D., Mitchell, G. F. Strongyloides ratti: Susceptibility to infection and resistance to reinfection in inbred strains of mice as assessed by excretion of larvae. Int J Parasitol. 10 (2), 125-129 (1980).
- Ehrens, A., et al. Eosinophils and neutrophils eliminate migrating Strongyloides ratti larvae at the site of infection in the context of extracellular DNA trap formation. Front Immunol. 12, 715766 (2021).
- Eschbach, M. L., et al. Strongyloides ratti infection induces transient nematode-specific Th2 response and reciprocal suppression of IFN-γ production in mice. Parasite Immunol. 32 (5), 370-383 (2010).
- Dawkins, H., Muir, G., Grove, D. Histopathological appearances in primary and secondary infections with Strongyloides ratti in mice. Int J Parasitol. 11 (1), 97-103 (1981).
- Tada, I., Mimori, T., Nakai, M. Migration route of Strongyloides ratti in albino rats. Jap J Parasit. 28 (4), 219-227 (1979).
- Reitz, M., et al. Mucosal mast cells are indispensable for the timely termination of Strongyloides ratti infection. Mucosal Immunol. 10 (2), 481-492 (2017).
- Viney, M. E., Lok, J. B. The biology of Strongyloides spp. WormBook. , 1-17 (2018).
- Reitz, M., et al. Interleukin-9 promotes early mast cell-mediated expulsion of Strongyloides ratti but is dispensable for generation of protective memory. Sci Rep. 8 (1), 8636 (2018).
- Breloer, M., et al. Cutting edge: The BTLA-HVEM regulatory pathway interferes with protective immunity to intestinal Helminth infection. J Immunol. 194 (4), 1413-1416 (2015).
- Blankenhaus, B., et al. Foxp3+ regulatory T cells delay expulsion of intestinal nematodes by suppression of IL-9-driven mast cell activation in BALB/c but not in C57BL/6 mice. PLoS Pathogens. 10 (2), e1003913 (2014).
- Niamatali, S., Nolan, T. J., Schad, G. A. . Can Autoinfection be Provoked in the Strongyloides ratt/-infected Gerbil, Meriones unguiculatus. 59 (2), 149-152 (1992).
- Gardner, M. P., Gems, D., Viney, M. E. Extraordinary plasticity in aging in Strongyloides ratti implies a gene-regulatory mechanism of lifespan evolution. Aging Cell. 5 (4), 315-323 (2006).
- Viney, M. E. Developmental switching in the parasitic nematode Strongyloides ratti. Proc Biol Sci. 263 (1367), 201-208 (1996).
- Dawkins, H. J., Thomason, H. J., Grove, D. I. The occurrence of Strongyloides ratti in the tissues of mice after percutaneous infection. J Helminthol. 56 (1), 45-50 (1982).
- Takamure, A. Migration route of Strongyloides venezuelensis in rodents. Int J Parasitol. 25 (8), 907-911 (1995).
- Filbey, K., Bouchery, T., Le Gros, G. The role of ILC 2 in hookworm infection. Parasite Immunol. 40 (2), e12429 (2018).
- Allen, J. E., Sutherland, T. E. Host protective roles of type 2 immunity: Parasite killing and tissue repair, flip sides of the same coin. Semin Immunol. 26 (4), 329-340 (2014).
- Dulovic, A., Puller, V., Streit, A. Optimizing culture conditions for free-living stages of the nematode parasite Strongyloides ratti. Exp Parasitol. 168, 25-30 (2016).
- Douglas, B., et al. Transgenic expression of a T cell epitope in Strongyloides ratti reveals that helminth-specific CD4+ T cells constitute both Th2 and Treg populations. PLOS Pathogens. 17 (7), e1009709 (2021).
- Vadlamudi, R. S., Chi, D. S., Krishnaswamy, G. Intestinal strongyloidiasis and hyperinfection syndrome. Clin Mol Allergy. 4 (1), 8 (2006).
- Viney, M., Kikuchi, T. Strongyloides ratti and S. venezuelensis- rodent models of Strongyloides infection. Parasitology. 144 (3), 285-294 (2017).
- Patton, J. B., et al. Methylprednisolone acetate induces, and Δ7-dafachronic acid suppresses, Strongyloides stercoralis hyperinfection in NSG mice. Proc Natl Acad Sci. 115 (1), 204-209 (2018).
- Reitz, M., Brunn, M. L., Voehringer, D., Breloer, M. Basophils are dispensable for the establishment of protective adaptive immunity against primary and challenge infection with the intestinal helminth parasite Strongyloides ratti. PLOS Neglected Trop Dis. 12 (11), e000699 (2018).
- Blankenhaus, B., et al. Strongyloides ratti infection induces expansion of Foxp3+ regulatory T cells that interfere with immune response and parasite clearance in BALB/c Mice. J Immunol. 186 (7), 4295-4305 (2011).
- Hartmann, W., Blankenhaus, B., Brunn, M. L., Meiners, J., Breloer, M. Elucidating different pattern of immunoregulation in BALB/c and C57BL/6 mice and their F1 progeny. Sci Rep. 11 (1), 1536 (2021).
- Meiners, J., et al. IL-33 facilitates rapid expulsion of the parasitic nematode Strongyloides ratti from the intestine via ILC2- and IL-9-driven mast cell activation. PLOS Pathogens. 16 (12), e1009121 (2020).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon