Method Article
نموذج 2.5D للتوصيف الميكانيكي Ex Vivo لتكوين الأوعية الدموية في الأنسجة الحية
In This Article
Summary
تنبت تكوين الأوعية الدموية ، وهو أمر أساسي للتطور والمرض ، ينطوي على عمليات جزيئية وميكانيكية معقدة. نقدم نموذجا متعدد الاستخدامات 2.5D ex vivo يحلل الإنبات الخلوي من الشرايين السباتية الخنازير ، ويكشف عن تكوين الأوعية المعتمدة على الصلابة وميكانيكا الخلايا المتميزة التي تتبع الزعيم. يساعد هذا النموذج في تطوير استراتيجيات هندسة الأنسجة وأساليب علاج السرطان.
Abstract
تنبت الأوعية الدموية هو تكوين أوعية دموية جديدة من الأوعية الدموية الموجودة مسبقا وهو ذو أهمية كبيرة للفسيولوجية مثل نمو الأنسجة وإصلاحها والعمليات المرضية ، بما في ذلك السرطان والورم الخبيث. العملية متعددة الخطوات لتكوين الأوعية الدموية هي عملية مدفوعة جزيئيا وميكانيكيا. وهو يتألف من تحريض البرعم الخلوي عن طريق عامل نمو البطانية الوعائية ، واختيار الخلية القائدة / التابعة من خلال إشارات الشق ، والهجرة الموجهة للخلايا البطانية ، واندماج الأوعية الدموية واستقرارها. تم تطوير مجموعة متنوعة من نماذج تكوين الأوعية الدموية الناعمة على مر السنين لفهم الآليات الأساسية للإنبات الخلوي بشكل أفضل. على الرغم من التقدم في فهم الدوافع الجزيئية لتكوين الأوعية الدموية ، إلا أن دور الإشارات الميكانيكية والمحرك الميكانيكي لتكوين الأوعية الدموية لا يزال غير مستكشف بسبب القيود المفروضة على النماذج الحالية. في هذه الدراسة ، صممنا نموذجا 2.5D ex vivo يمكننا من توصيف الخلايا التي تنبت ميكانيكيا من الشريان السباتي الخنازير باستخدام الفحص المجهري لقوة الجر. يحدد النموذج أنماط قوة مميزة داخل البرعم ، حيث تمارس الخلايا الرائدة قوى سحب وتمارس الخلايا التابعة قوى دفع على المصفوفة. يسمح تعدد استخدامات النموذج بمعالجة كل من الإشارات الكيميائية والميكانيكية ، مثل صلابة المصفوفة ، مما يعزز أهميته لمختلف البيئات المصغرة. هنا ، نوضح أن بداية تكوين الأوعية الدموية تعتمد على الصلابة. يقدم نموذج 2.5D المقدم لقياس قوى الجر الخلوي في تكوين الأوعية الدموية طريقة مبسطة ولكنها ذات صلة من الناحية الفسيولوجية ، مما يعزز فهمنا للاستجابات الخلوية للإشارات الميكانيكية ، والتي يمكن أن تعزز هندسة الأنسجة والاستراتيجيات العلاجية ضد تكوين الأوعية الدموية.
Introduction
تكوين الأوعية الدموية هو عملية تكوين أوعية دموية جديدة من الأوعية الدموية الموجودة مسبقا. هذه العملية ضرورية أثناء التطور الجنيني والتئام الجروح وتطور السرطان ، وكلها مرتبطة بالتغيرات الميكانيكية الحيوية في البيئة المكروية1،2،3،4. في بداية تكوين الأوعية الدموية ، تطلق الأنسجة الناقصة أو المصابة عامل نمو البطاني الوعائي (VEGF) الذي سينشط الخلايا البطانية للأوعية الدموية المجاورة لتشكيل براعم بطانية - حيث يتم اعتماد نمطين ظاهريين متميزان من القائد والتابع من خلال مسار إشارات الشق الجزيئي5. عند تكوين البراعم البطانية ، وهي ظاهرة تعرف باسم تكوين الأوعية الدموية ، ستعمل الخلايا الرائدة على تدهور المصفوفة خارج الخلية المحيطة بالهجرة بشكل جماعي نحو محفز VEGF دون فقدان التصاقات الخلايا الخلوية مع الخلايا اللاحقة6،7.
على مدى العقود الماضية ، كانت هناك أعداد متزايدة من فحوصات تكوين الأوعية الدموية المنبثقة الموصوفة والتي تبحث في الهجرة الجماعية للخلايا من خلال منهجيات مختلفة ، كل منها يقدم فوائد وقيودا مميزة. تقوم هذه المقايسات بتقييم الحركة المنسقة لمجموعات الخلايا ، مثل الخلايا البطانية ، من خلال المصفوفات ثلاثية الأبعاد ، مما يسمح بدراسة السلوكيات الخلوية مثل الإنبات والغزو والهجرة الجماعية في بيئة خاضعة للرقابة8،9،10. توفر فحوصات تكوين الأوعية الدموية في الجسم الحي تقييما شاملا داخل الكائن الحي ، وتلتقط التفاعلات المعقدة ، ولكنها تستغرق وقتا طويلا ، ومكلفة ، وعرضة للتقلبات العالية ، ويصعب تحديدها11،12. تسمح فحوصات تكوين الأوعية الدموية في المختبر بالتحكم الدقيق في الظروف التجريبية ذات قابلية التكرار العالية والقياس الكمي الدقيق ولكنها قد لا تتكرر بشكل كامل في التعقيدات في الجسم الحي 11،12،13. في المقابل ، تستخدم فحوصات تكوين الأوعية الدموية المنبثقة خارج الجسم الحي ، والتي يعد اختبار حلقة الأبهر هو النموذج الأكثر إجراؤا على نطاق واسع ، أنسجة خارج الكائن الحي ، مع الحفاظ على الأهمية الفسيولوجية مع تجنب المضاعفات في الجسم الحي 14،15،16. على الرغم من كونها صعبة من الناحية الفنية وتكافح أحيانا مع بقاء الأنسجة ، إلا أن نماذج ex vivo توفر توازنا قيما بين التعقيد والتحكم ، مما يجعلها نهجا واعدا لدراسة تكوين الأوعية الدموية. في حين تم استخدام هذه النماذج على نطاق واسع لدراسة الدوافع الجزيئية لتكوين الأوعية الدموية ، فإن تأثير الإشارات الميكانيكية والسلوك الميكانيكي للخلايا لا يزال غير مفهوم جيدا.
تعتمد الهجرة متعددة الخلايا أثناء نمو الأوعية الدموية بشكل كبير على الميكانيكا الخلوية ، حيث تنظم قوى الانقباض القائمة على actomyosin غزو الخلايا البطانية في المصفوفة خارج الخلية المحيطة17،18،19،20. على وجه التحديد ، لوحظ أن محركات الميوسين II غير العضلية ، وهي آلات الانقباض الرئيسية القائمة على الأكتين داخل الخلية21 ، تتحكم في قوى الانقباض الخلوية أثناء إنبات تكوين الأوعيةالدموية 22،23. من المحتمل أن تكون الخلية الرائدة هي العنصر السائد في توليد القوة في البرعم نظرا لأن تشوهات المصفوفة ثلاثية الأبعاد خارج الخلية المحيطة أعلى بكثير حول الخلية الرائدة ، وتحديدا النتوءات الخلوية القريبة الغنية بالأكتين23،24 ، مقارنة بأتباعها22،23،25. على الرغم من هذا الدليل المتزايد على أهمية الانقباض الخلوي في تكوين الأوعية الدموية في 3D ، إلا أنه لا توجد طريقة للتوصيف الميكانيكي الزماني المكاني للميكانيكا الخلوية لتكوين الأوعية الدموية.
الهدف العام من هذه الدراسة هو تطوير طريقة تسمح بالتوصيف الميكانيكي للهجرة الخلوية أثناء الإنبات. من خلال تحقيق التوصيف الزماني المكاني للقوى الميكانيكية في سياق ذي صلة بيولوجيا ، نهدف إلى تقديم رؤى جديدة حول كيفية تأثير الميكانيكا الخلوية على تكوين البرعم الوعائي تحقيقا لهذه الغاية ، قمنا بتطوير نظام نموذج 2.5D عن طريق إنشاء هيدروجيل ثنائي الأبعاد بولي أكريلاميد (PAA) ، وزرع ورقة شريانية سباتية عليه ، وتغطيته بطبقة رقيقة من هلام الكولاجين من النوع الأول لإنشاء بيئة ثلاثية الأبعاد موضعية للخلايا. هاجرت البراعم متعددة الخلايا من الصفيحة الشريانية على واجهة هلام الكولاجين PAA. تتمثل ميزة هذه الطريقة مقارنة بالتقنيات الحالية في أن الهيدروجيل 2D PAA يسمح بالتحليلات عن طريق الفحص المجهري لقوة الجر (TFM) - وهي تقنية متعددة الاستخدامات معروفة حيث تلتصق الخلايا بركيزة مرنة ثنائية الأبعاد وستشوه الركيزة بناء على قوى الجر الخلوي26. يمكن التقاط هذه التشوهات ، ويمكن حساب قوى الجر الخلوية بناء على الخصائص الميكانيكية للركيزة26. من خلال تكييف TFM للاستخدام في الأنسجة الحية خارج الجسم الحي ، نهدف إلى سد الفجوة بين التحكم في المختبر والأهمية في الجسم الحي ، مما يوفر فهما أكثر شمولا للقوى الميكانيكية أثناء تكوين الأوعية.
Protocol
تم استخدام الشرايين السباتية الخنازير في هذا البروتوكول. تم حصاد الشرايين السباتية الخنازير السباتية من الخنازير الهجينة الهولندية - التي تتراوح أعمارها بين 5-7 أشهر ووزنها (على قيد الحياة) 80-120 كجم - تم الحصول عليها من مسلخ محلي. كانت البروتوكولات متوافقة مع لوائح المفوضية الأوروبية 1069/2009 فيما يتعلق بالمواد الحيوانية في المسلخ للتشخيص والبحث كما تشرف عليها الحكومة الهولندية (وزارة الزراعة والطبيعة وجودة الأغذية الهولندية) وتمت الموافقة عليها من قبل السلطات القانونية المرتبطة برعاية (هيئة سلامة الأغذية والمنتجات الاستهلاكية). لم تكن الموافقة الأخلاقية مطلوبة حيث تم حصاد الأنسجة من المنتجات الثانوية للحيوانات التي تم إنهاؤها بالفعل. الوقت بين الموت ونقل الأنسجة هو 10-25 دقيقة ، اعتمادا على المسلخ.
ملاحظة: يلخص جدول المواد تفاصيل حول المواد والمعدات والكواشف المستخدمة في هذا البروتوكول. يتم وصف بروتوكولات العينات ثنائية الأبعاد وثلاثية الأبعاد في الملف التكميلي 1.
1. تحضير ركائز بولي أكريلاميد ثنائية الأبعاد (PAA)
- في غطاء الدخان ، قم بإعداد محلول ربط سيلان عن طريق خلط الإيثانول المطلق 12: 1: 1 (للتخليق) ، وحمض الخليك ، وربط السيلان عند 4286 ميكرولتر ، و 357 ميكرولتر ، و 357 ميكرولتر ، على التوالي. احتضان 120 ميكرولتر / محلول سيلان ربط جيدا على صفيحة زجاجية ذات قاع زجاجي 12 بئر لمدة ساعة واحدة في درجة حرارة الغرفة.
تنبيه: الإيثانول المطلق هو سائل وبخار شديد الاشتعال (H225) ويسبب تهيجا خطيرا للعين (H319). حمض الخليك هو سائل وبخار قابل للاشتعال (H226) ويسبب حروقا شديدة في الجلد وتلف العين (H314). ارتد معدات الحماية الشخصية واعمل في غطاء الدخان. - في غطاء الدخان ، اغسل اللوحة ذات القاع الزجاجي المكونة من 12 بئرا 3x بالإيثانول المطلق (الصناعي) باستخدام زجاجة رذاذ. تجاهل الإيثانول.
- جفف الصفيحة الزجاجية ذات 12 البئر باستخدام غاز النيتروجين. إذا ظهر زجاج أبيض أعلى قاع الزجاج ، فلن يكون الغسيل كافيا. أعد غسل الجزء السفلي من الزجاج 12 لوحة جيدا.
- تحضير خليط هلام PAA وفقا للنسب الواردة في الجدول 1.
- أضف PBS إلى أنبوب الطرد المركزي الدقيق وأعد تعليق 40٪ من الأكريلاميد و 2٪ ثنائي الأكريلاميد وعلامات الفلورسنت في خليط الجل. دوامة المحلول قبل تحضير الجل مباشرة.
- في أسرع وقت ممكن ، أضف 10٪ APS و TEMED إلى المحلول والدوامة بعد إضافة كل عنصر. قم بوضع قطرة من 11.5 ميكرولتر من خليط الجل على القاع الزجاجي لكل بئر وضع غطاء 13 مم برفق فوق القطرة.
- اضغط برفق على الطبق ولفه لتوزيع خليط الجل بالتساوي تحت الغطاء. إذا ظهرت فقاعات هواء ، فقم بإزالتها عن طريق رفع الغطاء برفق. اترك المواد الهلامية لبلمرة لمدة 1 ساعة في درجة حرارة الغرفة. تحقق من البلمرة باستخدام خليط الجل المتبقي في الأنبوب. ستعرض المواد الهلامية المبلمرة PAA في اللوحة المكونة من 12 بئرا هالة داخلية.
تنبيه: مادة الأكريلاميد ضارة إذا ابتلع أو إذا تم استنشاقه (H302 + H332) ، ويسبب تهيج الجلد (H315) ، وقد يسبب رد فعل تحسسي للجلد (H317) ، ويسبب تهيجا خطيرا للعين (H319) ، وقد يسبب عيوبا وراثية (H340) ، وقد يسبب السرطان (H350) ، ويشتبه في أنه يضر بالخصوبة (H361f) ، ويسبب تلفا للأعضاء من خلال التعرض لفترات طويلة أو متكررة إذا تم ابتلاعه (H372). APS قد تكثف النار (مؤكسد ، H272) ، ضارة إذا ابتلع (H302) ، تسبب تهيج الجلد (H315) ، قد تسبب رد فعل تحسسي للجلد (H317) ، تسبب تهيجا خطيرا للعين (H319) ، قد تسبب أعراض الحساسية أو الربو أو صعوبات في التنفس إذا تم استنشاقها (H334) ، وقد تسبب تهيجا في الجهاز التنفسي (H335). TEMED هو سائل وبخار شديد الاشتعال (H225) ، ضار إذا ابتلع (H302) ، ويسبب حروقا شديدة في الجلد وتلف العين (H314) ، وهو سام إذا تم استنشاقه (H331). ارتد معدات الحماية الشخصية.
- بعد البلمرة ، أضف PBS إلى البئر. باستخدام ملاقط و / أو إبرة مثنية ، ارفع الغطاء برفق وقم بإزالته. اغسل المواد الهلامية مرة واحدة في PBS.
- لتسهيل طلاء الكولاجين للمواد الهلامية PAA ، يجب تشغيل المواد الهلامية باستخدام الرابط المتشابك Sulfo-SANPAH. أضف 75 ميكرولتر من 1 مجم / مل من Sulfo-SANPAH المذاب في ماء فائق النقاء إلى هلام PAA واحتضنه لمدة 5 دقائق تحت ضوء الأشعة فوق البنفسجية 365 نانومتر.
ملاحظة: حافظ على Sulfo-SANPAH محميا من الضوء وأضف الماء عالي النقاء قبل حضانة الأشعة فوق البنفسجية مباشرة. يظهر تغير اللون من الأحمر الفاتح (قبل حضانة ضوء الأشعة فوق البنفسجية) إلى الأحمر الداكن (بعد حضانة ضوء الأشعة فوق البنفسجية).
تنبيه: يسبب Sulfo-SANPAH تهيجا خطيرا للعين (H319). - في خزانة السلامة الحيوية ، قم بإجراء غسل PBS معقم سريع ل Sulfo-SANPAH على المواد الهلامية. وبالتالي ، اغسل المواد الهلامية PAA الوظيفية 2x في PBS معقم لمدة 10 دقائق.
ملاحظة: بدءا من هذه النقطة في البروتوكول ، سيتم تنفيذ جميع الخطوات في ظل ظروف معقمة. - في خزانة السلامة الحيوية ، قم بإعداد محلول 0.1 مجم / مل من الكولاجين من النوع الرابع في PBS على الجليد. Pipet 50 ميكرولتر من 0.1 ملغم/مل قطرة كولاجين من النوع الرابع فوق جل PAA الوظيفي وتحتضن طوال الليل عند 4 درجات مئوية.
- اغسل المواد الهلامية 2x في PBS معقم. قم بإزالة PBS واترك المواد الهلامية حتى تجف لمدة 5 دقائق.
- Pipet عبارة عن قطرة 50 ميكرولتر من وسط نمو الخلايا البطانية (ECG) فوق المواد الهلامية وتحتضن لمدة ساعة واحدة على الأقل عند 37 درجة مئوية و 5٪ ثاني أكسيدالكربون 2.
ملاحظة: يؤدي احتضان المواد الهلامية في وسط تخطيط القلب إلى تحسين ارتباط الخلايا والأنسجة بالمواد الهلامية.
2. تحضير محلول كريبس المعدل للنقل
ملاحظة: قم بإعداد محلول كريبس المعدل طازجا. في هذا البروتوكول ، يتم تحضير محلول كريبس المعدل قبل يوم واحد من حصاد الأنسجة.
- تعقيم زجاجة النقل عن طريق التعقيم. املأ زجاجة زجاجية بنسبة 90٪ (315 مل) من إجمالي حجم النقل المطلوب (350 مل) من الماء فائق النقاء. تأكد من أن درجة حرارة الماء 15-20 درجة مئوية.
- أثناء تقليب الماء برفق باستخدام مغناطيس التحريك ، أضف 9.6 جم / لتر (3.36 جم) Krebs-Henseleit Buffer وحركه حتى يذوب. باستخدام ماصة باستور ، اشطف قارب الوزن بكمية صغيرة من المحلول لتضمين جميع آثار المسحوق في المحلول. لا تسخن المحلول.
- أثناء التقليب ، أضف 0.373 جم / لتر (130.55 مجم) من كلوريد الكالسيوم (CaCl2) إلى المحلول وحركه حتى يذوب. شطف قارب الوزن بحجم صغير من المحلول.
تنبيه: H319 يسبب تهيجا خطيرا للعين. - أثناء التحريك ، أضف 2.1 جم / لتر (0.63 جم) بيكربونات الصوديوم (NaHCO3) إلى المحلول وحركه حتى يذوب. شطف قارب الوزن بحجم صغير من المحلول.
- أثناء التقليب ، أضف 1 × 10-1 ملي (13.15 مجم) بابافيرين إلى المحلول وحركه حتى يذوب. شطف قارب الوزن بحجم صغير من المحلول.
ملاحظة: Papaverine هو مرخي للعضلات الملساء يستخدم لمنع تضيق الأوعية المفرط الناجم عن قطع الوعاء والتعامل معه أثناء الحصاد.
تنبيه: H301 سام إذا ابتلع. - في غطاء الدخان ، أضف 0.05 ملي مولار (1.2 ميكرولتر) 2-ميركابتو إيثانول إلى المحلول وحركه.
ملاحظة: يستخدم 2-mercaptoethanol للحفاظ على مستوى منخفض من جذور الأكسجين.
تنبيه: 2-ميركابتو إيثانول سام إذا تم ابتلاعه أو في حالة استنشاقه (H301 + H331) ، قاتل عند ملامسته للجلد (H310) ، يسبب تهيج الجلد (H315) ، قد يسبب رد فعل تحسسي للجلد (H317) ، يسبب تلفا خطيرا للعين (H318) ، يشتبه في إتلاف الطفل الذي لم يولد بعد (H361d) ، قد يتسبب في تلف الأعضاء من خلال التعرض الطويل أو المتكرر إذا تم ابتلاعه (H373) ، وسام جدا للحياة المائية ذات تأثيرات طويلة الأمد (H410). ارتد معدات الحماية الشخصية واعمل في غطاء الدخان. - أثناء التقليب ، اضبط الرقم الهيدروجيني إلى 7.2 عن طريق إضافة 1 نيوتن (1 م) حمض الهيدروكلوريك أو 1 نيوتن (1 م) هيدروكسيد الصوديوم. الهدف النهائي من الأس الهيدروجيني هو 7.4 ، لكن الرقم الهيدروجيني قد يرتفع 0.1-0.3 وحدة الأس الهيدروجيني أثناء الترشيح.
تنبيه: يحتوي حمض الهيدروكلوريك على غاز تحت الضغط ؛ قد ينفجر إذا تم تسخينه (H280) ، ويسبب حروقا شديدة في الجلد وتلف العين (H314) ، ويكون ساما إذا تم استنشاقه (H331). ارتد معدات الحماية الشخصية. - استمر في العمل في خزانة السلامة البيولوجية. أضف 10٪ ماء فائق النقاء لإحضار المحلول إلى الحجم النهائي.
- عقم المحلول على الفور عن طريق الترشيح باستخدام غشاء مسامية 0.22 ميكرومتر. استغني عن المحلول المعقم مباشرة في زجاجة معقمة. أضف 7 مل من البنسلين / الستربتوميوسين 2٪ (P / S) إلى المحلول.
ملاحظة: أثناء النقل ، يضاف 2٪ P / S إلى الوسط لإزالة جميع البكتيريا. أثناء زراعة الأنسجة ، يضاف 1٪ P / S إلى الوسط. - قم بتخزين محلول كريبس المعدل عند 4 درجات مئوية حتى حصاد الأنسجة.
3. حصاد الأنسجة
- اعتمادا على المسلخ ، صعق الخنازير من خلال الصدمة الكهربائية أو ثاني أكسيد الكربون2. بعد ذلك ، قم بتعليق الخنازير من طرف خلفي ، وأعلن عن وفاتها.
- قبل الدخول في عملية الذبح النظيفة ، قم بحرق الخنازير لإزالة الشعر ، وقم بإزالة الشعر الأخير ، وتعقيم الجزء الخارجي من الذبيحة.
- قم بإزالة أحشاء الخنازير عن طريق عمل شق في خط الوسط على طول البطن وإزالة الأعضاء الداخلية بعناية. اعتمادا على المسلخ ، كان الشريان السباتي لا يزال متصلا بجثة الخنزير ، أو تمت إزالة الشريان السباتي بالفعل من الذبيحة بنتف الأعضاء الصدرية.
- باستخدام سكين حاد ، حصاد الشريان السباتي مع بعض الأنسجة المحيطة المتبقية من الذبيحة أو أنسجة منطقة الحلق دون لمس الشريان أو تطبيق إجهاد ميكانيكي.
- ضع الأنسجة التي تحتوي على الشريان السباتي في زجاجة النقل التي تحتوي على محلول كريبس معقم معدل عن طريق فتح الزجاجة لفترة وجيزة. اقلب الزجاجة مرة واحدة للتأكد من تغطية الأنسجة بالكامل بمحلول كريبس. انقل الأنسجة الموجودة على الجليد إلى المختبر. يستغرق النقل حوالي 30-45 دقيقة.
4. تشريح الأنسجة
- تعقيم معدات التشريح الملقط الجراحي (المناولة الخشنة) ، الملقط ذو الطرف المستدير المطلي بالإيبوكسي (المناولة الدقيقة) ، المشرط ، القرصة ، والأغطية عن طريق التعقيم.
- قم بإعداد خزانة السلامة الحيوية قبل حصاد / نقل الأنسجة. قم بتغطية منطقة التشريح بورقة ستارة جراحية. تركيب معدات التشريح (في أنابيب معقمة 50 مل) ، والشفرات الجراحية ، والأغطية المعقمة. املأ طبقين كبيرين من بتري ب PBS معقم لتحضير صينية تشريح. احتضان زراعة الأنسجة في طبق بتري صغير مع وسط تخطيط القلب عند 37 درجة مئوية.
- بعد نقل الأنسجة ، داخل خزانة السلامة الحيوية ، انقل الشريان السباتي من زجاجة النقل (المملوءة بمحلول كريبس المعدل) إلى طبق بتري كبير مملوء ب PBS المعقم باستخدام الملقط الجراحي.
- قم بإزالة الأنسجة الزائدة المحيطة بالشريان السباتي باستخدام الملقط والمشرط الجراحي لإنشاء رؤية واضحة للشريان السباتي.
- قم بإزالة 2-3 سم من طرفي الشريان السباتي للقضاء على المناطق القريبة من تشعبات الشرايين عن طريق القطع بمشرط. قم بإزالة اللفافة الشريانية المحيطة بالشريان السباتي باستخدام الملقط الدقيق ذو الطرف المستدير.
ملاحظة: يساعد تجديد شفرة المشرط على قطع اللفافة بشكل أكثر دقة. - انقل الشريان السباتي إلى طبق بتري كبير جديد مليء ب PBS المعقم. قم بإزالة الطبقة الرقيقة المتبقية من اللفافة الشريانية قدر الإمكان.
ملاحظة: كلما طالت مدة وجود الشريان السباتي في PBS ، زادت قطع اللفافة التي تميل إلى التفكيك. تعد إزالة اللفافة مهمة لأنها ستعيق الرؤية أثناء الفحص المجهري. - قطع الشريان السباتي النظيف إلى حلقات بعرض 2 مم تقريبا. انقل حلقات الشريان السباتي إلى طبق بتري الصغير المسخن مسبقا المملوء بوسط تخطيط القلب واحتفظ به عند 37 درجة مئوية.
5. بذر الأنسجة
ملاحظة: تم اختبار مرفق الأنسجة عن طريق إضافة عدم إضافة غطاء ، أو غطاء معقم غير معالج ، أو غطاء معقم معالج بالجنبي (1٪ وزن / حجم الجنبي في PBS ، أغطية محضنة طوال الليل وغسلها في ماء معقم عالي النقاء قبل الاستخدام) بأحجام مختلفة أعلى الصفيحة الشريانية بعد البذر على هيدروجيل PAA.
- قم بإزالة قطرات تخطيط القلب المتوسطة من المواد الهلامية. انقل حلقة الشريان السباتي إلى طبق بتري متوسط نظيف مليء ب PBS المعقم.
- باستخدام الملقط والمشرط ذو الطرف الدائري ، اقطع الحلقة إلى نصفين. قم بتشريح نصف حلقة إلى صفائح بعرض 2 مم تقريبا لإنشاء صفائح شريانية بأبعاد 2 × 2 مم. ضع في اعتبارك اتجاه الجانب البطاني للورقة الشريانية. قد يساعد الانحناء وبعض اللفافة المتبقية في الصفيحة الشريانية في تحديد هذا الاتجاه.
ملاحظة: قد يختلف حجم حلقات الشريان السباتي. تنتج الحلقات الكبيرة ما يقرب من 6-8 أوراق ، بينما تنتج الحلقات الصغيرة 3-4 أوراق. عززت الحلقات الكبيرة التعلق بسبب قلة الانحناء في الصفيحة الشريانية. - باستخدام الملقط الدائري ، أمسك الصفيحة الشريانية في الجزء الخلفي من الورقة (خارج جدار الوعاء) وضع الورقة على حافة هلام PAA مع البطانة الداخلية التي تواجه ركيزة PAA لتجنب إتلاف ركيزة PAA عند وضع الورقة.
- باستخدام الملقط أو القرصة ، حرك الصفيحة الشريانية برفق شديد إلى مركز هيدروجيل PAA دون لمس الجل. ضع الصفيحة الشريانية على حافة الجل (قد تلتصق الأنسجة بالملاقط أو القرصة).
ملاحظة: تخلق البقايا الصغيرة من اللفافة الشريانية في الجزء الخارجي من جدار الوعاء الدموي مقبضا سهلا للإمساك بالصفيحة الشريانية بينما تكون البطانة الداخلية لجدار الوعاء الدموي ناعمة للغاية. - أضف 50 ميكرولتر من وسط تخطيط القلب أعلى الصفيحة الشريانية الموضوعة على ركيزة PAA. Ty للحفاظ على قطرة وسط تخطيط القلب فوق الجل.
- باستخدام الملقط ذو الرأس المستدير ، ضع غطاء جاف مقاس 13 مم أعلى الصفيحة الشريانية على ركيزة PAA في المتوسط. استخدم الحافة الداخلية للقاع الزجاجي لخفض الغطاء برفق حتى تلامس القطرة المتوسطة وينتشر الوسط تحتها.
ملاحظة: تعتبر أغطية الغطاء مقاس 13 مم مفيدة لأنها تتطابق بشكل وثيق مع حجم الجدار الداخلي للوحة البئر السفلية الزجاجية. إذا قمت بخفض الغطاء بسرعة كبيرة ، فسوف ينتقل النسيج إلى حافة الغطاء. - اترك الأنسجة لتتعلق عند 37 درجة مئوية و 5٪ ثاني أكسيد الكربون2 لمدة 5 ساعات قبل إضافة 1 مل من وسط تخطيط القلب إلى كل بئر. ضع الصفيحة الشريانية على الركيزة PAA عند 37 درجة مئوية و 5٪ ثاني أكسيد الكربون2 لمدة 24 ساعة.
6. إنشاء نموذج 2.5D
- الأوتوكلاف ملاقط مستديرة الطرف لإزالة الغطاء. قم بإعداد 1 M هيدروكسيد الصوديوم في ماء فائق النقاء ، وتعقيمه عن طريق الترشيح من خلال مرشح بحجم المسام 0.22 ميكرومتر ، وتخزينه في درجة حرارة 4 درجات مئوية.
ملاحظة: يمكن إعادة استخدام 1 M هيدروكسيد الصوديوم في التجارب المستقبلية. - باستخدام إبرة حادة معقمة ذات طرف مثني ، ارفع الغطاء مقاس 13 مم من الصفيحة الشريانية برفق شديد وقم بإزالة الغطاء. استخدم الحلقة الداخلية للقاع الزجاجي جيدا كدعم لرفع وإزالة الغطاء. أي حركة جانبية تزيد من خطر انفصال الصفيحة الشريانية عن ركيزة PAA.
- في أنبوب معقم للطرد المركزي الدقيق ، قم بإعداد خليط الكولاجين من النوع الأول وفقا للجدول 2 على الثلج. عند إضافة الكولاجين من النوع الأول و هيدروكسيد الصوديوم إلى المحلول ، قم بإعادة تعليقه جيدا وقلب الأنبوب مرة واحدة للتأكد من خلط الخليط بشكل متجانس.
ملاحظة: عند إضافة الكولاجين من النوع الأول إلى الخليط ، يتحول الخليط ذو اللون الوردي الفاتح إلى عديم اللون. عند إضافة هيدروكسيد الصوديوم ، يتحول لون الخليط عديم اللون إلى اللون الوردي الفاتح. - قم بإزالة الوسط من البئر باستخدام نظام شفط الفراغ. قم بإزالة الوسط المحيط بالأنسجة قدر الإمكان دون لمس الأنسجة.
ملاحظة: الكثير من الوسائط المحيطة بالصفيحة الشريانية سيمنع هلام الكولاجين من النوع الأول من إحاطته. - أضف قطرة 10 ميكرولتر من خليط جل الكولاجين من النوع الأول فوق كل ورقة شريانية واترك جل الكولاجين من النوع الأول لبلمرة لمدة ساعة واحدة عند 37 درجة مئوية و 5٪ ثاني أكسيدالكربون 2.
- برفق شديد ، أضف 1 مل من وسط تخطيط القلب المسخن مسبقا إلى كل بئر وضع العينات عند 37 درجة مئوية و 5٪ ثاني أكسيدالكربون 2.
7. تصوير الخلايا الحية
ملاحظة: تم إجراء تصوير الخلايا الحية باستخدام مجهر Leica DMi8 أو Nikon Ti2 Eclipse epi-fluorescence المجهز بالتحكم الحراري وثاني أكسيد الكربون2 والرطوبة والتحكم فيه باستخدام برنامج Leica أو NIS. تم استخدام التحكم التكيفي في التركيز البؤري (Leica) ونظام التركيز البؤري المثالي (نيكون) للحفاظ على التركيز في الوقت المناسب.
- بعد 24 ساعة من الثقافة في نظام 2.5D ، تحقق من تكوين الأوعية الدموية. تبدأ بعض الصفائح الشريانية بالفعل في تكوين براعم خلوية بعد 24 ساعة من الثقافة بينما تحتاج الأوراق الأخرى إلى مزيد من الوقت لبدء إنبات البطانة.
- إذا تم بدء تكوين الأوعية الدموية ، فقم بتحديث وسط تخطيط القلب وضع اللوحة المكونة من 12 بئرا في حامل المرحلة داخل صندوق الحضانة المسخن مسبقا بالمجهر 37 درجة مئوية.
- اختر الهدف الذي يثير اهتمامه. تم استخدام أهداف مختلفة في هذه الدراسة ، استخدم هدفا 10x لإنشاء نظرة عامة عالمية على تكوين البراعم الخلوية وهدف 20x لأداء TFM.
- حدد القناة (القنوات) ذات الاهتمام. لأغراض TFM ، قم بتصور البراعم الخلوية باستخدام تباين الطور وتصور علامات الفلورسنت (الأحمر الداكن) في ركيزة PAA باستخدام قناة فلورية بطول موجي يبلغ 660 نانومتر.
- حدد منطقة (مناطق) (متعددة) محل اهتمام وابحث عن مستوى التركيز البؤري. قم بتشغيل نظام التركيز البؤري (التحكم في التركيز البؤري التكيفي في Leica DMi8 أو نظام التركيز البؤري المثالي في Nikon Ti2 Eclipse) لضمان التركيز البؤري المستقر عبر التصوير بفاصل زمني.
- حدد اللقطات المتتابعة محل الاهتمام عن طريق تحديد الفاصل الزمني وطول اللقطات المتتابعة. تم استخدام فترات زمنية مختلفة (5-20 دقيقة) وأطوال الفاصل الزمني (4-24 ساعة) لأغراض مختلفة في هذه الدراسة.
- لأغراض TFM ، بعد التصوير بفاصل زمني ، قم بإزالة الخلايا المتنامية عن طريق إضافة عدة قطرات من 5٪ SDS في ماء فائق النقاء وانتظر عدة دقائق. لكل موضع محدد ، خذ مكدس z (تم تحديد ارتفاع z يبلغ 2 ميكرومتر بحجم خطوة 0.2 ميكرومتر) من علامات الفلورسنت في ركيزة PAA للحصول على حالة مريحة لعلامات الفلورسنت كصورة مرجعية.
ملاحظة: يتم إجراء التصوير Z-stack لأن الخلايا قد تسحب أو تدفع علامات الفلورسنت في الاتجاه z.
8. تحليل الفحص المجهري لقوة الجر
- قم بمحاذاة صور اللقطات المتتابعة واقتصاصها بالنسبة لأفضل صورة مرجعية لإجراء تحليل دقيق.
- لقياس إزاحة علامات الفلورسنت في هيدروجيل PAA ، قم بإجراء قياس سرعة صورة الجسيمات (PIV) بين أي صورة بفاصل زمني والصورة المرجعية باستخدام رموز MatLab المخصصة. ضمن تحليل PIV ، قسم الصور إلى نوافذ استجواب 32 × 32 بكسل مع تداخل 0.5.
- احسب قوى الجر من إزاحة علامات الفلورسنت بواسطة مجهر الجر القائم على تحويل فورييه لهلام لانهائي بسماكة هلام محدودة باستخدام معادلة بوسينسك27.
النتائج
عن طريق البروتوكول الموصوف ، يمكننا إحداث تكوين الأوعية الدموية من الشريان السباتي الخنازير فوق هيدروجيل ثنائي الأبعاد PAA مغطى بطبقة رقيقة من هلام الكولاجين من النوع الأول ، وبالتالي إنشاء نموذج تكوين الأوعية الدموية 2.5D ex vivo . يسمح لنا هذا النموذج بأداء TFM التقليدي وقياس قوى الجر الخلوية لتكوين الأوعية الدموية المنبت على واجهة هلام PAA في المكان والزمان.
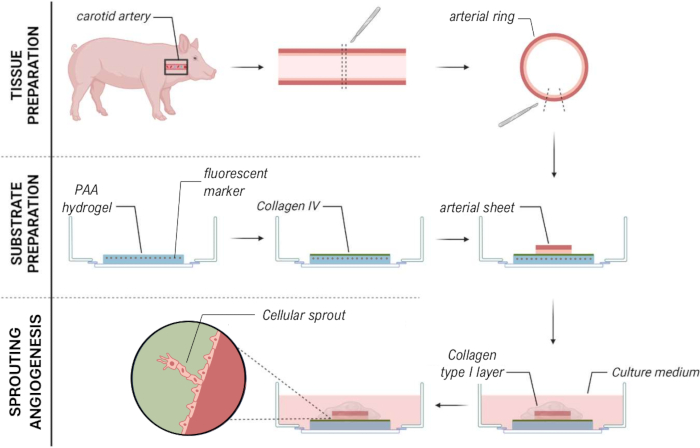
لإنشاء نموذج 2.5D ، قمنا أولا بإعداد هيدروجيل بولي أكريلاميد ثنائي الأبعاد (PAA) مدمج بعلامات الفلورسنت ، متبوعا بالطلاء الليلي بالكولاجين من النوع الرابع (d-1 إلى d0). في اليوم 0 (d0) ، تم وضع ورقة شريانية سباتية على هيدروجيل الكولاجين المطلي بالكولاجين IV وسمح لها بالالتصاق طوال الليل (d0 إلى d1). بعد ذلك ، تم وضع طبقة رقيقة من جل الكولاجين من النوع الأول على الصفيحة الشريانية ، وبعد ذلك بدأ التصوير في اليوم 1 (d1) لمراقبة الإنبات الخلوي وتتبع علامات الفلورسنت للتحليل الميكانيكي (d1 إلى d2). للتحقق من تكوين الأوعية الدموية في نموذج 2.5D ، أجرينا تكوين الأوعية الدموية التقليدي خارج الجسم الحي في هلام الكولاجين 3D من النوع الأول بالتوازي. لهذا الغرض ، تم تحضير طبقة رقيقة من جل الكولاجين من النوع الأول ، متبوعة بذر الصفيحة الشريانية السباتية ، ثم تم تغطيتها بطبقة كولاجين إضافية (d0). تمت مراقبة الإنبات الوعائي بمرور الوقت. بالإضافة إلى ذلك ، سعينا إلى إحداث تكوين الأوعية الدموية في 2D لتقليل تعقيد النموذج. عكس الإجراء التجريبي نموذج 2.5D ، مع الاختلاف الرئيسي في استبعاد طبقة هلام الكولاجين من النوع الأول العليا نظرة عامة على النماذج الثلاثة ، بما في ذلك إجراءاتها التجريبية ، موصوفة في الشكل 1. تم حصاد الشرايين السباتية من الخنازير من المسلخ المحلي ونقلها في محلول كريبس طازج معقم. داخل خزانة السلامة الحيوية ، تمت إزالة الأنسجة الزائدة المحيطة بالشريان السباتي لضمان عدم وجود ضعف بصري لتكوين الأوعية الدموية أثناء التصوير الحي بفاصل زمني (الشكل 2A-E). بمجرد تنظيف الشريان من الأنسجة الزائدة ، تم تقطيع الشريان إلى حلقات شريانية بعرض 2 مم ، وتم تقطيع الحلقات إلى صفائح شريانية بأبعاد 2 × 2 مم (الشكل 2F).
لضمان ظهور الأوعية الدموية أعلى واجهة هيدروجيل PAA ضمن نموذج 2.5D و 2D ، قمنا بزرع الصفائح الشريانية مع جانب الخلية البطانية الداخلية المواجه لهيدروجيل PAA المطلي بالكولاجين من النوع الرابع وتركنا متصلة. لتحسين ربط الصفيحة الشريانية بهيدروجيل PAA ، اختبرنا تأثير إضافة غطاء زجاجي مطلي مضاد للقاذورات مقاس 12 مم أعلى الصفيحة الشريانية. بعد 24 ساعة ، تمت إزالة الغطاء ، وتم قياس كفاءة التثبيت عن طريق النسبة المئوية للصفائح الشريانية المتصلة بهيدروجيل PAA. لاحظنا أن إضافة غطاء زجاجي - مستقل عن الطلاء المضاد للقاذورات - زاد من كفاءة التعلق للصفائح الشريانية أعلى هيدروجيل PAA مقارنة بعدم وجود غطاء (الشكل 3A-D). بعد ذلك ، اختبرنا تأثير قطر (12 أو 13 مم) للغطاء الزجاجي على كفاءة التثبيت للصفيحة الشريانية ، بينما كان البئر الداخلي للوحة 14 مم. لاحظنا أن انزلاق الغطاء 13 مم يزيد من كفاءة التعلق بالصفائح الشريانية أعلى هيدروجيل PAA مقارنة بغطاء 12 مم (الشكل 3E-G) حيث يتم تقليل قوى القص أثناء إزالة الغطاء. واصلنا استخدام غطاء غير معالج مقاس 13 مم لربط الصفيحة الشريانية بالهيدروجيل PAA في كل من طرازي 2.5D و 2D.
بعد ربط الصفيحة الشريانية بهيدروجيل PAA ، أضفنا طبقة رقيقة من جل الكولاجين من النوع الأول أعلى الصفيحة الشريانية لخلق بيئة 2.5D. قمنا بزراعة العينات لمدة 5 أيام وفحصنا العينات من أجل تكوين الأوعية. لاحظنا تكوين براعم خلوية في النموذج ثلاثي الأبعاد (الشكل 4 أ) ، بما يتفق مع تكوين الأوعية الدموية التي تم الإبلاغ عنها سابقا في الأدبيات28،29،30. ضمن نموذج 2.5D ، لاحظنا تنظيما مشابها للبراعم الخلوية مقارنة بالنموذج ثلاثي الأبعاد (الشكل 4 ب). تشكلت البراعم الخلوية على ارتفاعات متعددة (فيديو 1) ، بما في ذلك واجهة PAA. بالإضافة إلى ذلك ، يتميز تكوين الأوعية الدموية المتزايد بالتكاثر العالي للخلايا القائدة والتابعة ، وهي ظاهرة لاحظناها أثناء الإنبات داخل نموذج 2.5D (فيديو 2). عند زراعة صفيحة شريانية في 2D ، تهاجر الخلايا من أصول مختلفة (الشكل التكميلي 1) كطبقات أحادية الطبقات من الأنسجة ، وبالتالي تفتقر إلى تنظيم البراعم الخلوية (الشكل 4 ج). نظرا لأننا لم نلاحظ تكوين الأوعية الدموية في النموذج ثنائي الأبعاد ، فقد استبعدنا هذا النموذج من التحليلات اللاحقة. إجمالا ، تحتاج الورقة الشريانية إلى بيئة ثلاثية الأبعاد محلية للحث على تكوين الأوعية الدموية ، مما يدل على إمكانات نموذج 2.5D ex vivo لتكوين الأوعية الدموية.
علاوة على ذلك ، فإن نظام النموذج 2.5D هو نظام متعدد الاستخدامات يسمح للمستخدمين بفحص تأثير الإشارات الميكانيكية من البيئة المكروية الخلوية ، على سبيل المثال ، صلابة المصفوفة. تعتمد صلابة المصفوفة لهيدروجيل الكولاجين ثلاثي الأبعاد من النوع الأول - الهيدروجيل الذي يشيع استخدامه في تكوين الأوعية الدموية خارج الجسم الحي - على تركيز بروتين ECM ، حيث ترتبط الزيادة في تركيز البروتين بزيادة صلابة المصفوفة32. النطاق النموذجي لتركيز الكولاجين من النوع الأول لجعل هذا الهيدروجيل ثلاثي الأبعاد يحفز تكوين الأوعية الدموية هو 1-4 مجم / مل ، وهو ما يتوافق مع صلابة المصفوفة من 1 باسكال إلى 1 كيلو باسكال32،33،34. قد تكون التركيزات المنخفضة ناعمة جدا بحيث لا توفر الدعم الهيكلي ، في حين أن التركيزات الأعلى يمكن أن تمنع حركة الخلايا. الصلابة الفسيولوجية للأنسجة البطانية هي 1 كيلو باسكال35 ، والتي يمكن تقليدها باستخدام هيدروجيل الكولاجين ثلاثي الأبعاد من النوع الأول. ومع ذلك ، يرتبط تكوين الورم وتطوره بتصلب الأنسجة4 ، مما يؤكد على الحاجة إلى نموذج يمكنه تحقيق صلابة مصفوفة أعلى لدراسة تكوين الأوعية الدموية. يمكن بسهولة ضبط صلابة الركيزة للهلاميات المائية PAA - الصلابة التي تشعر بها الخلايا البطانية للورقة الشريانية - في نطاق 1 إلى عشرات كيلو باسكال. هنا ، قمنا بفحص تأثير صلابة الركيزة PAA على بداية تكوين الأوعية الدموية عن طريق النسبة المئوية للعينات التي بدأت في تكوين براعم خلوية في اليوم التالي لإضافة طبقة الكولاجين من النوع الأول. لاحظنا أن المزيد من الصفائح الشريانية أظهرت علامات مبكرة للبراعم الخلوية عند زراعتها على هيدروجيل PAA ناعم فسيولوجي (1 كيلو باسكال) مقارنة بهيدروجيل PAA المرضي الصلب (12 كيلو باسكال) (الشكل 5) ، مما يدل على إمكانات هذا النموذج لدراسة تأثير صلابة المصفوفة على تكوين الأوعية الدموية. بالإضافة إلى صلابة الركيزة القابلة للضبط ، تسمح هذه الركائز بالتعديل المنهجي للإشارات الميكانيكية الأخرى (على سبيل المثال ، تكوين المصفوفة وكثافتها) بالإضافة إلى الإشارات الكيميائية (على سبيل المثال ، تثبيط المنظمين الجزيئيين عن طريق تكييف وسط الثقافة) ، مما يدل على تعدد استخدامات نموذج تكوين الأوعية الدموية 2.5D ex vivo .
لتحديد الميكانيكا الخلوية في تكوين الأوعية الدموية ، أجرينا الفحص المجهري التقليدي لقوة الجر (TFM) على البراعم الخلوية التي تشكلت على واجهة 2D PAA. بعد يوم واحد من إضافة طبقة الكولاجين من النوع الأول ، أجرينا تصويرا للخلايا الحية للخلايا (الشكل 6 أ) وعلامات الفلورسنت المضمنة في هيدروجيل PAA. تم قياس إزاحة علامات الفلورسنت باستخدام قياس سرعة صورة الجسيمات (الشكل 6 ب) ، وتم حساب الجر الخلوي باستخدام الخصائص الميكانيكية للهيدروجيل PAA (الشكل 6 ج). مع نموذج 2.5D ex vivo هذا ، لاحظنا في البداية سحب القوى عند نتوءات الخلية الرائدة للبرعم الخلوي متبوعا بدفع القوى على طول البرعم الخلوي - سواء في الجزء الخلفي من الخلية الرائدة أو الخلايا التالية (الشكل 6C).
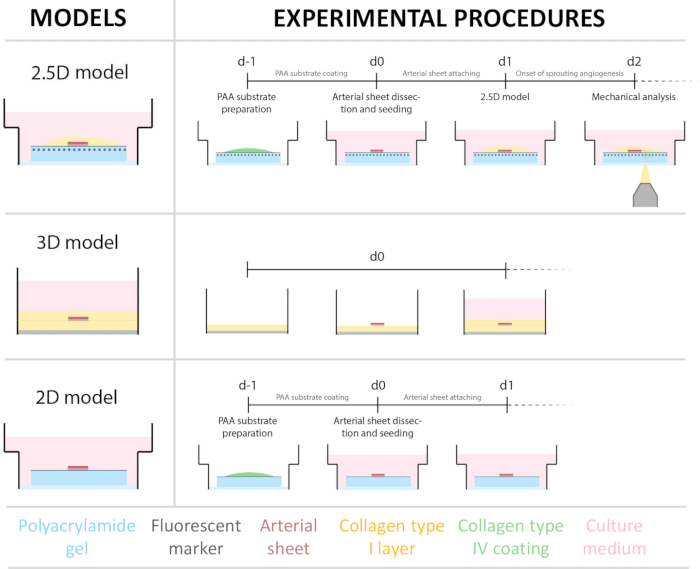
الشكل 1: النماذج والإجراءات التجريبية. (يسار) تم اختبار النماذج التجريبية. يمثل النموذج 2.5D صفيحة شريانية موضوعة فوق هيدروجيل بولي أكريلاميد مطلي بالكولاجين المسطح من النوع الرابع (PAA) ومغطاة بطبقة رقيقة من هيدروجيل الكولاجين من النوع الأول. يمثل النموذج ثلاثي الأبعاد صفيحة شريانية محصورة بين طبقتين من هلام الكولاجين من النوع الأول ، وهو نظام معروف بأنه يحفز تكوين الأوعيةالدموية 36. يمثل النموذج ثنائي الأبعاد ورقة شريانية موضوعة فوق هيدروجيل PAA مطلي بالكولاجين المسطح من النوع الرابع. (يمين) الإجراءات التجريبية للنماذج المقابلة. لكل من النموذجين 2D و 2.5D ، تم تحضير هيدروجيل PAA في اليوم السابق للبذر (d-1) ، وتم إجراء طلاء الكولاجين من النوع الرابع بين عشية وضحاها. تم حصاد الشريان السباتي من الخنازير ، وتشريحه إلى صفائح شريانية ، وزرعه فوق الهيدروجيل في اليوم 0 (d0) ، وتركه ليعلق طوال الليل (d1). بالنسبة للعينات 2.5D ، تم وضع طبقة رقيقة من هلام الكولاجين من النوع الأول فوق الصفيحة الشريانية. تم إجراء التحليل الميكانيكي بعد بداية الإنبات في اليوم 2 (d2). بالنسبة للعينات ثنائية الأبعاد ، تم تحديث الوسيط في اليوم 1 (d1). بالنسبة للنموذج ثلاثي الأبعاد ، تم تحضير طبقة من جل الكولاجين من النوع الأول قبل البذر مباشرة في اليوم 0 (d0). تم زرع الصفيحة الشريانية فوق طبقة الكولاجين من النوع الأول ومغطاة بطبقة ثانية من الكولاجين من النوع الأول. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
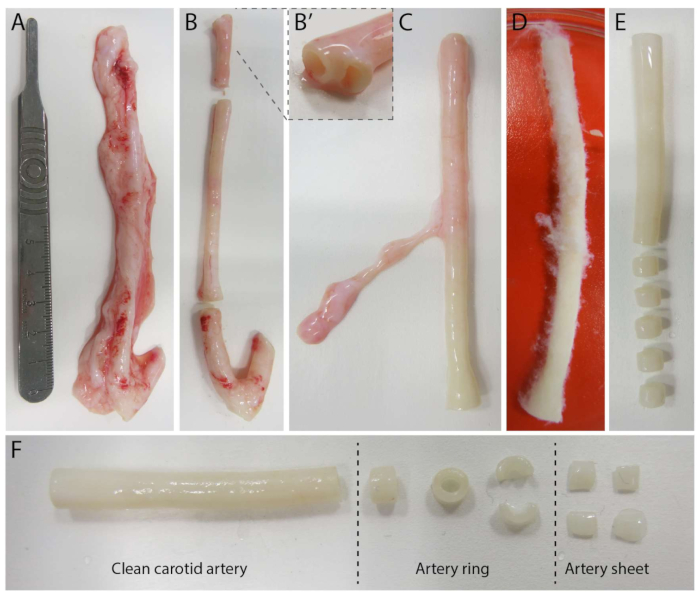
الشكل 2: خطوات تشريح الشريان السباتي (d0). (أ) تم حصاد الشرايين السباتية التي يبلغ طولها حوالي 10 سم من الخنازير من المسلخ المحلي. (ب) تم التخلص من الأنسجة الزائدة وحوالي 2 سم من الحافة (لتجنب الاقتراب الشديد من نقاط التفرع ، (ب'). (C-E) تم جلد الشريان السباتي (C) ، ونقعه في PBS (D) وتم سلخ جميع الأنسجة المتبقية لضمان رؤية واضحة أثناء التصوير (E). (و) يتم تقطيع الشريان السباتي النظيف إلى حلقات شريانية بعرض تقريبي يبلغ 2 مم. يتم تقطيع كل حلقة إلى 4 صفائح شريانية بأبعاد 2 × 2 مم تقريبا. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
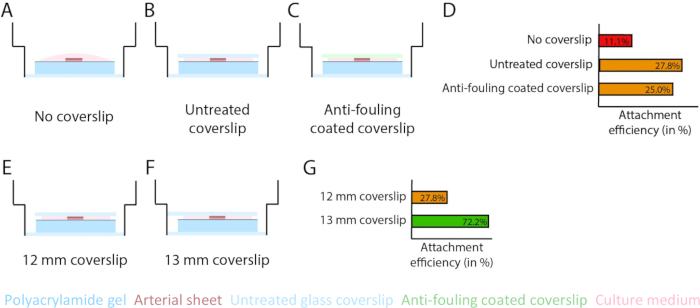
الشكل 3: تزداد كفاءة ربط الصفائح الشريانية باستخدام غطاء زجاجي مقاس 13 مم (d1). (A-D) تأثير غطاء زجاجي على ربط الصفيحة الشريانية بهيدروجيل بولي أكريلاميد (PAA). تم إجراء مقارنة بين عدم وجود غطاء زجاجي (A) ، وغطاء زجاجي غير معالج (B) ، وغطاء زجاجي مطلي مضاد للقاذورات باستخدام Pluronic F127 (C). تم قياس كفاءة التعلق من خلال عدد الصفائح الشريانية التي تم توصيلها بهيدروجيل PAA بعد إزالة الغطاء مقارنة بالعدد الإجمالي للعينات: عدم وجود غطاء (4 من 36) ، وغطاء غير معالج (10 من 36) ، وغطاء مغلف مضاد للقاذورات (9 من 36 ؛ د). (E-G) تأثير حجم الغطاء الزجاجي غير المعالج على ربط الصفيحة الشريانية بهيدروجيل PAA. تم إجراء مقارنة بين غطاء زجاجي غير معالج مقاس 12 مم (E) وغطاء زجاجي غير معالج مقاس 13 مم (F) داخل بئر 14 مم. تم قياس كفاءة التثبيت من خلال عدد الصفائح الشريانية المرفقة بهيدروجيل PAA بعد إزالة الغطاء مقارنة بالعدد الإجمالي للعينات: غطاء 12 مم (10 من 36) وغطاء 13 مم (52 من 72 ؛ ز). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
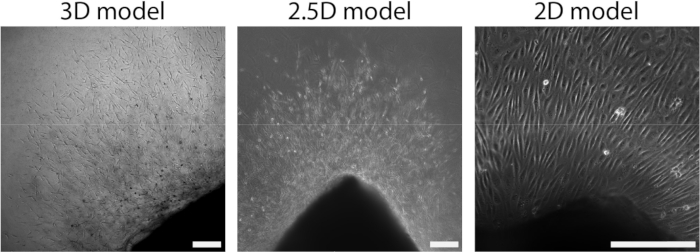
الشكل 4: تحدد أبعاد النموذج التنظيم أثناء النمو الخلوي (d2+). تهاجر الخلايا خارج الأنسجة في منظمة برعم في النموذج ثلاثي الأبعاد (يسار) ، على غرار نموذج 2.5D (الوسط). تهاجر الخلايا خارج الأنسجة في تنظيم أحادي الطبقة في إعداد ثنائي الأبعاد (يمين). يمثل مقياس المقياس 250 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.

الشكل 5: يعتمد ظهور إنبات البطان في نموذج 2.5D على صلابة ركيزة هيدروجيل بولي أكريلاميد (d2). (أ-ب) صفيحة شريانية مغطاة بطبقة رقيقة من جل الكولاجين من النوع الأول فوق هيدروجيل بولي أكريلاميد ناعم (A ؛ 1 كيلو باسكال) أو صلب (B ؛ 12 كيلو باسكال) في اليوم 2 من البروتوكول (يوم واحد بعد إضافة طبقة جل الكولاجين من النوع الأول). (ج) تم قياس بداية الإنبات من خلال عدد الصفائح الشريانية التي تظهر بالفعل علامات النمو الخلوي مقارنة بالعدد الإجمالي للعينات: ناعمة (7 من 24) ، وقاسية (3 من 24). يمثل شريط المقياس 1 مم (A ، B) أو 500 ميكرومتر (A '، B). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 6: توصيف قوة الجر أثناء تكوين الأوعية الدموية المبكر. يتم عرض خلايا التصوير في الوقت المناسب (0-4 ساعات) في الصف العلوي. يتم عرض إزاحة علامات الفلورسنت المقابلة (0-2 ميكرومتر) والجر الخلوي (0-50 باسكال) على ركيزة هيدروجيل 1 كيلو باسكال PAA في الصف الأوسط والسفلي ، على التوالي. يتم عرض تكبيرات عمليات التصغير الخلوية عند 0 ساعة و 2 ساعة و 4 ساعات باللون البرتقالي. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل 7: 2.5D ex vivo تنبت طريقة نموذج تكوين الأوعية الدموية التي تسمح بالتوصيف الميكانيكي للبراعم الخلوية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
| 1 كيلو باسكال | 12 كيلو باسكال | |
| برنامج تلفزيوني | 435 ميكرولتر | 373.7 ميكرولتر |
| 40٪ أكريلاميد | 50 ميكرولتر | 93.8 ميكرولتر |
| 2٪ ثنائي أكريلاميد | 7.5 ميكرولتر | 25 ميكرولتر |
| علامة الفلورسنت (حمراء داكنة) | 5 ميكرولتر | 5 ميكرولتر |
| 10٪ APS | 2.5 ميكرولتر | 2.5 ميكرولتر |
| تيميد | 0.25 ميكرولتر | 0.25 ميكرولتر |
الجدول 1: نسب خليط هلام PAA.
| صيغة | الحجم لكل صفيحة 12 بئرا (130 ميكرولتر) | |
| تخطيط القلب المتوسط | VECG = Vالنهائي Vcol1-V هيدروكسيد الصوديوم | 82.16 ميكرولتر |
| الكولاجين من النوع الأول | Vcol1 = (Vنهائي * Cنهائي) /مخزون C | 46 ميكرولتر |
| هيدروكسيد الصوديوميوم | الخامسهيدروكسيد الصوديوم = 0.04 * فولتعمود 1 | 1.84 ميكرولتر |
الجدول 2: مزيج جل الكولاجين من النوع الأول باستخدام اختصارات الحجم (V) والتركيز (C).
فيديو 1: تصوير الفاصل الزمني لتكوين البرعم الخلوي داخل نموذج 2.5D. تم تصوير الخلايا باستخدام تصوير تباين الطور على مدى فترة زمنية مدتها 22 ساعة بفاصل زمني قدره 17.5 دقيقة. تشكلت البراعم الخلوية على ارتفاعات متعددة داخل طبقة هلام الكولاجين من النوع الأول كما لوحظت المستويات البؤرية المختلفة. يمثل شريط المقياس 100 ميكرومتر. الرجاء النقر هنا لتنزيل هذا الفيديو.
فيديو 2: معدل تكاثر مرتفع للخلايا داخل البراعم الخلوية ضمن نموذج 2.5D. تم تصوير الخلايا باستخدام تصوير تباين الطور على مدى 22 ساعة بفاصل زمني قدره 17.5 دقيقة. يتكاثر كل من القادة وكذلك الخلايا المتابعة أثناء التصوير بفاصل زمني. يمثل شريط المقياس 100 ميكرومتر. الرجاء النقر هنا لتنزيل هذا الفيديو.
الشكل التكميلي 1: النمط الظاهري الخلوي في نموذج ثنائي الأبعاد (d2 +) عن طريق تلطيخ التألق المناعي. (أ) تلطيخ التألق المناعي (IF) لنواة الخلية (DAPI) ، وعلامة الخلية البطانية (CD31) ، وعلامة الخلايا الليفية (أكتين العضلات الملساء ألفا ؛ α-SMA). (ب) تلطيخ نواة الخلية (DAPI) ، وعلامة الخلية البطانية (CD31) ، وعلامة خلية العضلات الملساء (كالبونين). يمثل شريط المقياس 100 ميكرومتر. الرجاء النقر هنا لتنزيل هذا الشكل.
الملف التكميلي 1: بروتوكول تلطيخ التألق المناعي. الرجاء النقر هنا لتنزيل هذا الملف.
Discussion
تنبت تكوين الأوعية الدموية - تكوين أوعية دموية جديدة - هي عملية معقدة تنظمها كل من الآليات الجزيئية والميكانيكية. في حين تم تطوير العديد من النماذج ثلاثية الأبعاد على مدى العقود الماضية لدراسة الدوافع الجزيئية (على سبيل المثال ، إشارات VEGF و Notch) لتكوين الأوعية الدموية ، لا يعرف سوى القليل عن الميكانيكا الخلوية بسبب قيود النموذج. الفحص المجهري لقوة الجر (TFM) هو تقنية معروفة للقياس الكمي للقوى الخلوية في المكان والزمان ، حيث يتم تحويل تشوهات الركيزة ثنائية الأبعاد إلى عمليات جر خلوية. لذلك ، في هذا البروتوكول ، نصف نموذج 2.5D ex vivo ، مما يعني أننا نوفر للخلايا محليا بيئة ثلاثية الأبعاد مع الحفاظ على بساطة نموذج ثنائي الأبعاد يسمح بالقياس الكمي لقوى الجر أثناء نمو الأوعية الدموية (الشكل 1). للقيام بذلك ، قمنا بإعداد وزرع ورقة شريانية خنزير (الجانب البطاني لأسفل. الشكل 2) فوق هيدروجيل بولي أكريلاميد مطلي بالكولاجين من النوع الرابع (PAA) يحتوي على علامات الفلورسنت. بعد ربط الصفيحة الشريانية باستخدام غطاء زجاجي مقاس 13 مم (الشكل 3) ، نضيف طبقة رقيقة من هيدروجيل الكولاجين من النوع الأول الذي يسمح بتكوين براعم خلوية (الشكل 4). باستخدام هذا النموذج ، نوضح أنه أثناء الإنبات الخلوي22،23،24،25 ، تمارس الخلايا الرائدة قوى سحب (كما لوحظ في الأدبيات19،20،21،22) ، ولكن أيضا أن الخلايا التالية تمارس قوى دفع (الشكل 6). تسمح دقة مجال الجر التي تم الحصول عليها من خلال بروتوكولنا بإجراء تحليلات كمية للحركية والديناميكيات الخلوية في كل من الزمان والمكان التي تعتبر نموذجية للأعمال التي تلجأ إلى الفحص المجهري لقوة الجر على ركائز متوافقة37،38،39.
علاوة على ذلك ، نوضح تعدد استخدامات هذا النموذج 2.5D ex vivo لتكوين الأوعية الدموية عن طريق تغيير الإشارات الميكانيكية للبيئة المكروية (الشكل 5). في حين أن تكوين الأوعية الدموية يحدث عادة عند صلابة فسيولوجية تبلغ 1 كيلو باسكال35 - والتي يمكن محاكدها بواسطة هيدروجيل ثلاثي الأبعاد من النوع الأول من الكولاجين ، يحدث تكوين الأوعية الدموية للورم في بيئة مكروية صلبة40 - وهو ما يتجاوز نطاق صلابة الهلاميات المائية التقليدية ثلاثية الأبعاد من النوع الأول. يمكن بسهولة ضبط صلابة الركيزة PAA عن طريق تغيير نسبة الروابط المتشابكة لتوليد صلابة ركيزة أعلى. باستخدام هذا النموذج ، نكشف أن بداية تكوين الأوعية الدموية تعتمد على الصلابة. لا توفر هذه الركائز صلابة قابلة للضبط فحسب ، بل تتيح أيضا التعديل المنهجي للعديد من الإشارات الميكانيكية الأخرى ، على سبيل المثال ، تكوين المصفوفة وكثافتها. بالإضافة إلى ذلك ، يسمح لنا هذا النموذج بدراسة الميكانيكا الخلوية أثناء التلاعب بالمنظمين الجزيئيين باستخدام تكييف الوسط (على سبيل المثال ، تأثير التثبيط على إشارات Notch على الميكانيكا الخلوية) لفهم الآليات الميكانيكية البيولوجية لتكوين الأوعية الدموية. يوضح هذا فائدة نموذج 2.5D ex vivo هذا لتكوين الأوعية الدموية في عينة من البيئات الدقيقة المختلفة.
يستخدم النموذج الذي نقدمه 2D TFM التقليدي ، والذي يوفر تحليلا أبسط ودقة مكانية أعلى وتنفيذ أسهل مقارنة ب TFM ثلاثي الأبعاد (اللزج المرن) ، مما يجعله أكثر سهولة وفعالية من حيث التكلفة26،41. ومع ذلك ، يوفر TFM ثلاثي الأبعاد (اللزج المرن) بيئة أكثر صلة من الناحية الفسيولوجية من خلال التقاط قوى الجر في جميع الأبعاد الثلاثة وحساب الخصائص الميكانيكية المعقدة للمصفوفة خارج الخلية ، مما يوفر رؤى أعمق لسلوك الخلية في سياق أكثر واقعية42،43،44،45. يشير تأثير الأبعاد هذا أيضا إلى تقييد هذا النموذج 2.5D. نستخدم 2D TFM على افتراض أن الخلايا تهاجر على ركيزة ثنائية الأبعاد. في حين أن هذا هو الحال في هذا النموذج 2.5D ، فإن الخلايا موجودة في بيئة ثلاثية الأبعاد محلية وبالتالي تلتصق بطبقة هلام الكولاجين من النوع الأول وتمارس قوى في طبقة الهلام هذه. الافتراض الذي اعتمدناه في هذا التحليل هو أن طبقة هلام الكولاجين من النوع الأول ليست مقترنة ميكانيكيا (لا يوجد انتقال قوة بين هذين الهلاميين المدروجين) بواجهة PAA بسبب اختلاف الحجم في صلابة المصفوفة ، وبالتالي تقليل تأثير القوى الخلوية على طبقة الكولاجين من النوع الأول. هذا يجعل توصيف القوة باستخدام نموذج 2.5D ex vivo تمثيلا مبسطا للقوى الناتجة عن الخلايا. بالإضافة إلى ذلك ، يتطلب هذا البروتوكول دقة وواسع النطاق مع العديد من الخطوات التي يمكن أن تفقد فيها العينات ، على سبيل المثال (أنا) صعوبات رؤية الخلية بسبب الأنسجة الزائدة المحيطة بالورقة الشريانية (الشكل 2) ، (2) واحدة من كل ثلاث عينات لا ترتبط بركيزة PAA (الشكل 3) ، (3) لن تبدأ جميع العينات في تكوين براعم خلوية (الشكل 5) ، (iv) لا تتشكل البراعم الخلوية عند ركيزة PAA ، و (v) علامات الفلورسنت خارج نطاق التركيز عند استخدام صفيحة شريانية سميكة فوق هيدروجيل PAA منخفض الصلابة. لذلك ، قمنا بتحسين هذه الطريقة لصفيحة مكونة من 12 بئرا لضمان الكثير من المناطق ذات الأهمية لإجراء التحليل الميكانيكي لتكوين الأوعية الدموية.
في الختام ، يمكن أن يساعد النهج المقدم للتوصيف المبسط لقوى الجر الخلوية لتكوين الأوعية الدموية لصفيحة شريانية خنزير حية باستخدام نموذج 2.5D (الشكل 7) في خلق رؤى أكثر دقة وفي الوقت الفعلي للتفاعلات الميكانيكية أثناء تكوين الأوعية الدموية في سياق الأنسجة الأصلية ، مما يسهل دراسة العمليات الخلوية الديناميكية مع تقليل التعقيد وتحسين قابلية التكاثر مقارنة بالأنظمة ثلاثية الأبعاد بالكامل. هذا يمكن أن يعزز فهمنا لكيفية استجابة الخلايا للإشارات الميكانيكية في بيئة أكثر صلة من الناحية الفسيولوجية مع الحفاظ على البساطة التحليلية للطرق ثنائية الأبعاد. يمكن لهذه المعرفة أن تعزز مجال هندسة الأنسجة بهدف إنشاء الأوعية الدموية ولكن أيضا إيجاد أدوية علاجية للوقاية من تكوين الأوعية الدموية بهدف الحد من نمو الورم وتقليل ورم خبيث.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للإفصاح عنه.
Acknowledgements
نشكر الناس من LifeTec على حصاد ونقل الشرايين السباتية الخنازير من المسلخ المحلي. ليون هيرمانز وبيم فان دن بيرسيلار وأدريا فيلاكروسا ريباس (TU / e ، ICMS) للمناقشات المثمرة حول الإجراءات التجريبية وتحليل التوصيف الميكانيكي. نعرب عن امتناننا للدعم من خلال المنح المقدمة من مجلس البحوث الأوروبي (771168) ، والمنظمة الهولندية للبحث العلمي (024.003.013) ، وأكاديمية فنلندا (307133 و 316882 و 330411 و 337531) ، ومراكز التميز في الميكانيكا الخلوية التابعة لمؤسسة جامعة أبو أكاديمي (CellMech).
Materials
| Name | Company | Catalog Number | Comments |
| 2% bis-acrylamide | Bio-Rad | 1610143 | |
| 2-mercaptoethanol | Merck Life Science | 60-24-2 | |
| 3-(Trimethoxysilyl)propyl methacrylate | Bind-Silane | Sigma-Aldrich | 440159-100ML |
| 40% acrylamide | Bio-Rad | 1610140 | |
| Aboslute ethanol (for analysis) | VWR International | 1.00983.1000 | |
| Absolute ethanol (industrial) | VWR International | 83813.41 | |
| Acetic acid, glacial 100% | Merck | 1000562500 | |
| Ammonium persulfate | APS | Bio-Rad | 7727-54-0 |
| antibody (primary) - calponin | abcam | ab46794 | |
| antibody (primary) - CD31 | Serotec | MCA1746 | |
| antibody (primary) - α-smooth muscle actin | αSMA | Dako | M0851 |
| antibody (secondary) - goat-anti-mouse-IgG1 Alexa 488 | Molecular Probes | A21121 | |
| antibody (secondary) - goat-anti-mouse-IgG2a Alexa 555 | Molecular Probes | A21137 | |
| antibody (secondary) - goat-anti-rabbit-IgG Alexa 555 | Molecular Probes | A21428 | |
| Autoclave | Astell | ||
| Calcium chloride dihydrate | CaCl2 | Calbiochem | 208291-250GM |
| Collagen type I, rat-tail | Corning | 354236 | |
| Collagen type IV, human placenta | Merck Life Science | C5533-5MG | |
| Endothelial Cell Growth Medium | ECG medium | Promocell | C-22111 |
| Expoxy-coated round tip tweezer | fine tweezer | Rubis Pinzette | E78144-2A |
| Fluorescent marker, dark red | Invitrogen | F8807 | |
| Glass coverslips, Ø13 mm, #1 | Epredia | CB00130RA120MNZ0 | |
| Glass coverslips, Ø13 mm, #1.5 | Epredia | CB00120RAC20MNZ0 | |
| Hydrochloride acid, 25% | HCl | Merck | 1.100316.1000 |
| Krebs-Henseleit buffer | Sigma-Aldrich | K3753 | |
| Microscope, Leica Application Suite X software, version 3.5.7.23225 | Leica Microsystems | ||
| Microscope, Leica DMi8 epifluorescent microscope | Leica Microsystems | ||
| Microscope, Nikon Ti2 Eclipse | Nikon | ||
| Microscope, NIS-Elements AR software | Nikon | ||
| N,N,N',N'-tetramethylethane-1,2-diamine | TEMED | Merck Life Science | 110-18-9 |
| Nalgene bottle | Thermo Scientific | 2187-0016 | |
| Needle, 21Gx1" | Henke Sass Wolf | HK4710008025 | |
| Normal serum, goat | Gibco | 10098792 | |
| Papaverine hydrochloride | Sigma | 61-25-6 | |
| Penicillin/Streptomyocin (10 000 U/mL) | P/S | Gibco | 15140163 |
| Petri-dish, large (145x20mm) | Greiner Bio-one | 639160 | |
| Petri-dish, small (60x15mm) | Greiner Bio-one | 628160 | |
| Phosphate Buffered Saline | PBS | Sigma | P4417 |
| Pluronic F-127 | Merck Life Science | P2443-250G | |
| Puncture needle, sharp closed tip | unknown | ||
| Scalpel, no. 4 | Swann-Morton | ||
| Sodium hydrogen carbonate | NaHCO3 | VWR International | 144-55-8 |
| sulfosuccinimidyl 6-(4'-azido-2'-nitrophenylamino)hexanoate | Sulfo-SANPAH | Thermo Scientific | 22589 |
| Surgical blade, no. 20 | Swann-Morton | ||
| Surgical drape sheet | Foliodrape | 2775001 | |
| Surgical tweezer | Lettix | 400024 | |
| Triton X-100 | Merck | 9036-19-5 | |
| UV lamp | Analytik Jena | 95-0042-13 | |
| well plate, 96-well, F-bottom | Greiner Bio-one | 655180 | |
| well plate, glass bottom 12-well | MatTek | P12G-0-14-F |
References
- Carmeliet, P. Angiogenesis in health and disease. Nat Med. 9 (6), 653-660 (2003).
- Folkman, J. Angiogenesis in cancer, vascular, rheumatoid and other disease. Nat Med. 1, 27-30 (1995).
- Kretschmer, M., Rüdiger, D., Zahler, S. Mechanical aspects of angiogenesis. Cancers. 13 (19), 4987 (2021).
- Bordeleau, F., et al. Matrix stiffening promotes a tumor vasculature phenotype. Proc Natl Acad Sci U S A. 114 (3), 492-497 (2017).
- Blanco, R., Gerhardt, H. VEGF and Notch in tip and stalk cell selection. Cold Spring Harb Perspect Med. 3 (1), a006569 (2013).
- Adams, R. H., Alitalo, K. Molecular regulation of angiogenesis and lymphangiogenesis. Nat Rev Mol Cell Biol. 8, 464-478 (2007).
- Carmeliet, P., De Smet, F., Loges, S., Mazzone, M. Branching morphogenesis and antiangiogenesis candidates: tip cells lead the way. Nat Rev Clin Oncol. 6, 315-326 (2009).
- Salam, N., et al. Assessment of migration of human mscs through fibrin hydrogels as a tool for formulation optimisation. Materials. 11 (9), 1781 (2018).
- Solbu, A. A., et al. Assessing cell migration in hydrogels: An overview of relevant materials and methods. Materials Today Bio. 18, 100537 (2023).
- Cao, W., Li, X., Zuo, X., Gao, C. Migration of endothelial cells into photo-responsive hydrogels with tunable modulus under the presence of pro-inflammatory macrophages. Regenerat Biomater. 6 (5), 259-267 (2019).
- Staton, C. A., Reed, M. W. R., Brown, N. J. A critical analysis of current in vitro and in vivo angiogenesis assays. Int J Exp Pathol. 90 (3), 195-221 (2009).
- Staton, C. A., et al. Current methods for assaying angiogenesis in vitro and in vivo. Int J Exp Path. 85, 233-248 (2004).
- Ngo, T. X., et al. In Vitro models for angiogenesis research: A review. Int J Tissue Regenerat. 5, 37-45 (2014).
- Tomita, Y., et al. An ex vivo choroid sprouting assay of ocular microvascular angiogenesis. J Vis Exp. (162), e61677 (2020).
- Kapoor, A., Chen, C. G., Iozzo, R. V. A simplified aortic ring assay: A useful ex vivo method to assess biochemical and functional parameters of angiogenesis. Matrix Biol Plus. 6-7, 100025 (2020).
- Stiffey-Wilusz, J., Boice, J. A., Ronan, J., Fletcher, A. M., Anderson, M. S. An ex vivo angiogenesis assay utilizing commercial porcine carotid artery: Modification of the rat aortic ring assay. Angiogenesis. 4 (1), 3-9 (2001).
- Kniazeva, E., Putnam, A. J. Endothelial cell traction and ECM density influence both capillary morphogenesis and maintenance in 3-D. Am J Physiol Cell Physiol. 297 (1), C179-C187 (2009).
- Davidson, C. D., Wang, W. Y., Zaimi, I., Jayco, D. K. P., Baker, B. M. Cell force-mediated matrix reorganization underlies multicellular network assembly. Sc Rep. 9 (1), 12 (2019).
- Lyle, K. S., Corleto, J. A., Wittmann, T. Microtubule dynamics regulation contributes to endothelial morphogenesis. BioArchitecture. 2 (6), 220-227 (2012).
- Kniazeva, E., et al. Quantification of local matrix deformations and mechanical properties during capillary morphogenesis in 3D. Integrat Biol. 4 (4), 431-439 (2012).
- Quintanilla, M. A., Hammer, J. A., Beach, J. R. Non-muscle myosin 2 at a glance. J Cell Sci. 136 (5), jcs.260890 (2023).
- Fischer, R. S., Gardel, M., Ma, X., Adelstein, R. S., Waterman, C. M. Local cortical tension by myosin II guides 3D endothelial cell branching. Curr Biol. 19 (3), 260-265 (2009).
- Yoon, C., et al. Myosin IIA–mediated forces regulate multicellular integrity during vascular sprouting. Mol Biol Cell. 30 (16), 1974-1984 (2019).
- Du, Y., et al. Three-dimensional characterization of mechanical interactions between endothelial cells and extracellular matrix during angiogenic sprouting. Sci Rep. 6, 21362 (2016).
- Vaeyens, M. M., et al. Matrix deformations around angiogenic sprouts correlate to sprout dynamics and suggest pulling activity. Angiogenesis. 23 (3), 315-324 (2020).
- Style, R. W., et al. Traction force microscopy in physics and biology. Soft Matter. 10 (23), 4047-4055 (2014).
- Trepat, X., et al. Physical forces during collective cell migration. Nat Phys. 5 (6), 426-430 (2009).
- Santos-Oliveira, P., et al. The force at the tip - modelling tension and proliferation in sprouting angiogenesis. PLoS Comput Biol. 11 (8), e1004436 (2015).
- Boreddy, S. R., Sahu, R. P., Srivastava, S. K. Benzyl isothiocyanate suppresses pancreatic tumor angiogenesis and invasion by inhibiting HIF-α/VEGF/Rho-GTPases: Pivotal role of STAT-3. PLoS One. 6 (10), 0025799 (2011).
- Teng, R. J., Eis, A., Bakhutashvili, I., Arul, N., Konduri, G. G. Increased superoxide production contributes to the impaired angiogenesis of fetal pulmonary arteries with in utero pulmonary hypertension. Am J Physiol Lung Cell Mol Physiol. 297 (1), L184-L195 (2009).
- Costa, G., et al. Asymmetric division coordinates collective cell migration in angiogenesis. Nature Cell Biol. 18 (12), 1292-1301 (2016).
- Slater, K., Partridge, J., Nandivada, H. . Corning tuning the elastic moduli of Corning Matrigel and collagen I 3D matrices by varying the protein concentration. , (2019).
- Lee, J., et al. Effect of chain flexibility on cell adhesion: Semi-flexible model-based analysis of cell adhesion to hydrogels. Sci Rep. 9 (1), 2463 (2019).
- Motte, S., Kaufman, L. J. Strain stiffening in collagen i networks. Biopolymers. 99 (1), 35-46 (2013).
- Butcher, D. T., Alliston, T., Weaver, V. M. A tense situation: Forcing tumour progression. Nat Rev Cancer. 9 (2), 108-122 (2009).
- Artym, V. V., Matsumoto, K. Imaging cells in three-dimensional collagen matrix. Curr Prot Cell Biol. 10, Unit 10.18.1-Unit 10.18.20 (2010).
- Labernadie, A., et al. A mechanically active heterotypic E-cadherin/N-cadherin adhesion enables fibroblasts to drive cancer cell invasion. Nat Cell Biol. 19 (3), 224-237 (2017).
- Bazellières, E., et al. Control of cell-cell forces and collective cell dynamics by the intercellular adhesome. Nat Cell Biol. 17 (4), 409-420 (2015).
- Uroz, M., et al. Traction forces at the cytokinetic ring regulate cell division and polyploidy in the migrating zebrafish epicardium. Nat Mater. 18 (9), 1015-1023 (2019).
- Dong, C., Nastaran, Z., Konstantopoulos, K. . Biomechanics in oncology. , (2018).
- Schwarz, U. S., Soiné, J. R. D. Traction force microscopy on soft elastic substrates: A guide to recent computational advances. Biochim Biophys Acta. 1853 (11), 3095-3104 (2015).
- Toyjanova, J., et al. 3D Viscoelastic traction force microscopy. Soft Matter. 10 (40), 8095-8106 (2014).
- Legant, W. R., et al. Multidimensional traction force microscopy reveals out-of-plane rotational moments about focal adhesions. Proc Natl Acad Sci U S A. 110 (3), 881-886 (2013).
- Steinwachs, J., et al. Three-dimensional force microscopy of cells in biopolymer networks. Nat Meth. 13 (2), 171-176 (2016).
- Franck, C., Maskarinec, S. A., Tirrell, D. A., Ravichandran, G. Three-dimensional traction force microscopy: A new tool for quantifying cell-matrix interactions. PLoS One. 6 (3), e17833 (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved