Method Article
生体組織における発芽血管新生の ex vivo 機械的特性評価のための2.5Dモデル
要約
発芽血管新生は、発生と疾患の基本であり、複雑な分子的および機械的プロセスに関与しています。ブタの頸動脈からの細胞芽を解析し、硬さ依存性の血管新生と明確なリーダーフォロワー細胞力学を明らかにする、汎用性の高い2.5D ex vivo モデルを紹介します。このモデルは、組織工学戦略とがん治療アプローチの進歩に役立ちます。
要約
発芽血管新生は、既存の血管系から新しい血管が形成されることであり、組織の成長や修復などの生理学的プロセスや、がんや転移などの病理学的プロセスにとって非常に重要です。発芽血管新生の多段階プロセスは、分子的および機械的に駆動されるプロセスです。これは、血管内皮増殖因子による細胞芽の誘導、Notchシグナル伝達によるリーダー/フォロワー細胞の選択、内皮細胞の指向性移動、および血管の融合と安定化で構成されています。細胞の発芽の根底にあるメカニズムをよりよく理解するために、さまざまな発芽血管新生モデルが長年にわたって開発されてきました。発芽血管新生の分子ドライバーの理解が進んでいるにもかかわらず、既存のモデルでは限界があるため、機械的な手がかりの役割と発芽血管新生の機械的ドライバーはまだ十分に調査されていません。本研究では、牽引力顕微鏡を用いてブタ頸動脈からの細胞発芽を機械的に特徴づけることができる2.5次元ex vivoモデルを設計しました。このモデルは、スプラウト内の明確な力のパターンを特定し、リーダー細胞が引っ張る力を行使し、フォロワー細胞がマトリックスに押す力を及ぼします。このモデルの汎用性により、マトリックスの剛性など、化学的および機械的な手がかりの両方を操作でき、さまざまな微小環境との関連性が高まります。ここでは、発芽血管新生の発症が硬直依存性であることを示しています。発芽血管新生における細胞牽引力を定量化するための提示された2.5Dモデルは、単純でありながら生理学的に関連性のある方法を提供し、機械的な手がかりに対する細胞応答の理解を深め、腫瘍血管新生に対する組織工学と治療戦略を前進させる可能性があります。
概要
血管新生は、既存の血管から新しい血管が形成されるプロセスです。このプロセスは、胚発生、創傷治癒、および癌の進行中に不可欠であり、これらはすべて微小環境の生体力学的変化に関連しています1,2,3,4。血管新生が始まると、低酸素組織または損傷した組織は血管内皮増殖因子(VEGF)を放出し、隣接する血管の内皮細胞を活性化して内皮芽を形成します。内皮芽の形成(発芽血管新生として知られる現象)により、リーダー細胞は周囲の細胞外マトリックスを分解し、トレーリングフォロワー細胞との細胞間接着を失うことなく、集合的にVEGF刺激に向かって移動する6,7。
過去数十年にわたって、さまざまな方法論を通じて集団細胞遊走を調査する発芽血管新生アッセイの数が増えており、それぞれが明確な利点と制限を提供しています。これらのアッセイは、3Dマトリックスを通じて、内皮細胞などの細胞群の協調的な動きを評価し、制御された環境下での発芽、浸潤、集団移動などの細胞挙動の研究を可能にする8,9,10。In vivo発芽血管新生アッセイは、生体内で包括的な評価を行い、複雑な相互作用を捕捉しますが、時間とコストがかかり、ばらつきが大きくなりやすく、定量化が困難です11,12。In vitro発芽血管新生アッセイは、高い再現性と正確な定量で実験条件を正確に制御することができますが、in vivoの複合体11,12,13を完全には再現しない可能性があります。対照的に、ex vivo発芽血管新生アッセイは、大動脈環アッセイが最も広く実施されているモデルであり、生物の外側の組織を使用し、生体内の合併症を回避しながら生理学的関連性を維持します14,15,16。ex vivoモデルは、技術的に困難であり、時には組織の生存率に苦労することもありますが、複雑さと制御の貴重なバランスを提供し、発芽血管新生を研究するための有望なアプローチとなっています。これらのモデルは、発芽血管新生の分子ドライバーを研究するために広く使用されてきましたが、機械的な手がかりの影響と細胞の機械的挙動はよくわかっていません。
発芽血管新生中の多細胞移動は、アクトミオシンに基づく収縮力が周囲の細胞外マトリックス17,18,19,20への内皮細胞の浸潤を調節するため、細胞力学に大きく依存する。具体的には、細胞21内の主要なアクチンベースの収縮器である非筋ミオシンIIモーターは、発芽血管新生22,23中の細胞収縮力を制御することが観察されている。周囲の3D細胞外マトリックスの変形は、リーダー細胞、特にアクチンに富む細胞突起23,24の周りで、そのフォロワー22,23,25と比較して有意に高いため、リーダー細胞は芽の主要な力生成要素である可能性が高い.3Dでの発芽血管新生における細胞収縮性の重要性を示す証拠が増えているにもかかわらず、発芽血管新生の細胞力学の時空間的な機械的特性評価の方法は不足しています。
この研究の全体的な目標は、発芽中の細胞移動の機械的特性評価を可能にする方法を開発することです。生物学的に関連性のある文脈で力学的力の時空間的特性評価を達成することにより、細胞力学が血管新生芽の形成にどのように影響するかについての新たな洞察を提供することを目指しています。そのために、2次元ポリアクリルアミド(PAA)ハイドロゲルを作製し、その上に頸動脈シートを播種し、I型コラーゲンゲルの薄層で覆うことで、細胞の局在化3次元環境を確立することで、2.5次元モデルシステムを開発しました。多細胞芽は、PAA-コラーゲンゲル界面上の動脈シートから移動しました。既存の技術と比較したこの方法の利点は、2D PAAハイドロゲルが牽引力顕微鏡(TFM)による分析を可能にすることである - これは、細胞が弾性のある2D基板に付着し、細胞牽引力26によって基板を変形させるよく知られた汎用性の高い技術である。これらの変形を捕捉することができ、細胞牽引力は、基板26の機械的特性に基づいて計算することができる。TFMをex vivo生体組織での使用に適応させることで、 in vitro 制御と in vivo 関連性の間のギャップを埋め、血管新生中の機械的力をより包括的に理解することを目指しています。
プロトコル
このプロトコルでは、ブタ頸動脈を使用しました。豚の頸動脈は、地元の食肉処理場から入手したオランダのランドレース雑種豚(生後5〜7か月、体重(生存)80〜120 kg)から採取されました。このプロトコルは、オランダ政府(オランダ農業・自然・食品品質省)が監督する診断および研究用の食肉処理場の動物材料に関するEC規則1069/2009に準拠しており、動物福祉の関連法的機関(食品消費者製品安全局)によって承認されました。組織はすでに終了した動物の副産物から採取されたため、倫理的承認は必要ありませんでした。死から組織輸送までの時間は、食肉処理場にもよりますが、10〜25分です。
注: 材料表 は、このプロトコルで使用される材料、機器、および試薬の詳細をまとめたものです。2Dおよび3Dサンプルのプロトコルは、 補足ファイル1に記載されています。
1. 2Dポリアクリルアミド(PAA)基板の調製
- ドラフト内で、12:1:1の無水エタノール(合成用)、酢酸、およびバインドシランをそれぞれ4286 μL、357 μL、および357 μLで混合して、バインドシラン溶液を調製します。120 μL/well bind-silane溶液をガラス底の12ウェルプレート上で室温で1時間インキュベートします。
注意:無水エタノールは引火性の高い液体および蒸気(H225)であり、深刻な眼刺激(H319)を引き起こします。酢酸は可燃性の液体および蒸気(H226)であり、重度の皮膚の火傷および眼の損傷(H314)を引き起こします。個人用保護具を着用し、ドラフトで作業してください。 - ドラフト内で、スプレーボトルを使用して、ガラス底の12ウェルプレートを無水エタノール(工業用)で3回洗浄します。エタノールを捨てます。
- ガラス底部の12ウェルプレートを窒素ガスで乾燥させます。ガラス底の上に白いグレースが現れた場合は、洗濯が十分ではありませんでした。ガラス底の12ウェルプレートを再洗浄します。
- PAAゲル混合物を 表1の比率に従って調製します。
- PBSを微量遠心チューブに添加し、40%アクリルアミド、2%ビスアクリルアミド、および蛍光マーカーをゲル混合物に再懸濁します。ゲル調製の直前に溶液をボルテックスします。
- できるだけ早く、10%のAPSとTEMEDを溶液に加え、各元素を添加した後にボルテックスします。11.5 μLのゲル混合物の液滴を各ウェルのガラス底にピペットで移し、液滴の上に13 mmのカバースリップを静かに置きます。
- プレートを軽くたたいて渦巻き、ゲル混合物をカバーガラスの下に均等に広げます。気泡が出た場合は、カバーガラスをそっと持ち上げて取り除いてください。ゲルを室温で1時間重合させます。チューブ内に残ったゲル混合物を用いて重合を確認します。12ウェルプレート内の重合PAAゲルは、内側にハローを示します。
注意:アクリルアミドは、飲み込んだり吸入したりすると有害であり(H302 + H332)、皮膚の炎症を引き起こし(H315)、アレルギー性皮膚反応を引き起こす可能性があり(H317)、深刻な眼の刺激を引き起こす(H319)、遺伝的欠陥を引き起こす可能性があり(H340)、癌を引き起こす可能性があり(H350)、生殖能力を損なう疑いがある(H361f)、飲み込むと長期または反復暴露による臓器の損傷を引き起こします(H372)。APSは、発火を強める(酸化剤、H272)、飲み込むと有害(H302)、皮膚刺激(H315)、アレルギー性皮膚反応(H317)、深刻な眼刺激(H319)、吸入するとアレルギーや喘息の症状、呼吸困難を引き起こす(H334)、呼吸器刺激(H335)を引き起こす可能性があります。TEMEDは引火性の高い液体および蒸気(H225)であり、飲み込むと有害(H302)、重度の皮膚火傷および眼の損傷(H314)を引き起こし、吸入すると有毒です(H331)。個人用保護具を着用してください。
- 重合後、PBSをウェルに加えます。ピンセットや曲がった針を使用して、カバースリップをそっと持ち上げて取り外します。PBSでゲルを一度洗浄します。
- PAAゲルのコラーゲンコーティングを促進するには、架橋剤Sulfo-SANPAHを使用してゲルを官能基化する必要があります。超純水に溶解した1 mg/mL Sulfo-SANPAH75 μLをPAAゲルに加え、365 nmのUV光下で5分間インキュベートします。
注:Sulfo-SANPAHを光から保護し、UVインキュベーションの直前に超純水を加えてください。明るい赤色(UV光インキュベーション前)から濃い赤色(UV光インキュベーション後)まで変色が見られます。
注意:スルホサンパは深刻な眼刺激を引き起こします(H319)。 - バイオセーフティキャビネットで、ゲル上のSulfo-SANPAHのPBS滅菌迅速洗浄を行います。したがって、官能基化されたPAAゲルを滅菌PBSで2回10分間洗浄します。
注:プロトコルのこの時点から、すべてのステップは滅菌条件下で実行されます。 - バイオセーフティキャビネットで、氷上のPBS中の0.1 mg/mL IV型コラーゲン溶液を調製します。50 μLの0.1 mg/mL IV型コラーゲン液滴を官能基化PAAゲルの上にピペットで移し、4°Cで一晩インキュベートします。
- ゲルを滅菌PBSで2回洗浄します。PBSを取り外し、ゲルを5分間乾燥させます。
- ゲルの上に50 μLの液滴を内皮細胞増殖(ECG)培地にピペットで移し、37°Cおよび5%CO2で少なくとも1時間インキュベートします。
注:ECG培地でゲルをインキュベートすると、ゲルへの細胞および組織の付着が改善されます。
2. 輸送用修飾クレブス溶液の調製
注意: 修正したクレブス溶液を新鮮に準備します。このプロトコルでは、改変されたクレブス溶液を組織採取の1日前に調製します。
- オートクレーブで輸送ボトルを滅菌します。ガラス瓶に、必要な総輸送量(350mL)の超純水の90%(315mL)を入れます。水温が15〜20°Cであることを確認してください。
- 攪拌磁石で水を穏やかに攪拌しながら、9.6 g/L(3.36 g)のクレブス・ヘンセライト緩衝液を加え、溶解するまで撹拌します。パスツールピペットを使用して、計量ボートを少量の溶液ですすぎ、溶液中の微量の粉末をすべて含めます。溶液を加熱しないでください。
- 撹拌しながら、0.373 g/L(130.55 mg)の塩化カルシウム(CaCl2)を溶液に加え、溶解するまで撹拌します。計量ボートを少量の溶液ですすいでください。
注意:H319は深刻な眼の炎症を引き起こします。 - 撹拌しながら、2.1 g / L(0.63 g)の重炭酸ナトリウム(NaHCO3)を溶液に加え、溶解するまで撹拌します。計量ボートを少量の溶液ですすいでください。
- 撹拌しながら、1 x 10-1 mM(13.15 mg)のパパベリンを溶液に加え、溶解するまで撹拌します。計量ボートを少量の溶液ですすいでください。
注:パパベリンは、収穫中に血管を切断して取り扱うことによって引き起こされる過度の血管収縮を防ぐために使用される平滑筋弛緩剤です。
注意:H301は飲み込むと有毒です。 - ドラフト内で、0.05 mM(1.2 μL)の2-メルカプトエタノールを溶液に加え、撹拌します。
注:2-メルカプトエタノールは、酸素ラジカルのレベルを低く保つために使用されます。
注意:2-メルカプトエタノールは、飲み込んだり吸入したりすると毒性があり(H301 + H331)、皮膚と接触すると致命的であり(H310)、皮膚刺激を引き起こし(H315)、アレルギー性皮膚反応を引き起こす可能性があり(H317)、深刻な眼の損傷を引き起こし(H318)、胎児に損傷を与える疑いがあり(H361d)、飲み込むと長時間または反復暴露により臓器に損傷を与える可能性があり(H373)、水生生物に非常に有毒で、長期的な影響があります(H410)。個人用保護具を着用し、ドラフトで作業してください。 - 撹拌しながら、1 N (1 M) HCl または 1 N (1 M) NaOH を添加して pH を 7.2 に調整します。最終的なpH目標は7.4ですが、ろ過中にpHが0.1〜0.3pH単位上昇する可能性があります。
注意: HClには、加圧下でガスが含まれています。加熱すると爆発する(H280)、重度の皮膚や目の損傷を引き起こす(H314)、吸入すると有毒である(H331)。個人用保護具を着用してください。 - バイオセーフティキャビネットでの作業を続けます。10%の超純水を加えて、溶液を最終容量にします。
- 気孔率0.22μmのメンブレンを使用したろ過により、溶液をすぐに滅菌します。滅菌溶液を滅菌ボトルに直接分注します。7 mLの2%ペニシリン/ストレプトミオシン(P / S)を溶液に加えます。.
注:輸送中は、2%P / Sを培地に追加して、すべての細菌を除去します。組織培養中に、1% P/Sを培地に添加します。 - 改質したクレブス溶液は、組織が回収されるまで4°Cで保存します。
3. ティッシュ・ハーベスティング
- 食肉処理場によっては、電気ショックまたはCO2によって豚を気絶させます。その後、豚を後肢から吊るし、放血し、死亡を宣言しました。
- きれいな屠殺プロセスに入る前に、毛の除去のためのやけどをした豚、最後の毛を取り除くためにシングル、そして枝肉の外側を殺菌して下さい。
- 腹部に沿って正中線を切開し、内臓を慎重に切除することにより、豚を内臓を抜出します。食肉処理場によっては、頸動脈がまだ豚の死体に付着していたか、または胸部臓器の摘み取りによって頸動脈がすでに死体から取り除かれていました。
- 鋭利なナイフを使用して、動脈に触れたり機械的な負担をかけたりすることなく、死体または喉領域の組織から残っている周辺組織で頸動脈を採取します。
- 頸動脈を含む組織を、ボトルを短く開けて、滅菌修飾クレブス溶液を含む輸送ボトルに入れます。.ボトルを一度ひっくり返して、組織全体がクレブス溶液で覆われていることを確認します。氷上の組織を実験室に輸送します。輸送には約30〜45分かかります。
4. 組織解剖
- 解剖装置の外科用ピンセット(乱暴な取り扱い)、エポキシコーティングされた丸い先端のピンセット(細かい取り扱い)、メス、ピンチャー、カバースリップをオートクレーブで滅菌します。
- 組織の回収/輸送の前にバイオセーフティキャビネットを準備してください。解剖領域を外科用ドレープシートで覆います。解剖装置(滅菌済み50 mLチューブ入り)、外科用ブレード、滅菌カバースリップを取り付けます。2つの大きなペトリ皿に滅菌PBSを入れて、解剖トレイを準備します。組織培養物を1つの小さなペトリ皿でECG培地と37°Cでインキュベートします。
- 組織輸送後、バイオセーフティキャビネット内で、頸動脈を輸送ボトル(改変クレブス溶液で満たされた)から、外科用ピンセットを使用して滅菌PBSで満たされた大きなペトリ皿に移します。
- 外科用ピンセットとメスを使用して頸動脈を囲む余分な組織を取り除き、頸動脈がはっきりと見えるようにします。
- 頸動脈の両端から2〜3 cmを取り除き、メスで切断して動脈の分岐部に近い領域を排除します。細い丸い先端のピンセットを使用して、頸動脈を囲む動脈筋膜を取り除きます。
注意: メスの刃を新しくすると、筋膜をより正確に切断するのに役立ちます。 - 頸動脈を滅菌PBSで満たされた新しい大きなペトリ皿に移します。動脈筋膜の残りの薄い層をできるだけ取り除きます。
注:頸動脈がPBSにある時間が長いほど、筋膜の断片が緩む傾向があります。筋膜の除去は、顕微鏡検査中に視力を遮るため、重要です。 - きれいな頸動脈を幅約2mmの輪に切ります。頸動脈リングをECG培地で満たされた予熱した小さなペトリ皿に移し、37°Cに保ちます。
5. ティッシュシーディング
注:組織の付着は、PAAハイドロゲルに播種した後、動脈シートの上に異なるサイズのカバースリップを、カバースリップなし、滅菌未処理のカバースリップ、または滅菌プルロン酸処理カバースリップ(PBS中の1% w / v プルロン酸、カバースリップを一晩インキュベートし、使用前に滅菌超純水で洗浄)を追加することによってテストしました。
- ゲルからECG培地の液滴を取り除きます。頸動脈リングを滅菌PBSで満たされた清潔な中型ペトリ皿に移します。
- 丸いピンセットとメスを使って、リングを半分に切ります。リングの半分を約2mm幅のシートに解剖して、寸法2 x 2 mmの動脈シートを作成します。動脈シートの内皮側の向きに注意してください。動脈シートの曲率と残っている筋膜は、この向きを決定するのに役立つ可能性があります。
注:頸動脈リングのサイズは異なる場合があります。大きなリングは約6〜8枚、小さなリングは約3〜4枚です。大きなリングは、動脈シートの曲率が少ないため、アタッチメントが強化されています。 - 丸い先端ピンセットを使用して、シートの背面(血管壁の外側)にある動脈シートをつかみ、シートを配置するときにPAA基板を損傷しないように、内皮の内側の内層をPAA基板に向けてPAAゲルの端にシートを置きます。
- ピンセットまたはピンチャーを使用して、ゲルに触れずに動脈シートをPAAハイドロゲルの中心に非常に穏やかに動かします。動脈シートをゲルの端に置きます(組織がピンセットまたはピンチャーにくっつく場合があります)。
注:血管壁の外側にある動脈筋膜の小さな残骸は、血管壁の内皮内層が非常に滑らかである間、動脈シートをつかむための簡単なハンドルを作成します。 - PAA基板上に配置した動脈シートの上に50μLのECG培地を追加します。ECG培地の液滴をゲルの上に保持します。
- 丸い先端のピンセットを使用して、PAA基板上の動脈シートの上に乾いた13mmのカバースリップを中程度に置きます。.ガラス底の内側の縁を使用して、カバーガラスが中程度の液滴に触れ、媒体がその下に広がるまで、カバーガラスをゆっくりと下げます。
注:13mmのカバースリップは、ガラス底ウェルプレートの内壁のサイズに密接に一致するため、有利です。カバーガラスを速く下げすぎると、ティッシュがカバーガラスの端に移動します。 - 組織を37°Cおよび5%CO2 で5時間付着させてから、各ウェルに1 mLのECG培地を加えます。動脈シートをPAA基質に37°Cおよび5%CO2 で24時間置きます。
6. 2.5Dモデルの作成
- カバースリップを取り外すための丸い先端のピンセットをオートクレーブします。1 M NaOHを超純水に調製し、孔径0.22 μmフィルターによるろ過により滅菌し、4°Cで保存します。
注:1 M NaOHは、将来の実験で再利用できます。 - 先端が曲がった滅菌済みの鋭利な針を使用して、動脈シートから13 mmのカバースリップを非常に静かに持ち上げ、カバースリップを取り外します。.ガラス底の内側のリングをサポートとして使用して、カバースリップを持ち上げて取り外します。横方向に動くと、PAA基質から動脈シートが剥がれるリスクが高まります。
- 滅菌マイクロ遠心チューブで、 表2 に従ってI型コラーゲン混合物を氷上に調製します。I型コラーゲンとNaOHを溶液に添加したら、よく再懸濁し、チューブを一度反転させて、混合物が均一に混合されるようにします。
注:I型コラーゲンを混合物に加えると、淡いピンク色の混合物は無色に変わります。NaOHを添加すると、無色の混合物が淡いピンク色に変わります。 - 真空吸引システムを使用して、ウェルから培地を取り出します。ティッシュに触れないように、ティッシュを囲む培地をできるだけ取り除きます。
注:動脈シートを囲む培地が多すぎると、コラーゲンI型ゲルが動脈シートを囲むのを防ぎます。 - 各動脈シートの上にI型コラーゲンの混合物10 μLの液滴を加え、I型コラーゲンのゲルを37°Cおよび5%CO2で1時間重合させます。
- 非常に穏やかに、予め加温したECG培地1 mLを各ウェルに加え、サンプルを37°Cおよび5%CO2に置きます。
7. ライブセルイメージング
注:ライブセルイメージングは、熱、CO2、および湿度制御を備えたLeica DMi8またはNikon Ti2 Eclipse落射蛍光顕微鏡を使用して実行し、LeicaまたはNISソフトウェアを使用して制御しました。アダプティブフォーカスコントロール(ライカ)とパーフェクトフォーカスシステム(ニコン)を使用して、時間内にピントを合わせました。
- 2.5Dシステムでの24時間の培養後、発芽血管新生を確認します。一部の動脈シートは、培養の24時間後にすでに細胞芽を形成し始めていますが、他のシートは内皮発芽を開始するためにさらに時間が必要です。
- 発芽血管新生が開始された場合は、ECG培地をリフレッシュし、12ウェルプレートを顕微鏡の37°C温めたインキュベーションボックス内のステージホルダーに入れます。
- 目的の目的を選択します。この研究では、10倍の対物レンズを使用して細胞芽の形成の全体的な概要を作成し、20倍の対物レンズを使用してTFMを実行するという異なる対物レンズを使用しました。
- 関心のあるチャネルを定義します。TFMでは、位相コントラストを使用して細胞芽を可視化し、波長660nmの蛍光チャンネルを使用してPAA基質の蛍光マーカー(濃い赤色)を可視化します。
- 関心のある領域を複数選択し、焦点面を見つけます。フォーカスシステム(Leica DMi8のアダプティブフォーカスコントロールまたはNikon Ti2 Eclipseのパーフェクトフォーカスシステム)をオンにして、タイムラプスイメージングで安定したフォーカスを確保します。
- 時間間隔とタイムラプスの長さを選択して、対象のタイムラプスを定義します。この研究では、さまざまな時間間隔 (5 〜 20 分) とタイムラプスの長さ (4 〜 24 時間) がさまざまな目的で使用されました。
- TFMの目的で、タイムラプスイメージング後、超純水に5% SDSの液滴を数滴加えて成長細胞を取り出し、数分待ちます。選択した各位置について、PAA基質中の蛍光マーカーのzスタック(z高さ2μm、ステップサイズ0.2μmと定義)を取り、蛍光マーカーのリラックス状態を基準画像として取得します。
注:Zスタックイメージングは、細胞が蛍光マーカーをz方向に引っ張ったり押したりする可能性があるため、実行されます。
8. 牽引力顕微鏡分析
- タイムラプス画像を最適な参照画像に対して位置合わせおよびトリミングして、正確な分析を行います。
- PAAハイドロゲル内の蛍光マーカーの変位を測定するには、カスタマイズされたMatLabコードを使用して、任意のタイムラプス画像と参照画像の間で粒子画像速度測定(PIV)を実行します。PIV 解析では、画像を 32 x 32 ピクセルのインテロゲーション ウィンドウに分割し、0.5 のオーバーラップを示します。
- ブーシネスク方程式27を使用して、有限のゲル厚さを持つ無限ゲルのフーリエ変換ベースの牽引顕微鏡法により、蛍光マーカーの変位から牽引力を計算します。
結果
記載されたプロトコルにより、我々は、コラーゲンI型ゲルの薄層で覆われた2D PAAヒドロゲルの上のブタ頸動脈から ex vivo 発芽血管新生を誘導することができ、したがって、2.5D ex vivo 発芽血管新生モデルを作成することができる。このモデルにより、従来のTFMを実行し、PAAゲル界面上の血管新生の発芽による細胞牽引力を空間的および時間的に測定することができます。
2.5Dモデルを確立するために、まず蛍光マーカーを埋め込んだ2Dポリアクリルアミド(PAA)ハイドロゲルを調製し、続いてIV型コラーゲン(d-1〜d0)で一晩コーティングしました。0日目(d0)に、頸動脈シートをコラーゲンIV被覆ヒドロゲルの上に置き、一晩(d0〜d1)接着させました。続いて、I型コラーゲンゲルの薄層を動脈シート上に塗布し、その後、1日目(d1)にイメージングを開始し、細胞の発芽を監視し、機械的分析のための蛍光マーカーを追跡しました(d1〜d2)。2.5Dモデルで発芽血管新生を検証するために、従来のex vivo発芽血管新生を3DコラーゲンI型ゲルで並行して行いました。このために、I型コラーゲンゲルの薄層を調製し、続いて頸動脈シートを播種し、続いて追加のコラーゲン層(d0)で覆った。血管新生の発芽を経時的にモニターした。さらに、2次元での発芽血管新生の誘導に努め、モデルの複雑さをさらに軽減しました。実験手順は2.5Dモデルと同じでしたが、主な違いは上部コラーゲンI型ゲル層が除外されていることです。実験手順を含む 3 つのモデルの概要を図 1 に示します。頸動脈は地元の食肉処理場から豚から採取され、無菌の新鮮なクレブス溶液で輸送されました。バイオセーフティキャビネット内では、頸動脈を囲む過剰な組織を切除し、ライブタイムラプスイメージング中に発芽血管新生の視覚障害が発生しないようにしました(図2A-E)。動脈が過剰な組織からきれいになったら、動脈を2 mm幅の動脈リングに切断し、リングを2 x 2 mmの寸法の動脈シートに切断しました(図2F)。
2.5Dおよび2Dモデル内のPAAハイドロゲル界面上で血管新生を確実に発芽させるために、IV型コラーゲンでコーティングされたPAAハイドロゲルに内側の内皮細胞側を向けて動脈シートを播種し、それらを付着させました。PAAハイドロゲルへの動脈シートの接着を最適化するために、動脈シートの上に防汚コーティングされた12mmガラスカバースリップを追加した場合の効果をテストしました。24時間後、カバーガラスを取り外し、PAAハイドロゲルに付着した動脈シートの割合によって付着効率を測定しました。防汚コーティングとは無関係にガラスカバースリップを追加すると、カバースリップがない場合と比較して、PAAハイドロゲルの上の動脈シートの接着効率が向上することがわかりました(図3A-D)。次に、ガラスカバースリップの直径(12mmまたは13mm)が動脈シートの取り付け効率に及ぼす影響をテストしましたが、プレートのインナーウェルは14mmでした。13 mmのカバースリップは、12 mmのカバースリップと比較して、PAAハイドロゲルの上の動脈シートの接着効率が向上することがわかりました(図3E-G)。PAAハイドロゲルへの動脈シートの取り付けには、2.5Dモデルと2Dモデルの両方で、未処理の13mmカバースリップを引き続き使用しました。
動脈シートをPAAハイドロゲルに接着した後、動脈シートの上にI型コラーゲンゲルの薄層を追加して、2.5D環境を作成しました。サンプルを5日間培養し、サンプルの発芽血管新生を調べました。我々は、3Dモデル(図4A)で細胞芽の形成を観察し、これは文献28,29,30で以前に報告されたex vivo発芽血管新生と一致している。2.5Dモデル内では、3Dモデルと比較して、細胞芽の組織化が同様であることが観察されました(図4B)。細胞芽は、PAA界面を含む複数の高さで形成されました(ビデオ1)。さらに、発芽血管新生は、リーダー細胞とフォロワー細胞の高増殖を特徴としており、これは2.5Dモデル内の発芽中に観察された現象です(ビデオ2)。動脈シートを2Dで培養すると、異なる起源の細胞(補足図1)が組織から単層として移動するため、細胞芽の組織化が欠如します(図4C)。2Dモデルでは発芽血管新生が観察されなかったため、このモデルはその後の解析から除外しました。全体として、動脈シートは発芽血管新生を誘導するために局所的な3D環境を必要とし、発芽血管新生の2.5Dex vivoモデルの可能性を示しています。
さらに、2.5Dモデルシステムは、細胞微小環境からの機械的な手がかり(マトリックスの剛性など)の影響を調べることができる汎用性の高いシステムです。3DコラーゲンI型ハイドロゲル(ex vivo発芽血管新生に一般的に使用されるハイドロゲル)のマトリックス剛性は、ECMタンパク質の濃度に依存しており、タンパク質濃度の増加はマトリックス剛性の増加と相関する32。この3Dヒドロゲルが発芽血管新生を誘導するためのI型コラーゲン濃度の典型的な範囲は1〜4 mg / mLであり、1 Pa〜1 kPaのマトリックス剛性に対応します32,33,34。低濃度では構造的なサポートを提供するには柔らかすぎる可能性があり、高濃度では細胞の動きが阻害される可能性があります。内皮組織の生理学的剛性は1 kPa35であり、これは3DコラーゲンI型ハイドロゲルで模倣できます。しかし、腫瘍の形成と進行は組織の硬化4と関連しているため、腫瘍の血管新生を研究するためには、より高いマトリックス剛性を達成できるモデルの必要性が強調されている。PAAハイドロゲルの基質剛性(動脈シートの内皮細胞によって感知される剛性)は、1〜数十kPaの範囲で簡単に調整できます。ここでは、I型コラーゲン層を添加した翌日に細胞芽の形成を開始した試料の割合を用いて、PAA基質の硬化が発芽血管新生の発症に及ぼす影響を検討しました。生理学的な軟質(1 kPa)PAAハイドロゲルで培養した場合、病理学的硬質(12 kPa)PAAハイドロゲル(図5)と比較して、より多くの動脈シートが細胞芽の初期の兆候を示したことが観察され、このモデルが血管新生の発芽に対するマトリックス硬化の影響を研究する可能性を示しました。調整可能な基質剛性に加えて、これらの基質は、他の機械的手がかり(マトリックスの組成や密度など)や化学的手がかり(培養液のコンディショニングによる分子調節因子の阻害など)の系統的な調節を可能にし、この2.5D ex vivo発芽血管新生モデルの多様性を実証しています。
発芽血管新生における細胞力学を定量化するために、2D PAA界面上に形成された細胞芽に対して従来の牽引力顕微鏡(TFM)を実施しました。I型コラーゲン層を添加した1日後、細胞(図6A)とPAAハイドロゲルに埋め込まれた蛍光マーカーのライブセルイメージングを行いました。蛍光マーカーの変位は、粒子画像速度測定法(図6B)を使用して測定し、細胞牽引力はPAAハイドロゲルの機械的特性(図6C)を使用して計算しました。この2.5D 生体外 モデルでは、最初に細胞芽のリーダー細胞の突起に引っ張られる力が観察され、次に細胞芽に沿って力が押されるのを観察しました(リーダー細胞の後部とフォロワー細胞の両方)(図6C)。
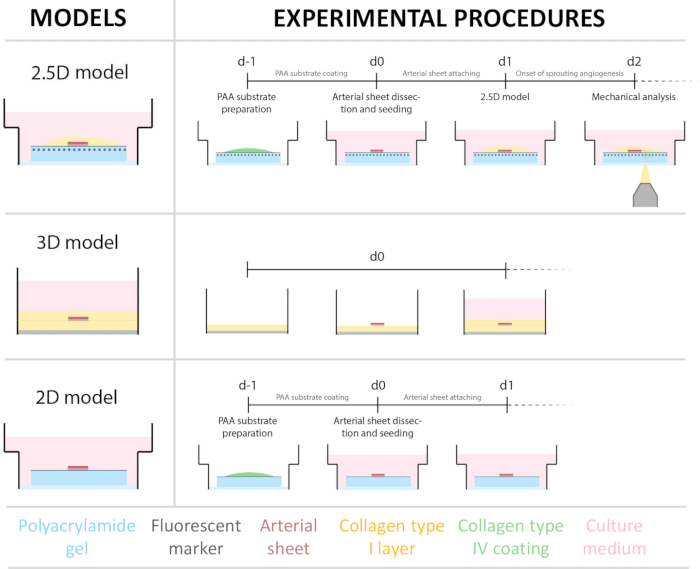
図1: 実験モデルと手順( 左)テストされた実験モデル。2.5D モデルは、平らな IV 型コラーゲンでコーティングされたポリアクリルアミド (PAA) ハイドロゲルの上に動脈シートを置き、I. 型コラーゲンの薄層で覆ったものを表しています。3Dモデルは、発芽血管新生を誘導することが知られているシステムであるコラーゲンI型ゲルの2つの層の間に挟まれた動脈シートを表しています36。2Dモデルは、平らなIV型コラーゲンでコーティングされたPAAハイドロゲルの上に置かれた動脈シートを表しています。(右)対応するモデルの実験手順。2Dモデルと2.5Dモデルの両方で、播種前日(d-1)にPAAハイドロゲルを調製し、IV型コラーゲンコーティングを一晩で行いました。頸動脈をブタから採取し、動脈シートに解剖し、0日目(d0)にヒドロゲルの上に播種し、一晩(d1)接着するために放置しました。2.5Dサンプルの場合、動脈シートの上にI型コラーゲンゲルの薄層を配置しました。機械的分析は、2日目(d2)の発芽開始後に実行されました。2D サンプルの場合、培地は 1 日目 (d1) にリフレッシュされました。3Dモデルでは、0日目(d0)の播種直前にI型コラーゲンゲルの層を調製しました。動脈シートは、コラーゲンI型層の上に播種され、コラーゲンI型の第2層で覆われ ています。
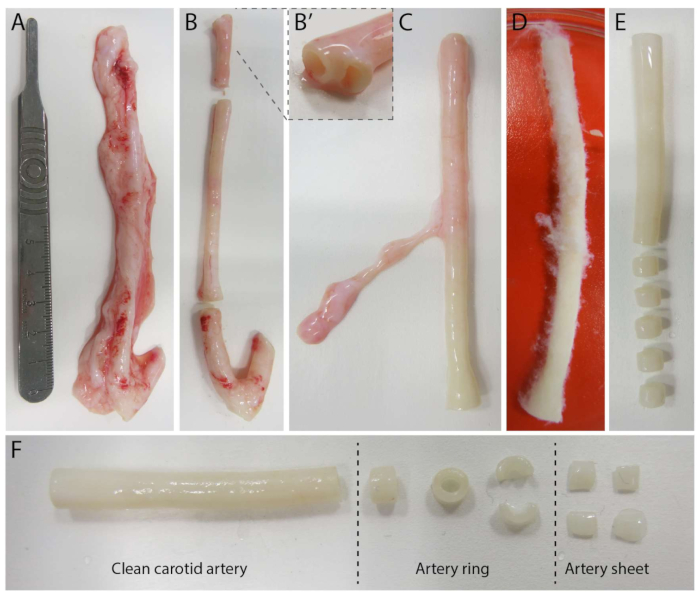
図2:頸動脈解離ステップ(d0)。 (A)地元の食肉処理場の豚から採取した長さ約10cmの頸動脈。(B)過剰な組織と約2cmの縁(分岐点に近づきすぎないように、(B'))を廃棄しました。(C-E)頸動脈を皮を剥がし(C)、PBSに浸し(D)、残りのすべての組織を皮を剥いで、イメージング中に明確な視認性を確保しました(E)。(F)きれいな頸動脈を約2mm幅の動脈輪にスライスします。各リングは、約2 x 2ミリメートルの寸法で4つの動脈シートにカットされています。 この図の拡大版を表示するには、ここをクリックしてください。
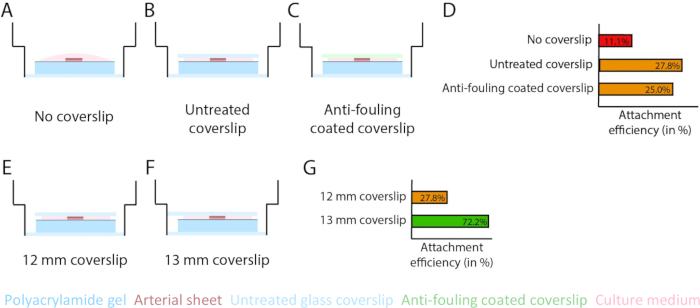
図3:13mmのガラスカバースリップ(d1)を使用すると、動脈シートの付着効率が向上します。 (A-D)ポリアクリルアミド(PAA)ハイドロゲルへの動脈シートの付着に対するガラスカバースリップの影響。ガラスカバースリップなし(A)、未処理のガラスカバースリップ(B)、およびPluronic F127(C)を使用した防汚コーティングガラスカバースリップを比較しました。付着効率は、カバースリップを取り外した後にPAAハイドロゲルに付着した動脈シートの数とサンプルの総数(カバースリップなし(36枚中4枚)、未処理のカバースリップ(36枚中10枚)、防汚コーティングされたカバースリップ(36枚中9枚;(E-G)PAAハイドロゲルへの動脈シートの付着に対する未処理のガラスカバースリップのサイズの影響。未処理の12 mmガラスカバースリップ(E)と未処理の13 mmガラスカバースリップ(F)を14 mmウェル内で比較しました。付着効率は、カバースリップを取り外した後にPAAヒドロゲルに付着した動脈シートの数とサンプルの総数(12 mmカバースリップ(36枚中10枚)および13 mmカバースリップ(72枚中52枚; この図の拡大版を表示するには、ここをクリックしてください。
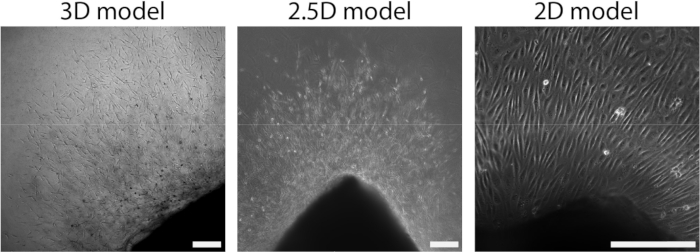
図4:モデルの次元性は、細胞成長中の組織化を定義します(d2+)。 細胞は、2.5Dモデル(中央)と同様に、3Dモデル(左)の芽組織内で組織から移動します。細胞は、2Dセットアップで単層組織化して組織から移動します(右)。スケールバーは250μmを表しています。 この図の拡大版を表示するには、ここをクリックしてください。

図5:2.5Dモデルにおける内皮発芽の開始は、ポリアクリルアミドハイドロゲル基質の剛性に依存します(d2)。 (A-B)プロトコールの2日目(層コラーゲンI型ゲルの添加の1日後)に、柔らかい(A; 1 kPa)または硬い(B; 12 kPa)ポリアクリルアミド(PAA)ハイドロゲルの上にコラーゲンI型ゲルの薄層で覆われた動脈シート。(C)発芽開始は、サンプルの総数(軟質(24のうち7)および硬(24のうち3))と比較して、すでに細胞増殖の兆候を示している動脈シートの数によって測定されました。スケールバーは1 mm(A、B)または500 μm(A'、B')を表します。 この図の拡大版を表示するには、ここをクリックしてください。

図6:早期発芽血管新生における牽引力の特性評価。 時間内(0-4時間)のイメージング細胞が一番上の行に表示されます。1 kPa PAAハイドロゲル基質上の対応する蛍光マーカーの変位(0-2 μm)と細胞牽引(0-50 Pa)が、それぞれ中央と下の行に表示されています。0時間、2時間、4時間での細胞牽引のズームインはオレンジ色で表示されます。 この図の拡大版を表示するには、ここをクリックしてください。
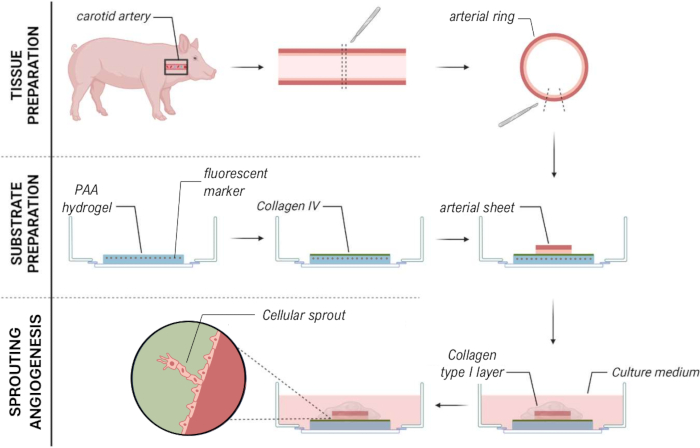
図7:細胞芽の機械的特性評価を可能にする2.5D ex vivo 発芽血管新生モデル法。 この図の拡大版を表示するには、ここをクリックしてください。
| 1キロパスカル | 12キロパスカット | |
| PBSの | 435 μL | 373.7μL |
| アクリルアミド 40% | 50 μL | 93.8μL |
| 2%ビスアクリルアミド | 7.5μL | 25μL |
| 蛍光マーカー(えんじ色) | 5 μL | 5 μL |
| 10%のAPS | 2.5 μL | 2.5 μL |
| テメド | 0.25 μL | 0.25 μL |
表1: PAAゲル混合物の比率。
| 式 | 12ウェルプレートあたりの容量(130 μL) | |
| ECG媒体 | VECG=Vfinal-V col1-V NaOH | 82.16μL |
| I.型コラーゲン | Vcol1=(Vファイナル×Cファイナル)/Cストック | 46μL |
| NaOHの | VNaOH=0.04*Vcol1 | 1.84 μL |
表2: I型コラーゲンは、容量(V)と濃度(C)の略語を使用して容量を混合します。
ビデオ1:2.5Dモデル内の細胞芽形成のタイムラプスイメージング。 細胞は、位相コントラストイメージングを使用して、17.5分の時間間隔で22時間にわたってイメージングされました。細胞芽は、異なる焦点面によって観察されたように、コラーゲンI型ゲル層内の複数の高さで形成されました。スケールバーは100 μmを表しています。 このビデオをダウンロードするには、ここをクリックしてください。
ビデオ2:2.5Dモデル内の細胞芽内の細胞の高い増殖率。 細胞は、位相コントラストイメージングを使用して、17.5分の時間間隔で22時間にわたってイメージングされました。リーダー細胞とフォロワー細胞の両方が、タイムラプスイメージング中に増殖します。スケールバーは100 μmを表しています。 このビデオをダウンロードするには、ここをクリックしてください。
補足 図1:免疫蛍光染色による2Dモデル(d2+)の細胞表現型。 (A)細胞核(DAPI)、内皮細胞マーカー(CD31)、および線維芽細胞マーカー(α-平滑筋アクチン;α-SMA)の免疫蛍光(IF)染色。(B)細胞核(DAPI)、内皮細胞マーカー(CD31)、平滑筋細胞マーカー(カルポニン)のIF染色。スケールバーは100μmを表しています。この図をダウンロードするには、ここをクリックしてください。
補足ファイル1:免疫蛍光染色プロトコル。 このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
発芽血管新生 - 新しい血管の形成 - は、分子メカニズムと機械的メカニズムの両方によって制御される複雑なプロセスです。過去数十年にわたって、発芽血管新生の分子ドライバー(VEGFやNotchシグナル伝達など)を研究するために多くの3Dモデルが開発されてきましたが、モデルの制限により、細胞力学についてはほとんど知られていません。牽引力顕微鏡(TFM)は、空間と時間における細胞力を定量化するためのよく知られた技術であり、2D基板の変形が細胞の牽引に変換されます。したがって、このプロトコルでは、2.5D ex vivoモデル、つまり、発芽血管新生中の牽引力の定量化を可能にする2Dモデルの単純さを維持しながら、細胞に3D環境を局所的に提供することを意味します(図1)。そのために、ブタの動脈シートを準備して播種しました(内皮側を下にして;図2)蛍光マーカーを含むIV型コラーゲンコーティングポリアクリルアミド(PAA)ハイドロゲルの上。13mmのガラスカバースリップを使用して動脈シートを接着した後(図3)、細胞芽の形成を可能にするコラーゲンI型ハイドロゲルの薄層を追加します(図4)。このモデルを用いて、我々は、細胞発芽22,23,24,25の間に、リーダー細胞が引っ張る力を発揮する(文献19,20,21,22で観察されたように)だけでなく、フォロワー細胞が押す力を発揮することも示す(図6).私たちのプロトコルを通じて得られた牽引場の分解能は、準拠基板37,38,39上の牽引力顕微鏡に頼る作品の典型的な時間と空間の両方での細胞運動学とダイナミクスの定量的分析を可能にします。
さらに、微小環境の機械的手がかりを変えることにより、この発芽血管新生の2.5D ex vivo モデルの多様性を実証します(図5)。発芽血管新生は通常、1kPa35 の生理学的剛性で起こるが、これは3DコラーゲンI型ハイドロゲルによって模倣され得るが、腫瘍血管新生は硬化した微小環境で起こる40 これは、従来の3DコラーゲンI型ハイドロゲルの剛性範囲を超えている。PAA基板の剛性は、架橋剤の比率を変更してより高い基板剛性を生成することで簡単に調整できます。このモデルを用いて、発芽血管新生の発症が剛性依存性であることを明らかにしました。これらの基板は、調整可能な剛性を提供するだけでなく、マトリックスの組成や密度など、他のさまざまな機械的手がかりの体系的な変調も可能にします。また、このモデルにより、培地の条件付けを用いて分子制御因子を操作しながら細胞力学を研究することができます(例えば、Notchシグナル伝達に対する阻害が細胞力学に及ぼす影響)ことで、血管新生の発芽メカニズムを理解することができます。これは、さまざまな微小環境のスウォッチで発芽血管新生のこの2.5Dex vivo モデルの有用性を示しています。
私たちが提示するモデルは、従来の2D TFMを利用しており、3D(粘弾性)TFMと比較して、より簡単な分析、高い空間分解能、および実装が容易で、よりアクセスしやすく、費用対効果が高い26,41。しかし、3D(粘弾性)TFMは、3次元すべてで牽引力を捕捉し、細胞外マトリックスの複雑な機械的特性を考慮することにより、より生理学的に関連性のある環境を提供し、より現実的な状況で細胞の挙動についてより深い洞察を提供する42,43,44,45.この次元の影響は、この 2.5D モデルの限界も示しています。2D TFMは、細胞が2D基板上を移動していると仮定して使用します。この2.5Dモデルでは、細胞は局所的な3D環境にあるため、I型コラーゲンゲル層に付着し、このゲル層に力を及ぼします。この解析で採用した仮定は、マトリックスの硬さの桁違いにより、I型コラーゲンゲル層がPAA界面に機械的に結合していない(これら2つのハイドロゲル間の力伝達がない)ため、I型コラーゲン層に対する細胞力の影響が最小限に抑えられるというものです。これにより、2.5D ex vivoモデルを使用した力の特性評価は、細胞によって生成される力の簡略化された表現になります。さらに、このプロトコルは精度が必要であり、サンプルが失われる可能性のあるいくつかのステップ、例えば、(i)動脈シートを囲む過剰な組織による細胞の視認性の困難さ(図2)、(ii)3つのサンプルのうち1つがPAA基質に付着しない(図3)、(iii)すべてのサンプルが細胞芽の形成を開始するわけではない(図5)、(iv)PAA基質に細胞芽が形成されない、および(v)低剛性のPAAハイドロゲルの上に厚い動脈シートを使用すると、焦点が合っていない蛍光マーカーが生じる。したがって、この方法を12ウェルプレートに最適化して、発芽血管新生の機械的分析を行うための関心領域を十分に確保しました。
結論として、2.5Dモデル(図7)を使用して、生きているブタ動脈シートの発芽血管新生の細胞牽引力の簡略化された特性評価のための提示されたアプローチは、天然の組織コンテキスト内で血管新生中の機械的相互作用についてより正確でリアルタイムの洞察を作成するのに役立ち、完全な3Dシステムと比較して複雑さを軽減し、再現性を向上させた動的細胞プロセスの研究を容易にします。これにより、2D法の分析の簡便さを維持しながら、より生理学的に関連性の高い環境で細胞が機械的な手がかりにどのように反応するかについての理解が深まる可能性があります。この知識は、血管の作成を目的とした組織工学の分野を進歩させるだけでなく、腫瘍の成長を制限し、転移を減らすことを目的とした腫瘍血管新生の予防のための治療薬を見つけることもできます。
開示事項
著者には、開示すべき利益相反はありません。
謝辞
地元の食肉処理場から豚の頸動脈を収穫し、輸送してくれたLifeTecの人々に感謝します。Leon Hermans、Pim van den Bersselaar、Adrià Villacrosa Ribas (TU/e, ICMS) は、実験手順と機械的特性解析に関する有意義な議論をいただきました。欧州研究会議(771168)、オランダ科学研究機構(024.003.013)、フィンランドアカデミー(307133、316882、330411、337531)、オーボアカデミー大学財団の細胞メカニズムセンターオブエクセレンス(CellMech)からの助成金による支援に感謝します。
資料
| Name | Company | Catalog Number | Comments |
| 2% bis-acrylamide | Bio-Rad | 1610143 | |
| 2-mercaptoethanol | Merck Life Science | 60-24-2 | |
| 3-(Trimethoxysilyl)propyl methacrylate | Bind-Silane | Sigma-Aldrich | 440159-100ML |
| 40% acrylamide | Bio-Rad | 1610140 | |
| Aboslute ethanol (for analysis) | VWR International | 1.00983.1000 | |
| Absolute ethanol (industrial) | VWR International | 83813.41 | |
| Acetic acid, glacial 100% | Merck | 1000562500 | |
| Ammonium persulfate | APS | Bio-Rad | 7727-54-0 |
| antibody (primary) - calponin | abcam | ab46794 | |
| antibody (primary) - CD31 | Serotec | MCA1746 | |
| antibody (primary) - α-smooth muscle actin | αSMA | Dako | M0851 |
| antibody (secondary) - goat-anti-mouse-IgG1 Alexa 488 | Molecular Probes | A21121 | |
| antibody (secondary) - goat-anti-mouse-IgG2a Alexa 555 | Molecular Probes | A21137 | |
| antibody (secondary) - goat-anti-rabbit-IgG Alexa 555 | Molecular Probes | A21428 | |
| Autoclave | Astell | ||
| Calcium chloride dihydrate | CaCl2 | Calbiochem | 208291-250GM |
| Collagen type I, rat-tail | Corning | 354236 | |
| Collagen type IV, human placenta | Merck Life Science | C5533-5MG | |
| Endothelial Cell Growth Medium | ECG medium | Promocell | C-22111 |
| Expoxy-coated round tip tweezer | fine tweezer | Rubis Pinzette | E78144-2A |
| Fluorescent marker, dark red | Invitrogen | F8807 | |
| Glass coverslips, Ø13 mm, #1 | Epredia | CB00130RA120MNZ0 | |
| Glass coverslips, Ø13 mm, #1.5 | Epredia | CB00120RAC20MNZ0 | |
| Hydrochloride acid, 25% | HCl | Merck | 1.100316.1000 |
| Krebs-Henseleit buffer | Sigma-Aldrich | K3753 | |
| Microscope, Leica Application Suite X software, version 3.5.7.23225 | Leica Microsystems | ||
| Microscope, Leica DMi8 epifluorescent microscope | Leica Microsystems | ||
| Microscope, Nikon Ti2 Eclipse | Nikon | ||
| Microscope, NIS-Elements AR software | Nikon | ||
| N,N,N',N'-tetramethylethane-1,2-diamine | TEMED | Merck Life Science | 110-18-9 |
| Nalgene bottle | Thermo Scientific | 2187-0016 | |
| Needle, 21Gx1" | Henke Sass Wolf | HK4710008025 | |
| Normal serum, goat | Gibco | 10098792 | |
| Papaverine hydrochloride | Sigma | 61-25-6 | |
| Penicillin/Streptomyocin (10 000 U/mL) | P/S | Gibco | 15140163 |
| Petri-dish, large (145x20mm) | Greiner Bio-one | 639160 | |
| Petri-dish, small (60x15mm) | Greiner Bio-one | 628160 | |
| Phosphate Buffered Saline | PBS | Sigma | P4417 |
| Pluronic F-127 | Merck Life Science | P2443-250G | |
| Puncture needle, sharp closed tip | unknown | ||
| Scalpel, no. 4 | Swann-Morton | ||
| Sodium hydrogen carbonate | NaHCO3 | VWR International | 144-55-8 |
| sulfosuccinimidyl 6-(4'-azido-2'-nitrophenylamino)hexanoate | Sulfo-SANPAH | Thermo Scientific | 22589 |
| Surgical blade, no. 20 | Swann-Morton | ||
| Surgical drape sheet | Foliodrape | 2775001 | |
| Surgical tweezer | Lettix | 400024 | |
| Triton X-100 | Merck | 9036-19-5 | |
| UV lamp | Analytik Jena | 95-0042-13 | |
| well plate, 96-well, F-bottom | Greiner Bio-one | 655180 | |
| well plate, glass bottom 12-well | MatTek | P12G-0-14-F |
参考文献
- Carmeliet, P. Angiogenesis in health and disease. Nat Med. 9 (6), 653-660 (2003).
- Folkman, J. Angiogenesis in cancer, vascular, rheumatoid and other disease. Nat Med. 1, 27-30 (1995).
- Kretschmer, M., Rüdiger, D., Zahler, S. Mechanical aspects of angiogenesis. Cancers. 13 (19), 4987 (2021).
- Bordeleau, F., et al. Matrix stiffening promotes a tumor vasculature phenotype. Proc Natl Acad Sci U S A. 114 (3), 492-497 (2017).
- Blanco, R., Gerhardt, H. VEGF and Notch in tip and stalk cell selection. Cold Spring Harb Perspect Med. 3 (1), a006569 (2013).
- Adams, R. H., Alitalo, K. Molecular regulation of angiogenesis and lymphangiogenesis. Nat Rev Mol Cell Biol. 8, 464-478 (2007).
- Carmeliet, P., De Smet, F., Loges, S., Mazzone, M. Branching morphogenesis and antiangiogenesis candidates: tip cells lead the way. Nat Rev Clin Oncol. 6, 315-326 (2009).
- Salam, N., et al. Assessment of migration of human mscs through fibrin hydrogels as a tool for formulation optimisation. Materials. 11 (9), 1781 (2018).
- Solbu, A. A., et al. Assessing cell migration in hydrogels: An overview of relevant materials and methods. Materials Today Bio. 18, 100537 (2023).
- Cao, W., Li, X., Zuo, X., Gao, C. Migration of endothelial cells into photo-responsive hydrogels with tunable modulus under the presence of pro-inflammatory macrophages. Regenerat Biomater. 6 (5), 259-267 (2019).
- Staton, C. A., Reed, M. W. R., Brown, N. J. A critical analysis of current in vitro and in vivo angiogenesis assays. Int J Exp Pathol. 90 (3), 195-221 (2009).
- Staton, C. A., et al. Current methods for assaying angiogenesis in vitro and in vivo. Int J Exp Path. 85, 233-248 (2004).
- Ngo, T. X., et al. In Vitro models for angiogenesis research: A review. Int J Tissue Regenerat. 5, 37-45 (2014).
- Tomita, Y., et al. An ex vivo choroid sprouting assay of ocular microvascular angiogenesis. J Vis Exp. (162), e61677 (2020).
- Kapoor, A., Chen, C. G., Iozzo, R. V. A simplified aortic ring assay: A useful ex vivo method to assess biochemical and functional parameters of angiogenesis. Matrix Biol Plus. 6-7, 100025 (2020).
- Stiffey-Wilusz, J., Boice, J. A., Ronan, J., Fletcher, A. M., Anderson, M. S. An ex vivo angiogenesis assay utilizing commercial porcine carotid artery: Modification of the rat aortic ring assay. Angiogenesis. 4 (1), 3-9 (2001).
- Kniazeva, E., Putnam, A. J. Endothelial cell traction and ECM density influence both capillary morphogenesis and maintenance in 3-D. Am J Physiol Cell Physiol. 297 (1), C179-C187 (2009).
- Davidson, C. D., Wang, W. Y., Zaimi, I., Jayco, D. K. P., Baker, B. M. Cell force-mediated matrix reorganization underlies multicellular network assembly. Sc Rep. 9 (1), 12 (2019).
- Lyle, K. S., Corleto, J. A., Wittmann, T. Microtubule dynamics regulation contributes to endothelial morphogenesis. BioArchitecture. 2 (6), 220-227 (2012).
- Kniazeva, E., et al. Quantification of local matrix deformations and mechanical properties during capillary morphogenesis in 3D. Integrat Biol. 4 (4), 431-439 (2012).
- Quintanilla, M. A., Hammer, J. A., Beach, J. R. Non-muscle myosin 2 at a glance. J Cell Sci. 136 (5), jcs.260890 (2023).
- Fischer, R. S., Gardel, M., Ma, X., Adelstein, R. S., Waterman, C. M. Local cortical tension by myosin II guides 3D endothelial cell branching. Curr Biol. 19 (3), 260-265 (2009).
- Yoon, C., et al. Myosin IIA–mediated forces regulate multicellular integrity during vascular sprouting. Mol Biol Cell. 30 (16), 1974-1984 (2019).
- Du, Y., et al. Three-dimensional characterization of mechanical interactions between endothelial cells and extracellular matrix during angiogenic sprouting. Sci Rep. 6, 21362 (2016).
- Vaeyens, M. M., et al. Matrix deformations around angiogenic sprouts correlate to sprout dynamics and suggest pulling activity. Angiogenesis. 23 (3), 315-324 (2020).
- Style, R. W., et al. Traction force microscopy in physics and biology. Soft Matter. 10 (23), 4047-4055 (2014).
- Trepat, X., et al. Physical forces during collective cell migration. Nat Phys. 5 (6), 426-430 (2009).
- Santos-Oliveira, P., et al. The force at the tip - modelling tension and proliferation in sprouting angiogenesis. PLoS Comput Biol. 11 (8), e1004436 (2015).
- Boreddy, S. R., Sahu, R. P., Srivastava, S. K. Benzyl isothiocyanate suppresses pancreatic tumor angiogenesis and invasion by inhibiting HIF-α/VEGF/Rho-GTPases: Pivotal role of STAT-3. PLoS One. 6 (10), 0025799 (2011).
- Teng, R. J., Eis, A., Bakhutashvili, I., Arul, N., Konduri, G. G. Increased superoxide production contributes to the impaired angiogenesis of fetal pulmonary arteries with in utero pulmonary hypertension. Am J Physiol Lung Cell Mol Physiol. 297 (1), L184-L195 (2009).
- Costa, G., et al. Asymmetric division coordinates collective cell migration in angiogenesis. Nature Cell Biol. 18 (12), 1292-1301 (2016).
- Slater, K., Partridge, J., Nandivada, H. . Corning tuning the elastic moduli of Corning Matrigel and collagen I 3D matrices by varying the protein concentration. , (2019).
- Lee, J., et al. Effect of chain flexibility on cell adhesion: Semi-flexible model-based analysis of cell adhesion to hydrogels. Sci Rep. 9 (1), 2463 (2019).
- Motte, S., Kaufman, L. J. Strain stiffening in collagen i networks. Biopolymers. 99 (1), 35-46 (2013).
- Butcher, D. T., Alliston, T., Weaver, V. M. A tense situation: Forcing tumour progression. Nat Rev Cancer. 9 (2), 108-122 (2009).
- Artym, V. V., Matsumoto, K. Imaging cells in three-dimensional collagen matrix. Curr Prot Cell Biol. 10, Unit 10.18.1-Unit 10.18.20 (2010).
- Labernadie, A., et al. A mechanically active heterotypic E-cadherin/N-cadherin adhesion enables fibroblasts to drive cancer cell invasion. Nat Cell Biol. 19 (3), 224-237 (2017).
- Bazellières, E., et al. Control of cell-cell forces and collective cell dynamics by the intercellular adhesome. Nat Cell Biol. 17 (4), 409-420 (2015).
- Uroz, M., et al. Traction forces at the cytokinetic ring regulate cell division and polyploidy in the migrating zebrafish epicardium. Nat Mater. 18 (9), 1015-1023 (2019).
- Dong, C., Nastaran, Z., Konstantopoulos, K. . Biomechanics in oncology. , (2018).
- Schwarz, U. S., Soiné, J. R. D. Traction force microscopy on soft elastic substrates: A guide to recent computational advances. Biochim Biophys Acta. 1853 (11), 3095-3104 (2015).
- Toyjanova, J., et al. 3D Viscoelastic traction force microscopy. Soft Matter. 10 (40), 8095-8106 (2014).
- Legant, W. R., et al. Multidimensional traction force microscopy reveals out-of-plane rotational moments about focal adhesions. Proc Natl Acad Sci U S A. 110 (3), 881-886 (2013).
- Steinwachs, J., et al. Three-dimensional force microscopy of cells in biopolymer networks. Nat Meth. 13 (2), 171-176 (2016).
- Franck, C., Maskarinec, S. A., Tirrell, D. A., Ravichandran, G. Three-dimensional traction force microscopy: A new tool for quantifying cell-matrix interactions. PLoS One. 6 (3), e17833 (2011).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved