Method Article
Modello 2.5D per la caratterizzazione meccanica ex vivo dell'angiogenesi da germogliamento in tessuto vivente
In questo articolo
Riepilogo
L'angiogenesi da germoglio, fondamentale per lo sviluppo e la malattia, coinvolge complessi processi molecolari e meccanici. Presentiamo un versatile modello ex vivo 2.5D che analizza la germinazione cellulare dalle arterie carotidi suine, rivelando l'angiogenesi rigida-dipendente e la distinta meccanica delle cellule leader-follower. Questo modello aiuta a far progredire le strategie di ingegneria tissutale e gli approcci alla terapia del cancro.
Abstract
L'angiogenesi è la formazione di nuovi vasi sanguigni da vasi sanguigni preesistenti ed è di grande importanza per la fisiologia come la crescita e la riparazione dei tessuti e i processi patologici, tra cui il cancro e le metastasi. Il processo a più fasi di germinazione dell'angiogenesi è un processo guidato molecolarmente e meccanicamente. Consiste nell'induzione del germoglio cellulare da parte del fattore di crescita dell'endotelio vascolare, nella selezione delle cellule leader/follower attraverso la segnalazione Notch, nella migrazione diretta delle cellule endoteliali e nella fusione e stabilizzazione dei vasi. Nel corso degli anni è stata sviluppata una varietà di modelli di angiogenesi germinativa per comprendere meglio i meccanismi alla base della germinazione cellulare. Nonostante i progressi nella comprensione dei fattori molecolari dell'angiogenesi germinativa, il ruolo dei segnali meccanici e il driver meccanico dell'angiogenesi germinativa rimangono inesplorati a causa delle limitazioni dei modelli esistenti. In questo studio, abbiamo progettato un modello ex vivo 2.5D che ci consente di caratterizzare meccanicamente la germinazione cellulare da un'arteria carotide suina utilizzando la microscopia a forza di trazione. Il modello identifica modelli di forza distinti all'interno del germoglio, in cui le cellule leader esercitano forze di trazione e le cellule follower esercitano forze di spinta sulla matrice. La versatilità del modello consente la manipolazione di segnali sia chimici che meccanici, come la rigidità della matrice, migliorandone la rilevanza per vari microambienti. Qui, dimostriamo che l'inizio dell'angiogenesi germinativa è rigidità-dipendente. Il modello 2.5D presentato per quantificare le forze di trazione cellulare nell'angiogenesi germinativa offre un metodo semplificato ma fisiologicamente rilevante, migliorando la nostra comprensione delle risposte cellulari a segnali meccanici, che potrebbero far progredire l'ingegneria tissutale e le strategie terapeutiche contro l'angiogenesi tumorale.
Introduzione
L'angiogenesi è il processo di formazione di nuovi vasi sanguigni da vasi sanguigni preesistenti. Questo processo è essenziale durante lo sviluppo embrionale, la guarigione delle ferite e la progressione del cancro, tutti associati a cambiamenti biomeccanici nel microambiente 1,2,3,4. All'inizio dell'angiogenesi, i tessuti ipossici o danneggiati rilasciano il fattore di crescita dell'endotelio vascolare (VEGF) che attiverà le cellule endoteliali dei vasi sanguigni vicini per formare germogli endoteliali, in cui due distinti fenotipi leader e follower vengono adottati attraverso la via di segnalazione molecolareNotch 5. Dopo la formazione di germogli endoteliali, un fenomeno noto come angiogenesi germinativa, le cellule leader degraderanno la matrice extracellulare circostante per migrare collettivamente verso lo stimolo VEGF senza perdere le aderenze cellula-cellula con le cellule seguitrici finali 6,7.
Negli ultimi decenni, è stato descritto un numero crescente di saggi di angiogenesi germinativa che studiano la migrazione cellulare collettiva attraverso varie metodologie, ognuna delle quali offre vantaggi e limitazioni distinti. Questi saggi valutano il movimento coordinato di gruppi cellulari, come le cellule endoteliali, attraverso matrici 3D, consentendo lo studio di comportamenti cellulari come la germinazione, l'invasione e la migrazione collettiva in un ambiente controllato 8,9,10. I saggi di angiogenesi germinativa in vivo forniscono una valutazione completa all'interno di un organismo vivente, catturando interazioni complesse, ma sono dispendiosi in termini di tempo, costosi, inclini a un'elevata variabilità e difficili da quantificare11,12. I saggi di angiogenesi germinativa in vitro consentono un controllo preciso sulle condizioni sperimentali con elevata riproducibilità e quantificazione precisa, ma potrebbero non replicare completamente le complessità in vivo 11,12,13. Al contrario, i saggi di angiogenesi ex vivo sprouting, di cui il saggio dell'anello aortico è il modello più utilizzato, utilizzano tessuti esterni all'organismo, preservandone la rilevanza fisiologica ed evitando complicanze in vivo 14,15,16. Nonostante siano tecnicamente impegnativi e talvolta abbiano difficoltà con la vitalità dei tessuti, i modelli ex vivo offrono un prezioso equilibrio tra complessità e controllo, rendendoli un approccio promettente per lo studio dell'angiogenesi germinativa. Mentre questi modelli sono stati ampiamente utilizzati per studiare i driver molecolari dell'angiogenesi germinativa, l'effetto dei segnali meccanici e il comportamento meccanico delle cellule rimangono poco compresi.
La migrazione multicellulare durante l'angiogenesi è fortemente dipendente dalla meccanica cellulare, poiché le forze contrattili basate sull'actomiosina regolano l'invasione delle cellule endoteliali nella matrice extracellulare circostante 17,18,19,20. In particolare, è stato osservato che i motori non muscolari della miosina II, le principali macchine contrattili basate sull'actina all'interno della cellula21, controllano le forze contrattili cellulari durante l'angiogenesi22,23. La cellula leader è probabilmente l'elemento predominante che genera la forza del germoglio poiché le deformazioni della matrice extracellulare 3D circostante sono significativamente più elevate intorno alla cellula leader, in particolare nelle vicinanze delle sporgenze cellulari ricche di actina23,24, rispetto ai suoi seguaci 22,23,25. Nonostante questa crescente evidenza dell'importanza della contrattilità cellulare nell'angiogenesi germinativa in 3D, manca un metodo per la caratterizzazione meccanica spazio-temporale della meccanica cellulare dell'angiogenesi germinativa.
L'obiettivo generale di questo studio è quello di sviluppare un metodo che consenta la caratterizzazione meccanica della migrazione cellulare durante la germinazione. Raggiungendo la caratterizzazione spazio-temporale delle forze meccaniche in un contesto biologicamente rilevante, miriamo a fornire nuove intuizioni su come la meccanica cellulare influenza la formazione dei germogli angiogenici. A tal fine, abbiamo sviluppato un sistema di modelli 2.5D creando un idrogel di poliacrilammide (PAA) 2D, seminando su di esso un foglio arterioso carotideo e coprendolo con un sottile strato di gel di collagene di tipo I per stabilire un ambiente 3D localizzato per le cellule. I germogli multicellulari sono migrati fuori dal foglio arterioso sull'interfaccia in gel di PAA-collagene. Il vantaggio di questo metodo rispetto alle tecniche esistenti è che l'idrogel PAA 2D consente analisi mediante microscopia a forza di trazione (TFM), una tecnica versatile ben nota in cui le cellule aderiscono a un substrato 2D elastico e deformano il substrato in base alle forze di trazione cellulare26. Queste deformazioni possono essere catturate e le forze di trazione cellulare possono essere calcolate in base alle proprietà meccaniche del substrato26. Adattando il TFM per l'uso in tessuti viventi ex vivo, miriamo a colmare il divario tra il controllo in vitro e la rilevanza in vivo , fornendo una comprensione più completa delle forze meccaniche durante l'angiogenesi.
Protocollo
In questo protocollo sono state utilizzate le arterie carotidi suine. Le arterie carotidi suine sono state raccolte da suini ibridi Landrace olandesi - di età compresa tra 5 e 7 mesi e peso (vivo) 80-120 kg - ottenuti da un macello locale. I protocolli sono conformi al regolamento CE 1069/2009 relativo al materiale animale da macello per la diagnosi e la ricerca, sotto la supervisione del governo olandese (Ministero olandese dell'agricoltura, della natura e della qualità degli alimenti) e sono stati approvati dalle autorità legali associate al benessere degli animali (Autorità per la sicurezza degli alimenti e dei prodotti di consumo). L'approvazione etica non era richiesta poiché il tessuto veniva raccolto da sottoprodotti di animali già terminati. Il tempo tra la morte e il trasporto dei tessuti è di 10-25 minuti, a seconda del macello.
NOTA: La Tabella dei materiali riassume i dettagli sui materiali, le attrezzature e i reagenti utilizzati in questo protocollo. I protocolli per i campioni 2D e 3D sono descritti nel File supplementare 1.
1. Preparazione di substrati 2D in poliacrilammide (PAA)
- Nella cappa aspirante, preparare la soluzione di legante-silano mescolando etanolo assoluto 12:1:1 (per la sintesi), acido acetico e legato-silano rispettivamente a 4286 μL, 357 μL e 357 μL. Incubare 120 μL/pozzetto di soluzione di legare-silano su una piastra a 12 pozzetti con fondo di vetro per 1 ora a temperatura ambiente.
ATTENZIONE: L'etanolo assoluto è un liquido e un vapore altamente infiammabili (H225) e provoca grave irritazione oculare (H319). L'acido acetico è un liquido e un vapore infiammabile (H226) e provoca gravi ustioni cutanee e danni agli occhi (H314). Indossare dispositivi di protezione individuale e lavorare in cappa aspirante. - Nella cappa aspirante, lavare la piastra a 12 pozzetti con fondo in vetro 3 volte con etanolo assoluto (industriale) utilizzando un flacone spray. Scartare l'etanolo.
- Asciugare la piastra a 12 pozzetti con fondo in vetro utilizzando azoto gassoso. Se sul fondo del vetro compare un bagliore bianco, il lavaggio non era sufficiente. Rilavare la piastra a 12 pozzetti con fondo in vetro.
- Preparare la miscela di gel PAA secondo i rapporti della Tabella 1.
- Aggiungere PBS a una provetta da microcentrifuga e risospendere il 40% di acrilammide, il 2% di bis-acrilammide e i marcatori fluorescenti nella miscela di gel. Agitare la soluzione subito prima della preparazione del gel.
- Il più velocemente possibile, aggiungi il 10% di APS e TEMED alla soluzione e vortice dopo l'aggiunta di ogni elemento. Pipettare una goccia di 11,5 μL di miscela di gel sul fondo di vetro di ciascun pozzetto e posizionare delicatamente un vetrino coprioggetti da 13 mm sopra la gocciolina.
- Picchiettare delicatamente e agitare la piastra per distribuire uniformemente la miscela di gel sotto il vetrino coprioggetti. Se compaiono bolle d'aria, rimuoverle sollevando delicatamente il vetrino coprioggetti. Lasciare polimerizzare i gel per 1 ora a temperatura ambiente. Controllare la polimerizzazione utilizzando la miscela di gel rimanente nel tubo. I gel PAA polimerizzati nella piastra a 12 pozzetti mostreranno un alone interno.
ATTENZIONE: L'acrilammide è dannosa se ingerita o inalata (H302 + H332), provoca irritazione cutanea (H315), può causare una reazione allergica cutanea (H317), provoca grave irritazione oculare (H319), può causare difetti genetici (H340), può causare cancro (H350), sospettata di danneggiare la fertilità (H361f) e provoca danni agli organi attraverso un'esposizione prolungata o ripetuta se ingerita (H372). L'APS può intensificare l'incendio (ossidante, H272), è dannoso se ingerito (H302), provoca irritazione cutanea (H315), può provocare una reazione allergica cutanea (H317), provoca grave irritazione oculare (H319), può causare sintomi allergici o asmatici o difficoltà respiratorie se inalato (H334) e può causare irritazione respiratoria (H335). Il TEMED è un liquido e vapore altamente infiammabile (H225), dannoso se ingerito (H302), provoca gravi ustioni cutanee e danni agli occhi (H314) ed è tossico se inalato (H331). Indossare dispositivi di protezione individuale.
- Dopo la polimerizzazione, aggiungere PBS al pozzetto. Utilizzando una pinzetta e/o un ago piegato, sollevare e rimuovere delicatamente il vetrino coprioggetti. Lavare i gel una volta in PBS.
- Per facilitare il rivestimento di collagene dei gel PAA, i gel devono essere funzionalizzati utilizzando il reticolante Sulfo-SANPAH. Aggiungere 75 μL di 1 mg/mL di Sulfo-SANPAH disciolto in acqua ultrapura al gel PAA e incubare per 5 minuti sotto la luce UV di 365 nm.
NOTA: Mantenere Sulfo-SANPAH al riparo dalla luce e aggiungere acqua ultrapura subito prima dell'incubazione UV. È visibile uno scolorimento dal rosso chiaro (prima dell'incubazione alla luce UV) al rosso scuro (dopo l'incubazione alla luce UV).
ATTENZIONE: Sulfo-SANPAH provoca grave irritazione oculare (H319). - Nella cabina di biosicurezza, eseguire un rapido lavaggio PBS sterile di Sulfo-SANPAH sui gel. Di conseguenza, lavare i gel PAA funzionalizzati 2 volte in PBS sterile per 10 minuti.
NOTA: A partire da questo punto del protocollo, tutti i passaggi verranno eseguiti in condizioni sterili. - Nella cabina di biosicurezza, preparare una soluzione di collagene di tipo IV 0,1 mg/mL in PBS su ghiaccio. Pipettare 50 μL di gocciolina di collagene di tipo IV da 0,1 mg/mL sopra il gel PAA funzionalizzato e incubare per una notte a 4 °C.
- Lavare i gel 2 volte in PBS sterile. Rimuovere il PBS e lasciare asciugare i gel per 5 minuti.
- Pipettare una gocciolina da 50 μL di terreno di crescita delle cellule endoteliali (ECG) sopra i gel e incubare per almeno 1 ora a 37 °C e 5% di CO2.
NOTA: L'incubazione dei gel nel mezzo ECG migliora l'adesione delle cellule e dei tessuti ai gel.
2. Preparazione della soluzione di Krebs modificata per il trasporto
NOTA: Preparare la soluzione di Krebs modificata fresca. In questo protocollo, la soluzione modificata di Krebs viene preparata 1 giorno prima del prelievo dei tessuti.
- Sterilizzare una bottiglia di trasporto in autoclave. Riempire una bottiglia di vetro con il 90% (315 ml) del volume di trasporto totale richiesto (350 ml) di acqua ultrapura. Assicurarsi che la temperatura dell'acqua sia di 15-20 °C.
- Mescolando delicatamente l'acqua con un magnete, aggiungere 9,6 g/L (3,36 g) di tampone Krebs-Henseleit e mescolare fino a quando non si sarà sciolto. Utilizzando una pipetta Pasteur, sciacquare la bilancia con un piccolo volume di soluzione per includere tutte le tracce di polvere nella soluzione. Non riscaldare la soluzione.
- Mescolando, aggiungere 0,373 g/L (130,55 mg) di cloruro di calcio (CaCl2) alla soluzione e mescolare fino a quando non si sarà sciolto. Sciacquare la pesa con un piccolo volume di soluzione.
ATTENZIONE: H319 provoca grave irritazione oculare. - Mescolando, aggiungere 2,1 g/L (0,63 g) di bicarbonato di sodio (NaHCO3) alla soluzione e mescolare fino a quando non si sarà sciolto. Sciacquare la pesa con un piccolo volume di soluzione.
- Mescolando, aggiungere 1 x 10-1 mM (13,15 mg) di papaverina alla soluzione e mescolare fino a quando non si sarà sciolta. Sciacquare la pesa con un piccolo volume di soluzione.
NOTA: La papaverina è un rilassante della muscolatura liscia utilizzato per prevenire l'eccessiva vasocostrizione causata dal taglio e dalla manipolazione del recipiente durante la raccolta.
ATTENZIONE: L'H301 è tossico se ingerito. - Nella cappa aspirante, aggiungere 0,05 mM (1,2 μL) di 2-mercaptoetanolo alla soluzione e mescolare.
NOTA: Il 2-mercaptoetanolo viene utilizzato per mantenere un basso livello di radicali dell'ossigeno.
ATTENZIONE: il 2-mercaptoetanolo è tossico se ingerito o inalato (H301 + H331), fatale a contatto con la pelle (H310), provoca irritazione cutanea (H315), può causare una reazione allergica cutanea (H317), provoca gravi danni agli occhi (H318), sospettato di danneggiare il nascituro (H361d), può causare danni agli organi attraverso un'esposizione prolungata o ripetuta se ingerito (H373) e molto tossico per la vita acquatica con effetti di lunga durata (H410). Indossare dispositivi di protezione individuale e lavorare in cappa aspirante. - Mentre si mescola, regolare il pH a 7,2 aggiungendo 1 N (1 M) di HCl o 1 N (1 M) di NaOH. L'obiettivo finale del pH è 7,4, ma il pH può aumentare di 0,1-0,3 unità di pH durante la filtrazione.
ATTENZIONE: L'HCl contiene gas sotto pressione; può esplodere se riscaldato (H280), causare gravi ustioni cutanee e danni agli occhi (H314) ed è tossico se inalato (H331). Indossare dispositivi di protezione individuale. - Continuare a lavorare in una cabina di biosicurezza. Aggiungere il 10% di acqua ultrapura per portare la soluzione al volume finale.
- Sterilizzare immediatamente la soluzione mediante filtrazione utilizzando una membrana con una porosità di 0,22 μm. Erogare la soluzione sterile direttamente in un flacone sterile. Aggiungere 7 ml di penicillina/streptomiocina (P/S) al 2% alla soluzione.
NOTA: Durante il trasporto, il 2% P/S viene aggiunto al terreno per rimuovere tutti i batteri. Durante la coltura dei tessuti, al terreno viene aggiunto l'1% di P/S. - Conservare la soluzione modificata di Krebs a 4 °C fino al prelievo dei tessuti.
3. Prelievo di tessuti
- A seconda del macello, stordire i suini attraverso scosse elettriche o CO2. Successivamente, impiccare i maiali a un arto posteriore, dissanguati e dichiarati morti.
- Prima di entrare nel processo di macellazione pulita, scottare i maiali per la depilazione, bruciare per rimuovere gli ultimi peli e sterilizzare l'esterno della carcassa.
- Eviscerare i maiali praticando un'incisione sulla linea mediana lungo l'addome e rimuovendo con cura gli organi interni. A seconda del macello, l'arteria carotide era ancora attaccata alla carcassa del maiale, oppure l'arteria carotide era già stata rimossa dalla carcassa con il prelievo di organi toracici.
- Usando un coltello affilato, prelevare l'arteria carotide con un po' di tessuto circostante rimanente dalla carcassa o dal tessuto dell'area della gola senza toccare l'arteria o applicare uno sforzo meccanico.
- Posizionare il tessuto contenente l'arteria carotide nel flacone di trasporto contenente la soluzione sterile di Krebs modificata aprendo brevemente il flacone. Capovolgere il flacone una volta per assicurarsi che l'intero tessuto sia coperto dalla soluzione di Krebs. Trasportare i tessuti su ghiaccio al laboratorio. Il trasporto dura circa 30-45 minuti.
4. Dissezione tissutale
- Sterilizzare le pinzette chirurgiche per apparecchiature di dissezione (manipolazione approssimativa), pinzette a punta tonda rivestite con resina epossidica (manipolazione fine), bisturi, pinza e vetrini coprioggetti mediante sterilizzazione in autoclave.
- Preparare la cabina di biosicurezza prima della raccolta/trasporto dei tessuti. Coprire l'area di dissezione con un telo chirurgico. Montare l'attrezzatura di dissezione (in provette sterili da 50 mL), le lame chirurgiche e i vetrini coprioggetti sterili. Riempire due grandi piastre di Petri con PBS sterile per preparare un vassoio di dissezione. Incubare la coltura tissutale in una piccola piastra di Petri con terreno ECG a 37 °C.
- Dopo il trasporto dei tessuti, all'interno della cabina di biosicurezza, trasferire l'arteria carotide dal flacone di trasporto (riempito con soluzione di Krebs modificata) a una grande piastra di Petri riempita con PBS sterile utilizzando la pinzetta chirurgica.
- Rimuovere il tessuto in eccesso che circonda l'arteria carotide utilizzando la pinzetta chirurgica e il bisturi per creare una visione chiara dell'arteria carotide.
- Rimuovere 2-3 cm da entrambe le estremità dell'arteria carotide per eliminare le zone vicine alle biforcazioni delle arterie tagliando con un bisturi. Rimuovere la fascia arteriosa che circonda l'arteria carotide usando la pinzetta a punta tonda fine.
NOTA: Il rinnovo della lama del bisturi aiuta a tagliare la fascia in modo più preciso. - Trasferire l'arteria carotide in una nuova grande capsula di Petri riempita con PBS sterile. Rimuovere il più possibile lo strato sottile rimanente della fascia arteriosa.
NOTA: Più a lungo l'arteria carotide è nella PBS, più pezzi di fascia tendono a staccarsi. La rimozione della fascia è importante poiché ostruirà la visione durante la microscopia. - Tagliare l'arteria carotide pulita in anelli di circa 2 mm di larghezza. Trasferire gli anelli dell'arteria carotide nella piccola capsula di Petri preriscaldata riempita con terreno ECG e mantenere a 37 °C.
5. Semina dei tessuti
NOTA: L'attacco del tessuto è stato testato aggiungendo un vetrino coprioggetti, un vetrino coprioggetti sterile non trattato o un vetrino coprioggetti sterile trattato con pluronico (1% p/v pluronico in PBS, vetrini coprioggetti incubati durante la notte e lavati in acqua ultrapura sterile prima dell'uso) di diverse dimensioni sulla parte superiore del foglio arterioso dopo la semina sull'idrogel PAA.
- Rimuovere le goccioline medie ECG dai gel. Trasferire un anello dell'arteria carotide in una capsula di Petri media pulita riempita con PBS sterile.
- Usando la pinzetta a punta tonda e il bisturi, taglia l'anello a metà. Sezionare mezzo anello in fogli di circa 2 mm di larghezza per creare fogli arteriosi di dimensioni 2 x 2 mm. Attenzione all'orientamento del lato endoteliale del foglio arterioso. La curvatura e alcune fasce rimanenti del foglio arterioso possono aiutare a determinare questo orientamento.
NOTA: La dimensione degli anelli dell'arteria carotide può variare. Gli anelli grandi producono circa 6-8 fogli, mentre gli anelli piccoli producono 3-4 fogli. Gli anelli di grandi dimensioni hanno un attacco migliorato grazie alla minore curvatura del foglio arterioso. - Usando la pinzetta a punta tonda, afferrare il foglio arterioso sul retro del foglio (al di fuori della parete del vaso) e posizionare il foglio sul bordo del gel PAA con il rivestimento interno endoteliale rivolto verso il substrato PAA per evitare di danneggiare il substrato PAA durante il posizionamento del foglio.
- Usando la pinzetta o la pinza, muovi il foglio arterioso molto delicatamente al centro dell'idrogel PAA senza toccare il gel. Posiziona il foglio arterioso sul bordo del gel (il fazzoletto potrebbe attaccarsi alla pinzetta o alla pinza).
NOTA: Piccoli resti di fascia arteriosa all'esterno della parete del vaso creano una facile maniglia per afferrare il foglio arterioso, mentre il rivestimento interno endoteliale della parete del vaso è molto liscio. - Aggiungere 50 μl di terreno ECG sopra il foglio arterioso posizionato sul substrato PAA. Ty per mantenere la gocciolina di terreno ECG sopra il gel.
- Utilizzando la pinzetta a punta tonda, posizionare un vetrino coprioggetti asciutto da 13 mm sopra il foglio arterioso sul substrato PAA in media. Utilizzare il bordo interno del fondo del bicchiere per abbassare delicatamente il vetrino coprioggetti fino a toccare la gocciolina media e il fluido si diffonde sotto di essa.
NOTA: I vetrini coprioggetti da 13 mm sono vantaggiosi perché si adattano perfettamente alle dimensioni della parete interna della piastra del pozzetto con fondo in vetro. Se si abbassa il vetrino coprioggetti troppo velocemente, il fazzoletto si sposterà verso il bordo del vetrino. - Lasciare che il tessuto si attacchi a 37 °C e al 5% di CO2 per 5 ore prima di aggiungere 1 ml di terreno ECG a ciascun pozzetto. Posizionare il foglio arterioso sul substrato PAA a 37 °C e 5% di CO2 per 24 ore.
6. Creazione del modello 2.5D
- Autoclavare in autoclave una pinzetta a punta tonda per la rimozione dei vetrini. Preparare 1 M di NaOH in acqua ultrapura, sterilizzare mediante filtrazione attraverso un filtro con pori di 0,22 μm e conservare a 4 °C.
NOTA: 1 M NaOH può essere riutilizzato in esperimenti futuri. - Utilizzando un ago sterile affilato con la punta piegata, sollevare molto delicatamente il vetrino coprioggetti da 13 mm dal foglio arterioso e rimuovere il vetrino coprioggetti. Utilizzare l'anello interno del pozzetto del fondo di vetro come supporto per sollevare e rimuovere il vetrino coprioggetti. Qualsiasi movimento laterale aumenta il rischio di distacco del foglio arterioso dal substrato PAA.
- In una provetta da microcentrifuga sterile, preparare la miscela di collagene di tipo I secondo la Tabella 2 con ghiaccio. Dopo l'aggiunta di collagene di tipo I e NaOH alla soluzione, risospendere molto bene e capovolgere il tubo una volta per assicurarsi che la miscela sia miscelata in modo omogeneo.
NOTA: Dopo l'aggiunta di collagene di tipo I alla miscela, la miscela di colore rosa chiaro diventa incolore. Dopo l'aggiunta di NaOH, la miscela incolore diventa rosa chiaro. - Rimuovere il fluido dal pozzo utilizzando un sistema di aspirazione a vuoto. Rimuovere il più possibile il terreno che circonda il tessuto senza toccare il tessuto.
NOTA: Troppo terreno che circonda il foglio arterioso impedirà al gel di collagene di circondarlo. - Aggiungere una goccia da 10 μL di miscela di gel di collagene di tipo I sopra ogni foglio arterioso e lasciare polimerizzare il gel di collagene di tipo I per 1 ora a 37 °C e 5% di CO2.
- Molto delicatamente, aggiungere 1 mL di terreno ECG preriscaldato a ciascun pozzetto e posizionare i campioni a 37 °C e 5% di CO2.
7. Imaging di cellule vive
NOTA: L'imaging di cellule vive è stato eseguito utilizzando un microscopio a epifluorescenza Leica DMi8 o Nikon Ti2 Eclipse dotato di controllo termico, CO2 e umidità e controllato tramite software Leica o NIS. Il controllo adattivo della messa a fuoco (Leica) e il sistema di messa a fuoco perfetta (Nikon) sono stati utilizzati per mantenere la messa a fuoco nel tempo.
- Dopo 24 ore di coltura nel sistema 2.5D, verificare la presenza di angiogenesi germinativa. Alcuni fogli arteriosi iniziano già a formare germogli cellulari dopo 24 ore di coltura, mentre altri fogli hanno bisogno di un po' più di tempo per avviare la germinazione endoteliale.
- Se è stata avviata l'angiogenesi germinativa, rinfrescare il terreno ECG e posizionare la piastra a 12 pozzetti nel supporto del tavolino all'interno della scatola di incubazione preriscaldata a 37 °C del microscopio.
- Scegli l'obiettivo di interesse. In questo studio sono stati utilizzati diversi obiettivi, utilizzare un obiettivo 10x per creare una panoramica globale della formazione di germogli cellulari e un obiettivo 20x per eseguire il TFM.
- Definisci i canali di interesse. Ai fini della TFM, visualizzare i germogli cellulari utilizzando il contrasto di fase e visualizzare i marcatori fluorescenti (rosso scuro) nel substrato PAA utilizzando un canale fluorescente a una lunghezza d'onda di 660 nm.
- Selezionare (più) regioni di interesse e trovare il piano di messa a fuoco. Attiva il sistema di messa a fuoco (controllo adattivo della messa a fuoco su Leica DMi8 o sistema di messa a fuoco perfetta su Nikon Ti2 Eclipse) per garantire una messa a fuoco stabile durante l'imaging timelapse.
- Definisci il timelapse di interesse selezionando un intervallo di tempo e la durata del timelapse. In questo studio sono stati utilizzati diversi intervalli di tempo (5-20 minuti) e lunghezze di timelapse (4-24 ore) per scopi diversi.
- Ai fini del TFM, dopo l'imaging timelapse, rimuovere le cellule in crescita aggiungendo diverse goccioline di SDS al 5% in acqua ultrapura e attendere alcuni minuti. Per ogni posizione selezionata, prendere uno z-stack (un'altezza z di 2 μm è stata definita con una dimensione del passo di 0,2 μm) dei marcatori fluorescenti nel substrato PAA per ottenere uno stato rilassato dei marcatori fluorescenti come immagine di riferimento.
NOTA: L'imaging Z-stack viene eseguito poiché le cellule potrebbero tirare o spingere i marcatori fluorescenti nella direzione z.
8. Analisi al microscopio della forza di trazione
- Allinea e ritaglia le immagini timelapse rispetto alla migliore immagine di riferimento per un'analisi precisa.
- Per misurare gli spostamenti dei marcatori fluorescenti nell'idrogel PAA, eseguire la velocimetria a immagine di particelle (PIV) tra qualsiasi immagine timelapse e l'immagine di riferimento utilizzando codici MatLab personalizzati. All'interno dell'analisi PIV, dividere le immagini in finestre di interrogazione di 32 x 32 pixel con sovrapposizione di 0,5.
- Calcola le forze di trazione dagli spostamenti dei marcatori fluorescenti mediante microscopia di trazione basata sulla trasformata di Fourier di un gel infinito con uno spessore di gel finito utilizzando l'equazione di Boussinesq27.
Risultati
Per mezzo del protocollo descritto, possiamo indurre un'angiogenesi germinativa ex vivo da un'arteria carotide suina sopra un idrogel PAA 2D ricoperto da un sottile strato di gel di collagene di tipo I, creando così un modello di angiogenesi germinativa ex vivo 2.5D. Questo modello ci consente di eseguire TFM convenzionale e misurare le forze di trazione cellulare dell'angiogenesi germinativa sull'interfaccia del gel PAA nello spazio e nel tempo.
Per stabilire il modello 2.5D, abbiamo prima preparato un idrogel di poliacrilammide 2D (PAA) incorporato con marcatori fluorescenti, seguito da un rivestimento notturno con collagene di tipo IV (da d-1 a d0). Il giorno 0 (d0), un foglio arterioso carotideo è stato posizionato sull'idrogel rivestito di collagene IV e lasciato attaccare per una notte (da d0 a d1). Successivamente, è stato applicato un sottile strato di gel di collagene di tipo I sul foglio arterioso, dopodiché l'imaging è stato avviato il giorno 1 (d1) per monitorare la germinazione cellulare e tracciare i marcatori fluorescenti per l'analisi meccanica (da d1 a d2). Per verificare l'angiogenesi germinativa nel modello 2.5D, abbiamo eseguito l'angiogenesi germinativa convenzionale ex vivo in un gel di collagene 3D di tipo I in parallelo. Per questo, è stato preparato un sottile strato di gel di collagene di tipo I, seguito dalla semina del foglio arterioso carotideo e successivamente ricoperto con un ulteriore strato di collagene (d0). La germinazione angiogenica è stata monitorata nel tempo. Inoltre, abbiamo cercato di indurre l'angiogenesi germinativa in 2D per ridurre ulteriormente la complessità del modello. La procedura sperimentale rispecchiava quella del modello 2.5D, con la differenza fondamentale che era l'esclusione dello strato superiore di gel di collagene di tipo I. Una panoramica dei tre modelli, comprese le loro procedure sperimentali, è descritta nella Figura 1. Le arterie carotidi sono state prelevate dai suini del macello locale e trasportate in una soluzione fresca sterile di Krebs. All'interno della cabina di biosicurezza, è stato rimosso il tessuto in eccesso che circonda l'arteria carotide per garantire l'assenza di compromissione visiva dell'angiogenesi germinativa durante l'imaging timelapse dal vivo (Figura 2A-E). Una volta che l'arteria è stata pulita dal tessuto in eccesso, l'arteria è stata tagliata in anelli arteriosi di 2 mm di larghezza e gli anelli sono stati tagliati in fogli arteriosi con una dimensione di 2 x 2 mm (Figura 2F).
Per garantire l'angiogenesi germinativa sulla parte superiore dell'interfaccia dell'idrogel PAA all'interno del modello 2.5D e 2D, abbiamo seminato i fogli arteriosi con il lato interno della cellula endoteliale rivolto verso l'idrogel PAA rivestito di collagene di tipo IV e li abbiamo lasciati attaccare. Per ottimizzare l'attacco del foglio arterioso all'idrogel PAA, abbiamo testato l'effetto dell'aggiunta di un vetrino coprioggetti in vetro da 12 mm rivestito antivegetativo sulla parte superiore del foglio arterioso. Dopo 24 ore, il vetrino coprioggetti è stato rimosso e l'efficienza di attacco è stata misurata mediante la percentuale di fogli arteriosi attaccati all'idrogel PAA. Abbiamo osservato che l'aggiunta di un vetrino coprioggetti - indipendente dal rivestimento antivegetativo - ha aumentato l'efficienza di fissaggio dei fogli arteriosi sopra l'idrogel PAA rispetto all'assenza di vetrino coprioggetti (Figura 3A-D). Successivamente, abbiamo testato l'effetto del diametro (12 o 13 mm) del vetrino vetrino sull'efficienza di attacco della lastra arteriosa, mentre il pozzetto interno della placca era di 14 mm. Abbiamo osservato che un vetrino coprioggetti da 13 mm aumenta l'efficienza di attacco dei fogli arteriosi sopra l'idrogel PAA rispetto a un vetrino coprioggetti da 12 mm (Figura 3E-G) poiché le forze di taglio durante la rimozione del vetrino coprioggetti sono ridotte al minimo. Abbiamo continuato a utilizzare un vetrino coprioggetti da 13 mm non trattato per il fissaggio del foglio arterioso all'idrogel PAA sia nel modello 2.5D che in quello 2D.
Dopo che il foglio arterioso è stato attaccato all'idrogel PAA, abbiamo aggiunto un sottile strato di gel di collagene di tipo I sopra il foglio arterioso per creare un ambiente 2.5D. Abbiamo coltivato i campioni per 5 giorni e li abbiamo esaminati per l'angiogenesi germinativa. Abbiamo osservato la formazione di germogli cellulari nel modello 3D (Figura 4A), coerente con l'angiogenesi da germogliamento ex vivo precedentemente riportata in letteratura28,29,30. All'interno del modello 2.5D, abbiamo osservato un'organizzazione simile dei germogli cellulari rispetto al modello 3D (Figura 4B). I germogli cellulari si sono formati a diverse altezze (Video 1), anche all'interfaccia PAA. Inoltre, l'angiogenesi germinativa è caratterizzata da un'elevata proliferazione di cellule leader e seguaci, un fenomeno che abbiamo osservato durante la germinazione all'interno del modello 2.5D (Video 2). Quando si coltiva un foglio arterioso in 2D, cellule di origini diverse (Figura 1 supplementare) migrano come monostrati fuori dal tessuto, mancando così l'organizzazione dei germogli cellulari (Figura 4C). Poiché non abbiamo osservato l'angiogenesi germinativa nel modello 2D, abbiamo escluso questo modello dalle analisi successive. Nel complesso, il foglio arterioso necessita di un ambiente 3D locale per indurre l'angiogenesi germinativa, mostrando il potenziale del modello ex vivo 2.5D dell'angiogenesi germinativa.
Inoltre, il sistema di modelli 2.5D è un sistema versatile che consente agli utenti di esaminare l'effetto di segnali meccanici provenienti dal microambiente cellulare, ad esempio la rigidità della matrice. La rigidità della matrice di un idrogel di collagene 3D di tipo I - l'idrogel comunemente usato per l'angiogenesi ex vivo - dipende dalla concentrazione della proteina ECM, dove un aumento della concentrazione proteica è correlato a un aumento della rigidità della matrice32. L'intervallo tipico di concentrazione di collagene di tipo I per far sì che questo idrogel 3D induca l'angiogenesi germinativa è di 1-4 mg/mL, corrispondente a una rigidità della matrice da 1 Pa a 1 kPa 32,33,34. Concentrazioni più basse possono essere troppo morbide per fornire un supporto strutturale, mentre concentrazioni più elevate possono inibire il movimento cellulare. La rigidità fisiologica del tessuto endoteliale è di 1 kPa35, che può essere imitata con un idrogel di collagene 3D di tipo I. Tuttavia, la formazione e la progressione del tumore sono associate all'irrigidimento dei tessuti4, sottolineando così la necessità di un modello in grado di raggiungere una maggiore rigidità della matrice per studiare l'angiogenesi tumorale. La rigidità del substrato degli idrogel di PAA - la rigidità rilevata dalle cellule endoteliali del foglio arterioso - può essere facilmente regolata nell'intervallo da 1 a decine di kPa. Qui, abbiamo esaminato l'effetto della rigidità del substrato PAA sull'inizio dell'angiogenesi germinativa mediante la percentuale di campioni che hanno avviato la formazione di germogli cellulari il giorno successivo all'aggiunta dello strato di collagene di tipo I. Abbiamo osservato che un maggior numero di fogli arteriosi mostrava segni precoci di germogli cellulari quando coltivati su un idrogel di PAA morbido fisiologico (1 kPa) rispetto a un idrogel di PAA rigido patologico (12 kPa) (Figura 5), mostrando il potenziale di questo modello per studiare l'effetto della rigidità della matrice sull'angiogenesi germinativa. Oltre alla rigidità del substrato regolabile, questi substrati consentono la modulazione sistematica di altri segnali meccanici (ad esempio, composizione e densità della matrice) e di segnali chimici (ad esempio, inibizione dei regolatori molecolari mediante condizionamento del terreno di coltura), dimostrando la versatilità di questo modello di angiogenesi con germogliamento ex vivo 2.5D.
Per quantificare la meccanica cellulare nell'angiogenesi germinativa, abbiamo eseguito la microscopia convenzionale a forza di trazione (TFM) su germogli cellulari che si sono formati sull'interfaccia PAA 2D. Un giorno dopo l'aggiunta dello strato di collagene di tipo I, abbiamo eseguito l'imaging su cellule vive delle cellule (Figura 6A) e dei marcatori fluorescenti incorporati nell'idrogel di PAA. Gli spostamenti dei marcatori fluorescenti sono stati misurati utilizzando la velocimetria a immagine di particelle (Figura 6B) e le trazioni cellulari sono state calcolate utilizzando le proprietà meccaniche dell'idrogel PAA (Figura 6C). Con questo modello ex vivo 2.5D, abbiamo osservato inizialmente forze di trazione alle sporgenze della cellula leader di un germoglio cellulare, seguite da forze di spinta lungo il germoglio cellulare, sia nella parte posteriore della cella leader che nelle celle follower (Figura 6C).
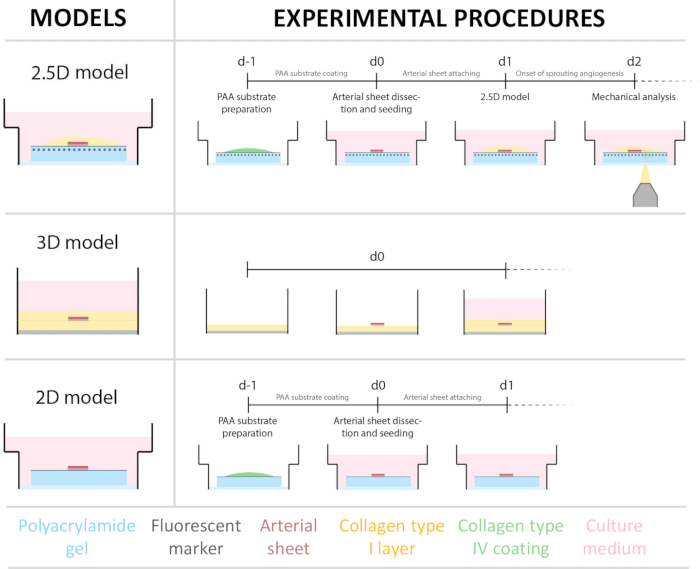
Figura 1: Modelli e procedure sperimentali. (a sinistra) Modelli sperimentali testati. Il modello 2.5D rappresenta un foglio arterioso posizionato sopra un idrogel di poliacrilammide (PAA) rivestito di collagene piatto di tipo IV e ricoperto da un sottile strato di idrogel di collagene di tipo I. Il modello 3D rappresenta un foglio arterioso inserito tra due strati di gel di collagene di tipo I, un sistema noto per indurre l'angiogenesi germinativa36. Il modello 2D rappresenta un foglio arterioso posizionato sopra un idrogel PAA rivestito di collagene piatto di tipo IV. (a destra) Procedure sperimentali per i modelli corrispondenti. Sia per i modelli 2D che per quelli 2.5D, il giorno prima della semina (d-1) è stato preparato un idrogel PAA e durante la notte è stato eseguito un rivestimento di collagene di tipo IV. L'arteria carotide è stata prelevata dai suini, sezionata in fogli arteriosi, seminata sopra l'idrogel al giorno 0 (d0) e lasciata attaccare per una notte (d1). Per i campioni 2.5D, un sottile strato di gel di collagene di tipo I è stato posizionato sopra il foglio arterioso. L'analisi meccanica è stata eseguita dopo l'inizio della germinazione al giorno 2 (d2). Per i campioni 2D, il terreno è stato rinfrescato il giorno 1 (d1). Per il modello 3D, uno strato di gel di collagene di tipo I è stato preparato appena prima della semina il giorno 0 (d0). Il foglio arterioso è stato seminato sopra lo strato di collagene di tipo I e coperto con un secondo strato di collagene di tipo I. Clicca qui per visualizzare una versione più grande di questa figura.
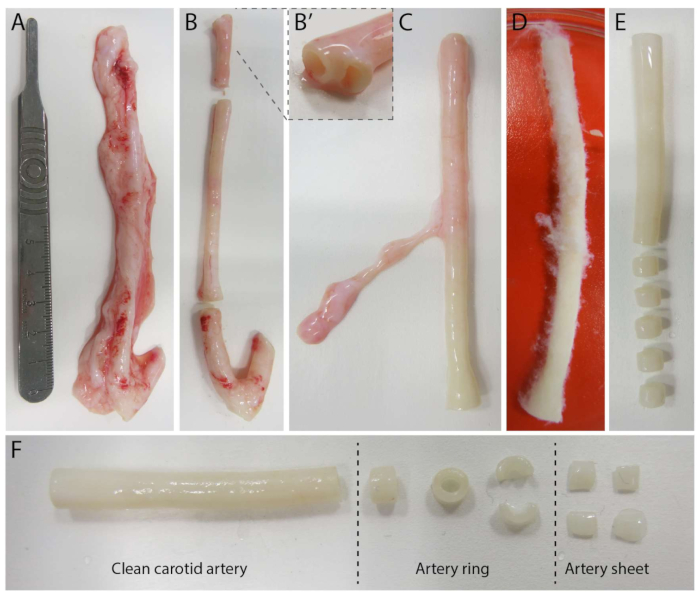
Figura 2: Fasi di dissezione dell'arteria carotide (d0). (A) Le arterie carotidi di circa 10 cm di lunghezza sono state prelevate dai suini del macello locale. (B) Il tessuto in eccesso e circa 2 cm del bordo (per evitare di essere troppo vicini ai punti di ramificazione), (B') sono stati scartati. (C-E) L'arteria carotide è stata spellata (C), imbevuta di PBS (D) e tutto il tessuto rimanente è stato spellato per garantire una chiara visibilità durante l'imaging (E). (F) L'arteria carotide pulita viene tagliata in anelli arteriosi con una larghezza approssimativa di 2 mm. Ogni anello è tagliato in 4 fogli arteriosi con una dimensione di circa 2 x 2 mm. Clicca qui per visualizzare una versione più grande di questa figura.
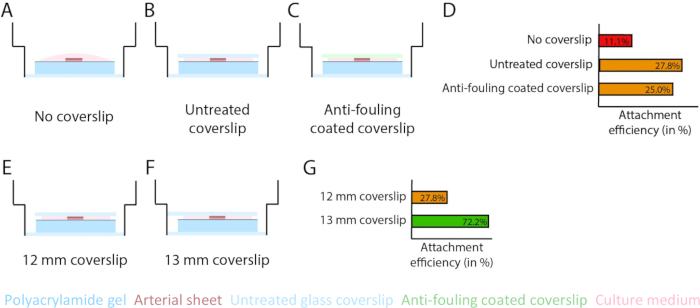
Figura 3: L'efficienza di fissaggio del foglio arterioso aumenta utilizzando un vetrino coprioggetti in vetro da 13 mm (d1). (A-D) Effetto di un vetrino coprioggetti sull'attacco del foglio arterioso all'idrogel di poliacrilammide (PAA). È stato effettuato un confronto tra vetrino coprioggetti senza vetro (A), un vetrino coprioggetti in vetro non trattato (B) e un vetrino coprioggetti in vetro rivestito antivegetativo utilizzando Pluronic F127 (C). L'efficienza di attacco è stata misurata dal numero di fogli arteriosi che si sono attaccati all'idrogel PAA dopo la rimozione del vetrino coprioggetti rispetto al numero totale di campioni: nessun vetrino coprioggetti (4 su 36), vetrino coprioggetti non trattato (10 su 36) e vetrino coprioggetti rivestito antivegetativo (9 su 36; D). (E-G) Effetto delle dimensioni di un vetrino coprioggetti non trattato sull'attaccamento del foglio arterioso all'idrogel PAA. È stato effettuato un confronto tra un vetrino coprioggetti in vetro da 12 mm non trattato (E) e un vetrino coprioggetti in vetro da 13 mm non trattato (F) all'interno di un pozzetto da 14 mm. L'efficienza di attacco è stata misurata dal numero di fogli arteriosi attaccati all'idrogel PAA dopo la rimozione del vetrino coprioggetti rispetto al numero totale di campioni: vetrino coprioggetti da 12 mm (10 su 36) e vetrino coprioggetti da 13 mm (52 su 72; G). Clicca qui per visualizzare una versione più grande di questa figura.
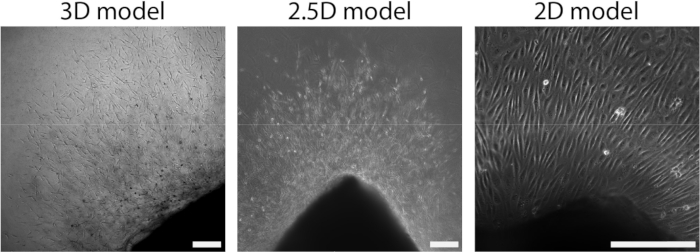
Figura 4: La dimensionalità del modello definisce l'organizzazione durante la crescita cellulare (d2+). Le cellule migrano fuori dal tessuto in un'organizzazione di germogli nel modello 3D (a sinistra), simile al modello 2.5D (al centro). Le cellule migrano fuori dal tessuto in un'organizzazione monostrato nella configurazione 2D (a destra). La barra di scala rappresenta 250 μm. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 5: L'inizio della germinazione endoteliale nel modello 2.5D dipende dalla rigidità del substrato di idrogel di poliacrilammide (d2). (A-B) Foglio arterioso ricoperto da un sottile strato di gel di collagene di tipo I sopra un idrogel di poliacrilammide (PAA) morbido (A; 1 kPa) o rigido (B; 12 kPa) al giorno 2 del protocollo (1 giorno dopo l'aggiunta di strato di gel di collagene di tipo I). (C) L'insorgenza della germinazione è stata misurata dal numero di fogli arteriosi che mostrano già segni di crescita cellulare rispetto al numero totale di campioni: morbidi (7 su 24) e rigidi (3 su 24). La barra di scala rappresenta 1 mm (A, B) o 500 μm (A', B'). Clicca qui per visualizzare una versione più grande di questa figura.

Figura 6: Caratterizzazione della forza di trazione durante l'angiogenesi a germogliamento precoce. L'imaging delle celle nel tempo (0-4 ore) viene visualizzato nella riga superiore. I corrispondenti spostamenti dei marcatori fluorescenti (0-2 μm) e le trazioni cellulari (0-50 Pa) su un substrato di idrogel PAA da 1 kPa sono visualizzati rispettivamente nella riga centrale e in quella inferiore. Gli ingrandimenti delle trazioni cellulari a 0 h, 2 h e 4 h vengono visualizzati in arancione. Clicca qui per visualizzare una versione più grande di questa figura.
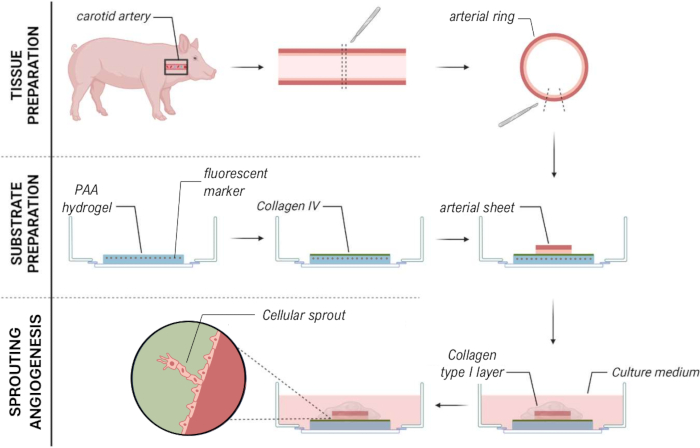
Figura 7: Metodo del modello di angiogenesi con germogliamento ex vivo 2.5D che consente la caratterizzazione meccanica dei germogli cellulari. Clicca qui per visualizzare una versione più grande di questa figura.
| 1 kPa | 12 kPa | |
| PBS | 435 μl | 373,7 μl |
| 40% acrilammide | 50 μl | 93,8 μl |
| 2% bis-acrilammide | 7,5 μl | 25 μl |
| Marcatore fluorescente (rosso scuro) | 5 μl | 5 μl |
| 10% APS | 2,5 μl | 2,5 μl |
| TEMED | 0,25 μl | 0,25 μl |
Tabella 1: Rapporti di miscela di gel PAA.
| formula | Volume per piastra a 12 pozzetti (130 μl) | |
| Mezzo ECG | VECG=Vfinale-V col1-V NaOH | 82,16 μl |
| Collagene di tipo I | Vcol1=(Vfinale*Cfinale)/Cstock | 46 μl |
| NaOH | VNaOH=0.04*Vcol1 | 1,84 μl |
Tabella 2: Il gel di collagene di tipo I mescola i volumi utilizzando le abbreviazioni di volume (V) e concentrazione (C).
Video 1: Imaging timelapse della formazione dei germogli cellulari all'interno del modello 2.5D. Le cellule sono state visualizzate utilizzando l'imaging a contrasto di fase per un periodo di tempo di 22 ore con un intervallo di tempo di 17,5 minuti. I germogli cellulari si sono formati su più altezze all'interno dello strato di gel di collagene di tipo I, come osservato dai diversi piani focali. La barra di scala rappresenta 100 μm. Clicca qui per scaricare questo video.
Video 2: Alto tasso di proliferazione delle cellule all'interno dei germogli cellulari all'interno del modello 2.5D. Le cellule sono state visualizzate utilizzando l'imaging a contrasto di fase per un periodo di 22 ore con un intervallo di tempo di 17,5 minuti. Sia i leader che le cellule follower proliferano durante l'imaging timelapse. La barra di scala rappresenta 100 μm. Clicca qui per scaricare questo video.
Figura 1 supplementare: Fenotipo cellulare in modello 2D (d2+) mediante colorazione in immunofluorescenza. (A) Colorazione in immunofluorescenza (IF) del nucleo cellulare (DAPI), del marcatore delle cellule endoteliali (CD31) e del marcatore dei fibroblasti (actina del muscolo liscio alfa; α-SMA). (B) Colorazione IF del nucleo cellulare (DAPI), del marcatore delle cellule endoteliali (CD31) e del marcatore delle cellule muscolari lisce (calpoina). La barra di scala rappresenta 100 μm. Clicca qui per scaricare questa figura.
File supplementare 1: Protocollo di colorazione in immunofluorescenza. Clicca qui per scaricare questo file.
Discussione
L'angiogenesi - la formazione di nuovi vasi sanguigni - è un processo complesso regolato da meccanismi sia molecolari che meccanici. Mentre molti modelli 3D sono stati sviluppati negli ultimi decenni per studiare i driver molecolari (ad esempio, VEGF e segnalazione Notch) dell'angiogenesi germinativa, si sa solo poco sulla meccanica cellulare a causa delle limitazioni del modello. La microscopia a forza di trazione (TFM) è una tecnica ben nota per la quantificazione delle forze cellulari nello spazio e nel tempo, in cui le deformazioni del substrato 2D vengono convertite in trazioni cellulari. Pertanto, in questo protocollo, descriviamo un modello ex vivo 2.5D, il che significa che forniamo localmente alle cellule un ambiente 3D preservando la semplicità di un modello 2D che consente la quantificazione delle forze di trazione durante l'angiogenesi germinativa (Figura 1). Per fare ciò, abbiamo preparato e seminato un foglio arterioso suino (lato endoteliale rivolto verso il basso; Figura 2) sopra un idrogel di poliacrilammide (PAA) rivestito di collagene di tipo IV contenente marcatori fluorescenti. Dopo l'attacco del foglio arterioso utilizzando un vetrino coprioggetti da 13 mm (Figura 3), aggiungiamo un sottile strato di idrogel di collagene di tipo I che permette la formazione di germogli cellulari (Figura 4). Utilizzando questo modello, dimostriamo che durante la germinazione cellulare 22,23,24,25, le cellule leader esercitano forze di trazione (come è stato osservato in letteratura 19,20,21,22), ma anche che le cellule seguaci esercitano forze di spinta (Figura 6). La risoluzione del campo di trazione ottenuta attraverso il nostro protocollo consente di effettuare analisi quantitative della cinematica e della dinamica cellulare sia nel tempo che nello spazio tipiche delle opere che ricorrono alla microscopia della forza di trazione su substrati conformi 37,38,39.
Inoltre, dimostriamo la versatilità di questo modello ex vivo 2.5D di angiogenesi germinativa modificando i segnali meccanici del microambiente (Figura 5). Mentre l'angiogenesi germinativa si verifica normalmente a una rigidità fisiologica di 1 kPa35 - che può essere imitata da un idrogel di collagene 3D di tipo I, l'angiogenesi tumorale si verifica in un microambiente irrigidito40 - che è oltre l'intervallo di rigidità degli idrogel convenzionali di collagene 3D di tipo I. La rigidità del substrato PAA può essere facilmente regolata modificando il rapporto dei reticolanti per generare una maggiore rigidità del substrato. Utilizzando questo modello, riveliamo che l'inizio dell'angiogenesi germinativa è rigidità-dipendente. Questi substrati non solo offrono rigidità regolabile, ma consentono anche la modulazione sistematica di vari altri segnali meccanici, ad esempio la composizione e la densità della matrice. Inoltre, questo modello ci permette di studiare la meccanica cellulare manipolando i regolatori molecolari utilizzando il condizionamento del mezzo (ad esempio, l'effetto dell'inibizione sulla segnalazione di Notch sulla meccanica cellulare) per comprendere i meccanismi meccanobiologici dell'angiogenesi germinativa. Ciò dimostra l'utilità di questo modello ex vivo 2.5D di angiogenesi germinativa in un campione di diversi microambienti.
Il modello che presentiamo utilizza il TFM 2D convenzionale, che offre un'analisi più semplice, una risoluzione spaziale più elevata e un'implementazione più semplice rispetto al TFM 3D (viscoelastico), rendendolo più accessibile ed economico26,41. Tuttavia, il TFM 3D (viscoelastico) fornisce un ambiente fisiologicamente più rilevante catturando le forze di trazione in tutte e tre le dimensioni e tenendo conto delle complesse proprietà meccaniche della matrice extracellulare, offrendo informazioni più approfondite sul comportamento cellulare in un contesto più realistico 42,43,44,45. Questo effetto della dimensionalità indica anche una limitazione di questo modello 2.5D. Utilizziamo il TFM 2D partendo dal presupposto che le cellule stiano migrando su un substrato 2D. Mentre questo è il caso di questo modello 2.5D, le cellule si trovano in un ambiente 3D locale e quindi aderiscono allo strato di gel di collagene di tipo I ed esercitano forze in questo strato di gel. L'ipotesi che abbiamo adottato all'interno di questa analisi è che lo strato di gel di collagene di tipo I non sia accoppiato meccanicamente (nessuna trasmissione di forza tra questi due idrogel) all'interfaccia PAA a causa della differenza di ordine di grandezza nella rigidità della matrice, riducendo quindi al minimo l'effetto delle forze cellulari sullo strato di collagene di tipo I. Ciò rende la caratterizzazione della forza utilizzando il modello 2.5D ex vivo una rappresentazione semplificata delle forze generate dalle cellule. Inoltre, questo protocollo richiede precisione ed è esteso con diverse fasi in cui i campioni possono essere persi, ad esempio (i) difficoltà di visibilità cellulare dovute all'eccessivo tessuto che circonda il foglio arterioso (Figura 2), (ii) un campione su tre non si attacca al substrato PAA (Figura 3), (iii) non tutti i campioni avviano la formazione di germogli cellulari (Figura 5), (iv) i germogli cellulari non si formano sul substrato PAA e (v) marcatori fluorescenti sfocati quando si utilizza un foglio arterioso spesso sopra un idrogel PAA a bassa rigidità. Pertanto, abbiamo ottimizzato questo metodo per una piastra a 12 pozzetti per garantire un ampio numero di regioni di interesse per eseguire l'analisi meccanica dell'angiogenesi germinativa.
In conclusione, l'approccio presentato per la caratterizzazione semplificata delle forze di trazione cellulare dell'angiogenesi germinativa di un foglio arterioso suino vivente utilizzando un modello 2.5D (Figura 7) può aiutare a creare informazioni più accurate e in tempo reale sulle interazioni meccaniche durante l'angiogenesi all'interno di un contesto tissutale nativo, facilitando lo studio dei processi cellulari dinamici con complessità ridotta e riproducibilità migliorata rispetto ai sistemi completamente 3D. Ciò potrebbe migliorare la nostra comprensione di come le cellule rispondono a segnali meccanici in un ambiente fisiologicamente più rilevante, pur mantenendo la semplicità analitica dei metodi 2D. Queste conoscenze potrebbero far progredire il campo dell'ingegneria tissutale con l'obiettivo di creare vasi sanguigni ma anche trovare farmaci terapeutici per la prevenzione dell'angiogenesi tumorale con l'obiettivo di limitare la crescita tumorale e ridurre le metastasi.
Divulgazioni
Gli autori non hanno conflitti di interesse da rivelare.
Riconoscimenti
Ringraziamo le persone di LifeTec per aver raccolto e trasportato le arterie carotidi suine dal macello locale; Leon Hermans, Pim van den Bersselaar e Adrià Villacrosa Ribas (TU/e, ICMS) per le proficue discussioni sulle procedure sperimentali e l'analisi della caratterizzazione meccanica. Ringraziamo il nostro sostegno per le sovvenzioni del Consiglio Europeo della Ricerca (771168), dell'Organizzazione Olandese per la Ricerca Scientifica (024.003.013), dell'Accademia di Finlandia (307133, 316882, 330411 e 337531) e dei Centri di Eccellenza per la Meccanostasi Cellulare (CellMech) della Fondazione Åbo Akademi University.
Materiali
| Name | Company | Catalog Number | Comments |
| 2% bis-acrylamide | Bio-Rad | 1610143 | |
| 2-mercaptoethanol | Merck Life Science | 60-24-2 | |
| 3-(Trimethoxysilyl)propyl methacrylate | Bind-Silane | Sigma-Aldrich | 440159-100ML |
| 40% acrylamide | Bio-Rad | 1610140 | |
| Aboslute ethanol (for analysis) | VWR International | 1.00983.1000 | |
| Absolute ethanol (industrial) | VWR International | 83813.41 | |
| Acetic acid, glacial 100% | Merck | 1000562500 | |
| Ammonium persulfate | APS | Bio-Rad | 7727-54-0 |
| antibody (primary) - calponin | abcam | ab46794 | |
| antibody (primary) - CD31 | Serotec | MCA1746 | |
| antibody (primary) - α-smooth muscle actin | αSMA | Dako | M0851 |
| antibody (secondary) - goat-anti-mouse-IgG1 Alexa 488 | Molecular Probes | A21121 | |
| antibody (secondary) - goat-anti-mouse-IgG2a Alexa 555 | Molecular Probes | A21137 | |
| antibody (secondary) - goat-anti-rabbit-IgG Alexa 555 | Molecular Probes | A21428 | |
| Autoclave | Astell | ||
| Calcium chloride dihydrate | CaCl2 | Calbiochem | 208291-250GM |
| Collagen type I, rat-tail | Corning | 354236 | |
| Collagen type IV, human placenta | Merck Life Science | C5533-5MG | |
| Endothelial Cell Growth Medium | ECG medium | Promocell | C-22111 |
| Expoxy-coated round tip tweezer | fine tweezer | Rubis Pinzette | E78144-2A |
| Fluorescent marker, dark red | Invitrogen | F8807 | |
| Glass coverslips, Ø13 mm, #1 | Epredia | CB00130RA120MNZ0 | |
| Glass coverslips, Ø13 mm, #1.5 | Epredia | CB00120RAC20MNZ0 | |
| Hydrochloride acid, 25% | HCl | Merck | 1.100316.1000 |
| Krebs-Henseleit buffer | Sigma-Aldrich | K3753 | |
| Microscope, Leica Application Suite X software, version 3.5.7.23225 | Leica Microsystems | ||
| Microscope, Leica DMi8 epifluorescent microscope | Leica Microsystems | ||
| Microscope, Nikon Ti2 Eclipse | Nikon | ||
| Microscope, NIS-Elements AR software | Nikon | ||
| N,N,N',N'-tetramethylethane-1,2-diamine | TEMED | Merck Life Science | 110-18-9 |
| Nalgene bottle | Thermo Scientific | 2187-0016 | |
| Needle, 21Gx1" | Henke Sass Wolf | HK4710008025 | |
| Normal serum, goat | Gibco | 10098792 | |
| Papaverine hydrochloride | Sigma | 61-25-6 | |
| Penicillin/Streptomyocin (10 000 U/mL) | P/S | Gibco | 15140163 |
| Petri-dish, large (145x20mm) | Greiner Bio-one | 639160 | |
| Petri-dish, small (60x15mm) | Greiner Bio-one | 628160 | |
| Phosphate Buffered Saline | PBS | Sigma | P4417 |
| Pluronic F-127 | Merck Life Science | P2443-250G | |
| Puncture needle, sharp closed tip | unknown | ||
| Scalpel, no. 4 | Swann-Morton | ||
| Sodium hydrogen carbonate | NaHCO3 | VWR International | 144-55-8 |
| sulfosuccinimidyl 6-(4'-azido-2'-nitrophenylamino)hexanoate | Sulfo-SANPAH | Thermo Scientific | 22589 |
| Surgical blade, no. 20 | Swann-Morton | ||
| Surgical drape sheet | Foliodrape | 2775001 | |
| Surgical tweezer | Lettix | 400024 | |
| Triton X-100 | Merck | 9036-19-5 | |
| UV lamp | Analytik Jena | 95-0042-13 | |
| well plate, 96-well, F-bottom | Greiner Bio-one | 655180 | |
| well plate, glass bottom 12-well | MatTek | P12G-0-14-F |
Riferimenti
- Carmeliet, P. Angiogenesis in health and disease. Nat Med. 9 (6), 653-660 (2003).
- Folkman, J. Angiogenesis in cancer, vascular, rheumatoid and other disease. Nat Med. 1, 27-30 (1995).
- Kretschmer, M., Rüdiger, D., Zahler, S. Mechanical aspects of angiogenesis. Cancers. 13 (19), 4987 (2021).
- Bordeleau, F., et al. Matrix stiffening promotes a tumor vasculature phenotype. Proc Natl Acad Sci U S A. 114 (3), 492-497 (2017).
- Blanco, R., Gerhardt, H. VEGF and Notch in tip and stalk cell selection. Cold Spring Harb Perspect Med. 3 (1), a006569 (2013).
- Adams, R. H., Alitalo, K. Molecular regulation of angiogenesis and lymphangiogenesis. Nat Rev Mol Cell Biol. 8, 464-478 (2007).
- Carmeliet, P., De Smet, F., Loges, S., Mazzone, M. Branching morphogenesis and antiangiogenesis candidates: tip cells lead the way. Nat Rev Clin Oncol. 6, 315-326 (2009).
- Salam, N., et al. Assessment of migration of human mscs through fibrin hydrogels as a tool for formulation optimisation. Materials. 11 (9), 1781 (2018).
- Solbu, A. A., et al. Assessing cell migration in hydrogels: An overview of relevant materials and methods. Materials Today Bio. 18, 100537 (2023).
- Cao, W., Li, X., Zuo, X., Gao, C. Migration of endothelial cells into photo-responsive hydrogels with tunable modulus under the presence of pro-inflammatory macrophages. Regenerat Biomater. 6 (5), 259-267 (2019).
- Staton, C. A., Reed, M. W. R., Brown, N. J. A critical analysis of current in vitro and in vivo angiogenesis assays. Int J Exp Pathol. 90 (3), 195-221 (2009).
- Staton, C. A., et al. Current methods for assaying angiogenesis in vitro and in vivo. Int J Exp Path. 85, 233-248 (2004).
- Ngo, T. X., et al. In Vitro models for angiogenesis research: A review. Int J Tissue Regenerat. 5, 37-45 (2014).
- Tomita, Y., et al. An ex vivo choroid sprouting assay of ocular microvascular angiogenesis. J Vis Exp. (162), e61677 (2020).
- Kapoor, A., Chen, C. G., Iozzo, R. V. A simplified aortic ring assay: A useful ex vivo method to assess biochemical and functional parameters of angiogenesis. Matrix Biol Plus. 6-7, 100025 (2020).
- Stiffey-Wilusz, J., Boice, J. A., Ronan, J., Fletcher, A. M., Anderson, M. S. An ex vivo angiogenesis assay utilizing commercial porcine carotid artery: Modification of the rat aortic ring assay. Angiogenesis. 4 (1), 3-9 (2001).
- Kniazeva, E., Putnam, A. J. Endothelial cell traction and ECM density influence both capillary morphogenesis and maintenance in 3-D. Am J Physiol Cell Physiol. 297 (1), C179-C187 (2009).
- Davidson, C. D., Wang, W. Y., Zaimi, I., Jayco, D. K. P., Baker, B. M. Cell force-mediated matrix reorganization underlies multicellular network assembly. Sc Rep. 9 (1), 12 (2019).
- Lyle, K. S., Corleto, J. A., Wittmann, T. Microtubule dynamics regulation contributes to endothelial morphogenesis. BioArchitecture. 2 (6), 220-227 (2012).
- Kniazeva, E., et al. Quantification of local matrix deformations and mechanical properties during capillary morphogenesis in 3D. Integrat Biol. 4 (4), 431-439 (2012).
- Quintanilla, M. A., Hammer, J. A., Beach, J. R. Non-muscle myosin 2 at a glance. J Cell Sci. 136 (5), jcs.260890 (2023).
- Fischer, R. S., Gardel, M., Ma, X., Adelstein, R. S., Waterman, C. M. Local cortical tension by myosin II guides 3D endothelial cell branching. Curr Biol. 19 (3), 260-265 (2009).
- Yoon, C., et al. Myosin IIA–mediated forces regulate multicellular integrity during vascular sprouting. Mol Biol Cell. 30 (16), 1974-1984 (2019).
- Du, Y., et al. Three-dimensional characterization of mechanical interactions between endothelial cells and extracellular matrix during angiogenic sprouting. Sci Rep. 6, 21362 (2016).
- Vaeyens, M. M., et al. Matrix deformations around angiogenic sprouts correlate to sprout dynamics and suggest pulling activity. Angiogenesis. 23 (3), 315-324 (2020).
- Style, R. W., et al. Traction force microscopy in physics and biology. Soft Matter. 10 (23), 4047-4055 (2014).
- Trepat, X., et al. Physical forces during collective cell migration. Nat Phys. 5 (6), 426-430 (2009).
- Santos-Oliveira, P., et al. The force at the tip - modelling tension and proliferation in sprouting angiogenesis. PLoS Comput Biol. 11 (8), e1004436 (2015).
- Boreddy, S. R., Sahu, R. P., Srivastava, S. K. Benzyl isothiocyanate suppresses pancreatic tumor angiogenesis and invasion by inhibiting HIF-α/VEGF/Rho-GTPases: Pivotal role of STAT-3. PLoS One. 6 (10), 0025799 (2011).
- Teng, R. J., Eis, A., Bakhutashvili, I., Arul, N., Konduri, G. G. Increased superoxide production contributes to the impaired angiogenesis of fetal pulmonary arteries with in utero pulmonary hypertension. Am J Physiol Lung Cell Mol Physiol. 297 (1), L184-L195 (2009).
- Costa, G., et al. Asymmetric division coordinates collective cell migration in angiogenesis. Nature Cell Biol. 18 (12), 1292-1301 (2016).
- Slater, K., Partridge, J., Nandivada, H. . Corning tuning the elastic moduli of Corning Matrigel and collagen I 3D matrices by varying the protein concentration. , (2019).
- Lee, J., et al. Effect of chain flexibility on cell adhesion: Semi-flexible model-based analysis of cell adhesion to hydrogels. Sci Rep. 9 (1), 2463 (2019).
- Motte, S., Kaufman, L. J. Strain stiffening in collagen i networks. Biopolymers. 99 (1), 35-46 (2013).
- Butcher, D. T., Alliston, T., Weaver, V. M. A tense situation: Forcing tumour progression. Nat Rev Cancer. 9 (2), 108-122 (2009).
- Artym, V. V., Matsumoto, K. Imaging cells in three-dimensional collagen matrix. Curr Prot Cell Biol. 10, Unit 10.18.1-Unit 10.18.20 (2010).
- Labernadie, A., et al. A mechanically active heterotypic E-cadherin/N-cadherin adhesion enables fibroblasts to drive cancer cell invasion. Nat Cell Biol. 19 (3), 224-237 (2017).
- Bazellières, E., et al. Control of cell-cell forces and collective cell dynamics by the intercellular adhesome. Nat Cell Biol. 17 (4), 409-420 (2015).
- Uroz, M., et al. Traction forces at the cytokinetic ring regulate cell division and polyploidy in the migrating zebrafish epicardium. Nat Mater. 18 (9), 1015-1023 (2019).
- Dong, C., Nastaran, Z., Konstantopoulos, K. . Biomechanics in oncology. , (2018).
- Schwarz, U. S., Soiné, J. R. D. Traction force microscopy on soft elastic substrates: A guide to recent computational advances. Biochim Biophys Acta. 1853 (11), 3095-3104 (2015).
- Toyjanova, J., et al. 3D Viscoelastic traction force microscopy. Soft Matter. 10 (40), 8095-8106 (2014).
- Legant, W. R., et al. Multidimensional traction force microscopy reveals out-of-plane rotational moments about focal adhesions. Proc Natl Acad Sci U S A. 110 (3), 881-886 (2013).
- Steinwachs, J., et al. Three-dimensional force microscopy of cells in biopolymer networks. Nat Meth. 13 (2), 171-176 (2016).
- Franck, C., Maskarinec, S. A., Tirrell, D. A., Ravichandran, G. Three-dimensional traction force microscopy: A new tool for quantifying cell-matrix interactions. PLoS One. 6 (3), e17833 (2011).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon