Method Article
Canlı Dokuda Filizlenen Anjiyogenezin Ex Vivo Mekanik Karakterizasyonu için 2.5D Model
Bu Makalede
Özet
Gelişim ve hastalık için temel olan filizlenme anjiyogenez, karmaşık moleküler ve mekanik süreçleri içerir. Domuz karotis arterlerinden hücresel filizlenmeyi analiz eden, sertliğe bağlı anjiyogenezi ve farklı lider-takipçi hücre mekaniğini ortaya çıkaran çok yönlü bir 2.5D ex vivo model sunuyoruz. Bu model, doku mühendisliği stratejilerinin ve kanser tedavisi yaklaşımlarının geliştirilmesine yardımcı olur.
Özet
Filizlenme anjiyogenez, önceden var olan damar sisteminden yeni kan damarlarının oluşumudur ve doku büyümesi ve onarımı gibi fizyolojik ve kanser ve metastaz dahil olmak üzere patolojik süreçler için büyük önem taşır. Filizlenme anjiyogenezinin çok aşamalı süreci, moleküler ve mekanik olarak yönlendirilen bir süreçtir. Vasküler endotelyal büyüme faktörü ile hücresel filizin indüksiyonu, Notch sinyali yoluyla lider/takipçi hücre seçimi, endotel hücrelerinin yönlendirilmiş göçü ve damar füzyonu ve stabilizasyonundan oluşur. Hücresel filizlenmenin altında yatan mekanizmaları daha iyi anlamak için yıllar boyunca çeşitli filizlenme anjiyogenez modelleri geliştirilmiştir. Filizlenme anjiyogenezinin moleküler itici güçlerinin anlaşılmasındaki ilerlemelere rağmen, mekanik ipuçlarının rolü ve filizlenme anjiyogenezinin mekanik itici gücü mevcut modellerdeki sınırlamalar nedeniyle yeterince araştırılmamıştır. Bu çalışmada, çekiş kuvveti mikroskobu kullanarak bir domuz karotis arterinden hücresel filizlenmeyi mekanik olarak karakterize etmemizi sağlayan 2.5D ex vivo bir model tasarladık. Model, filiz içinde, lider hücrelerin çekme kuvvetleri uyguladığı ve takip eden hücrelerin matris üzerinde itme kuvvetleri uyguladığı farklı kuvvet modellerini tanımlar. Modelin çok yönlülüğü, matris sertliği gibi hem kimyasal hem de mekanik ipuçlarının manipüle edilmesine izin vererek, çeşitli mikro ortamlarla olan ilgisini artırır. Burada, filizlenme anjiyogenezinin başlangıcının sertliğe bağlı olduğunu gösteriyoruz. Filizlenme anjiyogenezinde hücresel çekiş kuvvetlerini ölçmek için sunulan 2.5D modeli, doku mühendisliğini ve tümör anjiyogenezine karşı terapötik stratejileri ilerletebilecek mekanik ipuçlarına hücresel tepkiler hakkındaki anlayışımızı geliştiren basitleştirilmiş ancak fizyolojik olarak ilgili bir yöntem sunar.
Giriş
Anjiyogenez, önceden var olan kan damarlarından yeni kan damarı oluşumu sürecidir. Bu süreç, embriyonik gelişim, yara iyileşmesi ve kanserin ilerlemesi sırasında gereklidir ve bunların tümü mikro çevredekibiyomekanik değişikliklerle ilişkilidir 1,2,3,4. Anjiyogenezin başlangıcında, hipoksik veya yaralı dokular, komşu kan damarlarının endotel hücrelerini endotel filizleri oluşturmak üzere aktive edecek vasküler endotelyal büyüme faktörünü (VEGF) serbest bırakır - burada iki farklı lider ve takipçi fenotip, moleküler Çentik sinyal yolu5 aracılığıyla benimsenir. Filizlenme anjiyogenezi olarak bilinen bir fenomen olan endotel filizlerinin oluşumu üzerine, lider hücreler, takip eden takipçi hücreler 6,7 ile hücre-hücre adezyonlarını kaybetmeden toplu olarak VEGF uyaranına doğru göç etmek için çevredeki hücre dışı matrisi bozacaktır.
Geçtiğimiz on yıllar boyunca, her biri farklı faydalar ve sınırlamalar sunan çeşitli metodolojiler yoluyla kolektif hücre göçünü araştıran filizlenme anjiyogenez tahlilleri tanımlanmıştır. Bu tahliller, endotel hücreleri gibi hücre gruplarının 3D matrisler aracılığıyla koordineli hareketini değerlendirerek, kontrollü bir ortamda filizlenme, istila ve toplu göç gibi hücresel davranışların incelenmesine olanak tanır 8,9,10. İn vivo filizlenme anjiyogenez deneyleri, canlı bir organizma içinde kapsamlı bir değerlendirme sağlar, karmaşık etkileşimleri yakalar, ancak zaman alıcıdır, maliyetlidir, yüksek değişkenliğe eğilimlidir ve ölçülmesi zordur11,12. İn vitro filizlenme anjiyogenez deneyleri, yüksek tekrarlanabilirlik ve hassas miktar tayini ile deneysel koşullar üzerinde hassas kontrole izin verir, ancak in vivo karmaşıklıkları tam olarak kopyalamayabilir 11,12,13. Buna karşılık, aort halkası testinin en yaygın olarak uygulanan model olduğu ex vivo filizlenme anjiyogenez deneyleri, in vivo komplikasyonlardan kaçınırken fizyolojik alaka düzeyini koruyarak organizma dışındaki dokuları kullanır 14,15,16. Teknik olarak zorlayıcı olmalarına ve bazen doku canlılığı ile mücadele etmelerine rağmen, ex vivo modeller karmaşıklık ve kontrol arasında değerli bir denge sunar ve bu da onları filizlenme anjiyogenezini incelemek için umut verici bir yaklaşım haline getirir. Bu modeller, filizlenme anjiyogenezinin moleküler itici güçlerini incelemek için yaygın olarak kullanılmış olsa da, mekanik ipuçlarının etkisi ve hücrelerin mekanik davranışı tam olarak anlaşılamamıştır.
Filizlenme anjiyogenezi sırasında çok hücreli göç, aktomiyosin bazlı kasılma kuvvetleri, çevredeki hücre dışı matrise endotel hücre istilasını düzenlediğinden, hücresel mekaniğe büyük ölçüde bağlıdır 17,18,19,20. Spesifik olarak, hücre21 içindeki ana aktin bazlı kasılma makineleri olan kas dışı miyozin II motorların, filizlenme anjiyogenezi22,23 sırasında hücresel kasılma kuvvetlerini kontrol ettiği gözlemlenmiştir. Lider hücre muhtemelen filizin baskın kuvvet üreten elemanıdır, çünkü çevredeki 3D hücre dışı matrisin deformasyonları, lider hücre çevresinde, özellikle yakın aktin açısından zengin hücresel çıkıntılar23,24, takipçilerine kıyasla önemli ölçüde daha yüksektir 22,23,25. 3 boyutlu filizlenme anjiyogenezinde hücresel kontraktilitenin önemine dair bu artan kanıtlara rağmen, filizlenme anjiyogenezinin hücresel mekaniğinin uzay-zamansal mekanik karakterizasyonu için bir yöntem eksiktir.
Bu çalışmanın genel amacı, filizlenme sırasında hücresel göçün mekanik karakterizasyonuna izin veren bir yöntem geliştirmektir. Biyolojik olarak ilgili bir bağlamda mekanik kuvvetlerin uzay-zamansal karakterizasyonunu elde ederek, hücresel mekaniğin anjiyojenik filiz oluşumunu nasıl etkilediğine dair yeni bilgiler sağlamayı amaçlıyoruz. Bu amaçla, bir 2D poliakrilamid (PAA) hidrojel oluşturarak, üzerine bir karotis arter tabakası ekerek ve hücreler için lokalize bir 3D ortam oluşturmak için ince bir kollajen tip I jel tabakası ile kaplayarak bir 2.5D model sistemi geliştirdik. Çok hücreli filizler, PAA-kollajen jel arayüzündeki arteriyel tabakadan dışarı göç etti. Bu yöntemin mevcut tekniklere kıyasla avantajı, 2D PAA hidrojelinin, hücrelerin elastik bir 2D substrata yapıştığı ve hücresel çekiş kuvvetleri26 üzerine substratı deforme edeceği iyi bilinen çok yönlü bir teknik olan çekiş kuvveti mikroskobu (TFM) ile analizlere izin vermesidir. Bu deformasyonlar yakalanabilir ve hücresel çekiş kuvvetleri, alt tabakanın26 mekanik özelliklerine dayalı olarak hesaplanabilir. TFM'yi ex vivo canlı dokularda kullanım için uyarlayarak, in vitro kontrol ve in vivo alaka düzeyi arasındaki boşluğu doldurmayı ve anjiyogenez sırasında mekanik kuvvetlerin daha kapsamlı bir şekilde anlaşılmasını sağlamayı amaçlıyoruz.
Protokol
Bu protokolde domuz karotis arterleri kullanıldı. Domuz karotis arterleri, yerel bir mezbahadan elde edilen 5-7 aylık ve ağırlığı (canlı) 80-120 kg olan Hollanda Landrace melez domuzlarından hasat edildi. Protokoller, Hollanda Hükümeti (Hollanda Tarım, Doğa ve Gıda Kalitesi Bakanlığı) tarafından denetlenen teşhis ve araştırma için mezbaha hayvan materyali ile ilgili 1069/2009 sayılı EC yönetmeliklerine uygundu ve hayvan refahının ilgili yasal makamları (Gıda ve Tüketici Ürün Güvenliği Kurumu) tarafından onaylandı. Doku, halihazırda sonlandırılmış hayvanların yan ürünlerinden toplandığı için etik onay gerekli değildi. Ölüm ve doku nakli arasındaki süre, mezbahaya bağlı olarak 10-25 dakikadır.
NOT: Malzeme Tablosu , bu protokolde kullanılan malzemeler, ekipman ve reaktiflerle ilgili ayrıntıları özetlemektedir. 2D ve 3D numuneler için protokoller Ek Dosya 1'de açıklanmıştır.
1. 2D poliakrilamid (PAA) substratların hazırlanması
- Çeker ocakta, sırasıyla 4286 μL, 357 μL ve 357 μL'de 12:1:1 mutlak etanol (sentez için), asetik asit ve bağlayıcı-silanı karıştırarak bağlayıcı-silan çözeltisi hazırlayın. 120 μL / kuyucuk bağlama-silan çözeltisini cam tabanlı 12 oyuklu bir plaka üzerinde oda sıcaklığında 1 saat inkübe edin.
DİKKAT: Mutlak etanol oldukça yanıcı bir sıvı ve buhardır (H225) ve ciddi göz tahrişine (H319) neden olur. Asetik asit yanıcı bir sıvı ve buhardır (H226) ve ciddi cilt yanıklarına ve göz hasarına (H314) neden olur. Kişisel koruyucu ekipman giyin ve çeker ocakta çalışın. - Çeker ocakta, cam tabanlı 12 oyuklu plakayı 3x bir sprey şişesi kullanarak mutlak etanol (endüstriyel) ile yıkayın. Etanolü atın.
- Cam tabanlı 12 oyuklu plakayı nitrojen gazı kullanarak kurutun. Cam tabanın üstünde beyaz bir leke belirirse, yıkama yeterli değildir. Cam alt 12 kuyulu plakayı tekrar yıkayın.
- PAA jel karışımını Tablo 1'deki oranlara göre hazırlayın.
- PBS'yi bir mikrosantrifüj tüpüne ekleyin ve jel karışımındaki %40 akrilamid, %2 bis-akrilamid ve floresan işaretleyicileri yeniden süspanse edin. Jel hazırlamadan hemen önce çözeltiyi girdaplayın.
- Mümkün olduğunca hızlı bir şekilde, çözeltiye %10 APS ve TEMED ekleyin ve her bir elementin eklenmesinden sonra girdap yapın. Her bir oyuğun cam tabanına 11,5 μL jel karışımından oluşan bir damla pipetleyin ve damlacığın üzerine yavaşça 13 mm'lik bir lamel yerleştirin.
- Jel karışımını lamel altına eşit şekilde yaymak için plakaya hafifçe vurun ve döndürün. Hava kabarcıkları oluşursa, lamel hafifçe kaldırarak bunları çıkarın. Jelleri oda sıcaklığında 1 saat polimerleşmeye bırakın. Tüpte kalan jel karışımını kullanarak polimerizasyonu kontrol edin. 12 oyuklu plakadaki polimerize PAA jelleri bir iç hale gösterecektir.
DİKKAT: Akrilamid yutulduğunda veya solunduğunda zararlıdır (H302 + H332), cilt tahrişine neden olur (H315), alerjik cilt reaksiyonuna neden olabilir (H317), ciddi göz tahrişine neden olabilir (H319), genetik kusurlara neden olabilir (H340), kansere neden olabilir (H350), doğurganlığa zarar verme şüphesi vardır (H361f) ve yutulduğunda uzun süreli veya tekrarlanan maruz kalma yoluyla organlara zarar verir (H372). APS yangını yoğunlaştırabilir (oksitleyici, H272), yutulduğunda zararlı (H302), cilt tahrişine neden olabilir (H315), alerjik cilt reaksiyonuna neden olabilir (H317), ciddi göz tahrişine neden olabilir (H319), solunduğunda alerji veya astım semptomlarına veya solunum güçlüğüne neden olabilir (H334) ve solunum yolu tahrişine (H335). TEMED oldukça yanıcı bir sıvı ve buhardır (H225), yutulduğunda zararlıdır (H302), ciddi cilt yanıklarına ve göz hasarına neden olur (H314) ve solunduğunda toksiktir (H331). Kişisel koruyucu ekipman giyin.
- Polimerizasyondan sonra, kuyuya PBS ekleyin. Cımbız ve/veya bükülmüş bir iğne kullanarak lameli nazikçe kaldırın ve çıkarın. Jelleri PBS'de bir kez yıkayın.
- PAA jellerinin kollajen kaplamasını kolaylaştırmak için, jellerin çapraz bağlayıcı Sulfo-SANPAH kullanılarak işlevselleştirilmesi gerekir. PAA jele ultra saf suda çözülmüş 75 μL 1 mg / mL Sulfo-SANPAH ekleyin ve 365 nm UV ışığı altında 5 dakika inkübe edin.
NOT: Sulfo-SANPAH'ı ışıktan koruyun ve UV inkübasyonundan hemen önce ultra saf su ekleyin. Açık kırmızıdan (UV ışığı inkübasyonundan önce) koyu kırmızıya (UV ışığı inkübasyonundan sonra) kadar bir renk değişikliği görülebilir.
DİKKAT: Sülfo-SANPAH ciddi göz tahrişine (H319) neden olur. - Biyogüvenlik kabininde, jeller üzerinde Sulfo-SANPAH'ı hızlı ve steril bir PBS yıkaması gerçekleştirin. Sonuç olarak, işlevselleştirilmiş PAA jellerini 2x steril PBS'de 10 dakika yıkayın.
NOT: Protokolde bu noktadan itibaren tüm adımlar steril koşullar altında gerçekleştirilecektir. - Biyogüvenlik kabininde, buz üzerinde PBS'de 0.1 mg / mL kollajen tip IV çözelti hazırlayın. İşlevselleştirilmiş PAA jelinin üzerine 50 μL 0.1 mg / mL kollajen tip IV damlacık pipetleyin ve gece boyunca 4 ° C'de inkübe edin.
- Jelleri 2 kez steril PBS'de yıkayın. PBS'yi çıkarın ve jelleri 5 dakika kurumaya bırakın.
- Jellerin üzerine 50 μL'lik bir damla endotel hücre büyümesi (EKG) ortamı pipetleyin ve 37 ° C'de ve% 5 CO2'de en az 1 saat inkübe edin.
NOT: Jellerin EKG ortamında inkübe edilmesi, jellere hücre ve doku bağlanmalarını iyileştirir.
2. Taşıma için modifiye Krebs çözeltisinin hazırlanması
NOT: Modifiye edilmiş Krebs çözeltisini taze olarak hazırlayın. Bu protokolde doku alımından 1 gün önce modifiye Krebs solüsyonu hazırlanır.
- Bir taşıma şişesini otoklavlayarak sterilize edin. Bir cam şişeyi, gerekli toplam taşıma hacminin (350 mL) %90'ı (315 mL) ultra saf su ile doldurun. Su sıcaklığının 15-20 °C olduğundan emin olun.
- Karıştırma mıknatısı kullanarak suyu hafifçe karıştırırken 9,6 g/L (3,36 g) Krebs-Henseleit Tamponu ekleyin ve eriyene kadar karıştırın. Bir Pasteur pipeti kullanarak, çözeltideki tüm toz izlerini dahil etmek için tartım teknesini küçük bir hacimde çözelti ile durulayın. Çözeltiyi ısıtmayın.
- Karıştırırken, çözeltiye 0.373 g / L (130.55 mg) kalsiyum klorür (CaCl2) ekleyin ve eriyene kadar karıştırın. Kantarı az miktarda solüsyonla durulayın.
DİKKAT: H319 ciddi göz tahrişine neden olur. - Karıştırırken, çözeltiye 2,1 g/L (0,63 g) sodyum bikarbonat (NaHCO3) ekleyin ve eriyene kadar karıştırın. Kantarı az miktarda solüsyonla durulayın.
- Karıştırırken, çözeltiye 1 x 10-1 mM (13.15 mg) papaverin ekleyin ve eriyene kadar karıştırın. Kantarı az miktarda solüsyonla durulayın.
NOT: Papaverine, hasat sırasında damarın kesilmesi ve taşınmasından kaynaklanan aşırı vazokonstriksiyonu önlemek için kullanılan düz bir kas gevşeticidir.
DİKKAT: H301 yutulduğunda toksiktir. - Çeker ocakta, çözeltiye 0,05 mM (1,2 μL) 2-merkaptoetanol ekleyin ve karıştırın.
NOT: 2-merkaptoetanol, düşük oksijen radikallerini düşük seviyede tutmak için kullanılır.
DİKKAT: 2-merkaptoetanol yutulduğunda veya solunduğunda toksiktir (H301 + H331), cilt ile temasında ölümcüldür (H310), cilt tahrişine neden olur (H315), alerjik cilt reaksiyonuna neden olabilir (H317), ciddi göz hasarına neden olur (H318), doğmamış çocuğa zarar verdiğinden şüphelenilir (H361d), yutulduğunda daha uzun süre veya tekrarlanan maruz kalma yoluyla organlara zarar verebilir (H373) ve uzun süreli etkilerle su yaşamı için çok toksiktir (H410). Kişisel koruyucu ekipman giyin ve çeker ocakta çalışın. - Karıştırırken 1 N (1 M) HCl veya 1 N (1 M) NaOH ekleyerek pH'ı 7,2'ye ayarlayın. Nihai pH hedefi 7.4'tür, ancak filtreleme sırasında pH 0.1-0.3 pH birimi yükselebilir.
DİKKAT: HCl basınç altında gaz içerir; ısıtıldığında patlayabilir (H280), ciddi cilt yanıklarına ve göz hasarına (H314) neden olabilir ve solunduğunda toksiktir (H331). Kişisel koruyucu ekipman giyin. - Biyogüvenlik kabininde çalışmaya devam edin. Çözeltiyi son hacme getirmek için% 10 ultra saf su ekleyin.
- Çözeltiyi, 0.22 μm gözenekliliğe sahip bir membran kullanarak filtreleyerek hemen sterilize edin. Steril çözeltiyi doğrudan steril bir şişeye dağıtın. Çözeltiye 7 mL% 2 Penisilin / Streptomyosin (P / S) ekleyin.
NOT: Taşıma sırasında, tüm bakterileri uzaklaştırmak için ortama %2 P/S eklenir. Doku kültürü sırasında ortama %1 P/S eklenir. - Modifiye edilmiş Krebs solüsyonunu doku toplanana kadar 4 °C'de saklayın.
3. Doku toplama
- Mezbahaya bağlı olarak, domuzları elektrik çarpması veya CO2 ile sersemletin. Daha sonra, domuzları bir arka bacaktan asın, kanı boşaltılmış ve ölü ilan edilmiştir.
- Temiz kesim işlemine girmeden önce, epilasyon için domuzları haşlayın, son tüyleri çıkarmak için şarkı söyleyin ve karkasın dışını sterilize edin.
- Karın boyunca orta hat kesisi yaparak ve iç organları dikkatlice çıkararak domuzların içini boşaltın. Mezbahaya bağlı olarak, karotis arter hala domuzun karkasına bağlıydı veya karotis arter, torasik organların toplanmasıyla karkastan zaten çıkarılmıştı.
- Keskin bir bıçak kullanarak, karotis arteri, artere dokunmadan veya mekanik zorlama uygulamadan karkas veya boğaz bölgesi dokusundan kalan bir miktar çevre doku ile birlikte alın.
- Karotis arteri içeren dokuyu, şişeyi kısaca açarak steril modifiye Krebs solüsyonu içeren taşıma şişesine yerleştirin. Tüm dokunun Krebs solüsyonu ile kaplandığından emin olmak için şişeyi bir kez ters çevirin. Buz üzerindeki dokuları laboratuvara taşıyın. Ulaşım yaklaşık 30-45 dk sürer.
4. Doku diseksiyonu
- Diseksiyon ekipmanı cerrahi cımbız (kaba kullanım), epoksi kaplı yuvarlak uçlu cımbız (ince kullanım), neşter, kıskaç ve lameller otoklavlama ile sterilize edilir.
- Doku toplama/taşıma işleminden önce biyogüvenlik kabinini hazırlayın. Diseksiyon alanını cerrahi bir örtü tabakası ile örtün. Diseksiyon ekipmanını (steril 50 mL tüplerde), cerrahi bıçakları ve steril lameller monte edin. Bir diseksiyon tepsisi hazırlamak için iki büyük Petri kabını steril PBS ile doldurun. Doku kültürünü 37 ° C'de EKG ortamı ile küçük bir Petri kabında inkübe edin.
- Doku naklinden sonra, biyogüvenlik kabini içinde, karotis arteri taşıma şişesinden (modifiye Krebs solüsyonu ile doldurulmuş) cerrahi cımbız kullanarak steril PBS ile doldurulmuş büyük bir Petri kabına aktarın.
- Karotis arterin net bir görüntüsünü oluşturmak için cerrahi cımbız ve neşter kullanarak karotis arteri çevreleyen fazla dokuyu çıkarın.
- Şah damarının her iki ucundan 2-3 cm uzakta olup arter çatallanmalarına yakın alanları neşter ile keserek ortadan kaldırın. İnce yuvarlak uçlu cımbızı kullanarak karotis arteri çevreleyen arteriyel fasyayı çıkarın.
NOT: Neşter bıçağının yenilenmesi, ön panelin daha hassas bir şekilde kesilmesine yardımcı olur. - Karotis arteri steril PBS ile doldurulmuş yeni bir büyük Petri kabına aktarın. Kalan ince arteriyel fasya tabakasını mümkün olduğunca çıkarın.
NOT: Karotis arter PBS'de ne kadar uzun olursa, o kadar fazla fasya parçası gevşeme eğilimindedir. Fasyanın çıkarılması, mikroskopi sırasında görüşü engelleyeceği için önemlidir. - Temiz karotis arteri yaklaşık 2 mm genişliğinde halkalar halinde kesin. Karotis arter halkalarını EKG ortamı ile doldurulmuş önceden ısıtılmış küçük Petri kabına aktarın ve 37 ° C'de tutun.
5. Doku tohumlama
NOT: Doku bağlanması, PAA hidrojel üzerine tohumlamadan sonra arteriyel tabakanın üzerine farklı boyutlarda lamel yok, steril işlenmemiş lamel veya steril pluronik muamele edilmiş lamel (PBS'de %1 w/v pluronik, lameller gece boyunca inkübe edilmiş ve kullanımdan önce steril ultra saf suda yıkanmış) eklenerek test edilmiştir.
- EKG orta damlacıklarını jellerden çıkarın. Bir karotis arter halkasını steril PBS ile doldurulmuş temiz bir orta Petri kabına aktarın.
- Yuvarlak uçlu cımbız ve neşter kullanarak yüzüğü ikiye bölün. 2 x 2 mm boyutlarında arteriyel tabakalar oluşturmak için yarım halkayı yaklaşık 2 mm genişliğinde tabakalar halinde inceleyin. Arteriyel tabakanın endotel tarafının oryantasyonuna dikkat edin. Eğrilik ve arteriyel tabakanın kalan bazı fasyaları bu yönelimi belirlemeye yardımcı olabilir.
NOT: Karotis arter halkalarının boyutu değişebilir. Büyük halkalar yaklaşık 6-8 yaprak verirken, küçük halkalar 3-4 yaprak verir. Büyük halkalar, arteriyel tabakadaki daha az eğrilik nedeniyle daha iyi bağlantıya sahiptir. - Yuvarlak uçlu cımbızı kullanarak, tabakanın arkasındaki (damar duvarının dışındaki) arteriyel tabakayı tutun ve tabakayı yerleştirirken PAA substratına zarar vermemek için endotelyal iç astar PAA substratına bakacak şekilde PAA jelinin kenarına yerleştirin.
- Cımbız veya kıskaç kullanarak, arteriyel tabakayı jele dokunmadan çok nazikçe PAA hidrojelin merkezine doğru hareket ettirin. Arteriyel tabakayı jelin kenarına yerleştirin (doku cımbıza veya kıskaça yapışabilir).
NOT: Damar duvarının dışındaki küçük arteriyel fasya kalıntıları, damar duvarının endotelyal iç astarı çok pürüzsüzken, arteriyel tabakayı tutmak için kolay bir tutamak oluşturur. - PAA substratı üzerine yerleştirilen arteriyel tabakanın üzerine 50 μL EKG ortamı ekleyin. EKG ortamının damlacığını jelin üzerinde tutmak için Ty.
- Yuvarlak uçlu cımbızı kullanarak, ortadaki PAA substratı üzerindeki arteriyel tabakanın üzerine 13 mm'lik kuru bir lamel yerleştirin. Lameli orta damlacığa değene ve ortam altına yayılana kadar nazikçe indirmek için cam tabanın iç kenarını kullanın.
NOT: 13 mm'lik lameller avantajlıdır çünkü cam alt kuyu plakasının iç duvarının boyutuna çok yakındırlar. Lameli çok hızlı indirirseniz, doku lamelin kenarına doğru hareket edecektir. - Her oyuğa 1 mL EKG ortamı eklemeden önce dokuyu 37 ° C ve% 5 CO2'de 5 saat tutunmaya bırakın. Arteriyel tabakayı PAA substratı üzerine 37 ° C'de ve% 5 CO2'de 24 saat boyunca yerleştirin.
6. 2.5D modelin oluşturulması
- Lameli çıkarmak için yuvarlak uçlu bir cımbız otoklavlayın. Ultra saf suda 1 M NaOH hazırlayın, 0,22 μm gözenek boyutunda bir filtreden süzülerek sterilize edin ve 4 °C'de saklayın.
NOT: 1 M NaOH gelecekteki deneylerde tekrar kullanılabilir. - Bükülmüş uçlu steril keskin bir iğne kullanarak, 13 mm'lik lameli arteriyel tabakadan çok nazikçe kaldırın ve lameli çıkarın. Lameli kaldırmak ve çıkarmak için cam tabanın iç halkasını bir destek olarak kullanın. Yana doğru herhangi bir hareket, arteriyel tabakanın PAA substratından ayrılma riskini artırır.
- Steril bir mikrosantrifüj tüpünde, kollajen tip I karışımını buz üzerinde Tablo 2'ye göre hazırlayın. Çözeltiye kollajen tip I ve NaOH eklendikten sonra, çok iyi bir şekilde yeniden süspanse edin ve karışımın homojen bir şekilde karışmasını sağlamak için tüpü bir kez ters çevirin.
NOT: Karışıma kollajen tip I eklendiğinde, açık pembe renkli karışım renksiz hale gelir. NaOH ilavesiyle renksiz karışım açık pembeye döner. - Bir vakum emme sistemi kullanarak ortamı kuyudan çıkarın. Dokuyu çevreleyen ortamı dokuya dokunmadan mümkün olduğunca çıkarın.
NOT: Arteriyel tabakayı çevreleyen çok fazla ortam, kollajen tipi I jelin onu çevrelemesini engelleyecektir. - Her bir arteriyel tabakanın üzerine 10 μL'lik bir damla kollajen tip I jel karışımı ekleyin ve kollajen tip I jeli 37 ° C'de ve% 5 CO2'de 1 saat polimerize olmaya bırakın.
- Çok nazikçe, her bir oyuğa 1 mL önceden ısıtılmış EKG ortamı ekleyin ve numuneleri 37 °C ve% 5 CO2'ye yerleştirin.
7. Canlı hücre görüntüleme
NOT: Canlı hücre görüntüleme, termal, CO 8 ve nem kontrolü ile donatılmış ve Leica veya NIS yazılımı kullanılarak kontrol edilen bir LeicaDMi2 veya Nikon Ti2 Eclipse epi-floresan mikroskobu kullanılarak gerçekleştirilmiştir. Zaman içinde netlemeyi korumak için uyarlanabilir netleme kontrolü (Leica) ve mükemmel netleme sistemi (Nikon) kullanıldı.
- 2.5D sisteminde 24 saatlik kültürden sonra, filizlenme anjiyogenezi kontrol edin. Bazı arteriyel tabakalar 24 saatlik kültürden sonra hücresel filizler oluşturmaya başlarken, diğer tabakalar endotel filizlenmesini başlatmak için biraz daha zamana ihtiyaç duyar.
- Filizlenme anjiyogenezi başlatıldıysa, EKG ortamını yenileyin ve 12 oyuklu plakayı, mikroskobun 37 ° C'lik önceden ısıtılmış inkübasyon kutusu içindeki aşama tutucusuna yerleştirin.
- İlgilendiğiniz amacı seçin. Bu çalışmada farklı hedefler kullanılmıştır, hücresel filizlerin oluşumuna küresel bir genel bakış oluşturmak için 10x'lik bir hedef ve TFM'yi gerçekleştirmek için 20x'lik bir hedef kullanılmıştır.
- İlgilendiğiniz kanalları tanımlayın. TFM amaçları için, faz kontrastı kullanarak hücresel filizleri görselleştirin ve 660 nm dalga boyunda bir floresan kanalı kullanarak PAA substratındaki floresan işaretleyicileri (koyu kırmızı) görselleştirin.
- İlgilendiğiniz (çoklu) bölgeyi seçin ve odak düzlemini bulun. Zaman atlamalı görüntülemede sabit odaklama sağlamak için odak sistemini açın (Leica DMi8'de uyarlanabilir odak kontrolü veya Nikon Ti2 Eclipse'de mükemmel odak sistemi).
- Bir zaman aralığı ve timelapse uzunluğu seçerek ilgilenilen timelapse'ı tanımlayın. Bu çalışmada farklı amaçlar için farklı zaman aralıkları (5-20 dk) ve timelapse uzunlukları (4-24 saat) kullanılmıştır.
- TFM amaçları için, timelapse görüntülemeden sonra, ultra saf suya birkaç damla %5 SDS ekleyerek büyüyen hücreleri çıkarın ve birkaç dakika bekleyin. Seçilen her konum için, referans görüntü olarak floresan işaretleyicilerin rahat bir durumunu elde etmek için PAA substratındaki floresan işaretleyicilerin bir z-yığınını (2 μm'lik bir z-yüksekliği 0.2 μm'lik bir adım boyutuyla tanımlanmıştır) alın.
NOT: Hücreler floresan işaretleyicileri z yönünde çekebileceği veya itebileceği için Z yığını görüntüleme gerçekleştirilir.
8. Çekiş kuvveti mikroskobu analizi
- Hassas analiz için zaman atlamalı görüntüleri en iyi referans görüntüye göre hizalayın ve kırpın.
- PAA hidrojelindeki floresan işaretleyicilerin yer değiştirmelerini ölçmek için, özelleştirilmiş MatLab kodlarını kullanarak herhangi bir timelapse görüntü ile referans görüntü arasında Parçacık Görüntü Velosimetrisi (PIV) gerçekleştirin. PIV analizinde, görüntüleri 0,5 örtüşme ile 32 x 32 piksellik sorgulama pencerelerine bölün.
- Boussinesq denklemi27'yi kullanarak sonlu bir jel kalınlığına sahip sonsuz bir jelin Fourier dönüşümü tabanlı çekiş mikroskobu ile floresan belirteçlerin yer değiştirmelerinden çekiş kuvvetlerini hesaplayın.
Sonuçlar
Açıklanan protokol aracılığıyla, ince bir kollajen tip I jel tabakası ile kaplanmış bir 2D PAA hidrojelin üzerine bir domuz karotis arterinden ex vivo filizlenme anjiyogenezi indükleyebiliriz, böylece 2.5D ex vivo filizlenme anjiyogenez modeli oluşturabiliriz. Bu model, konvansiyonel TFM'yi gerçekleştirmemize ve PAA jel arayüzü üzerinde uzay ve zamanda filizlenen anjiyogenezin hücresel çekiş kuvvetlerini ölçmemize olanak tanır.
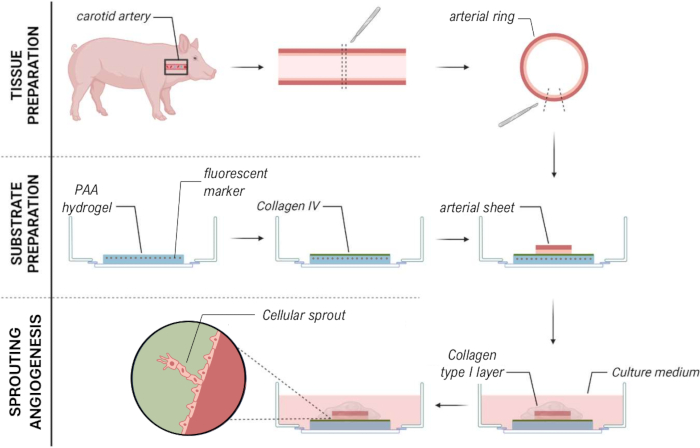
2.5D modelini oluşturmak için önce floresan işaretleyicilerle gömülü bir 2D poliakrilamid (PAA) hidrojel hazırladık, ardından gece boyunca tip IV kollajen (d-1 ila d0) ile kapladık. 0. günde (d0), kollajen IV kaplı hidrojel üzerine bir karotis arteriyel tabaka yerleştirildi ve gece boyunca bağlanmasına izin verildi (d0 ila d1). Daha sonra, arteriyel tabaka üzerine ince bir kollajen tip I jel tabakası uygulandı, ardından hücresel filizlenmeyi izlemek ve mekanik analiz için floresan belirteçleri izlemek (d1 ila d2) için 1. günde (d1) görüntüleme başlatıldı. 2.5D modelinde filizlenme anjiyogenezini doğrulamak için, paralel olarak bir 3D kollajen tip I jelde geleneksel ex vivo filizlenme anjiyogenezini gerçekleştirdik. Bunun için ince bir kollajen tip I jel tabakası hazırlandı, ardından karotis arter tabakasının tohumlanması ve ardından ek bir kollajen tabakası (d0) ile kaplandı. Anjiyojenik filizlenme zamanla izlendi. Ek olarak, model karmaşıklığını daha da azaltmak için 2D'de filizlenme anjiyogenezi indüklemeye çalıştık. Deneysel prosedür, 2.5D modelininkini yansıtıyordu, temel fark, üst kollajen tip I jel tabakasının dışlanmasıydı. Deneysel prosedürleri de dahil olmak üzere üç modele genel bir bakış Şekil 1'de açıklanmaktadır. Karotis arterler, yerel mezbahadan alınan domuzlardan toplandı ve steril taze Krebs çözeltisi içinde taşındı. Biyogüvenlik kabini içinde, canlı timelapse görüntüleme sırasında filizlenme anjiyogenezinde görsel bir bozulma olmamasını sağlamak için karotis arteri çevreleyen fazla doku çıkarıldı (Şekil 2A-E). Arter fazla dokudan temizlendikten sonra, arter 2 mm genişliğinde arter halkaları halinde kesildi ve halkalar 2 x 2 mm boyutlarında arteriyel tabakalar halinde kesildi (Şekil 2F).
2.5D ve 2D modeldeki PAA hidrojel arayüzünün üstünde filizlenme anjiyogenezini sağlamak için, arteriyel tabakaları, iç endotel hücre tarafı kollajen tip IV kaplı PAA hidrojele bakacak şekilde tohumladık ve onları yapışmaya bıraktık. Arteriyel tabakanın PAA hidrojele bağlanmasını optimize etmek için, arteriyel tabakanın üzerine kirlenme önleyici kaplamalı 12 mm'lik bir cam lamel eklenmesinin etkisini test ettik. 24 saat sonra, lamel çıkarıldı ve bağlantı verimliliği, PAA hidrojele bağlı arteriyel tabakaların yüzdesi vasıtasıyla ölçüldü. Kirlenme önleyici kaplamadan bağımsız olarak bir cam lamel ilavesinin, lamel olmamasına kıyasla PAA hidrojelin üzerine arteriyel tabakaların bağlanma verimliliğini artırdığını gözlemledik (Şekil 3A-D). Daha sonra, cam lamel çapının (12 veya 13 mm) arteriyel tabakanın bağlantı verimliliği üzerindeki etkisini test ettik, plakanın iç kuyusu ise 14 mm idi. 13 mm'lik bir lamel PAA hidrojel üzerindeki arteriyel tabakaların tutturma verimliliğini 12 mm'lik bir lamel ile karşılaştırıldığında arttırdığını gözlemledik (Şekil 3E-G), çünkü lamel çıkarma sırasında kesme kuvvetleri en aza indirilmiştir. Hem 2.5D hem de 2D modellerde PAA hidrojele arteriyel tabaka tutturmak için işlenmemiş 13 mm'lik bir lamel kullanmaya devam ettik.
Arteriyel tabaka PAA hidrojele bağlandıktan sonra, 2.5D bir ortam oluşturmak için arteriyel tabakanın üzerine ince bir kollajen tip I jel tabakası ekledik. Numuneleri 5 gün boyunca kültürledik ve numuneleri filizlenme anjiyogenezi açısından inceledik. Literatürde daha önce bildirilen ex vivo filizlenme anjiyogenezi ile tutarlı olarak 3D modelde (Şekil 4A) hücresel filizlerin oluşumunu gözlemledik 28,29,30. 2.5D modelinde, 3D modele kıyasla benzer bir hücresel filiz organizasyonu gözlemledik (Şekil 4B). Hücresel filizler, PAA arayüzü de dahil olmak üzere birden fazla yükseklikte oluşturuldu (Video 1). Ek olarak, filizlenme anjiyogenez, 2.5D modelinde filizlenme sırasında gözlemlediğimiz bir fenomen olan lider ve takipçi hücrelerin yüksek proliferasyonu ile karakterize edilir (Video 2). Bir arteriyel tabakayı 2D olarak kültürlendirirken, farklı kökenlerden gelen hücreler (Ek Şekil 1) dokudan tek tabakalar olarak göç eder, böylece hücresel filizlerin organizasyonundan yoksundur (Şekil 4C). 2D modelde filizlenme anjiyogenezi gözlemlemediğimiz için, bu modeli sonraki analizlerden çıkardık. Toplamda, arteriyel tabaka, filizlenme anjiyogenezini indüklemek için yerel bir 3B ortama ihtiyaç duyar ve bu da filizlenme anjiyogenezinin 2.5D ex vivo modelinin potansiyelini gösterir.
Ayrıca, 2.5D model sistemi, kullanıcıların hücresel mikro ortamdan gelen mekanik ipuçlarının, örneğin matris sertliğinin etkisini incelemesine olanak tanıyan çok yönlü bir sistemdir. Bir 3D kollajen tip I hidrojelin matris sertliği - ex vivo filizlenme anjiyogenezi için yaygın olarak kullanılan hidrojel - ECM proteininin konsantrasyonuna bağlıdır, burada protein konsantrasyonundaki bir artış, matris sertliğindeki bir artışla ilişkilidir32. Bu 3D hidrojelin filizlenme anjiyogenezini indüklemesini sağlamak için tipik kollajen tip I konsantrasyon aralığı 1-4 mg / mL'dir ve 1 Pa ila 1 kPa 32,33,34'lük bir matris sertliğine karşılık gelir. Daha düşük konsantrasyonlar yapısal destek sağlamak için çok yumuşak olabilirken, daha yüksek konsantrasyonlar hücre hareketini engelleyebilir. Endotel dokusunun fizyolojik sertliği 1 kPa35'tir ve bu, bir 3D kollajen tip I hidrojel ile taklit edilebilir. Bununla birlikte, tümör oluşumu ve ilerlemesi doku sertleşmesi4 ile ilişkilidir, bu nedenle tümör anjiyogenezini incelemek için daha yüksek bir matris sertliği elde edebilen bir modele olan ihtiyacı vurgulamaktadır. PAA hidrojellerinin substrat sertliği - arteriyel tabakanın endotel hücreleri tarafından algılanan sertlik - 1 ila onlarca kPa aralığında kolayca ayarlanabilir. Burada, PAA substrat sertliğinin, kollajen tip I tabakasının eklenmesinden sonraki gün hücresel filiz oluşumunu başlatan örneklerin yüzdesi aracılığıyla filizlenme anjiyogenezinin başlangıcı üzerindeki etkisini inceledik. Patolojik sert (12 kPa) PAA hidrojele kıyasla fizyolojik yumuşak (1 kPa) PAA hidrojel üzerinde kültürlendiğinde daha fazla arteriyel tabakanın hücresel filizlerin erken belirtilerini gösterdiğini gözlemledik (Şekil 5), bu modelin matris sertliğinin filizlenme anjiyogenezi üzerindeki etkisini inceleme potansiyelini gösterdi. Ayarlanabilir substrat sertliğine ek olarak, bu substratlar, diğer mekanik ipuçlarının (örneğin, matris bileşimi ve yoğunluğu) yanı sıra kimyasal ipuçlarının (örneğin, kültür ortamının koşullandırılmasıyla moleküler düzenleyicilerin inhibisyonu) sistematik modülasyonuna izin verir, bu da bu 2.5D ex vivo filizlenme anjiyogenez modelinin çok yönlülüğünü gösterir.
Filizlenme anjiyogenezindeki hücresel mekaniği ölçmek için, 2D PAA arayüzünde oluşan hücresel filizler üzerinde geleneksel Çekiş Kuvveti Mikroskobu (TFM) gerçekleştirdik. Kollajen tip I tabakasının eklenmesinden bir gün sonra, hücrelerin (Şekil 6A) ve PAA hidrojeline gömülü floresan belirteçlerin canlı hücre görüntülemesini gerçekleştirdik. Floresan belirteçlerin yer değiştirmeleri, Parçacık Görüntü Velosimetrisi (Şekil 6B) kullanılarak ölçüldü ve hücresel traksiyonlar, PAA hidrojelin mekanik özellikleri kullanılarak hesaplandı (Şekil 6C). Bu 2.5D ex vivo modelle, başlangıçta bir hücresel filizin lider hücresinin çıkıntılarında çekme kuvvetlerini ve ardından hücresel filiz boyunca itme kuvvetlerini gözlemledik - hem lider hücrenin arkasında hem de takip eden hücrelerde (Şekil 6C).
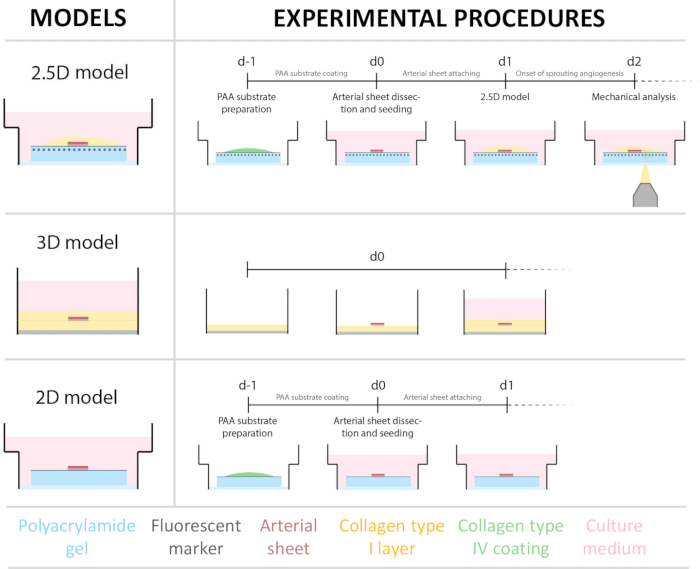
Şekil 1: Deneysel modeller ve prosedürler. (solda) Deneysel modeller test edildi. 2.5D modeli, düz bir kollajen tip IV kaplı poliakrilamid (PAA) hidrojelin üzerine yerleştirilen ve ince bir kollajen tip I hidrojel tabakası ile kaplanmış bir arteriyel tabakayı temsil eder. 3D model, filizlenme anjiyogenezi36 indüklediği bilinen bir sistem olan iki kollajen tip I jel tabakası arasına sıkıştırılmış bir arteriyel tabakayı temsil eder. 2D model, düz bir kollajen tip IV kaplı PAA hidrojelin üzerine yerleştirilmiş bir arteriyel tabakayı temsil eder. (sağda) Karşılık gelen modeller için deneysel prosedürler. Hem 2D hem de 2.5D modeller için, tohumlamadan bir gün önce bir PAA hidrojel hazırlandı (d-1) ve gece boyunca kollajen tip IV kaplama yapıldı. Karotis arter domuzlardan toplandı, arteriyel tabakalara diseke edildi, 0. günde (d0) hidrojelin üzerine ekildi ve gece boyunca bağlanmaya bırakıldı (d1). 2.5D numuneler için, arteriyel tabakanın üzerine ince bir kollajen tip I jel tabakası yerleştirildi. Mekanik analiz, 2. günde filizlenmenin başlamasından sonra yapıldı (d2). 2D numuneler için, ortam 1. günde (d1) yenilendi. 3D model için, 0. günde (d0) tohumlamadan hemen önce bir kollajen tip I jel tabakası hazırlandı. Arteriyel tabaka, kollajen tip I tabakasının üzerine ekildi ve ikinci bir kollajen tip I tabakası ile kaplandı. Bu rakamın daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
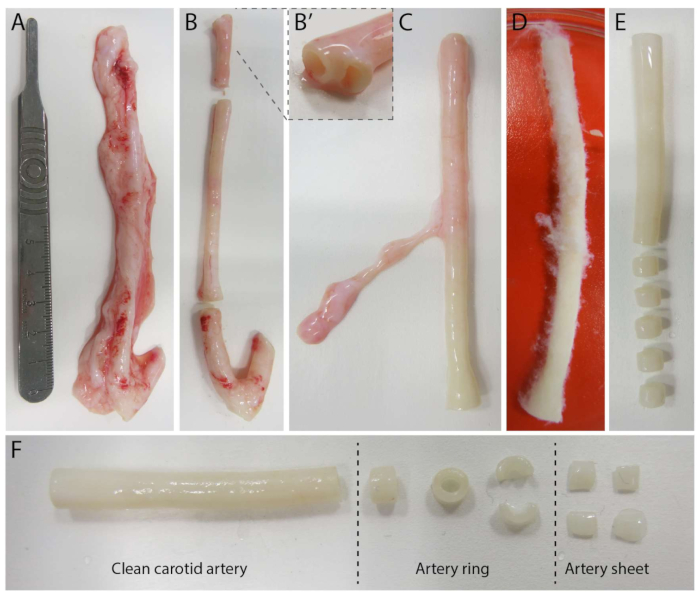
Şekil 2: Karotis arter diseksiyon basamakları (d0). (A) Yaklaşık 10 cm uzunluğundaki karotis arterler, yerel mezbahadan alınan domuzlardan toplanmıştır. (B) Fazla doku ve kenarın yaklaşık 2 cm'si (dallanma noktalarına çok yakın olmamak için (B') atıldı. (C-E) Karotis arterin derisi yüzüldü (C), PBS'ye batırıldı (D) ve görüntüleme sırasında net görünürlük sağlamak için kalan tüm doku derisi yüzüldü (E). (F) Temiz karotis arter, yaklaşık 2 mm genişliğinde arter halkaları halinde dilimlenir. Her halka, yaklaşık 2 x 2 mm boyutlarında 4 arteriyel tabaka halinde kesilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
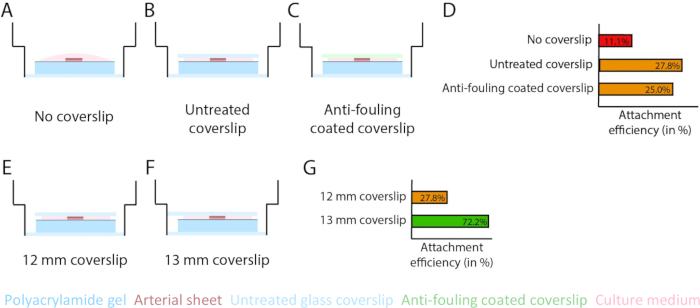
Şekil 3: 13 mm'lik bir cam lamel (d1) kullanılarak arteriyel tabaka bağlantı verimliliği artar. (AD) Bir cam lamellerin arteriyel tabakanın poliakrilamid (PAA) hidrojeline bağlanması üzerindeki etkisi. Pluronic F127 (C) kullanılarak cam lamel (A), işlenmemiş cam lamel (B) ve kirlenme önleyici kaplamalı cam lamel arasında bir karşılaştırma yapılmıştır. Bağlantı verimliliği, toplam numune sayısına kıyasla lamel çıkarıldıktan sonra PAA hidrojele bağlanan arteriyel tabakaların sayısı ile ölçüldü: lamel yok (36'da 4), işlenmemiş lamel (36'da 10) ve kirlenme önleyici kaplamalı lamel (36'da 9; D). (EG) İşlenmemiş bir cam lamel boyutunun, arteriyel tabakanın PAA hidrojele bağlanması üzerindeki etkisi. 14 mm'lik bir kuyu içinde işlenmemiş 12 mm'lik bir cam lamel (E) ile işlenmemiş 13 mm'lik cam lamel (F) arasında bir karşılaştırma yapılmıştır. Bağlantı verimliliği, toplam numune sayısına kıyasla lamel çıkarıldıktan sonra PAA hidrojele bağlı arteriyel tabakaların sayısı ile ölçüldü: 12 mm lamel (36'da 10) ve 13 mm lamel (72'de 52; G). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
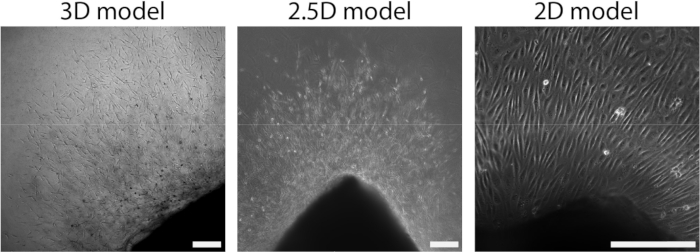
Şekil 4: Modelin boyutluluğu, hücresel büyüme (d2+) sırasındaki organizasyonu tanımlar. Hücreler, 2.5B modele (ortada) benzer şekilde, 3B modelde (solda) bir filiz organizasyonunda dokudan dışarı çıkar. Hücreler, 2B kurulumda (sağda) tek katmanlı bir organizasyonda dokudan dışarı çıkar. Ölçek çubuğu 250 μm'yi temsil eder. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 5: 2.5D modelde endotel filizlenmesinin başlangıcı, poliakrilamid hidrojel substrat sertliğine (d2) bağlıdır. (A-B) Protokolün 2. gününde (tabaka kollajen tip I jelinin eklenmesinden 1 gün sonra) yumuşak (A; 1 kPa) veya sert (B; 12 kPa) poliakrilamid (PAA) hidrojel üzerine ince bir kollajen tip I jel tabakası ile kaplanmış arteriyel tabaka. (C) Filizlenme başlangıcı, toplam numune sayısına kıyasla zaten hücresel büyüme belirtileri gösteren arteriyel tabakaların sayısı ile ölçüldü: yumuşak (24'ten 7'si) ve sert (24'ten 3'ü). Ölçek çubuğu 1 mm (A, B) veya 500 μm'yi (A', B') temsil eder. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 6: Erken filizlenme anjiyogenezi sırasında çekiş kuvveti karakterizasyonu. Hücrelerin zamanında görüntülenmesi (0-4 saat) en üst satırda görüntülenir. 0 kPa PAA hidrojel substrat üzerindeki karşılık gelen floresan işaretleyici yer değiştirmeleri (2 μm) ve hücresel traksiyonlar (0-50 Pa) sırasıyla orta ve alt sırada görüntülenir. 0 saat, 2 saat ve 4 saat'teki hücresel çekişlerin yakınlaştırmaları turuncu renkte görüntülenir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Şekil 7: Hücresel filizlerin mekanik karakterizasyonuna izin veren 2.5D ex vivo filizlenme anjiyogenez modeli yöntemi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| 1 kPa | 12 kPa | |
| PBS | 435 μL | 373,7 μL |
| % 40 akrilamid | 50 μL | 93,8 μL |
| % 2 bis-akrilamid | 7,5 μL | 25 μL |
| Floresan işaretleyici (koyu kırmızı) | 5 μL | 5 μL |
| %10 APS | 2,5 μL | 2,5 μL |
| TEMED (TEMED) | 0,25 μL | 0,25 μL |
Tablo 1: PAA jel karışım oranları.
| formül | 12 oyuklu plaka başına hacim (130 μL) | |
| EKG ortamı | VEKG = Vfinal-V sütun1-V NaOH | 82,16 μL |
| Kollajen tip I | Vsütun1=(Vfinal*Cfinal)/Cstoğu | 46 μL |
| NaOH (NanoOH) | VNaOH = 0.04 * Vsütun1 | 1,84 μL |
Tablo 2: Kollajen tip I jel, hacim (V) ve konsantrasyon (C) kısaltmalarını kullanarak hacimleri karıştırır.
Video 1: 2.5D modelinde hücresel filiz oluşumunun timelapse görüntülemesi. Hücreler, 17.5 dakikalık bir zaman aralığı ile 22 saatlik bir zaman periyodu boyunca Faz Kontrast görüntüleme kullanılarak görüntülendi. Hücresel filizler, farklı odak düzlemleri tarafından gözlemlendiği gibi, kollajen tip I jel tabakası içinde birden fazla yükseklikte oluşturulmuştur. Ölçek çubuğu 100 μm'yi temsil eder. Bu videoyu indirmek için lütfen buraya tıklayın.
Video 2: 2.5D modelinde hücresel filizler içindeki hücrelerin yüksek çoğalma hızı. Hücreler, 17.5 dakikalık bir zaman aralığı ile 22 saatlik bir süre boyunca Faz Kontrast görüntüleme kullanılarak görüntülendi. Timelapse görüntüleme sırasında hem liderler hem de takipçi hücreleri çoğalır. Ölçek çubuğu 100 μm'yi temsil eder. Bu videoyu indirmek için lütfen buraya tıklayın.
Ek Şekil 1: İmmünofloresan boyama ile 2D modelde (d2+) hücresel fenotip. (A) Hücre çekirdeğinin (DAPI), endotel hücre markörünün (CD31) ve fibroblast markörünün (alfa-düz kas aktini; α-SMA) immünofloresan (IF) boyanması. (B) Hücre çekirdeğinin (DAPI), endotel hücre markörünün (CD31) ve düz kas hücresi markörünün (kalponin) IF boyanması. Ölçek çubuğu 100 μm'yi temsil eder. Bu rakamı indirmek için lütfen buraya tıklayın.
Ek Dosya 1: İmmünofloresan boyama protokolü. Bu dosyayı indirmek için lütfen buraya tıklayın.
Tartışmalar
Filizlenme anjiyogenezi - yeni kan damarlarının oluşumu - hem moleküler hem de mekanik mekanizmalar tarafından düzenlenen karmaşık bir süreçtir. Filizlenme anjiyogenezinin moleküler itici güçlerini (örneğin, VEGF ve Çentik sinyali) incelemek için son on yılda birçok 3D model geliştirilmiş olsa da, model sınırlamaları nedeniyle hücresel mekanik hakkında çok az şey bilinmektedir. Çekiş Kuvveti Mikroskobu (TFM), 2D substrat deformasyonlarının hücresel traksiyonlara dönüştürüldüğü, uzay ve zamandaki hücresel kuvvetlerin nicelleştirilmesi için iyi bilinen bir tekniktir. Bu nedenle, bu protokolde, 2.5D ex vivo bir model tanımlıyoruz, yani filizlenme anjiyogenezi sırasında çekiş kuvvetlerinin ölçülmesine izin veren bir 2D modelin basitliğini korurken hücrelere yerel olarak 3D bir ortam sağlıyoruz (Şekil 1). Bunu yapmak için, bir domuz arteriyel tabakası hazırladık ve tohumladık (endotel tarafı aşağı; Şekil 2) floresan belirteçler içeren kollajen tip IV kaplı poliakrilamid (PAA) hidrojelin üstünde. Arteriyel tabakanın 13 mm'lik bir cam lamel kullanılarak tutturulmasından sonra (Şekil 3), hücresel filizlerin oluşumuna izin veren ince bir kollajen tip I hidrojel tabakası ekliyoruz (Şekil 4). Bu modeli kullanarak, 22,23,24,25 hücresel filizlenme sırasında lider hücrelerin çekme kuvveti uyguladığını (literatür 19,20,21,22'de gözlemlendiği gibi), ancak aynı zamanda takipçi hücrelerin itme kuvveti uyguladığını da gösteriyoruz (Şekil 6). Protokolümüz aracılığıyla elde edilen çekiş alanının çözünürlüğü, uyumlu substratlar üzerinde çekiş kuvveti mikroskobuna başvuran işlerin tipik özelliği olan hem zaman hem de uzayda hücresel kinematik ve dinamiklerin kantitatif analizlerine izin verir 37,38,39.
Ayrıca, mikroçevrenin mekanik ipuçlarını değiştirerek bu 2.5D ex vivo filizlenme anjiyogenez modelinin çok yönlülüğünü gösteriyoruz (Şekil 5). Filizlenme anjiyogenezi normalde 1 kPa35'lik bir fizyolojik sertlikte meydana gelirken - bu bir 3D kollajen tip I hidrojel tarafından taklit edilebilirken, tümör anjiyogenezi sertleştirilmiş bir mikro çevrede(40 ) meydana gelir - bu da geleneksel 3D kollajen tip I hidrojellerin sertlik aralığının ötesindedir. PAA alt tabaka sertliği, daha yüksek bir alt tabaka sertliği oluşturmak için çapraz bağlayıcıların oranı değiştirilerek kolayca ayarlanabilir. Bu modeli kullanarak, filizlenme anjiyogenezinin başlangıcının sertliğe bağlı olduğunu ortaya koyuyoruz. Bu substratlar sadece ayarlanabilir sertlik sunmakla kalmaz, aynı zamanda matris bileşimi ve yoğunluk gibi diğer çeşitli mekanik ipuçlarının sistematik modülasyonunu da mümkün kılar. Ek olarak, bu model, filizlenme anjiyogenezinin mekanobiyolojik mekanizmalarını anlamak için ortamın koşullandırılmasını (örneğin, Notch sinyalizasyonu üzerindeki inhibisyonun hücresel mekanik üzerindeki etkisi) kullanarak moleküler düzenleyicileri manipüle ederken hücresel mekaniği incelememize izin verir. Bu, bu 2.5D ex vivo filizlenme anjiyogenez modelinin farklı mikro ortamların bir örneğinde faydasını göstermektedir.
Sunduğumuz model, 3D (viskoelastik) TFM'ye kıyasla daha basit analiz, daha yüksek uzamsal çözünürlük ve daha kolay uygulama sunan geleneksel 2D TFM'yi kullanarak daha erişilebilir ve uygun maliyetli hale getiriyor26,41. Bununla birlikte, 3D (viskoelastik) TFM, her üç boyutta da çekiş kuvvetlerini yakalayarak ve hücre dışı matrisin karmaşık mekanik özelliklerini hesaba katarak fizyolojik olarak daha ilgili bir ortam sağlar ve daha gerçekçi bir bağlamda hücre davranışına ilişkin daha derin içgörüler sunar 42,43,44,45. Boyutluluğun bu etkisi aynı zamanda bu 2.5D modelinin bir sınırlamasına da işaret ediyor. Hücrelerin 2B bir alt tabaka üzerinde göç ettiği varsayımıyla 2B TFM kullanıyoruz. Bu 2.5D modelde durum böyle iken, hücreler lokal bir 3D ortamdadır ve bu nedenle kollajen tip I jel tabakasına yapışır ve bu jel tabakasına kuvvetler uygular. Bu analizde benimsediğimiz varsayım, kollajen tip I jel tabakasının, matris sertliğindeki büyüklük sırası farkından dolayı PAA arayüzüne mekanik olarak bağlanmadığı (bu iki hidrojel arasında kuvvet iletimi olmadığı), bu nedenle hücresel kuvvetlerin kollajen tip I tabakası üzerindeki etkisini en aza indirgediğidir. Bu, 2.5D ex vivo modeli kullanarak kuvvet karakterizasyonunu, hücreler tarafından üretilen kuvvetlerin basitleştirilmiş bir temsili haline getirir. Ek olarak, bu protokol hassasiyet gerektirir ve numunelerin kaybolabileceği birkaç adımla kapsamlıdır, örneğin (i) arteriyel tabakayı çevreleyen aşırı dokuya bağlı hücre görünürlük zorlukları (Şekil 2), (ii) üç numuneden biri PAA substratına yapışmaz (Şekil 3), (iii) tüm numuneler hücresel filizlerin oluşumunu başlatmaz (Şekil 5), (iv) PAA substratında hücresel filizler oluşmaz ve (v) düşük sertlikte PAA hidrojelin üzerinde kalın arteriyel tabaka kullanıldığında odak dışı floresan işaretleyiciler. Bu nedenle, filizlenme anjiyogenezinin mekanik analizini gerçekleştirmek için bol miktarda ilgi alanı sağlamak için bu yöntemi 12 oyuklu bir plaka için optimize ettik.
Sonuç olarak, bir 2.5D model (Şekil 7) kullanılarak canlı bir domuz arteriyel tabakasının filizlenme anjiyogenezinin hücresel çekiş kuvvetlerinin basitleştirilmiş karakterizasyonu için sunulan yaklaşım, doğal doku bağlamında anjiyogenez sırasındaki mekanik etkileşimler hakkında daha doğru ve gerçek zamanlı içgörüler oluşturmaya yardımcı olabilir, tam 3D sistemlere kıyasla daha az karmaşıklık ve daha iyi tekrarlanabilirlik ile dinamik hücresel süreçlerin incelenmesini kolaylaştırır. Bu, 2D yöntemlerin analitik basitliğini korurken, hücrelerin fizyolojik olarak daha ilgili bir ortamda mekanik ipuçlarına nasıl tepki verdiğine dair anlayışımızı geliştirebilir. Bu bilgi, kan damarları oluşturmak amacıyla doku mühendisliği alanını ilerletebilir, aynı zamanda tümör büyümesini sınırlamak ve metastazı azaltmak amacıyla tümör anjiyogenezinin önlenmesi için terapötik ilaçlar bulabilir.
Açıklamalar
Yazarların açıklanacak herhangi bir çıkar çatışması yoktur.
Teşekkürler
Domuz karotis arterlerini yerel mezbahadan hasat ettikleri ve taşıdıkları için LifeTec çalışanlarına teşekkür ederiz; Leon Hermans, Pim van den Bersselaar ve Adrià Villacrosa Ribas (TU/e, ICMS) deneysel prosedürler ve mekanik karakterizasyon analizi üzerine verimli tartışmalar için. Avrupa Araştırma Konseyi (771168), Hollanda Bilimsel Araştırma Örgütü (024.003.013), Finlandiya Akademisi (307133, 316882, 330411 ve 337531) ve Åbo Akademi Üniversitesi Vakfı'nın Hücresel Mekanostaz Mükemmeliyet Merkezleri (CellMech) tarafından sağlanan hibelerin desteğini minnetle kabul ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 2% bis-acrylamide | Bio-Rad | 1610143 | |
| 2-mercaptoethanol | Merck Life Science | 60-24-2 | |
| 3-(Trimethoxysilyl)propyl methacrylate | Bind-Silane | Sigma-Aldrich | 440159-100ML |
| 40% acrylamide | Bio-Rad | 1610140 | |
| Aboslute ethanol (for analysis) | VWR International | 1.00983.1000 | |
| Absolute ethanol (industrial) | VWR International | 83813.41 | |
| Acetic acid, glacial 100% | Merck | 1000562500 | |
| Ammonium persulfate | APS | Bio-Rad | 7727-54-0 |
| antibody (primary) - calponin | abcam | ab46794 | |
| antibody (primary) - CD31 | Serotec | MCA1746 | |
| antibody (primary) - α-smooth muscle actin | αSMA | Dako | M0851 |
| antibody (secondary) - goat-anti-mouse-IgG1 Alexa 488 | Molecular Probes | A21121 | |
| antibody (secondary) - goat-anti-mouse-IgG2a Alexa 555 | Molecular Probes | A21137 | |
| antibody (secondary) - goat-anti-rabbit-IgG Alexa 555 | Molecular Probes | A21428 | |
| Autoclave | Astell | ||
| Calcium chloride dihydrate | CaCl2 | Calbiochem | 208291-250GM |
| Collagen type I, rat-tail | Corning | 354236 | |
| Collagen type IV, human placenta | Merck Life Science | C5533-5MG | |
| Endothelial Cell Growth Medium | ECG medium | Promocell | C-22111 |
| Expoxy-coated round tip tweezer | fine tweezer | Rubis Pinzette | E78144-2A |
| Fluorescent marker, dark red | Invitrogen | F8807 | |
| Glass coverslips, Ø13 mm, #1 | Epredia | CB00130RA120MNZ0 | |
| Glass coverslips, Ø13 mm, #1.5 | Epredia | CB00120RAC20MNZ0 | |
| Hydrochloride acid, 25% | HCl | Merck | 1.100316.1000 |
| Krebs-Henseleit buffer | Sigma-Aldrich | K3753 | |
| Microscope, Leica Application Suite X software, version 3.5.7.23225 | Leica Microsystems | ||
| Microscope, Leica DMi8 epifluorescent microscope | Leica Microsystems | ||
| Microscope, Nikon Ti2 Eclipse | Nikon | ||
| Microscope, NIS-Elements AR software | Nikon | ||
| N,N,N',N'-tetramethylethane-1,2-diamine | TEMED | Merck Life Science | 110-18-9 |
| Nalgene bottle | Thermo Scientific | 2187-0016 | |
| Needle, 21Gx1" | Henke Sass Wolf | HK4710008025 | |
| Normal serum, goat | Gibco | 10098792 | |
| Papaverine hydrochloride | Sigma | 61-25-6 | |
| Penicillin/Streptomyocin (10 000 U/mL) | P/S | Gibco | 15140163 |
| Petri-dish, large (145x20mm) | Greiner Bio-one | 639160 | |
| Petri-dish, small (60x15mm) | Greiner Bio-one | 628160 | |
| Phosphate Buffered Saline | PBS | Sigma | P4417 |
| Pluronic F-127 | Merck Life Science | P2443-250G | |
| Puncture needle, sharp closed tip | unknown | ||
| Scalpel, no. 4 | Swann-Morton | ||
| Sodium hydrogen carbonate | NaHCO3 | VWR International | 144-55-8 |
| sulfosuccinimidyl 6-(4'-azido-2'-nitrophenylamino)hexanoate | Sulfo-SANPAH | Thermo Scientific | 22589 |
| Surgical blade, no. 20 | Swann-Morton | ||
| Surgical drape sheet | Foliodrape | 2775001 | |
| Surgical tweezer | Lettix | 400024 | |
| Triton X-100 | Merck | 9036-19-5 | |
| UV lamp | Analytik Jena | 95-0042-13 | |
| well plate, 96-well, F-bottom | Greiner Bio-one | 655180 | |
| well plate, glass bottom 12-well | MatTek | P12G-0-14-F |
Referanslar
- Carmeliet, P. Angiogenesis in health and disease. Nat Med. 9 (6), 653-660 (2003).
- Folkman, J. Angiogenesis in cancer, vascular, rheumatoid and other disease. Nat Med. 1, 27-30 (1995).
- Kretschmer, M., Rüdiger, D., Zahler, S. Mechanical aspects of angiogenesis. Cancers. 13 (19), 4987 (2021).
- Bordeleau, F., et al. Matrix stiffening promotes a tumor vasculature phenotype. Proc Natl Acad Sci U S A. 114 (3), 492-497 (2017).
- Blanco, R., Gerhardt, H. VEGF and Notch in tip and stalk cell selection. Cold Spring Harb Perspect Med. 3 (1), a006569 (2013).
- Adams, R. H., Alitalo, K. Molecular regulation of angiogenesis and lymphangiogenesis. Nat Rev Mol Cell Biol. 8, 464-478 (2007).
- Carmeliet, P., De Smet, F., Loges, S., Mazzone, M. Branching morphogenesis and antiangiogenesis candidates: tip cells lead the way. Nat Rev Clin Oncol. 6, 315-326 (2009).
- Salam, N., et al. Assessment of migration of human mscs through fibrin hydrogels as a tool for formulation optimisation. Materials. 11 (9), 1781 (2018).
- Solbu, A. A., et al. Assessing cell migration in hydrogels: An overview of relevant materials and methods. Materials Today Bio. 18, 100537 (2023).
- Cao, W., Li, X., Zuo, X., Gao, C. Migration of endothelial cells into photo-responsive hydrogels with tunable modulus under the presence of pro-inflammatory macrophages. Regenerat Biomater. 6 (5), 259-267 (2019).
- Staton, C. A., Reed, M. W. R., Brown, N. J. A critical analysis of current in vitro and in vivo angiogenesis assays. Int J Exp Pathol. 90 (3), 195-221 (2009).
- Staton, C. A., et al. Current methods for assaying angiogenesis in vitro and in vivo. Int J Exp Path. 85, 233-248 (2004).
- Ngo, T. X., et al. In Vitro models for angiogenesis research: A review. Int J Tissue Regenerat. 5, 37-45 (2014).
- Tomita, Y., et al. An ex vivo choroid sprouting assay of ocular microvascular angiogenesis. J Vis Exp. (162), e61677 (2020).
- Kapoor, A., Chen, C. G., Iozzo, R. V. A simplified aortic ring assay: A useful ex vivo method to assess biochemical and functional parameters of angiogenesis. Matrix Biol Plus. 6-7, 100025 (2020).
- Stiffey-Wilusz, J., Boice, J. A., Ronan, J., Fletcher, A. M., Anderson, M. S. An ex vivo angiogenesis assay utilizing commercial porcine carotid artery: Modification of the rat aortic ring assay. Angiogenesis. 4 (1), 3-9 (2001).
- Kniazeva, E., Putnam, A. J. Endothelial cell traction and ECM density influence both capillary morphogenesis and maintenance in 3-D. Am J Physiol Cell Physiol. 297 (1), C179-C187 (2009).
- Davidson, C. D., Wang, W. Y., Zaimi, I., Jayco, D. K. P., Baker, B. M. Cell force-mediated matrix reorganization underlies multicellular network assembly. Sc Rep. 9 (1), 12 (2019).
- Lyle, K. S., Corleto, J. A., Wittmann, T. Microtubule dynamics regulation contributes to endothelial morphogenesis. BioArchitecture. 2 (6), 220-227 (2012).
- Kniazeva, E., et al. Quantification of local matrix deformations and mechanical properties during capillary morphogenesis in 3D. Integrat Biol. 4 (4), 431-439 (2012).
- Quintanilla, M. A., Hammer, J. A., Beach, J. R. Non-muscle myosin 2 at a glance. J Cell Sci. 136 (5), jcs.260890 (2023).
- Fischer, R. S., Gardel, M., Ma, X., Adelstein, R. S., Waterman, C. M. Local cortical tension by myosin II guides 3D endothelial cell branching. Curr Biol. 19 (3), 260-265 (2009).
- Yoon, C., et al. Myosin IIA–mediated forces regulate multicellular integrity during vascular sprouting. Mol Biol Cell. 30 (16), 1974-1984 (2019).
- Du, Y., et al. Three-dimensional characterization of mechanical interactions between endothelial cells and extracellular matrix during angiogenic sprouting. Sci Rep. 6, 21362 (2016).
- Vaeyens, M. M., et al. Matrix deformations around angiogenic sprouts correlate to sprout dynamics and suggest pulling activity. Angiogenesis. 23 (3), 315-324 (2020).
- Style, R. W., et al. Traction force microscopy in physics and biology. Soft Matter. 10 (23), 4047-4055 (2014).
- Trepat, X., et al. Physical forces during collective cell migration. Nat Phys. 5 (6), 426-430 (2009).
- Santos-Oliveira, P., et al. The force at the tip - modelling tension and proliferation in sprouting angiogenesis. PLoS Comput Biol. 11 (8), e1004436 (2015).
- Boreddy, S. R., Sahu, R. P., Srivastava, S. K. Benzyl isothiocyanate suppresses pancreatic tumor angiogenesis and invasion by inhibiting HIF-α/VEGF/Rho-GTPases: Pivotal role of STAT-3. PLoS One. 6 (10), 0025799 (2011).
- Teng, R. J., Eis, A., Bakhutashvili, I., Arul, N., Konduri, G. G. Increased superoxide production contributes to the impaired angiogenesis of fetal pulmonary arteries with in utero pulmonary hypertension. Am J Physiol Lung Cell Mol Physiol. 297 (1), L184-L195 (2009).
- Costa, G., et al. Asymmetric division coordinates collective cell migration in angiogenesis. Nature Cell Biol. 18 (12), 1292-1301 (2016).
- Slater, K., Partridge, J., Nandivada, H. . Corning tuning the elastic moduli of Corning Matrigel and collagen I 3D matrices by varying the protein concentration. , (2019).
- Lee, J., et al. Effect of chain flexibility on cell adhesion: Semi-flexible model-based analysis of cell adhesion to hydrogels. Sci Rep. 9 (1), 2463 (2019).
- Motte, S., Kaufman, L. J. Strain stiffening in collagen i networks. Biopolymers. 99 (1), 35-46 (2013).
- Butcher, D. T., Alliston, T., Weaver, V. M. A tense situation: Forcing tumour progression. Nat Rev Cancer. 9 (2), 108-122 (2009).
- Artym, V. V., Matsumoto, K. Imaging cells in three-dimensional collagen matrix. Curr Prot Cell Biol. 10, Unit 10.18.1-Unit 10.18.20 (2010).
- Labernadie, A., et al. A mechanically active heterotypic E-cadherin/N-cadherin adhesion enables fibroblasts to drive cancer cell invasion. Nat Cell Biol. 19 (3), 224-237 (2017).
- Bazellières, E., et al. Control of cell-cell forces and collective cell dynamics by the intercellular adhesome. Nat Cell Biol. 17 (4), 409-420 (2015).
- Uroz, M., et al. Traction forces at the cytokinetic ring regulate cell division and polyploidy in the migrating zebrafish epicardium. Nat Mater. 18 (9), 1015-1023 (2019).
- Dong, C., Nastaran, Z., Konstantopoulos, K. . Biomechanics in oncology. , (2018).
- Schwarz, U. S., Soiné, J. R. D. Traction force microscopy on soft elastic substrates: A guide to recent computational advances. Biochim Biophys Acta. 1853 (11), 3095-3104 (2015).
- Toyjanova, J., et al. 3D Viscoelastic traction force microscopy. Soft Matter. 10 (40), 8095-8106 (2014).
- Legant, W. R., et al. Multidimensional traction force microscopy reveals out-of-plane rotational moments about focal adhesions. Proc Natl Acad Sci U S A. 110 (3), 881-886 (2013).
- Steinwachs, J., et al. Three-dimensional force microscopy of cells in biopolymer networks. Nat Meth. 13 (2), 171-176 (2016).
- Franck, C., Maskarinec, S. A., Tirrell, D. A., Ravichandran, G. Three-dimensional traction force microscopy: A new tool for quantifying cell-matrix interactions. PLoS One. 6 (3), e17833 (2011).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır