Method Article
Modelo 2.5D para la caracterización mecánica ex vivo de la angiogénesis germinal en tejido vivo
En este artículo
Resumen
La angiogénesis germinal, fundamental para el desarrollo y la enfermedad, implica procesos moleculares y mecánicos complejos. Presentamos un modelo ex vivo 2.5D versátil que analiza la germinación celular de las arterias carótidas porcinas, revelando la angiogénesis dependiente de la rigidez y la mecánica distintiva de las células líder-seguidoras. Este modelo ayuda a avanzar en las estrategias de ingeniería de tejidos y los enfoques de terapia contra el cáncer.
Resumen
La angiogénesis germinal es la formación de nuevos vasos sanguíneos a partir de la vasculatura preexistente y es de gran importancia para los procesos fisiológicos, como el crecimiento y la reparación de tejidos, y los procesos patológicos, como el cáncer y la metástasis. El proceso de varios pasos de la angiogénesis germinación es un proceso impulsado molecular y mecánicamente. Consiste en la inducción del brote celular por el factor de crecimiento endotelial vascular, la selección de células líderes/seguidoras a través de la señalización de Notch, la migración dirigida de las células endoteliales y la fusión y estabilización de los vasos. A lo largo de los años, se han desarrollado una variedad de modelos de angiogénesis de germinación para comprender mejor los mecanismos subyacentes de la germinación celular. A pesar de los avances en la comprensión de los impulsores moleculares de la angiogénesis germinal, el papel de las señales mecánicas y el impulsor mecánico de la angiogénesis germinación sigue siendo poco explorado debido a las limitaciones de los modelos existentes. En este estudio, diseñamos un modelo ex vivo 2.5D que nos permite caracterizar mecánicamente la brotación celular de una arteria carótida porcina utilizando microscopía de fuerza de tracción. El modelo identifica distintos patrones de fuerza dentro del brote, donde las células líderes ejercen fuerzas de tracción y las células seguidoras ejercen fuerzas de empuje sobre la matriz. La versatilidad del modelo permite la manipulación de señales químicas y mecánicas, como la rigidez de la matriz, lo que mejora su relevancia para diversos microentornos. Aquí, demostramos que el inicio de la angiogénesis germinal depende de la rigidez. El modelo 2.5D presentado para cuantificar las fuerzas de tracción celular en la angiogénesis germinal ofrece un método simplificado pero fisiológicamente relevante, que mejora nuestra comprensión de las respuestas celulares a las señales mecánicas, lo que podría avanzar en la ingeniería de tejidos y las estrategias terapéuticas contra la angiogénesis tumoral.
Introducción
La angiogénesis es el proceso de formación de nuevos vasos sanguíneos a partir de vasos sanguíneos preexistentes. Este proceso es esencial durante el desarrollo embrionario, la cicatrización de heridas y la progresión del cáncer, todos ellos asociados a cambios biomecánicos en el microambiente 1,2,3,4. Al inicio de la angiogénesis, los tejidos hipóxicos o lesionados liberan el factor de crecimiento endotelial vascular (VEGF) que activará las células endoteliales de los vasos sanguíneos vecinos para formar brotes endoteliales, donde se adoptan dos fenotipos líderes y seguidores distintos a través de la vía de señalización molecularNotch 5. Tras la formación de brotes endoteliales, un fenómeno conocido como angiogénesis germinal, las células líderes degradarán la matriz extracelular circundante para migrar colectivamente hacia el estímulo del VEGF sin perder las adherencias célula-célula con las células seguidorasposteriores 6,7.
En las últimas décadas, se ha descrito un número cada vez mayor de ensayos de angiogénesis germinal que investigan la migración celular colectiva a través de diversas metodologías, cada una de las cuales ofrece ventajas y limitaciones distintas. Estos ensayos evalúan el movimiento coordinado de grupos celulares, como las células endoteliales, a través de matrices 3D, lo que permite el estudio de comportamientos celulares como la brotación, la invasión y la migración colectiva en un ambiente controlado 8,9,10. Los ensayos de angiogénesis por germinación in vivo proporcionan una evaluación integral dentro de un organismo vivo, capturando interacciones complejas, pero requieren mucho tiempo, son costosos, propensos a una alta variabilidad y difíciles de cuantificar11,12. Los ensayos de angiogénesis por germinación in vitro permiten un control preciso sobre las condiciones experimentales con alta reproducibilidad y cuantificación precisa, pero pueden no replicar completamente las complejidades in vivo 11,12,13. Por el contrario, los ensayos de angiogénesis germinación ex vivo, de los cuales el ensayo del anillo aórtico es el modelo más realizado, utilizan tejidos fuera del organismo, preservando la relevancia fisiológica y evitando complicaciones in vivo 14,15,16. A pesar de ser técnicamente desafiantes y, a veces, tener dificultades con la viabilidad de los tejidos, los modelos ex vivo ofrecen un valioso equilibrio entre complejidad y control, lo que los convierte en un enfoque prometedor para estudiar la angiogénesis germinal. Si bien estos modelos se han utilizado ampliamente para estudiar los impulsores moleculares de la angiogénesis germinal, el efecto de las señales mecánicas y el comportamiento mecánico de las células siguen siendo poco conocidos.
La migración multicelular durante la angiogénesis germinal depende en gran medida de la mecánica celular, ya que las fuerzas contráctiles basadas en actomiosina regulan la invasión de células endoteliales a la matriz extracelular circundante 17,18,19,20. Específicamente, se ha observado que los motores de miosina II no muscular, las principales máquinas contráctiles basadas en actina dentro de la célula21, controlan las fuerzas contráctiles celulares durante la angiogénesis germinativa 22,23. La célula líder es probablemente el elemento generador de fuerza predominante del brote, ya que las deformaciones de la matriz extracelular 3D circundante son significativamente mayores alrededor de la célula líder, específicamente cerca de las protuberancias celulares ricas en actina23,24, en comparación con sus seguidores 22,23,25. A pesar de esta creciente evidencia de la importancia de la contractilidad celular en la angiogénesis germinal en 3D, se carece de un método para la caracterización mecánica espacio-temporal de la mecánica celular de la angiogénesis germinal.
El objetivo general de este estudio es desarrollar un método que permita la caracterización mecánica de la migración celular durante la brotación. Al lograr la caracterización espacio-temporal de las fuerzas mecánicas en un contexto biológicamente relevante, nuestro objetivo es proporcionar nuevos conocimientos sobre cómo la mecánica celular influye en la formación de brotes angiogénicos. Con este fin, desarrollamos un sistema de modelo 2.5D mediante la creación de un hidrogel de poliacrilamida (PAA) 2D, sembrando una lámina arterial carótida sobre él y cubriéndolo con una capa delgada de gel de colágeno tipo I para establecer un entorno 3D localizado para las células. Los brotes multicelulares migraron fuera de la lámina arterial en la interfaz PAA-gel de colágeno. La ventaja de este método en comparación con las técnicas existentes es que el hidrogel PAA 2D permite análisis por microscopía de fuerza de tracción (TFM), una técnica versátil bien conocida en la que las células se adhieren a un sustrato elástico 2D y deformarán el sustrato según las fuerzas de tracción celular26. Estas deformaciones pueden ser capturadas, y las fuerzas de tracción celular pueden ser calculadas en base a las propiedades mecánicas del sustrato26. Al adaptar TFM para su uso en tejidos vivos ex vivo, nuestro objetivo es cerrar la brecha entre el control in vitro y la relevancia in vivo , proporcionando una comprensión más completa de las fuerzas mecánicas durante la angiogénesis.
Protocolo
En este protocolo se utilizaron arterias carótidas porcinas. Las arterias carótidas porcinas se recolectaron de cerdos híbridos Landrace holandeses, de 5 a 7 meses de edad y peso (vivos) de 80 a 120 kg, obtenidos de un matadero local. Los protocolos cumplían con el reglamento CE 1069/2009 en lo que respecta al material animal de matadero para el diagnóstico y la investigación, supervisado por el Gobierno holandés (Ministerio de Agricultura, Naturaleza y Calidad de los Alimentos de los Países Bajos) y fueron aprobados por las autoridades legales asociadas de bienestar animal (Autoridad de Seguridad de los Alimentos y Productos de Consumo). No se requería aprobación ética, ya que el tejido se recolectaba de subproductos de animales ya exterminados. El tiempo entre la muerte y el transporte del tejido es de 10-25 min, dependiendo del matadero.
NOTA: La Tabla de Materiales resume detalles sobre los materiales, equipos y reactivos utilizados en este protocolo. Los protocolos para muestras 2D y 3D se describen en el Archivo Complementario 1.
1. Preparación de sustratos de poliacrilamida (PAA) 2D
- En la campana extractora, prepare la solución de aglutinante de silano mezclando etanol absoluto 12:1:1 (para síntesis), ácido acético y aglutinante de silano a 4286 μL, 357 μL y 357 μL, respectivamente. Incubar 120 μL/pocillo de solución de silano aglutinante en una placa de 12 pocillos con fondo de vidrio durante 1 h a temperatura ambiente.
PRECAUCIÓN: El etanol absoluto es un líquido y vapor altamente inflamable (H225) y causa irritación ocular grave (H319). El ácido acético es un líquido y vapor inflamable (H226) y causa quemaduras graves en la piel y daños oculares (H314). Use equipo de protección personal y trabaje con una campana extractora. - En la campana extractora, lave la placa de 12 pocillos con fondo de vidrio 3 veces con etanol absoluto (industrial) con una botella rociadora. Deseche el etanol.
- Seque la placa de 12 pocillos con fondo de vidrio con gas nitrógeno. Si aparece un esmalte blanco en la parte superior del fondo del vidrio, el lavado no fue suficiente. Vuelva a lavar la placa de 12 pocillos con fondo de vidrio.
- Prepare la mezcla de gel de PAA de acuerdo con las proporciones de la Tabla 1.
- Agregue PBS a un tubo de microcentrífuga y vuelva a suspender 40% de acrilamida, 2% de bis-acrilamida y marcadores fluorescentes en la mezcla de gel. Agite la solución justo antes de la preparación del gel.
- Tan rápido como sea posible, agregue un 10% de APS y TEMED a la solución y al vórtice después de la adición de cada elemento. Pipetear una gota de 11,5 μL de mezcla de gel en el fondo de vidrio de cada pocillo y colocar suavemente un cubreobjetos de 13 mm encima de la gota.
- Golpee y gire suavemente la placa para esparcir uniformemente la mezcla de gel debajo del cubreobjetos. Si aparecen burbujas de aire, elimínelas levantando suavemente el cubreobjetos. Deje que los geles polimericen durante 1 h a temperatura ambiente. Verifique la polimerización usando la mezcla de gel restante en el tubo. Los geles de PAA polimerizados en la placa de 12 pocillos mostrarán un halo interno.
PRECAUCIÓN: La acrilamida es dañina si se ingiere o se inhala (H302 + H332), causa irritación de la piel (H315), puede causar una reacción alérgica en la piel (H317), causa irritación ocular grave (H319), puede causar defectos genéticos (H340), puede causar cáncer (H350), se sospecha que daña la fertilidad (H361f) y causa daño a los órganos a través de la exposición prolongada o repetida si se ingiere (H372). El APS puede intensificar el fuego (oxidante, H272), ser perjudicial si se ingiere (H302), causar irritación de la piel (H315), puede causar una reacción alérgica en la piel (H317), causar irritación ocular grave (H319), puede causar síntomas de alergia o asma o dificultades respiratorias si se inhala (H334) y puede causar irritación respiratoria (H335). TEMED es un líquido y vapor altamente inflamable (H225), dañino si se ingiere (H302), causa quemaduras graves en la piel y daños oculares (H314) y es tóxico si se inhala (H331). Use equipo de protección personal.
- Después de la polimerización, agregue PBS al pocillo. Con unas pinzas y/o una aguja doblada, levante y retire suavemente el cubreobjetos. Lave los geles una vez en PBS.
- Para facilitar el recubrimiento de colágeno de los geles de PAA, los geles deben funcionalizarse utilizando el reticulante Sulfo-SANPAH. Añadir 75 μL de 1 mg/mL de Sulfo-SANPAH disuelto en agua ultrapura al gel de PAA e incubar durante 5 min bajo luz UV de 365 nm.
NOTA: Mantenga Sulfo-SANPAH protegido de la luz y agregue agua ultrapura justo antes de la incubación UV. Una decoloración es visible desde el rojo claro (antes de la incubación con luz ultravioleta) hasta el rojo oscuro (después de la incubación con luz ultravioleta).
PRECAUCIÓN: Sulfo-SANPAH causa irritación ocular grave (H319). - En el gabinete de bioseguridad, realice un lavado rápido y estéril de PBS del Sulfo-SANPAH en los geles. En consecuencia, lavar los geles de PAA funcionalizados 2 veces en PBS estéril durante 10 min.
NOTA: A partir de este punto del protocolo, todos los pasos se realizarán en condiciones estériles. - En el gabinete de bioseguridad, prepare una solución de colágeno tipo IV de 0,1 mg/mL en PBS en hielo. Pipetear 50 μL de 0,1 mg/mL de gota de colágeno tipo IV sobre el gel de PAA funcionalizado e incubar durante la noche a 4 °C.
- Lave los geles 2 veces en PBS estéril. Retira el PBS y deja secar los geles durante 5 min.
- Pipetear una gota de 50 μL de medio de crecimiento de células endoteliales (ECG) sobre los geles e incubar durante al menos 1 h a 37 °C y 5% de CO2.
NOTA: La incubación de los geles en el medio de ECG mejora la unión de células y tejidos a los geles.
2. Preparación de la solución Krebs modificada para el transporte
NOTA: Prepare la solución de Krebs modificada fresca. En este protocolo, la solución de Krebs modificada se prepara 1 día antes de la recolección de tejidos.
- Esterilizar un biberón de transporte mediante autoclave. Llene una botella de vidrio con el 90% (315 mL) del volumen total de transporte requerido (350 mL) de agua ultrapura. Asegúrese de que la temperatura del agua sea de 15-20 °C.
- Mientras agita suavemente el agua con un imán de agitación, agregue 9,6 g/L (3,36 g) de tampón Krebs-Henseleit y revuelva hasta que se disuelva. Con una pipeta Pasteur, enjuague el recipiente de pesaje con un pequeño volumen de solución para incluir todas las trazas de polvo en la solución. No caliente la solución.
- Mientras revuelve, agregue 0,373 g/L (130,55 mg) de cloruro de calcio (CaCl2) a la solución y revuelva hasta que se disuelva. Enjuague el bote de pesaje con un pequeño volumen de solución.
PRECAUCIÓN: H319 causa irritación ocular grave. - Mientras revuelve, agregue 2,1 g/L (0,63 g) de bicarbonato de sodio (NaHCO3) a la solución y revuelva hasta que se disuelva. Enjuague el bote de pesaje con un pequeño volumen de solución.
- Mientras revuelves, agrega 1 x 10-1 mM (13,15 mg) de papaverina a la solución y revuelve hasta que se disuelva. Enjuague el bote de pesaje con un pequeño volumen de solución.
NOTA: La papaverina es un relajante del músculo liso que se utiliza para prevenir la vasoconstricción excesiva causada por el corte y la manipulación del vaso durante la cosecha.
PRECAUCIÓN: El H301 es tóxico si se ingiere. - En la campana extractora, agregue 0,05 mM (1,2 μL) de 2-mercaptoetanol a la solución y revuelva.
NOTA: El 2-mercaptoetanol se utiliza para mantener un nivel bajo de radicales de oxígeno.
PRECAUCIÓN: El 2-mercaptoetanol es tóxico si se ingiere o se inhala (H301 + H331), es mortal en contacto con la piel (H310), causa irritación de la piel (H315), puede causar una reacción alérgica en la piel (H317), causa daños oculares graves (H318), se sospecha que daña al feto (H361d), puede causar daño a los órganos a través de la exposición prolongada o repetida si se ingiere (H373) y es muy tóxico para la vida acuática con efectos duraderos (H410). Use equipo de protección personal y trabaje con una campana extractora. - Mientras revuelve, ajuste el pH a 7.2 agregando 1 N (1 M) de HCl o 1 N (1 M) de NaOH. El objetivo final del pH es 7,4, pero el pH puede aumentar entre 0,1 y 0,3 unidades de pH durante la filtración.
PRECAUCIÓN: El HCl contiene gas a presión; puede explotar si se calienta (H280), causar quemaduras graves en la piel y daños oculares (H314) y es tóxico si se inhala (H331). Use equipo de protección personal. - Continúe trabajando en una cabina de bioseguridad. Agregue un 10% de agua ultrapura para llevar la solución al volumen final.
- Esterilizar la solución inmediatamente por filtración utilizando una membrana con una porosidad de 0,22 μm. Dispense la solución estéril directamente en un frasco estéril. Agregue 7 mL de penicilina/estreptomiocina (P/S) al 2% a la solución.
NOTA: Durante el transporte, se añade un 2% de P/S al medio para eliminar todas las bacterias. Durante el cultivo de tejidos, se añade un 1% de P/S al medio. - Almacene la solución de Krebs modificada a 4 °C hasta la recolección del tejido.
3. Recolección de tejidos
- Dependiendo del matadero, aturdir a los cerdos mediante descargas eléctricas o CO2. Posteriormente, se cuelgan cerdos de una extremidad trasera, se les desangra y se les declara muertos.
- Antes de entrar en el proceso de sacrificio limpio, escaldar los cerdos para la depilación, chamuscarlos para eliminar los últimos pelos y esterilizar el exterior de la canal.
- Eviscerar a los cerdos haciendo una incisión en la línea media a lo largo del abdomen y extrayendo cuidadosamente los órganos internos. Dependiendo del matadero, la arteria carótida todavía estaba unida al cadáver del cerdo, o la arteria carótida ya se había extraído del cadáver con el desplume de los órganos torácicos.
- Con un cuchillo afilado, extraiga la arteria carótida con algunos restos de tejido circundante de la carcasa o del tejido del área de la garganta sin tocar la arteria ni aplicar tensión mecánica.
- Coloque el tejido que contiene la arteria carótida en el frasco de transporte que contiene una solución estéril modificada de Krebs abriendo brevemente el frasco. Invierta el frasco una vez para asegurarse de que todo el tejido esté cubierto con la solución de Krebs. Transportar los tejidos en hielo al laboratorio. El transporte dura aproximadamente 30-45 min.
4. Disección de tejidos
- Esterilizar el equipo de disección: pinza quirúrgica (manejo brusco), pinza de punta redonda recubierta de epoxi (manejo fino), bisturí, pinza y cubreobjetos mediante autoclave.
- Prepare la cabina de bioseguridad antes de la extracción/transporte de tejidos. Cubra el área de disección con una sábana quirúrgica. Monte el equipo de disección (en tubos estériles de 50 mL), las cuchillas quirúrgicas y los cubreobjetos estériles. Llene dos placas de Petri grandes con PBS estéril para preparar una bandeja de disección. Incubar el cultivo de tejido en una pequeña placa de Petri con medio ECG a 37 °C.
- Después del transporte de tejidos, dentro del gabinete de bioseguridad, transfiera la arteria carótida del frasco de transporte (lleno con solución de Krebs modificada) a una placa de Petri grande llena de PBS estéril usando la pinza quirúrgica.
- Extirpe el exceso de tejido que rodea la arteria carótida con la pinza quirúrgica y el bisturí para crear una vista clara de la arteria carótida.
- Retire 2-3 cm de ambos extremos de la arteria carótida para eliminar las áreas cercanas a las bifurcaciones de la arteria cortando con un bisturí. Retire la fascia arterial que rodea la arteria carótida con la pinza fina de punta redonda.
NOTA: Renovar la hoja del bisturí ayuda a cortar la fascia con mayor precisión. - Transfiera la arteria carótida a una nueva placa de Petri grande llena de PBS estéril. Retire la capa delgada restante de la fascia arterial tanto como sea posible.
NOTA: Cuanto más tiempo esté la arteria carótida en PBS, más pedazos de fascia tienden a aflojarse. La extirpación de la fascia es importante, ya que obstruirá la visión durante la microscopía. - Corte la arteria carótida limpia en anillos de aproximadamente 2 mm de ancho. Transfiera los anillos de la arteria carótida a la pequeña placa de Petri precalentada llena de medio ECG y manténgala a 37 °C.
5. Siembra de tejidos
NOTA: La fijación del tejido se probó sin añadir un cubreobjetos, un cubreobjetos estéril sin tratar o un cubreobjetos estériles tratados con plurónico (1% p/v de plurónico en PBS, cubreobjetos incubados durante la noche y lavados en agua ultrapura estéril antes de su uso) de diferentes tamaños en la parte superior de la lámina arterial después de la siembra en el hidrogel PAA.
- Retire las gotas medias de ECG de los geles. Transfiera un anillo de la arteria carótida a una placa de Petri mediana limpia llena de PBS estéril.
- Con la pinza de punta redonda y el bisturí, corte el anillo por la mitad. Diseccionar medio anillo en láminas de aproximadamente 2 mm de ancho para crear láminas arteriales con dimensiones de 2 x 2 mm. Tenga en cuenta la orientación del lado endotelial de la lámina arterial. La curvatura y parte de la fascia restante de la lámina arterial pueden ayudar a determinar esta orientación.
NOTA: El tamaño de los anillos de las arterias carótidas puede variar. Los anillos grandes producen aproximadamente 6-8 hojas, mientras que los anillos pequeños producen 3-4 hojas. Los anillos grandes tienen una mejor fijación debido a la menor curvatura en la lámina arterial. - Con la pinza de punta redonda, agarre la lámina arterial en la parte posterior de la lámina (fuera de la pared del vaso) y coloque la lámina en el borde del gel de PAA con el revestimiento interno endotelial hacia el sustrato de PAA para evitar dañar el sustrato de PAA al colocar la lámina.
- Con la pinza o la pinza, mueva la lámina arterial muy suavemente hacia el centro del hidrogel PAA sin tocar el gel. Coloque la lámina arterial en el borde del gel (el pañuelo puede pegarse a la pinza o pinza).
NOTA: Los pequeños restos de fascia arterial en el exterior de la pared del vaso crean un mango fácil para agarrar la lámina arterial, mientras que el revestimiento interno endotelial de la pared del vaso es muy liso. - Añadir 50 μL de medio ECG sobre la lámina arterial colocada sobre el sustrato de PAA. Ty para mantener la gota de medio ECG en la parte superior del gel.
- Con la pinza de punta redonda, coloque un cubreobjetos seco de 13 mm encima de la lámina arterial sobre el sustrato de PAA en medio. Use el borde interior del fondo del vaso para bajar suavemente el cubreobjetos hasta que toque la gota mediana y el medio se extienda por debajo.
NOTA: Los cubreobjetos de 13 mm son ventajosos porque coinciden estrechamente con el tamaño de la pared interior de la placa del pocillo con fondo de vidrio. Si baja el cubreobjetos demasiado rápido, el pañuelo se moverá hacia el borde del cubreobjetos. - Deje que el tejido se adhiera a 37 °C y 5% de CO2 durante 5 h antes de agregar 1 mL de medio ECG a cada pocillo. Colocar la lámina arterial sobre el sustrato de PAA a 37 °C y 5% de CO2 durante 24 h.
6. Creación del modelo 2.5D
- Autoclave una pinza de punta redonda para la eliminación de cubreobjetos. Preparar 1 M de NaOH en agua ultrapura, esterilizar por filtración a través de un filtro de tamaño de poro de 0,22 μm y almacenar a 4 °C.
NOTA: 1 M de NaOH se puede reutilizar en futuros experimentos. - Con una aguja afilada estéril con la punta doblada, levante muy suavemente el cubreobjetos de 13 mm de la lámina arterial y retire el cubreobjetos. Utilice el anillo interior del pozo de cristal como soporte para levantar y quitar el cubreobjetos. Cualquier movimiento lateral aumenta el riesgo de desprendimiento de la lámina arterial del sustrato del AAP.
- En un tubo de microcentrífuga estéril, prepare la mezcla de colágeno tipo I de acuerdo con la Tabla 2 en hielo. Tras la adición de colágeno tipo I y NaOH a la solución, resuspender muy bien e invertir el tubo una vez para asegurarse de que la mezcla se mezcle homogéneamente.
NOTA: Al agregar colágeno tipo I a la mezcla, la mezcla de color rosa claro se vuelve incolora. Tras la adición de NaOH, la mezcla incolora se vuelve de color rosa claro. - Retire el medio del pozo utilizando un sistema de succión al vacío. Retire el medio que rodea el tejido tanto como sea posible sin tocar el tejido.
NOTA: Demasiado medio alrededor de la lámina arterial evitará que el gel de colágeno tipo I la rodee. - Añadir una gota de 10 μL de mezcla de gel de colágeno tipo I encima de cada lámina arterial y dejar polimerizar el gel de colágeno tipo I durante 1 h a 37 °C y 5% deCO2.
- Muy suavemente, agregue 1 mL de medio ECG precalentado a cada pocillo y coloque las muestras a 37 °C y 5% de CO2.
7. Imágenes de células vivas
NOTA: Las imágenes de células vivas se realizaron con un microscopio de epifluorescencia Leica DMi8 o Nikon Ti2 Eclipse equipado con control térmico, de CO2 y de humedad, y se controlaron con software Leica o NIS. Se utilizaron el control de enfoque adaptativo (Leica) y el sistema de enfoque perfecto (Nikon) para mantener el enfoque en el tiempo.
- Después de 24 h de cultivo en el sistema 2.5D, comprobar si hay angiogénesis germinal. Algunas láminas arteriales ya comienzan a formar brotes celulares después de 24 h de cultivo, mientras que otras láminas necesitan más tiempo para iniciar la brotación endotelial.
- Si se ha iniciado la angiogénesis germinal, refresque el medio de ECG y coloque la placa de 12 pocillos en el soporte de la platina dentro de la caja de incubación precalentada a 37 °C del microscopio.
- Elige el objetivo que te interese. En este estudio se utilizaron diferentes objetivos, utilizar un objetivo de 10x para crear una visión global de la formación de brotes celulares y un objetivo de 20x para realizar TFM.
- Defina los canales de interés. Para fines de TFM, visualice los brotes celulares usando contraste de fase y visualice los marcadores fluorescentes (rojo oscuro) en el sustrato de PAA usando un canal fluorescente a una longitud de onda de 660 nm.
- Seleccione (múltiples) regiones de interés y busque el plano de enfoque. Active el sistema de enfoque (control de enfoque adaptativo en Leica DMi8 o sistema de enfoque perfecto en Nikon Ti2 Eclipse) para garantizar un enfoque estable en imágenes de lapso de tiempo.
- Defina el lapso de tiempo de interés seleccionando un intervalo de tiempo y una duración de lapso de tiempo. En este estudio se utilizaron diferentes intervalos de tiempo (5-20 min) y longitudes de lapso de tiempo (4-24 h) para diferentes propósitos.
- Para fines de TFM, después de la obtención de imágenes de lapso de tiempo, elimine las células que crecen agregando varias gotas de SDS al 5% en agua ultrapura y espere varios minutos. Para cada posición seleccionada, tome una pila z (se definió una altura z de 2 μm con un tamaño de paso de 0,2 μm) de los marcadores fluorescentes en el sustrato PAA para obtener un estado relajado de los marcadores fluorescentes como imagen de referencia.
NOTA: Se realizan imágenes de pila Z ya que las células pueden tirar o empujar los marcadores fluorescentes en la dirección z.
8. Análisis de microscopía de fuerza de tracción
- Alinee y recorte las imágenes de lapso de tiempo en relación con la mejor imagen de referencia para un análisis preciso.
- Para medir los desplazamientos de los marcadores fluorescentes en el hidrogel PAA, realice la velocimetría de imágenes de partículas (PIV) entre cualquier imagen de lapso de tiempo y la imagen de referencia utilizando códigos MatLab personalizados. Dentro del análisis PIV, divida las imágenes en ventanas de interrogación de 32 por 32 píxeles con 0,5 de superposición.
- Calcule las fuerzas de tracción a partir de los desplazamientos de los marcadores fluorescentes mediante microscopía de tracción basada en la transformada de Fourier de un gel infinito con un espesor de gel finito utilizando la ecuación de Boussinesq27.
Resultados
Mediante el protocolo descrito, podemos inducir la angiogénesis de brotación ex vivo a partir de una arteria carótida porcina sobre un hidrogel de PAA 2D cubierto con una fina capa de gel de colágeno tipo I, creando así un modelo de angiogénesis de brotación ex vivo 2.5D. Este modelo nos permite realizar TFM convencional y medir las fuerzas de tracción celular de la angiogénesis germinada en la interfaz del gel de PAA en el espacio y el tiempo.
Para establecer el modelo 2.5D, primero preparamos un hidrogel de poliacrilamida (PAA) 2D incrustado con marcadores fluorescentes, seguido de un recubrimiento nocturno con colágeno tipo IV (d-1 a d0). En el día 0 (d0), se colocó una lámina arterial carotídea sobre el hidrogel recubierto de colágeno IV y se dejó adherir durante la noche (d0 a d1). Posteriormente, se aplicó una fina capa de gel de colágeno tipo I sobre la lámina arterial, tras lo cual se iniciaron las imágenes el día 1 (d1) para monitorizar el brote celular y rastrear los marcadores fluorescentes para el análisis mecánico (d1 a d2). Para verificar la angiogénesis germinal en el modelo 2.5D, realizamos la angiogénesis germinal convencional ex vivo en un gel de colágeno tipo I 3D en paralelo. Para ello, se preparó una fina capa de gel de colágeno tipo I, seguida de la siembra de la lámina arterial carotídea, y posteriormente se cubrió con una capa adicional de colágeno (d0). La brotación angiogénica se monitoreó a lo largo del tiempo. Además, nos esforzamos por inducir la angiogénesis germinal en 2D para disminuir aún más la complejidad del modelo. El procedimiento experimental reflejó el del modelo 2.5D, con la diferencia clave de la exclusión de la capa superior de gel de colágeno tipo I. En la Figura 1 se describe una descripción general de los tres modelos, incluidos sus procedimientos experimentales. Las arterias carótidas se extrajeron de cerdos del matadero local y se transportaron en una solución Krebs fresca y estéril. Dentro de la cabina de bioseguridad, se extirpó el exceso de tejido que rodeaba la arteria carótida para garantizar que no se produjera ningún deterioro visual de la angiogénesis germinal durante las imágenes de lapso de tiempo en vivo (Figura 2A-E). Una vez que la arteria quedó limpia del exceso de tejido, la arteria se cortó en anillos arteriales de 2 mm de ancho, y los anillos se cortaron en láminas arteriales con una dimensión de 2 x 2 mm (Figura 2F).
Para asegurar la angiogénesis germinación en la parte superior de la interfaz del hidrogel PAA dentro del modelo 2.5D y 2D, sembramos las láminas arteriales con el lado interno de la célula endotelial frente al hidrogel PAA recubierto de colágeno tipo IV y dejamos que se adhirieran. Para optimizar la fijación de la lámina arterial al hidrogel PAA, probamos el efecto de la adición de un cubreobjetos de vidrio de 12 mm con recubrimiento antiincrustante en la parte superior de la lámina arterial. A las 24 h se retiró el cubreobjetos y se midió la eficiencia de fijación mediante el porcentaje de láminas arteriales adheridas al hidrogel PAA. Observamos que la adición de un cubreobjetos de vidrio, independiente del recubrimiento antiincrustante, aumentó la eficiencia de fijación de las láminas arteriales sobre el hidrogel PAA en comparación con ningún cubreobjetos (Figura 3A-D). A continuación, probamos el efecto del diámetro (12 o 13 mm) del cubreobjetos de vidrio en la eficiencia de fijación de la lámina arterial, mientras que el pocillo interior de la placa era de 14 mm. Observamos que un cubreobjetos de 13 mm aumenta la eficiencia de fijación de las láminas arteriales sobre el hidrogel PAA en comparación con un cubreobjetos de 12 mm (Figura 3E-G), ya que se minimizan las fuerzas de cizallamiento durante la extracción del cubreobjetos. Continuamos utilizando un cubreobjetos de 13 mm sin tratar para la fijación de la lámina arterial al hidrogel PAA tanto en el modelo 2.5D como en el 2D.
Después de que la lámina arterial se adhirió al hidrogel PAA, agregamos una capa delgada de gel de colágeno tipo I encima de la lámina arterial para crear un entorno 2.5D. Cultivamos las muestras durante 5 días y examinamos las muestras para detectar la angiogénesis germinal. Observamos la formación de brotes celulares en el modelo 3D (Figura 4A), consistente con la angiogénesis de brotes ex vivo previamente reportada en la literatura28,29,30. Dentro del modelo 2.5D, observamos una organización similar de brotes celulares en comparación con el modelo 3D (Figura 4B). Los brotes celulares se formaron a múltiples alturas (Video 1), incluso en la interfaz PAA. Además, la angiogénesis de brotación se caracteriza por una alta proliferación de células líderes y seguidoras, un fenómeno que observamos durante la brotación dentro del modelo 2.5D (Video 2). Al cultivar una lámina arterial en 2D, las células de diferentes orígenes (Figura complementaria 1) migran como monocapas fuera del tejido, por lo que carecen de la organización de brotes celulares (Figura 4C). Dado que no observamos angiogénesis germinal en el modelo 2D, excluimos este modelo de los análisis posteriores. En conjunto, la lámina arterial necesita un entorno 3D local para inducir la angiogénesis de la brotación, lo que demuestra el potencial del modelo ex vivo 2.5D de la angiogénesis de la brotación.
Además, el sistema de modelos 2.5D es un sistema versátil que permite a los usuarios examinar el efecto de las señales mecánicas del microentorno celular, por ejemplo, la rigidez de la matriz. La rigidez de la matriz de un hidrogel de colágeno 3D tipo I, el hidrogel que se usa comúnmente para la angiogénesis de germinación ex vivo, depende de la concentración de la proteína ECM, donde un aumento en la concentración de proteína se correlaciona con un aumento en la rigidez de la matriz32. El rango típico de concentración de colágeno tipo I para hacer que este hidrogel 3D induzca la angiogénesis de la brotación es de 1-4 mg/mL, lo que corresponde a una rigidez de la matriz de 1 Pa a 1 kPa 32,33,34. Las concentraciones más bajas pueden ser demasiado blandas para proporcionar soporte estructural, mientras que las concentraciones más altas pueden inhibir el movimiento celular. La rigidez fisiológica del tejido endotelial es de 1 kPa35, que se puede imitar con un hidrogel de colágeno tipo I en 3D. Sin embargo, la formación y progresión tumoral se asocia con el endurecimiento del tejido4, lo que enfatiza la necesidad de un modelo que pueda lograr una mayor rigidez de la matriz para estudiar la angiogénesis tumoral. La rigidez del sustrato de los hidrogeles de PAA, la rigidez detectada por las células endoteliales de la lámina arterial, se puede ajustar fácilmente dentro del rango de 1 a decenas de kPa. Aquí, examinamos el efecto de la rigidez del sustrato de PAA en el inicio de la angiogénesis de la brotación mediante el porcentaje de muestras que iniciaron la formación de brotes celulares al día siguiente de la adición de la capa de colágeno tipo I. Observamos que más láminas arteriales mostraron signos tempranos de brotes celulares cuando se cultivaron en un hidrogel de PAA blando fisiológico (1 kPa) en comparación con un hidrogel de PAA rígido patológico (12 kPa) (Figura 5), lo que muestra el potencial de este modelo para estudiar el efecto de la rigidez de la matriz en la angiogénesis de la brotación. Además de la rigidez del sustrato ajustable, estos sustratos permiten la modulación sistemática de otras señales mecánicas (por ejemplo, composición y densidad de la matriz), así como señales químicas (por ejemplo, inhibición de reguladores moleculares por acondicionamiento del medio de cultivo), lo que demuestra la versatilidad de este modelo de angiogénesis de brotación ex vivo 2.5D.
Para cuantificar la mecánica celular en la angiogénesis de brotes, realizamos Microscopía de Fuerza de Tracción (TFM) convencional en brotes celulares que se formaron en la interfaz 2D de PAA. Un día después de la adición de la capa de colágeno tipo I, realizamos imágenes de células vivas de las células (Figura 6A) y de los marcadores fluorescentes incrustados en el hidrogel de PAA. Los desplazamientos de los marcadores fluorescentes se midieron utilizando la velocimetría de imágenes de partículas (Figura 6B), y las tracciones celulares se calcularon utilizando las propiedades mecánicas del hidrogel PAA (Figura 6C). Con este modelo ex vivo 2.5D, observamos inicialmente fuerzas de tracción en las protuberancias de la célula líder de un brote celular, seguidas de fuerzas de empuje a lo largo del brote celular, tanto en la parte posterior de la célula líder como en las células seguidoras (Figura 6C).
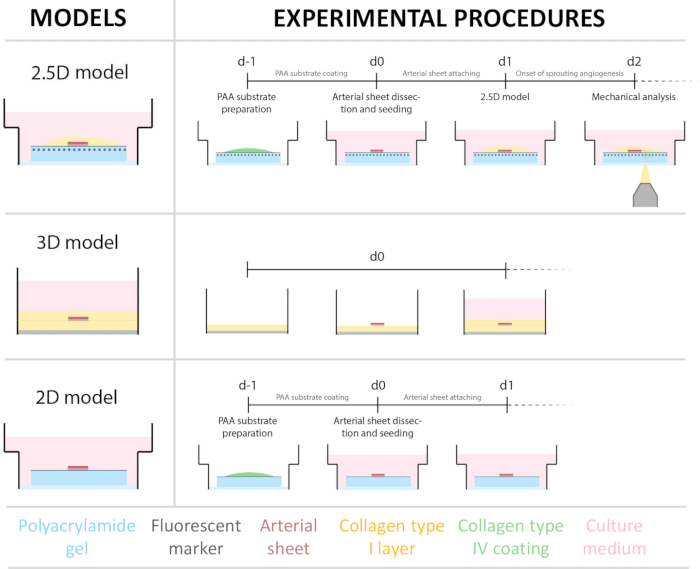
Figura 1: Modelos y procedimientos experimentales. (izquierda) Modelos experimentales probados. El modelo 2.5D representa una lámina arterial colocada sobre un hidrogel plano de poliacrilamida (PAA) recubierto de colágeno tipo IV y cubierto con una fina capa de hidrogel de colágeno tipo I. El modelo 3D representa una lámina arterial intercalada entre dos capas de gel de colágeno tipo I, un sistema que se sabe que induce la angiogénesis germinal36. El modelo 2D representa una lámina arterial colocada sobre un hidrogel PAA plano recubierto de colágeno tipo IV. (derecha) Procedimientos experimentales para los modelos correspondientes. Tanto para el modelo 2D como para el modelo 2.5D, se preparó un hidrogel de PAA el día antes de la siembra (d-1) y se realizó un recubrimiento de colágeno tipo IV durante la noche. La arteria carótida se extrajo de cerdos, se diseccionó en láminas arteriales, se sembró sobre el hidrogel en el día 0 (d0) y se dejó adherir durante la noche (d1). Para las muestras 2.5D, se colocó una capa delgada de gel de colágeno tipo I sobre la lámina arterial. El análisis mecánico se realizó después del inicio de la brotación en el día 2 (d2). Para las muestras 2D, el medio se actualizó el día 1 (d1). Para el modelo 3D, se preparó una capa de gel de colágeno tipo I justo antes de la siembra en el día 0 (d0). La lámina arterial se sembró sobre la capa de colágeno tipo I y se cubrió con una segunda capa de colágeno tipo I. Haga clic aquí para ver una versión más grande de esta figura.
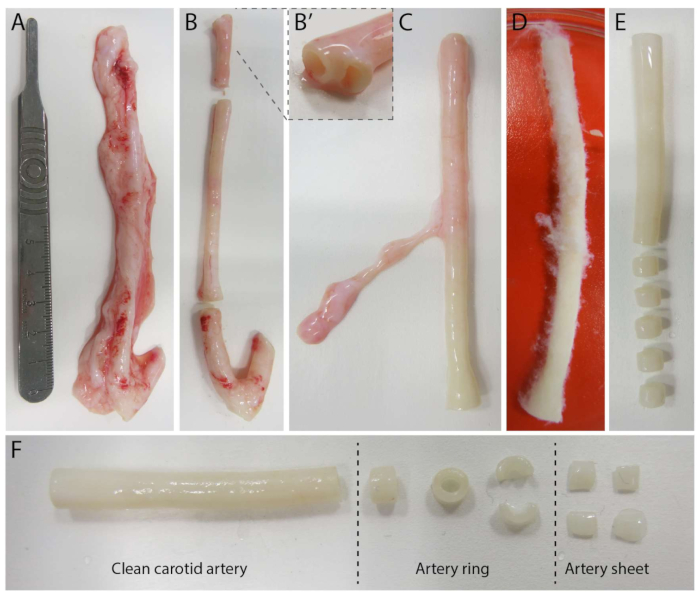
Figura 2: Pasos de disección de la arteria carótida (d0). (A) Las arterias carótidas de aproximadamente 10 cm de longitud se recolectaron de cerdos del matadero local. (B) Se descartó el exceso de tejido y aproximadamente 2 cm del borde (para evitar estar demasiado cerca de los puntos de ramificación, (B'). (C-E) La arteria carótida se despellejó (C), se empapó en PBS (D) y todo el tejido restante se despellejó para garantizar una visibilidad clara durante la obtención de imágenes (E). (F) La arteria carótida limpia se corta en anillos arteriales con un ancho aproximado de 2 mm. Cada anillo está cortado en 4 hojas arteriales con una dimensión aproximada de 2 x 2 mm. Haga clic aquí para ver una versión más grande de esta figura.
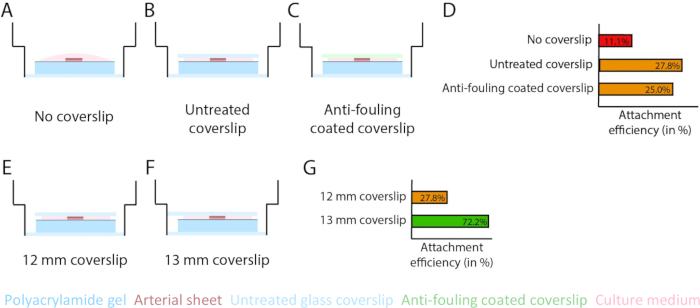
Figura 3: La eficiencia de la fijación de la lámina arterial aumenta utilizando un cubreobjetos de vidrio de 13 mm (d1 ). (A-D) Efecto de un cubreobjetos de vidrio en la unión de la lámina arterial al hidrogel de poliacrilamida (PAA). Se realizó una comparación entre un cubreobjetos sin vidrio (A), un cubreobjetos de vidrio sin tratar (B) y un cubreobjetos de vidrio con recubrimiento antiincrustante utilizando Pluronic F127 (C). La eficiencia de la fijación se midió por el número de láminas arteriales que se adhirieron al hidrogel PAA después de la extracción del cubreobjetos en comparación con el número total de muestras: sin cubreobjetos (4 de 36), cubreobjetos sin tratar (10 de 36) y cubreobjetos con recubrimiento antiincrustante (9 de 36; D). (E-G) Efecto del tamaño de un cubreobjetos de vidrio sin tratar en la fijación de la lámina arterial al hidrogel PAA. Se realizó una comparación entre un cubreobjetos de vidrio de 12 mm sin tratar (E) y un cubreobjetos de vidrio de 13 mm sin tratar (F) dentro de un pocillo de 14 mm. La eficiencia de la fijación se midió por el número de láminas arteriales adheridas al hidrogel PAA después de la retirada del cubreobjetos en comparación con el número total de muestras: 12 mm de cubreobjetos (10 de 36) y 13 mm de cubreobjetos (52 de 72; G). Haga clic aquí para ver una versión más grande de esta figura.
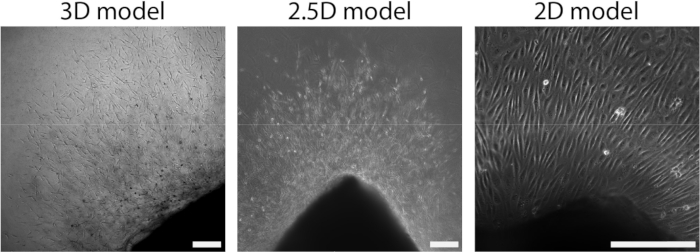
Figura 4: La dimensionalidad del modelo define la organización durante el crecimiento celular (d2+). Las células migran fuera del tejido en una organización de brotes en el modelo 3D (izquierda), similar al modelo 2.5D (centro). Las células migran fuera del tejido en una organización monocapa en la configuración 2D (derecha). La barra de escala representa 250 μm. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: El inicio de la brotación endotelial en el modelo 2.5D depende de la rigidez del sustrato de hidrogel de poliacrilamida (d2). (A-B) Lámina arterial cubierta con una fina capa de gel de colágeno tipo I sobre un hidrogel de poliacrilamida (PAA) suave (A; 1 kPa) o rígido (B; 12 kPa) en el día 2 del protocolo (1 día después de la adición de la capa de gel de colágeno tipo I). (C) El inicio de la brotación se midió por el número de láminas arteriales que ya mostraban signos de crecimiento celular en comparación con el número total de muestras: blandas (7 de 24) y rígidas (3 de 24). La barra de escala representa 1 mm (A, B) o 500 μm (A', B'). Haga clic aquí para ver una versión más grande de esta figura.

Figura 6: Caracterización de la fuerza de tracción durante la angiogénesis de brotación temprana. La imagen de las celdas en el tiempo (0-4 h) se muestra en la fila superior. Los correspondientes desplazamientos de marcadores fluorescentes (0-2 μm) y tracciones celulares (0-50 Pa) en un sustrato de hidrogel PAA de 1 kPa se muestran en la fila central e inferior, respectivamente. Los acercamientos de las tracciones celulares a 0 h, 2 h y 4 h se muestran en naranja. Haga clic aquí para ver una versión más grande de esta figura.
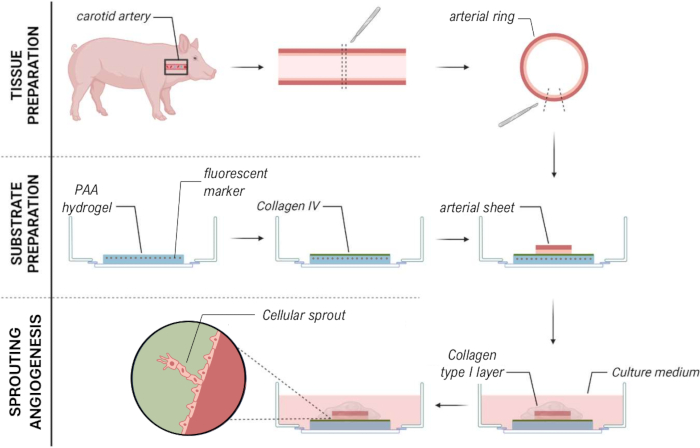
Figura 7: Método de modelo de angiogénesis de germinación ex vivo 2.5D que permite la caracterización mecánica de brotes celulares. Haga clic aquí para ver una versión más grande de esta figura.
| 1 kPa | 12 kPa | |
| PBS | 435 μL | 373,7 μL |
| 40% de acrilamida | 50 μL | 93,8 μL |
| 2% bis-acrilamida | 7,5 μL | 25 μL |
| Rotulador fluorescente (rojo oscuro) | 5 μL | 5 μL |
| 10% APS | 2,5 μL | 2,5 μL |
| TEMED | 0,25 μL | 0,25 μL |
Tabla 1: Proporciones de mezcla de gel de PAA.
| fórmula | Volumen por placa de 12 pocillos (130 μL) | |
| Medio de ECG | VECG=Vfinal-V col1-V NaOH | 82,16 μL |
| Colágeno tipo I | Vcol1=(Vfinal*Cfinal)/Cstock | 46 μL |
| NaOH | VNaOH=0.04*Vcol1 | 1,84 μL |
Tabla 2: El gel de colágeno tipo I mezcla los volúmenes utilizando las abreviaturas de volumen (V) y concentración (C).
Vídeo 1: Imágenes de lapso de tiempo de la formación de brotes celulares dentro del modelo 2.5D. Las células se obtuvieron mediante imágenes de contraste de fase durante un período de tiempo de 22 horas con un intervalo de tiempo de 17,5 minutos. Los brotes celulares se formaron a múltiples alturas dentro de la capa de gel de colágeno tipo I, según lo observado por los diferentes planos focales. La barra de escala representa 100 μm. Haga clic aquí para descargar este video.
Video 2: Alta tasa de proliferación de células dentro de brotes celulares dentro del modelo 2.5D. Las células se obtuvieron mediante imágenes de contraste de fase durante un período de 22 h con un intervalo de tiempo de 17,5 minutos. Tanto las células líderes como las seguidoras proliferan durante las imágenes de lapso de tiempo. La barra de escala representa 100 μm. Haga clic aquí para descargar este video.
Figura complementaria 1: Fenotipo celular en modelo 2D (d2+) mediante tinción de inmunofluorescencia. (A) Tinción de inmunofluorescencia (IF) del núcleo celular (DAPI), marcador de células endoteliales (CD31) y marcador de fibroblastos (actina de músculo liso alfa; α-SMA). (B) Tinción IF del núcleo celular (DAPI), marcador de células endoteliales (CD31) y marcador de células del músculo liso (calponina). La barra de escala representa 100 μm. Haga clic aquí para descargar esta figura.
Archivo complementario 1: Protocolo de tinción de inmunofluorescencia. Haga clic aquí para descargar este archivo.
Discusión
La angiogénesis germinal, la formación de nuevos vasos sanguíneos, es un proceso complejo regulado por mecanismos moleculares y mecánicos. Si bien se han desarrollado muchos modelos 3D en las últimas décadas para estudiar los impulsores moleculares (por ejemplo, VEGF y señalización de Notch) de la angiogénesis germinal, se sabe poco sobre la mecánica celular debido a las limitaciones del modelo. La microscopía de fuerza de tracción (TFM) es una técnica bien conocida para la cuantificación de fuerzas celulares en el espacio y el tiempo, donde las deformaciones del sustrato 2D se convierten en tracciones celulares. Por lo tanto, en este protocolo, describimos un modelo ex vivo 2.5D, lo que significa que proporcionamos localmente a las células un entorno 3D mientras preservamos la simplicidad de un modelo 2D que permite la cuantificación de las fuerzas de tracción durante la angiogénesis de la brotación (Figura 1). Para ello, preparamos y sembramos una lámina arterial porcina (con el lado endotelial hacia abajo; Figura 2) encima de un hidrogel de poliacrilamida (PAA) recubierto de colágeno tipo IV que contiene marcadores fluorescentes. Tras la fijación de la lámina arterial mediante un cubreobjetos de vidrio de 13 mm (Figura 3), añadimos una fina capa de hidrogel de colágeno tipo I que permite la formación de brotes celulares (Figura 4). Utilizando este modelo, mostramos que durante la brotación celular 22,23,24,25, las células líderes ejercen fuerzas de tracción (como se observó en la literatura 19,20,21,22), pero también que las células seguidoras ejercen fuerzas de empuje (Figura 6). La resolución del campo de tracción obtenida a través de nuestro protocolo permite realizar análisis cuantitativos de la cinemática y la dinámica celular, tanto en el tiempo como en el espacio, propios de los trabajos que recurren a la microscopía de fuerza de tracción sobre sustratos conformes 37,38,39.
Además, demostramos la versatilidad de este modelo ex vivo 2.5D de angiogénesis germinante mediante el cambio de las señales mecánicas del microambiente (Figura 5). Mientras que la angiogénesis germinal normalmente ocurre a una rigidez fisiológica de 1 kPa35 , que puede ser imitada por un hidrogel de colágeno 3D tipo I, la angiogénesis tumoral ocurre en un microambiente endurecido40 , que está más allá del rango de rigidez de los hidrogeles convencionales de colágeno 3D tipo I. La rigidez del sustrato PAA se puede ajustar fácilmente cambiando la relación de reticulantes para generar una mayor rigidez del sustrato. Utilizando este modelo, revelamos que el inicio de la angiogénesis germinal depende de la rigidez. Estos sustratos no solo ofrecen rigidez ajustable, sino que también permiten la modulación sistemática de otras señales mecánicas, por ejemplo, la composición y la densidad de la matriz. Además, este modelo nos permite estudiar la mecánica celular mientras manipulamos reguladores moleculares utilizando el condicionamiento del medio (por ejemplo, el efecto de la inhibición en la señalización de Notch en la mecánica celular) para comprender los mecanismos mecanobiológicos de la angiogénesis germinal. Esto demuestra la utilidad de este modelo ex vivo 2.5D de angiogénesis germinativa en una muestra de diferentes microambientes.
El modelo que presentamos hace uso del TFM 2D convencional, que ofrece un análisis más sencillo, una mayor resolución espacial y una implementación más sencilla en comparación con el TFM 3D (viscoelástico), lo que lo hace más accesible y rentable26,41. Sin embargo, el TFM 3D (viscoelástico) proporciona un entorno fisiológicamente más relevante al capturar las fuerzas de tracción en las tres dimensiones y tener en cuenta las complejas propiedades mecánicas de la matriz extracelular, ofreciendo una visión más profunda del comportamiento celular en un contexto más realista 42,43,44,45. Este efecto de dimensionalidad también apunta hacia una limitación de este modelo 2.5D. Utilizamos TFM 2D bajo la suposición de que las células están migrando en un sustrato 2D. Si bien este es el caso en este modelo 2.5D, las células se encuentran en un entorno 3D local y, por lo tanto, se adhieren a la capa de gel de colágeno tipo I y ejercen fuerzas en esta capa de gel. La suposición que adoptamos dentro de este análisis es que la capa de gel de colágeno tipo I no está acoplada mecánicamente (no hay transmisión de fuerza entre estos dos hidrogeles) a la interfaz PAA debido a la diferencia de orden de magnitud en la rigidez de la matriz, por lo tanto, minimiza el efecto de las fuerzas celulares sobre la capa de colágeno tipo I. Esto hace que la caracterización de fuerzas utilizando el modelo ex vivo 2.5D sea una representación simplificada de las fuerzas generadas por las células. Además, este protocolo requiere precisión y es extenso, con varios pasos en los que se pueden perder muestras, por ejemplo, (i) dificultades de visibilidad celular debido al exceso de tejido que rodea la lámina arterial (Figura 2), (ii) una de cada tres muestras no se adhiere al sustrato de PAA (Figura 3), (iii) no todas las muestras iniciarán la formación de brotes celulares (Figura 5), (iv) los brotes celulares no se forman en el sustrato de PAA, y (v) marcadores fluorescentes desenfocados cuando se usa una lámina arterial gruesa sobre un hidrogel de PAA de baja rigidez. Por lo tanto, optimizamos este método para una placa de 12 pocillos para garantizar muchas regiones de interés para realizar análisis mecánicos de la angiogénesis germinal.
En conclusión, el enfoque presentado para la caracterización simplificada de las fuerzas de tracción celular de la angiogénesis germinante de una lámina arterial porcina viva utilizando un modelo 2.5D (Figura 7) puede ayudar a crear información más precisa y en tiempo real sobre las interacciones mecánicas durante la angiogénesis dentro de un contexto de tejido nativo, facilitando el estudio de procesos celulares dinámicos con complejidad reducida y reproducibilidad mejorada en comparación con los sistemas completamente 3D. Esto podría mejorar nuestra comprensión de cómo las células responden a las señales mecánicas en un entorno fisiológicamente más relevante, manteniendo la simplicidad analítica de los métodos 2D. Este conocimiento podría avanzar en el campo de la ingeniería de tejidos con el objetivo de crear vasos sanguíneos, pero también encontrar fármacos terapéuticos para la prevención de la angiogénesis tumoral con el objetivo de limitar el crecimiento tumoral y reducir la metástasis.
Divulgaciones
Los autores no tienen conflictos de intereses que revelar.
Agradecimientos
Agradecemos a la gente de LifeTec por recolectar y transportar las arterias carótidas porcinas desde el matadero local; Leon Hermans, Pim van den Bersselaar y Adrià Villacrosa Ribas (TU/e, ICMS) por las fructíferas discusiones sobre procedimientos experimentales y análisis de caracterización mecánica. Agradecemos el apoyo del Consejo Europeo de Investigación (771168), la Organización Holandesa para la Investigación Científica (024.003.013), la Academia de Finlandia (307133, 316882, 330411 y 337531) y los Centros de Excelencia en Mecanostasis Celular (CellMech) de la Fundación Universitaria Åbo Akademi.
Materiales
| Name | Company | Catalog Number | Comments | |
| 2% bis-acrylamide | Bio-Rad | 1610143 | ||
| 2-mercaptoethanol | Merck Life Science | 60-24-2 | ||
| 3-(Trimethoxysilyl)propyl methacrylate | Bind-Silane | Sigma-Aldrich | 440159-100ML | |
| 40% acrylamide | Bio-Rad | 1610140 | ||
| Aboslute ethanol (for analysis) | VWR International | 1.00983.1000 | ||
| Absolute ethanol (industrial) | VWR International | 83813.41 | ||
| Acetic acid, glacial 100% | Merck | 1000562500 | ||
| Ammonium persulfate | APS | Bio-Rad | 7727-54-0 | 10% APS dissolved in Milli-Q water, aliquoted and stored at -20 °C |
| antibody (primary) - calponin | abcam | ab46794 | dilution 1:200 | |
| antibody (primary) - CD31 | Serotec | MCA1746 | dilution 1:10 | |
| antibody (primary) - α-smooth muscle actin | αSMA | Dako | M0851 | dilution 1:100 |
| antibody (secondary) - goat-anti-mouse-IgG1 Alexa 488 | Molecular Probes | A21121 | dilution 1:200 | |
| antibody (secondary) - goat-anti-mouse-IgG2a Alexa 555 | Molecular Probes | A21137 | dilution 1:200 | |
| antibody (secondary) - goat-anti-rabbit-IgG Alexa 555 | Molecular Probes | A21428 | dilution 1:200 | |
| Autoclave | Astell | |||
| Calcium chloride dihydrate | CaCl2 | Calbiochem | 208291-250GM | |
| Collagen type I, rat-tail | Corning | 354236 | ||
| Collagen type IV, human placenta | Merck Life Science | C5533-5MG | dissolved in PBS at a concentration of 1mg/mL, aliqouted and stored at -80 °C | |
| Endothelial Cell Growth Medium | ECG medium | Promocell | C-22111 | supplemented with 2% FCS, supplement mix (both included), and 1% P/S |
| Expoxy-coated round tip tweezer | fine tweezer | Rubis Pinzette | E78144-2A | |
| Fluorescent marker, dark red | Invitrogen | F8807 | ||
| Glass coverslips, Ø13 mm, #1 | Epredia | CB00130RA120MNZ0 | ||
| Glass coverslips, Ø13 mm, #1.5 | Epredia | CB00120RAC20MNZ0 | ||
| Hydrochloride acid, 25% | HCl | Merck | 1.100316.1000 | |
| Krebs-Henseleit buffer | Sigma-Aldrich | K3753 | ||
| Microscope, Leica Application Suite X software, version 3.5.7.23225 | Leica Microsystems | |||
| Microscope, Leica DMi8 epifluorescent microscope | Leica Microsystems | |||
| Microscope, Nikon Ti2 Eclipse | Nikon | |||
| Microscope, NIS-Elements AR software | Nikon | |||
| N,N,N',N'-tetramethylethane-1,2-diamine | TEMED | Merck Life Science | 110-18-9 | |
| Nalgene bottle | Thermo Scientific | 2187-0016 | ||
| Needle, 21Gx1" | Henke Sass Wolf | HK4710008025 | ||
| Normal serum, goat | Gibco | 10098792 | ||
| Papaverine hydrochloride | Sigma | 61-25-6 | ||
| Penicillin/Streptomyocin (10 000 U/mL) | P/S | Gibco | 15140163 | |
| Petri-dish, large (145x20mm) | Greiner Bio-one | 639160 | ||
| Petri-dish, small (60x15mm) | Greiner Bio-one | 628160 | ||
| Phosphate Buffered Saline | PBS | Sigma | P4417 | |
| Pluronic F-127 | Merck Life Science | P2443-250G | ||
| Puncture needle, sharp closed tip | unknown | |||
| Scalpel, no. 4 | Swann-Morton | |||
| Sodium hydrogen carbonate | NaHCO3 | VWR International | 144-55-8 | |
| sulfosuccinimidyl 6-(4'-azido-2'-nitrophenylamino)hexanoate | Sulfo-SANPAH | Thermo Scientific | 22589 | dissolved in DMSO at a concentration of 25 mg/mL, aliquoted and stored at -80 °C |
| Surgical blade, no. 20 | Swann-Morton | |||
| Surgical drape sheet | Foliodrape | 2775001 | ||
| Surgical tweezer | Lettix | 400024 | ||
| Triton X-100 | Merck | 9036-19-5 | ||
| UV lamp | Analytik Jena | 95-0042-13 | ||
| well plate, 96-well, F-bottom | Greiner Bio-one | 655180 | ||
| well plate, glass bottom 12-well | MatTek | P12G-0-14-F | ||
Referencias
- Carmeliet, P. Angiogenesis in health and disease. Nat Med. 9 (6), 653-660 (2003).
- Folkman, J. Angiogenesis in cancer, vascular, rheumatoid and other disease. Nat Med. 1, 27-30 (1995).
- Kretschmer, M., Rüdiger, D., Zahler, S. Mechanical aspects of angiogenesis. Cancers. 13 (19), 4987 (2021).
- Bordeleau, F., et al. Matrix stiffening promotes a tumor vasculature phenotype. Proc Natl Acad Sci U S A. 114 (3), 492-497 (2017).
- Blanco, R., Gerhardt, H. VEGF and Notch in tip and stalk cell selection. Cold Spring Harb Perspect Med. 3 (1), a006569 (2013).
- Adams, R. H., Alitalo, K. Molecular regulation of angiogenesis and lymphangiogenesis. Nat Rev Mol Cell Biol. 8, 464-478 (2007).
- Carmeliet, P., De Smet, F., Loges, S., Mazzone, M. Branching morphogenesis and antiangiogenesis candidates: tip cells lead the way. Nat Rev Clin Oncol. 6, 315-326 (2009).
- Salam, N., et al. Assessment of migration of human mscs through fibrin hydrogels as a tool for formulation optimisation. Materials. 11 (9), 1781 (2018).
- Solbu, A. A., et al. Assessing cell migration in hydrogels: An overview of relevant materials and methods. Materials Today Bio. 18, 100537 (2023).
- Cao, W., Li, X., Zuo, X., Gao, C. Migration of endothelial cells into photo-responsive hydrogels with tunable modulus under the presence of pro-inflammatory macrophages. Regenerat Biomater. 6 (5), 259-267 (2019).
- Staton, C. A., Reed, M. W. R., Brown, N. J. A critical analysis of current in vitro and in vivo angiogenesis assays. Int J Exp Pathol. 90 (3), 195-221 (2009).
- Staton, C. A., et al. Current methods for assaying angiogenesis in vitro and in vivo. Int J Exp Path. 85, 233-248 (2004).
- Ngo, T. X., et al. In Vitro models for angiogenesis research: A review. Int J Tissue Regenerat. 5, 37-45 (2014).
- Tomita, Y., et al. An ex vivo choroid sprouting assay of ocular microvascular angiogenesis. J Vis Exp. (162), e61677 (2020).
- Kapoor, A., Chen, C. G., Iozzo, R. V. A simplified aortic ring assay: A useful ex vivo method to assess biochemical and functional parameters of angiogenesis. Matrix Biol Plus. 6-7, 100025 (2020).
- Stiffey-Wilusz, J., Boice, J. A., Ronan, J., Fletcher, A. M., Anderson, M. S. An ex vivo angiogenesis assay utilizing commercial porcine carotid artery: Modification of the rat aortic ring assay. Angiogenesis. 4 (1), 3-9 (2001).
- Kniazeva, E., Putnam, A. J. Endothelial cell traction and ECM density influence both capillary morphogenesis and maintenance in 3-D. Am J Physiol Cell Physiol. 297 (1), C179-C187 (2009).
- Davidson, C. D., Wang, W. Y., Zaimi, I., Jayco, D. K. P., Baker, B. M. Cell force-mediated matrix reorganization underlies multicellular network assembly. Sc Rep. 9 (1), 12 (2019).
- Lyle, K. S., Corleto, J. A., Wittmann, T. Microtubule dynamics regulation contributes to endothelial morphogenesis. BioArchitecture. 2 (6), 220-227 (2012).
- Kniazeva, E., et al. Quantification of local matrix deformations and mechanical properties during capillary morphogenesis in 3D. Integrat Biol. 4 (4), 431-439 (2012).
- Quintanilla, M. A., Hammer, J. A., Beach, J. R. Non-muscle myosin 2 at a glance. J Cell Sci. 136 (5), jcs.260890 (2023).
- Fischer, R. S., Gardel, M., Ma, X., Adelstein, R. S., Waterman, C. M. Local cortical tension by myosin II guides 3D endothelial cell branching. Curr Biol. 19 (3), 260-265 (2009).
- Yoon, C., et al. Myosin IIA–mediated forces regulate multicellular integrity during vascular sprouting. Mol Biol Cell. 30 (16), 1974-1984 (2019).
- Du, Y., et al. Three-dimensional characterization of mechanical interactions between endothelial cells and extracellular matrix during angiogenic sprouting. Sci Rep. 6, 21362 (2016).
- Vaeyens, M. M., et al. Matrix deformations around angiogenic sprouts correlate to sprout dynamics and suggest pulling activity. Angiogenesis. 23 (3), 315-324 (2020).
- Style, R. W., et al. Traction force microscopy in physics and biology. Soft Matter. 10 (23), 4047-4055 (2014).
- Trepat, X., et al. Physical forces during collective cell migration. Nat Phys. 5 (6), 426-430 (2009).
- Santos-Oliveira, P., et al. The force at the tip - modelling tension and proliferation in sprouting angiogenesis. PLoS Comput Biol. 11 (8), e1004436 (2015).
- Boreddy, S. R., Sahu, R. P., Srivastava, S. K. Benzyl isothiocyanate suppresses pancreatic tumor angiogenesis and invasion by inhibiting HIF-α/VEGF/Rho-GTPases: Pivotal role of STAT-3. PLoS One. 6 (10), 0025799 (2011).
- Teng, R. J., Eis, A., Bakhutashvili, I., Arul, N., Konduri, G. G. Increased superoxide production contributes to the impaired angiogenesis of fetal pulmonary arteries with in utero pulmonary hypertension. Am J Physiol Lung Cell Mol Physiol. 297 (1), L184-L195 (2009).
- Costa, G., et al. Asymmetric division coordinates collective cell migration in angiogenesis. Nature Cell Biol. 18 (12), 1292-1301 (2016).
- Slater, K., Partridge, J., Nandivada, H. . Corning tuning the elastic moduli of Corning Matrigel and collagen I 3D matrices by varying the protein concentration. , (2019).
- Lee, J., et al. Effect of chain flexibility on cell adhesion: Semi-flexible model-based analysis of cell adhesion to hydrogels. Sci Rep. 9 (1), 2463 (2019).
- Motte, S., Kaufman, L. J. Strain stiffening in collagen i networks. Biopolymers. 99 (1), 35-46 (2013).
- Butcher, D. T., Alliston, T., Weaver, V. M. A tense situation: Forcing tumour progression. Nat Rev Cancer. 9 (2), 108-122 (2009).
- Artym, V. V., Matsumoto, K. Imaging cells in three-dimensional collagen matrix. Curr Prot Cell Biol. 10, Unit 10.18.1-Unit 10.18.20 (2010).
- Labernadie, A., et al. A mechanically active heterotypic E-cadherin/N-cadherin adhesion enables fibroblasts to drive cancer cell invasion. Nat Cell Biol. 19 (3), 224-237 (2017).
- Bazellières, E., et al. Control of cell-cell forces and collective cell dynamics by the intercellular adhesome. Nat Cell Biol. 17 (4), 409-420 (2015).
- Uroz, M., et al. Traction forces at the cytokinetic ring regulate cell division and polyploidy in the migrating zebrafish epicardium. Nat Mater. 18 (9), 1015-1023 (2019).
- Dong, C., Nastaran, Z., Konstantopoulos, K. . Biomechanics in oncology. , (2018).
- Schwarz, U. S., Soiné, J. R. D. Traction force microscopy on soft elastic substrates: A guide to recent computational advances. Biochim Biophys Acta. 1853 (11), 3095-3104 (2015).
- Toyjanova, J., et al. 3D Viscoelastic traction force microscopy. Soft Matter. 10 (40), 8095-8106 (2014).
- Legant, W. R., et al. Multidimensional traction force microscopy reveals out-of-plane rotational moments about focal adhesions. Proc Natl Acad Sci U S A. 110 (3), 881-886 (2013).
- Steinwachs, J., et al. Three-dimensional force microscopy of cells in biopolymer networks. Nat Meth. 13 (2), 171-176 (2016).
- Franck, C., Maskarinec, S. A., Tirrell, D. A., Ravichandran, G. Three-dimensional traction force microscopy: A new tool for quantifying cell-matrix interactions. PLoS One. 6 (3), e17833 (2011).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados