Method Article
Modelo 2.5D para caracterização mecânica ex vivo da angiogênese germinada em tecido vivo
Neste Artigo
Resumo
A angiogênese germinativa, fundamental para o desenvolvimento e a doença, envolve processos moleculares e mecânicos complexos. Apresentamos um modelo ex vivo 2.5D versátil que analisa o brotamento celular das artérias carótidas suínas, revelando a angiogênese dependente da rigidez e a mecânica celular líder-seguidora distinta. Este modelo auxilia no avanço de estratégias de engenharia de tecidos e abordagens de terapia do câncer.
Resumo
A angiogênese germinativa é a formação de novos vasos sanguíneos a partir de vasculaturas pré-existentes e é de grande importância para processos fisiológicos, como crescimento e reparo de tecidos e processos patológicos, incluindo câncer e metástase. O processo de várias etapas da angiogênese germinativa é um processo molecular e mecanicamente conduzido. Consiste na indução do broto celular pelo fator de crescimento endotelial vascular, seleção de células líderes/seguidoras por meio da sinalização Notch, migração direcionada de células endoteliais e fusão e estabilização de vasos. Uma variedade de modelos de angiogênese de brotamento foi desenvolvida ao longo dos anos para entender melhor os mecanismos subjacentes do brotamento celular. Apesar dos avanços na compreensão dos fatores moleculares da angiogênese germinada, o papel das pistas mecânicas e do condutor mecânico da angiogênese germinativa permanece pouco explorado devido às limitações dos modelos existentes. Neste estudo, projetamos um modelo ex vivo 2.5D que nos permite caracterizar mecanicamente o brotamento celular de uma artéria carótida suína usando microscopia de força de tração. O modelo identifica padrões de força distintos dentro do broto, onde as células líderes exercem forças de tração e as células seguidoras exercem forças de empurrão na matriz. A versatilidade do modelo permite a manipulação de pistas químicas e mecânicas, como rigidez da matriz, aumentando sua relevância para vários microambientes. Aqui, demonstramos que o início da angiogênese germinativa depende da rigidez. O modelo 2.5D apresentado para quantificar as forças de tração celular na angiogênese germinada oferece um método simplificado, mas fisiologicamente relevante, aprimorando nossa compreensão das respostas celulares a pistas mecânicas, o que pode avançar a engenharia de tecidos e estratégias terapêuticas contra a angiogênese tumoral.
Introdução
A angiogênese é o processo de formação de novos vasos sanguíneos a partir de vasos sanguíneos pré-existentes. Esse processo é essencial durante o desenvolvimento embrionário, a cicatrização de feridas e a progressão do câncer, todos associados a alterações biomecânicas no microambiente 1,2,3,4. No início da angiogênese, os tecidos hipóxicos ou lesados liberam o fator de crescimento endotelial vascular (VEGF) que ativará as células endoteliais dos vasos sanguíneos vizinhos para formar brotos endoteliais - onde dois fenótipos líderes e seguidores distintos são adotados através da via de sinalização molecular Notch5. Após a formação de brotos endoteliais, um fenômeno conhecido como angiogênese germinativa, as células líderes degradam a matriz extracelular circundante para migrar coletivamente em direção ao estímulo VEGF sem perder as aderências célula-célula com as células seguidoras 6,7.
Nas últimas décadas, tem havido um número crescente de ensaios de angiogênese germinados descritos que investigam a migração celular coletiva por meio de várias metodologias, cada uma oferecendo benefícios e limitações distintas. Esses ensaios avaliam o movimento coordenado de grupos celulares, como células endoteliais, através de matrizes 3D, permitindo o estudo de comportamentos celulares como brotamento, invasão e migração coletiva em um ambiente controlado 8,9,10. Os ensaios de angiogênese de brotamento in vivo fornecem uma avaliação abrangente dentro de um organismo vivo, capturando interações intrincadas, mas são demorados, caros, propensos a alta variabilidade e difíceis de quantificar11,12. Os ensaios de angiogênese germinada in vitro permitem o controle preciso sobre as condições experimentais com alta reprodutibilidade e quantificação precisa, mas podem não replicar totalmente as complexidades in vivo 11,12,13. Em contraste, os ensaios de angiogênese de brotamento ex vivo, dos quais o ensaio do anel aórtico é o modelo mais amplamente realizado, utilizam tecidos fora do organismo, preservando a relevância fisiológica e evitando complicações in vivo 14,15,16. Apesar de serem tecnicamente desafiadores e às vezes lutarem com a viabilidade do tecido, os modelos ex vivo oferecem um equilíbrio valioso entre complexidade e controle, tornando-os uma abordagem promissora para estudar a angiogênese germinada. Embora esses modelos tenham sido usados extensivamente para estudar os fatores moleculares da angiogênese germinada, o efeito das pistas mecânicas e o comportamento mecânico das células permanecem pouco compreendidos.
A migração multicelular durante a angiogênese germinativa é altamente dependente da mecânica celular, pois as forças contráteis baseadas em actomiosina regulam a invasão das células endoteliais na matriz extracelular circundante 17,18,19,20. Especificamente, observou-se que os motores de miosina II não musculares, as principais máquinas contráteis baseadas em actina dentro da célula21, controlam as forças contráteis celulares durante a angiogênese germinada22,23. A célula líder é provavelmente o elemento gerador de força predominante do broto, uma vez que as deformações da matriz extracelular 3D circundante são significativamente maiores ao redor da célula líder, especificamente saliências celulares ricas em actinapróximas 23,24, em comparação com seus seguidores 22,23,25. Apesar dessa crescente evidência da importância da contratilidade celular na angiogênese germinativa em 3D, falta um método para caracterização espaço-temporal mecânica da mecânica celular da angiogênese germinativa.
O objetivo geral deste estudo é desenvolver um método que permita a caracterização mecânica da migração celular durante a brotação. Ao alcançar a caracterização espaço-temporal das forças mecânicas em um contexto biologicamente relevante, pretendemos fornecer novos insights sobre como a mecânica celular influencia a formação de brotos angiogênicos. Para isso, desenvolvemos um sistema modelo 2.5D criando um hidrogel de poliacrilamida (PAA) 2D, semeando uma folha arterial carotídea nele e cobrindo-o com uma fina camada de gel de colágeno tipo I para estabelecer um ambiente 3D localizado para as células. Os brotos multicelulares migraram para fora da folha arterial na interface PAA-gel de colágeno. A vantagem desse método em relação às técnicas existentes é que o hidrogel de PAA 2D permite análises por microscopia de força de tração (TFM) - uma técnica versátil bem conhecida em que as células aderem a um substrato elástico 2D e deformam o substrato com as forças de tração celular26. Essas deformações podem ser capturadas e as forças de tração celular podem ser calculadas com base nas propriedades mecânicas do substrato26. Ao adaptar o TFM para uso em tecidos vivos ex vivo, pretendemos preencher a lacuna entre o controle in vitro e a relevância in vivo , fornecendo uma compreensão mais abrangente das forças mecânicas durante a angiogênese.
Protocolo
As artérias carótidas suínas foram utilizadas neste protocolo. As artérias carótidas suínas foram colhidas de suínos híbridos da raça Landrace holandesa - com idade entre 5 e 7 meses e peso (vivo) de 80 a 120 kg - obtidos em um abatedouro local. Os protocolos estavam em conformidade com os regulamentos CE 1069/2009 relativos a material animal para matadouros para diagnóstico e pesquisa, supervisionado pelo governo holandês (Ministério Holandês da Agricultura, Natureza e Qualidade Alimentar) e foram aprovados pelas autoridades legais associadas de bem-estar animal (Autoridade de Segurança de Alimentos e Produtos de Consumo). A aprovação ética não era necessária, uma vez que o tecido era colhido de subprodutos de animais já terminados. O tempo entre a morte e o transporte do tecido é de 10 a 25 minutos, dependendo do matadouro.
NOTA: A Tabela de Materiais resume detalhes sobre os materiais, equipamentos e reagentes usados neste protocolo. Os protocolos para amostras 2D e 3D são descritos no Arquivo Suplementar 1.
1. Preparação de substratos de poliacrilamida 2D (PAA)
- Na capela de exaustão, prepare a solução de ligação-silano misturando etanol absoluto 12:1:1 (para síntese), ácido acético e ligação-silano a 4286 μL, 357 μL e 357 μL, respectivamente. Incubar 120 μL/solução de ligante de silano de poço em uma placa de fundo de vidro de 12 poços por 1 h à temperatura ambiente.
CUIDADO: O etanol absoluto é um líquido e vapor altamente inflamável (H225) e causa irritação ocular grave (H319). O ácido acético é um líquido e vapor inflamável (H226) e causa queimaduras graves na pele e danos aos olhos (H314). Use equipamento de proteção individual e trabalhe em uma hotte. - Na hotte, lavar a placa de 12 poços com fundo de vidro 3x com etanol absoluto (industrial) utilizando um borrifador. Descarte o etanol.
- Seque a placa de 12 poços com fundo de vidro com gás nitrogênio. Se um brilho branco aparecer em cima do fundo do vidro, a lavagem não foi suficiente. Lave novamente a placa de fundo de vidro de 12 poços.
- Prepare a mistura de gel de PAA de acordo com as proporções da Tabela 1.
- Adicione PBS a um tubo de microcentrífuga e ressuspenda 40% de acrilamida, 2% de bis-acrilamida e marcadores fluorescentes na mistura de gel. Vortex a solução logo antes da preparação do gel.
- O mais rápido possível, adicione 10% de APS e TEMED à solução e ao vórtice após a adição de cada elemento. Pipetar uma gota de 11,5 μL de mistura de gel no fundo de vidro de cada poço e colocar suavemente uma lamínula de 13 mm no topo da gota.
- Bata suavemente e gire a placa para espalhar uniformemente a mistura de gel sob a lamínula. Se aparecerem bolhas de ar, remova-as levantando suavemente a lamínula. Deixe os géis polimerizarem por 1 h em temperatura ambiente. Verifique a polimerização usando a mistura de gel restante no tubo. Os géis de PAA polimerizados na placa de 12 poços exibirão um halo interno.
CUIDADO: A acrilamida é prejudicial se ingerida ou inalada (H302 + H332), causa irritação na pele (H315), pode causar uma reação alérgica na pele (H317), causa irritação ocular grave (H319), pode causar defeitos genéticos (H340), pode causar câncer (H350), suspeita de prejudicar a fertilidade (H361f) e causa danos aos órgãos por exposição prolongada ou repetida se ingerida (H372). A SAF pode intensificar o fogo (oxidante, H272), prejudicial se ingerido (H302), causar irritação cutânea (H315), causar uma reação alérgica na pele (H317), causar irritação ocular grave (H319), causar sintomas de alergia ou asma ou dificuldades respiratórias se inalado (H334) e pode causar irritação respiratória (H335). O TEMED é um líquido e vapor altamente inflamável (H225), prejudicial se ingerido (H302), causa queimaduras graves na pele e danos aos olhos (H314) e é tóxico se inalado (H331). Use equipamento de proteção individual.
- Após a polimerização, adicione PBS ao poço. Usando uma pinça e/ou uma agulha dobrada, levante e remova suavemente a lamínula. Lave os géis uma vez em PBS.
- Para facilitar o revestimento de colágeno dos géis de PAA, os géis precisam ser funcionalizados usando o reticulador Sulfo-SANPAH. Adicione 75 μL de 1 mg/mL de Sulfo-SANPAH dissolvido em água ultrapura ao gel de PAA e incube por 5 min sob luz UV de 365 nm.
NOTA: Mantenha o Sulfo-SANPAH protegido da luz e adicione água ultrapura logo antes da incubação UV. Uma descoloração é visível de vermelho claro (antes da incubação com luz UV) a vermelho escuro (após a incubação com luz UV).
CUIDADO: Sulfo-SANPAH causa irritação ocular grave (H319). - No gabinete de biossegurança, faça uma rápida lavagem estéril PBS do Sulfo-SANPAH nos géis. Consequentemente, lave os géis PAA funcionalizados 2x em PBS estéril por 10 min.
NOTA: A partir deste ponto do protocolo, todas as etapas serão realizadas em condições estéreis. - Na cabine de biossegurança, prepare uma solução de colágeno tipo IV 0,1 mg/mL em PBS no gelo. Pipetar 50 μL de gotícula de colágeno tipo IV 0,1 mg/mL em cima do gel de PAA funcionalizado e incubar durante a noite a 4 °C.
- Lave os géis 2x em PBS estéril. Retire o PBS e deixe os géis secarem por 5 min.
- Pipetar uma gota de 50 μL de meio de crescimento de células endoteliais (ECG) sobre os géis e incubar por pelo menos 1 h a 37 ° C e 5% de CO2.
NOTA: A incubação dos géis no meio de ECG melhora a ligação de células e tecidos aos géis.
2. Preparação da solução de Krebs modificada para transporte
NOTA: Prepare a solução de Krebs modificada fresca. Neste protocolo, a solução de Krebs modificada é preparada 1 dia antes da coleta de tecido.
- Esterilize uma garrafa de transporte em autoclavagem. Encha uma garrafa de vidro com 90% (315 mL) do volume total de transporte necessário (350 mL) de água ultrapura. Certifique-se de que a temperatura da água seja de 15-20 °C.
- Enquanto mexe suavemente a água usando um ímã de agitação, adicione 9.6 g / L (3.36 g) de tampão Krebs-Henseleit e mexa até dissolver. Utilizando uma pipeta de Pasteur, enxaguar o recipiente de pesagem com um pequeno volume de solução para incluir todos os vestígios de pó na solução. Não aqueça a solução.
- Enquanto mexe, adicione 0,373 g / L (130,55 mg) de cloreto de cálcio (CaCl2) à solução e mexa até dissolver. Lave o recipiente de pesagem com um pequeno volume de solução.
CUIDADO: H319 causa irritação ocular grave. - Enquanto mexe, adicione 2,1 g/L (0,63 g) de bicarbonato de sódio (NaHCO3) à solução e mexa até dissolver. Lave o recipiente de pesagem com um pequeno volume de solução.
- Enquanto agita, adicione 1 x 10-1 mM (13,15 mg) de papaverina à solução e mexa até dissolver. Lave o recipiente de pesagem com um pequeno volume de solução.
NOTA: A papaverina é um relaxante muscular liso usado para prevenir a vasoconstrição excessiva causada pelo corte e manuseio do vaso durante a colheita.
CUIDADO: H301 é tóxico se ingerido. - Na hotte, adicionar 0,05 mM (1,2 μL) de 2-mercaptoetanol à solução e agitar.
NOTA: O 2-mercaptoetanol é usado para manter um baixo nível de radicais de oxigênio.
CUIDADO: O 2-mercaptoetanol é tóxico por ingestão ou inalação (H301 + H331), fatal em contato com a pele (H310), irritação da pele (H315), pode causar uma reação alérgica na pele (H317), causa lesões oculares graves (H318), suspeita de danificar o nascituro (H361d), pode causar danos aos órgãos por exposição prolongada ou repetida se ingerido (H373) e muito tóxico para os organismos aquáticos com efeitos duradouros (H410). Use equipamento de proteção individual e trabalhe em uma hotte. - Enquanto mexe, ajuste o pH para 7,2 adicionando 1 N (1 M) HCl ou 1 N (1 M) NaOH. O objetivo final do pH é 7,4, mas o pH pode subir 0,1-0,3 unidades de pH durante a filtração.
CUIDADO: HCl contém gás sob pressão; pode explodir se aquecido (H280), causar queimaduras graves na pele e danos aos olhos (H314) e é tóxico se inalado (H331). Use equipamento de proteção individual. - Continue trabalhando em um gabinete de biossegurança. Adicione 10% de água ultrapura para levar a solução ao volume final.
- Esterilizar imediatamente a solução por filtração utilizando uma membrana com porosidade de 0,22 μm. Dispense a solução estéril diretamente em um frasco estéril. Adicione 7 mL de penicilina / estreptomiocina a 2% (P / S) à solução.
NOTA: Durante o transporte, 2% de P/S é adicionado ao meio para remover todas as bactérias. Durante a cultura de tecidos, 1% de P/S é adicionado ao meio. - Conservar a solução de Krebs modificada a 4 °C até à colheita de tecidos.
3. Colheita de tecidos
- Dependendo do matadouro, atordoe os porcos por meio de choque elétrico ou CO2. Posteriormente, pendure os porcos de um membro posterior, exsanguinados e declarados mortos.
- Antes de entrar no processo de abate limpo, escalde os porcos para depilação, chamusque para remover os últimos pelos e esterilize a parte externa da carcaça.
- Eviscere os porcos fazendo uma incisão na linha média ao longo do abdômen e removendo cuidadosamente os órgãos internos. Dependendo do matadouro, a artéria carótida ainda estava presa à carcaça do porco, ou a artéria carótida já estava removida da carcaça com a arrancada dos órgãos torácicos.
- Usando uma faca afiada, colha a artéria carótida com algum tecido circundante remanescente da carcaça ou do tecido da área da garganta sem tocar na artéria ou aplicar tensão mecânica.
- Coloque o tecido contendo a artéria carótida no frasco de transporte contendo solução estéril modificada de Krebs, abrindo brevemente o frasco. Inverta o frasco uma vez para garantir que todo o tecido seja coberto com solução de Krebs. Transporte os tecidos em gelo para o laboratório. O transporte demora aproximadamente 30-45 min.
4. Dissecção de tecido
- Esterilize a pinça cirúrgica do equipamento de dissecação (manuseio brusco), a pinça de ponta redonda revestida com epóxi (manuseio fino), o bisturi, a pinça e as lamínulas por autoclavagem.
- Prepare o gabinete de biossegurança antes da colheita/transporte de tecidos. Cubra a área de dissecção com uma folha de cortina cirúrgica. Monte o equipamento de dissecção (em tubos estéreis de 50 mL), lâminas cirúrgicas e lamínulas estéreis. Encha duas placas de Petri grandes com PBS estéril para preparar uma bandeja de dissecação. Incubar a cultura de tecidos numa pequena placa de Petri com meio de ECG a 37 °C.
- Após o transporte do tecido, dentro do gabinete de biossegurança, transfira a artéria carótida do frasco de transporte (preenchido com solução de Krebs modificada) para uma grande placa de Petri preenchida com PBS estéril usando a pinça cirúrgica.
- Remova o excesso de tecido ao redor da artéria carótida usando a pinça cirúrgica e o bisturi para criar uma visão clara da artéria carótida.
- Remova 2-3 cm de ambas as extremidades da artéria carótida para eliminar áreas próximas às bifurcações das artérias cortando com um bisturi. Remova a fáscia arterial ao redor da artéria carótida usando a pinça de ponta redonda fina.
NOTA: Renovar a lâmina do bisturi ajuda a cortar a fáscia com mais precisão. - Transfira a artéria carótida para uma nova placa de Petri grande cheia de PBS estéril. Remova a fina camada restante da fáscia arterial o máximo possível.
NOTA: Quanto mais tempo a artéria carótida estiver na PBS, mais pedaços de fáscia tendem a se soltar. A remoção da fáscia é importante, pois obstruirá a visão durante a microscopia. - Corte a artéria carótida limpa em anéis de aproximadamente 2 mm de largura. Transferir os anéis da artéria carótida para a pequena placa de Petri pré-aquecida cheia de meio de ECG e manter a 37 °C.
5. Semeadura de tecidos
NOTA: A fixação do tecido foi testada sem lamínula, uma lamínula estéril não tratada ou uma lamínula estéril tratada com plurônico (1% p / v plurônico em PBS, lamínulas incubadas durante a noite e lavadas em água ultrapura estéril antes do uso) de tamanhos diferentes no topo da lâmina arterial após a semeadura no hidrogel PAA.
- Remova as gotículas médias de ECG dos géis. Transfira um anel da artéria carótida para uma placa de Petri média limpa cheia de PBS estéril.
- Usando a pinça de ponta redonda e o bisturi, corte o anel ao meio. Disseque meio anel em folhas de aproximadamente 2 mm de largura para criar folhas arteriais com dimensões de 2 x 2 mm. Preste atenção à orientação do lado endotelial da folha arterial. A curvatura e alguma fáscia remanescente da folha arterial podem ajudar a determinar essa orientação.
NOTA: O tamanho dos anéis da artéria carótida pode variar. Anéis grandes rendem aproximadamente 6-8 folhas, enquanto anéis pequenos rendem 3-4 folhas. Anéis grandes têm fixação aprimorada devido à menor curvatura na lâmina arterial. - Usando a pinça de ponta redonda, pegue a lâmina arterial na parte de trás da folha (fora da parede do vaso) e coloque a folha na borda do gel PAA com o revestimento interno endotelial voltado para o substrato PAA para evitar danificar o substrato PAA ao colocar a folha.
- Usando a pinça ou pinça, mova a lâmina arterial muito suavemente para o centro do hidrogel PAA sem tocar no gel. Coloque a lâmina arterial na borda do gel (o tecido pode grudar na pinça ou pinça).
NOTA: Pequenos remanescentes de fáscia arterial na parte externa da parede do vaso criam uma alça fácil para agarrar a folha arterial, enquanto o revestimento interno endotelial da parede do vaso é muito liso. - Adicione 50 μL de meio de ECG em cima da lâmina arterial colocada no substrato do PAA. Ty para manter a gota de meio de ECG em cima do gel.
- Usando a pinça de ponta redonda, coloque uma lamínula seca de 13 mm em cima da lâmina arterial no substrato PAA em meio. Use a borda interna do fundo de vidro para abaixar suavemente a lamínula até que ela toque a gota média e a mídia se espalhe por baixo dela.
NOTA: As lamínulas de 13 mm são vantajosas porque correspondem ao tamanho da parede interna da placa de poço do fundo de vidro. Se você abaixar a lamínula muito rápido, o tecido se moverá para a borda da lamínula. - Deixe o tecido se fixar a 37 °C e 5% de CO2 por 5 h antes de adicionar 1 mL de meio de ECG a cada poço. Colocar a lâmina arterial sobre o substrato de PAA a 37 °C e 5% de CO2 durante 24 h.
6. Criação do modelo 2.5D
- Autoclave uma pinça de ponta redonda para remoção de lamínula. Preparar NaOH 1 M em água ultrapura, esterilizar por filtração através de um filtro de poros de 0,22 μm e conservar a 4 °C.
NOTA: 1 M NaOH pode ser reutilizado em experimentos futuros. - Levantando a lamínula de 13 mm da lâmina arterial, com a ajuda de uma agulha afiada estéril com a ponta dobrada, e retire-a com muita delitura. Use o anel interno do fundo de vidro como suporte para levantar e remover a lamínula. Qualquer movimento lateral aumenta o risco de descolamento da lâmina arterial do substrato do PAA.
- Em um tubo de microcentrífuga estéril, prepare a mistura de colágeno tipo I de acordo com a Tabela 2 no gelo. Após a adição de colágeno tipo I e NaOH à solução, ressuspenda muito bem e inverta o tubo uma vez para garantir que a mistura seja homogeneamente misturada.
NOTA: Após a adição de colágeno tipo I à mistura, a mistura de cor rosa claro torna-se incolor. Após a adição de NaOH, a mistura incolor torna-se rosa claro. - Remova o meio do poço usando um sistema de sucção a vácuo. Remova o meio ao redor do tecido o máximo possível sem tocar no tecido.
NOTA: Muito meio ao redor da folha arterial impedirá que o gel tipo colágeno I a envolva. - Adicione uma gota de 10 μL de mistura de gel de colágeno tipo I no topo de cada folha arterial e deixe o gel de colágeno tipo I polimerizar por 1 h a 37 ° C e 5% de CO2.
- Muito delicadamente, adicione 1 mL de meio de ECG pré-aquecido a cada poço e coloque as amostras a 37 ° C e 5% de CO2.
7. Imagem de células vivas
NOTA: A imagem de células vivas foi realizada usando um microscópio de epifluorescência Leica DMi8 ou Nikon Ti2 Eclipse equipado com controle térmico, de CO2 e de umidade e controlado usando o software Leica ou NIS. O controle de foco adaptativo (Leica) e o sistema de foco perfeito (Nikon) foram usados para manter o foco no tempo.
- Após 24 h de cultura no sistema 2.5D, verificar a angiogênese germinada. Algumas folhas arteriais já começam a formar brotos celulares após 24 h de cultivo, enquanto outras folhas precisam de mais tempo para iniciar a germinação endotelial.
- Se tiver sido iniciada a angiogénese germinativa, refrescar o meio de ECG e colocar a placa de 12 poços no suporte da platina dentro da caixa de incubação pré-aquecida a 37 °C do microscópio.
- Escolha o objetivo de interesse. Diferentes objetivos foram utilizados neste estudo, use um objetivo de 10x para criar uma visão global da formação de brotos celulares e um objetivo de 20x para realizar o TFM.
- Defina o(s) canal(is) de interesse. Para fins de TFM, visualize os brotos celulares usando contraste de fase e visualize os marcadores fluorescentes (vermelho escuro) no substrato PAA usando um canal fluorescente em um comprimento de onda de 660 nm.
- Selecione (várias) regiões de interesse e encontre o plano de foco. Ligue o sistema de foco (controle de foco adaptável na Leica DMi8 ou sistema de foco perfeito na Nikon Ti2 Eclipse) para garantir um foco estável ao longo da imagem em timelapse.
- Defina o lapso de tempo de interesse selecionando um intervalo de tempo e uma duração de lapso de tempo. Diferentes intervalos de tempo (5-20 min) e comprimentos de lapso de tempo (4-24 h) foram usados para diferentes propósitos neste estudo.
- Para fins de TFM, após a imagem em timelapse, remova as células que crescem adicionando várias gotículas de SDS a 5% em água ultrapura e aguarde alguns minutos. Para cada posição selecionada, pegue uma pilha z (uma altura z de 2 μm foi definida com um tamanho de passo de 0,2 μm) dos marcadores fluorescentes no substrato PAA para obter um estado relaxado dos marcadores fluorescentes como imagem de referência.
NOTA: A imagem da pilha Z é realizada porque as células podem puxar ou empurrar os marcadores fluorescentes na direção z.
8. Análise de microscopia de força de tração
- Alinhe e corte imagens de lapso de tempo em relação à melhor imagem de referência para uma análise precisa.
- Para medir deslocamentos de marcadores fluorescentes no hidrogel PAA, execute a Velocimetria de Imagem de Partículas (PIV) entre qualquer imagem de lapso de tempo e a imagem de referência usando códigos MatLab personalizados. Dentro da análise PIV, divida as imagens em janelas de interrogação de 32 por 32 pixels com sobreposição de 0,5.
- Calcule as forças de tração dos deslocamentos dos marcadores fluorescentes por microscopia de tração baseada em transformada de Fourier de um gel infinito com uma espessura de gel finita usando a equação de Boussinesq27.
Resultados
Por meio do protocolo descrito, podemos induzir angiogênese ex vivo brotando de uma artéria carótida suína em cima de um hidrogel 2D PAA coberto com uma fina camada de gel de colágeno tipo I, criando assim um modelo de angiogênese 2,5D ex vivo . Este modelo nos permite realizar TFM convencional e medir as forças de tração celular da angiogênese germinada na interface do gel PAA no espaço e no tempo.
Para estabelecer o modelo 2.5D, primeiro preparamos um hidrogel de poliacrilamida (PAA) 2D embebido com marcadores fluorescentes, seguido de revestimento noturno com colágeno tipo IV (d-1 a d0). No dia 0 (d0), uma lâmina arterial carótida foi colocada no hidrogel revestido com colágeno IV e deixada se fixar durante a noite (d0 a d1). Posteriormente, uma fina camada de gel de colágeno tipo I foi aplicada sobre a lâmina arterial, após o que a imagem foi iniciada no dia 1 (d1) para monitorar a germinação celular e rastrear marcadores fluorescentes para análise mecânica (d1 a d2). Para verificar a angiogênese germinativa no modelo 2.5D, realizamos a angiogênese convencional ex vivo em um gel de colágeno tipo I 3D em paralelo. Para isso, foi preparada uma fina camada de gel de colágeno tipo I, seguida da semeadura da lâmina arterial carotídea e, posteriormente, coberta com uma camada adicional de colágeno (d0). A brotação angiogênica foi monitorada ao longo do tempo. Além disso, nos esforçamos para induzir a angiogênese germinada em 2D para diminuir ainda mais a complexidade do modelo. O procedimento experimental espelhou o do modelo 2.5D, com a principal diferença sendo a exclusão da camada superior de gel de colágeno tipo I. Uma visão geral dos três modelos, incluindo seus procedimentos experimentais, é descrita na Figura 1. As artérias carótidas foram colhidas de porcos do matadouro local e transportadas em solução fresca estéril de Krebs. Dentro do gabinete de biossegurança, o tecido excessivo ao redor da artéria carótida foi removido para garantir que não houvesse comprometimento visual da angiogênese germinada durante a imagem de timelapse ao vivo (Figura 2A-E). Uma vez que a artéria estava limpa de excesso de tecido, a artéria foi cortada em anéis arteriais de 2 mm de largura e os anéis foram cortados em lâminas arteriais com uma dimensão de 2 x 2 mm (Figura 2F).
Para garantir a angiogênese germinada no topo da interface do hidrogel de PAA dentro do modelo 2.5D e 2D, semeamos as folhas arteriais com o lado da célula endotelial interna voltado para o hidrogel de PAA revestido com colágeno tipo IV e as deixamos se fixar. Para otimizar a fixação da lâmina arterial ao hidrogel de PAA, testamos o efeito da adição de uma lamínula de vidro de 12 mm revestida com anti-incrustante no topo da lâmina arterial. Após 24 h, a lamínula foi removida e a eficiência de inserção foi medida por meio da porcentagem de lâminas arteriais aderidas ao hidrogel de PAA. Observamos que a adição de uma lamínula de vidro - independente do revestimento anti-incrustante - aumentou a eficiência de fixação das lâminas arteriais sobre o hidrogel de PAA em comparação com a ausência de lamínula (Figura 3A-D). Em seguida, testamos o efeito do diâmetro (12 ou 13 mm) da lamínula de vidro na eficiência de fixação da lâmina arterial, enquanto o poço interno da placa foi de 14 mm. Observamos que uma lamínula de 13 mm aumenta a eficiência de fixação das lâminas arteriais no topo do hidrogel de PAA em comparação com uma lamínula de 12 mm (Figura 3E-G), uma vez que as forças de cisalhamento durante a remoção da lamínula são minimizadas. Continuamos usando uma lamínula de 13 mm não tratada para fixação da folha arterial ao hidrogel de PAA nos modelos 2.5D e 2D.
Depois que a lâmina arterial foi anexada ao hidrogel de PAA, adicionamos uma fina camada de gel de colágeno tipo I no topo da lâmina arterial para criar um ambiente 2,5D. Cultivamos as amostras por 5 dias e examinamos as amostras quanto à angiogênese germinada. Observamos a formação de brotos celulares no modelo 3D (Figura 4A), consistente com a angiogênese de brotamento ex vivo relatada anteriormente na literatura 28,29,30. Dentro do modelo 2.5D, observamos uma organização semelhante de brotos celulares em comparação com o modelo 3D (Figura 4B). Os brotos celulares foram formados em várias alturas (Vídeo 1), inclusive na interface PAA. Além disso, a angiogênese germinativa é caracterizada por alta proliferação de células líderes e seguidoras, um fenômeno que observamos durante a germinação dentro do modelo 2.5D (Vídeo 2). Ao cultivar uma folha arterial em 2D, células de diferentes origens (Figura Suplementar 1) migram como monocamadas para fora do tecido, faltando, portanto, a organização dos brotos celulares (Figura 4C). Como não observamos angiogênese germinativa no modelo 2D, excluímos esse modelo das análises subsequentes. Ao todo, a folha arterial precisa de um ambiente 3D local para induzir a angiogênese germinativa, mostrando o potencial do modelo ex vivo 2.5D de angiogênese germinativa.
Além disso, o sistema de modelo 2.5D é um sistema versátil que permite aos usuários examinar o efeito de pistas mecânicas do microambiente celular, por exemplo, rigidez da matriz. A rigidez da matriz de um hidrogel de colágeno tipo I 3D - o hidrogel comumente usado para angiogênese de brotamento ex vivo - depende da concentração da proteína ECM, onde um aumento na concentração de proteína se correlaciona com um aumento na rigidez da matriz32. A faixa típica de concentração de colágeno tipo I para fazer este hidrogel 3D induzir a angiogênese germinativa é de 1-4 mg / mL, correspondendo a uma rigidez da matriz de 1 Pa a 1 kPa 32,33,34. Concentrações mais baixas podem ser muito suaves para fornecer suporte estrutural, enquanto concentrações mais altas podem inibir o movimento celular. A rigidez fisiológica do tecido endotelial é de 1 kPa35, que pode ser imitada com um hidrogel de colágeno 3D tipo I. No entanto, a formação e progressão do tumor estão associadas ao enrijecimento do tecido4, enfatizando a necessidade de um modelo que possa alcançar uma maior rigidez da matriz para estudar a angiogênese tumoral. A rigidez do substrato dos hidrogéis de PAA - a rigidez detectada pelas células endoteliais da folha arterial - pode ser facilmente ajustada na faixa de 1 a dezenas de kPa. Aqui, examinamos o efeito da rigidez do substrato de PAA no início da angiogênese germinativa por meio da porcentagem de amostras que iniciaram a formação de brotos celulares no dia seguinte à adição da camada de colágeno tipo I. Observamos que mais lâminas arteriais mostraram sinais precoces de brotos celulares quando cultivadas em um hidrogel de PAA fisiológico macio (1 kPa) em comparação com um hidrogel de PAA patológico rígido (12 kPa) (Figura 5), mostrando o potencial deste modelo para estudar o efeito da rigidez da matriz na angiogênese germinativa. Além da rigidez do substrato ajustável, esses substratos permitem a modulação sistemática de outras pistas mecânicas (por exemplo, composição e densidade da matriz), bem como pistas químicas (por exemplo, inibição de reguladores moleculares pelo condicionamento do meio de cultura), demonstrando a versatilidade deste modelo de angiogênese de brotamento ex vivo 2.5D.
Para quantificar a mecânica celular na angiogênese de brotamento, realizamos microscopia de força de tração convencional (TFM) em brotos celulares que se formaram na interface PAA 2D. Um dia após a adição da camada de colágeno tipo I, realizamos imagens de células vivas das células (Figura 6A) e dos marcadores fluorescentes embebidos no hidrogel de PAA. Os deslocamentos dos marcadores fluorescentes foram medidos usando a velocimetria de imagem de partículas (Figura 6B) e as trações celulares foram calculadas usando as propriedades mecânicas do hidrogel de PAA (Figura 6C). Com este modelo ex vivo 2.5D, observamos inicialmente forças de tração nas saliências da célula líder de um broto celular, seguidas por forças de empurrão ao longo do broto celular - tanto na parte traseira da célula líder quanto nas células seguidoras (Figura 6C).
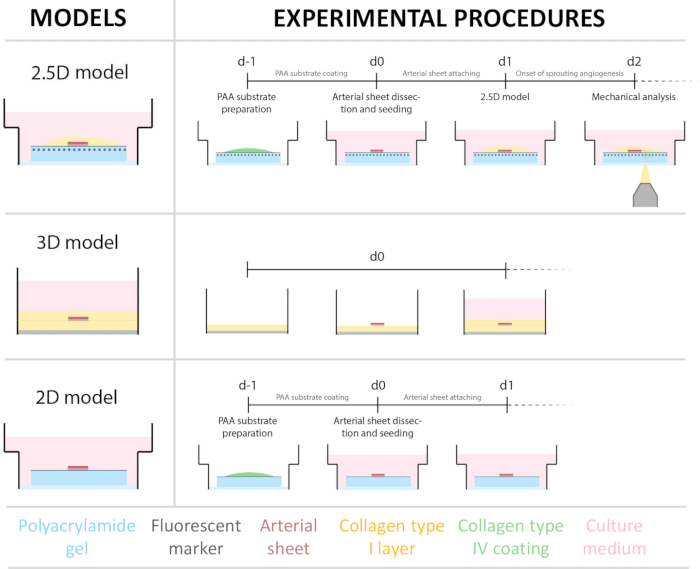
Figura 1: Modelos experimentais e procedimentos. (esquerda) Modelos experimentais testados. O modelo 2.5D representa uma folha arterial colocada em cima de um hidrogel de poliacrilamida (PAA) revestido com colágeno tipo IV e coberto com uma fina camada de hidrogel de colágeno tipo I. O modelo 3D representa uma folha arterial imprensada entre duas camadas de gel de colágeno tipo I, um sistema que é conhecido por induzir a angiogênese germinativa36. O modelo 2D representa uma folha arterial colocada em cima de um hidrogel PAA revestido com colágeno tipo IV plano. (direita) Procedimentos experimentais para modelos correspondentes. Para os modelos 2D e 2,5D, um hidrogel de PAA foi preparado um dia antes da semeadura (d-1) e o revestimento de colágeno tipo IV foi realizado durante a noite. A artéria carótida foi colhida de porcos, dissecada em folhas arteriais, semeada em cima do hidrogel no dia 0 (d0) e deixada para se fixar durante a noite (d1). Para amostras 2,5D, uma fina camada de gel de colágeno tipo I foi colocada no topo da lâmina arterial. A análise mecânica foi realizada após o início da brotação no dia 2 (d2). Para amostras 2D, o meio foi atualizado no dia 1 (d1). Para o modelo 3D, uma camada de gel de colágeno tipo I foi preparada imediatamente antes da semeadura no dia 0 (d0). A folha arterial foi semeada no topo da camada de colágeno tipo I e coberta com uma segunda camada de colágeno tipo I. Clique aqui para ver uma versão maior desta figura.
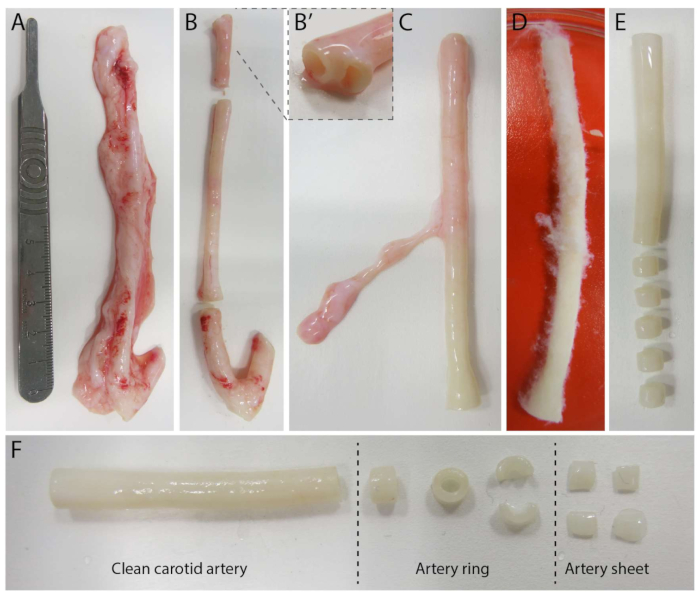
Figura 2: Etapas de dissecção da artéria carótida (d0). (A) As artérias carótidas de aproximadamente 10 cm de comprimento foram colhidas de porcos do matadouro local. (B) Excesso de tecido e aproximadamente 2 cm da borda (para evitar ficar muito próximo dos pontos de ramificação, (B') foram descartados. (CE) A artéria carótida foi esfolada (C), embebida em PBS (D) e todo o tecido restante foi esfolado para garantir uma visibilidade clara durante a imagem (E). (F) A artéria carótida limpa é cortada em anéis arteriais com uma largura aproximada de 2 mm. Cada anel é cortado em 4 folhas arteriais com uma dimensão de aproximadamente 2 x 2 mm. Clique aqui para ver uma versão maior desta figura.
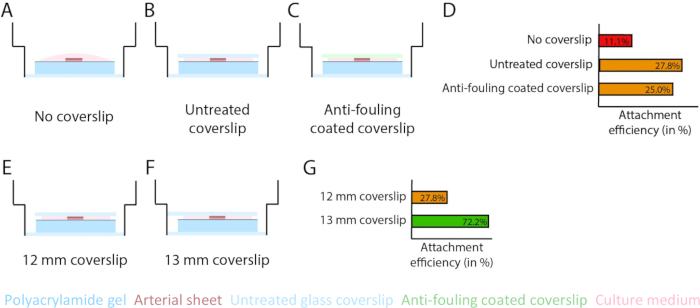
Figura 3: A eficiência de fixação da folha arterial aumenta usando uma lamínula de vidro de 13 mm (d1). (AD) Efeito de uma lamínula de vidro na fixação da folha arterial ao hidrogel de poliacrilamida (PAA). Foi feita uma comparação entre nenhuma lamínula de vidro (A), uma lamínula de vidro não tratada (B) e uma lamínula de vidro revestida anti-incrustante usando Pluronic F127 (C). A eficiência de fixação foi medida pelo número de folhas arteriais que se ligaram ao hidrogel de PAA após a remoção da lamínula em comparação com o número total de amostras: sem lamínula (4 de 36), lamínula não tratada (10 de 36) e lamínula revestida anti-incrustante (9 de 36; (EG) Efeito do tamanho de uma lamínula de vidro não tratada na fixação da lâmina arterial ao hidrogel de PAA. Foi feita uma comparação entre uma lamínula de vidro de 12 mm não tratada (E) e uma lamínula de vidro de 13 mm não tratada (F) dentro de um poço de 14 mm. A eficiência de inserção foi medida pelo número de lâminas arteriais aderidas ao hidrogel de PAA após a remoção da lamínula em comparação com o número total de amostras: lamínula de 12 mm (10 de 36) e lamínula de 13 mm (52 de 72; G). Clique aqui para ver uma versão maior desta figura.
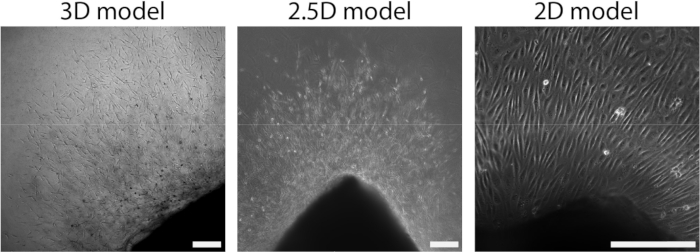
Figura 4: A dimensionalidade do modelo define a organização durante o crescimento celular (d2+). As células migram para fora do tecido em uma organização de broto no modelo 3D (à esquerda), semelhante ao modelo 2,5D (meio). As células migram para fora do tecido em uma organização de monocamada na configuração 2D (à direita). A barra de escala representa 250 μm. Clique aqui para ver uma versão maior desta figura.

Figura 5: O início da germinação endotelial no modelo 2.5D depende da rigidez do substrato de hidrogel de poliacrilamida (d2). (AB) Lâmina arterial coberta com uma fina camada de gel de colágeno tipo I em cima de um hidrogel de poliacrilamida (PAA) macio (A; 1 kPa) ou rígido (B; 12 kPa) no dia 2 do protocolo (1 dia após a adição da camada de gel de colágeno tipo I). (C) O início da brotação foi medido pelo número de folhas arteriais que já mostram sinais de crescimento celular em comparação com o número total de amostras: macias (7 de 24) e rígidas (3 de 24). A barra de escala representa 1 mm (A, B) ou 500 μm (A', B'). Clique aqui para ver uma versão maior desta figura.

Figura 6: Caracterização da força de tração durante a angiogênese inicial da brotação. As células de imagem no tempo (0-4 h) são exibidas na linha superior. Os deslocamentos dos marcadores fluorescentes correspondentes (0-2 μm) e trações celulares (0-50 Pa) em um substrato de hidrogel PAA de 1 kPa são exibidos na linha do meio e na linha inferior, respectivamente. Os zoom-ins de trações celulares em 0 h, 2 h e 4 h são exibidos em laranja. Clique aqui para ver uma versão maior desta figura.
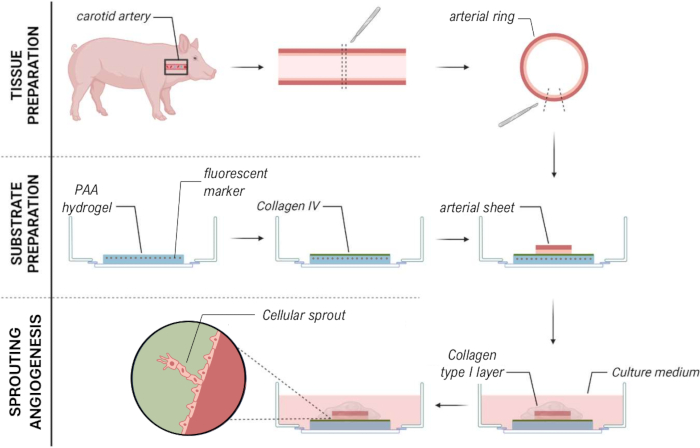
Figura 7: Método modelo de angiogênese de brotamento ex vivo 2.5D que permite a caracterização mecânica de brotos celulares. Clique aqui para ver uma versão maior desta figura.
| 1 kPa | 12 kPa | |
| PBS | 435 μL | 373,7 μL |
| 40% de acrilamida | 50 μL | 93,8 μL |
| 2% de bis-acrilamida | 7,5 μL | 25 μL |
| Marcador fluorescente (vermelho escuro) | 5 μL | 5 μL |
| 10% APS | 2,5 μL | 2,5 μL |
| TEMED | 0,25 μL | 0,25 μL |
Tabela 1: Proporções de mistura de gel PAA.
| fórmula | Volume por placa de 12 poços (130 μL) | |
| Meio de ECG | VECG=Vfinal-V col1-V NaOH | 82,16 μL |
| Colágeno tipo I | Vcol1=(Vfinal*Cfinal)/C stock | 46 μL |
| NaOH | VNaOH = 0,04 * Vcol1 | 1,84 μL |
Tabela 2: Volumes de mistura de gel de colágeno tipo I usando abreviações de volume (V) e concentração (C).
Vídeo 1: Imagem em timelapse da formação de brotos celulares dentro do modelo 2.5D. As células foram fotografadas usando imagens de contraste de fase durante um período de 22 horas com um intervalo de tempo de 17,5 minutos. Os brotos celulares foram formados em várias alturas dentro da camada de gel de colágeno tipo I, conforme observado pelos diferentes planos focais. A barra de escala representa 100 μm. Clique aqui para baixar este vídeo.
Vídeo 2: Alta taxa de proliferação de células dentro de brotos celulares dentro do modelo 2.5D. As células foram fotografadas usando imagens de contraste de fase durante um período de 22 h com um intervalo de tempo de 17,5 minutos. Tanto os líderes quanto as células seguidoras proliferam durante a imagem de lapso de tempo. A barra de escala representa 100 μm. Clique aqui para baixar este vídeo.
Figura suplementar 1: Fenótipo celular em modelo 2D (d2+) por coloração por imunofluorescência. (A) Coloração de imunofluorescência (IF) do núcleo celular (DAPI), marcador de células endoteliais (CD31) e marcador de fibroblastos (actina de músculo liso alfa; α-SMA). (B) Coloração IF do núcleo celular (DAPI), marcador de células endoteliais (CD31) e marcador de células musculares lisas (calponina). A barra de escala representa 100 μm. Clique aqui para baixar esta figura.
Arquivo Suplementar 1: Protocolo de coloração por imunofluorescência. Clique aqui para baixar este arquivo.
Discussão
A angiogênese germinativa - a formação de novos vasos sanguíneos - é um processo complexo regulado por mecanismos moleculares e mecânicos. Considerando que muitos modelos 3D foram desenvolvidos nas últimas décadas para estudar os drivers moleculares (por exemplo, VEGF e sinalização Notch) da angiogênese germinada, pouco se sabe sobre a mecânica celular devido às limitações do modelo. A Microscopia de Força de Tração (TFM) é uma técnica bem conhecida para quantificação de forças celulares no espaço e no tempo, onde deformações de substrato 2D são convertidas em trações celulares. Portanto, neste protocolo, descrevemos um modelo ex vivo 2.5D, o que significa que fornecemos localmente às células um ambiente 3D, preservando a simplicidade de um modelo 2D que permite a quantificação das forças de tração durante a angiogênese germinada (Figura 1). Para tanto, preparamos e semeamos uma lâmina arterial suína (lado endotelial para baixo; Figura 2) em cima de um hidrogel de poliacrilamida revestido com colágeno tipo IV (PAA) contendo marcadores fluorescentes. Após a fixação da lâmina arterial com lamínula de vidro de 13 mm (Figura 3), adicionamos uma fina camada de hidrogel de colágeno tipo I que permite a formação de brotos celulares (Figura 4). Usando este modelo, mostramos que durante a germinação celular 22,23,24,25, as células líderes exercem forças de tração (como foi observado na literatura 19,20,21,22), mas também que as células seguidoras exercem forças de empurrão (Figura 6). A resolução do campo de tração obtida através de nosso protocolo permite análises quantitativas da cinemática e dinâmica celular tanto no tempo quanto no espaço, típicas de trabalhos que recorrem à microscopia de força de tração em substratos compatíveis 37,38,39.
Além disso, demonstramos a versatilidade deste modelo ex vivo 2.5D de angiogênese germinada, alterando as pistas mecânicas do microambiente (Figura 5). Enquanto a angiogênese germinada normalmente ocorre com uma rigidez fisiológica de 1 kPa35 - que pode ser imitada por um hidrogel de colágeno tipo I 3D, a angiogênese tumoral ocorre em um microambiente enrijecido40 - que está além da faixa de rigidez dos hidrogéis convencionais de colágeno tipo I 3D. A rigidez do substrato PAA pode ser facilmente ajustada alterando a proporção de reticuladores para gerar uma rigidez maior do substrato. Usando este modelo, revelamos que o início da angiogênese germinativa é dependente da rigidez. Esses substratos não apenas oferecem rigidez ajustável, mas também permitem a modulação sistemática de várias outras pistas mecânicas, por exemplo, composição e densidade da matriz. Além disso, este modelo nos permite estudar a mecânica celular enquanto manipulamos reguladores moleculares usando o condicionamento do meio (por exemplo, o efeito da inibição na sinalização Notch na mecânica celular) para entender os mecanismos mecanobiológicos da angiogênese germinada. Isso demonstra a utilidade deste modelo ex vivo 2.5D de angiogênese germinada em uma amostra de diferentes microambientes.
O modelo que apresentamos faz uso do TFM 2D convencional, que oferece análise mais simples, maior resolução espacial e implementação mais fácil em comparação com o TFM 3D (viscoelástico), tornando-o mais acessível e econômico 26,41. No entanto, o TFM 3D (viscoelástico) fornece um ambiente fisiologicamente mais relevante, capturando forças de tração em todas as três dimensões e levando em conta as complexas propriedades mecânicas da matriz extracelular, oferecendo insights mais profundos sobre o comportamento celular em um contexto mais realista42 , 43 , 44 , 45. Esse efeito de dimensionalidade também aponta para uma limitação desse modelo 2.5D. Usamos o TFM 2D na suposição de que as células estão migrando em um substrato 2D. Embora este seja o caso neste modelo 2.5D, as células estão em um ambiente 3D local e, portanto, aderem à camada de gel de colágeno tipo I e exercem forças nessa camada de gel. A suposição que adotamos nesta análise é que a camada de gel de colágeno tipo I não é acoplada mecanicamente (sem transmissão de força entre esses dois hidrogéis) à interface PAA devido à diferença de ordem de magnitude na rigidez da matriz, minimizando, portanto, o efeito das forças celulares na camada de colágeno tipo I. Isso torna a caracterização da força usando o modelo 2.5D ex vivo uma representação simplificada das forças geradas pelas células. Além disso, este protocolo requer precisão e é extenso com várias etapas em que as amostras podem ser perdidas, por exemplo, (i) dificuldades de visibilidade celular devido ao excesso de tecido ao redor da lâmina arterial (Figura 2), (ii) uma em cada três amostras não se liga ao substrato PAA (Figura 3), (iii) nem todas as amostras iniciarão a formação de brotos celulares (Figura 5), (iv) brotos celulares não se formam no substrato de PAA e (v) marcadores fluorescentes fora de foco ao usar uma folha arterial espessa em cima de um hidrogel de PAA de baixa rigidez. Portanto, otimizamos esse método para uma placa de 12 poços para garantir muitas regiões de interesse para realizar análises mecânicas da angiogênese germinada.
Em conclusão, a abordagem apresentada para a caracterização simplificada das forças de tração celular da angiogênese germinativa de uma folha arterial suína viva usando um modelo 2.5D (Figura 7) pode ajudar na criação de insights mais precisos e em tempo real sobre as interações mecânicas durante a angiogênese dentro de um contexto de tecido nativo, facilitando o estudo de processos celulares dinâmicos com complexidade reduzida e reprodutibilidade aprimorada em comparação com sistemas totalmente 3D. Isso poderia melhorar nossa compreensão de como as células respondem a pistas mecânicas em um ambiente fisiologicamente mais relevante, mantendo a simplicidade analítica dos métodos 2D. Esse conhecimento pode avançar no campo da engenharia de tecidos com o objetivo de criar vasos sanguíneos, mas também encontrar drogas terapêuticas para a prevenção da angiogênese tumoral com o objetivo de limitar o crescimento do tumor e reduzir a metástase.
Divulgações
Os autores não têm conflitos de interesse a divulgar.
Agradecimentos
Agradecemos ao pessoal da LifeTec por colher e transportar as artérias carótidas suínas do matadouro local; Leon Hermans, Pim van den Bersselaar e Adrià Villacrosa Ribas (TU/e, ICMS) pelas discussões frutíferas sobre procedimentos experimentais e análise de caracterização mecânica. Agradecemos o apoio de doações do Conselho Europeu de Pesquisa (771168), da Organização Holandesa para Pesquisa Científica (024.003.013), da Academia da Finlândia (307133, 316882, 330411 e 337531) e dos Centros de Excelência em Mechanostase Celular (CellMech) da Fundação Universitária Åbo Akademi.
Materiais
| Name | Company | Catalog Number | Comments | |
| 2% bis-acrylamide | Bio-Rad | 1610143 | ||
| 2-mercaptoethanol | Merck Life Science | 60-24-2 | ||
| 3-(Trimethoxysilyl)propyl methacrylate | Bind-Silane | Sigma-Aldrich | 440159-100ML | |
| 40% acrylamide | Bio-Rad | 1610140 | ||
| Aboslute ethanol (for analysis) | VWR International | 1.00983.1000 | ||
| Absolute ethanol (industrial) | VWR International | 83813.41 | ||
| Acetic acid, glacial 100% | Merck | 1000562500 | ||
| Ammonium persulfate | APS | Bio-Rad | 7727-54-0 | 10% APS dissolved in Milli-Q water, aliquoted and stored at -20 °C |
| antibody (primary) - calponin | abcam | ab46794 | dilution 1:200 | |
| antibody (primary) - CD31 | Serotec | MCA1746 | dilution 1:10 | |
| antibody (primary) - α-smooth muscle actin | αSMA | Dako | M0851 | dilution 1:100 |
| antibody (secondary) - goat-anti-mouse-IgG1 Alexa 488 | Molecular Probes | A21121 | dilution 1:200 | |
| antibody (secondary) - goat-anti-mouse-IgG2a Alexa 555 | Molecular Probes | A21137 | dilution 1:200 | |
| antibody (secondary) - goat-anti-rabbit-IgG Alexa 555 | Molecular Probes | A21428 | dilution 1:200 | |
| Autoclave | Astell | |||
| Calcium chloride dihydrate | CaCl2 | Calbiochem | 208291-250GM | |
| Collagen type I, rat-tail | Corning | 354236 | ||
| Collagen type IV, human placenta | Merck Life Science | C5533-5MG | dissolved in PBS at a concentration of 1mg/mL, aliqouted and stored at -80 °C | |
| Endothelial Cell Growth Medium | ECG medium | Promocell | C-22111 | supplemented with 2% FCS, supplement mix (both included), and 1% P/S |
| Expoxy-coated round tip tweezer | fine tweezer | Rubis Pinzette | E78144-2A | |
| Fluorescent marker, dark red | Invitrogen | F8807 | ||
| Glass coverslips, Ø13 mm, #1 | Epredia | CB00130RA120MNZ0 | ||
| Glass coverslips, Ø13 mm, #1.5 | Epredia | CB00120RAC20MNZ0 | ||
| Hydrochloride acid, 25% | HCl | Merck | 1.100316.1000 | |
| Krebs-Henseleit buffer | Sigma-Aldrich | K3753 | ||
| Microscope, Leica Application Suite X software, version 3.5.7.23225 | Leica Microsystems | |||
| Microscope, Leica DMi8 epifluorescent microscope | Leica Microsystems | |||
| Microscope, Nikon Ti2 Eclipse | Nikon | |||
| Microscope, NIS-Elements AR software | Nikon | |||
| N,N,N',N'-tetramethylethane-1,2-diamine | TEMED | Merck Life Science | 110-18-9 | |
| Nalgene bottle | Thermo Scientific | 2187-0016 | ||
| Needle, 21Gx1" | Henke Sass Wolf | HK4710008025 | ||
| Normal serum, goat | Gibco | 10098792 | ||
| Papaverine hydrochloride | Sigma | 61-25-6 | ||
| Penicillin/Streptomyocin (10 000 U/mL) | P/S | Gibco | 15140163 | |
| Petri-dish, large (145x20mm) | Greiner Bio-one | 639160 | ||
| Petri-dish, small (60x15mm) | Greiner Bio-one | 628160 | ||
| Phosphate Buffered Saline | PBS | Sigma | P4417 | |
| Pluronic F-127 | Merck Life Science | P2443-250G | ||
| Puncture needle, sharp closed tip | unknown | |||
| Scalpel, no. 4 | Swann-Morton | |||
| Sodium hydrogen carbonate | NaHCO3 | VWR International | 144-55-8 | |
| sulfosuccinimidyl 6-(4'-azido-2'-nitrophenylamino)hexanoate | Sulfo-SANPAH | Thermo Scientific | 22589 | dissolved in DMSO at a concentration of 25 mg/mL, aliquoted and stored at -80 °C |
| Surgical blade, no. 20 | Swann-Morton | |||
| Surgical drape sheet | Foliodrape | 2775001 | ||
| Surgical tweezer | Lettix | 400024 | ||
| Triton X-100 | Merck | 9036-19-5 | ||
| UV lamp | Analytik Jena | 95-0042-13 | ||
| well plate, 96-well, F-bottom | Greiner Bio-one | 655180 | ||
| well plate, glass bottom 12-well | MatTek | P12G-0-14-F | ||
Referências
- Carmeliet, P. Angiogenesis in health and disease. Nat Med. 9 (6), 653-660 (2003).
- Folkman, J. Angiogenesis in cancer, vascular, rheumatoid and other disease. Nat Med. 1, 27-30 (1995).
- Kretschmer, M., Rüdiger, D., Zahler, S. Mechanical aspects of angiogenesis. Cancers. 13 (19), 4987 (2021).
- Bordeleau, F., et al. Matrix stiffening promotes a tumor vasculature phenotype. Proc Natl Acad Sci U S A. 114 (3), 492-497 (2017).
- Blanco, R., Gerhardt, H. VEGF and Notch in tip and stalk cell selection. Cold Spring Harb Perspect Med. 3 (1), a006569 (2013).
- Adams, R. H., Alitalo, K. Molecular regulation of angiogenesis and lymphangiogenesis. Nat Rev Mol Cell Biol. 8, 464-478 (2007).
- Carmeliet, P., De Smet, F., Loges, S., Mazzone, M. Branching morphogenesis and antiangiogenesis candidates: tip cells lead the way. Nat Rev Clin Oncol. 6, 315-326 (2009).
- Salam, N., et al. Assessment of migration of human mscs through fibrin hydrogels as a tool for formulation optimisation. Materials. 11 (9), 1781 (2018).
- Solbu, A. A., et al. Assessing cell migration in hydrogels: An overview of relevant materials and methods. Materials Today Bio. 18, 100537 (2023).
- Cao, W., Li, X., Zuo, X., Gao, C. Migration of endothelial cells into photo-responsive hydrogels with tunable modulus under the presence of pro-inflammatory macrophages. Regenerat Biomater. 6 (5), 259-267 (2019).
- Staton, C. A., Reed, M. W. R., Brown, N. J. A critical analysis of current in vitro and in vivo angiogenesis assays. Int J Exp Pathol. 90 (3), 195-221 (2009).
- Staton, C. A., et al. Current methods for assaying angiogenesis in vitro and in vivo. Int J Exp Path. 85, 233-248 (2004).
- Ngo, T. X., et al. In Vitro models for angiogenesis research: A review. Int J Tissue Regenerat. 5, 37-45 (2014).
- Tomita, Y., et al. An ex vivo choroid sprouting assay of ocular microvascular angiogenesis. J Vis Exp. (162), e61677 (2020).
- Kapoor, A., Chen, C. G., Iozzo, R. V. A simplified aortic ring assay: A useful ex vivo method to assess biochemical and functional parameters of angiogenesis. Matrix Biol Plus. 6-7, 100025 (2020).
- Stiffey-Wilusz, J., Boice, J. A., Ronan, J., Fletcher, A. M., Anderson, M. S. An ex vivo angiogenesis assay utilizing commercial porcine carotid artery: Modification of the rat aortic ring assay. Angiogenesis. 4 (1), 3-9 (2001).
- Kniazeva, E., Putnam, A. J. Endothelial cell traction and ECM density influence both capillary morphogenesis and maintenance in 3-D. Am J Physiol Cell Physiol. 297 (1), C179-C187 (2009).
- Davidson, C. D., Wang, W. Y., Zaimi, I., Jayco, D. K. P., Baker, B. M. Cell force-mediated matrix reorganization underlies multicellular network assembly. Sc Rep. 9 (1), 12 (2019).
- Lyle, K. S., Corleto, J. A., Wittmann, T. Microtubule dynamics regulation contributes to endothelial morphogenesis. BioArchitecture. 2 (6), 220-227 (2012).
- Kniazeva, E., et al. Quantification of local matrix deformations and mechanical properties during capillary morphogenesis in 3D. Integrat Biol. 4 (4), 431-439 (2012).
- Quintanilla, M. A., Hammer, J. A., Beach, J. R. Non-muscle myosin 2 at a glance. J Cell Sci. 136 (5), jcs.260890 (2023).
- Fischer, R. S., Gardel, M., Ma, X., Adelstein, R. S., Waterman, C. M. Local cortical tension by myosin II guides 3D endothelial cell branching. Curr Biol. 19 (3), 260-265 (2009).
- Yoon, C., et al. Myosin IIA–mediated forces regulate multicellular integrity during vascular sprouting. Mol Biol Cell. 30 (16), 1974-1984 (2019).
- Du, Y., et al. Three-dimensional characterization of mechanical interactions between endothelial cells and extracellular matrix during angiogenic sprouting. Sci Rep. 6, 21362 (2016).
- Vaeyens, M. M., et al. Matrix deformations around angiogenic sprouts correlate to sprout dynamics and suggest pulling activity. Angiogenesis. 23 (3), 315-324 (2020).
- Style, R. W., et al. Traction force microscopy in physics and biology. Soft Matter. 10 (23), 4047-4055 (2014).
- Trepat, X., et al. Physical forces during collective cell migration. Nat Phys. 5 (6), 426-430 (2009).
- Santos-Oliveira, P., et al. The force at the tip - modelling tension and proliferation in sprouting angiogenesis. PLoS Comput Biol. 11 (8), e1004436 (2015).
- Boreddy, S. R., Sahu, R. P., Srivastava, S. K. Benzyl isothiocyanate suppresses pancreatic tumor angiogenesis and invasion by inhibiting HIF-α/VEGF/Rho-GTPases: Pivotal role of STAT-3. PLoS One. 6 (10), 0025799 (2011).
- Teng, R. J., Eis, A., Bakhutashvili, I., Arul, N., Konduri, G. G. Increased superoxide production contributes to the impaired angiogenesis of fetal pulmonary arteries with in utero pulmonary hypertension. Am J Physiol Lung Cell Mol Physiol. 297 (1), L184-L195 (2009).
- Costa, G., et al. Asymmetric division coordinates collective cell migration in angiogenesis. Nature Cell Biol. 18 (12), 1292-1301 (2016).
- Slater, K., Partridge, J., Nandivada, H. . Corning tuning the elastic moduli of Corning Matrigel and collagen I 3D matrices by varying the protein concentration. , (2019).
- Lee, J., et al. Effect of chain flexibility on cell adhesion: Semi-flexible model-based analysis of cell adhesion to hydrogels. Sci Rep. 9 (1), 2463 (2019).
- Motte, S., Kaufman, L. J. Strain stiffening in collagen i networks. Biopolymers. 99 (1), 35-46 (2013).
- Butcher, D. T., Alliston, T., Weaver, V. M. A tense situation: Forcing tumour progression. Nat Rev Cancer. 9 (2), 108-122 (2009).
- Artym, V. V., Matsumoto, K. Imaging cells in three-dimensional collagen matrix. Curr Prot Cell Biol. 10, Unit 10.18.1-Unit 10.18.20 (2010).
- Labernadie, A., et al. A mechanically active heterotypic E-cadherin/N-cadherin adhesion enables fibroblasts to drive cancer cell invasion. Nat Cell Biol. 19 (3), 224-237 (2017).
- Bazellières, E., et al. Control of cell-cell forces and collective cell dynamics by the intercellular adhesome. Nat Cell Biol. 17 (4), 409-420 (2015).
- Uroz, M., et al. Traction forces at the cytokinetic ring regulate cell division and polyploidy in the migrating zebrafish epicardium. Nat Mater. 18 (9), 1015-1023 (2019).
- Dong, C., Nastaran, Z., Konstantopoulos, K. . Biomechanics in oncology. , (2018).
- Schwarz, U. S., Soiné, J. R. D. Traction force microscopy on soft elastic substrates: A guide to recent computational advances. Biochim Biophys Acta. 1853 (11), 3095-3104 (2015).
- Toyjanova, J., et al. 3D Viscoelastic traction force microscopy. Soft Matter. 10 (40), 8095-8106 (2014).
- Legant, W. R., et al. Multidimensional traction force microscopy reveals out-of-plane rotational moments about focal adhesions. Proc Natl Acad Sci U S A. 110 (3), 881-886 (2013).
- Steinwachs, J., et al. Three-dimensional force microscopy of cells in biopolymer networks. Nat Meth. 13 (2), 171-176 (2016).
- Franck, C., Maskarinec, S. A., Tirrell, D. A., Ravichandran, G. Three-dimensional traction force microscopy: A new tool for quantifying cell-matrix interactions. PLoS One. 6 (3), e17833 (2011).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados