Method Article
2.5D-модель для ex vivo механической характеристики ангиогенеза прорастания в живой ткани
В этой статье
Резюме
Ангиогенез прорастания, имеющий основополагающее значение для развития и болезней, включает в себя сложные молекулярные и механические процессы. Мы представляем универсальную 2.5D модель ex vivo , которая анализирует клеточное прорастание из сонных артерий свиней, выявляя ангиогенез, зависящий от жесткости, и четкую механику клеток-лидеров-последователей. Эта модель помогает в совершенствовании стратегий тканевой инженерии и подходов к лечению рака.
Аннотация
Прорастающий ангиогенез представляет собой образование новых кровеносных сосудов из ранее существовавшей сосудистой сети и имеет большое значение для физиологических процессов, таких как рост и восстановление тканей, а также патологических процессов, включая рак и метастазирование. Многоступенчатый процесс ангиогенеза прорастания является молекулярным и механическим процессом. Он состоит из индукции клеточного ростка фактором роста эндотелия сосудов, отбора клеток-лидеров с помощью передачи сигналов Notch, направленной миграции эндотелиальных клеток, а также слияния и стабилизации сосудов. На протяжении многих лет было разработано множество моделей ангиогенеза прорастания, чтобы лучше понять основные механизмы клеточного прорастания. Несмотря на успехи в понимании молекулярных факторов прорастающего ангиогенеза, роль механических сигналов и механического фактора прорастающего ангиогенеза остается недостаточно изученной из-за ограничений существующих моделей. В этом исследовании мы разработали модель 2.5D ex vivo, которая позволяет нам механически охарактеризовать клеточное прорастание из сонной артерии свиньи с помощью микроскопии силы вытяжения. Модель выявляет различные силовые паттерны внутри ростка, где ведущие клетки оказывают притягивающие силы, а последующие — толкающие силы на матрицу. Универсальность модели позволяет манипулировать как химическими, так и механическими сигналами, такими как жесткость матрицы, повышая ее актуальность для различных микросред. В данной работе мы показываем, что начало ангиогенеза прорастания зависит от жесткости. Представленная 2,5D-модель для количественной оценки клеточных тяговых сил в ангиогенезе прорастания предлагает упрощенный, но физиологически значимый метод, улучшающий наше понимание клеточных реакций на механические сигналы, что может продвинуть тканевую инженерию и терапевтические стратегии против ангиогенеза опухолей.
Введение
Ангиогенез – это процесс образования новых кровеносных сосудов из уже существующих кровеносных сосудов. Этот процесс необходим во время эмбрионального развития, заживления ран и прогрессирования рака, которые связаны с биомеханическими изменениями в микросреде 1,2,3,4. В начале ангиогенеза гипоксические или поврежденные ткани высвобождают фактор роста эндотелия сосудов (VEGF), который активирует эндотелиальные клетки соседних кровеносных сосудов с образованием эндотелиальных ростков, где два различных фенотипа лидера и последователя принимаются через молекулярный сигнальный путьNotch5. При образовании эндотелиальных ростков, явлении, известном как прорастающий ангиогенез, клетки-лидеры разрушают окружающий внеклеточный матрикс, чтобы коллективно мигрировать к стимулу VEGF, не теряя межклеточных адгезий с отстающими клетками-последователями 6,7.
За последние десятилетия появилось все большее число описанных анализов ангиогенеза, которые исследуют коллективную миграцию клеток с помощью различных методологий, каждая из которых предлагает свои преимущества и ограничения. Эти анализы оценивают скоординированное перемещение групп клеток, таких как эндотелиальные клетки, с помощью 3D-матриц, что позволяет изучать клеточное поведение, такое как прорастание, инвазия и коллективная миграция в контролируемой среде 8,9,10. Анализы ангиогенеза in vivo обеспечивают всестороннюю оценку в живом организме, захватывая сложные взаимодействия, но они трудоемки, дорогостоящи, подвержены высокой изменчивости и с трудом поддаются количественной оценке11,12. Анализы ангиогенеза in vitro позволяют точно контролировать экспериментальные условия с высокой воспроизводимостью и точным количественным оцениванием, но могут не полностью воспроизводить сложности in vivo 11,12,13. В отличие от этого, анализы прорастающего ангиогенеза ex vivo, из которых анализ кольца аорты является наиболее широко используемой моделью, используют ткани вне организма, сохраняя физиологическую значимость и избегая осложнений in vivo 14,15,16. Несмотря на техническую сложность и иногда трудности с жизнеспособностью тканей, модели ex vivo предлагают ценный баланс между сложностью и контролем, что делает их многообещающим подходом к изучению ангиогенеза прорастания. В то время как эти модели широко использовались для изучения молекулярных факторов прорастающего ангиогенеза, влияние механических сигналов и механическое поведение клеток остаются плохо изученными.
Многоклеточная миграция во время прорастающего ангиогенеза в значительной степени зависит от клеточной механики, поскольку сократительные силы на основе актомиозина регулируют инвазию эндотелиальных клеток в окружающий внеклеточный матрикс 17,18,19,20. В частности, было замечено, что немышечные моторы миозина II, основные сократительные машины на основе актина в клетке21, контролируют клеточные сократительные силы во время прорастающего ангиогенеза 22,23. Ведущая клетка, вероятно, является преобладающим силообразующим элементом ростка, поскольку деформации окружающего трехмерного внеклеточного матрикса значительно выше вокруг ведущей клетки, особенно вблизи богатых актином клеточных выступов23,24, по сравнению с его последователями 22,23,25. Несмотря на растущее число доказательств важности клеточной сократимости в прорастающем ангиогенезе в 3D, метод пространственно-временной механической характеристики клеточной механики прорастающего ангиогенеза отсутствует.
Общей целью данного исследования является разработка метода, позволяющего механически охарактеризовать клеточную миграцию во время прорастания. Достигая пространственно-временной характеристики механических сил в биологически значимом контексте, мы стремимся дать новое понимание того, как клеточная механика влияет на образование ангиогенных побегов. С этой целью мы разработали систему 2,5D-моделей, создав 2D-гидрогель на основе полиакриламида (ПАА), засеяв на него лист сонной артерии и покрыв его тонким слоем геля с коллагеном I типа для создания локализованной 3D-среды для клеток. Многоклеточные ростки мигрировали из артериального листа на границе раздела ПАА-коллагенового геля. Преимущество этого метода по сравнению с существующими методами заключается в том, что гидрогель 2D PAA позволяет проводить анализ с помощью микроскопии силы тяги (TFM) - хорошо известного универсального метода, при котором клетки прилипают к эластичному двумерному субстрату и деформируют субстрат под действием клеточных сил тяги26. Эти деформации могут быть зафиксированы, а силы сцепления ячеек могут быть рассчитаны на основе механических свойств подложки26. Адаптируя TFM для использования в живых тканях ex vivo, мы стремимся преодолеть разрыв между контролем in vitro и актуальностью in vivo , обеспечивая более полное понимание механических сил во время ангиогенеза.
протокол
В этом протоколе использовались сонные артерии свиней. Сонные артерии свиней были собраны у голландских свиней породы ландрас в возрасте 5-7 месяцев и весом (живыми) 80-120 кг, полученными с местной скотобойни. Протоколы соответствовали Регламенту ЕС 1069/2009 в отношении материалов для скотобоен для диагностики и исследований, осуществляемых под надзором правительства Нидерландов (Министерство сельского хозяйства, природы и качества пищевых продуктов Нидерландов), и были одобрены соответствующими юридическими органами по защите животных (Управление по безопасности пищевых продуктов и потребительских товаров). Этическое одобрение не требовалось, так как ткань собиралась из побочных продуктов уже уничтоженных животных. Время между смертью и транспортировкой тканей составляет 10-25 минут, в зависимости от скотобойни.
ПРИМЕЧАНИЕ: Таблица материалов содержит подробную информацию о материалах, оборудовании и реагентах, используемых в этом протоколе. Протоколы для 2D и 3D образцов описаны в Дополнительном файле 1.
1. Получение 2D полиакриламидных (ПАА) оснований
- В вытяжном шкафу приготовьте раствор связующего силана, смешав абсолютный этанол 12:1:1 (для синтеза), уксусную кислоту и связующий силан в дозах 4286 μл, 357 μл и 357 μл соответственно. Инкубировать 120 μл/луночный раствор силана на стеклянном дне 12-луночного планшета в течение 1 ч при комнатной температуре.
ВНИМАНИЕ: Абсолютный этанол является легковоспламеняющейся жидкостью и паром (H225) и вызывает серьезное раздражение глаз (H319). Уксусная кислота является легковоспламеняющейся жидкостью и паром (H226) и вызывает серьезные ожоги кожи и повреждение глаз (H314). Носите средства индивидуальной защиты и работайте в вытяжном шкафу. - В вытяжном шкафу вымойте 12-луночную пластину со стеклянным дном 3 раза абсолютным этанолом (промышленным) с помощью пульверизатора. Выбросьте этанол.
- Просушите стеклянное дно 12-луночной пластины, используя газообразный азот. Если на стеклянном дне появляется белая глазурь, мытья оказалось недостаточным. Перемойте стеклянное дно 12 хорошо тарелкой.
- Приготовьте гелевую смесь PAA в соответствии с соотношениями, приведенными в таблице 1.
- Добавьте PBS в микроцентрифужную пробирку и ресуспендируйте в гелевую смесь 40% акриламида, 2% бис-акриламида и флуоресцентные маркеры. Вортексируйте раствор непосредственно перед приготовлением геля.
- Как можно быстрее добавьте в раствор по 10% APS и TEMED и сделайте вихрь после добавления каждого элемента. Нанесите капельку 11,5 мкл гелевой смеси на стеклянное дно каждой лунки и аккуратно поместите сверху капли 13 мм.
- Аккуратно постучите и покрутите пластину, чтобы равномерно распределить гелевую смесь под покровным стеклом. Если появились пузырьки воздуха, удалите их, аккуратно приподняв покровную крышку. Оставьте гели полимеризоваться на 1 час при комнатной температуре. Проверьте полимеризацию с помощью остатков гелевой смеси в тюбике. Полимеризованные гели ПАА в 12-луночном планшете будут иметь внутренний ореол.
ВНИМАНИЕ: Акриламид вреден при проглатывании или вдыхании (H302 + H332), вызывает раздражение кожи (H315), может вызвать аллергическую кожную реакцию (H317), вызывает серьезное раздражение глаз (H319), может вызывать генетические дефекты (H340), может вызывать рак (H350), подозревается в нарушении фертильности (H361f) и вызывает повреждение органов при длительном или повторном воздействии при проглатывании (H372). АФС может усиливать огонь (окислитель, H272), вредить при проглатывании (H302), вызывать раздражение кожи (H315), вызывать аллергическую реакцию кожи (H317), вызывать серьезное раздражение глаз (H319), вызывать симптомы аллергии или астмы или затрудненное дыхание при вдыхании (H334), а также вызывать раздражение дыхательных путей (H335). TEMED является легковоспламеняющейся жидкостью и паром (H225), вреден при проглатывании (H302), вызывает серьезные ожоги кожи и повреждение глаз (H314) и токсичен при вдыхании (H331). Носите средства индивидуальной защиты.
- После полимеризации добавьте в лунку PBS. С помощью пинцета и/или изогнутой иглы аккуратно поднимите и снимите покровное стекло. Смойте гели один раз в PBS.
- Чтобы облегчить коллагеновое покрытие гелей PAA, гели должны быть функционализированы с помощью сшивающего агента Sulfo-SANPAH. Добавьте 75 мкл 1 мг/мл Sulfo-SANPAH, растворенного в ультрачистой воде, в гель PAA и инкубируйте в течение 5 минут под ультрафиолетовым светом 365 нм.
ПРИМЕЧАНИЕ: Храните Sulfo-SANPAH в защищенном от света месте и добавляйте ультрачистую воду непосредственно перед инкубацией ультрафиолета. Изменение цвета наблюдается от светло-красного (до инкубации под воздействием ультрафиолетового излучения) до темно-красного (после инкубации под действием ультрафиолетового излучения).
ВНИМАНИЕ: Сульфо-САНПА вызывает серьезное раздражение глаз (H319). - В шкафу биобезопасности проведите быструю стерильную промывку PBS Sulfo-SANPAH на гелях. Следовательно, промойте функционализированные гели PAA 2x в стерильном PBS в течение 10 минут.
ПРИМЕЧАНИЕ: Начиная с этого пункта протокола, все шаги будут выполняться в стерильных условиях. - В шкафу биобезопасности приготовьте 0,1 мг/мл раствора коллагена типа IV в PBS на льду. Пипет 50 мкл 0,1 мг/мл коллагена IV типа каплей поверх функционализированного геля PAA и инкубировать в течение ночи при 4 °C.
- Простирайте гели 2 раза в стерильном PBS. Удалите PBS и оставьте гели сохнуть на 5 минут.
- Пипетируйте каплю объемом 50 мкл среды для роста эндотелиальных клеток (ЭКГ) поверх гелей и инкубируйте не менее 1 ч при 37 °C и 5%CO2.
ПРИМЕЧАНИЕ: Инкубация гелей в среде ЭКГ улучшает прикрепление клеток и тканей к гелям.
2. Приготовление модифицированного раствора Кребса для транспортировки
ПРИМЕЧАНИЕ: Приготовьте модифицированный раствор Кребса в свежем виде. В этом протоколе модифицированный раствор Кребса готовится за 1 день до забора тканей.
- Стерилизовать транспортировочную бутылку методом автоклавирования. Наполните стеклянную бутылку 90% (315 мл) от общего необходимого транспортного объема (350 мл) сверхчистой водой. Следите за тем, чтобы температура воды составляла 15-20 °C.
- Осторожно помешивая воду с помощью магнита, добавьте 9,6 г/л (3,36 г) буфера Krebs-Henseleit и перемешайте до полного растворения. С помощью пастеровской пипетки промойте весовую лодку небольшим объемом раствора, чтобы включить в раствор все следы порошка. Не нагревайте раствор.
- Помешивая, добавьте в раствор 0,373 г/л (130,55 мг) хлорида кальция (CaCl2) и перемешайте до полного растворения. Промойте весовую лодку небольшим объемом раствора.
ВНИМАНИЕ: H319 вызывает серьезное раздражение глаз. - Помешивая, добавьте в раствор 2,1 г/л (0,63 г) гидрокарбоната натрия (NaHCO3) и перемешайте до полного растворения. Промойте весовую лодку небольшим объемом раствора.
- Помешивая, добавьте в раствор 1 x 10-1 mM (13,15 мг) папаверина и перемешайте до полного растворения. Промойте весовую лодку небольшим объемом раствора.
ПРИМЕЧАНИЕ: Папаверин является релаксантом гладких мышц, используемым для предотвращения чрезмерной вазоконстрикции, вызванной разрезанием и обращением с сосудом во время сбора.
ВНИМАНИЕ: H301 токсичен при проглатывании. - В вытяжной шкаф добавьте в раствор 0,05 мМ (1,2 μл) 2-меркаптоэтанола и перемешайте.
ПРИМЕЧАНИЕ: 2-меркаптоэтанол используется для поддержания низкого уровня кислородных радикалов.
ВНИМАНИЕ: 2-меркаптоэтанол токсичен при проглатывании или вдыхании (H301 + H331), приводит к летальному исходу при контакте с кожей (H310), вызывает раздражение кожи (H315), может вызвать аллергическую реакцию кожи (H317), вызывает серьезное повреждение глаз (H318), подозревается в причинении вреда нерожденному ребенку (H361d), может вызвать повреждение органов при длительном или повторном воздействии при проглатывании (H373) и очень токсичен для водных организмов с долгосрочными последствиями (H410). Носите средства индивидуальной защиты и работайте в вытяжном шкафу. - Во время помешивания отрегулируйте pH до 7,2, добавив 1 Н (1 М) HCl или 1 Н (1 М) NaOH. Итоговый целевой показатель pH составляет 7,4, но pH может повышаться на 0,1-0,3 единицы pH во время фильтрации.
ВНИМАНИЕ: HCl содержит газ под давлением; он может взорваться при нагревании (H280), вызвать серьезные ожоги кожи и повреждение глаз (H314) и токсичен при вдыхании (H331). Носите средства индивидуальной защиты. - Продолжайте работу в шкафу биобезопасности. Добавьте 10% ультрачистой воды, чтобы довести раствор до конечного объема.
- Раствор немедленно стерилизуют фильтрацией с помощью мембраны с пористостью 0,22 мкм. Раздайте стерильный раствор непосредственно в стерильной бутылке. Добавьте в раствор 7 мл 2% пенициллина/стрептомиоцина (P/S).
ПРИМЕЧАНИЕ: Во время транспортировки в среду добавляется 2% P/S для удаления всех бактерий. Во время культивирования тканей в среду добавляют 1% P/S. - Храните модифицированный раствор Кребса при температуре 4 °C до забора тканей.
3. Забор тканей
- В зависимости от скотобойни, оглушение свиней происходит с помощью электрошока или CO2. Впоследствии свиней подвешивают на задних конечностях, обескровливают, и объявляют мертвыми.
- Перед тем, как приступить к чистому процессу убоя, ошпарьте свиней для удаления шерсти, опалите для удаления последних волосков и простерилизуйте внешнюю часть туши.
- Потрошите свиней, сделав разрез по средней линии вдоль живота и аккуратно удалив внутренние органы. В зависимости от бойни, сонная артерия еще крепилась к туше свиньи, либо сонная артерия уже удалялась из туши с ощипыванием грудных органов.
- С помощью острого ножа соберите сонную артерию с остатками окружающей ткани из туши или горла, не касаясь артерии и не применяя механического напряжения.
- Поместите ткань, содержащую сонную артерию, в транспортировочный флакон со стерильным модифицированным раствором Кребса, кратковременно открыв флакон. Переверните флакон один раз, чтобы убедиться, что вся ткань покрыта раствором Кребса. Транспортируйте ткани на льду в лабораторию. Время в пути примерно 30-45 минут.
4. Диссекция тканей
- Стерилизующее оборудование для препарирования: хирургический пинцет (грубое обращение), пинцет с круглым наконечником с эпоксидным покрытием (тонкое обращение), скальпель, пинчер и покровные стекла методом автоклавирования.
- Подготовьте шкаф биобезопасности перед сбором/транспортировкой тканей. Накройте место вскрытия хирургическим простыней. Установите оборудование для диссекции (в стерильных пробирках объемом 50 мл), хирургические лезвия и стерильные покровные стекла. Заполните две большие чашки Петри стерильным PBS, чтобы приготовить поднос для вскрытия. Инкубируйте культуру ткани в одной небольшой чашке Петри со средой ЭКГ при 37 °C.
- После транспортировки тканей в шкафу биобезопасности перенесите сонную артерию из транспортной бутылки (наполненной модифицированным раствором Кребса) в большую чашку Петри, наполненную стерильным PBS, с помощью хирургического пинцера.
- Удалите излишки ткани, окружающей сонную артерию, с помощью хирургического пинцета и скальпеля, чтобы создать четкий обзор сонной артерии.
- Удалите 2-3 см с обоих концов сонной артерии, чтобы устранить участки, близкие к бифуркации артерий, путем разреза скальпелем. Удалите артериальную фасцию, окружающую сонную артерию, с помощью пинцета с тонким круглым концом.
ПРИМЕЧАНИЕ: Обновление лезвия скальпеля помогает более точно разрезать фасцию. - Перенесите сонную артерию в новую большую чашку Петри, наполненную стерильным ПБС. Максимально удалите оставшийся тонкий слой артериальной фасции.
ПРИМЕЧАНИЕ: Чем длиннее сонная артерия находится в PBS, тем больше кусочков фасции имеет тенденцию к ослаблению. Удаление фасции важно, так как она будет препятствовать зрению во время микроскопии. - Разрежьте чистую сонную артерию на кольца шириной примерно 2 мм. Перенесите кольца сонной артерии в предварительно подогретую маленькую чашку Петри, заполненную средой для ЭКГ, и поддерживайте при температуре 37 °C.
5. Посев тканей
ПРИМЕЧАНИЕ: Тканевое прикрепление проверяли путем добавления покровного стекла без покровного стекла, стерильного необработанного покровного стекла или стерильного плюронически обработанного покровного стекла (1% по сравнению с плуроновым раствором в PBS, покровные листы, инкубированные в течение ночи и промытые в стерильной сверхчистой воде перед использованием) различных размеров поверх артериального слоя после посева гидрогеля PAA.
- Удалите средние капли ЭКГ из гелей. Перенесите кольцо сонной артерии в чистую среду в чашку Петри, наполненную стерильным PBS.
- С помощью пинцета с круглым концом и скальпеля разрежьте кольцо пополам. Рассеките половину кольца на листы шириной примерно 2 мм, чтобы создать артериальные листы размером 2 х 2 мм. Обратите внимание на ориентацию эндотелиальной стороны артериального листа. Искривление и некоторые оставшиеся фасции артериального листа могут помочь определить эту ориентацию.
ПРИМЕЧАНИЕ: Размер колец сонной артерии может варьироваться. Большие кольца дают примерно 6-8 листов, в то время как маленькие кольца дают 3-4 листа. Большие кольца имеют усиленное прикрепление из-за меньшей кривизны артериального листа. - С помощью пинцета с круглым концом возьмитесь за артериальный лист в задней части листа (снаружи стенки сосуда) и поместите лист на край геля PAA так, чтобы эндотелиальная внутренняя оболочка была обращена к субстрату PAA, чтобы не повредить субстрат PAA при размещении листа.
- С помощью пинцета или пинчера очень аккуратно переместите артериальный лист к центру гидрогеля ПАА, не касаясь геля. Поместите артериальный лист на край геля (ткань может прилипнуть к пинцету или пинчеру).
ПРИМЕЧАНИЕ: Небольшие остатки артериальной фасции на внешней стороне стенки сосуда создают легкую ручку для захвата артериального слоя, в то время как эндотелиальная внутренняя оболочка стенки сосуда очень гладкая. - Добавьте 50 мкл среды ЭКГ поверх артериального листа, помещенного на субстрат ПАА. При этом капля среды ЭКГ удерживается поверх геля.
- С помощью пинцета с круглым концом поместите сухой покровный лист толщиной 13 мм поверх артериального листа на субстрат из ПАА средней плотности. Используйте внутренний край стеклянного дна, чтобы осторожно опустить покровную крышку, пока она не коснется капли медиума и среда не растечется под ней.
ПРИМЕЧАНИЕ: Покровные стекла 13 мм имеют преимущество, потому что они точно соответствуют размеру внутренней стенки стеклянной нижней колодцевой пластины. Если вы опустите покровное стекло слишком быстро, ткань переместится к краю покровного стекла. - Оставьте ткань прикрепляться при температуре 37 °C и 5%CO2 на 5 ч, прежде чем добавлять по 1 мл среды ЭКГ в каждую лунку. Поместите артериальный лист на субстрат из ПАА при температуре 37 °C и 5%CO2 на 24 часа.
6. Создание 2.5D модели
- Автоклавный пинцет с круглым наконечником для удаления покровного стекла. Приготовьте 1 М NaOH в ультрачистой воде, простерилизуйте фильтрацией через фильтр с размером пор 0,22 мкм и храните при температуре 4 °C.
ПРИМЕЧАНИЕ: 1 М NaOH может быть повторно использован в будущих экспериментах. - С помощью стерильной острой иглы с загнутым концом очень аккуратно приподнять покровное стекло диаметром 13 мм от артериального листа и снять покровное стекло. Используйте внутреннее кольцо стеклянного дна в качестве опоры для подъема и снятия покровного стекла. Любое боковое движение увеличивает риск отслоения артериального листа от субстрата ПАА.
- В стерильной микроцентрифужной пробирке приготовьте на льду смесь коллагена I типа согласно таблице 2 . При добавлении в раствор коллагена I типа и NaOH очень хорошо ресуспендировать и один раз перевернуть трубку, чтобы смесь равномерно перемешалась.
ПРИМЕЧАНИЕ: При добавлении в смесь коллагена I типа, светло-розовая смесь становится бесцветной. При добавлении NaOH бесцветная смесь приобретает светло-розовый цвет. - Удалите среду из лунки с помощью вакуумной системы всасывания. Удалите среду, окружающую ткань, насколько это возможно, не касаясь ткани.
ПРИМЕЧАНИЕ: Слишком большое количество среды, окружающей артериальный слой, не позволит гелю типа I коллагена окружать его. - Добавьте каплю 10 мкл гелевой смеси коллагена типа I поверх каждого артериального слоя и оставьте гель коллагена типа I для полимеризации на 1 час при 37 °C и 5%CO2.
- Очень осторожно добавьте 1 мл предварительно подогретой среды для ЭКГ в каждую лунку и поместите образцы при температуре 37 °C и 5%CO2.
7. Визуализация живых клеток
ПРИМЕЧАНИЕ: Визуализация живых клеток была выполнена с помощью эпифлуоресцентного микроскопа Leica DMi8 или Nikon Ti2 Eclipse, оснащенного системой контроля температуры,CO2 и влажности и управляемого с помощью программного обеспечения Leica или NIS. Для своевременного поддержания фокусировки использовались адаптивный контроль фокусировки (Leica) и идеальная система фокусировки (Nikon).
- После 24 ч культивирования в системе 2,5D проверьте наличие ангиогенеза при росте. Некоторые артериальные листы уже начинают формировать клеточные ростки через 24 ч после культивирования, в то время как другим листам требуется еще некоторое время, чтобы инициировать эндотелиальное прорастание.
- Если начался прорастающий ангиогенез, обновите среду для ЭКГ и поместите 12-луночный планшет в держатель предметного стекла в предварительно нагретую при температуре 37 °C инкубационную коробку микроскопа.
- Выберите интересующую вас цель. В этом исследовании использовались различные цели: 10-кратная цель для создания глобального обзора формирования клеточных ростков и 20-кратная цель для выполнения TFM.
- Определите интересующий вас канал (каналы). Для целей TFM визуализируйте клеточные ростки с помощью фазового контраста и визуализируйте флуоресцентные маркеры (темно-красные) в субстрате PAA с помощью флуоресцентного канала на длине волны 660 нм.
- Выберите (несколько) областей интереса и найдите плоскость фокусировки. Включите систему фокусировки (адаптивный контроль фокусировки у Leica DMi8 или идеальная система фокусировки у Nikon Ti2 Eclipse), чтобы обеспечить стабильную фокусировку при покадровой съемке.
- Определите интересующий вас таймлапс, выбрав временной интервал и продолжительность таймлапса. В данном исследовании для разных целей использовались различные временные интервалы (5-20 мин) и продолжительность таймлапса (4-24 ч).
- Для целей TFM, после покадровой визуализации, удалите отросшие клетки, добавив несколько капель 5% SDS в ультрачистую воду, и подождите несколько минут. Для каждой выбранной позиции возьмите z-стек (z-высота 2 мкм была определена с шагом 0,2 мкм) флуоресцентных маркеров в подложке PAA, чтобы получить расслабленное состояние флуоресцентных маркеров в качестве референсного изображения.
ПРИМЕЧАНИЕ: Визуализация Z-стека выполняется, поскольку клетки могут тянуть или выталкивать флуоресцентные маркеры в направлении z.
8. Анализ микроскопии силы вытяжения
- Выравнивайте и обрезайте изображения с интервальной съемкой относительно лучшего эталонного изображения для точного анализа.
- Чтобы измерить смещения флуоресцентных маркеров в гидрогеле PAA, выполните велоциметрию изображения частиц (PIV) между любым изображением таймлапса и эталонным изображением с использованием специальных кодов MatLab. В рамках анализа PIV разделите изображения на окна опроса размером 32 на 32 пикселя с перекрытием 0,5.
- Вычислить тяговые силы по смещениям флуоресцентных маркеров с помощью тракционной микроскопии бесконечного геля с конечной толщиной геля на основе преобразования Фурье с использованием уравнения Буссинеска27.
Результаты
С помощью описанного протокола мы можем индуцировать прорастающий ангиогенез ex vivo из сонной артерии свиньи поверх 2D гидрогеля PAA, покрытого тонким слоем геля коллагена I типа, таким образом создавая модель 2,5D прорастающего ангиогенеза ex vivo . Эта модель позволяет выполнить обычную ТФМ и измерить клеточные тяговые силы ангиогенеза прорастания на границе раздела геля ПАА в пространстве и времени.
Чтобы создать 2,5D-модель, мы сначала подготовили 2D-гидрогель из полиакриламида (ПАА) с флуоресцентными маркерами, а затем на ночь нанесли покрытие коллагеном IV типа (от d-1 до d0). На 0-й день (d0) на гидрогель с коллагеновым покрытием IV-капельным покрытием помещали лист сонной артерии и оставляли прикрепляться на ночь (от d0 до d1). Впоследствии на артериальный лист наносили тонкий слой геля коллагена I типа, после чего в 1-й день (d1) начинали визуализацию для мониторинга клеточного прорастания и отслеживания флуоресцентных маркеров для механического анализа (d1 - d2). Чтобы проверить прорастающий ангиогенез в 2,5D-модели, мы параллельно выполнили обычный ex vivo проращивающий ангиогенез в 3D-геле с коллагеном I типа. Для этого готовили тонкий слой геля коллагена I типа с последующим затравливанием стенки сонной артерии, а впоследствии покрывали дополнительным коллагеновым слоем (d0). Со временем контролировали ангиогенное прорастание. Кроме того, мы попытались индуцировать прорастающий ангиогенез в 2D, чтобы еще больше снизить сложность модели. Экспериментальная процедура была зеркальным отражением 2,5D-модели, с ключевым отличием в исключении верхнего слоя геля коллагена I типа. Обзор трех моделей, включая их экспериментальные процедуры, представлен на рисунке 1. Сонные артерии были собраны у свиней с местной скотобойни и транспортированы в стерильном свежем растворе Кребса. В боксе биобезопасности был удален избыток ткани, окружающей сонную артерию, чтобы гарантировать отсутствие визуального нарушения ангиогенеза прорастания во время визуализации в реальном времени (рис. 2A-E). После того, как артерия была очищена от излишней ткани, артерию разрезали на артерийные кольца шириной 2 мм, а кольца разрезали на артериальные листы размером 2 х 2 мм (рис. 2F).
Чтобы обеспечить прорастающий ангиогенез поверх границы раздела гидрогеля PAA в 2,5D и 2D модели, мы засеяли артериальные листы стороной внутренних эндотелиальных клеток, обращенной к гидрогелю PAA, покрытым коллагеном типа IV, и оставили их для прикрепления. Для оптимизации прикрепления артериального листа к гидрогелю ПАА мы протестировали эффект добавления 12-миллиметрового стеклянного покровного стекла с противообрастающим покрытием поверх артериального листа. Через 24 ч покровное стекло удаляли, а эффективность прикрепления измеряли с помощью процента артериальных листов, прикрепленных к гидрогелю ПАА. Мы заметили, что добавление стеклянного покровного стекла - независимо от противообрастающего покрытия - повышает эффективность прикрепления артериальных листов поверх гидрогеля PAA по сравнению с отсутствием покровного стекла (Рисунок 3A-D). Затем мы проверили влияние диаметра (12 или 13 мм) стеклянного покровного стекла на эффективность крепления артериального листа, в то время как внутренний колодец пластины составлял 14 мм. Мы обнаружили, что покровное стекло диаметром 13 мм увеличивает эффективность прикрепления артериальных стечек поверх гидрогеля PAA по сравнению с покровным стеклом диаметром 12 мм (рис. 3E-G), поскольку усилия сдвига при удалении покровного стекла сведены к минимуму. Мы продолжили использовать необработанный покровный лист толщиной 13 мм для крепления артериального листа к гидрогелю PAA как в 2,5D, так и в 2D-моделях.
После того, как артериальный лист был прикреплен к гидрогелю PAA, мы добавили тонкий слой геля коллагена типа I поверх артериального слоя для создания 2,5D-среды. Мы культивировали образцы в течение 5 дней и исследовали образцы на прорастающий ангиогенез. Мы наблюдали образование клеточных ростков в 3D-модели (рис. 4A), что согласуется с ранее описанным ангиогенезом прорастания ex vivo в литературе 28,29,30. В рамках 2,5D-модели мы наблюдали аналогичную организацию клеточных ростков по сравнению с 3D-моделью (рис. 4B). Клеточные ростки формировались на разных высотах (видео 1), в том числе на границе раздела ПАА. Кроме того, проращивающий ангиогенез характеризуется высокой пролиферацией ведущих и последующих клеток, что мы наблюдали во время проращивания в рамках 2,5D-модели (видео 2). При культивировании артериального листа в 2D клетки различного происхождения (дополнительный рисунок 1) мигрируют в виде монослоев из ткани, таким образом, не имея организации клеточных ростков (рисунок 4C). Поскольку в 2D-модели мы не наблюдали прорастающего ангиогенеза, мы исключили эту модель из последующих анализов. В целом, артериальный слой нуждается в локальной 3D-среде, чтобы индуцировать прорастающий ангиогенез, демонстрируя потенциал 2,5D-модели ex vivo прорастающего ангиогенеза.
Кроме того, система 2.5D-моделей является универсальной системой, которая позволяет пользователям изучать влияние механических сигналов из клеточного микроокружения, например, жесткость матрицы. Жесткость матрицы гидрогеля 3D коллагена I типа I - гидрогеля, который обычно используется для прорастающего ангиогенеза ex vivo - зависит от концентрации белка ECM, где увеличение концентрации белка коррелирует с увеличением жесткости матрицы32. Типичный диапазон концентрации коллагена I типа для того, чтобы этот 3D гидрогель вызывал прорастающий ангиогенез, составляет 1-4 мг/мл, что соответствует жесткости матрицы от 1 Па до 1 кПа 32,33,34. Более низкие концентрации могут быть слишком мягкими для обеспечения структурной поддержки, в то время как более высокие концентрации могут препятствовать движению клеток. Физиологическая жесткость эндотелиальной ткани составляет 1кПа 35, что можно имитировать с помощью 3D гидрогеля с коллагеном I типа. Тем не менее, образование и прогрессирование опухоли связаныс жесткостью тканей4, что подчеркивает необходимость модели, которая может достичь более высокой жесткости матрицы для изучения ангиогенеза опухоли. Жесткость субстрата гидрогелей ПАА - жесткость, ощущаемая эндотелиальными клетками артериального листа - может быть легко настроена в диапазоне от 1 до десятков кПа. В данной работе мы рассмотрели влияние жесткости субстрата ПАА на начало ангиогенеза прорастания с помощью процента образцов, которые инициировали образование клеточных ростков на следующий день после добавления слоя коллагена I типа. Мы обнаружили, что большее количество артериальных листов демонстрировало ранние признаки клеточных ростков при культивировании на физиологическом мягком (1 кПа) гидрогеле ПАА по сравнению с патологическим жестким (12 кПа) гидрогелем ПАА (рис. 5), что свидетельствует о потенциале этой модели для изучения влияния жесткости матрикса на ангиогенез прорастания. В дополнение к настраиваемой жесткости субстрата, эти субстраты позволяют систематически модулировать другие механические сигналы (например, состав и плотность матрицы), а также химические сигналы (например, ингибирование молекулярных регуляторов путем кондиционирования питательной среды), демонстрируя универсальность этой модели 2,5D ex vivo прорастающего ангиогенеза.
Чтобы количественно оценить клеточную механику в ангиогенезе прорастания, мы выполнили традиционную микроскопию тяговой силы (TFM) на клеточных ростках, которые сформировались на границе 2D PAA. На следующий день после добавления слоя коллагена I типа мы провели визуализацию живых клеток (рис. 6A) и флуоресцентных маркеров, встроенных в гидрогель PAA. Смещения флуоресцентных маркеров измеряли с помощью велоциметрии изображения частиц (рис. 6B), а клеточные тракции рассчитывали с использованием механических свойств гидрогеля PAA (рис. 6C). С помощью этой модели 2.5D ex vivo мы наблюдали первоначально тянущие силы на выступах ведущей клетки клеточного ростка, а затем толкающие силы вдоль клеточного ростка - как в задней части ведущей клетки, так и в последующих клетках (рис. 6C).
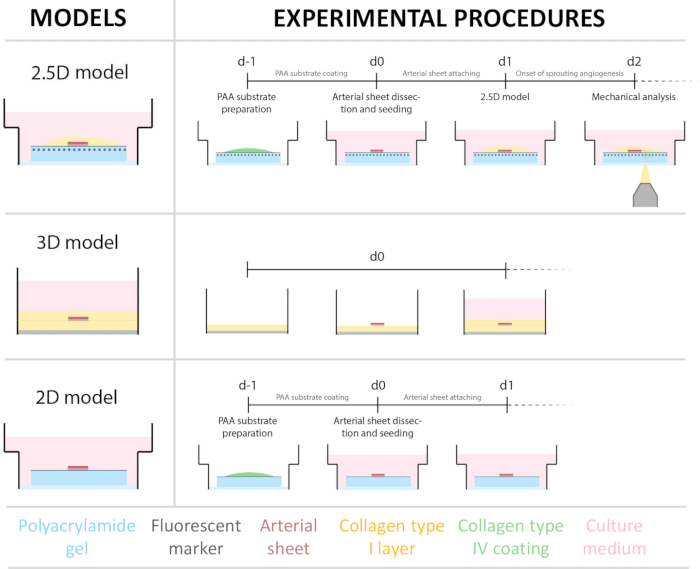
Рисунок 1: Экспериментальные модели и процедуры. (слева) Экспериментальные модели протестированы. Модель 2.5D представляет собой артериальный лист, помещенный поверх плоского гидрогеля из полиакриламида (ПАА) с коллагеновым покрытием типа IV и покрытый тонким слоем гидрогеля с коллагеном типа I. 3D-модель представляет собой артериальный слой, зажатый между двумя слоями геля коллагена I типа, системы, которая, как известно, индуцирует прорастающий ангиогенез36. 2D-модель представляет собой артериальный лист, помещенный поверх плоского гидрогеля PAA с коллагеновым покрытием типа IV. (справа) Экспериментальные методики для соответствующих моделей. Для моделей 2D и 2.5D гидрогель PAA был приготовлен за день до посева (d-1), а покрытие коллагеном IV типа было выполнено в течение ночи. Сонную артерию собирали у свиней, рассекали на артериальные листы, засеивали поверх гидрогеля на 0-й день (d0) и оставляли прикрепляться на ночь (d1). Для образцов 2,5D тонкий слой геля коллагена I типа был помещен поверх артериального листа. Механический анализ проводили после начала всходов на 2 день (d2). Для 2D-образцов носитель обновляли в 1-й день (d1). Для 3D-модели слой геля коллагена I типа был подготовлен непосредственно перед посевом в день 0 (d0). Артериальный лист был засеян поверх слоя коллагена I типа и покрыт вторым слоем коллагена I типа. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
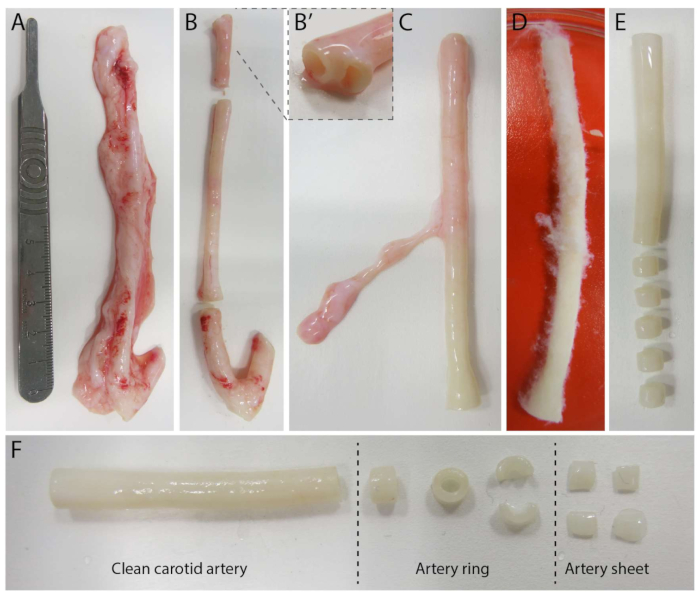
Рисунок 2: Этапы расслоения сонной артерии (d0). (А) Сонные артерии длиной около 10 см были собраны у свиней с местной скотобойни. (B) Излишняя ткань и примерно 2 см края (чтобы не находиться слишком близко к точкам ветвления, (B') были отброшены. (К-Е) Сонная артерия была очищена от кожи (C), пропитана PBS (D), а все оставшиеся ткани были очищены для обеспечения четкой видимости во время визуализации (E). (F) Чистая сонная артерия разрезается на артерийные кольца шириной около 2 мм. Каждое кольцо разрезано на 4 артериальных листа размером примерно 2 x 2 мм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
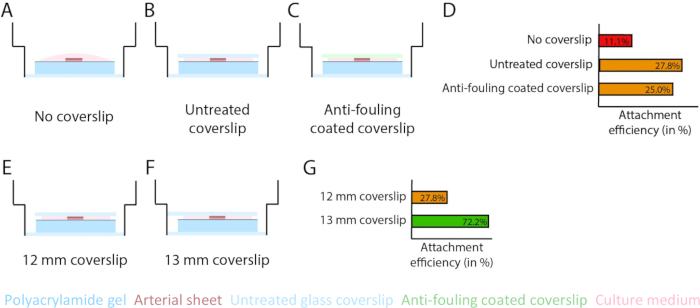
Рисунок 3: Эффективность крепления артериального листа увеличивается при использовании стеклянного покровного стекла диаметром 13 мм (d1). (A-D) Влияние стеклянного покровного стекла на прикрепление артериального листа к полиакриламидному (ПАА) гидрогелю. Было проведено сравнение между покровным стеклом без стекла (A), необработанным покровным стеклом (B) и стеклозащитным стеклом с противообрастающим покрытием с использованием Pluronic F127 (C). Эффективность прикрепления измерялась количеством артериальных листов, которые прикреплялись к гидрогелю ПАА после удаления покровного стекла по сравнению с общим количеством образцов: без покровного стекла (4 из 36), необработанного покровного стекла (10 из 36) и необрастающего покровного стекла с покрытием (9 из 36; D). (E-G) Влияние размера необработанного стеклянного покровного стекла на прикрепление артериального листа к гидрогелю PAA. Было проведено сравнение между необработанным стеклянным покровным стеклом диаметром 12 мм (E) и необработанным стеклянным покровным стеклом диаметром 13 мм (F) в лунке диаметром 14 мм. Эффективность прикрепления измеряли по количеству артериальных листов, прикрепленных к гидрогелю ПАА после удаления покровного стекла, по сравнению с общим количеством образцов: покровный лист 12 мм (10 из 36) и покровный лист 13 мм (52 из 72; G). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
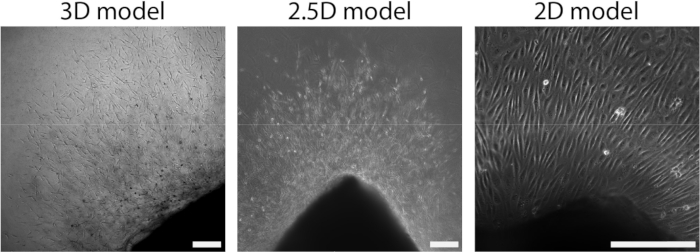
Рисунок 4: Размерность модели определяет организацию во время клеточного роста (d2+). Клетки мигрируют из ткани в виде ростков на 3D-модели (слева), аналогично 2,5D-модели (в центре). Клетки мигрируют из ткани в виде монослоя в 2D-конфигурации (справа). Масштабная линейка представляет собой 250 μм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 5: Начало прорастания эндотелия в модели 2.5D зависит от жесткости полиакриламидного гидрогелевого субстрата (d2). (А-Б) Артериальный лист покрывают тонким слоем геля с коллагеном I типа поверх мягкого (А; 1 кПа) или жесткого (В; 12 кПа) гидрогеля из полиакриламида (ПАА) на 2 день протокола (через 1 день после добавления слоя коллагена геля I типа). (В) Начало прорастания измерялось по количеству артериальных листов, которые уже демонстрируют признаки клеточного разрастания по сравнению с общим количеством образцов: мягких (7 из 24) и жестких (3 из 24). Масштабная линейка представляет собой 1 мм (A, B) или 500 μм (A', B'). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 6: Характеристика силы тяги во время ангиогенеза на ранних стадиях. Визуализация ячеек по времени (0-4 ч) отображается в верхнем ряду. Соответствующие смещения флуоресцентных маркеров (0-2 мкм) и клеточные тракции (0-50 Па) на гидрогелевой подложке с массой 1 кПа ПАА отображаются в среднем и нижнем ряду соответственно. Увеличенные значения сотовых тяг в 0 ч, 2 ч и 4 ч отображаются оранжевым цветом. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
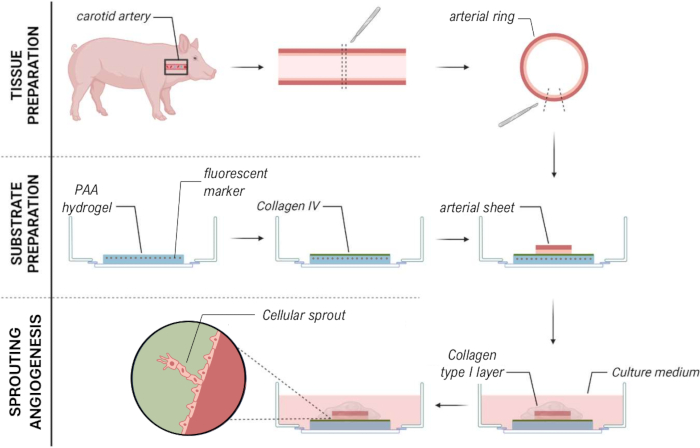
Рисунок 7: Метод модели ангиогенеза прорастания 2.5D ex vivo , который позволяет механически характеризовать клеточные ростки. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| 1 кПа | 12 кПа | |
| ПБС | 435 мкл | 373,7 мкл |
| 40% акриламида | 50 μл | 93,8 мкл |
| 2% бис-акриламид | 7,5 мкл | 25 мкл |
| Флуоресцентный маркер (темно-красный) | 5 μл | 5 μл |
| 10% APS | 2,5 мкл | 2,5 мкл |
| ТЕМЕД | 0,25 мкл | 0,25 мкл |
Таблица 1: Соотношения гелевых смесей ПАА.
| формула | Объем на 12-луночный планшет (130 μл) | |
| Среда ЭКГ | VЭКГ=Vfinal-V col1-V NaOH | 82,16 мкл |
| Коллаген I типа | Vcol1=(Vfinal*Cfinal)/Cstock | 46 мкл |
| НаОХ | VNaOH=0,04*Вcol1 | 1,84 мкл |
Таблица 2: Коллаген I типа смеси объемов с использованием аббревиатур объема (V) и концентрации (C).
Видео 1: Таймлапс-визуализация формирования клеточных ростков в рамках 2,5D-модели. Изображения клеток проводились с помощью фазовой контрастной визуализации в течение 22 часов с интервалом 17,5 минут. Клеточные ростки формировались на нескольких высотах в слое геля коллагена I типа, что наблюдалось в различных фокальных плоскостях. Масштабная линейка представляет собой 100 μм. Пожалуйста, нажмите здесь, чтобы скачать это видео.
Видео 2: Высокая скорость пролиферации клеток в клеточных ростках в рамках 2,5D-модели. Клетки визуализировали с помощью фазовой контрастной визуализации в течение 22 часов с временным интервалом 17,5 минут. Как лидеры, так и последующие клетки пролиферируют во время покадровой визуализации. Масштабная линейка представляет собой 100 μм. Пожалуйста, нажмите здесь, чтобы скачать это видео.
Дополнительный рисунок 1: Клеточный фенотип в 2D-модели (d2+) методом иммунофлуоресцентного окрашивания. (А) Иммунофлуоресцентное (ИФ) окрашивание клеточного ядра (DAPI), маркера эндотелиальных клеток (CD31) и маркера фибробластов (альфа-гладкомышечного актина; α-СМА). (B) IF окрашивание клеточного ядра (DAPI), маркера эндотелиальных клеток (CD31) и маркера гладкомышечных клеток (кальпонина). Масштабная линейка представляет собой 100 μм. Пожалуйста, нажмите здесь, чтобы загрузить этот рисунок.
Дополнительный файл 1: Протокол иммунофлуоресцентного окрашивания. Пожалуйста, нажмите здесь, чтобы скачать этот файл.
Обсуждение
Прорастающий ангиогенез – образование новых кровеносных сосудов – сложный процесс, регулируемый как молекулярными, так и механическими механизмами. В то время как за последние десятилетия было разработано множество 3D-моделей для изучения молекулярных драйверов (например, VEGF и передача сигналов Notch) прорастающего ангиогенеза, о клеточной механике известно очень мало из-за ограничений модели. Тракционная силовая микроскопия (TFM) — это хорошо известный метод количественной оценки клеточных сил в пространстве и времени, где двухмерные деформации подложки преобразуются в клеточные вытяжения. Таким образом, в этом протоколе мы описываем 2,5D-модель ex vivo, что означает, что мы локально обеспечиваем клетки 3D-средой, сохраняя при этом простоту 2D-модели, которая позволяет количественно оценить силы тяги во время прорастающего ангиогенеза (рис. 1). Для этого мы подготовили и засеяли лист свиной артерии (эндотелиальная сторона вниз; Рисунок 2) поверх гидрогеля из полиакриламида (ПАА) с коллагеновым покрытием типа IV, содержащего флуоресцентные маркеры. После прикрепления артериального листа с помощью стеклянного покровного стекла толщиной 13 мм (рис. 3) мы добавляем тонкий слой гидрогеля коллагена I типа, который позволяет формировать клеточные ростки (рис. 4). Используя эту модель, мы показываем, что во время клеточного прорастания 22,23,24,25 клетки-лидеры оказывают притягивающие силы (как было отмечено в литературе 19,20,21,22), но также и что клетки-последователи оказывают выталкивающие силы (рис. 6). Разрешение тракционного поля, полученное с помощью нашего протокола, позволяет проводить количественный анализ клеточной кинематики и динамики как во времени, так и в пространстве, что типично для работ, использующих микроскопию силы тяги на податливых подложках 37,38,39.
Более того, мы демонстрируем универсальность этой 2,5D ex vivo модели прорастающего ангиогенеза путем изменения механических сигналов микроокружения (Рисунок 5). В то время как прорастающий ангиогенез обычно происходит при физиологической жесткости 1 кПа35 , которую можно имитировать с помощью 3D коллагена I типа, опухолевый ангиогенез происходит в жесткой микросреде40 , которая выходит за пределы диапазона жесткости обычных 3D коллагеновых гидрогелей I типа. Жесткость подложки PAA можно легко отрегулировать, изменив соотношение сшивающих агентов для получения более высокой жесткости подложки. Используя эту модель, мы выявляем, что начало прорастающего ангиогенеза зависит от жесткости. Эти подложки не только обеспечивают настраиваемую жесткость, но и позволяют систематически модулировать различные другие механические сигналы, например, состав матрицы и плотность. Кроме того, эта модель позволяет нам изучать клеточную механику при манипулировании молекулярными регуляторами с использованием кондиционирования среды (например, влияние ингибирования передачи сигналов Notch на клеточную механику), чтобы понять механобиологические механизмы прорастающего ангиогенеза. Это демонстрирует полезность данной 2,5D-модели ex vivo для прорастающего ангиогенеза в образцах различных микроокружений.
Модель, которую мы представляем, использует обычный 2D TFM, который предлагает более простой анализ, более высокое пространственное разрешение и более легкую реализацию по сравнению с 3D (вязкоупругим) TFM, что делает его более доступным и экономичным26,41. Тем не менее, 3D (вязкоупругий) TFM обеспечивает более физиологически значимую среду, фиксируя силы тяги во всех трех измерениях и учитывая сложные механические свойства внеклеточного матрикса, предлагая более глубокое понимание поведения клеток в более реалистичном контексте 42,43,44,45. Этот эффект размерности также указывает на ограничение данной 2,5D-модели. Мы используем 2D TFM в предположении, что клетки мигрируют на 2D субстрате. В то время как в этой 2,5D-модели это происходит, клетки находятся в локальной 3D-среде и, таким образом, прилипают к слою геля коллагена I типа и оказывают влияние на этот слой геля. Предположение, которое мы приняли в рамках этого анализа, заключается в том, что слой геля коллагена I типа механически не связан (нет передачи силы между этими двумя гидрогелями) с границей раздела PAA из-за разницы в жесткости матрицы на порядок, что сводит к минимуму влияние клеточных сил на слой коллагена I типа. Это делает характеристику силы с помощью модели 2.5D ex vivo упрощенным представлением сил, создаваемых ячейками. Кроме того, этот протокол требует точности и включает в себя несколько этапов, в которых образцы могут быть потеряны, например, (i) трудности с видимостью клеток из-за чрезмерного количества ткани, окружающей артериальный лист (Рисунок 2), (ii) один из трех образцов не прикрепляется к субстрату PAA (Рисунок 3), (iii) не все образцы инициируют образование клеточных ростков (Рисунок 5), (iv) клеточные ростки не образуются на субстрате ПАА, и (v) расфокусированные флуоресцентные маркеры при использовании толстого артериального листа поверх гидрогеля ПАА низкой жесткости. Поэтому мы оптимизировали этот метод для 12-луночного планшета, чтобы обеспечить множество областей интереса для проведения механического анализа ангиогенеза прорастания.
В заключение следует отметить, что представленный подход к упрощенной характеристике клеточных тракционных сил прорастающего ангиогенеза живого артериального листа свиньи с использованием 2,5D-модели (рис. 7) может помочь в создании более точного понимания механических взаимодействий во время ангиогенеза в контексте нативной ткани в режиме реального времени, облегчая изучение динамических клеточных процессов с уменьшенной сложностью и улучшенной воспроизводимостью по сравнению с полностью 3D-системами. Это может улучшить наше понимание того, как клетки реагируют на механические сигналы в более физиологически значимой среде, сохраняя при этом аналитическую простоту двухмерных методов. Эти знания могут продвинуть вперед область тканевой инженерии с целью создания кровеносных сосудов, а также поиска терапевтических препаратов для профилактики опухолевого ангиогенеза с целью ограничения роста опухоли и уменьшения метастазирования.
Раскрытие информации
У авторов нет конфликта интересов, который можно было бы раскрыть.
Благодарности
Мы благодарим людей из LifeTec за сбор и транспортировку сонных артерий свиней с местной скотобойни; Леону Хермансу, Пиму ван ден Берсселаару и Адриа Виллакрозе Рибасу (TU/e, ICMS) за плодотворные дискуссии по экспериментальным процедурам и анализу механических характеристик. Мы выражаем благодарность за поддержку в виде грантов от Европейского исследовательского совета (771168), Нидерландской организации научных исследований (024.003.013), Академии Финляндии (307133, 316882, 330411 и 337531) и Центров передового опыта в области клеточного механостаза Фонда Университета Або (CellMech).
Материалы
| Name | Company | Catalog Number | Comments |
| 2% bis-acrylamide | Bio-Rad | 1610143 | |
| 2-mercaptoethanol | Merck Life Science | 60-24-2 | |
| 3-(Trimethoxysilyl)propyl methacrylate | Bind-Silane | Sigma-Aldrich | 440159-100ML |
| 40% acrylamide | Bio-Rad | 1610140 | |
| Aboslute ethanol (for analysis) | VWR International | 1.00983.1000 | |
| Absolute ethanol (industrial) | VWR International | 83813.41 | |
| Acetic acid, glacial 100% | Merck | 1000562500 | |
| Ammonium persulfate | APS | Bio-Rad | 7727-54-0 |
| antibody (primary) - calponin | abcam | ab46794 | |
| antibody (primary) - CD31 | Serotec | MCA1746 | |
| antibody (primary) - α-smooth muscle actin | αSMA | Dako | M0851 |
| antibody (secondary) - goat-anti-mouse-IgG1 Alexa 488 | Molecular Probes | A21121 | |
| antibody (secondary) - goat-anti-mouse-IgG2a Alexa 555 | Molecular Probes | A21137 | |
| antibody (secondary) - goat-anti-rabbit-IgG Alexa 555 | Molecular Probes | A21428 | |
| Autoclave | Astell | ||
| Calcium chloride dihydrate | CaCl2 | Calbiochem | 208291-250GM |
| Collagen type I, rat-tail | Corning | 354236 | |
| Collagen type IV, human placenta | Merck Life Science | C5533-5MG | |
| Endothelial Cell Growth Medium | ECG medium | Promocell | C-22111 |
| Expoxy-coated round tip tweezer | fine tweezer | Rubis Pinzette | E78144-2A |
| Fluorescent marker, dark red | Invitrogen | F8807 | |
| Glass coverslips, Ø13 mm, #1 | Epredia | CB00130RA120MNZ0 | |
| Glass coverslips, Ø13 mm, #1.5 | Epredia | CB00120RAC20MNZ0 | |
| Hydrochloride acid, 25% | HCl | Merck | 1.100316.1000 |
| Krebs-Henseleit buffer | Sigma-Aldrich | K3753 | |
| Microscope, Leica Application Suite X software, version 3.5.7.23225 | Leica Microsystems | ||
| Microscope, Leica DMi8 epifluorescent microscope | Leica Microsystems | ||
| Microscope, Nikon Ti2 Eclipse | Nikon | ||
| Microscope, NIS-Elements AR software | Nikon | ||
| N,N,N',N'-tetramethylethane-1,2-diamine | TEMED | Merck Life Science | 110-18-9 |
| Nalgene bottle | Thermo Scientific | 2187-0016 | |
| Needle, 21Gx1" | Henke Sass Wolf | HK4710008025 | |
| Normal serum, goat | Gibco | 10098792 | |
| Papaverine hydrochloride | Sigma | 61-25-6 | |
| Penicillin/Streptomyocin (10 000 U/mL) | P/S | Gibco | 15140163 |
| Petri-dish, large (145x20mm) | Greiner Bio-one | 639160 | |
| Petri-dish, small (60x15mm) | Greiner Bio-one | 628160 | |
| Phosphate Buffered Saline | PBS | Sigma | P4417 |
| Pluronic F-127 | Merck Life Science | P2443-250G | |
| Puncture needle, sharp closed tip | unknown | ||
| Scalpel, no. 4 | Swann-Morton | ||
| Sodium hydrogen carbonate | NaHCO3 | VWR International | 144-55-8 |
| sulfosuccinimidyl 6-(4'-azido-2'-nitrophenylamino)hexanoate | Sulfo-SANPAH | Thermo Scientific | 22589 |
| Surgical blade, no. 20 | Swann-Morton | ||
| Surgical drape sheet | Foliodrape | 2775001 | |
| Surgical tweezer | Lettix | 400024 | |
| Triton X-100 | Merck | 9036-19-5 | |
| UV lamp | Analytik Jena | 95-0042-13 | |
| well plate, 96-well, F-bottom | Greiner Bio-one | 655180 | |
| well plate, glass bottom 12-well | MatTek | P12G-0-14-F |
Ссылки
- Carmeliet, P. Angiogenesis in health and disease. Nat Med. 9 (6), 653-660 (2003).
- Folkman, J. Angiogenesis in cancer, vascular, rheumatoid and other disease. Nat Med. 1, 27-30 (1995).
- Kretschmer, M., Rüdiger, D., Zahler, S. Mechanical aspects of angiogenesis. Cancers. 13 (19), 4987 (2021).
- Bordeleau, F., et al. Matrix stiffening promotes a tumor vasculature phenotype. Proc Natl Acad Sci U S A. 114 (3), 492-497 (2017).
- Blanco, R., Gerhardt, H. VEGF and Notch in tip and stalk cell selection. Cold Spring Harb Perspect Med. 3 (1), a006569 (2013).
- Adams, R. H., Alitalo, K. Molecular regulation of angiogenesis and lymphangiogenesis. Nat Rev Mol Cell Biol. 8, 464-478 (2007).
- Carmeliet, P., De Smet, F., Loges, S., Mazzone, M. Branching morphogenesis and antiangiogenesis candidates: tip cells lead the way. Nat Rev Clin Oncol. 6, 315-326 (2009).
- Salam, N., et al. Assessment of migration of human mscs through fibrin hydrogels as a tool for formulation optimisation. Materials. 11 (9), 1781 (2018).
- Solbu, A. A., et al. Assessing cell migration in hydrogels: An overview of relevant materials and methods. Materials Today Bio. 18, 100537 (2023).
- Cao, W., Li, X., Zuo, X., Gao, C. Migration of endothelial cells into photo-responsive hydrogels with tunable modulus under the presence of pro-inflammatory macrophages. Regenerat Biomater. 6 (5), 259-267 (2019).
- Staton, C. A., Reed, M. W. R., Brown, N. J. A critical analysis of current in vitro and in vivo angiogenesis assays. Int J Exp Pathol. 90 (3), 195-221 (2009).
- Staton, C. A., et al. Current methods for assaying angiogenesis in vitro and in vivo. Int J Exp Path. 85, 233-248 (2004).
- Ngo, T. X., et al. In Vitro models for angiogenesis research: A review. Int J Tissue Regenerat. 5, 37-45 (2014).
- Tomita, Y., et al. An ex vivo choroid sprouting assay of ocular microvascular angiogenesis. J Vis Exp. (162), e61677 (2020).
- Kapoor, A., Chen, C. G., Iozzo, R. V. A simplified aortic ring assay: A useful ex vivo method to assess biochemical and functional parameters of angiogenesis. Matrix Biol Plus. 6-7, 100025 (2020).
- Stiffey-Wilusz, J., Boice, J. A., Ronan, J., Fletcher, A. M., Anderson, M. S. An ex vivo angiogenesis assay utilizing commercial porcine carotid artery: Modification of the rat aortic ring assay. Angiogenesis. 4 (1), 3-9 (2001).
- Kniazeva, E., Putnam, A. J. Endothelial cell traction and ECM density influence both capillary morphogenesis and maintenance in 3-D. Am J Physiol Cell Physiol. 297 (1), C179-C187 (2009).
- Davidson, C. D., Wang, W. Y., Zaimi, I., Jayco, D. K. P., Baker, B. M. Cell force-mediated matrix reorganization underlies multicellular network assembly. Sc Rep. 9 (1), 12 (2019).
- Lyle, K. S., Corleto, J. A., Wittmann, T. Microtubule dynamics regulation contributes to endothelial morphogenesis. BioArchitecture. 2 (6), 220-227 (2012).
- Kniazeva, E., et al. Quantification of local matrix deformations and mechanical properties during capillary morphogenesis in 3D. Integrat Biol. 4 (4), 431-439 (2012).
- Quintanilla, M. A., Hammer, J. A., Beach, J. R. Non-muscle myosin 2 at a glance. J Cell Sci. 136 (5), jcs.260890 (2023).
- Fischer, R. S., Gardel, M., Ma, X., Adelstein, R. S., Waterman, C. M. Local cortical tension by myosin II guides 3D endothelial cell branching. Curr Biol. 19 (3), 260-265 (2009).
- Yoon, C., et al. Myosin IIA–mediated forces regulate multicellular integrity during vascular sprouting. Mol Biol Cell. 30 (16), 1974-1984 (2019).
- Du, Y., et al. Three-dimensional characterization of mechanical interactions between endothelial cells and extracellular matrix during angiogenic sprouting. Sci Rep. 6, 21362 (2016).
- Vaeyens, M. M., et al. Matrix deformations around angiogenic sprouts correlate to sprout dynamics and suggest pulling activity. Angiogenesis. 23 (3), 315-324 (2020).
- Style, R. W., et al. Traction force microscopy in physics and biology. Soft Matter. 10 (23), 4047-4055 (2014).
- Trepat, X., et al. Physical forces during collective cell migration. Nat Phys. 5 (6), 426-430 (2009).
- Santos-Oliveira, P., et al. The force at the tip - modelling tension and proliferation in sprouting angiogenesis. PLoS Comput Biol. 11 (8), e1004436 (2015).
- Boreddy, S. R., Sahu, R. P., Srivastava, S. K. Benzyl isothiocyanate suppresses pancreatic tumor angiogenesis and invasion by inhibiting HIF-α/VEGF/Rho-GTPases: Pivotal role of STAT-3. PLoS One. 6 (10), 0025799 (2011).
- Teng, R. J., Eis, A., Bakhutashvili, I., Arul, N., Konduri, G. G. Increased superoxide production contributes to the impaired angiogenesis of fetal pulmonary arteries with in utero pulmonary hypertension. Am J Physiol Lung Cell Mol Physiol. 297 (1), L184-L195 (2009).
- Costa, G., et al. Asymmetric division coordinates collective cell migration in angiogenesis. Nature Cell Biol. 18 (12), 1292-1301 (2016).
- Slater, K., Partridge, J., Nandivada, H. . Corning tuning the elastic moduli of Corning Matrigel and collagen I 3D matrices by varying the protein concentration. , (2019).
- Lee, J., et al. Effect of chain flexibility on cell adhesion: Semi-flexible model-based analysis of cell adhesion to hydrogels. Sci Rep. 9 (1), 2463 (2019).
- Motte, S., Kaufman, L. J. Strain stiffening in collagen i networks. Biopolymers. 99 (1), 35-46 (2013).
- Butcher, D. T., Alliston, T., Weaver, V. M. A tense situation: Forcing tumour progression. Nat Rev Cancer. 9 (2), 108-122 (2009).
- Artym, V. V., Matsumoto, K. Imaging cells in three-dimensional collagen matrix. Curr Prot Cell Biol. 10, Unit 10.18.1-Unit 10.18.20 (2010).
- Labernadie, A., et al. A mechanically active heterotypic E-cadherin/N-cadherin adhesion enables fibroblasts to drive cancer cell invasion. Nat Cell Biol. 19 (3), 224-237 (2017).
- Bazellières, E., et al. Control of cell-cell forces and collective cell dynamics by the intercellular adhesome. Nat Cell Biol. 17 (4), 409-420 (2015).
- Uroz, M., et al. Traction forces at the cytokinetic ring regulate cell division and polyploidy in the migrating zebrafish epicardium. Nat Mater. 18 (9), 1015-1023 (2019).
- Dong, C., Nastaran, Z., Konstantopoulos, K. . Biomechanics in oncology. , (2018).
- Schwarz, U. S., Soiné, J. R. D. Traction force microscopy on soft elastic substrates: A guide to recent computational advances. Biochim Biophys Acta. 1853 (11), 3095-3104 (2015).
- Toyjanova, J., et al. 3D Viscoelastic traction force microscopy. Soft Matter. 10 (40), 8095-8106 (2014).
- Legant, W. R., et al. Multidimensional traction force microscopy reveals out-of-plane rotational moments about focal adhesions. Proc Natl Acad Sci U S A. 110 (3), 881-886 (2013).
- Steinwachs, J., et al. Three-dimensional force microscopy of cells in biopolymer networks. Nat Meth. 13 (2), 171-176 (2016).
- Franck, C., Maskarinec, S. A., Tirrell, D. A., Ravichandran, G. Three-dimensional traction force microscopy: A new tool for quantifying cell-matrix interactions. PLoS One. 6 (3), e17833 (2011).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены