Method Article
2.5D 모델: 생체 조직에서 발아 혈관 형성의 생체 외 기계적 특성화를 위한 모델
요약
발아 및 질병의 기본이 되는 발아 혈관 신생은 복잡한 분자 및 기계적 과정을 포함합니다. 우리는 돼지 경동맥에서 발아하는 세포를 분석하여 강성 의존적 혈관 신생과 뚜렷한 리더-추종자 세포 역학을 밝히는 다재다능한 2.5D 생체 외 모델을 제시합니다. 이 모델은 조직 공학 전략 및 암 치료 접근 방식을 발전시키는 데 도움이 됩니다.
초록
발아 혈관 형성은 기존 혈관 구조에서 새로운 혈관이 형성되는 것으로, 조직 성장 및 복구와 같은 생리학적 과정과 암 및 전이를 포함한 병리학적 과정에 매우 중요합니다. 발아 혈관 신생의 다단계 과정은 분자 및 기계적으로 주도되는 과정입니다. 혈관 내피 성장 인자에 의한 세포 새싹 유도, Notch 신호전달을 통한 리더/팔로워 세포 선택, 내피 세포의 지시 이동, 혈관 융합 및 안정화로 구성됩니다. 세포 발아의 기본 메커니즘을 더 잘 이해하기 위해 수년에 걸쳐 다양한 발아 혈관 형성 모델이 개발되었습니다. 발아 혈관 신생의 분자 동인에 대한 이해의 발전에도 불구하고 기계적 단서의 역할과 발아 혈관 신생의 기계적 동인은 기존 모델의 한계로 인해 연구되지 않은 상태로 남아 있습니다. 이 연구에서는 견인력 현미경을 사용하여 돼지 경동맥에서 싹이 트는 세포를 기계적으로 특성화할 수 있는 2.5D 생체 외 모델을 설계했습니다. 이 모델은 새싹 내에서 리더 세포가 당기는 힘을 발휘하고 추종자 세포가 매트릭스에 미는 힘을 가하는 뚜렷한 힘 패턴을 식별합니다. 이 모델의 다재다능함은 매트릭스 강성과 같은 화학적 및 기계적 단서를 모두 조작할 수 있게 하여 다양한 미시환경과의 관련성을 향상시킵니다. 여기서, 우리는 발아 혈관 신생의 시작이 강성에 의존한다는 것을 보여줍니다. 발아 혈관 신생에서 세포 견인력을 정량화하기 위해 제시된 2.5D 모델은 단순화되었지만 생리학적으로 관련된 방법을 제공하여 기계적 신호에 대한 세포 반응에 대한 이해를 향상시켜 종양 혈관 신생에 대한 조직 공학 및 치료 전략을 발전시킬 수 있습니다.
서문
혈관신생은 기존 혈관에서 새로운 혈관이 형성되는 과정입니다. 이 과정은 배아 발달, 상처 치유 및 암 진행에 필수적이며, 이 모든 것은 미세환경 1,2,3,4의 생체역학적 변화와 관련이 있습니다. 혈관신생이 시작되면 저산소 또는 손상된 조직은 혈관 내피 성장 인자(VEGF)를 방출하여 주변 혈관의 내피 세포를 활성화하여 내피 새싹을 형성하며, 여기서 두 개의 뚜렷한 리더 및 추종자 표현형이 분자 노치 신호 경로를 통해 채택됩니다5. 발아 혈관 형성으로 알려진 현상인 내피 새싹이 형성되면 리더 세포는 주변 세포외 기질을 분해하여 후행 추종 세포와의 세포-세포 접착을 잃지 않고 VEGF 자극을 향해 집합적으로 이동합니다 6,7.
지난 수십 년 동안 다양한 방법론을 통해 집단 세포 이동을 조사하는 발아 혈관 신생 분석법의 수가 증가하고 있으며, 각각 뚜렷한 이점과 한계를 제공합니다. 이러한 분석법은 3D 매트릭스를 통해 내피 세포와 같은 세포 그룹의 조정된 움직임을 평가하여 통제된 환경에서 발아, 침입 및 집단 이동과 같은 세포 행동을 연구할 수 있도록 합니다 8,9,10. In vivo Sprouting angiogenesis assay는 살아있는 유기체 내에서 포괄적인 평가를 제공하여 복잡한 상호 작용을 포착하지만 시간이 많이 걸리고 비용이 많이 들며 변동성이 높기 쉽고 정량화하기 어렵습니다11,12. 체외 발아 혈관 형성 분석은 높은 재현성과 정밀한 정량화로 실험 조건을 정밀하게 제어할 수 있지만 생체 내 복잡성을 완전히 복제하지 못할 수 있습니다 11,12,13. 이와는 대조적으로, 대동맥 고리 분석법이 가장 널리 수행되는 모델인 생체 외 발아 혈관 형성 분석법은 유기체 외부의 조직을 사용하여 생체 내 합병증을 피하면서 생리학적 관련성을 보존합니다 14,15,16. 기술적으로 까다롭고 때로는 조직 생존력에 어려움을 겪지만, 체외 모델은 복잡성과 제어 사이의 중요한 균형을 제공하여 발아 혈관 신생을 연구하기 위한 유망한 접근 방식입니다. 이러한 모델은 발아 혈관 신생의 분자 동인을 연구하는 데 광범위하게 사용되었지만 기계적 신호의 영향과 세포의 기계적 거동은 여전히 잘 이해되지 않고 있습니다.
발아 혈관 형성 중 다세포 이동은 액토미오신 기반 수축력이 주변 세포외 기질로의 내피 세포 침입을 조절하기 때문에 세포 역학에 크게 의존합니다 17,18,19,20. 특히, 세포21 내의 주요 액틴 기반 수축 기계인 비근육 미오신 II 모터는 발아 혈관 형성22,23 동안 세포 수축력을 제어하는 것으로 관찰되었습니다. 리더 세포는 주변 3D 세포 외 기질의 변형이 리더 세포 주변, 특히 근처의 액틴이 풍부한 세포 돌기23,24 주위에서 추종자 22,23,25에 비해 훨씬 높기 때문에 리더 세포는 새싹의 주된 힘 생성 요소일 가능성이 높습니다 . 3D에서 발아 혈관 신생에서 세포 수축성의 중요성에 대한 이러한 증거가 증가하고 있음에도 불구하고, 발아 혈관 신생의 세포 역학에 대한 시공간 기계적 특성화 방법은 부족합니다.
이 연구의 전반적인 목표는 발아 중 세포 이동의 기계적 특성을 허용하는 방법을 개발하는 것입니다. 생물학적으로 관련된 맥락에서 기계적 힘의 시공간 특성을 달성함으로써 세포 역학이 혈관 형성 새싹 형성에 어떻게 영향을 미치는지에 대한 새로운 통찰력을 제공하는 것을 목표로 합니다. 이를 위해 2D 폴리아크릴아미드(PAA) 하이드로겔을 만들어 그 위에 경동맥 시트를 파종하고 콜라겐 I형 겔의 얇은 층으로 덮어 세포에 국부적인 3D 환경을 구축하여 2.5D 모델 시스템을 개발했습니다. 다세포 새싹은 PAA-콜라겐 겔 계면의 동맥 시트에서 이동했습니다. 기존 기법과 비교했을 때 이 방법의 장점은 2D PAA 하이드로겔을 통해 세포가 탄성 2D 기판에 부착되어 세포 견인력에 따라 기판을 변형하는 잘 알려진 다목적 기술인 견인력 현미경(TFM)으로 분석할 수 있다는 것입니다26. 이러한 변형은 포착될 수 있고, 세포 견인력은 기판(26)의 기계적 성질에 기초하여 계산될 수 있다. TFM을 생체 외 생체 조직에서 사용하도록 조정함으로써 체외 제어와 생체 내 관련성 사이의 격차를 해소하여 혈관 신생 중 기계적 힘에 대한 보다 포괄적인 이해를 제공하는 것을 목표로 합니다.
프로토콜
이 프로토콜에는 돼지 경동맥이 사용되었습니다. 돼지 경동맥은 지역 도축장에서 얻은 5-7개월, 체중(살아있음) 80-120kg의 네덜란드 랜드레이스 잡종 돼지에서 수확했습니다. 이 프로토콜은 네덜란드 정부(네덜란드 농림자연식품품질부)의 감독하에 진단 및 연구를 위한 도축장 동물 재료에 관한 EC 규정 1069/2009를 준수했으며 동물 복지 관련 법률 기관(Food and Consumer Product Safety Authority)의 승인을 받았습니다. 조직은 이미 살처분된 동물의 부산물에서 채취했기 때문에 윤리적 승인이 필요하지 않았습니다. 사망과 조직 운반 사이의 시간은 도축장에 따라 10-25분입니다.
참고: 재료 표에는 이 프로토콜에 사용되는 재료, 장비 및 시약에 대한 세부 정보가 요약되어 있습니다. 2D 및 3D 샘플에 대한 프로토콜은 보충 파일 1에 설명되어 있습니다.
1. 2D 폴리아크릴아미드(PAA) 기판 제조
- 흄 후드에서 12:1:1 앱솔루트 에탄올(합성용), 아세트산 및 바인드 실란을 각각 4286 μL, 357 μL 및 357 μL에서 혼합하여 바인드 실란 용액을 준비합니다. 120μL/웰 바인드 실란 용액을 실온에서 1시간 동안 유리 바닥 12웰 플레이트에 배양합니다.
주의 : 앱솔루트 에탄올은 인화성이 높은 액체 및 증기(H225)이며 심각한 눈 자극(H319)을 유발합니다. 아세트산은 가연성 액체 및 증기(H226)로 심각한 피부 화상과 눈 손상(H314)을 일으킵니다. 개인 보호 장비를 착용하고 흄 후드에서 작업하십시오. - 흄 후드에서 스프레이 병을 사용하여 유리 바닥의 12웰 플레이트를 앱솔루트 에탄올(산업용)로 3x 세척합니다. 에탄올은 버리십시오.
- 유리 바닥 12웰 플레이트를 질소 가스를 사용하여 건조시킵니다. 유리 바닥 위에 흰색 유리가 나타나면 세탁이 충분하지 않은 것입니다. 유리 바닥 12웰 플레이트를 다시 세척합니다.
- 표 1의 비율에 따라 PAA 겔 혼합물을 준비합니다.
- 마이크로 원심분리 튜브에 PBS를 추가하고 겔 혼합물에 40% 아크릴아미드, 2% 비스-아크릴아미드 및 형광 마커를 재현탁합니다. 젤 준비 직전에 해결책을 소용돌이치십시오.
- 가능한 한 빨리 10% APS 및 TEMED를 용액에 추가하고 각 요소를 추가한 후 와류를 추가합니다. 각 웰의 유리 바닥에 11.5μL의 겔 혼합물 방울을 피펫으로 피펫하고 방울 위에 13mm 커버슬립을 부드럽게 놓습니다.
- 플레이트를 부드럽게 두드리고 휘저어 젤 혼합물을 커버슬립 아래에 고르게 펴 바릅니다. 기포가 나타나면 커버 슬립을 부드럽게 들어 올려 제거합니다. 젤을 실온에서 1시간 동안 중합하도록 둡니다. 튜브에 남아 있는 겔 혼합물을 사용하여 중합을 확인합니다. 12웰 플레이트의 중합된 PAA 겔은 내부 후광을 표시합니다.
주의: 아크릴아마이드는 삼키거나 흡입하면 유해하며(H302 + H332), 피부 자극을 일으키고(H315), 알레르기성 피부 반응을 일으킬 수 있음(H317), 심한 눈 자극을 일으킬 수 있음(H319), 유전적 결함을 유발할 수 있음(H340), 암을 유발할 수 있음(H350), 생식 능력 손상이 의심되는 경우(H361f), 삼키면 장기간 또는 반복 노출로 장기에 손상을 일으킴(H372). APS는 화재를 강화할 수 있으며(산화제, H272), 삼키면 유해함(H302), 피부 자극을 일으키고(H315), 알레르기성 피부 반응을 일으킬 수 있음(H317), 심한 눈 자극을 일으킬 수 있음(H319), 흡입 시 알레르기 또는 천식 증상 또는 호흡 곤란을 일으킬 수 있음(H334), 호흡기 자극을 유발할 수 있음(H335). TEMED는 인화성이 높은 액체 및 증기(H225)로 삼키면 유해하고(H302), 심각한 피부 화상과 눈 손상을 일으키며(H314), 흡입하면 독성이 있습니다(H331). 개인 보호 장비를 착용하십시오.
- 중합 후 PBS를 우물에 첨가하십시오. 핀셋 및/또는 구부러진 바늘을 사용하여 커버 슬립을 부드럽게 들어 올려 제거합니다. PBS에서 젤을 한 번 씻으십시오.
- PAA 겔의 콜라겐 코팅을 촉진하려면 가교제 Sulfo-SANPAH를 사용하여 겔을 기능화해야 합니다. 초순수에 용해된 75 μL의 1 mg/mL Sulfo-SANPAH를 PAA gel에 첨가하고 365 nm UV 광선 아래에서 5분 동안 배양합니다.
참고: Sulfo-SANPAH를 빛으로부터 보호하고 UV 배양 직전에 초순수를 첨가하십시오. 밝은 빨간색(UV-광선 배양 전)에서 짙은 빨간색(UV-광선 배양 후)까지 변색이 보입니다.
주의: Sulfo-SANPAH는 심각한 눈 자극을 유발합니다(H319). - 생물 안전성 작업대에서 겔에 Sulfo-SANPAH를 빠르게 멸균 PBS 세척합니다. 따라서 기능성화된 PAA 겔을 멸균 PBS에서 10분 동안 2x 세척합니다.
참고: 프로토콜의 이 지점부터 모든 단계는 멸균 조건에서 수행됩니다. - 생물 안전 캐비닛에서 얼음 위의 PBS에 0.1mg/mL 콜라겐 IV형 용액을 준비합니다. Pipet 50 μL의 0.1 mg/mL 콜라겐 IV형 방울을 기능화된 PAA 겔 위에 놓고 4 °C에서 밤새 배양합니다.
- 멸균 PBS에서 젤을 2번 세척합니다. PBS를 제거하고 젤을 5분 동안 건조시킵니다.
- 겔 위에 50μL 액적의 내피 세포 성장(ECG) 배지를 피펫하고 37°C 및 5% CO2에서 최소 1시간 동안 배양합니다.
참고: ECG 배지에서 겔을 배양하면 겔에 대한 세포 및 조직 부착이 향상됩니다.
2. 운송을 위한 수정된 Krebs 용액 준비
참고: 수정된 Krebs 솔루션을 새로 준비합니다. 이 프로토콜에서 변형된 Krebs 용액은 조직 채취 1일 전에 준비됩니다.
- 고압증기멸균으로 운송 병을 살균합니다. 유리병에 필요한 총 운반량(350mL)의 90%(350mL)를 채웁니다. 수온이 15-20 °C인지 확인하십시오.
- 교반 자석을 사용하여 물을 부드럽게 저어주면서 9.6g/L(3.36g)의 Krebs-Henseleit 완충액을 넣고 녹을 때까지 저어줍니다. 파스퇴르 피펫을 사용하여 소량의 용액으로 계량 보트를 헹구어 용액에 미량의 분말이 모두 포함되도록 합니다. 용액을 가열하지 마십시오.
- 교반하는 동안 용액에 0.373g/L(130.55mg)의 염화칼슘(CaCl2)을 넣고 녹을 때까지 저어줍니다. 소량의 용액으로 계량 보트를 헹굽니다.
주의: H319는 눈에 심한 자극을 일으킵니다. - 교반하는 동안 용액에 2.1g/L(0.63g)의 중탄산나트륨(NaHCO3)을 넣고 녹을 때까지 저어줍니다. 소량의 용액으로 계량 보트를 헹굽니다.
- 교반하는 동안 용액에 1 x 10-1mM (13.15mg) 파파베린을 넣고 녹을 때까지 저어줍니다. 소량의 용액으로 계량 보트를 헹굽니다.
참고: 파파베린은 채취 중 혈관을 절단하고 취급하여 발생하는 과도한 혈관 수축을 방지하는 데 사용되는 평활근 이완제입니다.
주의 : H301은 삼키면 독성이 있습니다. - 흄 후드에서 용액에 0.05mM(1.2μL) 2-메르캅토에탄올을 첨가하고 저어줍니다.
참고: 2-메르캅토에탄올은 낮은 수준의 산소 라디칼을 유지하는 데 사용됩니다.
주의: 2-메르캅토에탄올은 삼키거나 흡입하면 독성이 있고(H301 + H331), 피부 접촉 시 치명적이며(H310), 피부 자극을 일으키고(H315), 알레르기성 피부 반응을 일으킬 수 있으며(H317), 심각한 눈 손상을 일으킬 수 있으며(H318), 태아에게 손상을 줄 수 있음(H361d), 삼키면 장기간 또는 반복 노출로 장기에 손상을 줄 수 있으며(H373), 장기적인 영향을 미치며 수생 생물에 매우 유독합니다(H410). 개인 보호 장비를 착용하고 흄 후드에서 작업하십시오. - 교반하는 동안 1N(1M) HCl 또는 1N(1M) NaOH를 추가하여 pH를 7.2로 조정합니다. 최종 pH 목표는 7.4이지만 여과 중에 pH가 0.1-0.3 pH 단위 상승할 수 있습니다.
주의 : HCl에는 압력이 가해지는 가스가 포함되어 있습니다. 가열하면 폭발할 수 있으며(H280), 심한 피부 화상 및 눈 손상을 일으킬 수 있으며(H314), 흡입하면 독성이 있습니다(H331). 개인 보호 장비를 착용하십시오. - 생물 안전 캐비닛에서 계속 작업하십시오. 용액을 최종 부피로 가져오기 위해 10% 초순수를 추가합니다.
- 다공성이 0.22 μm인 멤브레인을 사용하여 여과하여 용액을 즉시 살균합니다. 멸균 용액을 멸균 병에 직접 분배합니다. 용액에 2% 페니실린/스트렙토미오신(P/S) 7mL를 추가합니다.
참고: 운송 중 2% P/S가 배지에 추가되어 모든 박테리아를 제거합니다. 조직 배양 중에 1% P/S가 배지에 추가됩니다. - 조직 채취 시까지 변형된 Krebs 용액을 4°C에서 보관하십시오.
3. 조직 수확
- 도축장에 따라 전기 충격 또는 CO2를 통해 돼지를 기절시킵니다. 그 후, 돼지를 뒷다리에 매달아 피를 흘리고 죽은 것으로 선언합니다.
- 깨끗한 도축 과정에 들어가기 전에 돼지의 탈모를 위해 데우고, 마지막 털을 제거하기 위해 그을리고, 사체 외부를 살균합니다.
- 복부를 따라 정중선을 절개하고 내부 장기를 조심스럽게 제거하여 돼지의 내장을 제거합니다. 도축장에 따라 경동맥이 돼지 사체에 여전히 붙어 있거나 흉기를 뽑아 사체에서 경동맥을 이미 제거했습니다.
- 날카로운 칼을 사용하여 동맥을 건드리거나 기계적으로 변형시키지 않고 시체 또는 인후 부위 조직에서 남아 있는 주변 조직과 함께 경동맥을 적출합니다.
- 병을 잠시 열어 멸균 변형 Krebs 용액이 들어 있는 운송 병에 경동맥이 포함된 조직을 놓습니다. 병을 한 번 뒤집어 전체 조직이 Krebs 용액으로 덮여 있는지 확인합니다. 얼음에 담긴 조직을 실험실로 운반합니다. 이동에는 약 30-45분이 소요됩니다.
4. 조직 해부
- 해부 장비 수술용 핀셋(거친 핸들링), 에폭시 코팅된 라운드 팁 핀셋(미세 핸들링), 메스, 집게 및 커버슬립을 고압멸균으로 살균합니다.
- 조직 채취/운송 전에 생물 안전 작업대를 준비합니다. 수술용 드레이프 시트로 절개 부위를 덮습니다. 해부 장비(멸균 50mL 튜브), 수술용 블레이드 및 멸균 커버슬립을 장착합니다. 두 개의 큰 페트리 접시에 멸균 PBS를 채워 해부 트레이를 준비합니다. 37°C에서 ECG 배지를 사용하여 하나의 작은 페트리 접시에 조직 배양을 배양합니다.
- 조직 운송 후 생물 안전 캐비닛 내에서 수술용 핀셋을 사용하여 운송 병(변형된 크렙스 용액으로 채워짐)에서 멸균 PBS로 채워진 대형 페트리 접시로 경동맥을 옮깁니다.
- 수술용 핀셋과 메스를 사용하여 경동맥을 둘러싼 과도한 조직을 제거하여 경동맥을 명확하게 볼 수 있습니다.
- 경동맥 양쪽 끝에서 2-3cm를 제거하고 메스로 절개하여 동맥 분기점에 가까운 부위를 제거합니다. 가는 둥근 끝 핀셋을 사용하여 경동맥을 둘러싼 동맥 근막을 제거합니다.
알림: 메스 날을 교체하면 근막을 더 정확하게 절단하는 데 도움이 됩니다. - 경동맥을 멸균 PBS로 채워진 새로운 큰 페트리 접시로 옮깁니다. 동맥 근막의 남아 있는 얇은 층을 가능한 한 많이 제거합니다.
참고: PBS에서 경동맥이 길수록 더 많은 근막 조각이 헐거워지는 경향이 있습니다. 근막을 제거하는 것은 현미경 검사 중에 시력을 방해하기 때문에 중요합니다. - 깨끗한 경동맥을 약 2mm 너비의 고리로 자릅니다. 경동맥 고리를 ECG 매체로 채워진 예열된 작은 페트리 접시에 옮기고 37°C를 유지합니다.
5. 조직 파종
참고: PAA 하이드로겔에 파종한 후 동맥 시트 위에 다양한 크기의 커버슬립 없음, 멸균 처리되지 않은 커버슬립 또는 멸균 플루론으로 처리된 커버슬립(PBS에서 1% w/v 플루론, 하룻밤 동안 배양하고 사용 전 멸균 초순수로 세척)을 추가하여 조직 부착을 테스트했습니다.
- 젤에서 ECG 중간 방울을 제거합니다. 경동맥 고리를 멸균 PBS로 채워진 깨끗한 매체의 페트리 접시로 옮깁니다.
- 끝이 둥근 핀셋과 메스를 사용하여 링을 반으로 자릅니다. 고리 반개를 약 2mm 너비의 시트로 해부하여 2 x 2mm 크기의 동맥 시트를 만듭니다. 동맥 시트의 내피 쪽의 방향에 유의하십시오. 동맥판의 곡률과 일부 남아 있는 근막은 이 방향을 결정하는 데 도움이 될 수 있습니다.
참고: 경동맥 고리의 크기는 다를 수 있습니다. 큰 고리는 약 6-8 장을 산출하고 작은 고리는 3-4 장을 산출합니다. 큰 고리는 동맥 시트의 곡률이 적기 때문에 부착력이 향상됩니다. - 둥근 팁 핀셋을 사용하여 시트 뒤쪽(혈관 벽 바깥쪽)에 있는 동맥 시트를 잡고 시트를 배치할 때 PAA 기판이 손상되지 않도록 내피 내부 내벽이 PAA 기판을 향하도록 PAA 젤의 가장자리에 시트를 놓습니다.
- 핀셋이나 집게를 사용하여 겔을 건드리지 않고 동맥 시트를 PAA 하이드로겔의 중앙으로 매우 부드럽게 움직입니다. 동맥 시트를 젤 가장자리에 놓습니다(조직이 핀셋이나 집게에 달라붙을 수 있음).
참고: 혈관 벽 바깥쪽에 있는 동맥 근막의 작은 잔해는 동맥 시트를 잡을 수 있는 쉬운 손잡이를 만드는 반면 혈관 벽의 내피 내벽은 매우 매끄럽습니다. - PAA 기질에 배치된 동맥 시트 위에 50μL의 ECG 배지를 추가합니다. ECG 배지의 물방울을 젤 위에 유지하기 위해 사용합니다.
- 끝이 둥근 핀셋을 사용하여 매체의 PAA 기판에 있는 동맥 시트 위에 마른 13mm 커버슬립을 놓습니다. 유리 바닥의 내부 테두리를 사용하여 커버슬립이 중간 액적에 닿고 매체가 그 아래로 퍼질 때까지 커버슬립을 부드럽게 내립니다.
알림: 13mm 커버슬립은 유리 바닥 웰 플레이트의 내벽 크기와 밀접하게 일치하기 때문에 유리합니다. 커버슬립을 너무 빨리 내리면 티슈가 커버슬립 가장자리로 이동합니다. - 조직을 37°C 및 5% CO2 에서 5시간 동안 부착한 후 각 웰에 1mL의 ECG 배지를 추가합니다. PAA 기판에 동맥 시트를 37°C 및 5% CO24 시간 동안 24개 놓습니다.
6. 2.5D 모델 생성
- 커버슬립 제거를 위해 라운드 팁 핀셋을 오토클레이브합니다. 초순수에 1M NaOH를 준비하고 0.22μm 기공 크기의 필터를 통한 여과로 살균한 후 4°C에서 보관합니다.
참고 : 1M NaOH는 향후 실험에서 재사용 할 수 있습니다. - 끝이 구부러진 멸균 날카로운 바늘을 사용하여 동맥 시트에서 13mm 커버슬립을 매우 부드럽게 들어 올리고 커버슬립을 제거합니다. 유리 바닥의 내부 링을 지지대로 사용하여 커버 슬립을 들어 올리고 제거하십시오. 옆으로 움직이면 PAA 기질에서 동맥판이 분리될 위험이 높아집니다.
- 멸균 미세원심분리기 튜브에서 표 2 에 따라 콜라겐 유형 I 혼합물을 얼음 위에 준비합니다. 용액에 콜라겐 유형 I과 NaOH를 첨가하면 매우 잘 재현탁하고 튜브를 한 번 뒤집어 혼합물이 균일하게 혼합되도록 합니다.
참고: 혼합물에 콜라겐 유형 I을 추가하면 밝은 분홍색 혼합물이 무색으로 변합니다. NaOH가 첨가되면 무색 혼합물이 밝은 분홍색으로 변합니다. - 진공 흡입 시스템을 사용하여 우물에서 매체를 제거합니다. 조직을 만지지 않고 가능한 한 조직을 둘러싼 매체를 제거하십시오.
참고: 동맥 시트를 둘러싸고 있는 매체가 너무 많으면 콜라겐 유형 I 젤이 동맥시트를 둘러싸는 것을 방지할 수 있습니다. - 각 동맥 시트 위에 콜라겐 유형 I 젤 혼합물 10μL 방울을 추가하고 콜라겐 유형 I 젤을 37 °C 및 5 % CO2에서 1 시간 동안 중합하도록 둡니다.
- 매우 부드럽게 예열된 ECG 배지 1mL를 각 웰에 추가하고 샘플을 37°C 및 5% CO2에 놓습니다.
7. 살아있는 세포 화상 진찰
참고: 라이브 셀 이미징은 열, CO2 및 습도 제어 기능이 있는 Leica DMi8 또는 Nikon Ti2 Eclipse epi-fluorescence 현미경을 사용하여 수행되었으며 Leica 또는 NIS 소프트웨어를 사용하여 제어되었습니다. 적응형 초점 제어(Leica)와 퍼펙트 포커스 시스템(Nikon)을 사용하여 초점을 시간에 유지했습니다.
- 2.5D 시스템에서 24시간 배양 후 발아 혈관 신생을 확인합니다. 일부 동맥 시트는 배양 24시간 후에 이미 세포 새싹을 형성하기 시작하는 반면, 다른 시트는 내피 발아를 시작하는 데 더 많은 시간이 필요합니다.
- 발아 혈관 신생이 시작된 경우 ECG 배지를 새로 고치고 현미경의 37°C 예열 배양 상자 내의 스테이지 홀더에 12웰 플레이트를 놓습니다.
- 관심 있는 목표를 선택합니다. 이 연구에서는 다양한 목표가 사용되었으며, 10x 대물렌즈를 사용하여 세포 새싹 형성에 대한 전반적인 개요를 생성하고 20x 대물렌즈를 사용하여 TFM을 수행했습니다.
- 관심 있는 채널을 정의합니다. TFM을 위해 위상차를 사용하여 세포 새싹을 시각화하고 660nm 파장의 형광 채널을 사용하여 PAA 기판의 형광 마커(진한 빨간색)를 시각화합니다.
- 관심 있는 (여러) 영역을 선택하고 초점 평면을 찾습니다. 초점 시스템(Leica DMi8의 적응형 초점 제어 또는 Nikon Ti2 Eclipse의 퍼펙트 포커스 시스템)을 켜서 타임랩스 이미징에서 안정적인 초점을 보장합니다.
- 시간 간격과 타임랩스 길이를 선택하여 관심 있는 타임랩스를 정의합니다. 이 연구에서는 다른 목적으로 다른 시간 간격(5-20분)과 타임랩스 길이(4-24시간)가 사용되었습니다.
- TFM을 위해 타임랩스 이미징 후 초순수에 5% SDS 방울을 여러 방울 첨가하여 자란 세포를 제거하고 몇 분 동안 기다립니다. 선택한 각 위치에 대해 PAA 기판에 있는 형광 마커의 z-스택(2μm의 z 높이는 0.2μm의 단계 크기로 정의됨)을 사용하여 참조 이미지로 형광 마커의 편안한 상태를 얻습니다.
참고: Z-stack 이미징은 세포가 z 방향으로 형광 마커를 당기거나 밀 수 있기 때문에 수행됩니다.
8. 견인력 현미경 분석
- 정확한 분석을 위해 최상의 참조 이미지를 기준으로 타임랩스 이미지를 정렬하고 자릅니다.
- PAA 하이드로겔에서 형광 마커의 변위를 측정하려면 맞춤형 MatLab 코드를 사용하여 타임랩스 이미지와 참조 이미지 사이에 PIV(Particle Image Velocimetry)를 수행합니다. PIV 분석 내에서 이미지를 0.5 중첩이 있는 32 x 32 픽셀의 질문 창으로 나눕니다.
- Boussinesq 방정식27을 사용하여 유한한 겔 두께를 가진 무한 겔의 푸리에 변환 기반 견인 현미경으로 형광 마커의 변위로 인한 견인력을 계산합니다.
결과
설명된 프로토콜을 통해 콜라겐 I 유형 겔의 얇은 층으로 덮인 2D PAA 하이드로겔 위에 있는 돼지 경동맥에서 생체 외 발아 혈관 신생을 유도할 수 있으므로 2.5D 생체 외 발아 혈관 신생 모델을 생성할 수 있습니다. 이 모델을 통해 기존 TFM을 수행하고 공간과 시간에서 PAA 겔 계면에서 발아 혈관 신생의 세포 견인력을 측정할 수 있습니다.
2.5D 모델을 확립하기 위해 먼저 형광 마커가 내장된 2D 폴리아크릴아미드(PAA) 하이드로겔을 준비한 다음 IV형 콜라겐(d-1 - d0)으로 하룻밤 동안 코팅했습니다. 0일(d0)에 콜라겐 IV로 코팅된 하이드로겔에 경동맥판을 놓고 밤새도록(d0 - d1) 부착시켰다. 그 후, 콜라겐 유형 I 젤의 얇은 층을 동맥 시트에 적용한 후 1일차(d1)에 이미징을 시작하여 세포 발아를 모니터링하고 기계적 분석(d1에서 d2)을 위해 형광 마커를 추적했습니다. 2.5D 모델에서 발아 혈관 신생을 확인하기 위해 3D 콜라겐 I 타입 겔에서 기존의 체외 발아 혈관 신생을 병렬로 수행했습니다. 이를 위해 콜라겐 유형 I 젤의 얇은 층을 준비한 다음 경동맥 시트를 파종한 다음 추가 콜라겐 층(d0)으로 덮었습니다. 혈인성 발아(angioogenic saving)는 시간이 지남에 따라 모니터링되었습니다. 또한 2D에서 발아 혈관 신생을 유도하여 모델의 복잡성을 더욱 줄이기 위해 노력했습니다. 실험 절차는 2.5D 모델의 절차를 반영했으며, 주요 차이점은 상단 콜라겐 유형 I 젤 층을 제외했다는 것입니다. 실험 절차를 포함한 세 가지 모델에 대한 개요가 그림 1에 설명되어 있습니다. 경동맥은 지역 도축장에서 돼지에서 채취하여 멸균된 신선한 크렙스 용액으로 운송했습니다. 생물 안전성 캐비닛 내에서 경동맥을 둘러싼 과도한 조직을 제거하여 실시간 타임랩스 이미징 중 발아 혈관 신생의 시각적 손상이 없도록 했습니다(그림 2A-E). 동맥이 과도한 조직으로부터 깨끗해지면 동맥을 2mm 너비의 동맥 고리로 절단하고 고리를 2 x 2mm 치수의 동맥 시트로 절단했습니다(그림 2F).
2.5D 및 2D 모델 내에서 PAA 하이드로겔 계면 상부에 발아 혈관 신생을 보장하기 위해 내부 내피 세포 면이 콜라겐 IV형 코팅된 PAA 하이드로겔을 향하도록 동맥 시트를 시딩하고 부착하도록 두었습니다. PAA 하이드로겔에 대한 동맥 시트의 부착을 최적화하기 위해 동맥 시트 상단에 방오 코팅된 12mm 유리 커버슬립을 첨가하는 효과를 테스트했습니다. 24시간 후, 커버슬립을 제거하고, PAA 하이드로겔에 부착된 동맥 시트의 백분율에 의해 부착 효율을 측정하였다. 우리는 방오 코팅과 무관하게 유리 커버슬립을 추가하면 커버슬립이 없는 경우와 비교하여 PAA 하이드로겔 상단의 동맥 시트의 부착 효율이 증가하는 것을 관찰했습니다(그림 3A-D). 다음으로, 유리제 커버슬립의 직경(12 또는 13mm)이 동맥 시트의 부착 효율에 미치는 영향을 테스트했으며, 플레이트의 내부 웰은 14mm였습니다. 우리는 13mm 커버슬립이 12mm 커버슬립(그림 3E-G)에 비해 PAA 하이드로겔 상단의 동맥 시트의 부착 효율을 증가시키는 것을 관찰했는데, 이는 커버슬립 제거 중 전단력이 최소화되기 때문입니다. 2.5D 및 2D 모델 모두에서 PAA 하이드로겔에 동맥 시트를 부착하기 위해 처리되지 않은 13mm 커버슬립을 계속 사용했습니다.
동맥 시트를 PAA 하이드로겔에 부착한 후 동맥 시트 위에 콜라겐 유형 I 젤의 얇은 층을 추가하여 2.5D 환경을 만들었습니다. 우리는 5일 동안 샘플을 배양하고 발아 혈관 신생에 대해 샘플을 검사했습니다. 우리는 3D 모델(그림 4A)에서 세포 새싹의 형성을 관찰했으며, 이는 이전에 문헌 28,29,30에서 보고된 생체 외 발아 혈관 형성과 일치합니다. 2.5D 모델 내에서 3D 모델과 비교하여 유사한 세포 새싹 조직을 관찰했습니다(그림 4B). 세포 새싹은 PAA 인터페이스를 포함하여 여러 높이에서 형성되었습니다(비디오 1). 또한, 발아 혈관 형성은 리더 세포와 추종자 세포의 높은 증식을 특징으로 하며, 이는 2.5D 모델 내에서 발아 중에 관찰된 현상입니다(비디오 2). 동맥 시트를 2D로 배양할 때, 서로 다른 기원의 세포(보충 그림 1)가 조직 밖으로 단층으로 이동하므로 세포 새싹의 조직이 부족합니다(그림 4C). 2D 모델에서 발아 혈관 신생을 관찰하지 못했기 때문에 후속 분석에서 이 모델을 제외했습니다. 전체적으로 동맥 시트는 발아 혈관 신생을 유도하기 위해 로컬 3D 환경이 필요하며, 이는 발아 혈관 신생의 2.5D 생체 외 모델의 잠재력을 보여줍니다.
또한 2.5D 모델 시스템은 사용자가 매트릭스 강성과 같은 세포 미세 환경의 기계적 단서의 영향을 검사할 수 있는 다목적 시스템입니다. 체외 발아 혈관 신생에 일반적으로 사용되는 하이드로겔인 3D 콜라겐 I형 하이드로겔의 매트릭스 강성은 ECM 단백질의 농도에 따라 달라지며, 단백질 농도의 증가는 매트릭스 강성의 증가와 상관관계가 있습니다32. 이 3D 하이드로겔이 발아 혈관 신생을 유도하도록 하는 콜라겐 유형 I 농도의 일반적인 범위는 1-4 mg/mL이며, 이는 1 Pa - 1 kPa 32,33,34의 매트릭스 강성에 해당합니다. 농도가 낮으면 너무 약해서 구조적 지지를 제공할 수 없으며, 농도가 높으면 세포의 움직임을 억제할 수 있습니다. 내피 조직의 생리적 강성은 1kPa35이며, 이는 3D 콜라겐 유형 I 하이드로겔로 모방할 수 있습니다. 그러나 종양의 형성 및 진행은 조직 경직(tissuestiffning)4과 관련이 있으며, 따라서 종양 혈관 신생을 연구하기 위해 더 높은 매트릭스 경직도를 달성할 수 있는 모델의 필요성을 강조합니다. PAA 하이드로겔의 기질 강성(동맥 시트의 내피 세포에 의해 감지되는 강성)은 1에서 수십 kPa 범위 내에서 쉽게 조정할 수 있습니다. 여기에서는 콜라겐 I형 층을 추가한 다음 날 세포 새싹 형성을 시작한 샘플의 비율을 통해 발아 혈관 신생 시작에 대한 PAA 기질 강성의 영향을 조사했습니다. 우리는 병리학적 경직(12kPa) PAA 하이드로겔에 비해 생리학적 연질(1kPa) PAA 하이드로겔에서 배양했을 때 더 많은 동맥판이 세포 새싹의 초기 징후를 보이는 것을 관찰했으며(그림 5), 발아 혈관 신생에 대한 기질 경직의 영향을 연구할 수 있는 이 모델의 잠재력을 보여주었습니다. 조정 가능한 기질 강성 외에도 이러한 기질은 화학적 단서(예: 배양 배지의 컨디셔닝에 의한 분자 조절 억제)뿐만 아니라 다른 기계적 단서(예: 매트릭스 구성 및 밀도)의 체계적인 조절을 가능하게 하여 이 2.5D 체외 발아 혈관 신생 모델의 다양성을 보여줍니다.
발아 혈관 신생의 세포 역학을 정량화하기 위해 2D PAA 인터페이스에서 형성된 세포 새싹에 대해 기존의 견인력 현미경(TFM)을 수행했습니다. 콜라겐 유형 I 층을 추가한 지 하루 후, 세포(그림 6A)와 PAA 하이드로겔에 내장된 형광 마커의 라이브 셀 이미징을 수행했습니다. 형광 마커의 변위는 Particle Image Velocimetry(그림 6B)를 사용하여 측정되었으며 세포 견인은 PAA 하이드로겔의 기계적 특성을 사용하여 계산되었습니다(그림 6C). 이 2.5D 생체 외 모델을 통해 우리는 처음에 세포 새싹의 리더 세포의 돌출부에서 힘을 당긴 다음 리더 세포의 뒤쪽과 추종자 세포 모두에서 세포 새싹을 따라 힘을 미는 것을 관찰했습니다(그림 6C).
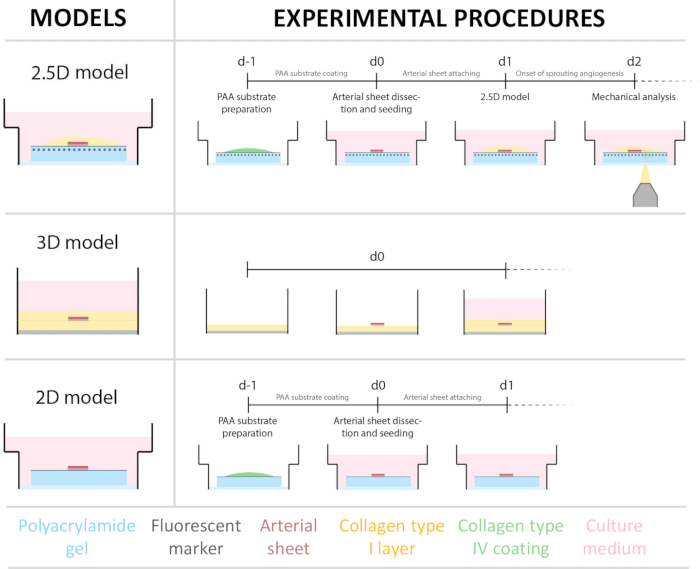
그림 1: 실험 모델 및 절차. (왼쪽) 테스트된 실험 모델. 2.5D 모델은 평평한 콜라겐 IV형 코팅된 폴리아크릴아미드(PAA) 하이드로겔 위에 놓이고 콜라겐 I형 하이드로겔의 얇은 층으로 덮인 동맥 시트를 나타냅니다. 3D 모델은 콜라겐 I 형 젤의 두 층 사이에 끼워진 동맥 시트를 나타내며, 이는 발아 혈관 신생을 유도하는 것으로 알려진 시스템입니다36. 2D 모델은 평평한 콜라겐 IV형으로 코팅된 PAA 하이드로겔 위에 놓인 동맥 시트를 나타냅니다. (오른쪽) 해당 모델에 대한 실험 절차. 2D 및 2.5D 모델 모두의 경우 파종(d-1) 전날 PAA 하이드로겔을 준비하고 콜라겐 IV형 코팅을 밤새 수행했습니다. 경동맥은 돼지에서 채취하여 동맥 시트로 절개하고 0일째(d0)에 하이드로겔 위에 파종하고 밤(d1) 부착하도록 방치했습니다. 2.5D 샘플의 경우, 콜라겐 유형 I 젤의 얇은 층을 동맥 시트 위에 배치했습니다. 기계적 분석은 2일째(d2)에 발아가 시작된 후 수행되었습니다. 2D 샘플의 경우, 배지를 1일(d1)에 새로 고쳤습니다. 3D 모델의 경우, 콜라겐 유형 I 젤 층을 0일차(d0)에 파종하기 직전에 준비했습니다. 동맥 시트는 콜라겐 유형 I 층 위에 씨를 뿌리고 콜라겐 유형 I의 두 번째 층으로 덮었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
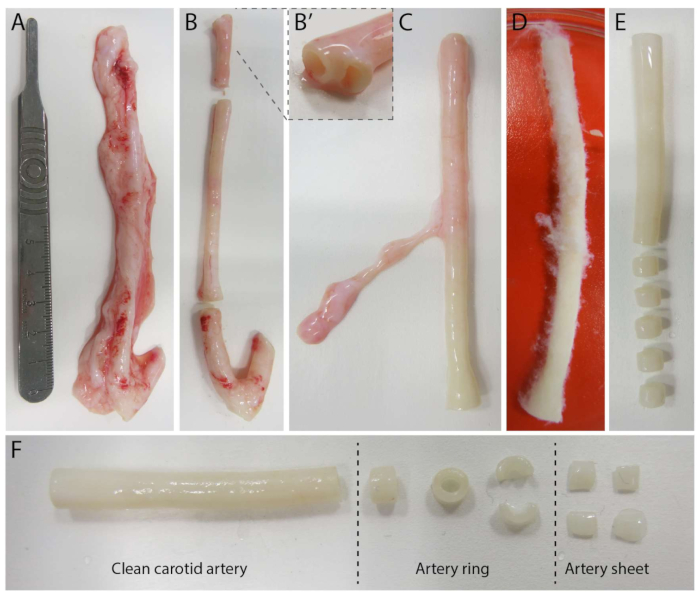
그림 2: 경동맥 절제 단계(d0). (A) 약 10cm 길이의 경동맥은 지역 도축장에서 돼지에서 채취했습니다. (B) 과도한 조직과 가장자리의 약 2cm(분기점에 너무 가까이 가지 않도록 (B')를 버렸습니다. (씨-E) 경동맥을 벗기고(C), PBS(D)에 담그고, 나머지 모든 조직을 피부질하여 이미징 중에 선명한 가시성을 보장했습니다(E). (F) 깨끗한 경동맥은 대략 2mm 너비의 동맥 고리로 절단됩니다. 각 링은 약 2 x 2mm 치수의 4개의 동맥 시트로 절단됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
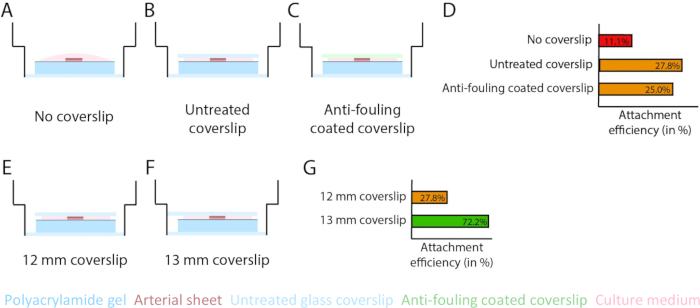
그림 3: 13mm 유리 커버슬립(d1)을 사용하여 동맥 시트 부착 효율이 증가합니다. (A-D) 폴리아크릴아미드(PAA) 하이드로겔에 동맥 시트 부착에 대한 유리 커버슬립의 효과. Pluronic F127(C)을 사용하여 유리 커버슬립이 없는 커버슬립(A), 처리되지 않은 유리 커버슬립(B) 및 오염 방지 코팅된 유리 커버슬립을 비교했습니다. 부착 효율은 총 샘플 수와 비교하여 커버슬립 제거 후 PAA 하이드로겔에 부착된 동맥 시트의 수로 측정되었습니다: 커버슬립 없음(36개 중 4개), 처리되지 않은 커버슬립(36개 중 10개) 및 오염 방지 코팅된 커버슬립(36개 중 9개; (E-G) PAA 하이드로겔에 동맥 시트 부착에 대한 처리되지 않은 유리 커버슬립 크기의 효과. 14mm 웰 내에서 처리되지 않은 12mm 유리 커버슬립(E)과 처리되지 않은 13mm 유리 커버슬립(F)을 비교했습니다. 부착 효율은 총 샘플 수와 비교하여 커버슬립 제거 후 PAA 하이드로겔에 부착된 동맥 시트의 수로 측정되었습니다: 12mm 커버슬립(36개 중 10개) 및 13mm 커버슬립(72개 중 52개; 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
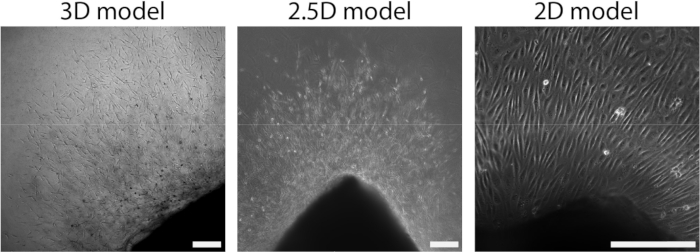
그림 4: 모델의 차원은 세포 분출(d2+) 중 조직을 정의합니다. 세포는 2.5D 모델(가운데)과 유사한 3D 모델(왼쪽)의 새싹 조직에서 조직 밖으로 이동합니다. 세포는 2D 설정에서 단층 조직의 조직 밖으로 이동합니다(오른쪽). 축척 막대는 250μm를 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5: 2.5D 모델에서 내피 발아의 시작은 폴리아크릴아미드 하이드로겔 기질 강성(d2)에 따라 달라집니다. (A-B) 프로토콜 2일차(콜라겐 유형 I 젤 추가 후 1일)에 부드러운(A; 1kPa) 또는 뻣뻣한(B, 12kPa) 폴리아크릴아미드(PAA) 하이드로겔 위에 얇은 층의 콜라겐 I 젤로 덮인 동맥 시트. (C) 발아 발병은 총 샘플 수와 비교하여 이미 세포 성장의 징후를 보이는 동맥 시트의 수로 측정되었습니다: 부드러움(24개 중 7개), 뻣뻣함(24개 중 3개). 스케일바는 1mm(A, B) 또는 500μm(A', B')를 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 6: 초기 발아 혈관 신생 중 견인력 특성화. 시간(0-4시간)의 이미징 셀이 맨 위 행에 표시됩니다. 1kPa PAA 하이드로겔 기질의 해당 형광 마커 변위(0-2μm) 및 세포 견인(0-50Pa)이 각각 중간 및 하단 열에 표시됩니다. 0 h, 2 h 및 4 h에서 세포 견인의 확대는 주황색으로 표시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
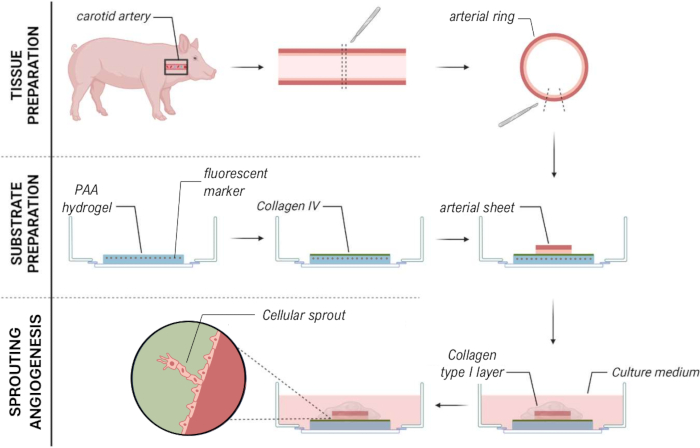
그림 7: 세포 새싹의 기계적 특성화를 가능하게 하는 2.5D 체외 발아 혈관형성 모델 방법. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 1 킬로패 | 12 킬로Pa | |
| PBS (PBS) | 재질 보기 : 435 μL | 373.7 μL |
| 아크릴아마이드 40% | 50 마이크로L | 93.8 μL |
| 비스-아크릴아미드 2% | 7.5 μL | 25 마이크로L |
| 형광 마커(진한 빨간색) | 5 μL | 5 μL |
| 10% APS | 2.5 μL | 2.5 μL |
| 테마드 | 0.25 μL | 0.25 μL |
표 1: PAA 겔 혼합 비율.
| 식 | 12웰 플레이트당 부피(130 μL) | |
| ECG 매체 | VECG = V최종 Vcol1-V NaOH | 82.16 μL |
| 콜라겐 타입 I | Vcol1=(V최종*C최종)/C주식 | 46 μL |
| 나오 | VNaOH = 0.04 * Vcol1 | 1.84 μL |
표 2: 콜라겐 유형 I 젤은 부피 (V)와 농도 (C)의 약어를 사용하여 부피를 혼합합니다.
동영상 1: 2.5D 모델 내에서 세포 새싹 형성의 타임랩스 이미징. 세포는 17.5분의 시간 간격으로 22시간의 기간 동안 위상차 이미징을 사용하여 이미지화되었습니다. 세포 새싹은 서로 다른 초점면에 의해 관찰된 바와 같이 콜라겐 유형 I 겔 층 내에서 여러 높이에서 형성되었습니다. 눈금 막대는 100μm를 나타냅니다. 이 비디오를 다운로드하려면 여기를 클릭하십시오.
비디오 2: 2.5D 모델 내에서 세포 새싹 내 세포의 높은 증식률. 세포는 17.5분의 시간 간격으로 22시간 동안 위상차 이미징을 사용하여 이미지화되었습니다. 리더 세포와 추종자 세포는 모두 타임랩스 이미징 중에 증식합니다. 눈금 막대는 100μm를 나타냅니다. 이 비디오를 다운로드하려면 여기를 클릭하십시오.
보충 그림 1: 면역형광 염색에 의한 2D 모델(d2+)의 세포 표현형. (A) 세포핵(DAPI), 내피 세포 마커(CD31) 및 섬유아세포 마커(알파-평활근 액틴, α-SMA)의 면역형광(IF) 염색. (B) 세포핵(DAPI), 내피 세포 마커(CD31) 및 평활근 세포 마커(칼포닌)의 IF 염색. 스케일바는 100μm를 나타냅니다. 이 그림을 다운로드하려면 여기를 클릭하십시오.
보충 파일 1: 면역형광 염색 프로토콜. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
새로운 혈관이 형성되는 발아 혈관 신생은 분자 및 기계적 메커니즘에 의해 조절되는 복잡한 과정입니다. 지난 수십 년 동안 발아 혈관 신생의 분자 동인(예: VEGF 및 Notch 신호)을 연구하기 위해 많은 3D 모델이 개발되었지만, 모델 제한으로 인해 세포 역학에 대해 알려진 바는 거의 없습니다. TFM(Traction Force Microscopy)은 2D 기판 변형이 세포 견인으로 변환되는 시공간에서 세포력을 정량화하는 잘 알려진 기술입니다. 따라서 이 프로토콜에서는 2.5D ex vivo 모델을 설명하며, 이는 발아 혈관 신생 중 견인력을 정량화할 수 있는 2D 모델의 단순성을 유지하면서 세포에 국부적으로 3D 환경을 제공한다는 것을 의미합니다(그림 1). 이를 위해 우리는 돼지 동맥 시트(내피 쪽이 아래로; 그림 2) 형광 마커를 함유한 콜라겐 IV형 코팅 폴리아크릴아미드(PAA) 하이드로겔 위에. 13mm 유리 커버슬립을 사용하여 동맥 시트를 부착한 후(그림 3), 세포 새싹을 형성할 수 있는 콜라겐 I형 하이드로겔의 얇은 층을 추가합니다(그림 4). 이 모델을 사용하여 세포 발아 22,23,24,25 동안 리더 세포가 당기는 힘을 발휘하지만(문헌 19,20,21,22에서 관찰된 바와 같이) 추종자 세포가 미는 힘을 발휘한다는 것을 보여줍니다(그림 6). 우리의 프로토콜을 통해 얻은 견인 자기장의 해상도는 고분고분한 기판 37,38,39에 대한 견인력 현미경에 의존하는 작업의 전형적인 시간과 공간 모두에서 세포 운동학 및 역학의 정량적 분석을 가능하게 합니다.
또한, 우리는 미세환경의 기계적 단서를 변화시켜 발아 혈관 신생의 이 2.5D ex vivo 모델의 다양성을 입증합니다(그림 5). 발아 혈관 형성은 일반적으로 3D 콜라겐 유형 I 하이드로겔에 의해 모방될 수 있는 1kPa35 의 생리학적 강성에서 발생하는 반면, 종양 혈관 형성은 기존의 3D 콜라겐 유형 I 하이드로겔의 강성 범위를 벗어나는 경화된 미세 환경40 에서 발생합니다. PAA 기판 강성은 더 높은 기판 강성을 생성하기 위해 가교제의 비율을 변경하여 쉽게 조정할 수 있습니다. 이 모델을 사용하여 발아 혈관 신생의 시작이 강성에 따라 달라진다는 것을 밝혔습니다. 이러한 기판은 조정 가능한 강성을 제공할 뿐만 아니라 매트릭스 구성 및 밀도와 같은 다양한 다른 기계적 신호의 체계적인 변조를 가능하게 합니다. 또한 이 모델을 통해 발아 혈관 신생의 기계생물학적 메커니즘을 이해하기 위해 배지의 조건화(예: 세포 역학에 대한 Notch 신호에 대한 억제의 효과)를 사용하여 분자 조절자를 조작하면서 세포 역학을 연구할 수 있습니다. 이는 다양한 미세환경의 견본에서 발아 혈관 신생의 이 2.5D ex vivo 모델의 유용성을 보여줍니다.
우리가 제시하는 모델은 3D(점탄성) TFM에 비해 더 간단한 분석, 더 높은 공간 해상도 및 더 쉬운 구현을 제공하는 기존 2D TFM을 사용하여 더 쉽게 액세스할 수 있고 비용 효율적입니다26,41. 그러나 3D(점탄성) TFM은 3차원 모두에서 견인력을 포착하고 세포 외 기질의 복잡한 기계적 특성을 고려하여 보다 현실적인 맥락에서 세포 행동에 대한 더 깊은 통찰력을 제공함으로써 생리학적으로 더 관련성이 높은 환경을 제공합니다 42,43,44,45. 이러한 차원의 효과는 또한 이 2.5D 모델의 한계를 나타냅니다. 우리는 세포가 2D 기질에서 이동한다는 가정하에 2D TFM을 사용합니다. 이 2.5D 모델의 경우가 그렇지만, 세포는 로컬 3D 환경에 있으므로 콜라겐 유형 I 겔 층에 부착하고이 겔 층에 힘을 가합니다. 이 분석에서 채택한 가정은 콜라겐 유형 I 겔 층이 매트릭스 강성의 크기 차이로 인해 PAA 계면에 기계적으로 결합되지 않으므로(이 두 하이드로겔 사이에 힘 전달 없음) 콜라겐 유형 I 층에 대한 세포 힘의 영향을 최소화한다는 것입니다. 이를 통해 2.5D ex vivo 모델을 사용한 힘 특성화를 통해 세포에서 생성된 힘을 단순화할 수 있습니다. 또한 이 프로토콜은 정밀성을 필요로 하며 샘플이 손실될 수 있는 여러 단계로 광범위합니다(예: (i) 동맥시트를 둘러싼 과도한 조직으로 인한 세포 가시성 문제(그림 2), (ii) 샘플 3개 중 1개가 PAA 기질에 부착되지 않음(그림 3), (iii) 모든 샘플이 세포 새싹 형성을 시작하는 것은 아닙니다(그림 5), (iv) PAA 기질에서 세포 새싹이 형성되지 않고 (v) 강성이 낮은 PAA 하이드로겔 위에 두꺼운 동맥 시트를 사용할 때 초점이 맞지 않는 형광 마커가 나타납니다. 따라서 발아 혈관 신생의 기계적 분석을 수행하기 위해 관심 영역을 많이 확보하기 위해 이 방법을 12웰 플레이트에 최적화했습니다.
결론적으로, 2.5D 모델(그림 7)을 사용하여 살아있는 돼지 동맥 시트의 발아 혈관 신생의 세포 견인력의 단순화된 특성화를 위해 제시된 접근 방식은 네이티브 조직 맥락에서 혈관 신생 중 기계적 상호 작용에 대한 보다 정확한 실시간 통찰력을 생성하는 데 도움이 될 수 있으며, 완전한 3D 시스템에 비해 복잡성을 줄이고 재현성을 개선한 동적 세포 과정에 대한 연구를 촉진할 수 있습니다. 이를 통해 세포가 생리학적으로 더 관련성이 높은 환경에서 기계적 신호에 어떻게 반응하는지에 대한 이해를 높이는 동시에 2D 방법의 분석적 단순성을 유지할 수 있습니다. 이 지식은 혈관 생성을 목표로 조직 공학 분야를 발전시킬 수 있을 뿐만 아니라 종양 성장을 제한하고 전이를 줄이기 위해 종양 혈관 신생을 예방하기 위한 치료 약물을 찾을 수 있습니다.
공개
저자는 공개할 이해 상충이 없습니다.
감사의 말
지역 도축장에서 돼지 경동맥을 적출하여 운송해 주신 LifeTec 직원들에게 감사드립니다. Leon Hermans, Pim van den Bersselaar, Adrià Villacrosa Ribas(TU/e, ICMS)는 실험 절차 및 기계적 특성화 분석에 대한 유익한 토론을 제공합니다. 유럽연구위원회(771168), 네덜란드 과학연구기구(024.003.013), 핀란드 아카데미(307133, 316882, 330411, 337531) 및 Åbo Akademi University Foundation의 세포 메카노스타시스 우수 센터(CellMech)의 보조금 지원에 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| 2% bis-acrylamide | Bio-Rad | 1610143 | |
| 2-mercaptoethanol | Merck Life Science | 60-24-2 | |
| 3-(Trimethoxysilyl)propyl methacrylate | Bind-Silane | Sigma-Aldrich | 440159-100ML |
| 40% acrylamide | Bio-Rad | 1610140 | |
| Aboslute ethanol (for analysis) | VWR International | 1.00983.1000 | |
| Absolute ethanol (industrial) | VWR International | 83813.41 | |
| Acetic acid, glacial 100% | Merck | 1000562500 | |
| Ammonium persulfate | APS | Bio-Rad | 7727-54-0 |
| antibody (primary) - calponin | abcam | ab46794 | |
| antibody (primary) - CD31 | Serotec | MCA1746 | |
| antibody (primary) - α-smooth muscle actin | αSMA | Dako | M0851 |
| antibody (secondary) - goat-anti-mouse-IgG1 Alexa 488 | Molecular Probes | A21121 | |
| antibody (secondary) - goat-anti-mouse-IgG2a Alexa 555 | Molecular Probes | A21137 | |
| antibody (secondary) - goat-anti-rabbit-IgG Alexa 555 | Molecular Probes | A21428 | |
| Autoclave | Astell | ||
| Calcium chloride dihydrate | CaCl2 | Calbiochem | 208291-250GM |
| Collagen type I, rat-tail | Corning | 354236 | |
| Collagen type IV, human placenta | Merck Life Science | C5533-5MG | |
| Endothelial Cell Growth Medium | ECG medium | Promocell | C-22111 |
| Expoxy-coated round tip tweezer | fine tweezer | Rubis Pinzette | E78144-2A |
| Fluorescent marker, dark red | Invitrogen | F8807 | |
| Glass coverslips, Ø13 mm, #1 | Epredia | CB00130RA120MNZ0 | |
| Glass coverslips, Ø13 mm, #1.5 | Epredia | CB00120RAC20MNZ0 | |
| Hydrochloride acid, 25% | HCl | Merck | 1.100316.1000 |
| Krebs-Henseleit buffer | Sigma-Aldrich | K3753 | |
| Microscope, Leica Application Suite X software, version 3.5.7.23225 | Leica Microsystems | ||
| Microscope, Leica DMi8 epifluorescent microscope | Leica Microsystems | ||
| Microscope, Nikon Ti2 Eclipse | Nikon | ||
| Microscope, NIS-Elements AR software | Nikon | ||
| N,N,N',N'-tetramethylethane-1,2-diamine | TEMED | Merck Life Science | 110-18-9 |
| Nalgene bottle | Thermo Scientific | 2187-0016 | |
| Needle, 21Gx1" | Henke Sass Wolf | HK4710008025 | |
| Normal serum, goat | Gibco | 10098792 | |
| Papaverine hydrochloride | Sigma | 61-25-6 | |
| Penicillin/Streptomyocin (10 000 U/mL) | P/S | Gibco | 15140163 |
| Petri-dish, large (145x20mm) | Greiner Bio-one | 639160 | |
| Petri-dish, small (60x15mm) | Greiner Bio-one | 628160 | |
| Phosphate Buffered Saline | PBS | Sigma | P4417 |
| Pluronic F-127 | Merck Life Science | P2443-250G | |
| Puncture needle, sharp closed tip | unknown | ||
| Scalpel, no. 4 | Swann-Morton | ||
| Sodium hydrogen carbonate | NaHCO3 | VWR International | 144-55-8 |
| sulfosuccinimidyl 6-(4'-azido-2'-nitrophenylamino)hexanoate | Sulfo-SANPAH | Thermo Scientific | 22589 |
| Surgical blade, no. 20 | Swann-Morton | ||
| Surgical drape sheet | Foliodrape | 2775001 | |
| Surgical tweezer | Lettix | 400024 | |
| Triton X-100 | Merck | 9036-19-5 | |
| UV lamp | Analytik Jena | 95-0042-13 | |
| well plate, 96-well, F-bottom | Greiner Bio-one | 655180 | |
| well plate, glass bottom 12-well | MatTek | P12G-0-14-F |
참고문헌
- Carmeliet, P. Angiogenesis in health and disease. Nat Med. 9 (6), 653-660 (2003).
- Folkman, J. Angiogenesis in cancer, vascular, rheumatoid and other disease. Nat Med. 1, 27-30 (1995).
- Kretschmer, M., Rüdiger, D., Zahler, S. Mechanical aspects of angiogenesis. Cancers. 13 (19), 4987 (2021).
- Bordeleau, F., et al. Matrix stiffening promotes a tumor vasculature phenotype. Proc Natl Acad Sci U S A. 114 (3), 492-497 (2017).
- Blanco, R., Gerhardt, H. VEGF and Notch in tip and stalk cell selection. Cold Spring Harb Perspect Med. 3 (1), a006569 (2013).
- Adams, R. H., Alitalo, K. Molecular regulation of angiogenesis and lymphangiogenesis. Nat Rev Mol Cell Biol. 8, 464-478 (2007).
- Carmeliet, P., De Smet, F., Loges, S., Mazzone, M. Branching morphogenesis and antiangiogenesis candidates: tip cells lead the way. Nat Rev Clin Oncol. 6, 315-326 (2009).
- Salam, N., et al. Assessment of migration of human mscs through fibrin hydrogels as a tool for formulation optimisation. Materials. 11 (9), 1781 (2018).
- Solbu, A. A., et al. Assessing cell migration in hydrogels: An overview of relevant materials and methods. Materials Today Bio. 18, 100537 (2023).
- Cao, W., Li, X., Zuo, X., Gao, C. Migration of endothelial cells into photo-responsive hydrogels with tunable modulus under the presence of pro-inflammatory macrophages. Regenerat Biomater. 6 (5), 259-267 (2019).
- Staton, C. A., Reed, M. W. R., Brown, N. J. A critical analysis of current in vitro and in vivo angiogenesis assays. Int J Exp Pathol. 90 (3), 195-221 (2009).
- Staton, C. A., et al. Current methods for assaying angiogenesis in vitro and in vivo. Int J Exp Path. 85, 233-248 (2004).
- Ngo, T. X., et al. In Vitro models for angiogenesis research: A review. Int J Tissue Regenerat. 5, 37-45 (2014).
- Tomita, Y., et al. An ex vivo choroid sprouting assay of ocular microvascular angiogenesis. J Vis Exp. (162), e61677 (2020).
- Kapoor, A., Chen, C. G., Iozzo, R. V. A simplified aortic ring assay: A useful ex vivo method to assess biochemical and functional parameters of angiogenesis. Matrix Biol Plus. 6-7, 100025 (2020).
- Stiffey-Wilusz, J., Boice, J. A., Ronan, J., Fletcher, A. M., Anderson, M. S. An ex vivo angiogenesis assay utilizing commercial porcine carotid artery: Modification of the rat aortic ring assay. Angiogenesis. 4 (1), 3-9 (2001).
- Kniazeva, E., Putnam, A. J. Endothelial cell traction and ECM density influence both capillary morphogenesis and maintenance in 3-D. Am J Physiol Cell Physiol. 297 (1), C179-C187 (2009).
- Davidson, C. D., Wang, W. Y., Zaimi, I., Jayco, D. K. P., Baker, B. M. Cell force-mediated matrix reorganization underlies multicellular network assembly. Sc Rep. 9 (1), 12 (2019).
- Lyle, K. S., Corleto, J. A., Wittmann, T. Microtubule dynamics regulation contributes to endothelial morphogenesis. BioArchitecture. 2 (6), 220-227 (2012).
- Kniazeva, E., et al. Quantification of local matrix deformations and mechanical properties during capillary morphogenesis in 3D. Integrat Biol. 4 (4), 431-439 (2012).
- Quintanilla, M. A., Hammer, J. A., Beach, J. R. Non-muscle myosin 2 at a glance. J Cell Sci. 136 (5), jcs.260890 (2023).
- Fischer, R. S., Gardel, M., Ma, X., Adelstein, R. S., Waterman, C. M. Local cortical tension by myosin II guides 3D endothelial cell branching. Curr Biol. 19 (3), 260-265 (2009).
- Yoon, C., et al. Myosin IIA–mediated forces regulate multicellular integrity during vascular sprouting. Mol Biol Cell. 30 (16), 1974-1984 (2019).
- Du, Y., et al. Three-dimensional characterization of mechanical interactions between endothelial cells and extracellular matrix during angiogenic sprouting. Sci Rep. 6, 21362 (2016).
- Vaeyens, M. M., et al. Matrix deformations around angiogenic sprouts correlate to sprout dynamics and suggest pulling activity. Angiogenesis. 23 (3), 315-324 (2020).
- Style, R. W., et al. Traction force microscopy in physics and biology. Soft Matter. 10 (23), 4047-4055 (2014).
- Trepat, X., et al. Physical forces during collective cell migration. Nat Phys. 5 (6), 426-430 (2009).
- Santos-Oliveira, P., et al. The force at the tip - modelling tension and proliferation in sprouting angiogenesis. PLoS Comput Biol. 11 (8), e1004436 (2015).
- Boreddy, S. R., Sahu, R. P., Srivastava, S. K. Benzyl isothiocyanate suppresses pancreatic tumor angiogenesis and invasion by inhibiting HIF-α/VEGF/Rho-GTPases: Pivotal role of STAT-3. PLoS One. 6 (10), 0025799 (2011).
- Teng, R. J., Eis, A., Bakhutashvili, I., Arul, N., Konduri, G. G. Increased superoxide production contributes to the impaired angiogenesis of fetal pulmonary arteries with in utero pulmonary hypertension. Am J Physiol Lung Cell Mol Physiol. 297 (1), L184-L195 (2009).
- Costa, G., et al. Asymmetric division coordinates collective cell migration in angiogenesis. Nature Cell Biol. 18 (12), 1292-1301 (2016).
- Slater, K., Partridge, J., Nandivada, H. . Corning tuning the elastic moduli of Corning Matrigel and collagen I 3D matrices by varying the protein concentration. , (2019).
- Lee, J., et al. Effect of chain flexibility on cell adhesion: Semi-flexible model-based analysis of cell adhesion to hydrogels. Sci Rep. 9 (1), 2463 (2019).
- Motte, S., Kaufman, L. J. Strain stiffening in collagen i networks. Biopolymers. 99 (1), 35-46 (2013).
- Butcher, D. T., Alliston, T., Weaver, V. M. A tense situation: Forcing tumour progression. Nat Rev Cancer. 9 (2), 108-122 (2009).
- Artym, V. V., Matsumoto, K. Imaging cells in three-dimensional collagen matrix. Curr Prot Cell Biol. 10, Unit 10.18.1-Unit 10.18.20 (2010).
- Labernadie, A., et al. A mechanically active heterotypic E-cadherin/N-cadherin adhesion enables fibroblasts to drive cancer cell invasion. Nat Cell Biol. 19 (3), 224-237 (2017).
- Bazellières, E., et al. Control of cell-cell forces and collective cell dynamics by the intercellular adhesome. Nat Cell Biol. 17 (4), 409-420 (2015).
- Uroz, M., et al. Traction forces at the cytokinetic ring regulate cell division and polyploidy in the migrating zebrafish epicardium. Nat Mater. 18 (9), 1015-1023 (2019).
- Dong, C., Nastaran, Z., Konstantopoulos, K. . Biomechanics in oncology. , (2018).
- Schwarz, U. S., Soiné, J. R. D. Traction force microscopy on soft elastic substrates: A guide to recent computational advances. Biochim Biophys Acta. 1853 (11), 3095-3104 (2015).
- Toyjanova, J., et al. 3D Viscoelastic traction force microscopy. Soft Matter. 10 (40), 8095-8106 (2014).
- Legant, W. R., et al. Multidimensional traction force microscopy reveals out-of-plane rotational moments about focal adhesions. Proc Natl Acad Sci U S A. 110 (3), 881-886 (2013).
- Steinwachs, J., et al. Three-dimensional force microscopy of cells in biopolymer networks. Nat Meth. 13 (2), 171-176 (2016).
- Franck, C., Maskarinec, S. A., Tirrell, D. A., Ravichandran, G. Three-dimensional traction force microscopy: A new tool for quantifying cell-matrix interactions. PLoS One. 6 (3), e17833 (2011).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유