Method Article
מודל 2.5D לאפיון מכני ex vivo של אנגיוגנזה מונבטת ברקמה חיה
In This Article
Summary
הנבטת אנגיוגנזה, הבסיסית להתפתחות ומחלות, כרוכה בתהליכים מולקולריים ומכניים מורכבים. אנו מציגים מודל 2.5D ex vivo רב-תכליתי המנתח נביטה תאית מעורקי הצוואר החזיריים, וחושף אנגיוגנזה תלוית קשיחות ומכניקת תאים מובילה-עוקב מובהקת. מודל זה מסייע בקידום אסטרטגיות הנדסת רקמות וגישות לטיפול בסרטן.
Abstract
אנגיוגנזה מונבטת היא היווצרות כלי דם חדשים מכלי דם קיימים ויש לה חשיבות רבה לתהליכים פיזיולוגיים כגון צמיחה ותיקון רקמות ותהליכים פתולוגיים, כולל סרטן וגרורות. התהליך הרב-שלבי של הנבטת אנגיוגנזה הוא תהליך מונע מולקולרית ומכנית. הוא מורכב מאינדוקציה של נבט תאים על ידי גורם גדילה אנדותל כלי דם, בחירת תאים מובילים/עוקבים באמצעות איתות Notch, נדידה מכוונת של תאי אנדותל ואיחוי וייצוב כלי דם. מגוון מודלים של אנגיוגנזה להנבטה פותחו במהלך השנים כדי להבין טוב יותר את המנגנונים הבסיסיים של הנבטה תאית. למרות ההתקדמות בהבנת המניעים המולקולריים של אנגיוגנזה הנבטה, תפקידם של רמזים מכניים והמניע המכני של אנגיוגנזה הנבטה נותר לא נחקר בשל מגבלות במודלים קיימים. במחקר זה, עיצבנו מודל 2.5D ex vivo המאפשר לנו לאפיין באופן מכני נביטה תאית מעורק צוואר חזירי באמצעות מיקרוסקופ כוח משיכה. המודל מזהה דפוסי כוח מובהקים בתוך הנבט, כאשר תאים מובילים מפעילים כוחות משיכה ותאי עוקבים מפעילים כוחות דחיפה על המטריצה. הרבגוניות של המודל מאפשרת מניפולציה של רמזים כימיים ומכניים כאחד, כגון קשיחות מטריצה, מה שמשפר את הרלוונטיות שלו למיקרו-סביבות שונות. כאן, אנו מדגימים כי תחילת האנגיוגנזה הנביטה תלויה בנוקשות. המודל הדו-ממדי המוצג לכימות כוחות המתיחה התאיים באנגיוגנזה של הנבטה מציע שיטה פשוטה אך רלוונטית מבחינה פיזיולוגית, המשפרת את ההבנה שלנו לגבי תגובות תאיות לרמזים מכניים, מה שיכול לקדם הנדסת רקמות ואסטרטגיות טיפוליות נגד אנגיוגנזה של גידולים.
Introduction
אנגיוגנזה היא תהליך של היווצרות כלי דם חדשים מכלי דם קיימים. תהליך זה חיוני במהלך התפתחות עוברית, ריפוי פצעים והתקדמות סרטן, כולם קשורים לשינויים ביומכניים במיקרו-סביבה 1,2,3,4. בתחילת האנגיוגנזה, רקמות היפוקסיות או פצועות משחררות גורם גדילה אנדותל כלי דם (VEGF) שיפעיל את תאי האנדותל של כלי הדם השכנים ליצירת נבטי אנדותל - שם מאומצים שני פנוטיפים מובילים ועוקבים מובהקים דרך מסלול האיתות המולקולריNotch 5. עם היווצרותם של נבטי אנדותל, תופעה המכונה אנגיוגנזה נביטה, תאים מובילים יפגעו במטריצה החוץ-תאית שמסביב כדי לנדוד באופן קולקטיבי לעבר גירוי ה-VEGF מבלי לאבד הידבקויות תא-תא עם תאי העוקבים הנגררים 6,7.
במהלך העשורים האחרונים, היו מספר הולך וגדל של מבחני אנגיוגנזה מונבטים המתוארים החוקרים נדידת תאים קולקטיבית באמצעות מתודולוגיות שונות, שכל אחת מהן מציעה יתרונות ומגבלות שונות. בדיקות אלו מעריכות את התנועה המתואמת של קבוצות תאים, כגון תאי אנדותל, באמצעות מטריצות תלת מימדיות, המאפשרות לחקור התנהגויות תאיות כמו נביטה, פלישה והגירה קולקטיבית בסביבה מבוקרת 8,9,10. מבחני אנגיוגנזה הנבטה in vivo מספקים הערכה מקיפה בתוך אורגניזם חי, לוכדים אינטראקציות מורכבות, אך הם גוזלים זמן, יקרים, נוטים לשונות גבוהה וקשה לכמת11,12. מבחני אנגיוגנזה של נביטת מבחנה מאפשרים שליטה מדויקת בתנאי הניסוי עם יכולת שחזור גבוהה וכימות מדויק, אך עשויים שלא לשכפל באופן מלא את המורכבויות in vivo 11,12,13. לעומת זאת, מבחני אנגיוגנזה הנבטה ex vivo, שבדיקת טבעת אבי העורקים היא המודל הנפוץ ביותר מתוכם, משתמשים ברקמות מחוץ לאורגניזם, תוך שמירה על רלוונטיות פיזיולוגית תוך הימנעות מסיבוכים in vivo 14,15,16. למרות היותם מאתגרים מבחינה טכנית ולפעמים נאבקים בכדאיות הרקמות, מודלים ex vivo מציעים איזון רב ערך בין מורכבות לשליטה, מה שהופך אותם לגישה מבטיחה לחקר אנגיוגנזה מונבטת. בעוד שמודלים אלה שימשו באופן נרחב לחקר המניעים המולקולריים של אנגיוגנזה הנבטה, ההשפעה של רמזים מכניים וההתנהגות המכנית של התאים נותרה לא מובנת היטב.
נדידה רב-תאית במהלך אנגיוגנזה של הנבטה תלויה מאוד במכניקה התאית, שכן כוחות כיווץ מבוססי אקטומיוזין מווסתים את פלישת תאי האנדותל למטריצה החוץ-תאית שמסביב 17,18,19,20. באופן ספציפי, מנועי מיוזין II שאינם שרירים, מכונות ההתכווצות העיקריות המבוססות על אקטין בתוך התא21, נצפו כשולטים בכוחות ההתכווצות התאיים במהלך אנגיוגנזה הנבטה22,23. התא המוביל הוא ככל הנראה האלמנט הדומיננטי המייצר כוח של הנבט מכיוון שעיוותים של המטריצה החוץ-תאית התלת-ממדית שמסביב גבוהים משמעותית סביב התא המוביל, במיוחד בליטות תאיות עשירות באקטין סמוכות23,24, בהשוואה לעוקביו 22,23,25. למרות עדויות הולכות וגדלות אלה לחשיבות ההתכווצות התאית באנגיוגנזה הנבטה בתלת מימד, חסרה שיטה לאפיון מכני מרחבי-זמני של מכניקה תאית של אנגיוגנזה נביטה.
מטרת העל של מחקר זה היא לפתח שיטה המאפשרת אפיון מכני של נדידת התאים במהלך הנביטה. על ידי השגת אפיון מרחבי-זמני של כוחות מכניים בהקשר רלוונטי מבחינה ביולוגית, אנו שואפים לספק תובנות חדשות לגבי האופן שבו מכניקת התא משפיעה על היווצרות נבטים אנגיוגניים. לשם כך, פיתחנו מערכת מודל 2.5D על ידי יצירת הידרוג'ל פוליאקרילאמיד דו-ממדי (PAA), זריעת יריעת עורקי קרוטיד עליה וכיסויה בשכבה דקה של ג'ל קולגן מסוג I כדי ליצור סביבה תלת מימדית מקומית לתאים. נבטים רב-תאיים נדדו מיריעת העורקים בממשק ג'ל PAA-קולגן. היתרון בשיטה זו בהשוואה לטכניקות הקיימות הוא שההידרוג'ל הדו-ממדי PAA מאפשר ניתוחים על ידי מיקרוסקופ כוח משיכה (TFM) - טכניקה רב-תכליתית ידועה שבה תאים נצמדים למצע דו-ממדי אלסטי ויעוותו את המצע בכוחות משיכה תאיים26. ניתן ללכוד עיוותים אלה, ולחשב כוחות משיכה תאיים על סמך התכונות המכניות של המצע26. על ידי התאמת TFM לשימוש ברקמות חיות ex vivo, אנו שואפים לגשר על הפער בין בקרת חוץ גופית לרלוונטיות in vivo , ולספק הבנה מקיפה יותר של כוחות מכניים במהלך אנגיוגנזה.
Protocol
עורקי צוואר חזיר שימשו בפרוטוקול זה. עורקי צוואר חזיר נקטפו מחזירים היברידיים הולנדיים - בני 5-7 חודשים ומשקלם (חי) 80-120 ק"ג - שהתקבלו מבית מטבחיים מקומי. הפרוטוקולים עמדו בתקנות האיחוד האירופי 1069/2009 בנוגע לחומר משחטות לאבחון ומחקר בפיקוח ממשלת הולנד (משרד החקלאות, הטבע ואיכות המזון ההולנדי) ואושרו על ידי הרשויות החוקיות הקשורות לרווחת בעלי חיים (הרשות לבטיחות מזון ומוצרי צריכה). לא נדרש אישור אתי מכיוון שרקמות נאספו מתוצרי לוואי של בעלי חיים שכבר הופסקו. הזמן בין המוות להובלת הרקמות הוא 10-25 דקות, תלוי בבית המטבחיים.
הערה: טבלת החומרים מסכמת פרטים על החומרים, הציוד והריאגנטים המשמשים בפרוטוקול זה. פרוטוקולים לדגימות דו-ממדיות ותלת-ממדיות מתוארים בקובץ המשלים 1.
1. הכנת מצעי פוליאקרילאמיד דו-ממדיים (PAA).
- במכסה האדים, הכינו תמיסת קשירה-סילאן על ידי ערבוב אתנול מוחלט 12:1:1 (לסינתזה), חומצה אצטית וקשירה-סילאן ב-4286 מיקרוליטר, 357 מיקרוליטר ו-357 מיקרוליטר, בהתאמה. דגירה של 120 מיקרוליטר / תמיסת קשירה-סילאן על צלחת זכוכית תחתית 12 בארות למשך שעה בטמפרטורת החדר.
זהירות: אתנול מוחלט הוא נוזל ואדים דליקים מאוד (H225) וגורם לגירוי חמור בעיניים (H319). חומצה אצטית היא נוזל ואדים דליקים (H226) וגורמת לכוויות עור חמורות ולנזק לעיניים (H314). ללבוש ציוד מגן אישי ולעבוד במכסה אדים. - במכסה האדים, שטפו את צלחת 12 הבארות עם תחתית הזכוכית פי 3 עם אתנול מוחלט (תעשייתי) באמצעות בקבוק ריסוס. השליכו את האתנול.
- יבש את צלחת הזכוכית התחתונה עם 12 בארות באמצעות גז חנקן. אם מופיעה קרח לבן על גבי תחתית הזכוכית, הכביסה לא הספיקה. שוטפים מחדש את צלחת הזכוכית התחתונה 12 היטב.
- מכינים את תערובת הג'ל PAA לפי היחסים בטבלה 1.
- הוסף PBS לצינור מיקרוצנטריפוגה והשהה מחדש 40% אקרילאמיד, 2% ביס-אקרילאמיד וסמני פלורסנט בתערובת הג'ל. מערבולת את התמיסה ממש לפני הכנת הג'ל.
- מהר ככל האפשר, הוסף 10% APS ו-TEMED לתמיסה ולמערבולת לאחר הוספת כל אלמנט. שפכו טיפה של 11.5 מיקרוליטר של תערובת ג'ל על תחתית הזכוכית של כל באר והניחו בעדינות כיסוי של 13 מ"מ על גבי הטיפה.
- הקש בעדינות וסובב את הצלחת כדי לפזר באופן שווה את תערובת הג'ל מתחת לכיסוי. אם מופיעות בועות אוויר, הסר אותן על ידי הרמת הכיסוי בעדינות. השאירו את הג'לים להתפלמר למשך שעה בטמפרטורת החדר. בדוק פילמור באמצעות תערובת הג'ל שנותרה בצינור. ג'ל PAA מפולימר בצלחת 12 הבארות יציג הילה פנימית.
זהירות: אקרילאמיד מזיק בבליעה או בשאיפה (H302 + H332), גורם לגירוי בעור (H315), עלול לגרום לתגובה אלרגית בעור (H317), גורם לגירוי חמור בעיניים (H319), עלול לגרום לפגמים גנטיים (H340), עלול לגרום לסרטן (H350), חשוד לפגיעה בפוריות (H361f), וגורם נזק לאיברים באמצעות חשיפה ממושכת או חוזרת בבליעה (H372). APS עלול להגביר את האש (מחמצן, H272), מזיק בבליעה (H302), גורם לגירוי בעור (H315), עלול לגרום לתגובה אלרגית בעור (H317), גורם לגירוי חמור בעיניים (H319), עלול לגרום לתסמיני אלרגיה או אסתמה או קשיי נשימה בשאיפה (H334), ועלול לגרום לגירוי בדרכי הנשימה (H335). TEMED הוא נוזל ואדים דליקים מאוד (H225), מזיקים בבליעה (H302), גורמים לכוויות חמורות בעור ולנזק לעיניים (H314), ורעיל בשאיפה (H331). ללבוש ציוד מגן אישי.
- לאחר פילמור, הוסף PBS לבאר. בעזרת פינצטה ו/או מחט כפופה, הרם והסר בעדינות את הכיסוי. שטפו ג'לים פעם אחת ב-PBS.
- כדי להקל על ציפוי הקולגן של ג'ל ה-PAA, יש לתפקד את הג'לים באמצעות ה-crosslinker Sulfo-SANPAH. הוסף 75 מיקרוליטר של 1 מ"ג/מ"ל Sulfo-SANPAH מומס במים טהורים במיוחד לג'ל PAA ודגירה למשך 5 דקות תחת אור UV של 365 ננומטר.
הערה: שמור על Sulfo-SANPAH מוגן מפני אור והוסף מים טהורים במיוחד ממש לפני הדגירה של UV. שינוי צבע נראה מאדום בהיר (לפני הדגירה באור UV) לאדום כהה (לאחר הדגירה באור UV).
זהירות: Sulfo-SANPAH גורם לגירוי חמור בעיניים (H319). - בארון הבטיחות הביולוגית, בצע שטיפה סטרילית מהירה של PBS של ה-Sulfo-SANPAH על הג'לים. כתוצאה מכך, שטפו את ג'ל ה-PAA הפונקציונלי פעמיים ב-PBS סטרילי למשך 10 דקות.
הערה: החל מנקודה זו בפרוטוקול, כל השלבים יבוצעו בתנאים סטריליים. - בארון הבטיחות הביולוגית, הכינו תמיסת קולגן מסוג IV של 0.1 מ"ג/מ"ל ב-PBS על קרח. פיפט 50 מיקרוליטר של 0.1 מ"ג/מ"ל טיפת קולגן מסוג IV על גבי ג'ל ה-PAA הפונקציונלי ודגירה למשך הלילה ב-4 מעלות צלזיוס.
- שוטפים את הג'לים פעמיים ב-PBS סטרילי. הסר את ה- PBS והשאיר את הג'לים לייבוש למשך 5 דקות.
- יש לזרוק טיפה של 50 מיקרוליטר של מדיום גידול תאי אנדותל (ECG) על גבי הג'לים ולדגור למשך שעה אחת לפחות ב-37 מעלות צלזיוס ו-5% CO2.
הערה: דגירה של הג'לים במדיום האק"ג משפרת את חיבורי התאים והרקמות לג'לים.
2. הכנת תמיסת קרבס שונה להובלה
הערה: הכן את תמיסת קרבס ששונתה טרייה. בפרוטוקול זה, תמיסת קרבס שהשתנתה מוכנה יום אחד לפני קצירת הרקמות.
- עקר בקבוק הובלה על ידי חיטוי. מלאו בקבוק זכוכית ב-90% (315 מ"ל) מנפח ההובלה הכולל הנדרש (350 מ"ל) של מים טהורים במיוחד. ודא שטמפרטורת המים היא 15-20 מעלות צלזיוס.
- תוך כדי ערבוב עדין של המים באמצעות מגנט ערבוב, מוסיפים 9.6 גרם/ליטר (3.36 גרם) Krebs-Henseleit Buffer ומערבבים עד להמסה. בעזרת פיפט פסטר, שטפו את סירת השקילה בנפח קטן של תמיסה כדי לכלול את כל עקבות האבקה בתמיסה. אין לחמם את התמיסה.
- תוך כדי ערבוב, יש להוסיף לתמיסה 0.373 גרם/ליטר (130.55 מ"ג) סידן כלורי (CaCl2) ולערבב עד להמסה. שוטפים את סירת השקילה בנפח קטן של תמיסה.
אזהרה: H319 גורם לגירוי חמור בעיניים. - תוך כדי ערבוב, יש להוסיף לתמיסה 2.1 גרם/ליטר (0.63 גרם) נתרן ביקרבונט (NaHCO3) ולערבב עד להמסה. שוטפים את סירת השקילה בנפח קטן של תמיסה.
- תוך כדי ערבוב מוסיפים לתמיסה 1 x 10-1 מ"מ (13.15 מ"ג) פפברין ומערבבים עד להמסה. שוטפים את סירת השקילה בנפח קטן של תמיסה.
הערה: פפברין הוא מרגיע שרירים חלק המשמש למניעת התכווצות מוגזמת של כלי הדם הנגרמת על ידי חיתוך וטיפול בכלי במהלך הקטיף.
אזהרה: H301 רעיל במקרה של בליעה. - במכסה האדים, הוסיפו לתמיסה 0.05 מ"מ (1.2 מיקרוליטר) 2-מרקפטואתנול וערבבו.
הערה: 2-מרקפטואתנול משמש לשמירה על רמה נמוכה של רדיקלי חמצן.
אזהרה: 2-מרקפטואתנול רעיל בבליעה או בשאיפה (H301 + H331), קטלני במגע עם העור (H310), גורם לגירוי בעור (H315), עלול לגרום לתגובה אלרגית בעור (H317), גורם לנזק חמור לעיניים (H318), חשוד בנזק לעובר (H361d), עלול לגרום נזק לאיברים באמצעות חשיפה ממושכת או חוזרת בבליעה (H373), ורעיל מאוד לחיים במים עם השפעות ארוכות טווח (H410). ללבוש ציוד מגן אישי ולעבוד במכסה אדים. - תוך כדי ערבוב, התאם את ה-pH ל-7.2 על ידי הוספת 1 N (1 M) HCl או 1 N (1 M) NaOH. יעד ה-pH הסופי הוא 7.4, אך ה-pH עשוי לעלות ב-0.1-0.3 יחידות pH במהלך הסינון.
זהירות: HCl מכיל גז בלחץ; הוא עלול להתפוצץ אם הוא מחומם (H280), לגרום לכוויות חמורות בעור ולנזק לעיניים (H314), והוא רעיל בשאיפה (H331). ללבוש ציוד מגן אישי. - המשך לעבוד בארון בטיחות ביולוגית. הוסף 10% מים טהורים במיוחד כדי להביא את התמיסה לנפח הסופי.
- עקר את התמיסה מיד על ידי סינון באמצעות קרום בעל נקבוביות של 0.22 מיקרומטר. יש להוציא את התמיסה הסטרילית ישירות לבקבוק סטרילי. הוסף לתמיסה 7 מ"ל של 2% פניצילין/סטרפטומיוצין (P/S).
הערה: במהלך ההובלה, מוסיפים 2% P/S למדיום כדי להסיר את כל החיידקים. במהלך תרבית רקמה מוסיפים למדיום 1% P/S. - אחסן את תמיסת קרבס שהשתנתה בטמפרטורה של 4 מעלות צלזיוס עד לקצירת רקמות.
3. קצירת רקמות
- בהתאם לבית המטבחיים, הממו חזירים באמצעות התחשמלות או CO2. לאחר מכן, תלו חזירים על גפה אחורית, הוצאו והוכרזו כמתים.
- לפני הכניסה לתהליך השחיטה הנקייה, יש לשרוף חזירים להסרת שיער, לשרוף כדי להסיר את השערות האחרונות ולעקר את החלק החיצוני של הפגר.
- הסר את החזירים על ידי ביצוע חתך בקו האמצע לאורך הבטן והסרה זהירה של האיברים הפנימיים. בהתאם לבית המטבחיים, עורק הצוואר עדיין היה מחובר לפגר החזיר, או שעורק הצוואר כבר הוסר מהפגר עם מריטת איברי בית החזה.
- בעזרת סכין חדה, קצרו את עורק הצוואר עם חלק מהרקמה שנותרה מסביב מרקמת הפגר או אזור הגרון מבלי לגעת בעורק או להפעיל מאמץ מכני.
- הנח את הרקמה המכילה את עורק הצוואר בבקבוק ההובלה המכיל תמיסת קרבס סטרילית על ידי פתיחה קצרה של הבקבוק. הפוך את הבקבוק פעם אחת כדי להבטיח שכל הרקמה מכוסה בתמיסת קרבס. העבר את הרקמות על קרח למעבדה. ההסעה אורכת כ-30-45 דקות.
4. דיסקציה של רקמות
- עיקור ציוד דיסקציה פינצטה כירורגית (טיפול גס), פינצטה עגולה מצופה אפוקסי (טיפול עדין), אזמל, צביטה וכיסוי על ידי חיטוי.
- הכן את ארון הבטיחות הביולוגית לפני קציר/הובלת רקמות. מכסים את אזור הדיסקציה ביריעת וילון כירורגית. התקן ציוד חיתוך (בצינורות סטריליים של 50 מ"ל), להבים כירורגיים וכיסויים סטריליים. מלאו שתי צלחות פטרי גדולות ב-PBS סטרילי להכנת מגש חיתוך. דגרו את תרבית הרקמה בצלחת פטרי אחת קטנה עם מדיום א.ק.ג ב-37 מעלות צלזיוס.
- לאחר הובלת רקמות, בתוך ארון הבטיחות הביולוגית, העבירו את עורק הצוואר מבקבוק ההובלה (מלא בתמיסת קרבס שונה) לצלחת פטרי גדולה מלאה ב-PBS סטרילי באמצעות פינצטה כירורגית.
- הסר רקמות עודפות המקיפות את עורק הצוואר באמצעות פינצטה ואזמל כירורגיים כדי ליצור תצוגה ברורה של עורק הצוואר.
- הסר 2-3 ס"מ משני קצוות עורק הצוואר כדי לחסל אזורים הקרובים להתפצלות העורקים על ידי חיתוך בעזרת אזמל. הסר את החיתולית העורקית המקיפה את עורק הצוואר באמצעות הפינצטה העגולה העדינה.
הערה: חידוש להב האזמל עוזר לחתוך את הפאשיה בצורה מדויקת יותר. - העבירו את עורק הצוואר לצלחת פטרי גדולה חדשה מלאה ב- PBS סטרילי. הסר את השכבה הדקה שנותרה של פאשיה עורקית ככל האפשר.
הערה: ככל שעורק הצוואר ארוך יותר ב-PBS, כך יותר חתיכות פאשיה נוטות להשתחרר. הסרת פאשיה חשובה מכיוון שהיא תחסום את הראייה במהלך מיקרוסקופיה. - חותכים את עורק הצוואר הנקי לטבעות ברוחב של כ -2 מ"מ. מעבירים את טבעות עורק הצוואר לצלחת הפטרי הקטנה שחוממה מראש במילוי מדיום א.ק.ג ושומרים על 37 מעלות צלזיוס.
5. זריעת רקמות
הערה: חיבור הרקמות נבדק על ידי הוספת כיסוי ללא כיסוי, כיסוי סטרילי לא מטופל, או כיסוי סטרילי שטופל בפלורוני (1% w/v pluronic ב-PBS, כיסויים שהודגרו למשך הלילה ונשטפו במים סטריליים אולטרה-טהורים לפני השימוש) בגדלים שונים על גבי יריעת העורקים לאחר זריעה על הידרוג'ל PAA.
- הסר טיפות בינוניות של א.ק.ג מהג'לים. מעבירים טבעת עורק הצוואר לצלחת פטרי בינונית ונקייה במילוי PBS סטרילי.
- בעזרת הפינצטה העגולה והאזמל חותכים את הרינג לשניים. מנתחים חצי טבעת ליריעות ברוחב של כ -2 מ"מ ליצירת יריעות עורקים במידות 2 על 2 מ"מ. שימו לב לכיוון הצד האנדותל של יריעת העורק. עקמומיות וחלק מהפאשיה שנותרה של יריעת העורקים עשויים לסייע בקביעת כיוון זה.
הערה: גודל טבעות עורק הצוואר עשוי להשתנות. טבעות גדולות מניבות כ-6-8 גיליונות, בעוד טבעות קטנות מניבות 3-4 גיליונות. לטבעות גדולות יש התקשרות משופרת עקב פחות עקמומיות ביריעת העורק. - בעזרת הפינצטה העגולה, תפסו את היריעה העורקית בחלק האחורי של הסדין (מחוץ לדופן הכלי) והניחו את הסדין בקצה ג'ל ה-PAA כשהציפוי הפנימי של האנדותל פונה למצע ה-PAA כדי למנוע נזק למצע ה-PAA בעת הנחת הסדין.
- בעזרת פינצטה או צביטה, הזיזו את יריעת העורקים בעדינות רבה למרכז ההידרוג'ל PAA מבלי לגעת בג'ל. הניחו את יריעת העורקים בקצה הג'ל (הרקמה עלולה להידבק לפינצטה או לצביטה).
הערה: שרידים קטנים של פאשיה עורקית בחלק החיצוני של דופן הכלי יוצרים ידית קלה לתפיסת יריעת העורק בעוד שהציפוי הפנימי האנדותל של דופן הכלי חלק מאוד. - הוסף 50 מיקרוליטר של מדיום א.ק.ג על גבי יריעת העורקים המונחת על מצע ה-PAA. טיי לשמור את טיפת מדיום האק"ג על גבי הג'ל.
- בעזרת הפינצטה העגולה, הנח כיסוי יבש של 13 מ"מ על גבי יריעת העורקים על מצע ה-PAA בבינוניות. השתמש בשפה הפנימית של תחתית הזכוכית כדי להוריד בעדינות את הכיסוי עד שהוא נוגע בטיפה הבינונית והמדיום מתפשט מתחתיה.
הערה: חיפויי הכיסוי בגודל 13 מ"מ הם יתרון מכיוון שהם תואמים היטב את גודל הקיר הפנימי של לוחית הבאר התחתונה מזכוכית. אם תוריד את הכיסוי מהר מדי, הרקמה תעבור לקצה הכיסוי. - השאירו את הרקמה להיצמד ב-37 מעלות צלזיוס ו-5% CO2 למשך 5 שעות לפני הוספת 1 מ"ל של מדיום א.ק.ג לכל באר. הנח את יריעת העורקים על מצע ה-PAA ב-37 מעלות צלזיוס ו-5% CO2 למשך 24 שעות.
6. יצירת מודל 2.5D
- חיטוי פינצטה עם קצה עגול להסרת כיסוי. הכן 1 M NaOH במים טהורים במיוחד, עקר על ידי סינון דרך מסנן בגודל נקבוביות של 0.22 מיקרומטר ואחסן בטמפרטורה של 4 מעלות צלזיוס.
הערה: ניתן לעשות שימוש חוזר ב-1 M NaOH בניסויים עתידיים. - בעזרת מחט חדה סטרילית עם קצה כפוף, הרם את הכיסוי בגודל 13 מ"מ מיריעת העורקים בעדינות רבה והסר את הכיסוי. השתמש בטבעת הפנימית של תחתית הזכוכית כתמיכה להרמה והסרה של הכיסוי. כל תנועה הצידה מגדילה את הסיכון לניתוק יריעת העורקים ממצע ה-PAA.
- בצינור מיקרוצנטריפוגה סטרילי מכינים את תערובת הקולגן מסוג I לפי טבלה 2 על קרח. עם הוספת קולגן מסוג I ו-NaOH לתמיסה, יש להשעות היטב ולהפוך את השפופרת פעם אחת כדי להבטיח שהתערובת מעורבבת בצורה הומוגנית.
הערה: עם הוספת קולגן מסוג I לתערובת, התערובת בצבע ורוד בהיר הופכת לחסרת צבע. עם הוספת NaOH, התערובת חסרת הצבע הופכת לוורוד בהיר. - הסר את המדיום מהבאר באמצעות מערכת יניקת ואקום. הסר את המדיום המקיף את הרקמה ככל האפשר מבלי לגעת ברקמה.
הערה: יותר מדי מדיום המקיף את יריעת העורקים ימנע מג'ל מסוג קולגן I להקיף אותו. - הוסף טיפה של 10 מיקרוליטר של תערובת ג'ל קולגן מסוג I על גבי כל יריעת עורקים והשאיר את ג'ל הקולגן מסוג I לפילמור למשך שעה אחת ב-37 מעלות צלזיוס ו-5% CO2.
- בעדינות רבה, הוסיפו 1 מ"ל של מדיום א.ק.ג מחומם מראש לכל באר והניחו את הדגימות ב-37 מעלות צלזיוס ו-5% CO2.
7. הדמיית תאים חיים
הערה: הדמיית תאים חיים בוצעה באמצעות מיקרוסקופ אפי-פלואורסצנטי Leica DMi8 או Nikon Ti2 Eclipse המצויד בבקרת תרמית, CO2 ולחות ונשלט באמצעות תוכנת Leica או NIS. בקרת מיקוד אדפטיבית (Leica) ומערכת מיקוד מושלמת (Nikon) שימשו לשמירה על מיקוד בזמן.
- לאחר 24 שעות של תרבית במערכת 2.5D, בדוק אם יש אנגיוגנזה מונבטת. חלק מהיריעות העורקיות כבר מתחילות ליצור נבטים תאיים לאחר 24 שעות של תרבית, בעוד שיריעות אחרות זקוקות לזמן נוסף כדי להתחיל הנבטה אנדותלית.
- אם החלה אנגיוגנזה של הנבטה, רענן את מדיום האק"ג והנח את צלחת 12 הבארות במחזיק הבמה בתוך קופסת הדגירה המחוממת מראש של 37 מעלות צלזיוס של המיקרוסקופ.
- בחר את המטרה המעניינת. במחקר זה נעשה שימוש במטרות שונות, השתמש ביעד פי 10 כדי ליצור סקירה גלובלית של היווצרות נבטים תאיים ויעד פי 20 לביצוע TFM.
- הגדר ערוץ (ים) מעניין. למטרות TFM, דמיין את הנבטים התאיים באמצעות ניגודיות פאזה ודמיין את הסמנים הפלואורסצנטיים (אדום כהה) במצע PAA באמצעות תעלה פלואורסצנטית באורך גל של 660 ננומטר.
- בחר (מרובים) אזורים מעניינים ומצא את מישור המיקוד. הפעל את מערכת המיקוד (בקרת מיקוד אדפטיבית ב-Leica DMi8 או מערכת מיקוד מושלמת ב-Nikon Ti2 Eclipse) כדי להבטיח מיקוד יציב בהדמיית דולג זמן.
- הגדר את קיטועי הזמן המעניינים על-ידי בחירת מרווח זמן ואורך קיטועי זמן. מרווחי זמן שונים (5-20 דקות) ואורכי זמן-lapse (4-24 שעות) שימשו למטרות שונות במחקר זה.
- למטרות TFM, לאחר הדמיית זמן, הסר תאים צומחים על ידי הוספת מספר טיפות של 5% SDS במים טהורים במיוחד והמתן מספר דקות. עבור כל מיקום שנבחר, קח מחסנית z (גובה z של 2 מיקרומטר הוגדר בגודל צעד של 0.2 מיקרומטר) של הסמנים הפלואורסצנטיים במצע PAA כדי לקבל מצב רגוע של הסמנים הפלואורסצנטיים כתמונת הייחוס.
הערה: הדמיית Z-stack מתבצעת מכיוון שתאים עשויים למשוך או לדחוף את הסמנים הפלואורסצנטיים בכיוון z.
8. ניתוח מיקרוסקופ כוח משיכה
- יישר וחתוך תמונות בהילוך מהיר ביחס לתמונת הייחוס הטובה ביותר לניתוח מדויק.
- כדי למדוד תזוזות של סמנים פלואורסצנטיים בהידרוג'ל PAA, בצע Velocimetry של תמונת חלקיקים (PIV) בין כל תמונת זמן-lapse לתמונת הייחוס באמצעות קודי MatLab מותאמים אישית. במסגרת ניתוח ה-PIV, חלקו את התמונות לחלונות חקירה של 32 על 32 פיקסלים עם חפיפה של 0.5.
- חשב את כוחות המתיחה מהתזוזות של הסמנים הפלואורסצנטיים על ידי מיקרוסקופ מתיחה מבוסס טרנספורמציה פורייה של ג'ל אינסופי בעובי ג'ל סופי באמצעות משוואת Boussinesq27.
תוצאות
באמצעות הפרוטוקול המתואר, אנו יכולים לגרום לאנגיוגנזה מונבטת ex vivo מעורק צוואר חזירי על גבי הידרוג'ל PAA דו-ממדי המכוסה בשכבה דקה של ג'ל קולגן מסוג I, ובכך ליצור מודל אנגיוגנזה מונבט ex vivo 2.5D. מודל זה מאפשר לנו לבצע TFM קונבנציונאלי ולמדוד את כוחות המתיחה התאיים של אנגיוגנזה הנבטה על ממשק הג'ל PAA במרחב ובזמן.
כדי לבסס את מודל ה-2.5D, הכנו תחילה הידרוג'ל פוליאקרילאמיד דו-ממדי (PAA) משובץ בסמנים פלואורסצנטיים, ולאחר מכן ציפוי לילה בקולגן מסוג IV (d-1 עד d0). ביום 0 (d0), יריעת עורקי הצוואר הונחה על ההידרוג'ל המצופה קולגן IV ואפשרה להיצמד למשך הלילה (d0 עד d1). לאחר מכן, שכבה דקה של ג'ל קולגן מסוג I נמרחה על יריעת העורקים, ולאחר מכן החלה הדמיה ביום הראשון (d1) כדי לנטר את הנבטת התאים ולעקוב אחר סמנים פלואורסצנטיים לניתוח מכני (d1 עד d2). כדי לאמת אנגיוגנזה מונבטת במודל 2.5D, ביצענו את אנגיוגנזה הנבטה ex vivo קונבנציונלית בג'ל קולגן תלת מימדי מסוג I במקביל. לשם כך הוכנה שכבה דקה של ג'ל קולגן מסוג I, ואחריה זריעה של יריעת עורק הצוואר, ולאחר מכן כוסה בשכבת קולגן נוספת (d0). הנבטה אנגיוגנית נוטרה לאורך זמן. בנוסף, השתדלנו לגרום לאנגיוגנזה מונבטת בדו-ממד כדי להפחית עוד יותר את מורכבות המודל. הליך הניסוי שיקף את זה של מודל 2.5D, כאשר ההבדל העיקרי הוא אי הכללת שכבת הג'ל העליונה של קולגן מסוג I. סקירה כללית של שלושת המודלים, כולל הליכי הניסוי שלהם, מתוארת באיור 1. עורקי הצוואר נקטפו מחזירים מבית המטבחיים המקומי והועברו בתמיסת קרבס טרייה וסטרילית. בתוך ארון הבטיחות הביולוגית, רקמה מוגזמת המקיפה את עורק הצוואר הוסרה כדי להבטיח שלא תהיה פגיעה בראייה של אנגיוגנזה מונבטת במהלך הדמיית זמן-lapse חיה (איור 2A-E). ברגע שהעורק היה נקי מרקמות עודפות, העורק נחתך לטבעות עורקים ברוחב 2 מ"מ, והטבעות נחתכו ליריעות עורקים במימד של 2X2 מ"מ (איור 2F).
כדי להבטיח אנגיוגנזה הנבטה על גבי ממשק ההידרוג'ל PAA במודל 2.5D ו-2D, זרענו את יריעות העורקים כשצד תא האנדותל הפנימי פונה להידרוג'ל PAA מצופה קולגן מסוג IV והשארנו אותם לחיבור. כדי לייעל את ההצמדה של יריעת העורקים להידרוג'ל PAA, בדקנו את ההשפעה של הוספת כיסוי זכוכית מצופה 12 מ"מ מצופה נגד עכירות על גבי יריעת העורק. לאחר 24 שעות, הכיסוי הוסר, ויעילות ההצמדה נמדדה באמצעות אחוז יריעות העורקים המחוברות להידרוג'ל PAA. ראינו שתוספת של כיסוי זכוכית - ללא תלות בציפוי נגד עכירות - הגדילה את יעילות ההצמדה של יריעות העורקים על גבי הידרוג'ל PAA בהשוואה ללא כיסוי (איור 3A-D). לאחר מכן, בדקנו את השפעת הקוטר (12 או 13 מ"מ) של כיסוי הזכוכית על יעילות ההצמדה של יריעת העורק, בעוד שהבאר הפנימית של הצלחת הייתה 14 מ"מ. ראינו כי כיסוי של 13 מ"מ מגביר את יעילות ההצמדה של יריעות העורקים על גבי הידרוג'ל PAA בהשוואה לכיסוי של 12 מ"מ (איור 3E-G) מכיוון שכוחות הגזירה במהלך הסרת החלקת הכיסוי ממוזערים. המשכנו להשתמש בכיסוי 13 מ"מ לא מטופל לחיבור יריעות עורקיות להידרוג'ל PAA הן במודלים 2.5D והן ב-2D.
לאחר שהיריעה העורקית חוברה להידרוג'ל PAA, הוספנו שכבה דקה של ג'ל קולגן מסוג I על גבי יריעת העורקים כדי ליצור סביבה של 2.5D. תרבית הדגימות במשך 5 ימים ובדקנו את הדגימות להנבטת אנגיוגנזה. צפינו בהיווצרות נבטים תאיים במודל התלת מימדי (איור 4A), בהתאם לאנגיוגנזה של נביטת ex vivo שדווחה בעבר בספרות 28,29,30. בתוך המודל הדו-ממדי, ראינו ארגון דומה של נבטים תאיים בהשוואה למודל התלת-ממדי (איור 4B). נבטים תאיים נוצרו במספר גבהים (וידאו 1), כולל בממשק PAA. בנוסף, אנגיוגנזה מונבטת מאופיינת בשגשוג גבוה של תאים מובילים ועוקבים, תופעה שראינו במהלך הנבטה במודל 2.5D (וידאו 2). כאשר מגדלים יריעת עורקים בדו-ממד, תאים ממקורות שונים (איור משלים 1) נודדים כחד-שכבות אל מחוץ לרקמה, ולכן חסרים את הארגון של נבטים תאיים (איור 4C). מכיוון שלא צפינו באנגיוגנזה מונבטת במודל הדו-ממדי, הוצאנו מודל זה מהניתוחים הבאים. בסך הכל, היריעה העורקית זקוקה לסביבה תלת מימדית מקומית כדי לגרום לאנגיוגנזה מונבטת, מה שמראה את הפוטנציאל של מודל 2.5D ex vivo של אנגיוגנזה מנביטה.
יתר על כן, מערכת מודל 2.5D היא מערכת רב-תכליתית המאפשרת למשתמשים לבחון את ההשפעה של רמזים מכניים מהמיקרו-סביבה התאית, למשל, קשיחות מטריצה. קשיחות מטריצה של הידרוג'ל קולגן תלת מימדי מסוג I - ההידרוג'ל המשמש בדרך כלל לאנגיוגנזה של הנבטה ex vivo - תלויה בריכוז חלבון ECM, כאשר עלייה בריכוז החלבון מתואמת עם עלייה בנוקשות המטריצה32. הטווח האופייני של ריכוז קולגן מסוג I כדי לגרום להידרוג'ל תלת מימדי זה לגרום לאנגיוגנזה של הנבטה הוא 1-4 מ"ג/מ"ל, המתאים לקשיחות מטריצה של 1 Pa עד 1 kPa 32,33,34. ריכוזים נמוכים יותר עשויים להיות רכים מכדי לספק תמיכה מבנית, בעוד שריכוזים גבוהים יותר יכולים לעכב את תנועת התאים. הנוקשות הפיזיולוגית של רקמת האנדותל היא 1 kPa35, אותה ניתן לחקות עם הידרוג'ל קולגן תלת מימדי מסוג I. עם זאת, היווצרות והתקדמות הגידול קשורות להתקשות רקמות4, ובכך מדגישים את הצורך במודל שיכול להשיג קשיחות מטריצה גבוהה יותר לחקר אנגיוגנזה של הגידול. ניתן לכוונן בקלות את קשיחות המצע של הידרוג'לים PAA - הנוקשות המורגשת על ידי תאי האנדותל של יריעת העורקים - בטווח של 1 עד עשרות kPa. כאן, בחנו את השפעת קשיחות המצע PAA על תחילת אנגיוגנזה הנבטה באמצעות אחוז הדגימות שהחלו את היווצרות הנבטים התאיים ביום שלאחר הוספת שכבת הקולגן מסוג I. ראינו כי יריעות עורקיות נוספות הראו סימנים מוקדמים של נבטים תאיים כאשר תרבית על הידרוג'ל PAA רך פיזיולוגי (1 kPa) בהשוואה להידרוג'ל PAA נוקשה פתולוגי (12 kPa) (איור 5), מה שמראה את הפוטנציאל של מודל זה לחקור את ההשפעה של נוקשות מטריצה על אנגיוגנזה של הנבטה. בנוסף לקשיחות המצע המתכווננת, מצעים אלה מאפשרים אפנון שיטתי של רמזים מכניים אחרים (למשל, הרכב וצפיפות מטריצה) כמו גם רמזים כימיים (למשל, עיכוב של מווסתים מולקולריים על ידי התניה של מדיום התרבית), המדגימים את הרבגוניות של מודל אנגיוגנזה זה של 2.5D ex vivo להנבטה.
כדי לכמת את המכניקה התאית באנגיוגנזה של הנבטה, ביצענו מיקרוסקופ כוח משיכה קונבנציונלי (TFM) על נבטים תאיים שנוצרו בממשק PAA הדו-ממדי. יום אחד אחרי הוספת שכבת הקולגן מסוג I, ביצענו דימות של תאים חיים של התאים (איור 6A) ושל הסמנים הפלואורסצנטיים שמוטמעים בהידרוג'ל PAA. תזוזות של הסמנים הפלואורסצנטיים נמדדו באמצעות Velocimetry של תמונת חלקיקים (איור 6B), ומתיחות תאיות חושבו באמצעות המאפיינים המכניים של הידרוג'ל PAA (איור 6C). עם מודל 2.5D ex vivo זה, ראינו בתחילה כוחות משיכה בבליטות של התא המוביל של נבט תאי ואחריו כוחות דחיפה לאורך הנבט התאי - הן בחלק האחורי של התא המוביל והן בתאי העוקב (איור 6C).
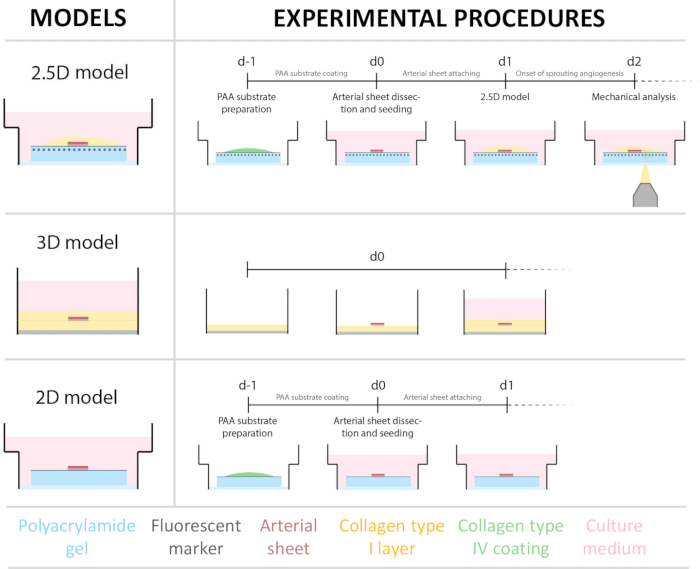
איור 1: מודלים והליכים ניסיוניים. (משמאל) מודלים ניסיוניים שנבדקו. מודל ה-2.5D מייצג יריעה עורקית המונחת על גבי הידרוג'ל שטוח מצופה קולגן מסוג IV פוליאקרילאמיד (PAA) ומכוסה בשכבה דקה של הידרוג'ל קולגן מסוג I. המודל התלת מימדי מייצג יריעת עורקים דחוקה בין שתי שכבות של ג'ל קולגן מסוג I, מערכת הידועה כגורמת לאנגיוגנזה הנבטה36. המודל הדו-ממדי מייצג יריעת עורקים המונחת על גבי הידרוג'ל PAA מצופה קולגן שטוח מסוג IV. (מימין) נהלים ניסיוניים למודלים מתאימים. עבור המודלים הדו-ממדיים וה-2.5D, הידרוג'ל PAA הוכן יום לפני הזריעה (d-1), וציפוי קולגן מסוג IV בוצע במהלך הלילה. עורק הצוואר נקצר מחזירים, נותח ליריעות עורקים, נזרע על גבי ההידרוג'ל ביום 0 (d0), והושאר לחיבור למשך הלילה (d1). עבור דגימות 2.5D, שכבה דקה של ג'ל קולגן מסוג I הונחה על גבי יריעת העורקים. ניתוח מכני בוצע לאחר תחילת ההנבטה ביום 2 (d2). עבור דגימות דו-ממדיות, המדיום עבר רענון ביום הראשון (d1). עבור המודל התלת מימדי, שכבה של קולגן מסוג I ג'ל הוכנה ממש לפני הזריעה ביום 0 (d0). יריעת העורקים נזרעה על גבי שכבת הקולגן מסוג I וכוסה בשכבה שנייה של קולגן מסוג I. אנא לחצו כאן לצפייה בגרסה גדולה יותר של איור זה.
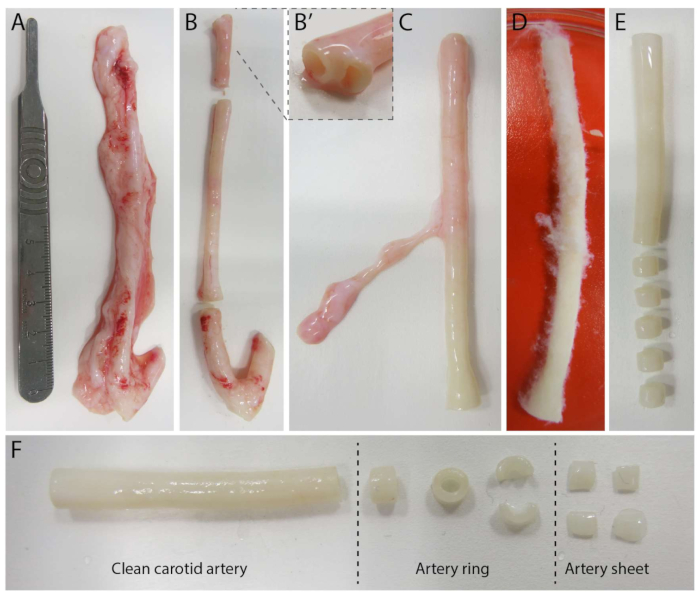
איור 2: שלבי דיסקציה של עורק הצוואר (d0). (A) עורקי צוואר באורך של כ-10 סנטימטרים נאספו מחזירים מבית המטבחיים המקומי. (B) רקמה עודפת וכ-2 ס"מ מהקצה (כדי להימנע מקרבה מדי לנקודות הסתעפות, (B') הושלכו. (ג-ה) עורק הצוואר היה מעור (C), ספוג ב-PBS (D) וכל הרקמות שנותרו הופשטו כדי להבטיח ראות ברורה במהלך ההדמיה (E). (F) עורק הצוואר הנקי נחתך לטבעות עורקים ברוחב משוער של 2 מילימטרים. כל רינג נחתך ל-4 יריעות עורקים במידות של כ-2X2 מ"מ. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
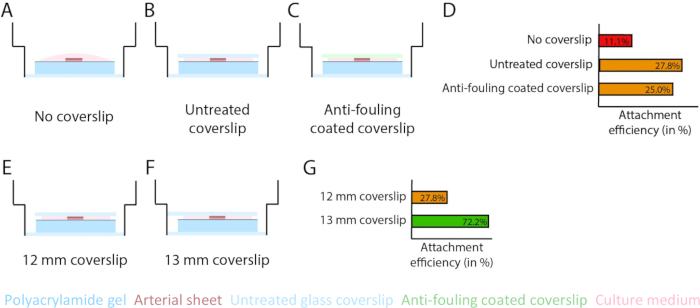
איור 3: נצילות ההצמדה של יריעות עורקיות גדלה באמצעות כיסוי זכוכית 13 מ"מ (d1). (A-D) השפעת כיסוי זכוכית על החיבור של יריעה עורקית להידרוג'ל פוליאקרילאמיד (PAA). נערכה השוואה בין כיסוי זכוכית ללא עכירות (A), כיסוי זכוכית לא מטופלת (B) וכיסוי זכוכית מצופה נגד עכירות באמצעות פלורוניק F127 (C). יעילות ההצמדה נמדדה על ידי מספר יריעות העורקים שהתחברו להידרוג'ל PAA לאחר הסרת הכיסוי בהשוואה למספר הכולל של הדגימות: ללא כיסוי (4 מתוך 36), כיסוי לא מטופל (10 מתוך 36) וכיסוי מצופה נגד עכירות (9 מתוך 36; ד). (E-G) השפעת גודל כיסוי זכוכית לא מטופלת על הצמדת יריעת עורקים להידרוג'ל PAA. נערכה השוואה בין כיסוי זכוכית 12 מ"מ לא מטופל (E) לבין כיסוי זכוכית 13 מ"מ לא מטופל (F) בתוך באר 14 מ"מ. יעילות החיבור נמדדה על ידי מספר יריעות העורקים המחוברות להידרוג'ל PAA לאחר הסרת הכיסוי בהשוואה למספר הכולל של הדגימות: כיסוי 12 מ"מ (10 מתוך 36) וכיסוי 13 מ"מ (52 מתוך 72; ז). אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של איור זה.
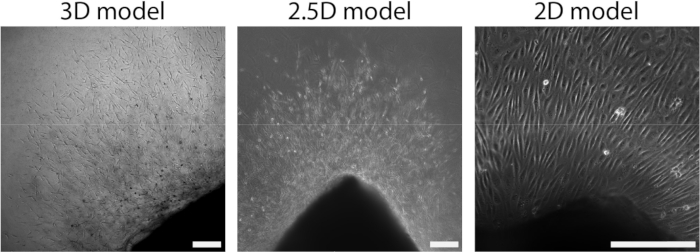
איור 4: הממדיות של המודל מגדירה ארגון במהלך צמיחה תאית (d2+). תאים נודדים החוצה מהרקמה בארגון נבטים במודל התלת-ממדי (משמאל), בדומה למודל 2.5D (באמצע). תאים נודדים החוצה מהרקמה בארגון חד-שכבתי במערך הדו-ממדי (מימין). סרגל הסולם מייצג 250 מיקרומטר. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 5: תחילת הנבטת האנדותל במודל 2.5D תלויה בקשיחות מצע הידרוג'ל פוליאקרילאמיד (d2). (א-ב) יריעה עורקית מכוסה בשכבה דקה של ג'ל קולגן מסוג I על גבי הידרוג'ל פוליאקרילאמיד (A; 1 kPa) או קשיח (B; 12 kPa) פוליאקרילאמיד (PAA) ביום השני של הפרוטוקול (יום אחד לאחר הוספת שכבת קולגן מסוג I ג'ל). (C) תחילת ההנבטה נמדדה על ידי מספר יריעות העורקים שכבר הראו סימנים של צמיחה תאית בהשוואה למספר הכולל של הדגימות: רכות (7 מתוך 24) ונוקשות (3 מתוך 24). סרגל קנה המידה מייצג 1 מ"מ (A, B) או 500 מיקרומטר (A', B'). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 6: אפיון כוח המתיחה במהלך אנגיוגנזה מוקדמת של הנבטה. הדמיה של תאים בזמן (0-4 שעות) מוצגת בשורה העליונה. תזוזות סמנים פלואורסצנטיות תואמות (0-2 מיקרומטר) ומתיחות תאיות (0-50 Pa) על מצע הידרוג'ל של 1 kPa PAA מוצגים בשורה האמצעית והתחתונה, בהתאמה. התקרבות של מתיחות סלולריות ב-0 שעות, 2 שעות ו-4 שעות מוצגות בכתום. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
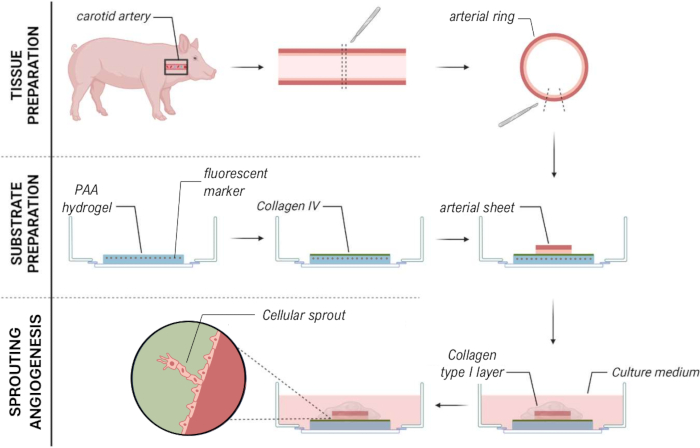
איור 7: שיטת מודל אנגיוגנזה להנבטה ex vivo 2.5D המאפשרת אפיון מכני של נבטים תאיים. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
| 1 kPa | 12 kPa | |
| PBS | 435 מיקרוליטר | 373.7 מיקרוליטר |
| 40% אקרילאמיד | 50 מיקרוליטר | 93.8 מיקרוליטר |
| 2% ביס-אקרילאמיד | 7.5 מיקרוליטר | 25 מיקרוליטר |
| סמן פלואורסצנטי (אדום כהה) | 5 מיקרוליטר | 5 מיקרוליטר |
| 10% APS | 2.5 מיקרוליטר | 2.5 מיקרוליטר |
| תמד | 0.25 מיקרוליטר | 0.25 מיקרוליטר |
טבלה 1: יחסי תערובת ג'ל PAA.
| נוסחה | נפח לצלחת 12 בארות (130 מיקרוליטר) | |
| א.ק.ג בינוני | VECG=Vסופי-V col1-V NaOH | 82.16 מיקרוליטר |
| קולגן סוג I | Vcol1=(Vסופי*Cסופי)/C מלאי | 46 מיקרוליטר |
| נאוה | VNaOH=0.04*Vcol1 | 1.84 מיקרוליטר |
טבלה 2: ג'ל קולגן מסוג I מערבב נפחים באמצעות קיצורים של נפח (V) וריכוז (C).
סרטון 1: הדמיית Timelapse של היווצרות נבטים תאיים בתוך מודל 2.5D. התאים צולמו באמצעות הדמיית ניגודיות פאזה לאורך פרק זמן של 22 שעות עם מרווח זמן של 17.5 דקות. נבטים תאיים נוצרו בגבהים מרובים בתוך שכבת הג'ל קולגן מסוג I כפי שנצפה על ידי מישורי המוקד השונים. סרגל הסולם מייצג 100 מיקרומטר. אנא לחץ כאן להורדת סרטון זה.
סרטון 2: קצב התפשטות גבוה של תאים בתוך נבטים תאיים במודל 2.5D. התאים צולמו באמצעות הדמיית ניגודיות פאזה במשך תקופה של 22 שעות עם מרווח זמן של 17.5 דקות. גם תאי המנהיגים וגם תאי העוקבים מתרבים במהלך הדמיית זמן-lapse. סרגל הסולם מייצג 100 מיקרומטר. אנא לחץ כאן להורדת סרטון זה.
איור משלים 1: פנוטיפ תאי במודל דו-ממדי (d2+) על ידי צביעה אימונופלואורסצנטית. (A) צביעה אימונופלואורסצנטית (IF) של גרעין התא (DAPI), סמן תאי אנדותל (CD31) וסמן פיברובלסטים (אלפא-שריר חלק; α-SMA). (B) צביעת IF של גרעין התא (DAPI), סמן תאי אנדותל (CD31) וסמן תאי שריר חלק (קלפונין). סרגל הסולם מייצג 100 מיקרומטר. אנא לחץ כאן להורדת איור זה.
קובץ משלים 1: פרוטוקול צביעה אימונופלואורסצנטי.אנא לחץ כאן להורדת קובץ זה.
Discussion
הנבטת אנגיוגנזה - היווצרות כלי דם חדשים - היא תהליך מורכב המוסדר על ידי מנגנונים מולקולריים ומכניים כאחד. בעוד שמודלים תלת מימדיים רבים פותחו במהלך העשורים האחרונים כדי לחקור את המניעים המולקולריים (למשל, איתות VEGF ו-Notch) של אנגיוגנזה נביטה, רק מעט ידוע על מכניקת התא בשל מגבלות המודל. מיקרוסקופ כוח משיכה (TFM) היא טכניקה ידועה לכימות כוחות תאיים במרחב ובזמן, שבה עיוותים דו-ממדיים של מצע מומרים למתיחות תאיות. לכן, בפרוטוקול זה, אנו מתארים מודל 2.5D ex vivo, כלומר אנו מספקים לתאים סביבה תלת-ממדית מקומית תוך שמירה על הפשטות של מודל דו-ממדי המאפשר כימות של כוחות משיכה במהלך אנגיוגנזה של הנבטה (איור 1). לשם כך, הכנו וזרענו יריעת עורקים חזירית (צד האנדותל כלפי מטה; איור 2) על גבי הידרוג'ל פוליאקרילאמיד מצופה קולגן מסוג IV (PAA) המכיל סמנים פלואורסצנטיים. אחרי החיבור של יריעת העורקים באמצעות כיסוי זכוכית בקוטר 13 מ"מ (איור 3), אנו מוסיפים שכבה דקה של הידרוג'ל קולגן מסוג I שמאפשרת היווצרות של נבטים תאיים (איור 4). באמצעות מודל זה, אנו מראים שבמהלך הנבטה התאית 22,23,24,25, תאים מובילים מפעילים כוחות משיכה (כפי שנצפה בספרות 19,20,21,22), אך גם שתאי עוקבים מפעילים כוחות דחיפה (איור 6). הרזולוציה של שדה המתיחה המתקבלת באמצעות הפרוטוקול שלנו מאפשרת ניתוחים כמותיים של קינמטיקה ודינמיקה תאית הן בזמן והן במרחב האופייניים לעבודות הנוקטות במיקרוסקופ כוח משיכה על מצעים תואמים 37,38,39.
יתר על כן, אנו מדגימים את הרבגוניות של מודל 2.5D ex vivo זה של אנגיוגנזה מונבטת על ידי שינוי הרמזים המכניים של המיקרו-סביבה (איור 5). בעוד שאנגיוגנזה של הנבטה מתרחשת בדרך כלל בנוקשות פיזיולוגית של 1 kPa35 - שניתן לחקות על ידי הידרוג'ל קולגן תלת מימדי מסוג I, אנגיוגנזה של גידול מתרחשת במיקרו-סביבה נוקשה40 - שהיא מעבר לטווח הנוקשות של הידרוג'לים קונבנציונליים של קולגן תלת מימדי מסוג I. ניתן לכוונן בקלות את קשיחות המצע של PAA על ידי שינוי היחס בין קישורים צולבים כדי ליצור קשיחות מצע גבוהה יותר. באמצעות מודל זה, אנו מגלים כי תחילת האנגיוגנזה הנביטה תלויה בנוקשות. מצעים אלה לא רק מציעים קשיחות ניתנת לכוונון אלא גם מאפשרים אפנון שיטתי של רמזים מכניים שונים אחרים, למשל, הרכב וצפיפות מטריצה. בנוסף, מודל זה מאפשר לנו לחקור מכניקה תאית תוך מניפולציה של מווסתים מולקולריים באמצעות התניה של המדיום (למשל, השפעת העיכוב על איתות Notch על מכניקת התא) כדי להבין את המנגנונים המכנוביולוגיים של אנגיוגנזה הנבטה. זה מדגים את התועלת של מודל 2.5D ex vivo זה של אנגיוגנזה מונבטת בדוגמית של מיקרו-סביבות שונות.
המודל שאנו מציגים עושה שימוש ב-TFM דו-ממדי קונבנציונלי, המציע ניתוח פשוט יותר, רזולוציה מרחבית גבוהה יותר ויישום קל יותר בהשוואה ל-TFM תלת-ממדי (ויסקו-אלסטי), מה שהופך אותו לנגיש וחסכוני יותר26,41. עם זאת, TFM תלת מימדי (ויסקו-אלסטי) מספק סביבה רלוונטית יותר מבחינה פיזיולוגית על ידי לכידת כוחות משיכה בכל שלושת הממדים והתחשבות בתכונות המכניות המורכבות של המטריצה החוץ-תאית, ומציע תובנות עמוקות יותר לגבי התנהגות התא בהקשר מציאותי יותר 42,43,44,45. השפעה זו של מימדיות מצביעה גם על מגבלה של מודל 2.5D זה. אנו משתמשים ב-TFM דו-ממדי בהנחה שתאים נודדים על מצע דו-ממדי. אמנם זה המקרה במודל 2.5D זה, אך התאים נמצאים בסביבה תלת מימדית מקומית ולכן נצמדים לשכבת הג'ל מסוג קולגן מסוג I ומפעילים כוחות בשכבת ג'ל זו. ההנחה שאימצנו בניתוח זה היא ששכבת הג'ל של קולגן מסוג I אינה מחוברת מכנית (אין העברת כוח בין שני ההידרוג'לים הללו) לממשק PAA בשל הפרש סדר הגודל בנוקשות המטריצה, ולכן ממזערת את השפעת הכוחות התאיים על שכבת הקולגן מסוג I. זה הופך את אפיון הכוח באמצעות מודל 2.5D ex vivo לייצוג פשוט של הכוחות הנוצרים על ידי התאים. בנוסף, פרוטוקול זה דורש דיוק והוא נרחב עם מספר שלבים שבהם ניתן לאבד דגימות, למשל (i) קשיי נראות תאים עקב רקמה מוגזמת המקיפה את יריעת העורקים (איור 2), (ii) אחת מכל שלוש דגימות אינה מתחברת למצע PAA (איור 3), (iii) לא כל הדגימות יתחילו היווצרות של נבטים תאיים (איור 5), (iv) נבטים תאיים אינם נוצרים במצע PAA, ו-(v) סמנים פלואורסצנטיים לא ממוקדים בעת שימוש ביריעת עורקים עבה על גבי הידרוג'ל PAA בעל קשיחות נמוכה. לכן, ביצענו אופטימיזציה של שיטה זו עבור צלחת של 12 בארות כדי להבטיח שפע של אזורי עניין לביצוע ניתוח מכני של אנגיוגנזה מונבטת.
לסיכום, הגישה המוצגת לאפיון פשוט יותר של כוחות המתיחה התאיים של אנגיוגנזה מונבטת של יריעת עורק חזירית חיה באמצעות מודל 2.5D (איור 7) יכולה לסייע ביצירת תובנות מדויקות יותר ובזמן אמת לגבי האינטראקציות המכניות במהלך אנגיוגנזה בהקשר של רקמה מקומית, מה שמקל על חקר תהליכים תאיים דינמיים עם מורכבות מופחתת ויכולת שחזור משופרת בהשוואה למערכות תלת מימד מלאות. זה יכול לשפר את ההבנה שלנו כיצד תאים מגיבים לרמזים מכניים בסביבה רלוונטית יותר מבחינה פיזיולוגית תוך שמירה על הפשטות האנליטית של שיטות דו-ממדיות. ידע זה יכול לקדם את תחום הנדסת הרקמות במטרה ליצור כלי דם אך גם למצוא תרופות טיפוליות למניעת אנגיוגנזה של גידולים במטרה להגביל את צמיחת הגידול ולהפחית גרורות.
Disclosures
למחברים אין ניגודי אינטרסים לחשוף.
Acknowledgements
אנו מודים לאנשי LifeTec על הקציר וההובלה של עורקי הצוואר החזיריים מבית המטבחיים המקומי; ליאון הרמנס, פים ואן דן ברסלאר ואדריה וילקרוסה ריבאס (TU/e, ICMS) על הדיונים הפוריים על נהלים ניסויים וניתוח אפיון מכני. אנו אסירי תודה על התמיכה במענקים ממועצת המחקר האירופית (771168), הארגון ההולנדי למחקר מדעי (024.003.013), האקדמיה של פינלנד (307133, 316882, 330411 ו-337531), ומרכזי המצוינות של קרן אוניברסיטת אובו אקדמי (CellMech).
Materials
| Name | Company | Catalog Number | Comments | |
| 2% bis-acrylamide | Bio-Rad | 1610143 | ||
| 2-mercaptoethanol | Merck Life Science | 60-24-2 | ||
| 3-(Trimethoxysilyl)propyl methacrylate | Bind-Silane | Sigma-Aldrich | 440159-100ML | |
| 40% acrylamide | Bio-Rad | 1610140 | ||
| Aboslute ethanol (for analysis) | VWR International | 1.00983.1000 | ||
| Absolute ethanol (industrial) | VWR International | 83813.41 | ||
| Acetic acid, glacial 100% | Merck | 1000562500 | ||
| Ammonium persulfate | APS | Bio-Rad | 7727-54-0 | 10% APS dissolved in Milli-Q water, aliquoted and stored at -20 °C |
| antibody (primary) - calponin | abcam | ab46794 | dilution 1:200 | |
| antibody (primary) - CD31 | Serotec | MCA1746 | dilution 1:10 | |
| antibody (primary) - α-smooth muscle actin | αSMA | Dako | M0851 | dilution 1:100 |
| antibody (secondary) - goat-anti-mouse-IgG1 Alexa 488 | Molecular Probes | A21121 | dilution 1:200 | |
| antibody (secondary) - goat-anti-mouse-IgG2a Alexa 555 | Molecular Probes | A21137 | dilution 1:200 | |
| antibody (secondary) - goat-anti-rabbit-IgG Alexa 555 | Molecular Probes | A21428 | dilution 1:200 | |
| Autoclave | Astell | |||
| Calcium chloride dihydrate | CaCl2 | Calbiochem | 208291-250GM | |
| Collagen type I, rat-tail | Corning | 354236 | ||
| Collagen type IV, human placenta | Merck Life Science | C5533-5MG | dissolved in PBS at a concentration of 1mg/mL, aliqouted and stored at -80 °C | |
| Endothelial Cell Growth Medium | ECG medium | Promocell | C-22111 | supplemented with 2% FCS, supplement mix (both included), and 1% P/S |
| Expoxy-coated round tip tweezer | fine tweezer | Rubis Pinzette | E78144-2A | |
| Fluorescent marker, dark red | Invitrogen | F8807 | ||
| Glass coverslips, Ø13 mm, #1 | Epredia | CB00130RA120MNZ0 | ||
| Glass coverslips, Ø13 mm, #1.5 | Epredia | CB00120RAC20MNZ0 | ||
| Hydrochloride acid, 25% | HCl | Merck | 1.100316.1000 | |
| Krebs-Henseleit buffer | Sigma-Aldrich | K3753 | ||
| Microscope, Leica Application Suite X software, version 3.5.7.23225 | Leica Microsystems | |||
| Microscope, Leica DMi8 epifluorescent microscope | Leica Microsystems | |||
| Microscope, Nikon Ti2 Eclipse | Nikon | |||
| Microscope, NIS-Elements AR software | Nikon | |||
| N,N,N',N'-tetramethylethane-1,2-diamine | TEMED | Merck Life Science | 110-18-9 | |
| Nalgene bottle | Thermo Scientific | 2187-0016 | ||
| Needle, 21Gx1" | Henke Sass Wolf | HK4710008025 | ||
| Normal serum, goat | Gibco | 10098792 | ||
| Papaverine hydrochloride | Sigma | 61-25-6 | ||
| Penicillin/Streptomyocin (10 000 U/mL) | P/S | Gibco | 15140163 | |
| Petri-dish, large (145x20mm) | Greiner Bio-one | 639160 | ||
| Petri-dish, small (60x15mm) | Greiner Bio-one | 628160 | ||
| Phosphate Buffered Saline | PBS | Sigma | P4417 | |
| Pluronic F-127 | Merck Life Science | P2443-250G | ||
| Puncture needle, sharp closed tip | unknown | |||
| Scalpel, no. 4 | Swann-Morton | |||
| Sodium hydrogen carbonate | NaHCO3 | VWR International | 144-55-8 | |
| sulfosuccinimidyl 6-(4'-azido-2'-nitrophenylamino)hexanoate | Sulfo-SANPAH | Thermo Scientific | 22589 | dissolved in DMSO at a concentration of 25 mg/mL, aliquoted and stored at -80 °C |
| Surgical blade, no. 20 | Swann-Morton | |||
| Surgical drape sheet | Foliodrape | 2775001 | ||
| Surgical tweezer | Lettix | 400024 | ||
| Triton X-100 | Merck | 9036-19-5 | ||
| UV lamp | Analytik Jena | 95-0042-13 | ||
| well plate, 96-well, F-bottom | Greiner Bio-one | 655180 | ||
| well plate, glass bottom 12-well | MatTek | P12G-0-14-F | ||
References
- Carmeliet, P. Angiogenesis in health and disease. Nat Med. 9 (6), 653-660 (2003).
- Folkman, J. Angiogenesis in cancer, vascular, rheumatoid and other disease. Nat Med. 1, 27-30 (1995).
- Kretschmer, M., Rüdiger, D., Zahler, S. Mechanical aspects of angiogenesis. Cancers. 13 (19), 4987 (2021).
- Bordeleau, F., et al. Matrix stiffening promotes a tumor vasculature phenotype. Proc Natl Acad Sci U S A. 114 (3), 492-497 (2017).
- Blanco, R., Gerhardt, H. VEGF and Notch in tip and stalk cell selection. Cold Spring Harb Perspect Med. 3 (1), a006569 (2013).
- Adams, R. H., Alitalo, K. Molecular regulation of angiogenesis and lymphangiogenesis. Nat Rev Mol Cell Biol. 8, 464-478 (2007).
- Carmeliet, P., De Smet, F., Loges, S., Mazzone, M. Branching morphogenesis and antiangiogenesis candidates: tip cells lead the way. Nat Rev Clin Oncol. 6, 315-326 (2009).
- Salam, N., et al. Assessment of migration of human mscs through fibrin hydrogels as a tool for formulation optimisation. Materials. 11 (9), 1781 (2018).
- Solbu, A. A., et al. Assessing cell migration in hydrogels: An overview of relevant materials and methods. Materials Today Bio. 18, 100537 (2023).
- Cao, W., Li, X., Zuo, X., Gao, C. Migration of endothelial cells into photo-responsive hydrogels with tunable modulus under the presence of pro-inflammatory macrophages. Regenerat Biomater. 6 (5), 259-267 (2019).
- Staton, C. A., Reed, M. W. R., Brown, N. J. A critical analysis of current in vitro and in vivo angiogenesis assays. Int J Exp Pathol. 90 (3), 195-221 (2009).
- Staton, C. A., et al. Current methods for assaying angiogenesis in vitro and in vivo. Int J Exp Path. 85, 233-248 (2004).
- Ngo, T. X., et al. In Vitro models for angiogenesis research: A review. Int J Tissue Regenerat. 5, 37-45 (2014).
- Tomita, Y., et al. An ex vivo choroid sprouting assay of ocular microvascular angiogenesis. J Vis Exp. (162), e61677 (2020).
- Kapoor, A., Chen, C. G., Iozzo, R. V. A simplified aortic ring assay: A useful ex vivo method to assess biochemical and functional parameters of angiogenesis. Matrix Biol Plus. 6-7, 100025 (2020).
- Stiffey-Wilusz, J., Boice, J. A., Ronan, J., Fletcher, A. M., Anderson, M. S. An ex vivo angiogenesis assay utilizing commercial porcine carotid artery: Modification of the rat aortic ring assay. Angiogenesis. 4 (1), 3-9 (2001).
- Kniazeva, E., Putnam, A. J. Endothelial cell traction and ECM density influence both capillary morphogenesis and maintenance in 3-D. Am J Physiol Cell Physiol. 297 (1), C179-C187 (2009).
- Davidson, C. D., Wang, W. Y., Zaimi, I., Jayco, D. K. P., Baker, B. M. Cell force-mediated matrix reorganization underlies multicellular network assembly. Sc Rep. 9 (1), 12 (2019).
- Lyle, K. S., Corleto, J. A., Wittmann, T. Microtubule dynamics regulation contributes to endothelial morphogenesis. BioArchitecture. 2 (6), 220-227 (2012).
- Kniazeva, E., et al. Quantification of local matrix deformations and mechanical properties during capillary morphogenesis in 3D. Integrat Biol. 4 (4), 431-439 (2012).
- Quintanilla, M. A., Hammer, J. A., Beach, J. R. Non-muscle myosin 2 at a glance. J Cell Sci. 136 (5), jcs.260890 (2023).
- Fischer, R. S., Gardel, M., Ma, X., Adelstein, R. S., Waterman, C. M. Local cortical tension by myosin II guides 3D endothelial cell branching. Curr Biol. 19 (3), 260-265 (2009).
- Yoon, C., et al. Myosin IIA–mediated forces regulate multicellular integrity during vascular sprouting. Mol Biol Cell. 30 (16), 1974-1984 (2019).
- Du, Y., et al. Three-dimensional characterization of mechanical interactions between endothelial cells and extracellular matrix during angiogenic sprouting. Sci Rep. 6, 21362 (2016).
- Vaeyens, M. M., et al. Matrix deformations around angiogenic sprouts correlate to sprout dynamics and suggest pulling activity. Angiogenesis. 23 (3), 315-324 (2020).
- Style, R. W., et al. Traction force microscopy in physics and biology. Soft Matter. 10 (23), 4047-4055 (2014).
- Trepat, X., et al. Physical forces during collective cell migration. Nat Phys. 5 (6), 426-430 (2009).
- Santos-Oliveira, P., et al. The force at the tip - modelling tension and proliferation in sprouting angiogenesis. PLoS Comput Biol. 11 (8), e1004436 (2015).
- Boreddy, S. R., Sahu, R. P., Srivastava, S. K. Benzyl isothiocyanate suppresses pancreatic tumor angiogenesis and invasion by inhibiting HIF-α/VEGF/Rho-GTPases: Pivotal role of STAT-3. PLoS One. 6 (10), 0025799 (2011).
- Teng, R. J., Eis, A., Bakhutashvili, I., Arul, N., Konduri, G. G. Increased superoxide production contributes to the impaired angiogenesis of fetal pulmonary arteries with in utero pulmonary hypertension. Am J Physiol Lung Cell Mol Physiol. 297 (1), L184-L195 (2009).
- Costa, G., et al. Asymmetric division coordinates collective cell migration in angiogenesis. Nature Cell Biol. 18 (12), 1292-1301 (2016).
- Slater, K., Partridge, J., Nandivada, H. . Corning tuning the elastic moduli of Corning Matrigel and collagen I 3D matrices by varying the protein concentration. , (2019).
- Lee, J., et al. Effect of chain flexibility on cell adhesion: Semi-flexible model-based analysis of cell adhesion to hydrogels. Sci Rep. 9 (1), 2463 (2019).
- Motte, S., Kaufman, L. J. Strain stiffening in collagen i networks. Biopolymers. 99 (1), 35-46 (2013).
- Butcher, D. T., Alliston, T., Weaver, V. M. A tense situation: Forcing tumour progression. Nat Rev Cancer. 9 (2), 108-122 (2009).
- Artym, V. V., Matsumoto, K. Imaging cells in three-dimensional collagen matrix. Curr Prot Cell Biol. 10, Unit 10.18.1-Unit 10.18.20 (2010).
- Labernadie, A., et al. A mechanically active heterotypic E-cadherin/N-cadherin adhesion enables fibroblasts to drive cancer cell invasion. Nat Cell Biol. 19 (3), 224-237 (2017).
- Bazellières, E., et al. Control of cell-cell forces and collective cell dynamics by the intercellular adhesome. Nat Cell Biol. 17 (4), 409-420 (2015).
- Uroz, M., et al. Traction forces at the cytokinetic ring regulate cell division and polyploidy in the migrating zebrafish epicardium. Nat Mater. 18 (9), 1015-1023 (2019).
- Dong, C., Nastaran, Z., Konstantopoulos, K. . Biomechanics in oncology. , (2018).
- Schwarz, U. S., Soiné, J. R. D. Traction force microscopy on soft elastic substrates: A guide to recent computational advances. Biochim Biophys Acta. 1853 (11), 3095-3104 (2015).
- Toyjanova, J., et al. 3D Viscoelastic traction force microscopy. Soft Matter. 10 (40), 8095-8106 (2014).
- Legant, W. R., et al. Multidimensional traction force microscopy reveals out-of-plane rotational moments about focal adhesions. Proc Natl Acad Sci U S A. 110 (3), 881-886 (2013).
- Steinwachs, J., et al. Three-dimensional force microscopy of cells in biopolymer networks. Nat Meth. 13 (2), 171-176 (2016).
- Franck, C., Maskarinec, S. A., Tirrell, D. A., Ravichandran, G. Three-dimensional traction force microscopy: A new tool for quantifying cell-matrix interactions. PLoS One. 6 (3), e17833 (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved