Method Article
2.5D-Modell zur ex vivo mechanischen Charakterisierung der Keimangiogenese in lebendem Gewebe
In diesem Artikel
Zusammenfassung
Die Keimangiogenese, die für Entwicklung und Krankheit von grundlegender Bedeutung ist, umfasst komplexe molekulare und mechanische Prozesse. Wir präsentieren ein vielseitiges 2,5D-ex vivo-Modell , das das zelluläre Keimen aus Schweine-Halsschlagadern analysiert und dabei die steifigkeitsabhängige Angiogenese und die ausgeprägte Leader-Follower-Zellmechanik aufdeckt. Dieses Modell hilft bei der Weiterentwicklung von Tissue-Engineering-Strategien und Krebstherapieansätzen.
Zusammenfassung
Die Keimangiogenese ist die Bildung neuer Blutgefäße aus bereits bestehenden Gefäßen und ist von großer Bedeutung für physiologische wie Gewebewachstum und -reparatur sowie pathologische Prozesse, einschließlich Krebs und Metastasen. Der mehrstufige Prozess der keimenden Angiogenese ist ein molekular und mechanisch getriebener Prozess. Es besteht aus der Induktion von zellulären Sprossen durch den vaskulären endothelialen Wachstumsfaktor, der Selektion von Leader/Follower-Zellen durch Notch-Signalgebung, der gerichteten Migration von Endothelzellen sowie der Gefäßfusion und -stabilisierung. Im Laufe der Jahre wurde eine Vielzahl von Modellen zur Keimangiogenese entwickelt, um die zugrunde liegenden Mechanismen des zellulären Keimens besser zu verstehen. Trotz Fortschritten beim Verständnis der molekularen Treiber der sprießenden Angiogenese ist die Rolle mechanischer Signale und des mechanischen Treibers der sprießenden Angiogenese aufgrund von Einschränkungen in bestehenden Modellen noch zu wenig erforscht. In dieser Studie haben wir ein 2,5D ex vivo-Modell entworfen, das es uns ermöglicht, das zelluläre Keimen aus einer Schweinehalsschlagader mittels Zugkraftmikroskopie mechanisch zu charakterisieren. Das Modell identifiziert ausgeprägte Kraftmuster innerhalb des Sprosses, wobei Leitzellen Zugkräfte und Folgezellen Druckkräfte auf die Matrix ausüben. Die Vielseitigkeit des Modells ermöglicht die Manipulation sowohl chemischer als auch mechanischer Hinweise, wie z. B. der Matrixsteifigkeit, was seine Relevanz für verschiedene Mikroumgebungen erhöht. Hier zeigen wir, dass der Beginn der sprießenden Angiogenese steifigkeitsabhängig ist. Das vorgestellte 2,5D-Modell zur Quantifizierung der zellulären Zugkräfte bei der Keimangiogenese bietet eine vereinfachte, aber physiologisch relevante Methode, die unser Verständnis der zellulären Reaktionen auf mechanische Signale verbessert, was das Tissue Engineering und therapeutische Strategien gegen die Tumorangiogenese vorantreiben könnte.
Einleitung
Die Angiogenese ist der Prozess der Bildung neuer Blutgefäße aus bereits vorhandenen Blutgefäßen. Dieser Prozess ist während der Embryonalentwicklung, der Wundheilung und des Fortschreitens der Krebserkrankung von entscheidender Bedeutung, die alle mit biomechanischen Veränderungen der Mikroumgebung verbunden sind 1,2,3,4. Zu Beginn der Angiogenese setzen hypoxische oder verletzte Gewebe den vaskulären endothelialen Wachstumsfaktor (VEGF) frei, der die Endothelzellen benachbarter Blutgefäße aktiviert, um endotheliale Sprossen zu bilden - wo zwei unterschiedliche Leader- und Follower-Phänotypen über den molekularen Notch-Signalwegangenommen werden 5. Bei der Bildung von Endothelsprossen, einem Phänomen, das als sprießende Angiogenese bekannt ist, bauen Leitzellen die umgebende extrazelluläre Matrix ab, um kollektiv in Richtung des VEGF-Stimulus zu wandern, ohne die Zell-Zell-Adhäsionen mit den nachfolgenden Zellen zu verlieren 6,7.
In den letzten Jahrzehnten wurden immer mehr Assays zur Keimangiogenese beschrieben, die die kollektive Zellmigration mit verschiedenen Methoden untersuchen, die jeweils unterschiedliche Vorteile und Grenzen bieten. Diese Assays bewerten die koordinierte Bewegung von Zellgruppen, wie z. B. Endothelzellen, durch 3D-Matrizen und ermöglichen die Untersuchung zellulärer Verhaltensweisen wie Keimen, Invasion und kollektive Migration in einer kontrollierten Umgebung 8,9,10. In-vivo-Angiogenese-Assays für das Keimen bieten eine umfassende Bewertung innerhalb eines lebenden Organismus, indem sie komplizierte Wechselwirkungen erfassen, sind jedoch zeitaufwändig, kostspielig, anfällig für eine hohe Variabilität und schwer zu quantifizieren 11,12. In-vitro-Keim-Angiogenese-Assays ermöglichen eine präzise Kontrolle der experimentellen Bedingungen mit hoher Reproduzierbarkeit und präziser Quantifizierung, replizieren jedoch möglicherweise nicht vollständig in vivo-Komplexitäten 11,12,13. Im Gegensatz dazu verwenden ex vivo Keimungs-Angiogenese-Assays, von denen der Aortenring-Assay das am weitesten verbreitete Modell ist, Gewebe außerhalb des Organismus, wodurch die physiologische Relevanz erhalten bleibt und gleichzeitig In-vivo-Komplikationen vermieden werden 14,15,16. Obwohl sie technisch anspruchsvoll sind und manchmal mit der Lebensfähigkeit des Gewebes zu kämpfen haben, bieten Ex-vivo-Modelle ein wertvolles Gleichgewicht zwischen Komplexität und Kontrolle, was sie zu einem vielversprechenden Ansatz für die Untersuchung der Keimangiogenese macht. Während diese Modelle ausgiebig verwendet wurden, um die molekularen Treiber der sprießenden Angiogenese zu untersuchen, sind die Auswirkungen mechanischer Signale und das mechanische Verhalten von Zellen nach wie vor wenig verstanden.
Die multizelluläre Migration während der Keimangiogenese hängt stark von der zellulären Mechanik ab, da Aktomyosin-basierte kontraktile Kräfte die Invasion von Endothelzellen in die umgebende extrazelluläre Matrix regulieren 17,18,19,20. Insbesondere wurde beobachtet, dass nicht-muskuläre Myosin-II-Motoren, die wichtigsten aktinbasierten kontraktilen Maschinen innerhalb der Zelle21, die zellulären kontraktilen Kräfte während der sprießenden Angiogenese kontrollieren22,23. Die Leitzelle ist wahrscheinlich das vorherrschende krafterzeugende Element des Sprosses, da die Verformungen der umgebenden extrazellulären 3D-Matrix um die Leitzelle herum signifikant höher sind, insbesondere in der Nähe von aktinreichen zellulären Vorsprüngen23,24, verglichen mit ihren Nachfolgern 22,23,25. Trotz dieser zunehmenden Evidenz für die Bedeutung der zellulären Kontraktilität bei der sprießenden Angiogenese in 3D fehlt eine Methode zur raumzeitlichen mechanischen Charakterisierung der zellulären Mechanik der sprießenden Angiogenese.
Das übergeordnete Ziel dieser Studie ist es, eine Methode zu entwickeln, die es ermöglicht, die zelluläre Migration während des Keimens mechanisch zu charakterisieren. Durch die raumzeitliche Charakterisierung mechanischer Kräfte in einem biologisch relevanten Kontext wollen wir neue Erkenntnisse darüber gewinnen, wie die zelluläre Mechanik die angiogene Sprossenbildung beeinflusst. Zu diesem Zweck haben wir ein 2,5D-Modellsystem entwickelt, indem wir ein 2D-Hydrogel aus Polyacrylamid (PAA) erstellten, ein Arterienblatt der Halsschlagader darauf aussäten und es mit einer dünnen Schicht Kollagen-Typ-I-Gel bedeckten, um eine lokalisierte 3D-Umgebung für die Zellen zu schaffen. Mehrzellige Sprossen wanderten aus dem arteriellen Blatt auf die PAA-Kollagen-Gel-Grenzfläche. Der Vorteil dieser Methode im Vergleich zu bestehenden Techniken besteht darin, dass das 2D-PAA-Hydrogel Analysen mittels Traktionskraftmikroskopie (TFM) ermöglicht - eine bekannte, vielseitige Technik, bei der Zellen an einem elastischen 2D-Substrat haften und das Substrat bei zellulären Zugkräften verformen26. Diese Verformungen können erfasst werden, und zelluläre Zugkräfte können auf der Grundlage der mechanischen Eigenschaften des Substratsberechnet werden 26. Durch die Adaption von TFM für den Einsatz in lebenden ex vivo-Geweben wollen wir die Lücke zwischen In-vitro-Kontrolle und In-vivo-Relevanz schließen und ein umfassenderes Verständnis der mechanischen Kräfte während der Angiogenese ermöglichen.
Protokoll
In diesem Protokoll wurden Schweine-Carotis-Arterien verwendet. Die Schweine-Halsschlagadern wurden von niederländischen Landrassen-Hybridschweinen im Alter von 5-7 Monaten und einem Gewicht (lebend) von 80-120 kg aus einem örtlichen Schlachthof entnommen. Die Protokolle entsprachen der EG-Verordnung 1069/2009 über Schlachttiermaterial für Diagnose- und Forschungszwecke, die von der niederländischen Regierung (niederländisches Ministerium für Landwirtschaft, Natur und Lebensmittelqualität) überwacht wurden, und wurden von den zugehörigen Tierschutzbehörden (Behörde für Lebensmittel- und Verbraucherproduktsicherheit) genehmigt. Eine ethische Genehmigung war nicht erforderlich, da Gewebe aus Nebenprodukten bereits getöteter Tiere gewonnen wurde. Die Zeit zwischen Tod und Gewebetransport beträgt je nach Schlachthof 10-25 Minuten.
HINWEIS: Die Materialtabelle fasst Details zu den Materialien, Geräten und Reagenzien zusammen, die in diesem Protokoll verwendet werden. Protokolle für 2D- und 3D-Proben sind in der Zusatzdatei 1 beschrieben.
1. Vorbereitung von 2D-Polyacrylamid (PAA)-Substraten
- Bereiten Sie im Abzug eine Bind-Silan-Lösung vor, indem Sie 12:1:1 absolutes Ethanol (für die Synthese), Essigsäure und Bind-Silan bei 4286 μl, 357 μl bzw. 357 μl mischen. Inkubieren Sie 120 μl/Well-Bind-Silan-Lösung auf einer 12-Well-Platte mit Glasboden für 1 h bei Raumtemperatur.
ACHTUNG: Absolutes Ethanol ist eine leicht entzündliche Flüssigkeit und Dämpfe (H225) und verursacht schwere Augenreizungen (H319). Essigsäure ist eine brennbare Flüssigkeit und ein brennbarer Dampf (H226) und verursachen schwere Hautverbrennungen und Augenschäden (H314). Tragen Sie persönliche Schutzausrüstung und arbeiten Sie in einem Abzug. - Waschen Sie im Abzug die 12-Well-Platte mit Glasboden 3x mit absolutem Ethanol (industriell) mit einer Sprühflasche. Entsorgen Sie das Ethanol.
- Trocknen Sie die untere 12-Well-Platte mit Stickstoffgas. Wenn oben auf dem Glasboden eine weiße Glasur erscheint, war das Waschen nicht ausreichend. Waschen Sie die untere 12-Well-Platte des Glases erneut.
- Bereiten Sie die PAA-Gelmischung gemäß den Verhältnissen in Tabelle 1 vor.
- Geben Sie PBS in ein Mikrozentrifugenröhrchen und resuspendieren Sie 40 % Acrylamid, 2 % Bis-Acrylamid und fluoreszierende Marker in der Gelmischung. Wirbeln Sie die Lösung direkt vor der Gelvorbereitung ein.
- Geben Sie so schnell wie möglich 10 % APS und TEMED zur Lösung und zum Wirbel nach der Zugabe jedes Elements. Pipettieren Sie einen Tropfen mit 11,5 μl Gelmischung auf den Glasboden jeder Vertiefung und legen Sie vorsichtig ein 13 mm Deckglas auf das Tröpfchen.
- Klopfen und schwenken Sie vorsichtig auf die Platte, um die Gelmischung gleichmäßig unter dem Deckglas zu verteilen. Wenn Luftblasen entstehen, entfernen Sie sie, indem Sie das Deckglas vorsichtig anheben. Lassen Sie die Gele 1 h bei Raumtemperatur polymerisieren. Überprüfen Sie die Polymerisation mit der restlichen Gelmischung im Röhrchen. Polymerisierte PAA-Gele in der 12-Well-Platte weisen einen inneren Halo auf.
ACHTUNG: Acrylamid ist schädlich, wenn es verschluckt oder eingeatmet wird (H302 + H332), verursacht Hautreizungen (H315), kann allergische Hautreaktionen hervorrufen (H317), schwere Augenreizungen verursachen (H319), kann genetische Defekte verursachen (H340), kann Krebs verursachen (H350), steht im Verdacht, die Fruchtbarkeit zu beeinträchtigen (H361f) und schädigt Organe durch längere oder wiederholte Exposition beim Verschlucken (H372). APS kann das Feuer verstärken (Oxidationsmittel, H272), schädlich beim Verschlucken (H302), Hautreizungen verursachen (H315), allergische Hautreaktionen hervorrufen (H317), schwere Augenreizungen verursachen (H319), beim Einatmen Allergie- oder Asthmasymptome oder Atembeschwerden verursachen (H334) und Atemwegsreizungen verursachen (H335). TEMED ist eine leicht entzündliche Flüssigkeit und ein leicht entzündlicher Dampf (H225), gesundheitsschädlich beim Verschlucken (H302), verursachen schwere Hautverbrennungen und Augenschäden (H314) und sind giftig, wenn es eingeatmet wird (H331). Tragen Sie persönliche Schutzausrüstung.
- Nach der Polymerisation PBS in die Vertiefung geben. Heben Sie das Deckglas mit einer Pinzette und/oder einer gebogenen Nadel vorsichtig an und entfernen Sie es. Waschen Sie die Gele einmal in PBS.
- Um die Kollagenbeschichtung der PAA-Gele zu erleichtern, müssen die Gele mit dem Vernetzer Sulfo-SANPAH funktionalisiert werden. Geben Sie 75 μl 1 mg/ml Sulfo-SANPAH, gelöst in Reinstwasser, zum PAA-Gel und inkubieren Sie es 5 Minuten lang unter 365 nm UV-Licht.
HINWEIS: Bewahren Sie Sulfo-SANPAH lichtgeschützt auf und fügen Sie Reinstwasser direkt vor der UV-Inkubation hinzu. Eine Verfärbung ist von hellrot (vor der UV-Inkubation) bis dunkelrot (nach UV-Licht-Inkubation) sichtbar.
VORSICHT: Sulfo-SANPAH verursacht schwere Augenreizungen (H319). - Führen Sie in der Biosicherheitswerkbank eine schnelle sterile PBS-Wäsche des Sulfo-SANPAH auf den Gelen durch. Waschen Sie die funktionalisierten PAA-Gele daher 2x in sterilem PBS für 10 min.
HINWEIS: Ab diesem Punkt des Protokolls werden alle Schritte unter sterilen Bedingungen durchgeführt. - Bereiten Sie in der Biosicherheitswerkbank eine 0,1 mg/ml Kollagen-Typ-IV-Lösung in PBS auf Eis vor. Pipettieren Sie 50 μl 0,1 mg/ml Kollagen Typ IV Tröpfchen auf das funktionalisierte PAA-Gel und inkubieren Sie es über Nacht bei 4 °C.
- Waschen Sie die Gele 2x in sterilem PBS. Entfernen Sie das PBS und lassen Sie die Gele 5 Minuten trocknen.
- Pipettieren Sie einen 50-μl-Tropfen Endothelzellwachstumsmedium (EKG) auf die Gele und inkubieren Sie sie mindestens 1 h lang bei 37 °C und 5 % CO2.
HINWEIS: Die Inkubation der Gele im EKG-Medium verbessert die Zell- und Gewebeanhaftungen an den Gelen.
2. Vorbereitung der modifizierten Krebslösung für den Transport
HINWEIS: Bereiten Sie die modifizierte Krebslösung frisch zu. In diesem Protokoll wird die modifizierte Krebslösung 1 Tag vor der Gewebeentnahme hergestellt.
- Sterilisieren Sie eine Transportflasche durch Autoklavieren. Füllen Sie eine Glasflasche mit 90 % (315 mL) des gesamten benötigten Transportvolumens (350 mL) Reinstwasser. Stellen Sie sicher, dass die Wassertemperatur 15-20 °C beträgt.
- Unter vorsichtigem Rühren des Wassers mit einem Rührmagneten 9,6 g/L (3,36 g) Krebs-Henseleit Buffer zugeben und rühren, bis es sich aufgelöst hat. Spülen Sie das Wägeschiffchen mit einer Pasteurpipette mit einer kleinen Menge Lösung, um alle Spuren von Pulver in die Lösung aufzunehmen. Erhitzen Sie die Lösung nicht.
- Unter Rühren 0,373 g/l (130,55 mg) Calciumchlorid (CaCl2) in die Lösung geben und rühren, bis es sich aufgelöst hat. Spülen Sie das Wägeschiffchen mit einer kleinen Menge Lösung aus.
ACHTUNG: H319 verursacht schwere Augenreizungen. - Geben Sie unter Rühren 2,1 g/l (0,63 g) Natriumbicarbonat (NaHCO3) in die Lösung und rühren Sie, bis es sich aufgelöst hat. Spülen Sie das Wägeschiffchen mit einer kleinen Menge Lösung aus.
- Unter Rühren 1 x 10-1 mM (13,15 mg) Papaverin in die Lösung geben und rühren, bis es sich aufgelöst hat. Spülen Sie das Wägeschiffchen mit einer kleinen Menge Lösung aus.
HINWEIS: Papaverin ist ein Relaxans der glatten Muskulatur, das verwendet wird, um eine übermäßige Vasokonstriktion zu verhindern, die durch das Schneiden und den Umgang mit dem Gefäß während der Ernte verursacht wird.
ACHTUNG: H301 ist giftig, wenn es verschluckt wird. - Geben Sie im Abzug 0,05 mM (1,2 μl) 2-Mercaptoethanol in die Lösung und rühren Sie um.
HINWEIS: 2-Mercaptoethanol wird verwendet, um einen niedrigen Gehalt an Sauerstoffradikalen zu halten.
ACHTUNG: 2-Mercaptoethanol ist giftig, wenn es verschluckt oder eingeatmet wird (H301 + H331), tödlich bei Berührung mit der Haut (H310), verursacht Hautreizungen (H315), kann allergische Hautreaktionen hervorrufen (H317), verursacht schwere Augenschäden (H318), steht im Verdacht, das Kind im Mutterleib zu schädigen (H361d), kann bei längerer oder wiederholter Exposition bei Verschlucken Organe schädigen (H373) und ist sehr giftig für Wasserorganismen mit langfristiger Wirkung (H410). Tragen Sie persönliche Schutzausrüstung und arbeiten Sie in einem Abzug. - Stellen Sie während des Rührens den pH-Wert auf 7,2 ein, indem Sie 1 N (1 M) HCl oder 1 N (1 M) NaOH hinzufügen. Das endgültige pH-Ziel liegt bei 7,4, aber der pH-Wert kann während der Filtration um 0,1-0,3 pH-Einheiten ansteigen.
ACHTUNG: HCl enthält Gas unter Druck; Es kann explodieren, wenn es erhitzt wird (H280), schwere Hautverbrennungen und Augenschäden verursachen (H314) und ist giftig, wenn es eingeatmet wird (H331). Tragen Sie persönliche Schutzausrüstung. - Arbeiten Sie weiter in einer Biosicherheitswerkbank. Fügen Sie 10 % Reinstwasser hinzu, um die Lösung auf das endgültige Volumen zu bringen.
- Sterilisieren Sie die Lösung sofort durch Filtration mit einer Membran mit einer Porosität von 0,22 μm. Geben Sie die sterile Lösung direkt in eine sterile Flasche. Geben Sie 7 ml 2% Penicillin/Streptomyocin (P/S) in die Lösung.
HINWEIS: Während des Transports werden dem Medium 2 % P/S zugesetzt, um alle Bakterien zu entfernen. Während der Gewebekultur wird dem Medium 1 % P/S zugesetzt. - Lagern Sie die modifizierte Krebslösung bis zur Gewebeentnahme bei 4 °C.
3. Gewebeentnahme
- Je nach Schlachthof werden die Schweine durch elektrischen Schlag oder CO2 betäubt. Anschließend werden Schweine an einem Hinterglied aufgehängt, ausgeblutet und für tot erklärt.
- Bevor sie in den sauberen Schlachtprozess gelangen, brühen Sie die Schweine zur Haarentfernung, versengen Sie, um die letzten Haare zu entfernen, und sterilisieren Sie die Außenseite des Schlachtkörpers.
- Weiden Sie die Schweine aus, indem Sie einen Mittellinienschnitt entlang des Bauches machen und vorsichtig die inneren Organe entfernen. Je nach Schlachthof wurde die Halsschlagader noch am Schlachtkörper des Schweins befestigt oder die Halsschlagader bereits mit dem Rupfen von Brustorganen aus dem Schlachtkörper entfernt.
- Entnehmen Sie mit einem scharfen Messer die Halsschlagader mit etwas restlichem umgebendem Gewebe aus dem Kadaver oder dem Gewebe im Rachenbereich, ohne die Arterie zu berühren oder mechanisch zu belasten.
- Legen Sie das Gewebe mit der Halsschlagader in die Transportflasche mit der sterilen modifizierten Krebslösung, indem Sie die Flasche kurz öffnen. Drehen Sie die Flasche einmal um, um sicherzustellen, dass das gesamte Gewebe mit Krebslösung bedeckt ist. Transportieren Sie das Gewebe auf Eis ins Labor. Der Transport dauert ca. 30-45 Minuten.
4. Dissektion des Gewebes
- Sterilisieren Sie Dissektionsgeräte, chirurgische Pinzetten (grobe Handhabung), epoxidbeschichtete Pinzetten mit runder Spitze (feine Handhabung), Skalpell, Zange und Deckgläser durch Autoklavieren.
- Bereiten Sie die Biosicherheitswerkbank vor der Gewebeentnahme/dem Gewebetransport vor. Decken Sie den Präparierbereich mit einem chirurgischen Abdecktuch ab. Montieren Sie Präpariergeräte (in sterilen 50-ml-Röhrchen), chirurgische Klingen und sterile Deckgläser. Füllen Sie zwei große Petrischalen mit sterilem PBS, um eine Sezierschale vorzubereiten. Inkubieren Sie die Gewebekultur in einer kleinen Petrischale mit EKG-Medium bei 37 °C.
- Nach dem Gewebetransport wird die Halsschlagader in der Biosicherheitswerkbank mit der chirurgischen Pinzette aus der Transportflasche (gefüllt mit modifizierter Krebslösung) in eine große Petrischale, die mit sterilem PBS gefüllt ist, übertragen.
- Entfernen Sie überschüssiges Gewebe, das die Halsschlagader umgibt, mit der chirurgischen Pinzette und dem Skalpell, um eine klare Sicht auf die Halsschlagader zu erhalten.
- Entfernen Sie 2-3 cm von beiden Enden der Halsschlagader, um Bereiche in der Nähe der Arteriengabelungen durch Schneiden mit einem Skalpell zu entfernen. Entfernen Sie die Arterienfaszie, die die Halsschlagader umgibt, mit der feinen Pinzette mit runder Spitze.
HINWEIS: Das Erneuern der Skalpellklinge hilft, die Faszie präziser zu schneiden. - Übertragen Sie die Halsschlagader in eine neue große Petrischale, die mit sterilem PBS gefüllt ist. Entfernen Sie die verbleibende dünne Schicht der Arterienfaszie so weit wie möglich.
HINWEIS: Je länger die Halsschlagader bei PBS ist, desto mehr Faszienstücke neigen dazu, sich zu lösen. Das Entfernen von Faszien ist wichtig, da sie die Sicht während der Mikroskopie behindern. - Schneiden Sie die saubere Halsschlagader in etwa 2 mm breite Ringe. Übertragen Sie die Halsschlagaderringe in die vorgewärmte kleine Petrischale, die mit EKG-Medium gefüllt ist, und halten Sie sie bei 37 °C.
5. Aussaat von Gewebe
HINWEIS: Die Gewebebefestigung wurde getestet, indem kein Deckglas, ein steriles, unbehandeltes Deckglas oder ein steriles, mit Pluronic behandeltes Deckglas (1 % w/v pluronic in PBS, Deckgläser, die über Nacht inkubiert und vor der Verwendung in sterilem Reinstwasser gewaschen wurden) verschiedener Größen auf das arterielle Blatt gelegt wurde, nachdem es auf das PAA-Hydrogel aufgesät wurde.
- Entfernen Sie EKG-Mitteltröpfchen aus den Gelen. Übertragen Sie einen Karotis-Ring in eine saubere Petrischale, die mit sterilem PBS gefüllt ist.
- Schneiden Sie den Ring mit der Pinzette und dem Skalpell mit runder Spitze in zwei Hälften. Präparieren Sie einen halben Ring in ca. 2 mm breite Blätter, um arterielle Blätter mit den Maßen 2 x 2 mm zu erhalten. Achten Sie auf die Ausrichtung der endothelialen Seite des arteriellen Blattes. Die Krümmung und einige verbleibende Faszien des Arterienblattes können helfen, diese Ausrichtung zu bestimmen.
HINWEIS: Die Größe der Ringe der Halsschlagadern kann variieren. Große Ringe ergeben etwa 6-8 Blatt, während kleine Ringe 3-4 Blatt ergeben. Große Ringe haben eine verbesserte Befestigung aufgrund der geringeren Krümmung des Arterienblatts. - Fassen Sie mit der Pinzette mit runder Spitze das arterielle Blatt an der Rückseite des Blattes (außerhalb der Gefäßwand) und legen Sie das Blatt an den Rand des PAA-Gels, wobei die endotheliale Innenauskleidung dem PAA-Substrat zugewandt ist, um eine Beschädigung des PAA-Substrats beim Platzieren des Blattes zu vermeiden.
- Bewegen Sie das arterielle Blatt mit der Pinzette oder Pinzette sehr vorsichtig in die Mitte des PAA-Hydrogels, ohne das Gel zu berühren. Legen Sie das arterielle Blatt an den Rand des Gels (das Gewebe könnte an der Pinzette oder Zange kleben).
HINWEIS: Kleine Reste der arteriellen Faszie an der Außenseite der Gefäßwand bilden einen einfachen Griff zum Greifen des arteriellen Blattes, während die endotheliale Innenauskleidung der Gefäßwand sehr glatt ist. - Geben Sie 50 μl EKG-Medium auf das arterielle Blatt, das auf dem PAA-Substrat platziert ist. Ty, um den Tropfen des EKG-Mediums auf dem Gel zu halten.
- Legen Sie mit der Pinzette mit runder Spitze ein trockenes Deckglas von 13 mm auf das arterielle Blatt auf dem PAA-Substrat in Medium. Verwende den inneren Rand des Glasbodens, um das Deckglas vorsichtig abzusenken, bis es das mittlere Tröpfchen berührt und sich das Medium darunter ausbreitet.
HINWEIS: Die 13-mm-Deckgläser sind vorteilhaft, da sie der Größe der Innenwand der Glasbodenplatte sehr nahe kommen. Wenn Sie das Deckglas zu schnell absenken, wandert das Taschentuch an den Rand des Deckglases. - Lassen Sie das Gewebe 5 Stunden lang bei 37 °C und 5 % CO2 anhaften, bevor Sie 1 ml EKG-Medium in jede Vertiefung geben. Legen Sie das arterielle Blatt 24 h lang bei 37 °C und 5 % CO2 auf das PAA-Substrat.
6. Erstellung des 2,5D-Modells
- Autoklavieren Sie eine Pinzette mit runder Spitze, um das Deckglas zu entfernen. 1 M NaOH in Reinstwasser zubereiten, durch Filtration durch einen Filter mit einer Porengröße von 0,22 μm sterilisieren und bei 4 °C lagern.
HINWEIS: 1 M NaOH kann in zukünftigen Experimenten wiederverwendet werden. - Heben Sie mit einer sterilen, scharfen Nadel mit gebogener Spitze das 13 mm Deckglas sehr vorsichtig von der Arterienfolie ab und entfernen Sie das Deckglas. Verwenden Sie den Innenring der Glasmulde als Stütze, um das Deckglas anzuheben und zu entfernen. Jede Seitwärtsbewegung erhöht das Risiko einer Ablösung des arteriellen Blattes vom PAA-Substrat.
- Bereiten Sie in einem sterilen Mikrozentrifugenröhrchen die Kollagen-Typ-I-Mischung gemäß Tabelle 2 auf Eis vor. Nach Zugabe von Kollagen Typ I und NaOH zur Lösung resuspendieren Sie sehr gut und drehen Sie das Röhrchen einmal um, um sicherzustellen, dass die Mischung homogen gemischt wird.
HINWEIS: Bei Zugabe von Kollagen Typ I zur Mischung wird die hellrosa Mischung farblos. Durch die Zugabe von NaOH färbt sich die farblose Mischung hellrosa. - Entfernen Sie das Medium mit einem Vakuumsaugsystem aus der Vertiefung. Entfernen Sie das Medium, das das Gewebe umgibt, so weit wie möglich, ohne das Gewebe zu berühren.
HINWEIS: Zu viel Medium, das das Arterienblatt umgibt, verhindert, dass das Kollagen-Typ-I-Gel es umgibt. - Geben Sie einen 10-μl-Tropfen Kollagen-Typ-I-Gelmischung auf jedes Arterienblatt und lassen Sie das Kollagen-Typ-I-Gel 1 h lang bei 37 °C und 5 % CO2 polymerisieren.
- Geben Sie sehr vorsichtig 1 ml vorgewärmtes EKG-Medium in jede Vertiefung und legen Sie die Proben bei 37 °C und 5 % CO2.
7. Bildgebung von lebenden Zellen
HINWEIS: Die Lebendzellbildgebung wurde mit einem Leica DMi8 oder Nikon Ti2 Eclipse Epifluoreszenzmikroskop durchgeführt, das mit Wärme-, CO2- und Feuchtigkeitskontrolle ausgestattet war und mit Leica- oder NIS-Software gesteuert wurde. Adaptive Fokussteuerung (Leica) und Perfect Focus System (Nikon) wurden verwendet, um den Fokus rechtzeitig zu halten.
- Nach 24 Stunden Kultur im 2,5D-System prüfen Sie, ob die Angiogenese keimt. Einige arterielle Schichten beginnen bereits nach 24 h Kultur zelluläre Sprossen zu bilden, während andere Schichten etwas mehr Zeit benötigen, um die Endothelkeimung zu initiieren.
- Wenn die Keimangiogenese eingeleitet wurde, frischen Sie das EKG-Medium auf und platzieren Sie die 12-Well-Platte in der Tischhalterung in der auf 37 °C vorgewärmten Inkubationsbox des Mikroskops.
- Wählen Sie das gewünschte Ziel aus. In dieser Studie wurden verschiedene Objektive verwendet, wobei ein 10-faches Objektiv verwendet wurde, um einen globalen Überblick über die Bildung von Zellsprossen zu erhalten, und ein 20-faches Objektiv zur Durchführung von TFM.
- Definieren Sie die gewünschten Kanäle. Visualisieren Sie für TFM-Zwecke die zellulären Sprossen mit Hilfe des Phasenkontrasts und visualisieren Sie die Fluoreszenzmarker (dunkelrot) im PAA-Substrat mit einem Fluoreszenzkanal bei einer Wellenlänge von 660 nm.
- Wählen Sie (mehrere) Region(en) von Interesse aus und suchen Sie die Fokusebene. Schalten Sie das Fokussystem ein (adaptive Fokussteuerung bei Leica DMi8 oder perfektes Fokussystem bei Nikon Ti2 Eclipse), um eine stabile Fokussierung im Zeitraffer zu gewährleisten.
- Definieren Sie den gewünschten Zeitraffer, indem Sie ein Zeitintervall und eine Zeitrafferlänge auswählen. In dieser Studie wurden unterschiedliche Zeitintervalle (5-20 min) und Zeitrafferlängen (4-24 h) für unterschiedliche Zwecke verwendet.
- Entfernen Sie zu TFM-Zwecken nach der Zeitraffer-Bildgebung herauswachsende Zellen, indem Sie mehrere Tröpfchen mit 5 % SDS in Reinstwasser geben und einige Minuten warten. Für jede ausgewählte Position wird ein z-Stapel (eine z-Höhe von 2 μm wurde mit einer Schrittweite von 0,2 μm definiert) der fluoreszierenden Marker im PAA-Substrat genommen, um einen entspannten Zustand der fluoreszierenden Marker als Referenzbild zu erhalten.
HINWEIS: Die Z-Stapel-Bildgebung wird durchgeführt, da Zellen die Fluoreszenzmarker in z-Richtung ziehen oder drücken können.
8. Zugkraftmikroskopische Analyse
- Richten Sie Zeitrafferbilder relativ zum besten Referenzbild aus und schneiden Sie sie für eine präzise Analyse zu.
- Um die Verschiebungen von Fluoreszenzmarkern im PAA-Hydrogel zu messen, führen Sie eine Particle Image Velocimetry (PIV) zwischen einem beliebigen Zeitrafferbild und dem Referenzbild mit benutzerdefinierten MatLab-Codes durch. Teilen Sie die Bilder innerhalb der PIV-Analyse in Abfragefenster von 32 x 32 Pixeln mit 0,5 Überlappung auf.
- Berechnen Sie die Traktionskräfte aus den Verschiebungen der fluoreszierenden Marker durch Fourier-Transformations-basierte Traktionsmikroskopie eines unendlichen Gels mit einer endlichen Geldicke unter Verwendung der Boussinesq-Gleichung27.
Ergebnisse
Mit Hilfe des beschriebenen Protokolls können wir ex vivo die sprießende Angiogenese aus einer Schweinehalsschlagader auf einem 2D-PAA-Hydrogel induzieren, das mit einer dünnen Schicht Kollagen Typ I Gel bedeckt ist, wodurch ein 2,5D ex vivo Keimungsangiogenesemodell entsteht. Dieses Modell ermöglicht es uns, konventionelle TFM durchzuführen und die zellulären Zugkräfte der sprießenden Angiogenese an der PAA-Gel-Grenzfläche in Raum und Zeit zu messen.
Um das 2,5D-Modell zu erstellen, haben wir zunächst ein 2D-Hydrogel aus Polyacrylamid (PAA) hergestellt, das mit fluoreszierenden Markern eingebettet ist, gefolgt von einer Übernachtbeschichtung mit Kollagen Typ IV (d-1 bis d0). An Tag 0 (d0) wurde ein Halsschlagaderblatt auf das Kollagen-IV-beschichtete Hydrogel gelegt und über Nacht (d0 bis d1) anheften gelassen. Anschließend wurde eine dünne Schicht Kollagen-Typ-I-Gel auf das arterielle Blatt aufgetragen, woraufhin an Tag 1 (d1) mit der Bildgebung begonnen wurde, um das Zellsprossen zu überwachen und fluoreszierende Marker für die mechanische Analyse (d1 bis d2) zu verfolgen. Um die Keimangiogenese im 2,5D-Modell zu verifizieren, führten wir parallel die konventionelle ex vivo Keimangiogenese in einem 3D-Kollagen-Typ-I-Gel durch. Zu diesem Zweck wurde eine dünne Schicht Kollagen-Typ-I-Gel hergestellt, gefolgt von der Aussaat des Halsschlagaderblatts und anschließend mit einer zusätzlichen Kollagenschicht (d0) bedeckt. Die angiogene Keimung wurde im Laufe der Zeit überwacht. Darüber hinaus haben wir uns bemüht, die sprießende Angiogenese in 2D zu induzieren, um die Modellkomplexität weiter zu verringern. Das experimentelle Verfahren entsprach dem des 2,5D-Modells, wobei der Hauptunterschied darin bestand, dass die oberste Kollagen-Typ-I-Gelschicht ausgeschlossen wurde. Eine Übersicht über die drei Modelle, einschließlich ihrer experimentellen Verfahren, ist in Abbildung 1 beschrieben. Die Halsschlagadern wurden von Schweinen aus dem örtlichen Schlachthof entnommen und in steriler, frischer Krebslösung transportiert. In der Biosicherheitswerkbank wurde überschüssiges Gewebe um die Halsschlagader herum entfernt, um sicherzustellen, dass die sprießende Angiogenese während der Live-Zeitraffer-Bildgebung nicht beeinträchtigt wird (Abbildung 2A-E). Nachdem die Arterie von überschüssigem Gewebe gereinigt war, wurde die Arterie in Arterienringe von 2 mm Breite geschnitten und die Ringe wurden in arterielle Blätter mit einer Abmessung von 2 x 2 mm geschnitten (Abbildung 2F).
Um sicherzustellen, dass die Angiogenese auf der PAA-Hydrogel-Grenzfläche innerhalb des 2,5D- und 2D-Modells keimt, haben wir die arteriellen Schichten mit der inneren Endothelzellseite besiedelt, die dem Kollagen-Typ-IV-beschichteten PAA-Hydrogel zugewandt ist, und sie anlagern lassen. Um die Befestigung der arteriellen Folie an dem PAA-Hydrogel zu optimieren, haben wir die Wirkung der Zugabe eines Antifouling-beschichteten 12 mm Glasdeckglases auf der Oberseite der Arterienplatte getestet. Nach 24 h wurde das Deckglas entfernt und die Befestigungseffizienz anhand des Prozentsatzes der arteriellen Folien gemessen, die an das PAA-Hydrogel gebunden waren. Wir beobachteten, dass die Zugabe eines Glasdeckglases - unabhängig von der Antifouling-Beschichtung - die Befestigungseffizienz der arteriellen Schichten auf dem PAA-Hydrogel im Vergleich zu keinem Deckglas erhöhte (Abbildung 3A-D). Als nächstes testeten wir die Auswirkung des Durchmessers (12 oder 13 mm) des Glasdeckglases auf die Befestigungseffizienz der Arterienplatte, während die innere Vertiefung der Platte 14 mm betrug. Wir haben beobachtet, dass ein 13 mm Deckglas die Befestigungseffizienz der arteriellen Schichten auf dem PAA-Hydrogel im Vergleich zu einem 12 mm Deckglas erhöht (Abbildung 3E-G), da die Scherkräfte beim Entfernen des Deckglases minimiert werden. Wir haben sowohl im 2,5D- als auch im 2D-Modell weiterhin ein unbehandeltes 13-mm-Deckglas für die Befestigung des arteriellen Blattes mit dem PAA-Hydrogel verwendet.
Nachdem das arterielle Blatt mit dem PAA-Hydrogel verbunden worden war, fügten wir eine dünne Schicht Kollagen-Typ-I-Gel auf das arterielle Blatt hinzu, um eine 2,5D-Umgebung zu schaffen. Wir kultivierten die Proben 5 Tage lang und untersuchten die Proben auf Keimangiogenese. Wir beobachteten die Bildung von zellulären Sprossen im 3D-Modell (Abbildung 4A), was mit der zuvor in der Literatur berichteten ex vivo sprießenden Angiogenese übereinstimmt 28,29,30. Innerhalb des 2,5D-Modells beobachteten wir eine ähnliche Organisation der zellulären Sprossen im Vergleich zum 3D-Modell (Abbildung 4B). Zelluläre Sprossen wurden in mehreren Höhen gebildet (Video 1), auch an der PAA-Grenzfläche. Darüber hinaus ist die Keimangiogenese durch eine hohe Proliferation von Leader- und Followerzellen gekennzeichnet, ein Phänomen, das wir während des Keimens im 2,5D-Modell beobachtet haben (Video 2). Bei der Kultivierung eines arteriellen Blattes in 2D wandern Zellen unterschiedlicher Herkunft (Ergänzende Abbildung 1) als Monoschichten aus dem Gewebe heraus, wodurch die Organisation der zellulären Sprossen fehlt (Abbildung 4C). Da wir im 2D-Modell keine sprießende Angiogenese beobachteten, schlossen wir dieses Modell aus nachfolgenden Analysen aus. Insgesamt benötigt die arterielle Schicht eine lokale 3D-Umgebung, um die sprießende Angiogenese zu induzieren, was das Potenzial des 2,5D-Ex-vivo-Modells der sprießenden Angiogenese zeigt.
Darüber hinaus ist das 2,5D-Modellsystem ein vielseitiges System, das es dem Benutzer ermöglicht, die Wirkung mechanischer Signale aus der zellulären Mikroumgebung, z. B. die Matrixsteifigkeit, zu untersuchen. Die Matrixsteifigkeit eines 3D-Kollagen-Typ-I-Hydrogels - des Hydrogels, das üblicherweise für die Ex-vivo-Keimangiogenese verwendet wird - hängt von der Konzentration des EZM-Proteins ab, wobei ein Anstieg der Proteinkonzentration mit einem Anstieg der Matrixsteifigkeit korreliert32. Der typische Bereich der Kollagen-Typ-I-Konzentration, um dieses 3D-Hydrogel zur Induktion einer Keimangiogenese zu veranlassen, beträgt 1-4 mg/ml, was einer Matrixsteifigkeit von 1 Pa bis 1 kPaentspricht 32,33,34. Niedrigere Konzentrationen können zu weich sein, um strukturelle Unterstützung zu bieten, während höhere Konzentrationen die Zellbewegung hemmen können. Die physiologische Steifigkeit des Endothelgewebes beträgt 1 kPa35, die mit einem 3D-Kollagen-Typ-I-Hydrogel nachgeahmt werden kann. Die Tumorbildung und -progression sind jedoch mit einer Gewebeversteifung verbunden4, was die Notwendigkeit eines Modells unterstreicht, das eine höhere Matrixsteifigkeit zur Untersuchung der Tumorangiogenese erreichen kann. Die Substratsteifigkeit von PAA-Hydrogelen - die Steifigkeit, die von den Endothelzellen der arteriellen Schicht wahrgenommen wird - kann leicht im Bereich von 1 bis zu zehn kPa eingestellt werden. In dieser Arbeit untersuchten wir den Einfluss der Steifigkeit des PAA-Substrats auf den Beginn der Keimangiogenese anhand des Prozentsatzes der Proben, die die Bildung von zellulären Sprossen am Tag nach der Zugabe der Kollagen-Typ-I-Schicht initiierten. Wir beobachteten, dass mehr arterielle Schichten frühe Anzeichen von zellulären Sprossen zeigten, wenn sie auf einem physiologisch weichen (1 kPa) PAA-Hydrogel kultiviert wurden, verglichen mit einem pathologisch steifen (12 kPa) PAA-Hydrogel (Abbildung 5), was das Potenzial dieses Modells zeigt, den Einfluss der Matrixsteifigkeit auf die sprießende Angiogenese zu untersuchen. Zusätzlich zur einstellbaren Substratsteifigkeit ermöglichen diese Substrate die systematische Modulation anderer mechanischer Signale (z. B. Matrixzusammensetzung und -dichte) sowie chemischer Signale (z. B. Hemmung molekularer Regulatoren durch Konditionierung des Kulturmediums), was die Vielseitigkeit dieses 2,5D-ex vivo-Angiogenesemodells zeigt.
Um die zelluläre Mechanik bei der Keimangiogenese zu quantifizieren, führten wir konventionelle Traktionskraftmikroskopie (TFM) an zellulären Sprossen durch, die sich an der 2D-PAA-Grenzfläche gebildet haben. Einen Tag nach der Zugabe der Kollagen-Typ-I-Schicht führten wir eine Live-Zell-Bildgebung der Zellen (Abbildung 6A) und der in das PAA-Hydrogel eingebetteten Fluoreszenzmarker durch. Die Verschiebungen der Fluoreszenzmarker wurden mit Hilfe der Particle Image Velocimetry (Abbildung 6B) gemessen, und die zellulären Traktionen wurden mit den mechanischen Eigenschaften des PAA-Hydrogels berechnet (Abbildung 6C). Mit diesem 2.5D ex vivo Modell beobachteten wir zunächst Zugkräfte an den Ausstülpungen der Leitzelle eines zellulären Sprosses, gefolgt von Schubkräften entlang des zellulären Sprosses - sowohl an der Rückseite der Leitzelle als auch in den Folgezellen (Abbildung 6C).
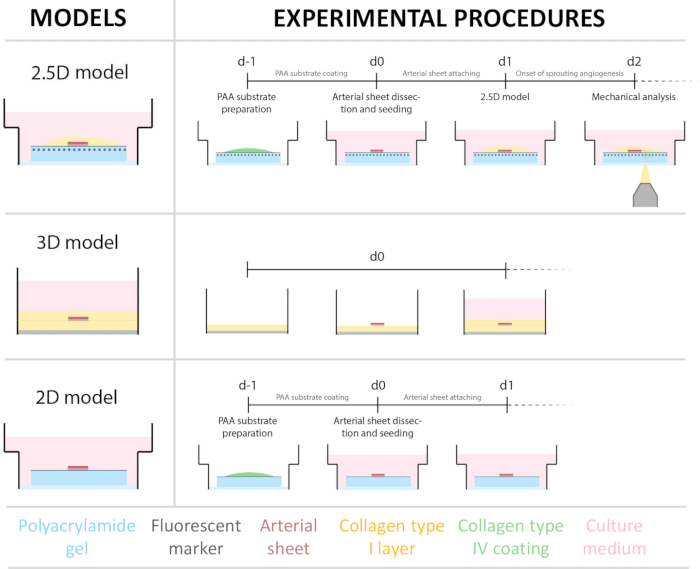
Abbildung 1: Experimentelle Modelle und Verfahren. (links) Getestete experimentelle Modelle. Das 2,5D-Modell stellt eine arterielle Schicht dar, die auf ein flaches, mit Kollagen Typ IV beschichtetes Polyacrylamid (PAA)-Hydrogel gelegt und mit einer dünnen Schicht Kollagen-Typ-I-Hydrogel bedeckt ist. Das 3D-Modell stellt eine arterielle Schicht dar, die zwischen zwei Schichten Kollagen-Typ-I-Gel eingebettet ist, ein System, von dem bekannt ist, dass es die sprießende Angiogenese induziert36. Das 2D-Modell stellt ein arterielles Blatt dar, das auf ein flaches, mit Kollagen Typ IV beschichtetes PAA-Hydrogel gelegt wird. (rechts) Experimentelle Vorgehensweisen für entsprechende Modelle. Sowohl für das 2D- als auch für das 2,5D-Modell wurde am Tag vor der Aussaat (d-1) ein PAA-Hydrogel hergestellt und eine Kollagen-Typ-IV-Beschichtung über Nacht durchgeführt. Die Halsschlagader wurde von Schweinen entnommen, in arterielle Schichten präpariert, an Tag 0 (d0) auf das Hydrogel gesät und über Nacht (d1) befestigt. Für 2,5D-Proben wurde eine dünne Schicht Kollagen-Typ-I-Gel auf die arterielle Schicht aufgebracht. Die mechanische Analyse wurde nach Beginn der Keimung an Tag 2 (d2) durchgeführt. Bei 2D-Proben wurde das Medium an Tag 1 (d1) aufgefrischt. Für das 3D-Modell wurde kurz vor der Aussaat an Tag 0 (d0) eine Schicht Kollagen-Typ-I-Gel hergestellt. Das arterielle Blatt wurde auf die Kollagenschicht Typ I gesät und mit einer zweiten Schicht Kollagen Typ I bedeckt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
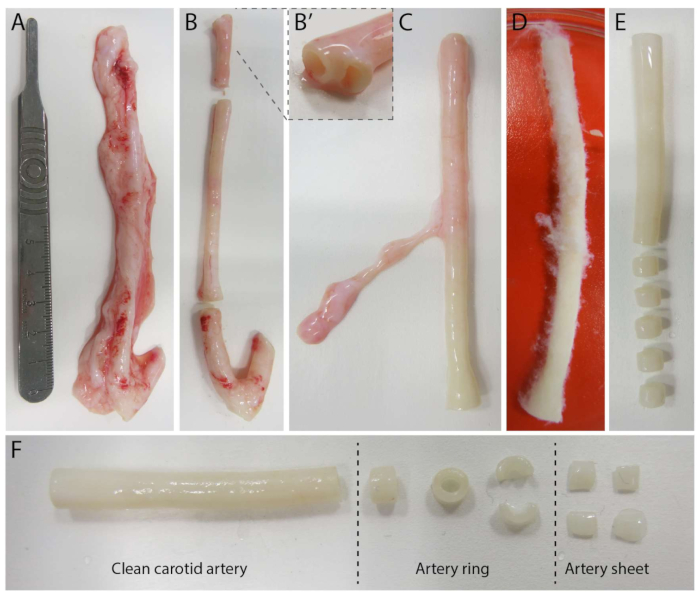
Abbildung 2: Schritte der Dissektion der Halsschlagader (d0). (A) Halsschlagadern mit einer Länge von etwa 10 cm wurden von Schweinen aus dem örtlichen Schlachthof entnommen. (B) Überschüssiges Gewebe und etwa 2 cm des Randes (um eine zu große Nähe zu den Verzweigungspunkten zu vermeiden, (B') wurden verworfen. (C-E) Die Halsschlagader wurde enthäutet (C), mit PBS getränkt (D) und das gesamte verbleibende Gewebe enthäutet, um eine klare Sicht während der Bildgebung zu gewährleisten (E). (F) Die saubere Halsschlagader wird in Arterienringe mit einer Breite von ca. 2 mm geschnitten. Jeder Ring wird in 4 arterielle Blätter mit einer Abmessung von ca. 2 x 2 mm geschnitten. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
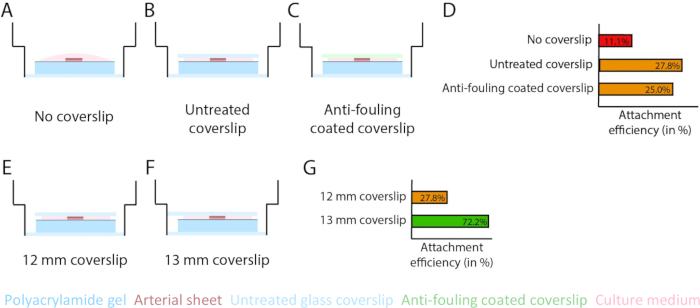
Abbildung 3: Die Effizienz der Befestigung von arteriellen Folien wird mit einem 13 mm Glasdeckglas (d1) erhöht. (A-D) Einfluss eines Glasdeckglases auf die Befestigung der arteriellen Folie an das Polyacrylamid (PAA)-Hydrogel. Es wurde ein Vergleich zwischen einem Deckglas ohne Glas (A), einem Deckglas aus unbehandeltem Glas (B) und einem Antifouling-beschichteten Glasdeckglas mit Pluronic F127 (C) durchgeführt. Die Wirksamkeit der Befestigung wurde anhand der Anzahl der arteriellen Blätter gemessen, die sich nach der Entfernung des Deckglases an das PAA-Hydrogel anhefteten, verglichen mit der Gesamtzahl der Proben: kein Deckglas (4 von 36), unbehandeltes Deckglas (10 von 36) und Antifouling-beschichtetes Deckglas (9 von 36; D). (E-G) Auswirkung der Größe eines Deckglases aus unbehandeltem Glas auf die Befestigung der arteriellen Folie an das PAA-Hydrogel. Es wurde ein Vergleich zwischen einem unbehandelten 12 mm Glasdeckglas (E) und einem unbehandelten 13 mm Glasdeckglas (F) innerhalb einer 14 mm Vertiefung durchgeführt. Die Befestigungseffizienz wurde anhand der Anzahl der arteriellen Blätter gemessen, die nach der Entfernung des Deckglases an das PAA-Hydrogel gebunden waren, verglichen mit der Gesamtzahl der Proben: 12 mm Deckglas (10 von 36) und 13 mm Deckglas (52 von 72; G). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
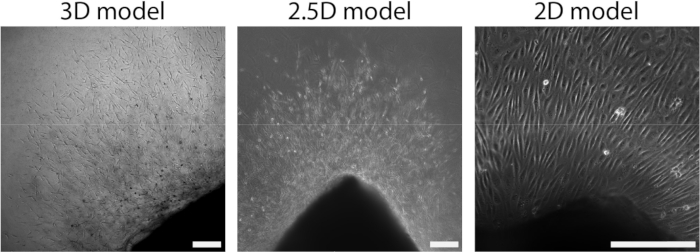
Abbildung 4: Die Dimensionalität des Modells definiert die Organisation während des zellulären Auswachsens (d2+). Im 3D-Modell (links) wandern Zellen in einer Sprossenorganisation aus dem Gewebe heraus, ähnlich wie im 2,5D-Modell (Mitte). Im 2D-Aufbau (rechts) wandern Zellen in einer Monolayer-Organisation aus dem Gewebe heraus. Der Maßstabsbalken stellt 250 μm dar. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 5: Der Beginn der Endothelkeimung im 2,5D-Modell hängt von der Steifigkeit des Polyacrylamid-Hydrogel-Substrats ab (d2). (A-B) Arterielle Folie, die an Tag 2 des Protokolls (1 Tag nach Zugabe von Kollagen-Typ-I-Gel) mit einer dünnen Schicht Kollagen-Typ-I-Gel auf einem weichen (A; 1 kPa) oder steifen (B; 12 kPa) Polyacrylamid (PAA)-Hydrogel bedeckt ist. (C) Der Keimbeginn wurde anhand der Anzahl der arteriellen Blätter gemessen, die bereits Anzeichen eines zellulären Auswuchses zeigten, verglichen mit der Gesamtzahl der Proben: weich (7 von 24) und steif (3 von 24). Die Maßstabsleiste steht für 1 mm (A, B) oder 500 μm (A', B'). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 6: Charakterisierung der Zugkraft während der frühen Keimangiogenese. Die Abbildung der Zellen in der Zeit (0-4 h) wird in der oberen Zeile angezeigt. Die entsprechenden Fluoreszenzmarker-Verschiebungen (0-2 μm) und zellulären Traktionen (0-50 Pa) auf einem 1 kPa PAA-Hydrogelsubstrat sind in der mittleren bzw. unteren Reihe dargestellt. Vergrößern von zellulären Traktionen bei 0 h, 2 h und 4 h werden orange dargestellt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
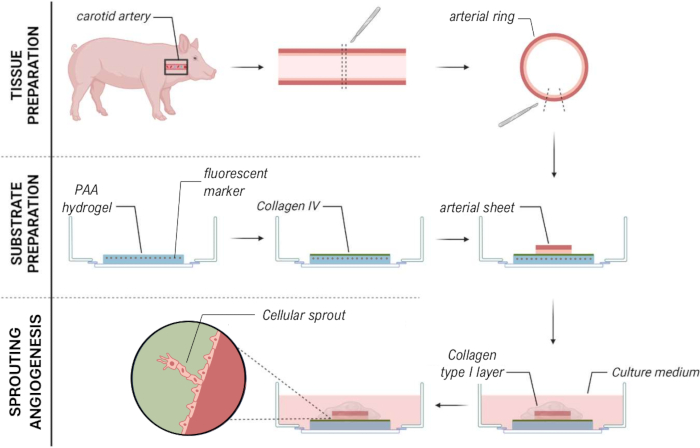
Abbildung 7: 2.5D ex vivo Keim-Angiogenese-Modellmethode, die eine mechanische Charakterisierung von zellulären Sprossen ermöglicht. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| 1 kPa | 12 kPa | |
| PBS | 435 μL | 373,7 μL |
| 40% Acrylamid | 50 μL | 93,8 μl |
| 2% Bis-Acrylamid | 7,5 μl | ca. 25 μl |
| Fluoreszierender Marker (dunkelrot) | 5 μL | 5 μL |
| 10% APS | 2,5 μL | 2,5 μL |
| TEMED | 0,25 μl | 0,25 μl |
Tabelle 1: PAA-Gel-Mischungsverhältnisse.
| Formel | Volumen pro 12-Well-Platte (130 μl) | |
| EKG-Medium | VEVG=Vendgültig-V col1-V NaOH | 82,16 μl |
| Kollagen Typ I | Vcol1=(Vfinal*Cfinal)/C schaft | 46 μL |
| NaOH | VNaOH=0,04*Vcol1 | 1,84 μL |
Tabelle 2: Kollagen Typ I Gel mischt Volumina unter Verwendung von Abkürzungen für Volumen (V) und Konzentration (C).
Video 1: Zeitraffer-Bildgebung der zellulären Sprossenbildung innerhalb des 2,5D-Modells. Die Zellen wurden mittels Phasenkontrast-Bildgebung über einen Zeitraum von 22 Stunden mit einem Zeitintervall von 17,5 Minuten abgebildet. Zelluläre Sprossen wurden auf mehreren Höhen innerhalb der Kollagen-Typ-I-Gelschicht gebildet, wie sie in den verschiedenen Fokusebenen beobachtet wurden. Der Maßstabsbalken stellt 100 μm dar. Bitte klicken Sie hier, um dieses Video herunterzuladen.
Video 2: Hohe Proliferationsrate von Zellen in zellulären Sprossen im 2,5D-Modell. Die Zellen wurden mittels Phasenkontrast-Bildgebung über einen Zeitraum von 22 Stunden mit einem Zeitintervall von 17,5 Minuten abgebildet. Sowohl Leader- als auch Follower-Zellen vermehren sich während der Zeitraffer-Bildgebung. Der Maßstabsbalken stellt 100 μm dar. Bitte klicken Sie hier, um dieses Video herunterzuladen.
Ergänzende Abbildung 1: Zellulärer Phänotyp im 2D-Modell (d2+) durch Immunfluoreszenzfärbung. (A) Immunfluoreszenz (IF)-Färbung des Zellkerns (DAPI), des Endothelzellmarkers (CD31) und des Fibroblastenmarkers (Alpha-glattes Muskelaktin; α-SMA). (B) IF-Färbung des Zellkerns (DAPI), des Endothelzellmarkers (CD31) und des Markers der glatten Muskelzellen (Calponin). Der Maßstabsbalken stellt 100 μm dar. Bitte klicken Sie hier, um diese Abbildung herunterzuladen.
Ergänzende Datei 1: Immunfluoreszenz-Färbeprotokoll. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
Die Keimangiogenese - die Bildung neuer Blutgefäße - ist ein komplexer Prozess, der sowohl durch molekulare als auch durch mechanische Mechanismen reguliert wird. Während in den letzten Jahrzehnten viele 3D-Modelle entwickelt wurden, um die molekularen Treiber (z.B. VEGF- und Notch-Signalwege) der sprießenden Angiogenese zu untersuchen, ist aufgrund von Modelleinschränkungen nur wenig über die zelluläre Mechanik bekannt. Die Traktionskraftmikroskopie (TFM) ist eine bekannte Technik zur Quantifizierung zellulärer Kräfte in Raum und Zeit, bei der 2D-Substratverformungen in zelluläre Traktionen umgewandelt werden. Daher beschreiben wir in diesem Protokoll ein 2,5D-Ex-vivo-Modell, was bedeutet, dass wir den Zellen lokal eine 3D-Umgebung zur Verfügung stellen, während wir die Einfachheit eines 2D-Modells beibehalten, das die Quantifizierung der Zugkräfte während der Keimangiogenese ermöglicht (Abbildung 1). Zu diesem Zweck haben wir ein arterielles Blatt aus Schweinefleisch vorbereitet und ausgesät (Endothelseite nach unten; Abbildung 2) auf einem Kollagen-Typ-IV-beschichteten Polyacrylamid (PAA)-Hydrogel mit fluoreszierenden Markern. Nach der Befestigung des arteriellen Blattes mit einem 13 mm Glasdeckglas (Abbildung 3) fügen wir eine dünne Schicht Kollagen-Typ-I-Hydrogel hinzu, das die Bildung von Zellsprossen ermöglicht (Abbildung 4). Anhand dieses Modells zeigen wir, dass während des zellulären Keimens 22,23,24,25 Leitzellen Zugkräfte ausüben (wie in der Literatur19,20,21,22 beobachtet wurde), aber auch, dass Folgezellen Druckkräfte ausüben (Abbildung 6). Die Auflösung des Traktionsfeldes, die durch unser Protokoll erhalten wird, ermöglicht quantitative Analysen der zellulären Kinematik und Dynamik sowohl in Zeit als auch in Raum, die typisch für Arbeiten sind, die auf Zugkraftmikroskopie auf nachgiebigen Substraten zurückgreifen 37,38,39.
Darüber hinaus demonstrieren wir die Vielseitigkeit dieses 2,5D-Ex-vivo-Modells der sprießenden Angiogenese, indem wir die mechanischen Signale der Mikroumgebung verändern (Abbildung 5). Während die Keimangiogenese normalerweise bei einer physiologischen Steifigkeit von 1 kPa35 stattfindet - die von einem 3D-Kollagen-Typ-I-Hydrogel nachgeahmt werden kann, findet die Tumorangiogenese in einer versteiften Mikroumgebung40 statt - die außerhalb des Steifigkeitsbereichs herkömmlicher 3D-Kollagen-Typ-I-Hydrogele liegt. Die Steifigkeit des PAA-Substrats kann leicht angepasst werden, indem das Verhältnis der Vernetzer geändert wird, um eine höhere Substratsteifigkeit zu erzeugen. Anhand dieses Modells zeigen wir, dass der Beginn der sprießenden Angiogenese steifigkeitsabhängig ist. Diese Substrate bieten nicht nur eine einstellbare Steifigkeit, sondern ermöglichen auch die systematische Modulation verschiedener anderer mechanischer Hinweise, z. B. der Matrixzusammensetzung und -dichte. Darüber hinaus ermöglicht uns dieses Modell, die zelluläre Mechanik zu untersuchen und gleichzeitig molekulare Regulatoren durch Konditionierung des Mediums zu manipulieren (z. B. die Wirkung der Hemmung auf die Notch-Signalgebung auf die zelluläre Mechanik), um die mechanobiologischen Mechanismen der sprießenden Angiogenese zu verstehen. Dies zeigt die Nützlichkeit dieses 2,5D-Ex-vivo-Modells für die sprießende Angiogenese in einer Reihe verschiedener Mikroumgebungen.
Das von uns vorgestellte Modell nutzt die konventionelle 2D-TFM, die im Vergleich zu 3D-TFM (viskoelastisch) eine einfachere Analyse, eine höhere räumliche Auflösung und eine einfachere Implementierung bietet, wodurch es zugänglicher und kostengünstiger wird26,41. Die 3D-TFM (viskoelastisch) bietet jedoch eine physiologisch relevantere Umgebung, indem sie Zugkräfte in allen drei Dimensionen erfasst und die komplexen mechanischen Eigenschaften der extrazellulären Matrix berücksichtigt, was tiefere Einblicke in das Zellverhalten in einem realistischeren Kontext bietet 42,43,44,45. Dieser Effekt der Dimensionalität deutet auch auf eine Begrenzung dieses 2,5D-Modells hin. Wir verwenden 2D-TFM unter der Annahme, dass Zellen auf einem 2D-Substrat wandern. Während dies in diesem 2,5D-Modell der Fall ist, befinden sich die Zellen in einer lokalen 3D-Umgebung und haften somit an der Kollagen-Typ-I-Gelschicht und üben in dieser Gelschicht Kräfte aus. Die Annahme, die wir in dieser Analyse angenommen haben, ist, dass die Kollagen-Typ-I-Gelschicht aufgrund des Größenordnungsunterschieds in der Matrixsteifigkeit nicht mechanisch an die PAA-Grenzfläche gekoppelt ist (keine Kraftübertragung zwischen diesen beiden Hydrogelen), wodurch die Wirkung zellulärer Kräfte auf die Kollagen-Typ-I-Schicht minimiert wird. Damit ist die Kraftcharakterisierung mit Hilfe des 2,5D-Ex-vivo-Modells eine vereinfachte Darstellung der von den Zellen erzeugten Kräfte. Darüber hinaus erfordert dieses Protokoll Präzision und ist umfangreich mit mehreren Schritten, in denen Proben verloren gehen können, z. B. (i) Schwierigkeiten bei der Zellsichtbarkeit aufgrund von übermäßigem Gewebe, das das arterielle Blatt umgibt (Abbildung 2), (ii) eine von drei Proben haftet nicht an das PAA-Substrat (Abbildung 3), (iii) nicht alle Proben initiieren die Bildung von Zellsprossen (Abbildung 5)), (iv) zelluläre Sprossen bilden sich nicht am PAA-Substrat und (v) unscharfe fluoreszierende Marker bei Verwendung einer dicken arteriellen Schicht auf einem PAA-Hydrogel mit geringer Steifigkeit. Daher haben wir diese Methode für eine 12-Well-Platte optimiert, um sicherzustellen, dass genügend interessante Regionen für die mechanische Analyse der Keimangiogenese vorhanden sind.
Zusammenfassend lässt sich sagen, dass der vorgestellte Ansatz zur vereinfachten Charakterisierung der zellulären Zugkräfte der Keimangiogenese eines lebenden Schweinearterienblattes unter Verwendung eines 2,5D-Modells (Abbildung 7) dazu beitragen kann, genauere und Echtzeit-Einblicke in die mechanischen Wechselwirkungen während der Angiogenese in einem nativen Gewebekontext zu erhalten und so die Untersuchung dynamischer zellulärer Prozesse mit reduzierter Komplexität und verbesserter Reproduzierbarkeit im Vergleich zu vollständigen 3D-Systemen zu erleichtern. Dies könnte unser Verständnis darüber verbessern, wie Zellen auf mechanische Signale in einer physiologisch relevanteren Umgebung reagieren, während die analytische Einfachheit von 2D-Methoden erhalten bleibt. Dieses Wissen könnte das Gebiet des Tissue Engineering voranbringen, mit dem Ziel, Blutgefäße zu schaffen, aber auch therapeutische Medikamente zur Prävention der Tumorangiogenese zu finden, mit dem Ziel, das Tumorwachstum zu begrenzen und die Metastasierung zu reduzieren.
Offenlegungen
Die Autoren haben keine Interessenkonflikte offenzulegen.
Danksagungen
Wir danken den Mitarbeitern von LifeTec für die Ernte und den Transport der Schweinehalsschlagadern aus dem örtlichen Schlachthof; Leon Hermans, Pim van den Bersselaar und Adrià Villacrosa Ribas (TU/e, ICMS) für die fruchtbaren Diskussionen über experimentelle Verfahren und mechanische Charakterisierungsanalysen. Wir danken für die Unterstützung durch Zuschüsse des Europäischen Forschungsrats (771168), der niederländischen Organisation für wissenschaftliche Forschung (024.003.013), der Finnischen Akademie (307133, 316882, 330411 und 337531) und der Exzellenzzentren für zelluläre Mechanotastase (CellMech) der Åbo Akademi University Foundation.
Materialien
| Name | Company | Catalog Number | Comments |
| 2% bis-acrylamide | Bio-Rad | 1610143 | |
| 2-mercaptoethanol | Merck Life Science | 60-24-2 | |
| 3-(Trimethoxysilyl)propyl methacrylate | Bind-Silane | Sigma-Aldrich | 440159-100ML |
| 40% acrylamide | Bio-Rad | 1610140 | |
| Aboslute ethanol (for analysis) | VWR International | 1.00983.1000 | |
| Absolute ethanol (industrial) | VWR International | 83813.41 | |
| Acetic acid, glacial 100% | Merck | 1000562500 | |
| Ammonium persulfate | APS | Bio-Rad | 7727-54-0 |
| antibody (primary) - calponin | abcam | ab46794 | |
| antibody (primary) - CD31 | Serotec | MCA1746 | |
| antibody (primary) - α-smooth muscle actin | αSMA | Dako | M0851 |
| antibody (secondary) - goat-anti-mouse-IgG1 Alexa 488 | Molecular Probes | A21121 | |
| antibody (secondary) - goat-anti-mouse-IgG2a Alexa 555 | Molecular Probes | A21137 | |
| antibody (secondary) - goat-anti-rabbit-IgG Alexa 555 | Molecular Probes | A21428 | |
| Autoclave | Astell | ||
| Calcium chloride dihydrate | CaCl2 | Calbiochem | 208291-250GM |
| Collagen type I, rat-tail | Corning | 354236 | |
| Collagen type IV, human placenta | Merck Life Science | C5533-5MG | |
| Endothelial Cell Growth Medium | ECG medium | Promocell | C-22111 |
| Expoxy-coated round tip tweezer | fine tweezer | Rubis Pinzette | E78144-2A |
| Fluorescent marker, dark red | Invitrogen | F8807 | |
| Glass coverslips, Ø13 mm, #1 | Epredia | CB00130RA120MNZ0 | |
| Glass coverslips, Ø13 mm, #1.5 | Epredia | CB00120RAC20MNZ0 | |
| Hydrochloride acid, 25% | HCl | Merck | 1.100316.1000 |
| Krebs-Henseleit buffer | Sigma-Aldrich | K3753 | |
| Microscope, Leica Application Suite X software, version 3.5.7.23225 | Leica Microsystems | ||
| Microscope, Leica DMi8 epifluorescent microscope | Leica Microsystems | ||
| Microscope, Nikon Ti2 Eclipse | Nikon | ||
| Microscope, NIS-Elements AR software | Nikon | ||
| N,N,N',N'-tetramethylethane-1,2-diamine | TEMED | Merck Life Science | 110-18-9 |
| Nalgene bottle | Thermo Scientific | 2187-0016 | |
| Needle, 21Gx1" | Henke Sass Wolf | HK4710008025 | |
| Normal serum, goat | Gibco | 10098792 | |
| Papaverine hydrochloride | Sigma | 61-25-6 | |
| Penicillin/Streptomyocin (10 000 U/mL) | P/S | Gibco | 15140163 |
| Petri-dish, large (145x20mm) | Greiner Bio-one | 639160 | |
| Petri-dish, small (60x15mm) | Greiner Bio-one | 628160 | |
| Phosphate Buffered Saline | PBS | Sigma | P4417 |
| Pluronic F-127 | Merck Life Science | P2443-250G | |
| Puncture needle, sharp closed tip | unknown | ||
| Scalpel, no. 4 | Swann-Morton | ||
| Sodium hydrogen carbonate | NaHCO3 | VWR International | 144-55-8 |
| sulfosuccinimidyl 6-(4'-azido-2'-nitrophenylamino)hexanoate | Sulfo-SANPAH | Thermo Scientific | 22589 |
| Surgical blade, no. 20 | Swann-Morton | ||
| Surgical drape sheet | Foliodrape | 2775001 | |
| Surgical tweezer | Lettix | 400024 | |
| Triton X-100 | Merck | 9036-19-5 | |
| UV lamp | Analytik Jena | 95-0042-13 | |
| well plate, 96-well, F-bottom | Greiner Bio-one | 655180 | |
| well plate, glass bottom 12-well | MatTek | P12G-0-14-F |
Referenzen
- Carmeliet, P. Angiogenesis in health and disease. Nat Med. 9 (6), 653-660 (2003).
- Folkman, J. Angiogenesis in cancer, vascular, rheumatoid and other disease. Nat Med. 1, 27-30 (1995).
- Kretschmer, M., Rüdiger, D., Zahler, S. Mechanical aspects of angiogenesis. Cancers. 13 (19), 4987 (2021).
- Bordeleau, F., et al. Matrix stiffening promotes a tumor vasculature phenotype. Proc Natl Acad Sci U S A. 114 (3), 492-497 (2017).
- Blanco, R., Gerhardt, H. VEGF and Notch in tip and stalk cell selection. Cold Spring Harb Perspect Med. 3 (1), a006569 (2013).
- Adams, R. H., Alitalo, K. Molecular regulation of angiogenesis and lymphangiogenesis. Nat Rev Mol Cell Biol. 8, 464-478 (2007).
- Carmeliet, P., De Smet, F., Loges, S., Mazzone, M. Branching morphogenesis and antiangiogenesis candidates: tip cells lead the way. Nat Rev Clin Oncol. 6, 315-326 (2009).
- Salam, N., et al. Assessment of migration of human mscs through fibrin hydrogels as a tool for formulation optimisation. Materials. 11 (9), 1781 (2018).
- Solbu, A. A., et al. Assessing cell migration in hydrogels: An overview of relevant materials and methods. Materials Today Bio. 18, 100537 (2023).
- Cao, W., Li, X., Zuo, X., Gao, C. Migration of endothelial cells into photo-responsive hydrogels with tunable modulus under the presence of pro-inflammatory macrophages. Regenerat Biomater. 6 (5), 259-267 (2019).
- Staton, C. A., Reed, M. W. R., Brown, N. J. A critical analysis of current in vitro and in vivo angiogenesis assays. Int J Exp Pathol. 90 (3), 195-221 (2009).
- Staton, C. A., et al. Current methods for assaying angiogenesis in vitro and in vivo. Int J Exp Path. 85, 233-248 (2004).
- Ngo, T. X., et al. In Vitro models for angiogenesis research: A review. Int J Tissue Regenerat. 5, 37-45 (2014).
- Tomita, Y., et al. An ex vivo choroid sprouting assay of ocular microvascular angiogenesis. J Vis Exp. (162), e61677 (2020).
- Kapoor, A., Chen, C. G., Iozzo, R. V. A simplified aortic ring assay: A useful ex vivo method to assess biochemical and functional parameters of angiogenesis. Matrix Biol Plus. 6-7, 100025 (2020).
- Stiffey-Wilusz, J., Boice, J. A., Ronan, J., Fletcher, A. M., Anderson, M. S. An ex vivo angiogenesis assay utilizing commercial porcine carotid artery: Modification of the rat aortic ring assay. Angiogenesis. 4 (1), 3-9 (2001).
- Kniazeva, E., Putnam, A. J. Endothelial cell traction and ECM density influence both capillary morphogenesis and maintenance in 3-D. Am J Physiol Cell Physiol. 297 (1), C179-C187 (2009).
- Davidson, C. D., Wang, W. Y., Zaimi, I., Jayco, D. K. P., Baker, B. M. Cell force-mediated matrix reorganization underlies multicellular network assembly. Sc Rep. 9 (1), 12 (2019).
- Lyle, K. S., Corleto, J. A., Wittmann, T. Microtubule dynamics regulation contributes to endothelial morphogenesis. BioArchitecture. 2 (6), 220-227 (2012).
- Kniazeva, E., et al. Quantification of local matrix deformations and mechanical properties during capillary morphogenesis in 3D. Integrat Biol. 4 (4), 431-439 (2012).
- Quintanilla, M. A., Hammer, J. A., Beach, J. R. Non-muscle myosin 2 at a glance. J Cell Sci. 136 (5), jcs.260890 (2023).
- Fischer, R. S., Gardel, M., Ma, X., Adelstein, R. S., Waterman, C. M. Local cortical tension by myosin II guides 3D endothelial cell branching. Curr Biol. 19 (3), 260-265 (2009).
- Yoon, C., et al. Myosin IIA–mediated forces regulate multicellular integrity during vascular sprouting. Mol Biol Cell. 30 (16), 1974-1984 (2019).
- Du, Y., et al. Three-dimensional characterization of mechanical interactions between endothelial cells and extracellular matrix during angiogenic sprouting. Sci Rep. 6, 21362 (2016).
- Vaeyens, M. M., et al. Matrix deformations around angiogenic sprouts correlate to sprout dynamics and suggest pulling activity. Angiogenesis. 23 (3), 315-324 (2020).
- Style, R. W., et al. Traction force microscopy in physics and biology. Soft Matter. 10 (23), 4047-4055 (2014).
- Trepat, X., et al. Physical forces during collective cell migration. Nat Phys. 5 (6), 426-430 (2009).
- Santos-Oliveira, P., et al. The force at the tip - modelling tension and proliferation in sprouting angiogenesis. PLoS Comput Biol. 11 (8), e1004436 (2015).
- Boreddy, S. R., Sahu, R. P., Srivastava, S. K. Benzyl isothiocyanate suppresses pancreatic tumor angiogenesis and invasion by inhibiting HIF-α/VEGF/Rho-GTPases: Pivotal role of STAT-3. PLoS One. 6 (10), 0025799 (2011).
- Teng, R. J., Eis, A., Bakhutashvili, I., Arul, N., Konduri, G. G. Increased superoxide production contributes to the impaired angiogenesis of fetal pulmonary arteries with in utero pulmonary hypertension. Am J Physiol Lung Cell Mol Physiol. 297 (1), L184-L195 (2009).
- Costa, G., et al. Asymmetric division coordinates collective cell migration in angiogenesis. Nature Cell Biol. 18 (12), 1292-1301 (2016).
- Slater, K., Partridge, J., Nandivada, H. . Corning tuning the elastic moduli of Corning Matrigel and collagen I 3D matrices by varying the protein concentration. , (2019).
- Lee, J., et al. Effect of chain flexibility on cell adhesion: Semi-flexible model-based analysis of cell adhesion to hydrogels. Sci Rep. 9 (1), 2463 (2019).
- Motte, S., Kaufman, L. J. Strain stiffening in collagen i networks. Biopolymers. 99 (1), 35-46 (2013).
- Butcher, D. T., Alliston, T., Weaver, V. M. A tense situation: Forcing tumour progression. Nat Rev Cancer. 9 (2), 108-122 (2009).
- Artym, V. V., Matsumoto, K. Imaging cells in three-dimensional collagen matrix. Curr Prot Cell Biol. 10, Unit 10.18.1-Unit 10.18.20 (2010).
- Labernadie, A., et al. A mechanically active heterotypic E-cadherin/N-cadherin adhesion enables fibroblasts to drive cancer cell invasion. Nat Cell Biol. 19 (3), 224-237 (2017).
- Bazellières, E., et al. Control of cell-cell forces and collective cell dynamics by the intercellular adhesome. Nat Cell Biol. 17 (4), 409-420 (2015).
- Uroz, M., et al. Traction forces at the cytokinetic ring regulate cell division and polyploidy in the migrating zebrafish epicardium. Nat Mater. 18 (9), 1015-1023 (2019).
- Dong, C., Nastaran, Z., Konstantopoulos, K. . Biomechanics in oncology. , (2018).
- Schwarz, U. S., Soiné, J. R. D. Traction force microscopy on soft elastic substrates: A guide to recent computational advances. Biochim Biophys Acta. 1853 (11), 3095-3104 (2015).
- Toyjanova, J., et al. 3D Viscoelastic traction force microscopy. Soft Matter. 10 (40), 8095-8106 (2014).
- Legant, W. R., et al. Multidimensional traction force microscopy reveals out-of-plane rotational moments about focal adhesions. Proc Natl Acad Sci U S A. 110 (3), 881-886 (2013).
- Steinwachs, J., et al. Three-dimensional force microscopy of cells in biopolymer networks. Nat Meth. 13 (2), 171-176 (2016).
- Franck, C., Maskarinec, S. A., Tirrell, D. A., Ravichandran, G. Three-dimensional traction force microscopy: A new tool for quantifying cell-matrix interactions. PLoS One. 6 (3), e17833 (2011).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten