Method Article
مقايسة السمية الخلوية القائمة على القطرات لتقييم الخلايا التائية لمستقبلات المستضد الخيمري على مستوى الخلية المفردة
In This Article
Summary
هنا ، نصف طريقة لإنشاء قطرات مستحلب مزدوجة تغلف خلية تائية واحدة وخلية مستهدفة سرطانية لفحص قتل الخلايا على مستوى الخلية الواحدة. تسمح هذه الطريقة بالقياس الكمي المزدوج لكل من الجزيئات السامة للخلايا وموت الخلايا المبرمج للخلايا المستهدفة داخل عدد كبير من الخلايا التائية.
Abstract
يعد تقييم الإمكانات السامة للخلايا للعلاجات القائمة على الخلايا التائية ، مثل علاجات الخلايا التائية لمستقبلات المستضد الخيمري (CAR) ، مفيدا في تقييم فعاليتها وهو شرط أساسي للتطبيق السريري. ومع ذلك ، يتم إجراء فحوصات السمية الخلوية التقليدية كمقايسات مجمعة ولا تقدم معلومات مفصلة حول عدم التجانس الوظيفي لمجموعة الخلايا التائية CAR. في هذه الدراسة ، نصف طريقة قائمة على قطرات المستحلب المزدوج تسمح بالتغليف المشترك على نطاق واسع لخلايا CAR T المستجيب الفردي مع الخلايا المستهدفة المفردة مع تمكين القياس الكمي المزدوج لكل من جزيئات المستجيب السامة للخلايا من الخلايا التائية وموت الخلايا للخلية المستهدفة. يحدد البروتوكول طريقة لتوليد وتنقية خلايا CAR T الخاصة ب CD19 ، متبوعة بغلافها المشترك في قطرات مع خط الخلية CD19 + JeKo-1 ، جنبا إلى جنب مع الكواشف لتصور إفراز جزيء المستجيب السام للخلايا (Granzyme B) وموت الخلايا (باستخدام يوديد البروبيديوم ، PI). نوضح كيفية توليد قطرات تحتوي على CAR T مفردة وخلايا مستهدفة باستخدام جهاز الموائع الدقيقة المتاح تجاريا لتوليد قطرات مستحلب مزدوجة. بالإضافة إلى ذلك ، نقدم أمثلة على كيفية فحص التنوع الوظيفي لخلايا CAR T في القطرات باستخدام معدات قياس التدفق الخلوي القياسية. أخيرا ، نصف بإيجاز الحركية الزمنية وعدم التجانس لقتل الخلايا التائية CAR الخاصة ب CD19. بينما تركز هذه الطريقة على موت الخلايا بعد هجوم الخلايا التائية CAR ، فهي أيضا قابلة للتكيف لفحص الأنواع الأخرى من الخلايا التائية والخلايا المناعية السامة للخلايا ووظائف الخلايا المستجيبة ، مثل إفراز السيتوكين.
Introduction
العلاج بالخلايا التائية لمستقبلات المستضد الخيمري (CAR) هو مجال سريع التوسع للعلاج المناعي للسرطان الخلوي أثبت فعاليته ضد أشكال مختلفة من سرطان الدم وسرطان الغدد الليمفاوية1 والورم النقويالمتعدد 2. يتم إنشاء الخلايا التائية CAR عن طريق تعديل الخلايا التائية بمستقبل مستضد اصطناعي يمكنه الارتباط بشكل انتقائي بالبروتينات السطحية مثل CD19 أو مستضد نضج الخلايا البائية (BCMA) ، معبرا عنها في الخلايا البائية وخلايا البلازما ونظيراتها الخبيثة. مكنت التطورات الحديثة في تصميم CAR من استهداف مستضدات متعددة في وقت واحد3 ، بالاعتماد على إشارات إدخال متعددة ، أو الارتباط حصريا بالمستضدات المرتبطة بالورم ، مثل الأشكال الإسوية البروتينيةالمحددة 4. بالإضافة إلى ذلك ، يتم الآن اختبار العديد من CAR ضد أهداف السرطانات غير الدموية5.
تعد مقايسات السمية الخلوية ضرورية لتطوير CAR ومراقبة الجودة قبل إصدار المنتجات السريرية6،7،8. ومع ذلك ، تعتمد معظم المقايسات الحالية على مجموعات كبيرة من الخلايا التائية المستجيبة CAR المضافة بكميات زائدة إلى خطوط الخلايا السرطانية ، مما قد يؤدي إلى نتائج إيجابية كاذبة بسبب تأثيرات المتفرج9 وتؤدي إلى ارتباط ضعيف بين النتائج في المختبر وفي الجسم الحي 10. نظرا لأن تكاثر الخلايا التائية واستمرارها على المدى الطويل يعتمدان على الإشارات الواردة أثناء أحداث التنشيط الأولية11،12 ، فإن الفحص الدقيق للأحداث السامة للخلايا على مستوى الخلية المفردة أمر ذو أهمية كبيرة.
لمعالجة قيود المنهجيات السائبة ، يمكن إجراء دراسات السمية الخلوية على مستوى الخلية المفردة باستخدام قياس التدفق الخلوي13،14،15،16،17 والمقايسات القائمة على التصوير18. ومع ذلك ، على الرغم من أن قياس التدفق الخلوي القياسي يوفر دقة خلية واحدة لقياس وتوصيف كل من الخلايا المستجيبة والمستهدفة ، إلا أنه لا يمكنه تحديد القدرة السامة للخلايا المحددة لخلايا CAR T الفردية تجاه الخلايا المستهدفة. بالإضافة إلى ذلك ، فإن تصوير الخلايا التائية CAR الفردية التي تتفاعل مع أهدافها بكميات كبيرة يمثل تحديا ويستغرق وقتا طويلا بسبب الحركة المتسقة للخلايا. لمواجهة هذه التحديات ، تم تطوير أدوات جديدة لتحليل الخلية المفردة التي تعتمد على إقران المستجيب والخلايا المستهدفة في الأماكن الضيقة مكانيا باستخدام مصفوفات microwell19،20،21 ، ومصفوفات الطوافةالدقيقة 22 ، والرقائقالدقيقة 23 ، والموائع الدقيقةDroplet 24،25،26. توفر هذه الأدوات حساسية قياس محسنة ، مما يتيح التحقيق في عدد أقل من الخلايا باستخدام أحجام كاشف منخفضة. ومع ذلك ، لا تزال هناك العديد من التحديات ، بما في ذلك الاقتران الفعال للخلايا ، والعدد المحدود من العينات التي يمكن تحليلها ، والاعتماد على التحليل القائم على التصوير فقط ، والصعوبات في استرداد مجموعات الخلايا القابلة للحياة لمزيد من التحليلات.
هنا ، نستخدم جهاز الموائع الدقيقة المتاح تجاريا والذي يسمح بنهج مبسط بشكل كبير للموائع الدقيقة القائمة على القطيرات. يتيح هذا الجهاز إجراء تحليل ومقايسات متقدمة أحادية الخلية باستخدام قطرات مستحلب مزدوج (DE) عالية الاستقرار. بالمقارنة مع فحوصات microwell والتقليدية ، فإن البروتوكول الموضح هنا لا يتطلب خبرة واسعة في microfludics.
قطرات DE عبارة عن مقصورات كروية صغيرة تتكون من غلاف زيت مع قلب مائي معلق في محلول مائي. تحتوي القطرة المائية على الخلايا وإفرازات الخلية ووسط الخلية وكواشف الفحص وتحتفظ بها ، مما يسمح بإجراء فحوصات معقدة داخل كل حجرة. باستخدام جهاز الموائع الدقيقة ، يتم إنشاء قطرات DE بحجم محدد (حوالي 100 pL) مناسب لمقايسات تفاعل الخلية المفردة أو الخلية الخلوية للثدييات ، والتي يمكن توليدها بأعداد كبيرة جدا (حوالي 750،000 قطرة لكل عينة) وفي إطار زمني قصير (حوالي 10 دقائق ل 8 عينات) من قبل مستخدمي المختبر العام الذين ليس لديهم معرفة متخصصة في الموائع الدقيقة. يمكن تعليق القطرات المتولدة في وسط الخلية ، مما يسمح بانتشار O2 و CO2 عبر القشرة والتخزين المؤقت للداخل مع الاحتفاظ في نفس الوقت بالجزيئات المحبة للماء والأكبر حجما مثل جزيئات المستجيب التي تفرز الخلايا. وبالتالي يتم تخزين الخلايا التي تم فحصها بشكل كاف ، مما يسمح بفحص تفاعلات الخلية الخلوية والديناميكيات الزمنية بمرور الوقت. على عكس قطرات المستحلب المفردة (على سبيل المثال ، قطرات الماء في الزيت)27 ، فإن قطرات DE هي هياكل قوية لا تندمج أو تندمج في حاضنات الخلايا القياسية. نظرا لاستقرارها وطورها الخارجي المائي ، فهي متوافقة أيضا مع إجراءات التحليل النهائية مثل قياس التدفق الخلوي التقليدي. لذلك ، يمكن استخدام قطرات البيكوليتر الناتجة عن جهاز الموائع الدقيقة لتحليل الخلية المفردة عالية الإنتاجية لوظيفة الخلية لتوضيح عدم التجانس الوظيفي المخفي في المقايسات السائبة التقليدية.
هنا ، نحدد بروتوكولا يستخدم قطرات DE لفحص إمكانات CARs السامة للخلايا الخاصة ب CD19 تجاه خلايا سرطان الغدد الليمفاوية. يسمح بروتوكولنا بتحليل خلية واحدة للقتل المستهدف وإفراز Granzyme B (GzmB) ويكشف أن ما يقرب من 20٪ من الخلايا التائية CAR التي تم فحصها هنا لديها إمكانية قتل فوري.
Protocol
تم إنشاء الخلايا التائية CAR المستخدمة في هذه الدراسة عن طريق نقل الفيروسات العدسية للخلايا التائية الأولية باستخدام CD19scFv-CD28-CD3ζ-tNGFR CAR في مختبر معتمد للسلامة الحيوية من الفئة 2 من الكائنات المعدلة وراثيا وتم رفع السرية عنها بعد 4 أيام وفقا لمعيار المعهد. كانت الخلايا التائية المنقاة من المواد الفائضة المهملة من التبرعات بالدم مجهولة المصدر وتم إعفاؤها من المزيد من الموافقات الأخلاقية وفقا للقانون الدنماركي.
1. توليد الخلايا التائية CAR
ملاحظة: يستخدم اسم الكواشف المستخدمة أدناه أسماء عامة ومختصرة. يمكن العثور على الاسم التجاري الكامل بين قوسين في جدول المواد.
- تنشيط الخلايا التائية ونقلها وتمددها
ملاحظة: تم تحقيق التعبير المستقر للخلايا التائية CD19 CAR من خلال نقل الفيروسات القشرية للخلايا التائية البشرية الأولية المعزولة من خلايا الدم المحيطية أحادية النواة الطازجة (PBMCs) باستخدام مجموعة عزل الخلايا التائية ذات الاختيار السلبي. إن مضاد CD19 CAR المستخدم هو هيكل من الجيل الثاني يتكون من جزء متغير أحادي السلسلة FMC63 (scFv) ، ومفصلة CD28 ومجال غشاء ، ومجال تكلفة CD28 ، ومجال تنشيط CD3ζ28 ونسخة مبتورة من مستقبل عامل نمو الأعصاب (tNGFR) لمراقبة وإثراء الخلايا الشفرة عن CAR29. تم تصنيع بلازميد ناقل النقل من جديد ، وتم صنع فيروس العدسات من الجيل الثالث من خلال الجمع بين هذا مع pMDLg / pRRE (بلازميد Addgene # 12251) ، pRSV-Rev (بلازميد Addgene # 12253) ، و pMD2.G (بلازميد Addgene # 12259) 30. كانت البلازميدات الثلاثة اللاحقة هدية من ديدييه ترونو. تم تركيز الفيروس الخام باستخدام كاشف قائم على PEG ، وتم تحديد تعدد العدوى (MOI) عن طريق تحويل خلايا SUP-T1 وقياس tNGFR عن طريق قياس التدفق الخلوي وفقا للبروتوكول القياسي31.- انقل 2 × 106 خلايا تائية بشرية أولية إلى طبق مزرعة مكون من 12 بئرا وتحفيزها بخرز مغلف ب CD3 / CD28 بنسبة 1: 1 حبة إلى خلية في 1 مل من وسط RPMI-1640 الكامل (10٪ مصل بقري جنيني معطل بالحرارة ، 1٪ بنسلين / ستربتومايسين) مكمل ب 100 وحدة / مل إنترلوكين بشري مؤتلف -2 (IL-2). احتضان الخلايا عند 37 درجة مئوية في حاضنة مرطب بنسبة 5٪ ثاني أكسيد الكربون2 لمدة 24 ساعة.
- أضف جزيئات الفيروس إلى الخلايا التائية المنشطة في وزارة الداخلية من 5-10. تخلط بلطف وتحتضن الخلايا لمدة 72 ساعة. قم بتضمين الخلايا التائية غير المحولة (NTD) كعنصر تحكم سلبي.
- في اليوم 3 بعد التنبيغ ، قم بإزالة حبات تنشيط CD3 / CD28 عن طريق حصاد الخلايا التائية في أنبوب سعة 1.5 مل ووضع الأنبوب على حامل مغناطيسي لمدة 1-2 دقيقة. انقل المادة الطافية التي تحتوي على الخلايا إلى أنبوب جديد سعة 1.5 مل.
- قم بإجراء عد الخلايا باستخدام عداد الخلايا الآلي واضبط كثافة الخلية على 1 × 106 خلايا / مل في وسط RPMI-1640 كامل مكمل ب 100 U / مل IL-2. استمر في توسيع الخلايا التائية حتى يصل إجمالي عدد الخلايا التائية CAR إلى 1.5 × 106 على الأقل (عادة حوالي 6 × 106 خلايا T في المجموع) في التعليق قبل الشروع في تخصيب NGFR (انظر أدناه).
- راقب عدد الخلايا كل يومين واضبط التركيز على 1 × 106 خلايا / مل عن طريق إضافة وسط طازج مكمل ب 100 وحدة / مل IL-2 لضمان حالة الخلية المثلى أثناء التمدد.
- إثراء الخلايا التائية التي تعبر عن CAR
- انقل 6 × 106 أو أكثر من الخلايا التائية المحولة إلى أنبوب سعة 15 مل وجهاز طرد مركزي بمعدل 300 × جم لمدة 5 دقائق. أعد تعليق حبيبات الخلية في 320 ميكرولتر من PBS مكملا بنسبة 0.5٪ من ألبومين مصل الأبقار (BSA) لصنع PBSA وإضافة 40 ميكرولتر من الخرز المغناطيسي المضاد ل NGFR. تخلط جيدا وتحتضن على الثلج لمدة 15 دقيقة.
ملاحظة: يفترض هذا البروتوكول كفاءة نقل تبلغ حوالي 25٪ ، مما ينتج عنه >1.5 × 106 خلايا CAR T بعد التخصيب. لا نوصي بالبدء بأقل من 6 × 106 خلايا ، لأن هذا قد يؤدي إلى ضعف استعادة الخلايا التائية ذات مستقبلات المستضدات الوهمية. - أضف 1640 ميكرولتر من PBSA ليصل الحجم النهائي إلى 2 مل ، ثم تابع الفصل المغناطيسي باستخدام أعمدة الفصل وفقا لتعليمات الشركة المصنعة.
- انقل 6 × 106 أو أكثر من الخلايا التائية المحولة إلى أنبوب سعة 15 مل وجهاز طرد مركزي بمعدل 300 × جم لمدة 5 دقائق. أعد تعليق حبيبات الخلية في 320 ميكرولتر من PBS مكملا بنسبة 0.5٪ من ألبومين مصل الأبقار (BSA) لصنع PBSA وإضافة 40 ميكرولتر من الخرز المغناطيسي المضاد ل NGFR. تخلط جيدا وتحتضن على الثلج لمدة 15 دقيقة.
- الكشف عن تعبير CAR عن طريق قياس التدفق الخلوي
ملاحظة: نوصي بتحديد النسبة المئوية للخلايا التي تعبر عن CAR وقابليتها للحياة في هذه المرحلة ، لضمان الخلايا المناسبة قبل إجراء الفحص أدناه. يمكن أيضا تحديد نسبة CD4 و CD8 والنمط الظاهري للذاكرة في هذه المرحلة. انظر الشكل 1 للاطلاع على المؤامرات التمثيلية.- نقل خلايا 2.5 × 105 T من كل من الثقافات المحولة وغير المحولة إلى أنابيب قياس التدفق الخلوي المنفصلة. اغسل الخلايا 2x ب 200 ميكرولتر من PBS ، مع الطرد المركزي عند 300 × جم لمدة 5 دقائق بعد كل غسلة.
- قم بإعداد مزيج من الأجسام المضادة تحتوي على الأجسام المضادة ل CD19 CAR FMC63 Idiotype PE والأجسام المضادة ل CD3 BV480 والمضادة ل NGFR FITC ، كل منها مخفف 1: 100 في PBS. أعد تعليق الخلايا في 50 ميكرولتر من مزيج الأجسام المضادة واحتضانها عند 4 درجات مئوية لمدة 20 دقيقة.
- اغسل الخلايا 2x ب 200 ميكرولتر من PBS ، مع الطرد المركزي عند 300 × جم لمدة 5 دقائق بعد كل غسلة. أعد تعليق الخلايا في 200 ميكرولتر من PBS وتحليلها باستخدام قياس التدفق الخلوي.
2. توليد قطرات تغلف الخلايا التائية والخلايا المستهدفة
ملاحظة: قبل التغليف ، يتم تلطيخ الخلايا التائية وخلايا JeKo-1 ببقع خلايا مختلفة لمراقبة المحتوى الخلوي للقطرات. يتم تغليف الخلايا بكواشف الفحص وتحضينها لمدة 2-6 ساعات قبل تحليل القطرات على مقياس التدفق الخلوي (انظر الشكل 2).
- تلطيخ الخلايا قبل التغليف
- قم بإعداد محاليل عمل لأصباغ فلورية (استخدمنا صبغة بنفسجية وصبغة حمراء بعيدة) عن طريق تخفيف محاليل المخزون (المحضرة وفقا لتعليمات الشركة المصنعة) 1: 5,000 في dPBS.
- لكل متبرع ، قم بنقل 2.5 × 106 CAR T و 2.5 × 106 NTD T و 15 × 106 خلايا JeKo-1 إلى أنابيب طرد مركزي منفصلة (أنابيب 15 مل أو 50 مل) وأجهزة الطرد المركزي عند 300 × جم لمدة 5 دقائق. في هذه التجربة ، تم تغليف 0.5 × 106 خلايا مستجيبة ب 1.5 × 106 خلايا مستهدفة لكل عينة محضرة.
ملاحظة: عدد الخلايا المنقولة هنا مخصص لعينات تغليف 4x مع كل نوع من أنواع الخلايا المستجيبة لكل متبرع. قم بتقليل عدد الخلايا والكواشف وفقا لعدد العينات المطلوبة. بالإضافة إلى ذلك ، يمكن قياس العدد الدقيق للخلايا لكل عينة وفقا للاحتياجات التجريبية. - قم بإزالة كريات الخلايا المستجيبة الطافية وإعادة تعليقها في محلول العمل 1: 5,000 لصبغة الفلورسنت البنفسجية وكريات الخلية المستهدفة (JeKo-1) في محلول العمل 1: 5,000 لصبغة الفلورسنت الحمراء البعيدة. أعد تعليق الخلايا جيدا باستخدام ماصة وبتركيز خلية 1 × 106 خلايا / مل محلول تلطيخ.
- احتضان الخلايا لمدة 20 دقيقة في حاضنة ثاني أكسيد الكربون2 المرطبة بدرجة حرارة 37 درجة مئوية. قم بالطرد المركزي للخلايا عند 300 × جم لمدة 5 دقائق ، وقم بإزالة المادة الطافية ، وأعد تعليقها في 15 مل من وسط RPMI-1640 الكامل لغسل الخلايا.
- كرر الغسيل وجهاز الطرد المركزي على حرارة 300 × جم لمدة 5 دقائق. قم بإزالة المادة الطافية وإعادة تعليق كريات الخلية المستجيبة في 225 ميكرولتر من RPMI-1640 الكامل وحبيبات الخلية المستهدفة في 450 ميكرولتر من RPMI-1640 الكامل.
- أضف 30 ميكرولتر من وسط التدرج إلى معلقات الخلية المستجيبة و 60 ميكرولتر من نفس وسط التدرج إلى معلقات الخلية المستهدفة. أعد تعليق محلول المخزون المتوسط المتدرج جيدا قبل سحب العينات.
- أضف 15 ميكرولتر من مخزون PI 20 ميكروغرام / مل إلى معلقات الخلية المستجيب و 30 ميكرولتر من مخزون PI إلى معلقات الخلية المستهدفة. سيكون تركيز PI النهائي في النهاية 1 ميكروغرام / مل بعد إضافة ركيزة Granzyme B (GzmB) أدناه.
- قم بإعداد تخفيف 1:10 من ركيزة GzmB في RPMI-1640 الكامل وأضف 30 ميكرولتر من تخفيف الركيزة GzmB إلى تعليق الخلية المستجيب و 60 ميكرولتر منه إلى معلقات الخلية المستهدفة. تخلط جيدا مع الماصة.
ملاحظة: يجب أن يكون الحجم الإجمالي للكواشف المضافة إلى كل كريات خلية مستجيب الآن 300 ميكرولتر وإلى كريات الخلية المستهدفة 600 ميكرولتر. يجب أن يكون تركيز وسط التدرج في هذه المحاليل 10٪ ، وتركيز PI 1 ميكروغرام / مل ، وتركيز الركيزة GzmB 1: 100. - وضع العلامات البديلة باستخدام الأجسام المضادة CD3 و CD4 و CD8
ملاحظة: في بعض الحالات ، قد يكون من المفيد تسمية الخلايا المستجيبة بشكل أكبر قبل التغليف المشترك مع الخلايا المستهدفة. نعرض هنا إثبات المبدأ لهذا النوع من الملصقات باستخدام الأجسام المضادة CD3 و CD4 و CD8 و PBMC (انظر الشكل 3).- انقل 2.0 × 106 PBMC إلى أنبوب 1.5 مل وقم بتدوير الخلايا لأسفل لمدة 5 دقائق عند 300 × جم. قم بإزالة المادة الطافية وإعادة تعليق حبيبات الخلية في 200 ميكرولتر من dPBS مع 0.5٪ BSA. قسم المحتوى إلى أنبوبين سعة 2 مل.
- أضف 5 ميكرولتر من مضاد CD3-APC و 5 ميكرولتر من مضاد CD4-StarBright Violet 760 إلى أحد الأنابيب. أضف 20 ميكرولتر من مضاد CD3-FITC و 5 ميكرولتر من مضاد CD8-StarBright Violet 760 إلى الأنبوب الآخر.
- تخلط جيدا وتحتضن لمدة 30 دقيقة في درجة حرارة الغرفة في الظلام. أضف 1 مل من المخزن المؤقت للغسيل إلى الخلايا ، وقم بالدوران عند 300 × جم لمدة 5 دقائق ، وقم بإزالة المادة الطافية ، وأعد تعليق كريات الخلية في 1 مل من dPBS مع 0.5٪ BSA.
- قم بتدوير الخلايا عند 300 × جم لمدة 5 دقائق ، وقم بإزالة المادة الطافية ، وأعد تعليق كريات الخلية في 150 ميكرولتر من RPMI بدون الفينول الأحمر و 10٪ وسط متدرج. قم بتغليف كما هو موضح في الخطوة 2.2 باستخدام RPMI بدون أحمر الفينول ، ومحلول تثبيت 33٪ للخلايا ، و 10٪ وسط متدرج كوسط خارجي.
- تغليف الخلايا
- قم بتسخين خرطوشة التغليف ومحلول التثبيت إلى درجة حرارة الغرفة قبل التغليف. قم بإعداد مخزون من الوسط الخارجي يتكون من وسط RPMI-1640 كامل ، ومحلول تثبيت 33٪ للخلايا ، و 10٪ وسط متدرج.
- لكل عينة تغليف ، قم بإعداد محلول عينة خلية بخلايا مستجيب مستهدفة مختلطة. أعد تعليق المحاليل الخلوية المحضرة جيدا باستخدام ماصة واخلط 65 ميكرولتر من معلق الخلية المستجيب المحضر مع 65 ميكرولتر من معلق الخلية المستهدفة المحضر في أنابيب سعة 1.5 مل (كلاهما محضر في الخطوة 2.1).
- تابع على الفور تحميل الآبار المشار إليها لخرطوشة التغليف مع الكواشف بالترتيب التالي لضمان التغليف المناسب. قم بتحميل مجموعة واحدة من الآبار لكل عينة تغليف محضرة.
حسنا #A: 400 ميكرولتر من الوسائط الخارجية.
حسنا #D: 40 ميكرولتر من الوسائط الخارجية على الرف الصغير.
#C الحسنا: 120 ميكرولتر من المحلول المخلوط مسبقا مع الخلايا المستهدفة (JeKo-1) والخلايا المستجيبة. أعد تعليق الخلايا جيدا باستخدام ماصة قبل التحميل مباشرة.
#B الجيد: 250 ميكرولتر من الزيت.
ملاحظة: يمكن تحميل كل خرطوشة بما يصل إلى 8 عينات للتغليف بالتوازي. - تابع على الفور في إحكام غلق الحشية وتحميل الخرطوشة في الجهاز مع تجنب إمالة الخرطوشة المحملة أو اهتزازها أو ارتدامها. أغلق الحشية بعناية على الخرطوشة.
- انقل الخرطوشة بعناية إلى جهاز الموائع الدقيقة وابدأ التغليف كما هو موضح في دليل المستخدم.
- تتميز القطرات المتولدة بكثافة أعلى من الوسط الخارجي المحيط وستترسب بسرعة في قاع بئر التجميع (بئر #D). اجمع كل قطرة إنتاج (جميع القطرات والوسط الخارجي المحيط بها) عن طريق تعليق القطرات المترسبة من #D البئر في وسط التراكب ونقلها إلى أنبوب DNA منخفض الارتباط سعة 2 مل بغطاء. اغسل جيدا #D بالوسائط الخارجية المتبقية من Well #A لجمع القطرات المتبقية.
- عندما تترسب القطرات في أنابيب التجميع (يستغرق الأمر حوالي 1 دقيقة) ، تحقق من إنتاج القطرات عن طريق فحصها في مجهر المجال الساطع. للقيام بذلك، املأ طرف ماصة سعة 10 ميكرولتر بعينة: حوالي 1/3 بقطرات من سطح طور القطيرات (المرحلة البيضاء) وحوالي 2/3 بالوسط الخارجي المتراكب لملء الطرف. قم بتحميل العينة على الفور على شريحة زجاجية مكونة من 8 غرف وافحص القطرات عن طريق الفحص المجهري للمجال الساطع بتكبير 4x و 20x لتأكيد تحميل القطرات بالخلايا.
ملاحظة: من المهم أن يتم شفط القطرات بهذه الطريقة في حجم أكبر من الوسط المحيط.
- حضانة المرض
ملاحظة: يمكن الآن تحضين القطرات في 2 مل من أنابيب الحمض النووي منخفضة الارتباط في حاضنة قياسية مرطبة 37 درجة مئوية ، 5٪ CO2. نوصي باستخدام هذه الأنابيب ، لأنها تتمتع بخصائص سطحية مثالية لزراعة القطيرات.- باستخدام إبرة حقنة (23 جم) ، قم بثقب غطاء العدد المطلوب من أنابيب الحمض النووي منخفضة الارتباط سعة 2 مل بعناية وأمان. سيضمن ذلك انتشارا مجانيا لثاني أكسيد الكربون2 / O2 مع منع تبخر الوسائط.
- أضف 1 مل من الوسط الخارجي إلى كل أنبوب حضانة. يجب احتضان القطرات بحجم 5x على الأقل من الوسائط الخارجية لضمان التخزين المؤقت المناسب. يمكن زيادة حجم الوسط الخارجي المضاف اعتمادا على عملية التمثيل الغذائي للخلايا المطبقة.
- أعد تعليق القطرات المتولدة في وسائط التراكب وقسم كل إنتاج إلى ثلاثة من أنابيب الحضانة المعدة (واحد لكل قياس نقطة زمنية). القطرات ثقيلة وسريعة الرواسب ، وبالتالي من المهم إعادة تعليق المخزون بين كل عملية نقل.
ملاحظة: يمكن أن يتنوع عدد أنابيب الحضانة التي يتم تقسيم إنتاج القطرات إليها ، لكننا نوصي بتقسيم إنتاج واحد إلى ما لا يزيد عن 4 أنابيب حضانة للتأكد من أن كل عينة تحتوي على أحداث كافية للتحليل. - ضع الأنابيب في وضع مستقيم في الحاضنة لمدة 2 ساعة أو 4 ساعات أو 6 ساعات بعد توليد القطيرات.
3. تحليل المصب للقطرات
- مجهريه
- بعد الحضانة ، انقل عددا صغيرا من القطرات إلى شريحة مجهرية كما هو موضح في الخطوة 2.2.7 وقم بتحليلها عن طريق المجهر اللامع والفلوري باستخدام مجهر مضان قياسي مع تكوين الليزر والمرشح المناسب.
ملاحظة: يمكن اكتشاف القطرات عن طريق المجهر ذو المجال الساطع. يمكن اكتشاف الخلايا التائية الملطخة باللون البنفسجي باستخدام مرشح DAPI ، وخلايا JeKo-1 الملطخة باللون الأحمر البعيد مع مرشح APC ، وإشارة GzmB-FAM مع مرشح FITC ، وإشارة PI مع مرشح PE. قد يكون من الصعب تصور إشارة PI ذات الأهمية القصوى عن طريق الفحص المجهري لأن الخلايا المبرمجة المبكرة لها ذروة انبعاث أقل من الخلايا موت الخلايا المبرمج المتأخرة. انظر الشكل 4 للحصول على بيانات تمثيلية.
- بعد الحضانة ، انقل عددا صغيرا من القطرات إلى شريحة مجهرية كما هو موضح في الخطوة 2.2.7 وقم بتحليلها عن طريق المجهر اللامع والفلوري باستخدام مجهر مضان قياسي مع تكوين الليزر والمرشح المناسب.
- قياس التدفق الخلوي
- بعد الحضانة ، أعد تعليق كل عينة قطرة في وسط التراكب وانقلها إلى أنابيب FACS سعة 5 مل. قم بتحليل القطرات باستخدام مقياس التدفق الخلوي القياسي باتباع الإرشادات العامة المدرجة أدناه.
- استخدم مقياس التدفق الخلوي مع تكوين الليزر والفلتر المناسب. مع اللوحة المحددة لبقع الخلايا والمقايسة ، لا يلزم تعويض اللون على مقياس التدفق الخلوي المستخدم هنا. إذا تم تطبيق ألوان أخرى أو كان تكوين مقياس التدفق الخلوي المطبق مختلفا ، فقد يكون التعويض ضروريا.
- استخدم FSC-H كمشغل عتبة لاستبعاد ضوضاء الخلفية من أحداث الزيت الصغيرة.
- القطرات ثقيلة وسوف تترسب في قاع أنابيب FACS. تأكد من وصول SIP إلى القطرات. يجب تعليق القطرات في حجم 5 أضعاف على الأقل من المخزن المؤقت الخارجي للقطرات قبل الاستحواذ.
- يتم الحصول على أحداث Droplet باستخدام سرعة عالية. سجل إشارات ارتفاع الشدة (H) ل FSC و SSC والفلوروفورات التي تم فحصها حيث يتم استخدام قياسات ارتفاع الشدة عند تحليل القطرات. ضبط المكاسب للحصول على الفصل المناسب بين الأحداث الإيجابية والسلبية.
ملاحظة: استخدمنا قناة FITC لقياس إشارة GzmB ، وقناة Pacific Blue للكشف عن الخلايا التائية الملطخة باللون البنفسجي ، وقناة APC للكشف عن خلايا JeKo-1 الملطخة باللون الأحمر البعيد وقناة PE للكشف عن إشارة PI. - سجل ما يكفي من الأحداث لتحليل المصب. هنا ، سجلنا 4.5 - 8.3 × 103 من القطرات المغلفة المشتركة لكل نقطة زمنية.
- اغسل مقياس التدفق الخلوي من خلال SIP بعد كل مجموعة من عمليات الحصول على القطرات ، باستخدام محاليل التنظيف والشطف القياسية. نظف مقياس التدفق الخلوي جيدا في نهاية التجربة. انظر الشكل 4 والشكل 5 للحصول على بيانات تمثيلية.
- بعد الحضانة ، أعد تعليق كل عينة قطرة في وسط التراكب وانقلها إلى أنابيب FACS سعة 5 مل. قم بتحليل القطرات باستخدام مقياس التدفق الخلوي القياسي باتباع الإرشادات العامة المدرجة أدناه.
- تحليل البيانات
- احسب النسبة المئوية للخلايا التائية التي تفرز GzmB بناء على النسبة المئوية للخلايا التائية الموجبة GzmB والتغليف المشترك لخلايا JeKo-1 التي تم تطبيعها إلى قابلية بقاء الخلايا التائية المحددة في مجموعات قطرات الخلايا التائية فقط في النقطة الزمنية المعنية ، على النحو التالي:
قطرات خلية تائية + ، Jeko-1+ ، GzmB + / (قطرات خلية تائية + ، Jeko-1+ - قطرات ميتة خلية تائية + ، Jeko-1+)
حيث يتم تقدير القطرات الميتة الخلية التائية + ، Jeko-1 + من الموت في قطرات مع الخلايا التائية فقط: قطراتميتة خلية تائية + ، Jeko-1+ = قطراتخلية تائية + ، Jeko-1 + x قطرات ميتة خلية تائية + ، Jeko-1- / قطراتTcell + ، Jeko-1-. - احسب النسبة المئوية للخلايا التائية التي قتلت خلاياها المستهدفة على النحو التالي:
النسبة المئوية للخلايا التائية السامة للخلايا = (الموت الملحوظ - الموت في الخلفية) / (100 - الموت في الخلفية)
حيث الموت في الخلفية هو الموت الموجود داخل قطرات (الخلايا التائية + ، Jeko-1+) الناتجة إما عن الموت غير المرتبط بالقتل أو الموت الذي حدث قبل التغليف. - تقدير الموت في الخلفية من موت الخلايا في قطرات (الخلايا التائية + ، جيكو-1-) وقطرات (الخلايا التائية ، جيكو-1+):
الموت في الخلفية = (1- (1- نسبة الوفيات في DropletsTcell- ، Jeko-1+) × (1- نسبة الوفاة فيDroplets T cell + ، Jeko-1-)) × 100
حيث يتم قياس نسبة الوفيات مباشرة على أنها النسبة المئوية للقطرات الموجبة PI في قطرات الخلايا التائية فقط وقطرات خلايا JeKo-1 فقط ، على التوالي. يتم إجراء جميع العمليات الحسابية باستخدام أرقام محددة بوقت العينات.
- احسب النسبة المئوية للخلايا التائية التي تفرز GzmB بناء على النسبة المئوية للخلايا التائية الموجبة GzmB والتغليف المشترك لخلايا JeKo-1 التي تم تطبيعها إلى قابلية بقاء الخلايا التائية المحددة في مجموعات قطرات الخلايا التائية فقط في النقطة الزمنية المعنية ، على النحو التالي:
النتائج
بعد التنبيغ ، تم تحليل الخلايا التائية للتعبير عن CAR عن طريق قياس التدفق الخلوي باستخدام الأجسام المضادة المضادة ل CD3 والأجسام المضادة ل NGFR. تم إثراء مجموعة الخلايا التائية CAR لاحقا باستخدام الخرز المغناطيسي المضاد ل NGFR ، مما أدى إلى نقاء يزيد عن 98٪ لكلا المتبرعين (الشكل 1 أ-ب). كما تم تحديد نسبة CD4 / CD8 والنمط الظاهري للذاكرة لخلايا CAR التي تم فرزها المستخدمة ، باستخدام استراتيجية بوابة قياسية باستخدام الأجسام المضادة CCR7 و CD45RA. تظهر هذه البيانات أن نسبة CD4 / CD8 لخلايا CAR T المستخدمة كانت 0.73 ، وكانت الخلايا في المقام الأول من النمط الظاهري للذاكرة الشبيهة بالساذج (الشكل 1C-E).
تم تلطيخ خلايا CAR T وخلايا JeKo-1 بأصباغ بنفسجية وحمراء بعيدة ، على التوالي ، وتم تغليفها في قطرات DE50 جنبا إلى جنب مع كواشف الفحص GzmB الركيزة و PI (الشكل 2). بدلا من ذلك ، يمكن أيضا تسمية الخلايا التائية CAR باستخدام الأجسام المضادة مثل anti-CD4 أو anti-CD8 (الشكل 3) ، مما يتيح توصيفا أكثر تفصيلا للخلايا التائية. تم خلط كل تعليق للخلايا التائية (CAR T أو NTD) مع تعليق خلية JeKo-1 مباشرة قبل التغليف في مستجيب: نسبة الخلية المستهدفة 1: 3 (0.5 × 106 خلايا T و 1.5 × 106 JeKo-1). بعد التغليف ، تم تقسيم كل إنتاج قطرة (خلايا CAR T + JeKo-1 و NTD + JeKo-1) إلى ثلاثة أنابيب حضانة لمدة 2 ساعة و 4 ساعات و 6 ساعات على التوالي. تم تحضين الخلايا داخل القطرات عند 37 درجة مئوية في 5٪ ثاني أكسيد الكربون2 ثم تم تحليلها بواسطة الفحص المجهري وقياس التدفق الخلوي في النقاط الزمنية المحددة.
أجرينا الفحص المجهري الفلوري لقطرات المستحلب المزدوج بعد 4 ساعات من الحضانة (الشكل 4). توضح شدة إشارة التألق الأخضر (FITC) مستوى نشاط GzmB المفرز لخلايا CAR T أو NTDs داخل قطرات DE50. يعرض الشكل 4 ب تباين الطور وصور المجهر الفلوري لقطرة موجبة GzmB واحدة تحتوي على خلية CAR T وخلية مستهدفة JeKo-1 على اتصال وثيق.
بعد ذلك ، تم تحليل قطرات DE50 عن طريق قياس التدفق الخلوي لتحديد النسبة المئوية للخلايا التائية CAR مع إفراز GzmB المبكر ونشاط قتل الخلايا السامة للخلايا (الشكل 5). سهل تلطيخ ما قبل الحضانة للخلايا المستهدفة JeKo-1 بصبغة حمراء بعيدة وخلايا T المستجيبة بصبغة بنفسجية قبل التغليف تحديد ثلاث مجموعات قطرات متميزة تحتوي على خلايا حيث يتم توزيع الخلايا في قطرات بناء على توزيع بواسون. مجموعات القطرات التي تم تحديدها هي قطرات بها خلايا تائية وحدها ، وخلايا JeKo-1 وحدها ، وخلايا T وخلايا JeKo-1 معا (الشكل 5 أ). تم بوابات وتحليل القطرات التي تغليف الخلايا التائية مع خلايا JeKo-1 بحثا عن إشارات تشير إلى نشاط GzmB (الشكل 5 ب) وموت الخلايا ، كما هو موضح في PI (الشكل 5 ج).
يتبع تغليف الخلايا في القطرات توزيع بواسون ، ويتم الحصول على أربعة مجموعات مختلفة من القطرات (الشكل 6 أ). يوضح الشكل 6 ب مستوى القطرات الموجبة GzmB داخل جميع مجموعات القطرات بعد 6 ساعات من حضانة القطرات التي يمكن من خلالها تحديد النسبة المئوية للخلايا التائية التي تفرز GzmB تلقائيا. تشير هذه البيانات إلى الخصوصية العالية للطريقة ، حيث تفرز الخلايا التائية CAR فقط GzmB.
أخيرا ، قمنا بقياس مستويات GzmB و PI عبر النقاط الزمنية ، بعد 2 ساعة و 4 ساعات و 6 ساعات من الحضانة المشتركة. كمرجع ، تم تحليل القطرات التي تحتوي على الخلايا التائية فقط وخلايا JeKo-1 فقط لفحص موت خلايا الخلفية في كل مجموعة سكانية (الشكل 6 ج). تم استخدام موت الخلايا الخلفية لتحديد النسبة المئوية للخلايا التائية الحية التي تفرز GzmB والخلايا التائية المستهدفة في مجموعة الخلايا المستجيبة (الشكل 7) ، كما هو موضح في الخطوة 3.3. أظهرت الخلايا التائية CAR من اثنين من المتبرعين زيادة تعتمد على الوقت في كل من إفراز GzmB الناجم عن الخلايا المستهدفة ونشاط قتل الخلايا. ما يقرب من 36٪ من الخلايا التائية الحية CAR T من المتبرع 1 و 31٪ من المتبرع 2 قد أفرزت GzmB بعد 6 ساعات من التغليف المشترك مع الخلية المستهدفة ، وهي زيادة كبيرة مقارنة بالخلايا التائية للتحكم في NTD (الشكل 7 أ). في المقابل ، قتل حوالي 21٪ من خلايا المتبرع الحي 1 و 22٪ من خلايا CAR T الحية 2 للمتبرع الحي الخلايا المستهدفة ، كما يتضح من إشارة PI موجبة (الشكل 7 ب). تجاوزت النسبة المئوية للخلايا التائية CAR التي تفرز GzmB النسبة المئوية للخلايا المستهدفة المقتولة في كل نقطة زمنية ، بما يتفق مع التسلسل المتوقع للأحداث في السمية الخلوية بوساطة GzmB. مجتمعة ، تظهر هذه البيانات أن الطريقة المعروضة هنا تسمح بتوصيف عدم التجانس في السمية الخلوية للخلايا التائية الفردية داخل مجموعة من الخلايا بالإضافة إلى المقارنات بين مجموعات سكانية مختلفة.
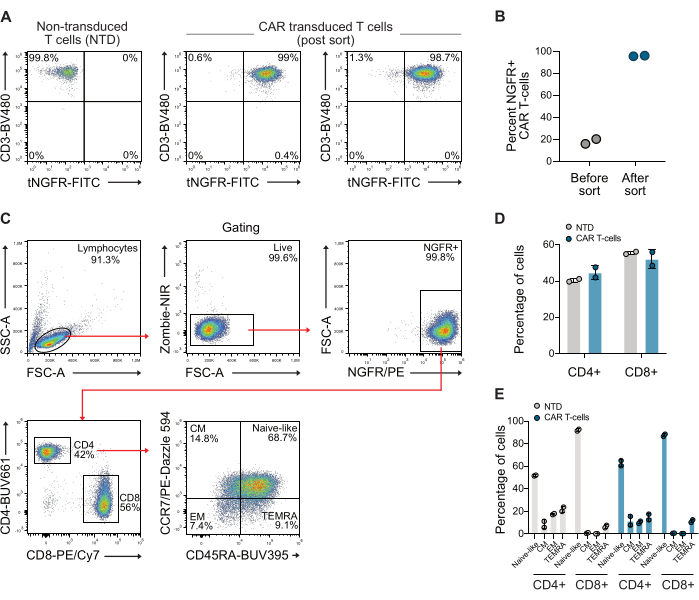
الشكل 1: مخططات قياس التدفق الخلوي التمثيلية بعد فرز NGFR. (أ) بعد ما يقرب من 10 أيام من التوسع ، تم فرز الخلايا التائية CAR باستخدام الميكروبيدات الخاصة ب NGFR والفرز المغناطيسي ، مما أدى إلى مجموعة من الخلايا التائية CAR التي كانت >98٪ من الخلايا التائية CAR. (ب) القياس الكمي للخلايا التائية ذات مستقبلات المستضدات المستضدة المستضدة من متبرعين استخدمين في هذه الدراسة قبل الفرز وبعده. (ج) استراتيجية البوابات المستخدمة لفحص نسبة CD4 / CD8 والنمط الظاهري للذاكرة للخلايا التائية. (د) القياس الكمي ل CD4 و CD8 للخلايا التائية المستخدمة. (ه) القياس الكمي للنمط الظاهري للذاكرة للخلايا التائية المستخدمة. اختصار: CM = الذاكرة المركزية ، EM = ذاكرة المستجيب ، NTD = غير محول ، TEMRA = خلايا مستجيب متمايزة نهائيا. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
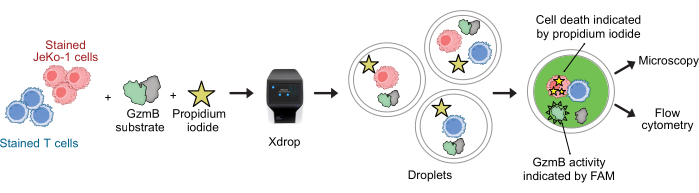
الشكل 2: سير عمل إفراز GzmB المشترك ومقايسة السمية الخلوية مع دقة خلية واحدة في القطرات. قبل التغليف في قطرات DE ، يتم تلطيخ الخلايا المستهدفة والمستجيب بشكل منفصل باستخدام بقع الخلايا البنفسجية والحمراء البعيدة. باستخدام جهاز الموائع الدقيقة وخرطوشة التغليف ، يتم تغليف الخلايا المستجيبة مع الخلايا المستهدفة في قطرات جنبا إلى جنب مع وسط الخلية ، PI ، وركيزة الببتيد GzmB المسماة FAM. يتم إجراء الفحص والحضانة داخل القطرات. يشار إلى نشاط GzmB المفرز من خلال انبعاث التألق الأخضر الذي يحدث بعد شق GzmB الركيزة. يشار إلى موت الخلايا بواسطة PI. بعد الحضانة ، يتم تحليل قطرات DE50 عن طريق الفحص المجهري و / أو قياس التدفق الخلوي. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
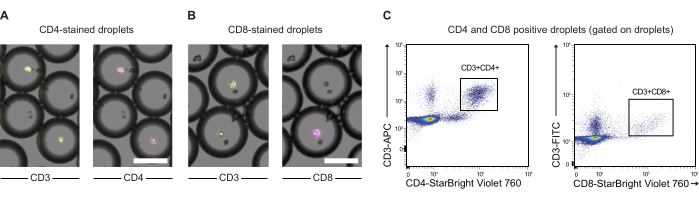
الشكل 3: تحليل PBMCs المغلفة بالقطرات المسمى مسبقا بالأجسام المضادة ل CD3 و anti-CD4 و Anti-CD8. (أ) صور الفحص المجهري للقطرات ذات PBMCs المغلفة المسماة مسبقا بالأجسام المضادة ل CD3 (APC) ومضادة ل CD4 (NIR). شريط المقياس = 100 ميكرومتر (ب) مثل (A) ، ولكن مع وضع العلامات CD3 (FITC) ومضاد ل CD8 (NIR) بدلا من ذلك. مقياس المقياس = 100 ميكرومتر. (ج) تحليل قياس التدفق الخلوي لنفس القطرات. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
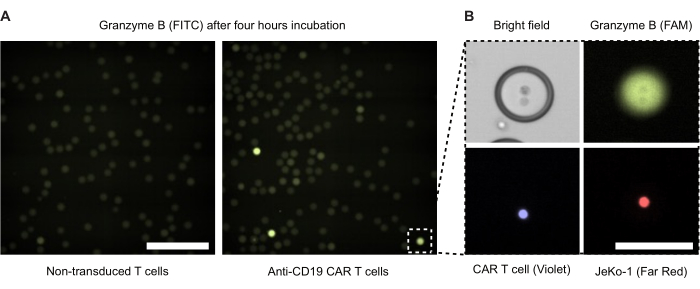
الشكل 4: صور مجهرية للقطرات مع المستجيب والخلايا المستهدفة. تم التقاط الصور بعد حضانة 4 ساعات في حاضنة الخلايا المرطبة القياسية 37 درجة مئوية ، 5٪ ثاني أكسيد الكربون2. (أ) قطرات من عينة بها خلايا NTD و JeKo-1 مغلفة (يسار) أو خلايا CAR T وخلايا JeKo-1 (يمين) تم تصويرها بواسطة المجهر الفلوري باستخدام قناة FITC للكشف عن قطرات GzmB الإيجابية (الخضراء). مقياس المقياس = 500 ميكرومتر. (ب) قطرة واحدة مصورة عن طريق تباين الطور ، FITC (GzmB) ، APC (خلية JeKo-1) ، و DAPI (خلية CAR T). مقياس المقياس = 100 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
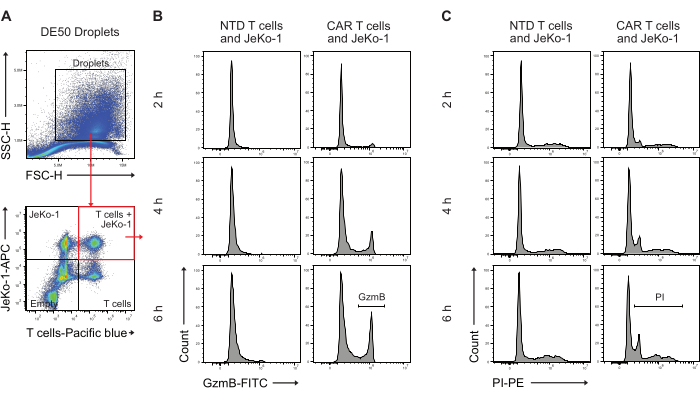
الشكل 5: استراتيجية البوابات لتحليل القطرات عن طريق قياس التدفق الخلوي بعد الحضانة. (أ) تم إجراء البوابات عن طريق التشتت الأمامي والجانبي لتحديد القطرات ، متبوعا بتحديد البوابة التي تحتوي على القطرات. تمثل الأحداث خارج البوابة قطرات الزيت المنتجة كمنتج ثانوي لإنتاج قطرات المستحلب المزدوج. يحدد التحليل المضان اللاحق للقطرات في القنوات المقابلة لبقع الخلية المطبقة أربعة مجموعات قطرات: قطرات تحتوي على كل من الخلايا التائية وخلايا JeKo-1 (المربع الأحمر). قطرات مع خلايا JeKo-1 وحدها ؛ قطرات مع الخلايا التائية وحدها ؛ والقطرات الفارغة. (ب) الرسوم البيانية التمثيلية لإشارة GzmB في قطرات موجبة مزدوجة عبر النقاط الزمنية وبين الخلايا NTD و CAR T (ج) الرسوم البيانية التمثيلية لإشارة PI في القطرات الموجبة المزدوجة عبر النقاط الزمنية وبين الخلايا التائية NTD و CAR T يتم إجراء جميع قياسات القطرات كقياسات ارتفاع الشدة (H). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
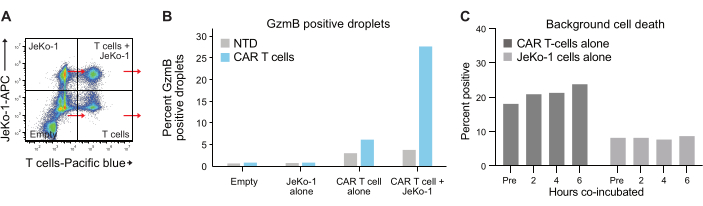
الشكل 6: الرقابة الداخلية والمجموعات المرجعية. (أ) تم اختيار كل من الأرباع الأربعة من الشكل 5 أ ، وتم قياس GzmB و PI في كل منهما. يسمح هذا النوع من القياس الكمي بقياس إشارات الخلفية وطرحها قبل إجراء التحليل النهائي لفعالية الخلايا التائية. (ب) رسم بياني يوضح تردد قطرات موجبة GzmB بعد حضانة لمدة 6 ساعات لكل مجموعة من مجموعات القطرات الأربعة، متمثلة في بيانات من عينة T من الجهة المانحة 1 CAR. (ج) تم تحديد موت خلايا الخلفية في مجموعات قطرات التحكم في الخلايا التائية JeKo-1 فقط والخلايا التائية فقط في كل نقطة زمنية تم قياسها ، مع بيانات من المتبرع 1. يتم استخدام موت خلايا الخلفية لحساب تواتر الخلايا المستجيبة التي تفرز GzmB الحية والخلايا القاتلة للخلايا الموضحة في الشكل 7 والموضحة في الخطوة 3.3. الاختصارات: قبل = التغليف. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
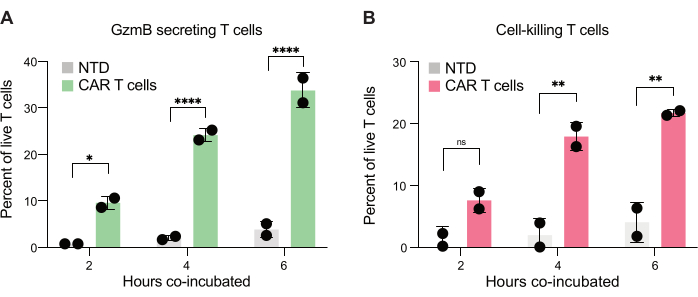
الشكل 7: القياس الكمي للخلايا التائية القادرة على إفراز GzmB وقتل خلايا JeKo-1 في قطرات موجبة مزدوجة. تم فحص الرذاذ الإيجابي المزدوج المسور من اثنين من المتبرعين بعد 2 ساعة و 4 ساعات و 6 ساعات في الحضانة المصاحبة في الرذاذ. (أ) تواتر الخلايا التائية التي تواجه الخلايا المستهدفة التي تفرز GzmB والمقارنة بين الخلايا التائية NTD والخلايا التائية CAR. (ب) تواتر الخلايا التائية التي تواجه الخلايا المستهدفة التي تقتل الخلية المستهدفة المغلفة بشكل مشترك. الاختصارات: GzmB = granzyme B ، NTD = غير محول ، PI = يوديد البروبيديوم. * = قيمة P < 0.05 ، ** = قيمة P < 0.005 ، **** = قيمة P < 0.0001 بواسطة ANOVA ثنائي الاتجاه. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
نقدم هنا طريقة لفحص الإمكانات السامة للخلايا للخلايا التائية على مستوى الخلية المفردة باستخدام جهاز سوائل دقيقة سهل الاستخدام متاح تجاريا لتقييم الإمكانات السامة للخلايا CD19-CD28-CD3z CAR T عند التغليف المشترك مع خط خلية سرطان الغدد الليمفاوية لخلية الوشاح الإيجابي CD19 JeKo-1.
هناك العديد من الخطوات الحاسمة في هذا البروتوكول. أولا ، نوصي بإزالة حبات التحفيز من الخلايا التائية قبل 48 ساعة على الأقل من إجراء أي فحوصات ، لتجنب النتائج الإيجابية الخاطئة. ثانيا ، يمكن أن تختلف كفاءة نقل الخلايا التائية مع تركيبات مثل CARs أو مستقبلات الخلايا التائية اختلافا كبيرا. بدون خطوة تنقية لاحقة للخلايا التائية المنقولة ، قد يكون من الصعب تفسير النتائج. هنا ، تم استخدام مجموعة نقية من الخلايا التائية ذات مستقبلات المستضدات الخيمرية ، وبالتالي يمكن توقع درجة عالية من اليقين عند وصف الخلايا التائية ذات مستقبلات المستضدات المستضدة بأنها قاتلة أو غير قاتلة في كل نقطة زمنية. بدلا من ذلك ، يمكن تطبيق وضع علامات على CARs ببروتين الفلورسنت أو العلامة الجينية للإشارة إلى الخلايا الإيجابية ل CAR ثم يتم تثبيتها عند تحليل القطرات. إذا تم استخدام الوسم ، يجب ألا تتداخل جزيئات الفلورسنت المختارة مع الانبعاثات الفلورية من أي من الفلوروفورات الأخرى للفحص. على سبيل المثال ، قد يتداخل استخدام وضع علامات GFP مع ركيزة GzmB المسماة FAM المطبقة في التجارب التي أجريت هنا وبالتالي لا يوصى به.
تتمثل إحدى المزايا الرئيسية للبروتوكول الموضح هنا في أن توليد القطرات نفسه مبسط وآلي. ومع ذلك ، من أجل ضمان التغليف أحادي الخلية ، من المهم أن يتم تعليق الخلايا تماما قبل تحميل الخرطوشة. لهذا السبب ، يوصى بالعمل بوتيرة عادلة عند التحضير لتحميل الخرطوشة. ينطبق اعتبار مماثل عند إضافة ركيزة GzmB ، حيث أن بعض الخلايا عبارة عن إفرازات عالية ل GzmB. ستمنع إعادة تعليق الخلايا أيضا انسداد قنوات الموائع الدقيقة للخرطوشة الصغيرة. يتم التحقق بسهولة من التغليف الصحيح للخلايا عن طريق الفحص المجهري ، كما هو موضح أعلاه.
نظرا لأن القطرة تغلف وسط الخلية وتحتفظ بالمنتجات الخلوية التي تفرز من الخلايا ، يمكن تحليل السيتوكينات والأجسام المضادة والمركبات الأخرى. في الواقع ، اختبرنا جزيئات أخرى ذات صلة تفرز الخلايا المناعية ، مثل IFN-γ و TNF-α ، والتي تتطلب تعديلات على البروتوكول الحالي. للكشف عن السيتوكين ، يمكن تطبيق نوع مختلف من تنسيق الفحص عما نستخدمه هنا ل GzmB ، مثل إنشاء شطيرة ELISA على سطح الخلية المستجيب32. بالإضافة إلى ذلك ، يمكن تغيير بقع الخلايا وألوان الفحص ، على سبيل المثال ، كربوكسي فلوريسين إستر السكسينيمديل (CFSE) ، ولكن من المهم ضمان الحد الأدنى من النزيف أو عدم النزيف عبر مجموعات الألوان المختلفة ، كما هو الحال في قياس التدفق الخلوي القياسي.
علاوة على ذلك ، لا يقتصر هذا البروتوكول على تحليل خلايا CAR T يمكن أيضا تمديده لدراسة تفاعلات الخلايا التائية / المستهدفة الأخرى أو الخلايا المناعية الأخرى مثل خلايا CAR NK. يمكن أيضا تصور تجارب أكثر تقدما ، على سبيل المثال وضع العلامات على مجموعات فرعية من الخلايا التائية CD4 و CD8 بفلوروفورات إضافية لأداء التنميط المناعي الوظيفي الأوسع. في الواقع ، نوضح هنا أنه يمكن اكتشاف CD4 و CD8 في القطرات ، مما يتيح مزيدا من التوصيف للخلايا التائية المستجيبة وقدرتها السامة للخلايا.
لتحسين هذا البروتوكول ، هدفنا على وجه التحديد أن يعمل على أدوات قياس التدفق الخلوي القياسية. في حين أن قياس تدفق القطرات الخلوي ليس معقدا ، فقد لاحظنا أن تراكم الزيت قد يحدث إذا لم يتم شطف مقياس التدفق الخلوي بشكل صحيح على فترات زمنية معينة أو على النحو الموصى به هنا بعد تحليل العينات في كل فترة زمنية. قد يكون أفضل بروتوكول شطف محددا لكل مقياس تدفق خلوي فردي.
تتمثل إحدى المزايا المهمة لهذه الطريقة في قدرتها العالية على الإنتاجية ، مما يسمح بمراقبة السمية الخلوية بوساطة المستجيب أحادي الخلية ضد الخلايا المستهدفة دون الحاجة إلى خبرة واسعة أو معدات عالية التخصص. يمكن إجراء الفحص بسهولة باستخدام الأدوات الموجودة ، مثل قياس التدفق الخلوي أو الفحص المجهري. قطرات المستحلب المزدوجة قابلة أيضا للفرز باستخدام أجهزة فرز الخلايا30،31 ، والتي قد تمكن من عزل الخلايا ذات الوظائف المحددة ، على سبيل المثال ، خلايا CAR T مع وبدون إمكانات سامة للخلايا ، متبوعا بتحليل النسخ أحادي الخلية.
التكنولوجيا لا تخلو من القيود. في حين أن بعض خطوط الخلايا ستتحمل الثقافة في القطرات لمدة 24 ساعة وما بعدها ، فقد يكون للخلايا الأولية قابلية أقل بكثير للحياة بعد 24 ساعة. يمثل هذا قيودا زمنيا على المقايسات بشكل عام ، ولكن بالنسبة للمقايسة الحالية ، يمكن ملاحظة GzmB الملحوظ ونشاط قتل الخلايا في غضون 4-6 ساعات ، على الأرجح لأن حجرة القطرات الصغيرة تضمن المواجهة السريعة للمستجيب والخلايا المستهدفة. وبالمثل ، فإن حجم القطرات الصغير سيضمن تراكما سريعا في التركيز إلى مستويات يمكن اكتشافها من الركيزة المشقوقة المفرزة GzmB. قيد آخر للتكنولوجيا هو عدم القدرة على اكتشاف القتل التسلسلي بواسطة الخلايا المستجيبة عند استخدام مقاييس التدفق الخلوي القياسية. ومع ذلك ، يمكن تحقيق ذلك باستخدام مقاييس تدفق الصورة الخلوية أو تقنيات قياس الخلايا للصور ، والتي يجب التحقق منها.
أظهر النقل بالتبني لخلايا CD19 CAR T نجاحا ملحوظا في علاج المرضى الذين يعانون من أورام الدم الخبيثة. على الرغم من ذلك ، هناك تباين كبير في الاستجابة والسمية غير المتوقعة في المرضى32 ، والتي قد تكون جزئيا بسبب عدم التجانس داخل منتج تسريب CAR T. نتيجة لذلك ، هناك اهتمام متزايد بتحليل التركيب الظاهري والقدرة السامة للخلايا التائية ذات مستقبلات المستضدات الخيمرية الفردية داخل السكان. سيكون هذا مهما بشكل خاص حيث يتم اختبار علاج CAR بشكل متزايد في حالات المناعة الذاتية وفي أشكال أخرى من السرطان. يوفر جهاز وبروتوكول الموائع الدقيقة الموصوفين هنا نهجا قويا ومتعدد الاستخدامات لفحص عدم تجانس الخلايا التائية ذات مستقبلات المستضدات المستضدة المستضدة والعلاجات الأخرى القائمة على الخلايا.
Disclosures
يعلن المؤلفون عن المصالح المتنافسة التالية: حصل MBB على مكافآت استشارية من Janssen و Roche و Kite / Gilead ، لا علاقة لها بالعمل الحالي. D.L.P. و P.M. موظفان في Samplix.
Acknowledgements
ويود المؤلفان أن يشكروا أعضاء وموظفي سيتكو وسامبليكس على المناقشات والاقتراحات المفيدة. MBB مدعوم من قبل زمالة العلماء السريريين في بداية حياتهم المهنية من مؤسسة Lundbeck (R381-2021-1278). يتم دعم هذا العمل من خلال منحة بحثية من النخبة من مستشفى جامعة أودنسي. علاوة على ذلك ، تم دعم هذا البحث بمنحة من مشروع مجلس الابتكار الأوروبي 190144395 إلى Samplix ApS.
Materials
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| Blocker BSA (BSA) | Thermo Scientific | 37525 | |
| CellTrace Far Red Cell Proliferation Kit (far red fluorescent dye) | Invitrogen | C34564 | |
| CellTrace Violet Cell Proliferation Kit (violet fluorescent dye) | Invitrogen | C34557 | |
| DE Stabilizing Solution (stabilizing solution) | Samplix | REDIVSTABSOL1500 | |
| DPBS (dPBS) | Gibco | 14190-094 | |
| Dulbecco’s PBS (dPBS) | Capricorn Scientific | PBS-1A | |
| Dynabeads Human T-Activator (CD3/CD28 activation beads) | Gibco | 11132D | |
| Fetal Bovine Serum (FBS) | Capricorn Scientific | FBS-HI-12A | |
| Lenti-X Concentrator (PEG-based reagent) | Takara Bio | 631232 | |
| MACSelect LNGFR Microbeads (anti-NGFR magnetic beads) | Miltenyi Biotec | 130-091-330 | |
| OptiPrep density gradient medium (gradient medium) | Stemcell | 7820 | |
| Penicillin-Streptomycin (P/S) | Capricorn Scientific | PS-B | |
| Propidium iodide (PI) | Invitrogen | BMS500PI | |
| Recombinant Human IL-2 (IL-2) | Peprotech | 200-02 | |
| RPMI-1640 with Stable Glutamine (RPMI-1640) | Capricorn Scientific | RPMI-STA | |
| RPMI-1640 without L-Glutamine and phenol red | Gibco | 32404-014 | |
| Xdrop DE oil I (oil) | Samplix | REOILDEC1900 | |
| Xdrop Granzyme B substrate (GzmB substrate) | Samplix | REGRB100 | |
| Zombie-NIR viability dye (viability dye) | BioLegend | 423106 | |
| Plasticware etc. | |||
| 8-chamber glass slide | Chemometec | 942-0003 | |
| Cell culture plate, 12 well | TH Geyer | 7696791 | |
| DNA LoBind tube, 2 mL (DNA tube) | Eppendorf | 30108078 | |
| Eppendorf tube, 1.5 mL (1.5 mL tube) | Eppendorf | 30108051 | |
| Falcon tube, 15 mL (15 mL tube) | TPP | 91015 | |
| Falcon tube, 5 mL (5 mL tube) | Falcon (VWR) | 734-0443 | |
| Green cell suspension flasks for cell incubations (T75 flask) | Sarstedt | 148.19.22 | |
| Green cell suspension plates for cell incubations (96 well plate) | Sarstedt | 148.32.20 | |
| LS Separation Columns (separation column) | Miltenyi Biotec | 130-042-401 | |
| Xdrop DE Gaskets (gaskets) | Samplix | #GADEA100 | |
| Xdrop DE50 Cartridge (encapsulation cartridge) | Samplix | #CADE50A100 | |
| Antibodies | |||
| anti-CCR7 PE-Dazzle 594 | BioLegend | 353236 | |
| anti-CD19 CAR FMC63 Idiotype Antibody, PE | Miltenyi Biotec | 130-127-342 | |
| anti-CD3 APC | Biolegend | 300439 | |
| anti-CD3 BV480 | BD Biosciences | 566105 | |
| anti-CD3 FITC | BD Biosciences | 345763 | |
| anti-CD4 BUV661 | BD Biosciences | 612962 | |
| anti-CD4 StarBright Violet 760 | Bio-Rad | MCA1267SBV760T | |
| anti-CD45RA BUV395 | BD Biosciences | 740298 | |
| anti-CD8 PE-Cy7 | BioLegend | 344712 | |
| anti-CD8 StarBright Violet | Bio-Rad | MCA1226SBV760 | |
| anti-NGFR FITC | BioLegend | 345106 | |
| anti-NGFR PE | BioLegend | 345106 | |
| Cells | |||
| JeKo-1 Mantle-cell lymphoma cell-line (JeKo-1) | ATCC | CRL-3006 | |
| Primary peripheral blood mononuclear cells (PBMCs) | |||
| Equipment | |||
| Countess 3 Automated Cell Counter | Thermo Fisher Scientific | A50298 | |
| DynaMag-2 Magnet | Invitrogen | 12321D | |
| NovoCyte Quanteon Flow Cytometer (flow cytometer) | Agilent | 2010011AA | |
| Xdrop (microfluidics device) | Samplix | IN00110-EU |
References
- Pasqui, D. M., Latorraca, C. D. O. C., Pacheco, R. L., Riera, R. CAR-T cell therapy for patients with hematological malignancies. A systematic review. Eur J Haematol. 109 (6), 601-618 (2022).
- Krejcik, J., et al. Harnessing the immune system to fight multiple myeloma. Cancers. 13 (18), 4546 (2021).
- Tokarew, N., Ogonek, J., Endres, S., von Bergwelt-Baildon, M., Kobold, S. Teaching an old dog new tricks: next-generation CAR T cells. British J Cancer. 120 (1), 26-37 (2019).
- Bogetofte Barnkob, M., Vitting-Seerup, K., Rønn Olsen, L. Target isoforms are an overlooked challenge and opportunity in chimeric antigen receptor cell therapy. Immunother Adv. 2 (1), ltac009 (2022).
- Daei Sorkhabi, A., et al. The current landscape of CAR T-cell therapy for solid tumors: Mechanisms, research progress, challenges, and counterstrategies. Front Immunol. 14, 1113882 (2023).
- . Considerations for the Development of Chimeric Antigen Receptor (CAR) T Cell Products Available from: https://www.fda.gov/regulatory-information/search-fda-guidance-documents/considerations-development-chimeric-antigen-receptor-car-t-cell-products (2024)
- Roddie, C., O'Reilly, M., Dias Alves Pinto, J., Vispute, K., Lowdell, M. Manufacturing chimeric antigen receptor T cells: issues and challenges. Cytotherapy. 21 (3), 327-340 (2019).
- Wang, L., et al. Improvement of in vitro potency assays by a resting step for clinical-grade chimeric antigen receptor engineered T cells. Cytotherapy. 21 (5), 566-578 (2019).
- Burrows, S. R., Fernan, A., Argaet, V., Suhrbier, A. Bystander apoptosis induced by CD8+ cytotoxic T cell (CTL) clones: implications for CTL lytic mechanisms. Int Immunol. 5 (9), 1049-1058 (1993).
- Gattinoni, L., et al. Acquisition of full effector function in vitro paradoxically impairs the in vivo antitumor efficacy of adoptively transferred CD8+ T cells. J Clin Invest. 115 (6), 1616-1626 (2005).
- Chen, G. M., et al. Integrative bulk and single-cell profiling of premanufacture T-cell populations reveals factors mediating long-term persistence of CAR T-cell therapy. Cancer Dis. 11 (9), 2186-2199 (2021).
- Frazer, G. L., Gawden-Bone, C. M., Dieckmann, N. M. G., Asano, Y., Griffiths, G. M. Signal strength controls the rate of polarization within CTLs during killing. J Cell Biol. 220 (10), e202104093 (2021).
- Hermans, I. F., et al. The VITAL assay: a versatile fluorometric technique for assessing CTL- and NKT-mediated cytotoxicity against multiple targets in vitro and in vivo. J Immunol Meth. 285 (1), 25-40 (2004).
- Zaritskaya, L., Shurin, M. R., Sayers, T. J., Malyguine, A. M. New flow cytometric assays for monitoring cell-mediated cytotoxicity. Expert Rev Vaccines. 9 (6), 601-616 (2010).
- Piccinini, C., et al. In vitro CAR-T cell killing: validation of the potency assay. Cancer Immunol Immunother CII. 73 (9), 168 (2024).
- Martinez, E. M., et al. High-throughput flow cytometric method for the simultaneous measurement of CAR-T cell characterization and cytotoxicity against solid tumor cell lines. SLAS Disc Adv Life Sci. 23 (7), 603-612 (2018).
- Jedema, I., van der Werff, N. M., Barge, R. M. Y., Willemze, R., Falkenburg, J. H. F. New CFSE-based assay to determine susceptibility to lysis by cytotoxic T cells of leukemic precursor cells within a heterogeneous target cell population. Blood. 103 (7), 2677-2682 (2004).
- Liu, L., et al. Cellular and molecular imaging of CAR-T cell-based immunotherapy. Adv Drug Delivery Rev. 203, 115135 (2023).
- Liadi, I., et al. Defining potency of CAR+ T cells: Fast and furious or slow and steady. Oncoimmunology. 8 (10), e1051298 (2019).
- Xhangolli, I., et al. Single-cell analysis of CAR-T cell activation reveals a mixed TH1/TH2 response independent of differentiation. Genom Proteom Bioinfo. 17 (2), 129-139 (2019).
- Zhou, Y., et al. Evaluation of single-cell cytokine secretion and cell-cell interactions with a hierarchical loading microwell chip. Cell Rep. 31 (4), 107574 (2020).
- LaBelle, C. A., Zhang, R. J., Hunsucker, S. A., Armistead, P. M., Allbritton, N. L. Microraft arrays for serial-killer CD19 chimeric antigen receptor T cells and single cell isolation. Cytometry J Int Soc Anal Cytol. 103 (3), 208-220 (2023).
- Hellmann, M. J., et al. Heterogeneously deacetylated chitosans possess an unexpected regular pattern favoring acetylation at every third position. Nat Comm. 15 (1), 6695 (2024).
- Wong, K. U., et al. Assessment of chimeric antigen receptor T cytotoxicity by droplet microfluidics in vitro. Antibody Therapeut. 5 (2), 85-99 (2022).
- Antona, S., Platzman, I., Spatz, J. P. Droplet-based cytotoxicity assay: Implementation of time-efficient screening of antitumor activity of natural killer cells. ACS omega. 5 (38), 24674-24683 (2020).
- Subedi, N., et al. An automated real-time microfluidic platform to probe single NK cell heterogeneity and cytotoxicity on-chip. Sci Rep. 11 (1), 17084 (2021).
- Zhang, Y., et al. Enhanced CRISPR/Cas12a-based quantitative detection of nucleic acids using double emulsion droplets. Biosens Bioelect. 257, 116339 (2024).
- Kochenderfer, J. N., et al. Construction and preclinical evaluation of an anti-CD19 chimeric antigen receptor. J Immunother. 32 (7), 689-702 (2009).
- Michaels, Y. S., et al. Precise tuning of gene expression levels in mammalian cells. Nat Comm. 10 (1), 818 (2019).
- Yuan, Y., et al. Droplet encapsulation improves accuracy of immune cell cytokine capture assays. Lab on a Chip. 20 (8), 1513-1520 (2020).
- Brower, K. K., et al. Double emulsion flow cytometry with high-throughput single droplet isolation and nucleic acid recovery. Lab on a Chip. 20 (12), 2062-2074 (2020).
- Kirouac, D. C., et al. Deconvolution of clinical variance in CAR-T cell pharmacology and response. Nat Biotechnol. 41 (11), 1606-1617 (2023).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved