Method Article
Анализ цитотоксичности на основе капель для оценки химерных антигенных рецепторов Т-клеток на уровне одиночных клеток
В этой статье
Резюме
Здесь мы опишем метод создания двойных эмульсионных капель, инкапсулирующих одну Т-клетку и раковую клетку-мишень, для изучения уничтожения клеток на уровне одной клетки. Этот метод позволяет проводить двойное количественное определение как цитотоксических молекул, так и апоптоза клеток-мишеней в большой популяции Т-клеток.
Аннотация
Оценка цитотоксического потенциала методов лечения на основе Т-клеток, таких как лечение химерными антигенными рецепторами (CAR) Т-клетками, играет важную роль в оценке их эффективности и является предпосылкой для клинического применения. Однако традиционные анализы цитотоксичности проводятся в виде объемных анализов и не дают подробной информации о функциональной гетерогенности популяции CAR-Т-клеток. В этом исследовании мы описываем метод на основе капель с двойной эмульсией, который позволяет проводить крупномасштабную коинкапсуляцию одиночных эффекторных CAR-Т-клеток с клетками-мишенью, обеспечивая при этом двойное количественное определение как цитотоксических эффекторных молекул из Т-клеток, так и гибель клеток-мишеней. В протоколе описан метод получения и очистки CD19-специфичных CAR-Т-клеток с последующей их совместной инкапсуляцией в капли с CD19+ клеточной линией JeKo-1, а также реагентами для визуализации секреции цитотоксических эффекторных молекул (Granzyme B) и гибели клеток (с использованием йодида пропидия, PI). Мы демонстрируем, как генерировать капли, содержащие одиночный CAR-T, и клетки-мишени с помощью коммерчески доступного микрофлюидного устройства для получения двойных эмульсионных капель. Кроме того, мы приводим примеры того, как анализировать функциональное разнообразие CAR-Т-клеток в каплях с помощью стандартного оборудования для проточной цитометрии. Наконец, мы кратко опишем временную кинетику и гетерогенность CD19-специфичного убийства CAR T-клеток. В то время как этот метод фокусируется на гибели клеток после атаки CAR-Т-клеток, он также может быть адаптирован для исследования других типов Т-клеток, цитотоксических иммунных клеток и эффекторных функций клеток, таких как секреция цитокинов.
Введение
Терапия Т-клетками с помощью химерного антигенного рецептора (CAR) является быстро развивающейся областью клеточной иммунотерапии рака, которая доказала свою эффективность против различных форм лейкемии, лимфомы1 и множественной миеломы2. CAR-Т-клетки образуются путем модификации Т-клеток с помощью синтетического антигенного рецептора, который может избирательно связываться с поверхностными белками, такими как CD19 или антиген созревания В-клеток (BCMA), экспрессируемыми на В-клетках, плазматических клетках и их злокачественных аналогах. Последние достижения в области дизайна CAR позволили нацеливаться на несколько антигеноводновременно3, полагаясь на множественные входные сигналы, или связываясь исключительно с опухолеассоциированными антигенами, такими как специфические изоформы белка4. Кроме того, в настоящее время несколько CAR тестируются против мишеней негематологических раковых заболеваний5.
Анализ цитотоксичности имеет важное значение как для разработки CAR, так и для контроля качества до выпуска клинических продуктов 6,7,8. Тем не менее, большинство современных анализов зависят от объемных популяций эффекторных CAR-Т-клеток, добавленных в избытке к раковым клеточным линиям, что может привести к ложноположительным результатам из-за эффектов свидетеля9 и привести к плохой корреляции между исходами in vitro и in vivo 10. Поскольку пролиферация Т-клеток и долговременная персистенция зависят от сигналов, полученных во время первоначальных событий активации11,12, тщательное изучение цитотоксических событий на уровне отдельных клеток представляет большой интерес.
Для устранения ограничений объемных методологий исследования цитотоксичности на уровне отдельных клеток могут быть проведены с использованием проточной цитометрии 13,14,15,16,17 и анализов на основе визуализации 18. Однако, несмотря на то, что стандартная проточная цитометрия обеспечивает разрешение одной клетки для количественного определения и характеристики как эффекторных, так и целевых клеток, она не может напрямую определить специфическую цитотоксическую способность отдельных CAR-Т-клеток по отношению к клеткам-мишеням. Кроме того, визуализация отдельных CAR-Т-клеток, взаимодействующих со своими соответствующими мишенями в больших количествах, является сложной и трудоемкой задачей из-за постоянной подвижности клеток. Для решения этих проблем были разработаны новые инструменты для анализа одиночных клеток, которые основаны на спаривании эффекторных и целевых клеток в пространственно ограниченных пространствах с использованием микролуночных массивов 19,20,21, микрорафтовых массивов 22, микрочипов23 и капельной микрофлюидики 24,25,26. Эти инструменты обеспечивают повышенную чувствительность измерений, что позволяет исследовать меньшее количество клеток с использованием уменьшенных объемов реагентов. Тем не менее, остается несколько проблем, в том числе эффективное спаривание клеток, ограниченное количество образцов, которые могут быть проанализированы, зависимость только от анализа на основе визуализации и трудности с получением жизнеспособных клеточных популяций для дальнейшего анализа.
В данном случае мы используем коммерчески доступное устройство для микрофлюидики, которое позволяет значительно упростить подход к микрофлюидике на основе капель. Это устройство позволяет проводить расширенный анализ и анализ отдельных клеток с использованием высокостабильных капель двойной эмульсии (ДЭ). По сравнению с микролуночными и традиционными микрофлюидными анализами и анализами капельной микрофлюидики, описанный здесь протокол не требует обширных знаний в области микрофлюидики.
Капли DE представляют собой небольшие сферические отсеки, состоящие из масляной оболочки с водным ядром, взвешенным в водном растворе. Водная капля содержит и удерживает клетки, клеточный секретом, клеточную среду и реагенты для анализа, что позволяет проводить сложные анализы в каждом компартменте. С помощью устройства для микрофлюидики капли ДЭ генерируются с заданным объемом (около 100 пл), подходящим для анализа одиночных клеток млекопитающих или межклеточного взаимодействия, которые могут быть получены в очень больших количествах (примерно 750 000 капель на образец) и за короткий промежуток времени (примерно 10 минут для 8 образцов) обычными пользователями лаборатории, не имеющими специальных знаний в области микрофлюидики. Образующиеся капли могут быть суспендированы в клеточной среде, тем самым обеспечивая транс-оболочку диффузии O2 и CO2 и буферизацию внутренней части, в то же время сохраняя гидрофильные и более крупные молекулы, такие как секретируемые клеткой эффекторные молекулы. Таким образом, исследуемые клетки адекватно буферизуются, что позволяет изучать межклеточные взаимодействия и временную динамику с течением времени. В отличие от капель одиночной эмульсии (например, капель воды в масле)27, капли ДЭ представляют собой прочные структуры, которые не сливаются и не сливаются в стандартных клеточных инкубаторах. Благодаря своей стабильности и водной внешней фазе они также совместимы с последующими процедурами анализа, такими как традиционная проточная цитометрия. Таким образом, эти капли пиколитера, генерируемые устройством микрофлюидики, могут быть использованы для высокопроизводительного анализа функции клетки отдельными клетками для выяснения функциональной гетерогенности, скрытой в традиционных объемных анализах.
В этой статье мы описываем протокол, который использует капли DE для изучения цитотоксического потенциала CD19-специфичных CAR по отношению к клеткам лимфомы. Наш протокол позволяет проводить анализ уничтожения мишени и секреции Granzyme B (GzmB) отдельными клетками и показывает, что примерно 20% исследованных здесь CAR-Т-клеток обладают потенциалом немедленного уничтожения.
протокол
CAR-Т-клетки, использованные в этом исследовании, были получены путем лентивирусной трансдукции первичных Т-клеток с помощью конструкции CD19scFv-CD28-CD3ζ-tNGFR CAR в сертифицированной лаборатории биобезопасности класса 2 GMO и рассекречены через 4 дня в соответствии со стандартами института. Очищенные Т-клетки были получены из выброшенного избыточного материала от анонимной донорской крови и были освобождены от дальнейших этических одобрений в соответствии с датским законодательством.
1. Генерация CAR-Т-клеток
ПРИМЕЧАНИЕ: В названии используемых ниже реагентов используются общие и сокращенные названия. Полное коммерческое название можно найти в скобках в Таблице материалов.
- Активация, трансдукция и экспансия Т-клеток
Примечание: Стабильная экспрессия CD19 CAR T-клеток была достигнута путем лентивирусной трансдукции первичных Т-клеток человека, выделенных из свежих мононуклеарных клеток периферической крови (PBMC), с использованием набора для выделения Т-клеток с отрицательным отбором. Используемый анти-CD19 CAR представляет собой конструкцию второго поколения, состоящую из одноцепочечного вариабельного фрагмента FMC63 (scFv), шарнира и трансмембранного домена CD28, коструктурного домена CD28, домена активации CD3ζ28 и усеченной версии рецептора фактора роста нервов (tNGFR) для мониторинга и обогащения CAR-экспрессирующих клеток29. Плазмида переносного вектора была синтезирована de novo, и лентивирус третьего поколения был получен путем объединения ее с pMDLg/pRRE (Addgene plasmid #12251), pRSV-Rev (Addgene plasmid #12253) и pMD2.G (Addgene plasmid #12259)30. Последние три плазмиды были подарком от Дидье Троно. Сырой вирус концентрировали с помощью реагента на основе ПЭГ, а множественность инфекции (MOI) определяли путем трансдукции клеток SUP-T1 и измерения tNGFR методом проточной цитометрии в соответствии со стандартным протоколом31.- Перенесите 2 x 106 первичных человеческих Т-клеток в 12-луночную чашку для культивирования и стимулируйте их гранулами, покрытыми CD3/CD28, в соотношении гранул к клеткам 1:1 в 1 мл полной среды RPMI-1640 (10% инактивированной при нагревании фетальной бычьей сыворотки, 1% пенициллин/стрептомицин) с добавлением 100 ЕД/мл рекомбинантного человеческого интерлейкина-2 (IL-2). Инкубируйте клетки при температуре 37°C во увлажненном инкубаторе с 5% содержаниемCO2 в течение 24 часов.
- Добавляйте лентивирусные частицы к активированным Т-клеткам с MOI 5-10. Аккуратно перемешайте и инкубируйте клетки в течение 72 часов. Включите нетрансдуцированные (NTD) Т-клетки в качестве отрицательного контроля.
- На 3-й день после трансдукции удалите бусины активации CD3/CD28, собрав Т-клетки в пробирку объемом 1,5 мл и поместив пробирку на магнитную подставку на 1-2 минуты. Перенесите надосадочную жидкость, содержащую клетки, в новую пробирку объемом 1,5 мл.
- Выполните подсчет клеток с помощью автоматического счетчика клеток и отрегулируйте плотность клеток до 1 x 106 клеток/мл в полной среде RPMI-1640 с добавлением 100 Ед/мл IL-2. Продолжайте наращивать Т-клетки до тех пор, пока общее количество CAR-Т-клеток не достигнет по крайней мере 1,5 x 106 ( обычно около 6 x 106 Т-клеток в общей сложности) в суспензии, прежде чем приступать к обогащению NGFR (см. ниже).
- Контролируйте количество клеток через день и отрегулируйте концентрацию до 1 x 106 клеток/мл, добавив свежую среду с добавлением 100 единиц/мл IL-2 для обеспечения оптимального состояния клеток во время расширения.
- Обогащение CAR-экспрессирующих Т-клеток
- Перенесите 6 x 10,6 или более трансдуцированных Т-клеток в пробирку объемом 15 мл и центрифугируйте при 300 x g в течение 5 минут. Ресуспендируйте клеточную гранулу в 320 мкл PBS с добавлением 0,5% бычьего сывороточного альбумина (BSA) для получения PBSA и добавьте 40 μл анти-NGFR магнитных шариков. Хорошо перемешать и выдерживать на льду в течение 15 минут.
Примечание: Этот протокол предполагает эффективность трансдукции примерно 25%, в результате чего после обогащения получается >1,5 x 106 CAR-Т-клеток. Мы не рекомендуем начинать с менее чем 6 x 106 клеток, так как это может привести к плохому восстановлению CAR-Т-клеток. - Добавьте 1640 мкл PBSA, чтобы довести конечный объем до 2 мл, затем приступайте к магнитной сепарации с помощью разделительных колонок в соответствии с инструкциями производителя.
- Перенесите 6 x 10,6 или более трансдуцированных Т-клеток в пробирку объемом 15 мл и центрифугируйте при 300 x g в течение 5 минут. Ресуспендируйте клеточную гранулу в 320 мкл PBS с добавлением 0,5% бычьего сывороточного альбумина (BSA) для получения PBSA и добавьте 40 μл анти-NGFR магнитных шариков. Хорошо перемешать и выдерживать на льду в течение 15 минут.
- Определение экспрессии CAR методом проточной цитометрии
ПРИМЕЧАНИЕ: Мы рекомендуем определить процент клеток, экспрессирующих CAR, и их жизнеспособность на этом этапе, чтобы убедиться в правильности клеток перед проведением приведенного ниже анализа. На этом этапе также можно определить соотношение CD4 и CD8 и фенотип памяти. Репрезентативные графики приведены на рисунке 1 .- Перенесите 2,5 x 105 Т-клеток из трансдуцированных и нетрансдуцированных культур в отдельные пробирки проточной цитометрии. Промойте ячейки 2 раза 200 μл PBS, центрифугируя при 300 x g в течение 5 минут после каждой промывки.
- Приготовьте смесь антител, содержащую антитела против CD19 CAR FMC63 Idiotype PE, антитела против CD3 BV480 и антитела против NGFR FITC, разведенные в соотношении 1:100 в PBS. Ресуспендируйте клетки в 50 мкл смеси антител и инкубируйте при 4 °C в течение 20 мин.
- Промойте ячейки 2 раза 200 μл PBS, центрифугируя при 300 x g в течение 5 минут после каждой промывки. Ресуспендируйте клетки в 200 мкл PBS и проанализируйте с помощью проточной цитометрии.
2. Генерация капель, инкапсулирующих Т-клетки и клетки-мишени
ПРИМЕЧАНИЕ: Перед инкапсуляцией Т-клетки и клетки JeKo-1 окрашиваются различными клеточными красителями для контроля содержания клеток в капле. Клетки инкапсулируют с помощью реагентов для анализа и инкубируют в течение 2-6 ч, прежде чем капли анализируют на проточном цитометре (см. рис. 2).
- Окрашивание клеток перед инкапсуляцией
- Приготовьте рабочие растворы двух флуоресцентных красителей (мы использовали фиолетовый краситель и дальний красный краситель) путем разбавления исходных растворов (приготовленных в соответствии с инструкциями производителя) в соотношении 1:5 000 в дПБС.
- Для каждого донора переложите 2,5 x 106 CAR T, 2,5 x 106 NTD T и 15 x 106 JeKo-1 клетки в отдельные центрифужные пробирки (пробирки объемом 15 мл или 50 мл) и центрифугируйте при 300 x g в течение 5 минут. В этом эксперименте 0,5 x 106 эффекторных клеток были инкапсулированы с 1,5 x 106 клетками-мишенями для каждого приготовленного образца.
ПРИМЕЧАНИЕ: Количество переносимых здесь клеток предназначено для 4-кратной инкапсуляции образцов с каждым типом эффекторных клеток для каждого донора. Увеличьте количество клеток и реагентов в соответствии с количеством необходимых образцов. Кроме того, точное количество клеток в образце может быть масштабировано в соответствии с экспериментальными потребностями. - Удалите надосадочную жидкость и ресуспендируйте гранулы эффекторных клеток в рабочем растворе фиолетового флуоресцентного красителя в соотношении 1:5000 и гранулы клеток-мишеней (JeKo-1) в рабочем растворе 1:5000 дальнего красного флуоресцентного красителя. Хорошо суспендируйте клетки с помощью пипетки и до концентрации клеток 1 x 106 клеток/мл окрашивающего раствора.
- Инкубируйте клетки в течение 20 минут в увлажнённом инкубаторе с содержаниемСО2 при температуре 37 °C. Центрифугируйте клетки при 300 х г в течение 5 минут, удалите надосадочную жидкость и повторно суспендируйте в 15 мл полной среды RPMI-1640 для промывания клеток.
- Повторите промывку и центрифугируйте при 300 х г в течение 5 минут. Удалите надосадочную жидкость и ресуспендируйте гранулы эффекторных клеток в 225 мкл полного RPMI-1640 и гранулы целевых клеток в 450 мкл полного RPMI-1640.
- Добавьте 30 мкл градиентной среды к эффекторным клеточным суспензиям и 60 мкл той же градиентной среды к клеточным суспензиям-мишеням. Суспендируйте градиентный средний исходный раствор задолго до пипетирования.
- Добавьте 15 мкл 20 мкг/мл ПИ в эффекторные клеточные суспензии и 30 мкл ПИ в целевые клеточные суспензии. Конечная концентрация PI в конечном итоге составит 1 г/мл после добавления субстрата Granzyme B (GzmB) ниже.
- Приготовьте разведение субстрата GzmB в соотношении 1:10 в полном RPMI-1640 и добавьте 30 мкл этого субстрата GzmB в эффекторную клеточную суспензию и 60 мкл его в целевые клеточные суспензии. Хорошо перемешайте с пипеткой.
ПРИМЕЧАНИЕ: Общий объем реагентов, добавляемых в каждую гранулу эффекторной ячейки, теперь должен составлять 300 мкл, а в целевые клеточные гранулы - 600 мкл. Концентрация градиентной среды в этих растворах должна составлять 10%, концентрация PI – 1 г/мл, а концентрация субстрата GzmB – 1:100. - Альтернативная маркировка с помощью антител к CD3, CD4 и CD8
Примечание: В некоторых случаях может быть интересно дополнительно мечить эффекторные клетки перед совместной инкапсуляцией с клетками-мишенями. Здесь мы демонстрируем доказательство принципа для этого типа мечения с использованием антител CD3, CD4 и CD8 и PBMC (см. рисунок 3).- Перенесите 2,0 x 106 PBMC в пробирку объемом 1,5 мл и вращайте клетки в течение 5 минут при 300 x g. Удалите надосадочную жидкость и повторно суспендируйте клеточную гранулу в 200 мкл дПБС с 0,5% БСА. Разделите содержимое на две пробирки объемом 2 мл.
- Добавьте в одну из пробирок 5 мкл анти-CD3-APC и 5 мкл анти-CD4-StarBright Violet 760. Добавьте 20 мкл анти-CD3-FITC и 5 мкл анти-CD8-StarBright Violet 760 в другую пробирку.
- Хорошо перемешать и выдерживать 30 минут при комнатной температуре в темноте. Добавьте в ячейки 1 мл промывочного буфера, уменьшите при 300 x g в течение 5 минут, удалите надосадочную жидкость и повторно суспендируйте клеточные гранулы в 1 мл dPBS с 0,5% BSA.
- Раскрутите клетки при 300 x g в течение 5 минут, удалите надосадочную жидкость и повторно суспендируйте клеточные гранулы в 150 мкл RPMI без фенольного красного и 10% градиентной среды. Инкапсулируйте, как описано в шаге 2.2, используя RPMI без фенольного красного, 33% стабилизирующего раствора для клеток и 10% градиентной среды в качестве наружной среды.
- Инкапсуляция ячеек
- Перед инкапсуляцией разогрейте картридж для инкапсуляции и стабилизирующий раствор до комнатной температуры. Приготовьте запас наружной среды, состоящий из полной среды RPMI-1640, 33% стабилизирующего раствора для клеток и 10% градиентной среды.
- Для каждого образца инкапсуляции приготовьте раствор для образца клетки со смешанными клетками-мишенями-эффекторами. Хорошо приготовленные клеточные растворы повторно суспендируют с помощью пипетки и смешают 65 мкл приготовленной суспензии эффекторных клеток с 65 мкл приготовленной суспензии клеток-мишеней в пробирках объемом 1,5 мл (оба препарата приготовлены на этапе 2.1).
- Немедленно приступайте к загрузке указанных лунок капсуляционного картриджа реагентами в следующем порядке, чтобы обеспечить надлежащую инкапсуляцию. Загрузите по одному комплекту лунок для каждого подготовленного образца для инкапсуляции.
Скважина #A: 400 μл наружной среды.
Ну и #D: 40 μл внешней среды на маленькой полке.
Хорошо #C: 120 мкл предварительно смешанного раствора с клетками-мишенями (JeKo-1) и эффекторными клетками. Хорошо ресуспендируйте клетки с помощью пипетки прямо перед загрузкой.
Скважина #B: 250 μл нефти.
ПРИМЕЧАНИЕ: В каждый картридж можно загрузить до 8 образцов для параллельной инкапсуляции. - Немедленно приступайте к герметизации прокладки и загрузке картриджа в прибор, избегая наклона, тряски или удара загруженного картриджа. Тщательно запечатайте прокладку на картридже.
- Осторожно перенесите картридж в устройство микрофлюидики и начните инкапсуляцию, как описано в руководстве пользователя.
- Образующиеся капли имеют более высокую плотность, чем окружающая внешняя среда, и быстро оседают на дне сборного колодца (Well #D). Соберите каждую каплю (все капли и окружающую их внешнюю среду) путем ресуспендирования осажденных капель из лунки #D в перекрывающейся среде и переноса их в пробирку ДНК с низкой связываемостью объемом 2 мл и крышкой. Хорошо промойте #D оставшимся внешним средством из Well #A, чтобы собрать оставшиеся капли.
- Когда капли оседают в пробирках для сбора (это занимает примерно 1 минуту), проверьте образование капель, исследуя их в светлопольный микроскоп. Для этого заполните наконечник пипетки объемом 10 мкл образцом: примерно на 1/3 каплями с поверхности капельной фазы (белая фаза) и примерно на 2/3 с наложенной внешней средой для заполнения наконечника. Немедленно загрузите образец на предметное стекло с 8 камерами и исследуйте капли с помощью микроскопии в светлом поле с 4-кратным и 20-кратным увеличением, чтобы подтвердить загрузку капель элементами.
ПРИМЕЧАНИЕ: Важно, чтобы капли таким образом отсасывались в большем объеме окружающей среды.
- Инкубация
ПРИМЕЧАНИЕ: Теперь капли можно инкубировать в 2 мл пробирок с низким связыванием ДНК в стандартном увлажненном инкубаторе с температурой 37 °C и 5% CO2. Мы рекомендуем использовать эти трубки, так как они обладают оптимальными поверхностными свойствами для капельного культивирования.- С помощью иглы шприца (23G) осторожно и безопасно проколите крышку необходимого количества пробирок ДНК объемом 2 мл с низким связыванием. Это обеспечит свободную диффузию CO2/O2 и предотвратит испарение среды.
- Добавьте 1 мл наружной среды в каждую инкубационную пробирку. Капли следует инкубировать с объемом внешней среды не менее чем в 5 раз для обеспечения надлежащей буферизации. Объем добавляемой наружной среды может быть увеличен в зависимости от метаболизма применяемых клеток.
- Ресуспендируйте капли, образующиеся в перекрывающей среде, и разделите каждую продукцию в трех подготовленных инкубационных пробирках (по одной для каждого измерения в определенный момент времени). Капли тяжелые и быстро оседают, поэтому важно повторно суспендировать запас между каждым перемещением.
ПРИМЕЧАНИЕ: Количество инкубационных пробирок, на которые разделяются капельные продукты, может варьироваться, но мы рекомендуем разделять одну продукцию не более чем на 4 инкубационные пробирки, чтобы гарантировать, что каждый образец содержит достаточно событий для анализа. - Поместите пробирки в вертикальное положение в инкубатор на 2 ч, 4 ч или 6 ч инкубации после образования капель.
3. Анализ капель на последующих этапах
- Микроскопия
- После инкубации перенесите небольшое количество капель на предметное стекло микроскопа, как описано в шаге 2.2.7, и проанализируйте их с помощью светло-польной и флуоресцентной микроскопии с использованием стандартного флуоресцентного микроскопа с соответствующей конфигурацией лазера и фильтра.
ПРИМЕЧАНИЕ: Капли могут быть обнаружены с помощью светлопольной микроскопии. Окрашенные фиолетовым цветом Т-клетки могут быть обнаружены с помощью фильтра DAPI, сильно окрашенные красным цветом клетки JeKo-1 — с помощью фильтра APC, сигнал GzmB-FAM — с помощью фильтра FITC, а сигнал PI — с помощью фильтра PE. Сигнал ПИ, представляющий наибольший интерес, может быть трудно визуализировать с помощью микроскопии, поскольку ранние апоптотические клетки имеют более низкую пиковую эмиссию, чем поздние апоптотические клетки. Репрезентативные данные приведены на рисунке 4 .
- После инкубации перенесите небольшое количество капель на предметное стекло микроскопа, как описано в шаге 2.2.7, и проанализируйте их с помощью светло-польной и флуоресцентной микроскопии с использованием стандартного флуоресцентного микроскопа с соответствующей конфигурацией лазера и фильтра.
- Проточная цитометрия
- После инкубации каждую каплю повторно суспендируйте в перекрывающей среде и перенесите ее в пробирки FACS объемом 5 мл. Проанализируйте капли с помощью стандартного проточного цитометра, следуя общим рекомендациям, перечисленным ниже.
- Используйте проточный цитометр с соответствующей конфигурацией лазера и фильтра. При выбранной панели окрашивания клеток и анализе цветовая компенсация на используемом здесь проточном цитометре не требуется. Если применяются другие цвета или конфигурация применяемого проточного цитометра отличается, может потребоваться компенсация.
- Используйте FSC-H в качестве порогового триггера для исключения фонового шума от небольших масляных событий.
- Капли тяжелые и оседают на дне трубок FACS. Убедитесь, что SIP достигает капель. Перед сбором капли должны быть суспендированы по крайней мере в 5-кратном объеме внешнего буфера по отношению к каплям.
- События дроплетов регистрируются с высокой скоростью. Записывайте сигналы высоты интенсивности (H) для FSC и SSC и исследуемых флуорофоров, так как при анализе капель используются измерения высоты интенсивности. Корректируйте прибыль, чтобы иметь правильное разделение положительных и отрицательных событий.
Примечание: Мы использовали канал FITC для измерения сигнала GzmB, тихоокеанский синий канал для обнаружения окрашенных фиолетовым цветом Т-клеток, APC-канал для обнаружения далеко окрашенных красным JeKo-1 клеток и PE-канал для обнаружения сигнала PI. - Запишите достаточное количество событий для последующего анализа. Здесь мы зафиксировали 4,5 - 8,3 x 10 3 совпадающих капель за каждую временную точку.
- Промывайте проточный цитометр через SIP после каждого набора капель, используя стандартные чистящие и промывающие растворы. В конце эксперимента тщательно очистите проточный цитометр. Репрезентативные данные см. на рисунках 4 и 5 .
- После инкубации каждую каплю повторно суспендируйте в перекрывающей среде и перенесите ее в пробирки FACS объемом 5 мл. Проанализируйте капли с помощью стандартного проточного цитометра, следуя общим рекомендациям, перечисленным ниже.
- Анализ данных
- Рассчитайте процент Т-клеток, секретирующих GzmB, на основе процента коинкапсуляций GzmB-положительных Т-клеток и JeKo-1-клеток, нормализованных до жизнеспособности Т-клеток, определенной в популяциях только капель Т-клеток в рассматриваемый момент времени, следующим образом:
Капли Т-клетка+, Jeko-1+, GzmB+ / (Капли Т-клетки+, Jeko-1+ - Капли мертвые Т-клетки+, Jeko-1+)
где Капли мертвые Т-клетки+, Jeko-1+ оцениваются от гибели в каплях только с Т-клетками: Каплимертвые Т-клетки+, Jeko-1+ = КаплиТ-клетки+, Jeko-1+ x Капли мертвые Т-клетки+, Jeko-1- / КаплиTcell+, Jeko-1-. - Рассчитайте процент Т-клеток, которые убили свои целевые клетки, следующим образом:
Процентное содержание цитотоксических Т-клеток = (Наблюдаемая смерть - Фоновая смерть)/(100 - Фоновая смерть)
где фоновая смерть - это смерть, присутствующая внутри капель (Т-клетка+, Jeko-1+) в результате либо смерти, не связанной с убийством, либо смерти, произошедшей до инкапсуляции. - Оцените фоновую гибель от гибели клеток в каплях (Т-клетках+, Jeko-1-) и каплях (Т-клетки-, Jeko-1+):
Фоновая смертность = (1- (1- коэффициент смертности в капляхTcell-, Jeko-1+) x (1- коэффициент смертности в капляхTcell+, Jeko-1-)) x 100
где коэффициент смертности измеряется непосредственно в виде % PI-положительной капли в каплях, содержащих только Т-клетки, и каплях, содержащих только JeKo-1, соответственно. Все расчеты выполняются с выборкой чисел, зависящих от времени.
- Рассчитайте процент Т-клеток, секретирующих GzmB, на основе процента коинкапсуляций GzmB-положительных Т-клеток и JeKo-1-клеток, нормализованных до жизнеспособности Т-клеток, определенной в популяциях только капель Т-клеток в рассматриваемый момент времени, следующим образом:
Результаты
После трансдукции Т-клетки анализировали на экспрессию CAR с помощью проточной цитометрии с использованием анти-CD3 и анти-NGFR антител. Популяция CAR-Т-клеток впоследствии была обогащена с помощью анти-NGFR магнитных шариков, в результате чего чистота составила более 98% для обоих доноров (рис. 1A-B). Также количественно оценивали соотношение CD4/CD8 и фенотип памяти отсортированных CAR-клеток с использованием стандартной стратегии ворот с использованием антител CCR7 и CD45RA. Эти данные показывают, что соотношение CD4/CD8 используемых CAR-Т-клеток составляло 0,73, и клетки были в основном наивного фенотипа памяти (рисунок 1C-E).
CAR-Т-клетки и клетки JeKo-1 окрашивали фиолетовым и дальним красным красителями соответственно и инкапсулировали в капли DE50 вместе с реагентами анализа субстратом GzmB и PI (рис. 2). В качестве альтернативы, CAR-Т-клетки также могут быть помечены с помощью антител, таких как анти-CD4 или анти-CD8 (рис. 3), что позволяет более детально охарактеризовать Т-клетки. Каждую суспензию Т-клеток (CAR T или NTD) смешивали с суспензией клеток JeKo-1 непосредственно перед инкапсуляцией в соотношении эффектор: клетки-мишень 1:3 (0,5 x 106 Т-клеток и 1,5 x 106 JeKo-1). После инкапсуляции каждую каплю (CAR T-клетки + JeKo-1 и NTD + JeKo-1) делили на три инкубационные пробирки в течение 2 ч, 4 ч и 6 ч инкубации соответственно. Клетки инкубировали внутри капель при 37 °C при 5%CO2 , а затем анализировали с помощью микроскопии и проточной цитометрии в указанные временные точки.
Мы проводили флуоресцентную микроскопию капель двойной эмульсии через 4 ч инкубации (рис. 4). Интенсивность зеленого флуоресцентного сигнала (FITC) иллюстрирует уровень секретируемой GzmB активности CAR-Т-клеток или NTD внутри капель DE50. На рисунке 4B представлены фазово-контрастные и флуоресцентные микроскопические изображения одной GzmB-положительной капли, содержащей CAR-T-клетку и клетку-мишень JeKo-1, находящуюся в тесном контакте.
Затем капли DE50 были проанализированы с помощью проточной цитометрии для количественной оценки процентного соотношения CAR-Т-клеток с ранней секрецией GzmB и цитотоксической активностью в уничтожении клеток (рис. 5). Преинкубационное окрашивание клеток-мишеней JeKo-1 дальним красным красителем и эффекторных Т-клеток фиолетовым красителем перед инкапсуляцией способствовало идентификации трех различных популяций капель, содержащих клетки, поскольку клетки распределяются в каплях на основе распределения Пуассона. Идентифицированные популяции капель представляют собой капли только с Т-клетками, только с клетками JeKo-1, а также с Т-клетками и клетками JeKo-1 вместе (рис. 5A). Капли, инкапсулирующие Т-клетки совместно с клетками JeKo-1, были закрыты и проанализированы на наличие сигналов, указывающих на активность GzmB (рисунок 5B) и гибель клеток, на что указывает PI (рисунок 5C).
Инкапсуляция клеток в капли происходит в соответствии с распределением Пуассона, в результате чего получаются четыре различные популяции капель (рис. 6A). На рисунке 6B показан уровень GzmB-положительных капель во всех популяциях капель после 6-часовой инкубации капель, из которых можно определить процент спонтанных GzmB-секретирующих Т-клеток. Эти данные свидетельствуют о высокой специфичности метода, так как только CAR T-клетки секретируют GzmB.
Наконец, мы количественно оценили уровни GzmB и PI во временных точках после 2 ч, 4 ч и 6 ч совместной инкубации. Для справки, капли, содержащие только Т-клетки и только клетки JeKo-1, были проанализированы для изучения фоновой гибели клеток в каждой популяции (рис. 6C). Фоновая гибель клеток использовалась для определения процента живых GzmB-секретирующих и убивающих клетки Т-мишеней в популяции эффекторных клеток (рис. 7), как описано на шаге 3.3. CAR-Т-клетки от двух доноров продемонстрировали зависящее от времени увеличение как индуцированной клетками-мишенями секреции GzmB, так и активности по уничтожению клеток. Почти 36% живых CAR-Т-клеток от донора 1 и 31% от донора 2 секретировали GzmB после 6-часовой коинкапсуляции с клеткой-мишенью, что является значительным увеличением по сравнению с контрольными Т-клетками NTD (рис. 7A). Соответственно, около 21% CAR-T-клеток живого донора 1 и 22% CAR-T-клеток живого донора 2 были убиты клетками-мишенями, на что указывает положительный сигнал PI (рис. 7B). Процент CAR-Т-клеток, секретировавших GzmB, превышал процент убитых клеток-мишеней в каждый момент времени, что согласуется с ожидаемой последовательностью событий в GzmB-опосредованной цитотоксичности. В совокупности эти данные показывают, что представленный здесь метод позволяет охарактеризовать гетерогенность цитотоксичности отдельных Т-клеток в популяции клеток, а также сравнить различные популяции.
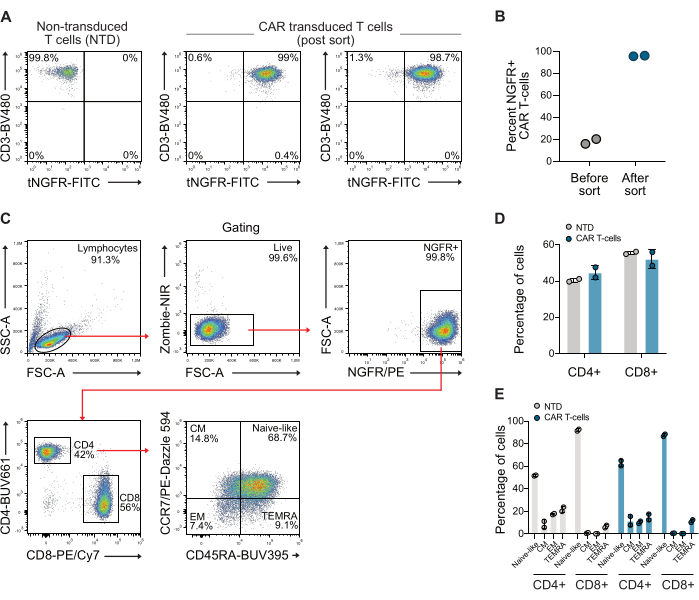
Рисунок 1: Репрезентативные графики проточной цитометрии после сортировки NGFR. (A) После примерно 10 дней экспансии CAR-T-клетки были отсортированы с использованием NGFR-специфичных микрогранул и магнитной сортировки, в результате чего популяция CAR-T-клеток составляла >98% CAR-T-клеток. (B) Количественная оценка CAR-Т-клеток от двух доноров, использованных в этом исследовании, до и после сортировки. (C) Стратегия гейтирования, используемая для изучения соотношения CD4/CD8 и фенотипа памяти Т-клеток. (D) Количественное определение CD4 и CD8 используемых Т-клеток. (E) Количественная оценка фенотипа памяти используемых Т-клеток. Сокращение: CM = центральная память, EM = эффекторная память, NTD = нетрансдуцированные, TEMRA = терминально дифференцированные эффекторные клетки. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
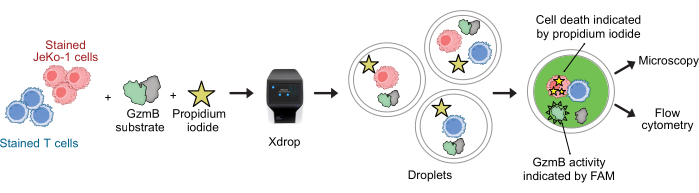
Рисунок 2: Рабочий процесс комбинированного анализа секреции GzmB и цитотоксичности с разрешением одиночных клеток в каплях. Перед инкапсуляцией в капли ДЭ клетки-мишень и эффекторные клетки окрашивают отдельно с использованием фиолетового и дальнего эритроцитарного красителя. С помощью микрофлюидного устройства и инкапсулирующего картриджа эффекторные клетки инкапсулируются совместно с клетками-мишенями в каплях вместе с клеточной средой, PI и пептидным субстратом GzmB, меченным FAM. Анализ и инкубация происходят внутри капель. Активность секретируемого GzmB проявляется в излучении зеленой флуоресценции, которая происходит после того, как GzmB расщепляет субстрат. Гибель клеток обозначается ИП. После инкубации капли DE50 анализируются с помощью микроскопии и/или проточной цитометрии. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
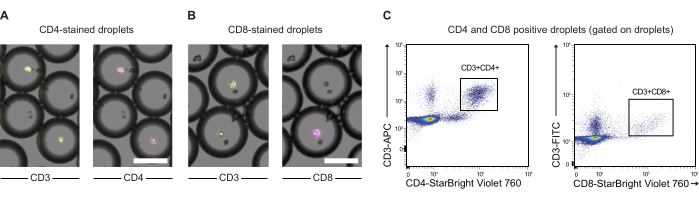
Рисунок 3: Анализ инкапсулированных в капли PBMC, предварительно меченных анти-CD3, анти-CD4 и анти-CD8 антителами. (A) Микроскопические изображения капель с инкапсулированными PBMC, предварительно меченными анти-CD3 (APC) и анти-CD4 (NIR) антителами. Масштабная линейка = 100 мкм. (B) Как (A), но с мечением CD3 (FITC) и анти-CD8 (NIR). Шкала = 100 мкм. (C) Анализ проточной цитометрии тех же капель. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
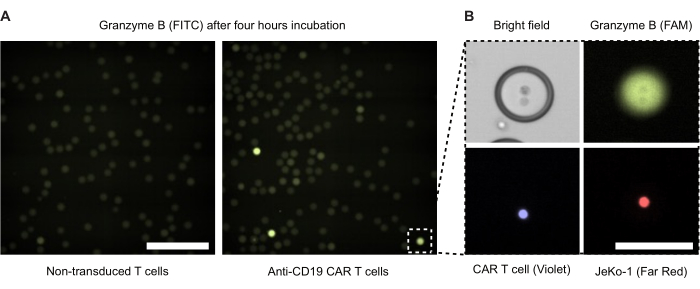
Рисунок 4: Микроскопические изображения капель с эффекторными клетками и клетками-мишенями. Изображения были сделаны после 4-часовой инкубации в стандартном инкубаторе с влажностью CO2 при температуре 37 °C и 5%CO2 . (A) Капли из образца с инкапсулированными NTD и JeKo-1 клетками (слева) или CAR-T-клетками и JeKo-1 (справа), визуализированными с помощью флуоресцентной микроскопии с использованием канала FITC для обнаружения GzmB-положительных (зеленых) капель. Масштабная линейка = 500 мкм. (B) Одна капля, визуализированная с помощью фазового контраста, FITC (GzmB), APC (JeKo-1 cell) и DAPI (CAR T cell). Масштабная линейка = 100 μм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
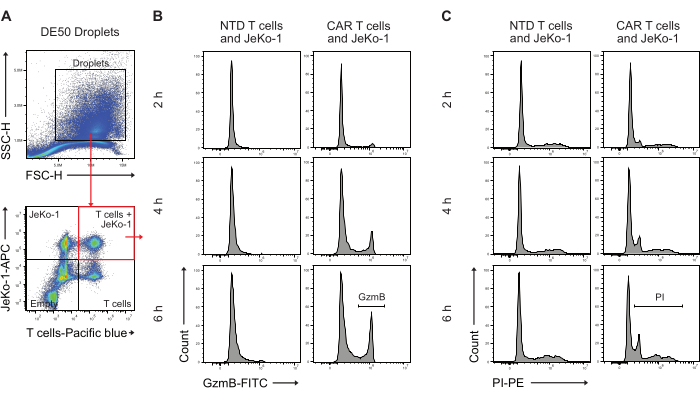
Рисунок 5: Стратегия стробирования для анализа капель с помощью проточной цитометрии после инкубации. (A) Стробирование проводилось путем прямого и бокового рассеяния для идентификации капель с последующим выбором ворот, содержащих капли. События за воротами представляют собой капли масла, образующиеся в качестве побочного продукта производства капель с двойной эмульсией. Последующий флуоресцентный анализ капель в каналах, соответствующих нанесенным клеточным красителям, идентифицирует четыре популяции капель: капли, содержащие как Т-клетки, так и клетки JeKo-1 (красный квадрат); капли только с клетками JeKo-1; капли только с Т-клетками; и пустые капли. (B) Репрезентативные гистограммы для сигнала GzmB в двойных положительных каплях во временных точках и между NTD и CAR-T-клетками. (C) Репрезентативные гистограммы для сигнала PI в двойных положительных каплях через временные точки и между NTD и CAR T-клетками. Все измерения капель выполняются как измерения интенсивности, высоты (H). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
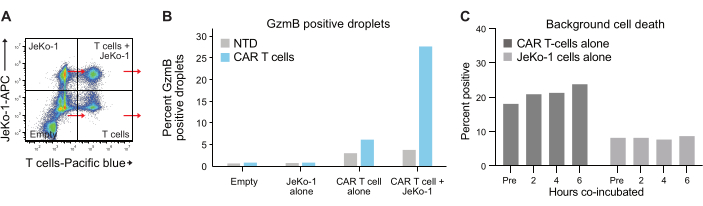
Рисунок 6: Внутренний контроль и референтные популяции. (A) Был выбран каждый из четырех квадрантов из рисунка 5A , и в каждом из них были измерены GzmB и PI. Этот тип количественной оценки позволяет измерять и вычитать фоновые сигналы до того, как будет проведен окончательный анализ эффективности Т-клеток. (B) График, показывающий частоту попадания GzmB-положительных капель после 6-часовой инкубации для каждой из четырех популяций капель, на примере образца донора 1 CAR-T. (C) Фоновую гибель клеток определяли в контрольных популяциях капель, содержащих только JeKo-1 и Т-клетки, в каждый измеряемый момент времени с использованием данных от донора 1. Фоновая гибель клеток используется для расчета частоты живых GzmB-секреций и эффекторных клеток, убивающих клетки, показанных на рисунке 7 и объясненных на шаге 3.3. Сокращения: Pre = инкапсуляция. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
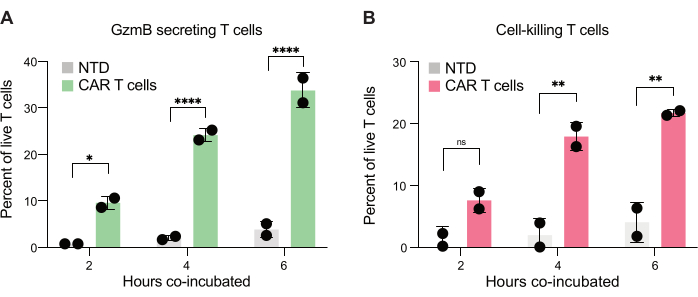
Рисунок 7: Количественное определение Т-клеток, способных секретировать GzmB и убивать клетки JeKo-1 в двойных положительных каплях. Двойные положительные капли, сторированные от двух доноров, были исследованы после 2, 4 и 6 часов совместной инкубации в каплях. (A) Частота Т-клеток, встречающихся с клетками-мишенями, секретирующих GzmB, и сравнение между NTD T-клетками и CAR-т-клетками. (B) Частота контакта Т-клеток-мишеней с клетками-мишенями, убивающих ко-инкапсулированную клетку-мишень. Сокращения: GzmB = гранзим B, NTD = нетрансдуцированный, PI = йодид пропидия. * = P-значение < 0,05, ** = P-значение < 0,005, **** = P-значение < 0,0001 с помощью двустороннего ANOVA. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Обсуждение
В данной работе мы представляем метод исследования цитотоксического потенциала Т-клеток на уровне отдельных клеток с использованием простого в использовании коммерчески доступного устройства микрожидкостей для оценки цитотоксического потенциала CD19-CD28-CD3z CAR-Т-клеток при совместной инкапсуляции с CD19-положительной линией клеток мантийноклеточной лимфомы JeKo-1.
В этом протоколе есть несколько важных шагов. Во-первых, мы рекомендуем удалять стимулирующие шарики из Т-клеток не менее чем за 48 часов до проведения любых анализов, чтобы избежать ложноположительных результатов. Во-вторых, эффективность трансдукции Т-клеток с помощью таких конструкций, как CAR или Т-клеточные рецепторы, может значительно варьироваться. Без последующей стадии очистки трансдуцированных Т-клеток интерпретация результатов может быть затруднена. В данном случае была использована чистая популяция CAR-T-клеток, и поэтому можно ожидать высокой степени уверенности при характеристике CAR-T-клеток как убийц или неубийц в каждый момент времени. В качестве альтернативы, мечение CAR флуоресцентным белком или генетической меткой может быть применено для обозначения клеток, которые являются CAR-положительными, а затем к ним можно приступать при анализе капель. Если используется маркировка, выбранные флуоресцентные молекулы не должны влиять на флуоресцентное излучение любого из других флуорофоров для анализа. Например, использование GFP-тегирования будет мешать субстрату GzmB, меченому FAM, примененному в проведенных здесь экспериментах, и поэтому не рекомендуется.
Основным преимуществом описанного здесь протокола является то, что сама генерация капель упрощена и автоматизирована. Однако для обеспечения инкапсуляции одиночных элементов важно, чтобы элементы тщательно ресуспендировали перед загрузкой картриджа. По этой причине при подготовке к зарядке картриджа рекомендуется работать в хорошем темпе. Аналогичное соображение относится и к добавлению субстрата GzmB, поскольку некоторые клетки являются высокосекретерами GzmB. Ресуспендирование ячеек также предотвратит закупорку микрофлюидных каналов небольших картриджей. Правильная инкапсуляция клеток легко проверяется с помощью микроскопии, как описано выше.
Поскольку капля инкапсулирует клеточную среду и удерживает клеточные продукты, секретируемые клетками, можно анализировать другие цитокины, антитела и соединения. Действительно, мы протестировали другие соответствующие молекулы, секретируемые иммунными клетками, такие как ИФН-γ и ФНО-α, которые требуют модификации текущего протокола. Для детектирования цитокинов может быть применен другой тип анализа, отличный от того, который мы используем здесь для GzmB, такой как генерация сэндвича ИФА на поверхности эффекторной клетки32. Кроме того, можно изменить окраску клеток и цвета анализа, например, карбоксифлуоресцеин сукцинимидиловый эфир (CFSE), но важно обеспечить минимальное или полное отсутствие просачивания через различные цветовые комбинации, как это было бы сделано при стандартной проточной цитометрии.
Кроме того, этот протокол не ограничивается анализом CAR-Т-клеток. Он также может быть расширен для изучения других взаимодействий Т-клеток/мишени или других иммунных клеток, таких как CAR-NK-клетки. Можно также предусмотреть более продвинутые эксперименты, например, мечение субпопуляций CD4 и CD8 Т-клеток дополнительными флуорофорами для выполнения более широкого функционального иммунофенотипирования. Действительно, здесь мы показываем, что CD4 и CD8 могут быть обнаружены в каплях, что позволяет дополнительно охарактеризовать эффекторные Т-клетки и их цитотоксическую способность.
Оптимизируя этот протокол, мы специально нацелились на то, чтобы он работал на стандартных приборах проточной цитометрии. Несмотря на то, что капельная проточная цитометрия не является сложной задачей, мы заметили, что образование масла может происходить, если проточный цитометр не промывается должным образом через определенные промежутки времени или в соответствии с рекомендациями здесь после анализа образцов в каждом временном интервале. Лучший протокол полоскания может быть специфичным для каждого отдельного проточного цитометра.
Одним из существенных преимуществ этого метода является его высокая пропускная способность, позволяющая проводить мониторинг эффекторно-опосредованной цитотоксичности одиночных клеток в отношении клеток-мишеней без необходимости обширного опыта или узкоспециализированного оборудования. Анализ может быть легко проведен с использованием существующих инструментов, таких как проточная цитометрия или микроскопия. Двойные эмульсионные капли также поддаются сортировке с помощью клеточных сортировщиков30,31, которые могут позволить выделить клетки со специфическими функциональными возможностями, например, CAR-Т-клетки с цитотоксическим потенциалом и без него, с последующим анализом транскриптома одиночных клеток.
Технология не лишена ограничений. В то время как некоторые клеточные линии переносят культуру в каплях в течение 24 ч и более, первичные клетки могут иметь значительно более низкую жизнеспособность через 24 ч. Это представляет собой временное ограничение для анализов в целом, но для текущего анализа заметная активность GzmB и уничтожения клеток могут наблюдаться в течение 4-6 часов, вероятно, потому, что маленькое отделение капель обеспечивает быстрое столкновение эффектора и клеток-мишеней. Кроме того, небольшой объем капель обеспечит быстрое наращивание концентрации до обнаруживаемых уровней секретируемого GzmB-расщепленного субстрата. Еще одним ограничением технологии является невозможность обнаружения серийного убийства эффекторными клетками при использовании стандартных проточных цитометров. Тем не менее, это может быть достижимо с помощью проточных цитометров или технологий цитометрии изображений, которые необходимо исследовать.
Адоптивный перенос CD19 CAR T-клеток показал замечательный успех в лечении пациентов с гематологическими злокачественными новообразованиями. Несмотря на это, у пациентов32 наблюдается большая вариабельность ответа и непредсказуемая токсичность, что может быть отчасти связано с гетерогенностью инфузионного продукта CAR-T. В результате растет интерес к анализу фенотипического состава и цитотоксической способности отдельных CAR-Т-клеток в популяции. Это будет особенно важно, поскольку CAR-терапия все чаще тестируется при аутоиммунных заболеваниях и других формах рака. Описанное здесь микрофлюидное устройство и протокол предлагают надежный и универсальный подход к изучению гетерогенности CAR-Т-клеток и других методов клеточной терапии.
Раскрытие информации
Авторы заявляют о следующих конкурирующих интересах: M.B.B. получала гонорары за консультационные услуги от Janssen, Roche и Kite/Gilead, не связанные с настоящей работой. D.L.P. и P.M. являются сотрудниками Samplix.
Благодарности
Авторы хотели бы поблагодарить членов и сотрудников CITCO и Samplix за полезные обсуждения и предложения. M.B.B. поддерживается стипендией для начинающих ученых-клиницистов от Фонда Лундбека (R381-2021-1278). Эта работа поддерживается за счет гранта на элитные исследования от Университетской больницы Оденсе. Кроме того, это исследование было поддержано грантом проекта Европейского инновационного совета 190144395 Samplix ApS.
Материалы
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| Blocker BSA (BSA) | Thermo Scientific | 37525 | |
| CellTrace Far Red Cell Proliferation Kit (far red fluorescent dye) | Invitrogen | C34564 | |
| CellTrace Violet Cell Proliferation Kit (violet fluorescent dye) | Invitrogen | C34557 | |
| DE Stabilizing Solution (stabilizing solution) | Samplix | REDIVSTABSOL1500 | |
| DPBS (dPBS) | Gibco | 14190-094 | |
| Dulbecco’s PBS (dPBS) | Capricorn Scientific | PBS-1A | |
| Dynabeads Human T-Activator (CD3/CD28 activation beads) | Gibco | 11132D | |
| Fetal Bovine Serum (FBS) | Capricorn Scientific | FBS-HI-12A | |
| Lenti-X Concentrator (PEG-based reagent) | Takara Bio | 631232 | |
| MACSelect LNGFR Microbeads (anti-NGFR magnetic beads) | Miltenyi Biotec | 130-091-330 | |
| OptiPrep density gradient medium (gradient medium) | Stemcell | 7820 | |
| Penicillin-Streptomycin (P/S) | Capricorn Scientific | PS-B | |
| Propidium iodide (PI) | Invitrogen | BMS500PI | |
| Recombinant Human IL-2 (IL-2) | Peprotech | 200-02 | |
| RPMI-1640 with Stable Glutamine (RPMI-1640) | Capricorn Scientific | RPMI-STA | |
| RPMI-1640 without L-Glutamine and phenol red | Gibco | 32404-014 | |
| Xdrop DE oil I (oil) | Samplix | REOILDEC1900 | |
| Xdrop Granzyme B substrate (GzmB substrate) | Samplix | REGRB100 | |
| Zombie-NIR viability dye (viability dye) | BioLegend | 423106 | |
| Plasticware etc. | |||
| 8-chamber glass slide | Chemometec | 942-0003 | |
| Cell culture plate, 12 well | TH Geyer | 7696791 | |
| DNA LoBind tube, 2 mL (DNA tube) | Eppendorf | 30108078 | |
| Eppendorf tube, 1.5 mL (1.5 mL tube) | Eppendorf | 30108051 | |
| Falcon tube, 15 mL (15 mL tube) | TPP | 91015 | |
| Falcon tube, 5 mL (5 mL tube) | Falcon (VWR) | 734-0443 | |
| Green cell suspension flasks for cell incubations (T75 flask) | Sarstedt | 148.19.22 | |
| Green cell suspension plates for cell incubations (96 well plate) | Sarstedt | 148.32.20 | |
| LS Separation Columns (separation column) | Miltenyi Biotec | 130-042-401 | |
| Xdrop DE Gaskets (gaskets) | Samplix | #GADEA100 | |
| Xdrop DE50 Cartridge (encapsulation cartridge) | Samplix | #CADE50A100 | |
| Antibodies | |||
| anti-CCR7 PE-Dazzle 594 | BioLegend | 353236 | |
| anti-CD19 CAR FMC63 Idiotype Antibody, PE | Miltenyi Biotec | 130-127-342 | |
| anti-CD3 APC | Biolegend | 300439 | |
| anti-CD3 BV480 | BD Biosciences | 566105 | |
| anti-CD3 FITC | BD Biosciences | 345763 | |
| anti-CD4 BUV661 | BD Biosciences | 612962 | |
| anti-CD4 StarBright Violet 760 | Bio-Rad | MCA1267SBV760T | |
| anti-CD45RA BUV395 | BD Biosciences | 740298 | |
| anti-CD8 PE-Cy7 | BioLegend | 344712 | |
| anti-CD8 StarBright Violet | Bio-Rad | MCA1226SBV760 | |
| anti-NGFR FITC | BioLegend | 345106 | |
| anti-NGFR PE | BioLegend | 345106 | |
| Cells | |||
| JeKo-1 Mantle-cell lymphoma cell-line (JeKo-1) | ATCC | CRL-3006 | |
| Primary peripheral blood mononuclear cells (PBMCs) | |||
| Equipment | |||
| Countess 3 Automated Cell Counter | Thermo Fisher Scientific | A50298 | |
| DynaMag-2 Magnet | Invitrogen | 12321D | |
| NovoCyte Quanteon Flow Cytometer (flow cytometer) | Agilent | 2010011AA | |
| Xdrop (microfluidics device) | Samplix | IN00110-EU |
Ссылки
- Pasqui, D. M., Latorraca, C. D. O. C., Pacheco, R. L., Riera, R. CAR-T cell therapy for patients with hematological malignancies. A systematic review. Eur J Haematol. 109 (6), 601-618 (2022).
- Krejcik, J., et al. Harnessing the immune system to fight multiple myeloma. Cancers. 13 (18), 4546 (2021).
- Tokarew, N., Ogonek, J., Endres, S., von Bergwelt-Baildon, M., Kobold, S. Teaching an old dog new tricks: next-generation CAR T cells. British J Cancer. 120 (1), 26-37 (2019).
- Bogetofte Barnkob, M., Vitting-Seerup, K., Rønn Olsen, L. Target isoforms are an overlooked challenge and opportunity in chimeric antigen receptor cell therapy. Immunother Adv. 2 (1), ltac009 (2022).
- Daei Sorkhabi, A., et al. The current landscape of CAR T-cell therapy for solid tumors: Mechanisms, research progress, challenges, and counterstrategies. Front Immunol. 14, 1113882 (2023).
- . Considerations for the Development of Chimeric Antigen Receptor (CAR) T Cell Products Available from: https://www.fda.gov/regulatory-information/search-fda-guidance-documents/considerations-development-chimeric-antigen-receptor-car-t-cell-products (2024)
- Roddie, C., O'Reilly, M., Dias Alves Pinto, J., Vispute, K., Lowdell, M. Manufacturing chimeric antigen receptor T cells: issues and challenges. Cytotherapy. 21 (3), 327-340 (2019).
- Wang, L., et al. Improvement of in vitro potency assays by a resting step for clinical-grade chimeric antigen receptor engineered T cells. Cytotherapy. 21 (5), 566-578 (2019).
- Burrows, S. R., Fernan, A., Argaet, V., Suhrbier, A. Bystander apoptosis induced by CD8+ cytotoxic T cell (CTL) clones: implications for CTL lytic mechanisms. Int Immunol. 5 (9), 1049-1058 (1993).
- Gattinoni, L., et al. Acquisition of full effector function in vitro paradoxically impairs the in vivo antitumor efficacy of adoptively transferred CD8+ T cells. J Clin Invest. 115 (6), 1616-1626 (2005).
- Chen, G. M., et al. Integrative bulk and single-cell profiling of premanufacture T-cell populations reveals factors mediating long-term persistence of CAR T-cell therapy. Cancer Dis. 11 (9), 2186-2199 (2021).
- Frazer, G. L., Gawden-Bone, C. M., Dieckmann, N. M. G., Asano, Y., Griffiths, G. M. Signal strength controls the rate of polarization within CTLs during killing. J Cell Biol. 220 (10), e202104093 (2021).
- Hermans, I. F., et al. The VITAL assay: a versatile fluorometric technique for assessing CTL- and NKT-mediated cytotoxicity against multiple targets in vitro and in vivo. J Immunol Meth. 285 (1), 25-40 (2004).
- Zaritskaya, L., Shurin, M. R., Sayers, T. J., Malyguine, A. M. New flow cytometric assays for monitoring cell-mediated cytotoxicity. Expert Rev Vaccines. 9 (6), 601-616 (2010).
- Piccinini, C., et al. In vitro CAR-T cell killing: validation of the potency assay. Cancer Immunol Immunother CII. 73 (9), 168 (2024).
- Martinez, E. M., et al. High-throughput flow cytometric method for the simultaneous measurement of CAR-T cell characterization and cytotoxicity against solid tumor cell lines. SLAS Disc Adv Life Sci. 23 (7), 603-612 (2018).
- Jedema, I., van der Werff, N. M., Barge, R. M. Y., Willemze, R., Falkenburg, J. H. F. New CFSE-based assay to determine susceptibility to lysis by cytotoxic T cells of leukemic precursor cells within a heterogeneous target cell population. Blood. 103 (7), 2677-2682 (2004).
- Liu, L., et al. Cellular and molecular imaging of CAR-T cell-based immunotherapy. Adv Drug Delivery Rev. 203, 115135 (2023).
- Liadi, I., et al. Defining potency of CAR+ T cells: Fast and furious or slow and steady. Oncoimmunology. 8 (10), e1051298 (2019).
- Xhangolli, I., et al. Single-cell analysis of CAR-T cell activation reveals a mixed TH1/TH2 response independent of differentiation. Genom Proteom Bioinfo. 17 (2), 129-139 (2019).
- Zhou, Y., et al. Evaluation of single-cell cytokine secretion and cell-cell interactions with a hierarchical loading microwell chip. Cell Rep. 31 (4), 107574 (2020).
- LaBelle, C. A., Zhang, R. J., Hunsucker, S. A., Armistead, P. M., Allbritton, N. L. Microraft arrays for serial-killer CD19 chimeric antigen receptor T cells and single cell isolation. Cytometry J Int Soc Anal Cytol. 103 (3), 208-220 (2023).
- Hellmann, M. J., et al. Heterogeneously deacetylated chitosans possess an unexpected regular pattern favoring acetylation at every third position. Nat Comm. 15 (1), 6695 (2024).
- Wong, K. U., et al. Assessment of chimeric antigen receptor T cytotoxicity by droplet microfluidics in vitro. Antibody Therapeut. 5 (2), 85-99 (2022).
- Antona, S., Platzman, I., Spatz, J. P. Droplet-based cytotoxicity assay: Implementation of time-efficient screening of antitumor activity of natural killer cells. ACS omega. 5 (38), 24674-24683 (2020).
- Subedi, N., et al. An automated real-time microfluidic platform to probe single NK cell heterogeneity and cytotoxicity on-chip. Sci Rep. 11 (1), 17084 (2021).
- Zhang, Y., et al. Enhanced CRISPR/Cas12a-based quantitative detection of nucleic acids using double emulsion droplets. Biosens Bioelect. 257, 116339 (2024).
- Kochenderfer, J. N., et al. Construction and preclinical evaluation of an anti-CD19 chimeric antigen receptor. J Immunother. 32 (7), 689-702 (2009).
- Michaels, Y. S., et al. Precise tuning of gene expression levels in mammalian cells. Nat Comm. 10 (1), 818 (2019).
- Yuan, Y., et al. Droplet encapsulation improves accuracy of immune cell cytokine capture assays. Lab on a Chip. 20 (8), 1513-1520 (2020).
- Brower, K. K., et al. Double emulsion flow cytometry with high-throughput single droplet isolation and nucleic acid recovery. Lab on a Chip. 20 (12), 2062-2074 (2020).
- Kirouac, D. C., et al. Deconvolution of clinical variance in CAR-T cell pharmacology and response. Nat Biotechnol. 41 (11), 1606-1617 (2023).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены