Method Article
Ensayo de citotoxicidad basado en gotas para evaluar las células T receptoras de antígenos quiméricos a nivel de una sola célula
En este artículo
Resumen
Aquí, describimos un método para crear gotas de doble emulsión que encapsulan una célula T y una célula diana cancerosa para examinar la muerte celular a nivel de una sola célula. Este método permite la cuantificación dual de las moléculas citotóxicas y la apoptosis de las células diana dentro de una gran población de células T.
Resumen
La evaluación del potencial citotóxico de las terapias basadas en linfocitos T, como los tratamientos con linfocitos T con receptor de antígeno quimérico (CAR), es fundamental para evaluar su eficacia y es un requisito previo para la aplicación clínica. Sin embargo, los ensayos de citotoxicidad tradicionales se realizan como ensayos masivos y no proporcionan información detallada sobre la heterogeneidad funcional de la población de células T con CAR. En este estudio, describimos un método basado en gotas de doble emulsión que permite la coencapsulación a gran escala de células CAR-T efectoras individuales con células diana únicas, al tiempo que permite la cuantificación dual de ambas moléculas efectoras citotóxicas de las células T y la muerte celular de la célula diana. El protocolo describe un método para la generación y purificación de células CAR-T específicas de CD19, seguido de su coencapsulación en gotas con la línea celular CD19+ JeKo-1, junto con reactivos para visualizar la secreción de moléculas efectoras citotóxicas (Granzima B) y la muerte celular (utilizando yoduro de propidio, PI). Demostramos cómo generar gotas que contienen CAR-T individuales y células diana utilizando un dispositivo de microfluídica disponible en el mercado para generar gotas de emulsión dobles. Además, proporcionamos ejemplos de cómo analizar la diversidad funcional de las células CAR-T en gotitas utilizando equipos de citometría de flujo estándar. Finalmente, describimos brevemente la cinética temporal y la heterogeneidad de la muerte de células T con CAR específicas de CD19. Si bien este método se centra en la muerte celular después de un ataque de células T con CAR, también se adapta para examinar otros tipos de células T, células inmunitarias citotóxicas y funciones de células efectoras, como la secreción de citocinas.
Introducción
La terapia de células T con receptor de antígeno quimérico (CAR) es un campo de inmunoterapia contra el cáncer celular en rápida expansión que ha demostrado ser eficaz contra varias formas de leucemia, linfoma1 y mielomamúltiple 2. Las células CAR-T se generan modificando las células T con un receptor de antígeno sintético que puede unirse selectivamente a proteínas de superficie como CD19 o el antígeno de maduración de células B (BCMA), expresadas en células B, células plasmáticas y sus contrapartes malignas. Los avances recientes en el diseño de CAR han permitido dirigirse a múltiples antígenos simultáneamente3, basándose en múltiples señales de entrada, o uniéndose exclusivamente a antígenos asociados a tumores, como isoformas de proteínas específicas4. Además, se están probando varios CAR contra dianas de cánceres no hematológicos5.
Los ensayos de citotoxicidad son esenciales tanto para el desarrollo de CAR como para el control de calidad antes de que se liberen los productos clínicos 6,7,8. Sin embargo, la mayoría de los ensayos actuales dependen de poblaciones masivas de células CAR-T efectoras añadidas en exceso a las líneas celulares cancerosas, lo que puede dar lugar a resultados falsos positivos debido a los efectos de los espectadores9 y dar lugar a una mala correlación entre los resultados in vitro e in vivo 10. Dado que la proliferación de linfocitos T y su persistencia a largo plazo dependen de las señales recibidas durante los eventos de activación inicial11,12, es de gran interés examinar de cerca los eventos citotóxicos a nivel de una sola célula.
Para abordar las limitaciones de las metodologías masivas, los estudios de citotoxicidad a nivel de una sola célula se pueden realizar utilizando citometría de flujo 13,14,15,16,17 y ensayos basados en imágenes18. Sin embargo, a pesar de que la citometría de flujo estándar ofrece una resolución de una sola célula para cuantificar y caracterizar tanto las células efectoras como las diana, no puede determinar directamente la capacidad citotóxica específica de las células CAR-T individuales hacia las células diana. Además, la obtención de imágenes de células CAR-T individuales que interactúan con sus respectivos objetivos a granel es un desafío y requiere mucho tiempo debido a la motilidad constante de las células. Para abordar estos desafíos, se han desarrollado nuevas herramientas para el análisis de células individuales que se basan en el emparejamiento de células efectoras y diana en espacios espacialmente confinados utilizando matrices de micropocillos19,20,21, matrices de microbalsas 22, microchips23 y microfluídica de gotas 24,25,26. Estas herramientas proporcionan una sensibilidad de medición mejorada, lo que permite la investigación de menos células utilizando volúmenes de reactivos reducidos. Sin embargo, siguen existiendo varios desafíos, como el emparejamiento eficiente de células, el número limitado de muestras que se pueden analizar, la dependencia únicamente del análisis basado en imágenes y las dificultades para recuperar poblaciones de células viables para análisis posteriores.
Aquí, utilizamos un dispositivo de microfluídica disponible comercialmente que permite un enfoque masivamente simplificado de la microfluídica basada en gotas. Este dispositivo permite realizar análisis y ensayos avanzados de una sola célula utilizando gotas de doble emulsión (DE) altamente estables. En comparación con los ensayos tradicionales de micropocillos y microfluídica de gotas, el protocolo descrito aquí no requiere una amplia experiencia en microfludic.
Las gotas de DE son pequeños compartimentos esféricos compuestos por una capa de aceite con un núcleo acuoso suspendido en una solución acuosa. La gota acuosa contiene y retiene células, secretoma celular, medio celular y reactivos de ensayo, lo que permite realizar ensayos complejos dentro de cada compartimento. Con el dispositivo de microfluídica, se generan gotas de DE con un volumen establecido (aproximadamente 100 pL) adecuado para ensayos de interacción de una sola célula o célula a célula de mamíferos, que pueden ser generados en cantidades muy altas (aproximadamente 750.000 gotas por muestra) y en un corto período de tiempo (aproximadamente 10 minutos para 8 muestras) por usuarios generales de laboratorio sin conocimientos especializados en microfluídica. Las gotas generadas pueden suspenderse en el medio celular, lo que permite la difusión trans-cáscara de O2 y CO2 y la amortiguación del interior, mientras que al mismo tiempo retiene moléculas hidrófilas y más grandes, como las moléculas efectoras secretadas por células. De este modo, las células examinadas están adecuadamente amortiguadas, lo que permite examinar a lo largo del tiempo las interacciones célula-célula y la dinámica temporal. A diferencia de las gotas de emulsión individuales (por ejemplo, gotas de agua en aceite)27, las gotas de DE son estructuras robustas que no se fusionan ni se fusionan en las incubadoras de células estándar. Debido a su estabilidad y a una fase externa acuosa, también son compatibles con los procedimientos de análisis posteriores, como la citometría de flujo tradicional. Por lo tanto, estas gotas de picolitros generadas por el dispositivo de microfluídica se pueden utilizar para el análisis de una sola célula de alto rendimiento de la función celular para dilucidar la heterogeneidad funcional oculta en los ensayos a granel tradicionales.
Aquí, describimos un protocolo que utiliza gotas de DE para examinar el potencial citotóxico de los CAR específicos de CD19 hacia las células de linfoma. Nuestro protocolo permite el análisis de una sola célula de la matanza de objetivos y la secreción de Granzima B (GzmB) y revela que aproximadamente el 20% de las células CAR-T examinadas aquí tienen un potencial de muerte inmediato.
Protocolo
Las células CAR-T utilizadas en este estudio se generaron por transducción lentiviral de células T primarias con una construcción CAR CD19scFv-CD28-CD3ζ-tNGFR en un laboratorio certificado de bioseguridad OGM clase 2 y se desclasificaron después de 4 días de acuerdo con el estándar del instituto. Las células T purificadas procedían de material sobrante desechado de donaciones de sangre anónimas y estaban exentas de otras aprobaciones éticas según la legislación danesa.
1. Generación de células CAR-T
NOTA: El nombre de los reactivos utilizados a continuación utiliza nombres genéricos y abreviados. El nombre comercial completo se puede encontrar entre paréntesis en la Tabla de Materiales.
- Activación, transducción y expansión de linfocitos T
NOTA: La expresión estable de las células T con CAR CD19 se logró mediante la transducción lentiviral de células T humanas primarias aisladas de células mononucleares frescas de sangre periférica (PBMC) utilizando un kit de aislamiento de células T de selección negativa. El CAR anti-CD19 utilizado es una construcción de segunda generación compuesta por un fragmento variable de cadena simple (scFv) FMC63, un dominio transmembrana y bisagra CD28, un dominio coestimulador CD28, un dominio de activación CD3ζ28 y una versión truncada del receptor del factor de crecimiento nervioso (tNGFR) para la monitorización y el enriquecimiento de las células que expresan CAR29. El plásmido vector de transferencia se sintetizó de novo y el lentivirus de tercera generación se fabricó combinándolo con pMDLg/pRRE (plásmido Addgene #12251), pRSV-Rev (plásmido Addgene #12253) y pMD2.G (plásmido Addgene #12259)30. Los tres últimos plásmidos fueron un regalo de Didier Trono. El virus crudo se concentró utilizando un reactivo basado en PEG, y la multiplicidad de infección (MOI) se determinó mediante la transducción de células SUP-T1 y la medición de tNGFR por citometría de flujo según el protocolo estándar31.- Transfiera 2 x 106 células T humanas primarias a una placa de cultivo de 12 pocillos y estimulícelas con perlas recubiertas de CD3/CD28 en una proporción de 1:1 perla a célula en 1 mL de medio RPMI-1640 completo (10% de suero bovino fetal inactivado por calor, 1% de penicilina/estreptomicina) suplementado con 100 unidades/mL de interleucina-2 humana recombinante (IL-2). Incubar las células a 37°C en una incubadora humidificada con 5% de CO2 durante 24 h.
- Agregue partículas lentivirales a las células T activadas a un MOI de 5-10. Mezclar suavemente e incubar las células durante 72 h. Incluya las células T no transducidas (NTD) como control negativo.
- En el día 3 después de la transducción, retire las perlas de activación de CD3/CD28 recolectando las células T en un tubo de 1,5 ml y colocando el tubo en un soporte magnético durante 1-2 minutos. Transfiera el sobrenadante que contiene las células a un nuevo tubo de 1,5 mL.
- Realice un recuento de células utilizando un contador de células automatizado y ajuste la densidad de células a 1 x 106 células/mL en un medio RPMI-1640 completo suplementado con 100 U/mL de IL-2. Continúe expandiendo las células T hasta que el recuento total de células T con CAR alcance al menos 1,5 x 106 (generalmente alrededor de 6 x 106 células T en total) en la suspensión antes de continuar con el enriquecimiento con NGFR (ver más abajo).
- Controle el recuento de células cada dos días y ajuste la concentración a 1 x 106 células/mL añadiendo medio fresco suplementado con 100 unidades/mL de IL-2 para garantizar un estado celular óptimo durante la expansión.
- Enriquecimiento de linfocitos T que expresan CAR
- Transfiera 6 x 10,6 o más células T transducidas a un tubo de 15 mL y centrifugue a 300 x g durante 5 min. Vuelva a suspender el pellet celular en 320 μL de PBS suplementado con albúmina sérica bovina (BSA) al 0,5% para producir PBSA y agregue 40 μL de perlas magnéticas anti-NGFR. Mezclar bien e incubar en hielo durante 15 min.
NOTA: Este protocolo supone una eficiencia de transducción de aproximadamente el 25%, lo que da como resultado >1,5 x 106 células CAR-T después del enriquecimiento. No recomendamos comenzar con menos de 6 x 106 células, ya que esto puede resultar en una recuperación deficiente de las células CAR-T. - Agregue 1640 μL de PBSA para llevar el volumen final a 2 mL, luego proceda con la separación magnética usando columnas de separación de acuerdo con las instrucciones del fabricante.
- Transfiera 6 x 10,6 o más células T transducidas a un tubo de 15 mL y centrifugue a 300 x g durante 5 min. Vuelva a suspender el pellet celular en 320 μL de PBS suplementado con albúmina sérica bovina (BSA) al 0,5% para producir PBSA y agregue 40 μL de perlas magnéticas anti-NGFR. Mezclar bien e incubar en hielo durante 15 min.
- Detección de la expresión de CAR por citometría de flujo
NOTA: Recomendamos determinar el porcentaje de células que expresan CAR y su viabilidad en este punto, para asegurarse de que las células sean adecuadas antes de realizar el ensayo a continuación. La relación CD4 y CD8 y el fenotipo de memoria también se pueden determinar en este punto. Consulte la Figura 1 para ver gráficos representativos.- Transfiera 2,5 x 105 células T de cultivos transducidos y no transducidos a tubos de citometría de flujo separados. Lavar las celdas 2 veces con 200 μL de PBS, centrifugando a 300 x g durante 5 minutos después de cada lavado.
- Prepare una mezcla de anticuerpos que contenga anticuerpos anti-CD19 CAR FMC63 Idiotipo PE, anti-CD3 BV480 y anti-NGFR FITC, cada uno diluido 1:100 en PBS. Vuelva a suspender las células en 50 μL de la mezcla de anticuerpos e incube a 4 °C durante 20 min.
- Lavar las celdas 2 veces con 200 μL de PBS, centrifugando a 300 x g durante 5 minutos después de cada lavado. Vuelva a suspender las células en 200 μL de PBS y analice mediante citometría de flujo.
2. Generación de gotas que encapsulan células T y células diana
NOTA: Antes de la encapsulación, las células T y las células JeKo-1 se tiñen con diferentes tinciones celulares para controlar el contenido celular de las gotas. Las células se encapsulan con reactivos de ensayo y se incuban durante 2-6 h antes de que las gotas se analicen en el citómetro de flujo (ver Figura 2).
- Tinción de células antes de la encapsulación
- Prepare soluciones de trabajo de dos tintes fluorescentes (utilizamos un tinte violeta y un tinte rojo lejano) diluyendo las soluciones madre (preparadas de acuerdo con las instrucciones del fabricante) 1:5,000 en dPBS.
- Para cada donante, transfiera 2,5 x 106 células CAR T, 2,5 x 106 NTD T y 15 x 106 células JeKo-1 a tubos de centrífuga separados (tubos de 15 ml o 50 ml) y centrifugar a 300 x g durante 5 minutos. En este experimento, se encapsularon 0,5 x 106 células efectoras con 1,5 x 106 células objetivo para cada muestra preparada.
NOTA: El número de células transferidas aquí está destinado a muestras de encapsulación 4x con cada tipo de célula efectora para cada donante. Reduzca el número de células y reactivos en función del número de muestras necesarias. Además, el número exacto de células por muestra se puede escalar de acuerdo con las necesidades experimentales. - Retire el sobrenadante y vuelva a suspender los gránulos de células efectoras en la solución de trabajo 1:5.000 del colorante fluorescente violeta y los gránulos de células diana (JeKo-1) en la solución de trabajo 1:5.000 del tinte fluorescente rojo lejano. Vuelva a suspender bien las células con una pipeta y hasta una concentración celular de 1 x 106 células/ml de solución de tinción.
- Incubar las células durante 20 minutos en una incubadora deCO2 humidificada a 37 °C. Centrifugar las células a 300 x g durante 5 min, eliminar el sobrenadante y volver a suspender en 15 mL de medio RPMI-1640 completo para lavar las células.
- Repita el lavado y centrifugar a 300 x g durante 5 min. Retire el sobrenadante y vuelva a suspender los gránulos de células efectoras en 225 μL de RPMI-1640 completo y los gránulos de células objetivo en 450 μL de RPMI-1640 completo.
- Añadir 30 μL de un medio de gradiente a las suspensiones de células efectoras y 60 μL del mismo medio de gradiente a las suspensiones de células objetivo. Vuelva a suspender la solución madre del medio de gradiente mucho antes de pipetear.
- Añadir 15 μL de un stock de PI de 20 μg/mL a las suspensiones de células efectoras y 30 μL de stock de PI a las suspensiones de células objetivo. La concentración final de PI será finalmente de 1 μg/mL después de que se haya añadido el sustrato Granzyme B (GzmB) a continuación.
- Prepare una dilución 1:10 de sustrato de GzmB en RPMI-1640 completo y agregue 30 μL de esta dilución de sustrato de GzmB a la suspensión de la célula efectora y 60 μL de la misma a las suspensiones de la célula objetivo. Mezclar bien con la pipeta.
NOTA: El volumen total de los reactivos añadidos a cada gránulo de célula efectora debe ser ahora de 300 μL y de 600 μL a los gránulos de célula objetivo. La concentración del medio de gradiente en estas soluciones debe ser del 10%, la concentración de PI de 1 μg/mL y la concentración del sustrato de GzmB de 1:100. - Marcaje alternativo con anticuerpos CD3, CD4 y CD8
NOTA: En algunos casos, puede ser de interés etiquetar aún más las células efectoras antes de la coencapsulación con las células objetivo. Aquí mostramos una prueba de principio para este tipo de etiquetado utilizando anticuerpos CD3, CD4 y CD8 y PBMC (ver Figura 3).- Transfiera 2.0 x 106 PBMC a un tubo de 1.5 mL y gire las celdas hacia abajo durante 5 min a 300 x g. Retirar el sobrenadante y resuspender el pellet celular en 200 μL de dPBS con 0,5% de BSA. Divida el contenido en dos tubos de 2 ml.
- Añada 5 μL de anti-CD3-APC y 5 μL de anti-CD4-StarBright Violet 760 a uno de los tubos. Añada 20 μL de anti-CD3-FITC y 5 μL de anti-CD8-StarBright Violet 760 al otro tubo.
- Mezclar bien e incubar durante 30 minutos a temperatura ambiente en la oscuridad. Agregue 1 mL de tampón de lavado a las celdas, centrifugue a 300 x g durante 5 min, retire el sobrenadante y vuelva a suspender los gránulos de la celda en 1 mL de dPBS con 0.5% de BSA.
- Centrifugar las células a 300 x g durante 5 min, retirar el sobrenadante y resuspender los gránulos de las células en 150 μL de RPMI sin rojo fenol y medio de gradiente del 10%. Encapsule como se describe en el paso 2.2 utilizando RPMI sin rojo de fenol, solución estabilizadora al 33% para las células y medio de gradiente al 10% como medio externo.
- Encapsulación de las células
- Precaliente un cartucho de encapsulación y una solución estabilizadora a temperatura ambiente antes de la encapsulación. Prepare un stock de medio externo que consista en medio RPMI-1640 completo, solución estabilizadora al 33% para celdas y medio de gradiente al 10%.
- Para cada muestra de encapsulación, prepare una solución de muestra celular con células efectoras diana mixtas. Vuelva a suspender las soluciones celulares bien preparadas con una pipeta y mezcle 65 μL de suspensión de células efectoras preparadas con 65 μL de suspensión de células diana preparadas en tubos de 1,5 mL (ambos preparados en el paso 2.1).
- Proceda inmediatamente a cargar los pocillos indicados del cartucho de encapsulación con reactivos en el siguiente orden para garantizar una encapsulación adecuada. Cargue un conjunto de pocillos por cada muestra de encapsulación preparada.
Pocillo #A: 400 μL de medio externo.
Pocillo #D: 40 μL de medio exterior en el estante pequeño.
Pocillo #C: 120 μL de solución premezclada con células diana (JeKo-1) y células efectoras. Vuelva a suspender bien las células con una pipeta justo antes de cargarlas.
Pozo #B: 250 μL de aceite.
NOTA: Cada cartucho se puede cargar con hasta 8 muestras para encapsular en paralelo. - Proceda inmediatamente con el sellado de la junta y cargue el cartucho en el instrumento evitando inclinar, sacudir o golpear el cartucho cargado. Selle con cuidado la junta en el cartucho.
- Transfiera con cuidado el cartucho al dispositivo de microfluídica e inicie la encapsulación como se describe en el manual del usuario.
- Las gotas generadas tienen densidades más altas que el medio exterior circundante y se sedimentarán rápidamente en el fondo del pozo de recolección (pozo #D). Recoja cada producción de gotas (todas las gotas y el medio externo circundante) resuspendiendo las gotas sedimentadas del pozo #D en el medio de recubrimiento y transfiriéndolas a un tubo de ADN de baja unión de 2 ml con tapa. Lave el #D de pozo con los medios exteriores restantes de Well #A para recoger las gotas restantes.
- Cuando las gotas se hayan sedimentado en los tubos de recolección (toma aproximadamente 1 minuto), verifique la producción de gotas examinándolas con un microscopio de campo claro. Para ello, llene una punta de pipeta de 10 μL con una muestra: aprox. 1/3 con gotas de la superficie de la fase de gota (fase blanca) y aprox. 2/3 con el medio exterior superpuesto para rellenar la punta. Cargue inmediatamente la muestra en un portaobjetos de vidrio de 8 cámaras y examine las gotas mediante microscopía de campo claro con aumentos de 4x y 20x para confirmar la carga de gotas con las células.
NOTA: Es importante que las gotas de esta manera se aspiren en un mayor volumen del medio circundante.
- Incubación
NOTA: Las gotas ahora se pueden incubar en 2 mL de tubos de baja unión de ADN en una incubadora estándar humidificada a 37 °C y 5% de CO2. Recomendamos el uso de estos tubos, ya que tienen propiedades superficiales óptimas para el cultivo de gotas.- Con una aguja de jeringa (23 G), perfore con cuidado y seguridad la tapa del número requerido de tubos de ADN de baja unión de 2 ml. Esto asegurará la difusión libre de CO2/O2 al tiempo que evitará la evaporación del medio.
- Agregue 1 mL de medio exterior a cada tubo de incubación. Las gotas deben incubarse con al menos 5 veces el volumen de medios externos para garantizar una amortiguación adecuada. El volumen del medio exterior añadido puede aumentarse en función del metabolismo de las células aplicadas.
- Vuelva a suspender las gotas generadas en el medio de superposición y divida cada producción en tres de los tubos de incubación preparados (uno para cada medición de punto de tiempo). Las gotas son pesadas y se sedimentan rápidamente, por lo que es importante resuspender el stock entre cada transferencia.
NOTA: El número de tubos de incubación en los que se dividen las producciones de gotas puede variar, pero recomendamos dividir una producción en no más de 4 tubos de incubación para garantizar que cada muestra contenga suficientes eventos para el análisis. - Coloque los tubos en posición vertical en la incubadora durante 2 h, 4 h o 6 h de incubación después de la generación de gotas.
3. Análisis posterior de las gotas
- Microscopia
- Después de la incubación, transfiera un pequeño número de gotas a un portaobjetos de microscopio como se describe en el paso 2.2.7 y analícelas mediante microscopía de campo claro y fluorescencia utilizando un microscopio de fluorescencia estándar con la configuración adecuada de láser y filtro.
NOTA: Las gotas se pueden detectar mediante microscopía de campo claro. Las células T teñidas de violeta se pueden detectar con un filtro DAPI, las células JeKo-1 teñidas de rojo lejano con un filtro APC, la señal GzmB-FAM con un filtro FITC y la señal PI con un filtro PE. La señal PI de mayor interés puede ser difícil de visualizar por microscopía, ya que las células apoptóticas tempranas tienen una emisión máxima más baja que las células apoptóticas tardías. Consulte la Figura 4 para ver datos representativos.
- Después de la incubación, transfiera un pequeño número de gotas a un portaobjetos de microscopio como se describe en el paso 2.2.7 y analícelas mediante microscopía de campo claro y fluorescencia utilizando un microscopio de fluorescencia estándar con la configuración adecuada de láser y filtro.
- Citometría de flujo
- Después de la incubación, vuelva a suspender cada muestra de gota en el medio de recubrimiento y transfiérala a tubos FACS de 5 ml. Analice las gotas con un citómetro de flujo estándar siguiendo las pautas generales que se enumeran a continuación.
- Utilice un citómetro de flujo con la configuración adecuada de láser y filtro. Con el panel seleccionado de tinciones celulares y ensayo, no se requiere compensación de color en el citómetro de flujo utilizado aquí. Si se aplican otros colores o la configuración del citómetro de flujo aplicado es diferente, puede ser necesaria una compensación.
- Utilice FSC-H como activador de umbral para excluir el ruido de fondo de pequeños eventos de aceite.
- Las gotas son pesadas y se sedimentarán en el fondo de los tubos FACS. Asegúrese de que el SIP llegue a las gotas. Las gotas deben suspenderse en al menos 5 veces el volumen del búfer externo a las gotas antes de la adquisición.
- Los eventos de gota se adquieren a alta velocidad. Registre las señales de altura de intensidad (H) para FSC y SSC y los fluoróforos examinados, ya que las mediciones de altura de intensidad se utilizan cuando se analizan gotas. Ajuste las ganancias para tener una separación adecuada de los eventos positivos y negativos.
NOTA: Utilizamos el canal FITC para medir la señal GzmB, el canal azul del Pacífico para detectar las células T teñidas de violeta, el canal APC para detectar las células JeKo-1 teñidas en rojo lejano y el canal PE para detectar la señal PI. - Registre suficientes eventos para el análisis posterior. Aquí, registramos 4,5 - 8,3 x 103 de las gotas coencapsulantes por punto de tiempo.
- Lave el citómetro de flujo a través del SIP después de cada conjunto de adquisiciones de gotas, utilizando soluciones estándar de limpieza y enjuague. Limpie a fondo el citómetro de flujo al final del experimento. Consulte la Figura 4 y la Figura 5 para obtener datos representativos.
- Después de la incubación, vuelva a suspender cada muestra de gota en el medio de recubrimiento y transfiérala a tubos FACS de 5 ml. Analice las gotas con un citómetro de flujo estándar siguiendo las pautas generales que se enumeran a continuación.
- Análisis de datos
- Calcule el porcentaje de linfocitos T que secretan GzmB en función del porcentaje de coencapsulaciones de linfocitos T positivos para GzmB y linfocitos JeKo-1 normalizados a la viabilidad de los linfocitos T determinada en las poblaciones de gotitas de linfocitos T solo en el momento en cuestión, de la siguiente manera:
Gotitas T cell+, Jeko-1+, GzmB+ / (Gotitas T cell+, Jeko-1+ - Gotas muertas T cell+, Jeko-1+)
donde Gotitas de célula T muerta+, Jeko-1+ se estima a partir de la muerte en gotitas con células T solamente: Gotitasde célula T muerta+, Jeko-1+ = Gotasde célula T+, Jeko-1+ x Gotas de célula T muerta+, Jeko-1- / GotasTcell+, Jeko-1-. - Calcule el porcentaje de células T que mataron a sus células objetivo de la siguiente manera:
Porcentaje de linfocitos T citotóxicos = (Muerte observada - Muerte de fondo)/(100 - Muerte de fondo)
donde la muerte de fondo es la muerte presente dentro de las gotitas (células T+, Jeko-1+) que resultan de una muerte no relacionada con la muerte o de una muerte ocurrida antes de la encapsulación. - Calcule la muerte de fondo por muerte celular en gotas (T cell +, Jeko-1-) y (T cell -, Jeko-1+):
Muerte de fondo = (1- (1- tasa de mortalidad en DropletsTcell-, Jeko-1+) x (1- tasa de mortalidad en DropletsT cell+, Jeko-1-)) x 100
donde la tasa de mortalidad se mide directamente como el % de gotas positivas para PI en gotas solo de células T y gotas solo de células JeKo-1, respectivamente. Todos los cálculos se realizan con números específicos del tiempo de muestreo.
- Calcule el porcentaje de linfocitos T que secretan GzmB en función del porcentaje de coencapsulaciones de linfocitos T positivos para GzmB y linfocitos JeKo-1 normalizados a la viabilidad de los linfocitos T determinada en las poblaciones de gotitas de linfocitos T solo en el momento en cuestión, de la siguiente manera:
Resultados
Después de la transducción, se analizó la expresión de CAR de las células T mediante citometría de flujo utilizando anticuerpos anti-CD3 y anti-NGFR. Posteriormente, la población de células CAR-T se enriqueció utilizando perlas magnéticas anti-NGFR, lo que dio como resultado una pureza de más del 98% para ambos donantes (Figura 1A-B). También se cuantificó la relación CD4/CD8 y el fenotipo de memoria de las células CAR clasificadas utilizadas, utilizando una estrategia de puerta estándar que utiliza anticuerpos CCR7 y CD45RA. Estos datos muestran que la relación CD4/CD8 de las células CAR-T utilizadas fue de 0,73, y las células eran principalmente de fenotipo de memoria ingenua (Figura 1C-E).
Las células CAR-T y las células JeKo-1 se tiñeron con colorantes violeta y rojo lejano, respectivamente, y se encapsularon en gotas de DE50 junto con los reactivos de ensayo GzmB, sustrato y PI (Figura 2). Alternativamente, las células T con CAR también se pueden marcar utilizando anticuerpos como anti-CD4 o anti-CD8 (Figura 3), lo que permite una caracterización más detallada de las células T. Cada suspensión de células T (CAR-T o NTD) se mezcló con una suspensión de células JeKo-1 inmediatamente antes de la encapsulación en una relación efector-célula objetivo de 1:3 (0,5 x 106 células T y 1,5 x 106 JeKo-1). Después de la encapsulación, cada producción de gotas (células CAR-T + JeKo-1 y NTD + JeKo-1) se dividió en tres tubos de incubación para una incubación de 2 h, 4 h y 6 h, respectivamente. Las células se incubaron dentro de las gotas a 37 °C en CO2 al 5% y luego se analizaron por microscopía y citometría de flujo en los puntos de tiempo indicados.
Se realizó microscopía de fluorescencia de gotas de doble emulsión a las 4 h de incubación (Figura 4). La intensidad de la señal de fluorescencia verde (FITC) ilustra el nivel de actividad de GzmB secretada por las células CAR-T o NTD dentro de las gotas DE50. La Figura 4B presenta imágenes de microscopía de fluorescencia y contraste de fase de una sola gota positiva para GzmB que contiene una célula CAR-T y una célula diana JeKo-1 en contacto cercano.
A continuación, se analizaron las gotas de DE50 mediante citometría de flujo para cuantificar el porcentaje de células CAR-T con secreción temprana de GzmB y actividad de destrucción de células citotóxicas (Figura 5). La tinción previa a la incubación de las células diana JeKo-1 con un colorante rojo lejano y de las células T efectoras con un colorante violeta antes de la encapsulación facilitó la identificación de tres poblaciones distintas de gotas que contienen células, ya que las células se distribuyen en gotas según la distribución de Poisson. Las poblaciones de gotitas identificadas son gotitas con linfocitos T solos, linfocitos JeKo-1 solos y linfocitos T y linfocitos JeKo-1 juntos (Figura 5A). Las gotas que coencapsulaban las células T con las células JeKo-1 se comprimieron y analizaron en busca de señales que indicaran actividad de GzmB (Figura 5B) y muerte celular, según lo indicado por PI (Figura 5C).
La encapsulación de las células en gotas sigue la distribución de Poisson, y se obtienen cuatro poblaciones de gotas diferentes (Figura 6A). La Figura 6B muestra el nivel de gotas positivas para GzmB en todas las poblaciones de gotitas después de 6 horas de incubación de gotitas, a partir de las cuales se puede determinar el porcentaje de células T secretoras espontáneas de GzmB. Estos datos indican la alta especificidad del método, ya que solo las células T con CAR secretan GzmB.
Finalmente, cuantificamos los niveles de GzmB y PI en todos los puntos temporales, después de 2 h, 4 h y 6 h de co-incubación. Como referencia, se analizaron las gotitas que contenían solo células T y solo células JeKo-1 para examinar la muerte celular de fondo en cada población (Figura 6C). La muerte celular de fondo se utilizó para determinar el porcentaje de células T vivas secretoras de GzmB y destructoras de células diana en la población de células efectoras (Figura 7), como se describe en el paso 3.3. Las células CAR-T de dos donantes mostraron un aumento dependiente del tiempo tanto en la secreción de GzmB inducida por la célula diana como en la actividad de destrucción celular. Casi el 36% de las células CAR-T vivas del donante 1 y el 31% del donante 2 habían secretado GzmB después de 6 h de coencapsulación con la célula diana, un aumento significativo en comparación con las células T de control NTD (Figura 7A). En consecuencia, alrededor del 21% de los linfocitos CAR-T del Donante 1 vivo y el 22% de los linfocitos CAR-T del Donante 2 vivos habían matado a las células diana, como indica una señal PI positiva (Figura 7B). El porcentaje de células CAR-T que habían secretado GzmB superó el porcentaje de células diana muertas en cada punto de tiempo, lo que es coherente con la secuencia esperada de eventos en la citotoxicidad mediada por GzmB. Tomados en conjunto, estos datos muestran que el método presentado aquí permite la caracterización de la heterogeneidad en la citotoxicidad de las células T individuales dentro de una población de células, así como comparaciones entre diferentes poblaciones.
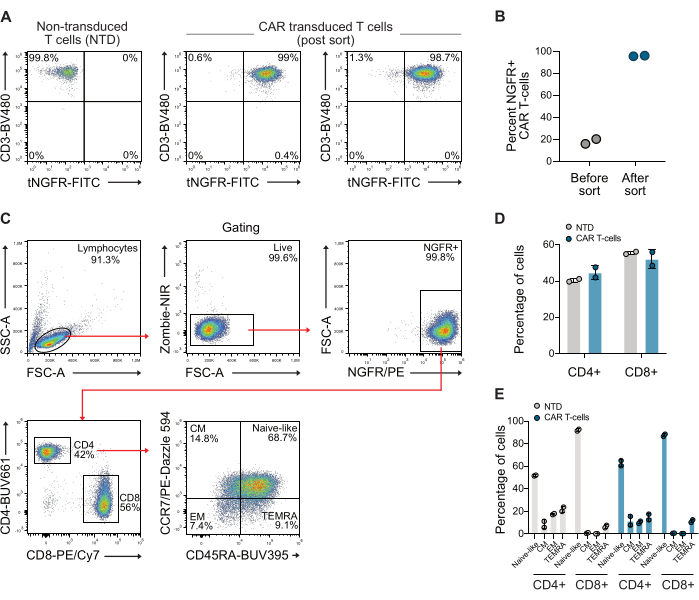
Figura 1: Gráficos representativos de citometría de flujo siguiendo la clasificación NGFR. (A) Después de aproximadamente 10 días de expansión, las células CAR-T se clasificaron utilizando microperlas específicas de NGFR y clasificación magnética, lo que dio como resultado una población de células CAR-T que tenía un >98% de células CAR-T. (B) Cuantificación de células CAR-T de dos donantes utilizadas en este estudio antes y después de la clasificación. (C) Estrategia de compuerta utilizada para examinar la relación CD4/CD8 y el fenotipo de memoria de las células T. (D) Cuantificación de CD4 y CD8 de los linfocitos T utilizados. (E) Cuantificación del fenotipo de memoria de las células T utilizadas. Abreviatura: CM = memoria central, EM = memoria efectora, NTD = no transducida, TEMRA = células efectoras terminalmente diferenciadas. Haga clic aquí para ver una versión más grande de esta figura.
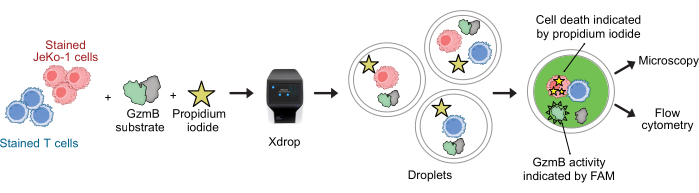
Figura 2: Flujo de trabajo para el ensayo combinado de secreción y citotoxicidad de GzmB con resolución de una sola célula en gotas. Antes de la encapsulación en gotas de DE, las células diana y efectoras se tiñen por separado utilizando tinciones de glóbulos violeta y rojo lejano. Utilizando el dispositivo de microfluídica y el cartucho de encapsulación, las células efectoras se coencapsulan con las células objetivo en gotas junto con el medio celular, PI y el sustrato de péptidos GzmB marcados con FAM. El ensayo y la incubación se llevan a cabo dentro de las gotas. La actividad secretada de GzmB está indicada por la emisión de fluorescencia verde que se produce después de que GzmB escinde el sustrato. La muerte celular está indicada por PI. Después de la incubación, las gotas de DE50 se analizan mediante microscopía y/o citometría de flujo. Haga clic aquí para ver una versión más grande de esta figura.
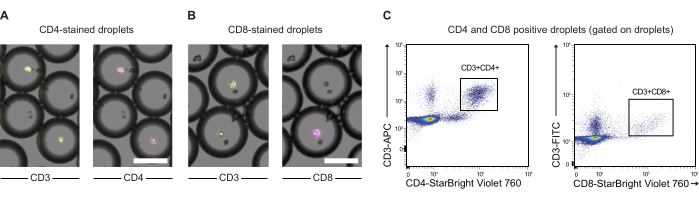
Figura 3: Análisis de PBMCs encapsuladas en gotas premarcadas con anticuerpos anti-CD3, anti-CD4 y anti-CD8. (A) Imágenes de microscopía de gotitas con PBMC encapsuladas premarcadas con anticuerpos anti-CD3 (APC) y anti-CD4 (NIR). Barra de escala = 100 μm. (B) Como (A), pero con etiquetado CD3 (FITC) y anti-CD8 (NIR) en su lugar. Barra de escala = 100 μm. (C) Análisis por citometría de flujo de las mismas gotas. Haga clic aquí para ver una versión más grande de esta figura.
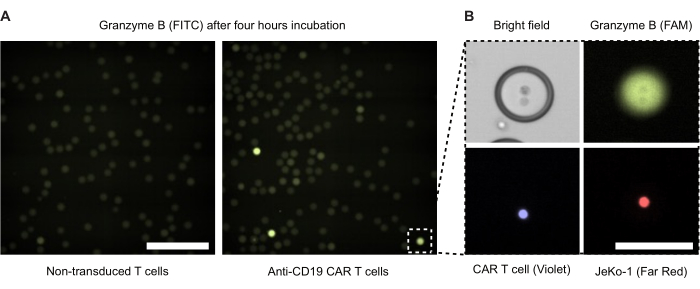
Figura 4: Imágenes microscópicas de gotitas con células efectoras y diana. Las imágenes se tomaron después de 4 h de incubación en una incubadora de células humidificadas estándar a 37 °C, 5% de CO2 . (A) Gotitas de una muestra con células NTD y JeKo-1 encapsuladas (izquierda) o células CAR-T y células JeKo-1 (derecha) obtenidas mediante microscopía de fluorescencia utilizando el canal FITC para detectar gotas positivas de GzmB (verdes). Barra de escala = 500 μm. (B) Una sola gota fotografiada por contraste de fase, FITC (GzmB), APC (célula JeKo-1) y DAPI (célula CAR-T). Barra de escala = 100 μm. Haga clic aquí para ver una versión más grande de esta figura.
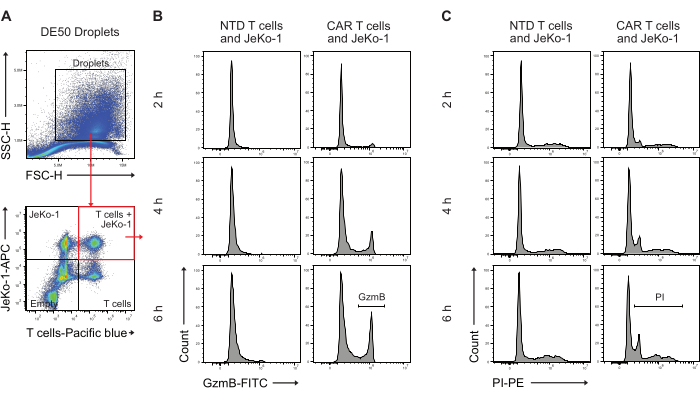
Figura 5: Estrategia de compuerta para analizar las gotas por citometría de flujo después de la incubación. (A) La compuerta se realizó mediante dispersión frontal y lateral para identificar las gotas, seguido de la selección de la puerta que contiene las gotas. Los eventos fuera de la puerta representan gotas de aceite producidas como subproducto de la producción de gotas de doble emulsión. El análisis de fluorescencia posterior de las gotas en los canales correspondientes a las tinciones celulares aplicadas identifica cuatro poblaciones de gotas: gotas que contienen tanto células T como células JeKo-1 (cuadrado rojo); gotitas con células JeKo-1 solas; gotitas con linfocitos T solos; y gotas vacías. (B) Histogramas representativos de la señal GzmB en gotas dobles positivas a través de puntos de tiempo y entre células NTD y CAR-T. (C) Histogramas representativos de la señal PI en gotas dobles positivas a través de puntos de tiempo y entre células T NTD y CAR. Todas las mediciones de gotas se realizan como mediciones de intensidad, altura (H). Haga clic aquí para ver una versión más grande de esta figura.
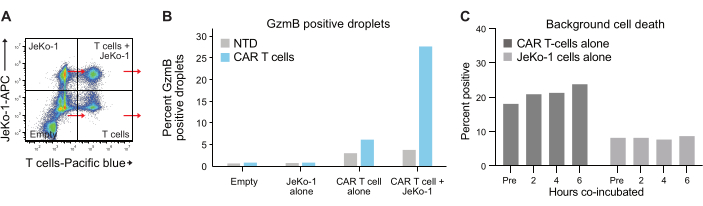
Figura 6: Control interno y poblaciones de referencia. (A) Se seleccionó cada uno de los cuatro cuadrantes de la Figura 5A , y se midieron GzmB e PI en cada uno. Este tipo de cuantificación permite medir y restar las señales de fondo antes de realizar un análisis final de la eficacia de las células T. (B) Gráfico que muestra la frecuencia de gotas positivas para GzmB después de 6 h de incubación para cada una de las cuatro poblaciones de gotas, ejemplificado con datos de la muestra CAR-T del donante 1. (C) Se determinó la muerte de las células de fondo en las poblaciones de gotitas de control de solo JeKo-1 y solo de células T en cada punto de tiempo medido, con datos del donante 1. La muerte celular de fondo se utiliza para calcular la frecuencia de las células efectoras secredoras y destructoras de células vivas que secretan GzmB y que se muestran en la Figura 7 y se explican en el paso 3.3. Abreviaturas: Pre = encapsulación. Haga clic aquí para ver una versión más grande de esta figura.
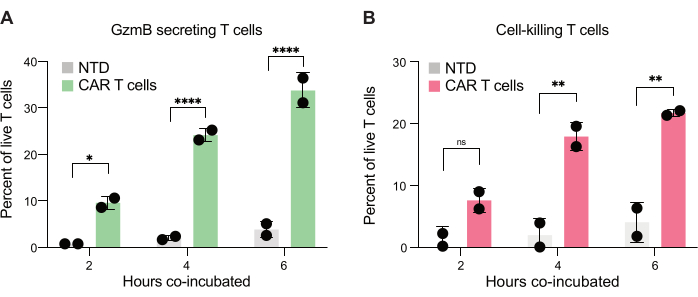
Figura 7: Cuantificación de linfocitos T capaces de secretar GzmB y matar linfocitos JeKo-1 en gotas dobles positivas. Se examinaron las gotitas dobles positivas de dos donantes después de 2 h, 4 h y 6 h de co-incubación en gotas. (A) Frecuencia de células T que se encuentran con células diana que secretan GzmB y comparación entre células T NTD y células T con CAR. (B) Frecuencia con la que las células T se encuentran con células diana y matan a la célula diana coencapsulada. Abreviaturas: GzmB = granzima B, NTD = no transducido, PI = yoduro de propidio. * = Valor P < 0,05, ** = Valor P < 0,005, **** = Valor P < 0,0001 por ANOVA de dos vías. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Aquí presentamos un método para examinar el potencial citotóxico de las células T a nivel de una sola célula utilizando un dispositivo de microfluidos fácil de usar disponible comercialmente para evaluar el potencial citotóxico de las células CAR-T CD19-CD28-CD3z tras la coencapsulación con la línea celular de linfoma de manto CD19 positiva JeKo-1.
Hay varios pasos críticos en este protocolo. En primer lugar, recomendamos retirar las perlas de estimulación de las células T al menos 48 horas antes de realizar cualquier ensayo, para evitar resultados falsos positivos. En segundo lugar, la eficiencia de la transducción de linfocitos T con construcciones como los CAR o los receptores de linfocitos T puede variar considerablemente. Sin una etapa posterior de purificación de las células T transducidas, los resultados pueden ser difíciles de interpretar. En este caso, se utilizó una población pura de células CAR-T y, por lo tanto, se puede esperar un alto grado de certeza al caracterizar las células CAR-T como asesinas o no asesinas en cada momento dado. Alternativamente, se puede aplicar el marcaje de CAR con proteína fluorescente o etiqueta genética para indicar las células que son CAR positivas y luego se pueden controlar al analizar las gotas. Si se utiliza el marcaje, las moléculas fluorescentes seleccionadas no deben interferir con las emisiones fluorescentes de ninguno de los otros fluoróforos del ensayo. Por ejemplo, el uso del etiquetado GFP interferiría con el sustrato GzmB marcado con FAM aplicado en los experimentos realizados aquí y, por lo tanto, no se recomienda.
Una de las principales ventajas del protocolo descrito aquí es que la generación de gotas en sí misma está simplificada y automatizada. Sin embargo, para garantizar la encapsulación de una sola célula, es importante que las células se resuspendan completamente antes de cargar el cartucho. Por esta razón, se recomienda trabajar a un ritmo justo cuando se prepare para cargar el cartucho. Una consideración similar se aplica cuando se agrega el sustrato de GzmB, ya que algunas células son altamente secretoras de GzmB. La resuspensión de las células también evitará la obstrucción de los canales microfluídicos de los cartuchos pequeños. La encapsulación adecuada de las células se verifica fácilmente mediante microscopía, como se describió anteriormente.
Debido a que la gota encapsula el medio celular y retiene los productos celulares secretados por las células, se pueden analizar otras citocinas, anticuerpos y compuestos. De hecho, hemos probado otras moléculas relevantes secretadas por las células inmunitarias, como el IFN-γ y el TNF-α, que requieren modificaciones del protocolo actual. Para la detección de citocinas, se puede aplicar un tipo de formato de ensayo diferente al que utilizamos aquí para GzmB, como la generación de un sándwich ELISA en la superficie de la célula efectora32. Además, las tinciones celulares y los colores de los ensayos se pueden cambiar, por ejemplo, el éster de carboxifluoresceína succinimidilo (CFSE), pero es importante garantizar un sangrado mínimo o nulo en las diferentes combinaciones de colores, como se haría en la citometría de flujo estándar.
Además, este protocolo no se limita al análisis de células CAR-T. También puede ampliarse para estudiar otras interacciones entre células T y diana u otras células inmunitarias, como las células CAR NK. También se pueden imaginar experimentos más avanzados, por ejemplo, marcando subconjuntos de células T CD4 y CD8 con fluoróforos adicionales para realizar un inmunofenotipado funcional más amplio. De hecho, aquí demostramos que CD4 y CD8 se pueden detectar en las gotas, lo que permite una mayor caracterización de las células T efectoras y su capacidad citotóxica.
Al optimizar este protocolo, nuestro objetivo específico es que funcione en instrumentos de citometría de flujo estándar. Si bien la citometría de flujo por gotas no es complicada, hemos notado que puede ocurrir acumulación de aceite si el citómetro de flujo no se enjuaga adecuadamente a ciertos intervalos o como se recomienda aquí después del análisis de muestras en cada intervalo de tiempo. El mejor protocolo de enjuague puede ser específico para cada citómetro de flujo individual.
Una de las ventajas significativas de este método es su capacidad de alto rendimiento, lo que permite la monitorización de la citotoxicidad mediada por efectores unicelulares frente a células diana sin necesidad de una amplia experiencia o equipos altamente especializados. El ensayo se puede realizar fácilmente utilizando las herramientas existentes, como la citometría de flujo o la microscopía. Las gotas de doble emulsión también son susceptibles de clasificación utilizando clasificadores de células30,31, que pueden permitir el aislamiento de células con funcionalidades específicas, por ejemplo, células CAR-T con y sin potencial citotóxico, seguido de un análisis de transcriptoma de una sola célula.
La tecnología no está exenta de limitaciones. Mientras que algunas líneas celulares toleran el cultivo en gotitas durante 24 h y más, las células primarias pueden tener una viabilidad significativamente menor después de 24 h. Esto representa una limitación de tiempo en los ensayos en general, pero para el ensayo actual, se puede observar una GzmB notable y una actividad de destrucción celular dentro de las 4-6 horas, probablemente porque el pequeño compartimento de gotas asegura un encuentro rápido entre las células efectoras y objetivo. Del mismo modo, el pequeño volumen de gotas asegurará una rápida acumulación en la concentración hasta niveles detectables del sustrato escindido por GzmB secretado. Otra limitación de la tecnología es la imposibilidad de detectar la muerte en serie por células efectoras cuando se utilizan citómetros de flujo estándar. Sin embargo, esto podría lograrse con citómetros de flujo de imagen o tecnologías de citometría de imagen, que tendrán que ser investigadas.
La transferencia adoptiva de linfocitos CAR-T CD19 ha demostrado un éxito notable en el tratamiento de pacientes con neoplasias malignas hematológicas. A pesar de esto, existe una gran variación en la respuesta y una toxicidad impredecible en los pacientes32, lo que puede deberse en parte a la heterogeneidad dentro del producto de infusión de CAR-T. Como resultado, existe un creciente interés en analizar la composición fenotípica y la capacidad citotóxica de las células CAR-T individuales dentro de una población. Esto será particularmente importante a medida que la terapia con CAR se pruebe cada vez más en enfermedades autoinmunes y en otras formas de cáncer. El dispositivo y el protocolo de microfluídica descritos aquí ofrecen un enfoque sólido y versátil para examinar la heterogeneidad de las células CAR-T y otras terapias basadas en células.
Divulgaciones
Los autores declaran los siguientes intereses contrapuestos: M.B.B. ha recibido honorarios de consultoría de Janssen, Roche y Kite/Gilead, no relacionados con el presente trabajo. D.L.P. y P.M. son empleados de Samplix.
Agradecimientos
Los autores desean agradecer a los miembros y empleados de CITCO y Samplix por sus útiles discusiones y sugerencias. M.B.B. cuenta con el apoyo de la beca Early-Career Clinician Scientists de la Fundación Lundbeck (R381-2021-1278). Este trabajo cuenta con el apoyo de una beca de investigación de élite del Hospital Universitario de Odense. Además, esta investigación ha contado con el apoyo de una subvención del proyecto 190144395 del Consejo Europeo de Innovación a Samplix ApS.
Materiales
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| Blocker BSA (BSA) | Thermo Scientific | 37525 | |
| CellTrace Far Red Cell Proliferation Kit (far red fluorescent dye) | Invitrogen | C34564 | |
| CellTrace Violet Cell Proliferation Kit (violet fluorescent dye) | Invitrogen | C34557 | |
| DE Stabilizing Solution (stabilizing solution) | Samplix | REDIVSTABSOL1500 | |
| DPBS (dPBS) | Gibco | 14190-094 | |
| Dulbecco’s PBS (dPBS) | Capricorn Scientific | PBS-1A | |
| Dynabeads Human T-Activator (CD3/CD28 activation beads) | Gibco | 11132D | |
| Fetal Bovine Serum (FBS) | Capricorn Scientific | FBS-HI-12A | |
| Lenti-X Concentrator (PEG-based reagent) | Takara Bio | 631232 | |
| MACSelect LNGFR Microbeads (anti-NGFR magnetic beads) | Miltenyi Biotec | 130-091-330 | |
| OptiPrep density gradient medium (gradient medium) | Stemcell | 7820 | |
| Penicillin-Streptomycin (P/S) | Capricorn Scientific | PS-B | |
| Propidium iodide (PI) | Invitrogen | BMS500PI | |
| Recombinant Human IL-2 (IL-2) | Peprotech | 200-02 | |
| RPMI-1640 with Stable Glutamine (RPMI-1640) | Capricorn Scientific | RPMI-STA | |
| RPMI-1640 without L-Glutamine and phenol red | Gibco | 32404-014 | |
| Xdrop DE oil I (oil) | Samplix | REOILDEC1900 | |
| Xdrop Granzyme B substrate (GzmB substrate) | Samplix | REGRB100 | |
| Zombie-NIR viability dye (viability dye) | BioLegend | 423106 | |
| Plasticware etc. | |||
| 8-chamber glass slide | Chemometec | 942-0003 | |
| Cell culture plate, 12 well | TH Geyer | 7696791 | |
| DNA LoBind tube, 2 mL (DNA tube) | Eppendorf | 30108078 | |
| Eppendorf tube, 1.5 mL (1.5 mL tube) | Eppendorf | 30108051 | |
| Falcon tube, 15 mL (15 mL tube) | TPP | 91015 | |
| Falcon tube, 5 mL (5 mL tube) | Falcon (VWR) | 734-0443 | |
| Green cell suspension flasks for cell incubations (T75 flask) | Sarstedt | 148.19.22 | |
| Green cell suspension plates for cell incubations (96 well plate) | Sarstedt | 148.32.20 | |
| LS Separation Columns (separation column) | Miltenyi Biotec | 130-042-401 | |
| Xdrop DE Gaskets (gaskets) | Samplix | #GADEA100 | |
| Xdrop DE50 Cartridge (encapsulation cartridge) | Samplix | #CADE50A100 | |
| Antibodies | |||
| anti-CCR7 PE-Dazzle 594 | BioLegend | 353236 | |
| anti-CD19 CAR FMC63 Idiotype Antibody, PE | Miltenyi Biotec | 130-127-342 | |
| anti-CD3 APC | Biolegend | 300439 | |
| anti-CD3 BV480 | BD Biosciences | 566105 | |
| anti-CD3 FITC | BD Biosciences | 345763 | |
| anti-CD4 BUV661 | BD Biosciences | 612962 | |
| anti-CD4 StarBright Violet 760 | Bio-Rad | MCA1267SBV760T | |
| anti-CD45RA BUV395 | BD Biosciences | 740298 | |
| anti-CD8 PE-Cy7 | BioLegend | 344712 | |
| anti-CD8 StarBright Violet | Bio-Rad | MCA1226SBV760 | |
| anti-NGFR FITC | BioLegend | 345106 | |
| anti-NGFR PE | BioLegend | 345106 | |
| Cells | |||
| JeKo-1 Mantle-cell lymphoma cell-line (JeKo-1) | ATCC | CRL-3006 | |
| Primary peripheral blood mononuclear cells (PBMCs) | |||
| Equipment | |||
| Countess 3 Automated Cell Counter | Thermo Fisher Scientific | A50298 | |
| DynaMag-2 Magnet | Invitrogen | 12321D | |
| NovoCyte Quanteon Flow Cytometer (flow cytometer) | Agilent | 2010011AA | |
| Xdrop (microfluidics device) | Samplix | IN00110-EU |
Referencias
- Pasqui, D. M., Latorraca, C. D. O. C., Pacheco, R. L., Riera, R. CAR-T cell therapy for patients with hematological malignancies. A systematic review. Eur J Haematol. 109 (6), 601-618 (2022).
- Krejcik, J., et al. Harnessing the immune system to fight multiple myeloma. Cancers. 13 (18), 4546 (2021).
- Tokarew, N., Ogonek, J., Endres, S., von Bergwelt-Baildon, M., Kobold, S. Teaching an old dog new tricks: next-generation CAR T cells. British J Cancer. 120 (1), 26-37 (2019).
- Bogetofte Barnkob, M., Vitting-Seerup, K., Rønn Olsen, L. Target isoforms are an overlooked challenge and opportunity in chimeric antigen receptor cell therapy. Immunother Adv. 2 (1), ltac009 (2022).
- Daei Sorkhabi, A., et al. The current landscape of CAR T-cell therapy for solid tumors: Mechanisms, research progress, challenges, and counterstrategies. Front Immunol. 14, 1113882 (2023).
- . Considerations for the Development of Chimeric Antigen Receptor (CAR) T Cell Products Available from: https://www.fda.gov/regulatory-information/search-fda-guidance-documents/considerations-development-chimeric-antigen-receptor-car-t-cell-products (2024)
- Roddie, C., O'Reilly, M., Dias Alves Pinto, J., Vispute, K., Lowdell, M. Manufacturing chimeric antigen receptor T cells: issues and challenges. Cytotherapy. 21 (3), 327-340 (2019).
- Wang, L., et al. Improvement of in vitro potency assays by a resting step for clinical-grade chimeric antigen receptor engineered T cells. Cytotherapy. 21 (5), 566-578 (2019).
- Burrows, S. R., Fernan, A., Argaet, V., Suhrbier, A. Bystander apoptosis induced by CD8+ cytotoxic T cell (CTL) clones: implications for CTL lytic mechanisms. Int Immunol. 5 (9), 1049-1058 (1993).
- Gattinoni, L., et al. Acquisition of full effector function in vitro paradoxically impairs the in vivo antitumor efficacy of adoptively transferred CD8+ T cells. J Clin Invest. 115 (6), 1616-1626 (2005).
- Chen, G. M., et al. Integrative bulk and single-cell profiling of premanufacture T-cell populations reveals factors mediating long-term persistence of CAR T-cell therapy. Cancer Dis. 11 (9), 2186-2199 (2021).
- Frazer, G. L., Gawden-Bone, C. M., Dieckmann, N. M. G., Asano, Y., Griffiths, G. M. Signal strength controls the rate of polarization within CTLs during killing. J Cell Biol. 220 (10), e202104093 (2021).
- Hermans, I. F., et al. The VITAL assay: a versatile fluorometric technique for assessing CTL- and NKT-mediated cytotoxicity against multiple targets in vitro and in vivo. J Immunol Meth. 285 (1), 25-40 (2004).
- Zaritskaya, L., Shurin, M. R., Sayers, T. J., Malyguine, A. M. New flow cytometric assays for monitoring cell-mediated cytotoxicity. Expert Rev Vaccines. 9 (6), 601-616 (2010).
- Piccinini, C., et al. In vitro CAR-T cell killing: validation of the potency assay. Cancer Immunol Immunother CII. 73 (9), 168 (2024).
- Martinez, E. M., et al. High-throughput flow cytometric method for the simultaneous measurement of CAR-T cell characterization and cytotoxicity against solid tumor cell lines. SLAS Disc Adv Life Sci. 23 (7), 603-612 (2018).
- Jedema, I., van der Werff, N. M., Barge, R. M. Y., Willemze, R., Falkenburg, J. H. F. New CFSE-based assay to determine susceptibility to lysis by cytotoxic T cells of leukemic precursor cells within a heterogeneous target cell population. Blood. 103 (7), 2677-2682 (2004).
- Liu, L., et al. Cellular and molecular imaging of CAR-T cell-based immunotherapy. Adv Drug Delivery Rev. 203, 115135 (2023).
- Liadi, I., et al. Defining potency of CAR+ T cells: Fast and furious or slow and steady. Oncoimmunology. 8 (10), e1051298 (2019).
- Xhangolli, I., et al. Single-cell analysis of CAR-T cell activation reveals a mixed TH1/TH2 response independent of differentiation. Genom Proteom Bioinfo. 17 (2), 129-139 (2019).
- Zhou, Y., et al. Evaluation of single-cell cytokine secretion and cell-cell interactions with a hierarchical loading microwell chip. Cell Rep. 31 (4), 107574 (2020).
- LaBelle, C. A., Zhang, R. J., Hunsucker, S. A., Armistead, P. M., Allbritton, N. L. Microraft arrays for serial-killer CD19 chimeric antigen receptor T cells and single cell isolation. Cytometry J Int Soc Anal Cytol. 103 (3), 208-220 (2023).
- Hellmann, M. J., et al. Heterogeneously deacetylated chitosans possess an unexpected regular pattern favoring acetylation at every third position. Nat Comm. 15 (1), 6695 (2024).
- Wong, K. U., et al. Assessment of chimeric antigen receptor T cytotoxicity by droplet microfluidics in vitro. Antibody Therapeut. 5 (2), 85-99 (2022).
- Antona, S., Platzman, I., Spatz, J. P. Droplet-based cytotoxicity assay: Implementation of time-efficient screening of antitumor activity of natural killer cells. ACS omega. 5 (38), 24674-24683 (2020).
- Subedi, N., et al. An automated real-time microfluidic platform to probe single NK cell heterogeneity and cytotoxicity on-chip. Sci Rep. 11 (1), 17084 (2021).
- Zhang, Y., et al. Enhanced CRISPR/Cas12a-based quantitative detection of nucleic acids using double emulsion droplets. Biosens Bioelect. 257, 116339 (2024).
- Kochenderfer, J. N., et al. Construction and preclinical evaluation of an anti-CD19 chimeric antigen receptor. J Immunother. 32 (7), 689-702 (2009).
- Michaels, Y. S., et al. Precise tuning of gene expression levels in mammalian cells. Nat Comm. 10 (1), 818 (2019).
- Yuan, Y., et al. Droplet encapsulation improves accuracy of immune cell cytokine capture assays. Lab on a Chip. 20 (8), 1513-1520 (2020).
- Brower, K. K., et al. Double emulsion flow cytometry with high-throughput single droplet isolation and nucleic acid recovery. Lab on a Chip. 20 (12), 2062-2074 (2020).
- Kirouac, D. C., et al. Deconvolution of clinical variance in CAR-T cell pharmacology and response. Nat Biotechnol. 41 (11), 1606-1617 (2023).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados