Method Article
Kimerik Antijen Reseptörü T hücrelerini Tek Hücre Düzeyinde Değerlendirmek için Damlacık Bazlı Sitotoksisite Testi
Bu Makalede
Özet
Burada, tek hücre düzeyinde hücre öldürmeyi incelemek için bir T hücresini ve bir kanser hedef hücresini kapsülleyen çift emülsiyon damlacıkları oluşturmak için bir yöntem açıklıyoruz. Bu yöntem, büyük bir T hücresi popülasyonu içinde hem sitotoksik moleküllerin hem de hedef hücre apoptozunun ikili miktar tayinine izin verir.
Özet
Kimerik antijen reseptörü (CAR) T hücresi tedavileri gibi T hücresi bazlı tedavilerin sitotoksik potansiyelinin değerlendirilmesi, etkinliklerinin değerlendirilmesinde etkilidir ve klinik uygulama için bir ön koşuldur. Bununla birlikte, geleneksel sitotoksisite testleri, toplu testler olarak gerçekleştirilir ve CAR T hücre popülasyonunun fonksiyonel heterojenliği hakkında ayrıntılı bilgi sağlamaz. Bu çalışmada, tek efektör CAR T hücrelerinin tek hedef hücrelerle büyük ölçekli ko-kapsüllenmesine izin verirken, T hücrelerinden hem sitotoksik efektör moleküllerinin hem de hedef hücrenin hücre ölümünün ikili kantitifikasyonunu sağlayan çift emülsiyon damlacık tabanlı bir yöntemi tanımladık. Protokol, CD19'a özgü CAR T hücrelerinin üretilmesi ve saflaştırılması için bir yöntemin ana hatlarını çizer, ardından bunların CD19+ hücre hattı JeKo-1 ile damlacıklar halinde birlikte kapsüllenmesini, sitotoksik efektör molekül sekresyonunu görselleştirmek için reaktiflerle birlikte belirtir (Granzyme B) ve hücre ölümü (propidyum iyodür, PI kullanılarak). Çift emülsiyon damlacıkları oluşturmak için ticari olarak temin edilebilen bir mikroakışkan cihaz kullanarak tek CAR T ve hedef hücreler içeren damlacıkların nasıl oluşturulacağını gösteriyoruz. Ek olarak, standart akış sitometri ekipmanı kullanarak damlacıklardaki CAR T hücrelerinin fonksiyonel çeşitliliğinin nasıl test edileceğine dair örnekler sunuyoruz. Son olarak, CD19'a özgü CAR T hücresi öldürmenin zamansal kinetiğini ve heterojenliğini kısaca açıklıyoruz. Bu yöntem, bir CAR T hücresi saldırısını takiben hücre ölümüne odaklanırken, diğer T hücresi tiplerini, sitotoksik bağışıklık hücrelerini ve sitokin sekresyonu gibi efektör hücre fonksiyonlarını incelemek için de uyarlanabilir.
Giriş
Kimerik antijen reseptörü (CAR) T hücre tedavisi, çeşitli lösemi, lenfoma1 ve multipl miyelom2 formlarına karşı etkili olduğu kanıtlanmış, hızla genişleyen bir hücresel kanser immünoterapisi alanıdır. CAR T hücreleri, B hücreleri, plazma hücreleri ve bunların malign muadilleri üzerinde eksprese edilen CD19 veya B hücresi olgunlaşma antijeni (BCMA) gibi yüzey proteinlerine seçici olarak bağlanabilen sentetik bir antijen reseptörü ile T hücrelerinin modifiye edilmesiyle üretilir. CAR tasarımındaki son gelişmeler, birden fazla giriş sinyaline dayanarak veya yalnızca spesifik protein izoformları4 gibi tümörle ilişkili antijenlere bağlanarakaynı anda birden fazla antijenin 3 hedeflenmesini sağlamıştır. Ek olarak, birkaç CAR şu anda hematolojik olmayan kanserlerin hedeflerine karşı test edilmektedir5.
Sitotoksisite deneyleri, klinik ürünler piyasaya sürülmeden önce hem CAR geliştirme hem de kalite kontrol için gereklidir 6,7,8. Bununla birlikte, mevcut tahlillerin çoğu, kanser hücre hatlarına fazla eklenen efektör CAR T hücrelerinin toplu popülasyonlarına bağlıdır, bu da seyirci etkileri9 nedeniyle yanlış pozitif sonuçlara yol açabilir ve in vitro ve in vivo sonuçlar arasında zayıf bir korelasyona neden olabilir10. T hücresi proliferasyonu ve uzun süreli kalıcılık, ilk aktivasyon olayları11,12 sırasında alınan sinyallere bağlı olduğundan, tek hücre düzeyinde sitotoksik olayların yakından incelenmesi büyük ilgi görmektedir.
Toplu metodolojilerin sınırlamalarını ele almak için, tek hücre düzeyinde sitotoksisite çalışmaları, akış sitometrisi 13,14,15,16,17 ve görüntülemeye dayalı testler18 kullanılarak gerçekleştirilebilir. Bununla birlikte, standart akış sitometrisi, hem efektör hem de hedef hücreleri ölçmek ve karakterize etmek için tek hücreli çözünürlük sunsa da, tek tek CAR T hücrelerinin hedef hücrelere yönelik spesifik sitotoksik yeteneğini doğrudan belirleyemez. Ek olarak, hücrelerin tutarlı hareketliliği nedeniyle ilgili hedefleriyle toplu olarak etkileşime giren tek tek CAR T hücrelerinin görüntülenmesi zor ve zaman alıcıdır. Bu zorlukların üstesinden gelmek için, mikro kuyu dizileri 19,20,21, mikrosal dizileri22, mikroçipler23 ve damlacık mikroakışkanları 24,25,26 kullanılarak uzamsal olarak sınırlı alanlarda efektör ve hedef hücrelerin eşleştirilmesine dayanan tek hücreli analiz için yeni araçlar geliştirilmiştir . Bu araçlar, gelişmiş ölçüm hassasiyeti sağlayarak azaltılmış reaktif hacimleri kullanılarak daha az hücrenin araştırılmasını sağlar. Bununla birlikte, verimli hücre eşleştirmesi, analiz edilebilecek sınırlı sayıda örnek, yalnızca görüntülemeye dayalı analize güvenme ve daha ileri analizler için canlı hücre popülasyonlarının elde edilmesindeki zorluklar dahil olmak üzere çeşitli zorluklar devam etmektedir.
Burada, damlacık bazlı mikroakışkanlara büyük ölçüde basitleştirilmiş bir yaklaşıma izin veren, ticari olarak temin edilebilen bir mikroakışkan cihazı kullanıyoruz. Bu cihaz, gelişmiş tek hücreli analiz ve tahlillerin yüksek derecede kararlı çift emülsiyon (DE) damlacıkları kullanılarak gerçekleştirilmesini sağlar. Mikrokuyu ve geleneksel damlacık-mikroakışkan tahlilleri ile karşılaştırıldığında, burada özetlenen protokol kapsamlı mikrofludiks uzmanlığı gerektirmez.
DE damlacıkları, sulu bir çözelti içinde süspanse edilmiş sulu bir çekirdeğe sahip bir yağ kabuğundan oluşan küçük küresel bölmelerdir. Sulu damlacık, hücreleri, hücre sekretomunu, hücre ortamını ve tahlil reaktiflerini içerir ve tutar, bu da her bölme içinde karmaşık tahlillerin gerçekleştirilmesine izin verir. Mikroakışkan cihazı kullanılarak, DE damlacıkları, memeli tek hücreli veya hücre-hücre etkileşim deneyleri için uygun bir ayarlanmış hacimle (yaklaşık 100 pL) üretilir ve bu damlacıklar, mikroakışkanlar konusunda uzmanlık bilgisi olmayan genel laboratuvar kullanıcıları tarafından çok yüksek sayılarda (numune başına yaklaşık 750.000 damlacık) ve kısa bir zaman diliminde (8 numune için yaklaşık 10 dakika) üretilebilir. Üretilen damlacıklar hücre ortamında süspanse edilebilir, böyleceO2 ve CO2'nin kabuk ötesi difüzyonuna ve iç kısmın tamponlanmasına izin verirken aynı zamanda hücre tarafından salgılanan efektör moleküller gibi hidrofilik ve daha büyük molekülleri korur. İncelenen hücreler böylece yeterince tamponlanır ve zaman içinde hücre-hücre etkileşimlerinin ve zamansal dinamiklerin incelenmesine izin verir. Tek emülsiyon damlacıklarının (örneğin, yağda su damlacıkları)27 aksine, DE damlacıkları, standart hücre inkübatörlerinde kaynaşmayan veya birleşmeyen sağlam yapılardır. Stabiliteleri ve sulu bir dış fazları nedeniyle, geleneksel akış sitometrisi gibi aşağı akış analiz prosedürleriyle de uyumludurlar. Bu nedenle, mikroakışkan cihaz tarafından üretilen bu pikolitre damlacıkları, geleneksel toplu tahlillerde gizlenen fonksiyonel heterojenliği aydınlatmak için hücre fonksiyonunun yüksek verimli tek hücreli analizi için kullanılabilir.
Burada, CD19'a özgü CAR'ların lenfoma hücrelerine yönelik sitotoksik potansiyelini incelemek için DE damlacıklarını kullanan bir protokolün ana hatlarını çiziyoruz. Protokolümüz, hedef öldürme ve Granzyme B (GzmB) sekresyonunun tek hücreli analizine izin verir ve burada incelenen CAR T hücrelerinin yaklaşık% 20'sinin anında öldürme potansiyeline sahip olduğunu ortaya koymaktadır.
Protokol
Bu çalışmada kullanılan CAR T hücreleri, sertifikalı bir biyogüvenlik GDO sınıf 2 laboratuvarında CD19scFv-CD28-CD3ζ-tNGFR CAR yapısı ile primer T hücrelerinin lentiviral transdüksiyonu ile üretildi ve enstitü standardına göre 4 gün sonra sınıflandırıldı. Saflaştırılmış T hücreleri, anonimleştirilmiş kan bağışlarından atılan fazla materyalden elde edildi ve Danimarka yasalarına göre daha fazla etik onaydan muaf tutuldu.
1. CAR T hücrelerinin üretilmesi
NOT: Aşağıda kullanılan reaktiflerin adında genel ve kısaltılmış isimler kullanılmaktadır. Tam ticari ad, Malzeme Tablosu'nda parantez içinde bulunabilir.
- T hücresi aktivasyonu, transdüksiyonu ve genişlemesi
NOT: CD19 CAR T hücrelerinin stabil ekspresyonu, negatif bir seçim T hücresi izolasyon kiti kullanılarak taze periferik kan mononükleer hücrelerinden (PBMC'ler) izole edilen birincil insan T hücrelerinin lentiviral transdüksiyonu yoluyla elde edildi. Kullanılan anti-CD19 CAR, bir FMC63 tek zincirli değişken fragman (scFv), bir CD28 menteşe ve transmembran alanı, bir CD28 kostimülatör alanı, bir CD3ζ aktivasyon alanı28 ve CAR eksprese eden hücrelerin29 izlenmesi ve zenginleştirilmesi için sinir büyüme faktörü reseptörünün (tNGFR) kesilmiş bir versiyonundan oluşan ikinci nesil bir yapıdır. Transfer vektörü plazmidi de novo sentezlendi ve bunun pMDLg/pRRE (Addgene plazmidi #12251), pRSV-Rev (Addgene plazmidi #12253) ve pMD2.G (Addgene plazmidi #12259) ile birleştirilmesiyle üçüncü nesil lentivirüs yapıldı30. Daha sonraki üç plazmit Didier Trono'nun bir hediyesiydi. Ham virüs, PEG bazlı bir reaktif kullanılarak konsantre edildi ve enfeksiyon çokluğu (MOI), SUP-T1 hücrelerinin dönüştürülmesi ve standart protokol31'e göre akış sitometrisi ile tNGFR'nin ölçülmesiyle belirlendi.- 2 x 106 birincil insan T hücresini 12 oyuklu bir kültür kabına aktarın ve bunları 1 mL tam RPMI-1640 ortamında 1: 1 boncuk-hücre oranında CD3 / CD28 kaplı boncuklarla uyarın (% 10 ısıyla inaktive edilmiş fetal sığır serumu,% 1 penisilin / streptomisin) 100 birim / mL rekombinant insan interlökin-2 (IL-2) ile desteklenmiştir. Hücreleri 37 ° C'de nemlendirilmiş% 5 CO2 inkübatörde 24 saat inkübe edin.
- Aktive edilmiş T hücrelerine 5-10'luk bir MOI'de lentiviral partiküller ekleyin. Yavaşça karıştırın ve hücreleri 72 saat inkübe edin. Negatif kontrol olarak transdüksiyonsuz (NTD) T hücrelerini dahil edin.
- Transdüksiyondan sonraki 3. günde, T hücrelerini 1.5 mL'lik bir tüpe toplayarak ve tüpü 1-2 dakika boyunca manyetik bir stand üzerine yerleştirerek CD3 / CD28 aktivasyon boncuklarını çıkarın. Hücreleri içeren süpernatanı 1.5 mL'lik yeni bir tüpe aktarın.
- Otomatik bir hücre sayacı kullanarak bir hücre sayımı gerçekleştirin ve 100 U / mL IL-2 ile desteklenmiş tam bir RPMI-1640 ortamında hücre yoğunluğunu 1 x 106 hücre / mL'ye ayarlayın. NGFR zenginleştirmesine devam etmeden önce süspansiyonda toplam CAR T hücresi sayısı en az 1,5 x 106'ya (genellikle toplamda yaklaşık 6 x 106 T hücresi) ulaşana kadar T hücrelerini genişletmeye devam edin (aşağıya bakın).
- Hücre sayısını her gün izleyin ve genişleme sırasında optimal hücre durumunu sağlamak için 100 birim / mL IL-2 ile desteklenmiş taze ortam ekleyerek konsantrasyonu 1 x 106 hücre / mL'ye ayarlayın.
- CAR eksprese eden T hücrelerinin zenginleştirilmesi
- 6 x 10,6 veya daha fazla dönüştürülmüş T hücresini 15 mL'lik bir tüpe aktarın ve 5 dakika boyunca 300 x g'da santrifüjleyin. PBSA yapmak için% 0.5 sığır serum albümini (BSA) ile desteklenmiş 320 μL PBS içinde hücre peletini yeniden süspanse edin ve 40 μL anti-NGFR manyetik boncuk ekleyin. İyice karıştırın ve 15 dakika buz üzerinde inkübe edin.
NOT: Bu protokol, yaklaşık% 25'lik bir transdüksiyon verimliliği olduğunu varsayar, bu da zenginleştirmeden sonra >1.5 x 106 CAR T hücresi ile sonuçlanır. 6 x 106 hücreden daha azıyla başlamanızı önermiyoruz, çünkü bu zayıf CAR T hücresi geri kazanımına neden olabilir. - Nihai hacmi 2 mL'ye getirmek için 1640 μL PBSA ekleyin, ardından üreticinin talimatlarına göre ayırma sütunlarını kullanarak manyetik ayırma işlemine devam edin.
- 6 x 10,6 veya daha fazla dönüştürülmüş T hücresini 15 mL'lik bir tüpe aktarın ve 5 dakika boyunca 300 x g'da santrifüjleyin. PBSA yapmak için% 0.5 sığır serum albümini (BSA) ile desteklenmiş 320 μL PBS içinde hücre peletini yeniden süspanse edin ve 40 μL anti-NGFR manyetik boncuk ekleyin. İyice karıştırın ve 15 dakika buz üzerinde inkübe edin.
- Akış sitometrisi ile CAR ekspresyonunun tespiti
NOT: Aşağıdaki testi gerçekleştirmeden önce uygun hücrelerin sağlanmasını sağlamak için CAR eksprese eden hücrelerin yüzdesini ve bu noktada yaşayabilirliklerini belirlemenizi öneririz. CD4 ve CD8 oranı ve bellek fenotipi de bu noktada belirlenebilir. Temsili çizimler için Şekil 1'e bakın.- 2.5 x 105 T hücrelerini hem transdüksiyonlu hem de transdüksiyonsuz kültürlerden ayrı akış sitometri tüplerine aktarın. Hücreleri 2 kez 200 μL PBS ile yıkayın, her yıkamadan sonra 5 dakika boyunca 300 x g'da santrifüjleyin.
- Her biri PBS'de 1:100 oranında seyreltilmiş anti-CD19 CAR FMC63 Idiotype PE, anti-CD3 BV480 ve anti-NGFR FITC antikorları içeren bir antikor karışımı hazırlayın. Hücreleri 50 μL antikor karışımında yeniden süspanse edin ve 4 ° C'de 20 dakika inkübe edin.
- Hücreleri 2 kez 200 μL PBS ile yıkayın, her yıkamadan sonra 5 dakika boyunca 300 x g'da santrifüjleyin. Hücreleri 200 μL PBS'de yeniden süspanse edin ve akış sitometrisi kullanarak analiz edin.
2. T hücrelerini ve hedef hücreleri kapsülleyen damlacıkların üretilmesi
NOT: Kapsüllemeden önce, T hücreleri ve JeKo-1 hücreleri, damlacık hücresel içeriğini izlemek için farklı hücre boyaları ile boyanır. Hücreler, tahlil reaktifleri ile kapsüllenir ve damlacıklar akış sitometresinde analiz edilmeden önce 2-6 saat inkübe edilir (bkz. Şekil 2).
- Kapsüllemeden önce hücrelerin boyanması
- Stok çözeltilerini (üreticinin talimatlarına göre hazırlanmış) dPBS'de 1:5.000 oranında seyrelterek iki floresan boyanın (bir menekşe boya ve bir uzak kırmızı boya kullandık) çalışma çözeltilerini hazırlayın.
- Her donör için 2,5 x 106 CAR T, 2,5 x 106 NTD T ve 15 x 106 JeKo-1 hücrelerini ayrı santrifüj tüplerine (15 mL veya 50 mL tüpler) aktarın ve 300 x g'da 5 dakika santrifüjleyin. Bu deneyde, hazırlanan her örnek için 0.5 x 106 efektör hücre, 1.5 x 106 hedef hücre ile kapsüllendi.
NOT: Buraya aktarılan hücre sayısı, her donör için her efektör hücre tipine sahip 4x kapsülleme numunesi için tasarlanmıştır. İhtiyaç duyulan numune sayısına göre hücre ve reaktif sayısını küçültün. Ek olarak, numune başına tam hücre sayısı deneysel ihtiyaçlara göre ölçeklendirilebilir. - Menekşe floresan boyanın 1: 5.000 çalışma çözeltisindeki süpernatan ve efektör hücre peletlerini ve uzak kırmızı floresan boyanın 1: 5.000 çalışma çözeltisindeki hedef hücre (JeKo-1) peletlerini çıkarın. Hücreleri bir pipetle ve 1 x 106 hücre / mL boyama çözeltisi hücre konsantrasyonuna kadar iyice yeniden süspanse edin.
- Hücreleri 37 ° C nemlendirilmiş bir CO2 inkübatörde 20 dakika inkübe edin. Hücreleri 5 dakika boyunca 300 x g'da santrifüjleyin, süpernatanı çıkarın ve hücreleri yıkamak için 15 mL tam RPMI-1640 ortamında yeniden süspanse edin.
- Yıkamayı tekrarlayın ve 5 dakika boyunca 300 x g'da santrifüjleyin. Süpernatanı çıkarın ve efektör hücre peletlerini 225 μL tam RPMI-1640'ta ve hedef hücre peletlerini 450 μL tam RPMI-1640'ta yeniden süspanse edin.
- Efektör hücre süspansiyonlarına 30 μL'lik bir gradyan ortamı ve hedef hücre süspansiyonlarına 60 μL'lik aynı gradyan ortamından ekleyin. Pipetlemeden önce gradyan orta stok çözeltisini iyice yeniden süspanse edin.
- Efektör hücre süspansiyonlarına 15 μL 20 μg/mL PI stoğu ve hedef hücre süspansiyonlarına 30 μL PI stoğu ekleyin. Nihai PI konsantrasyonu, aşağıda Granzyme B (GzmB) substratı eklendikten sonra sonunda 1 μg/mL olacaktır.
- Tam RPMI-1640'ta 1:10 oranında bir GzmB substratı seyreltmesi hazırlayın ve bu GzmB substrat seyreltmesinin 30 μL'sini efektör hücre süspansiyonuna ve 60 μL'sini hedef hücre süspansiyonlarına ekleyin. Pipet ile iyice karıştırın.
NOT: Her bir efektör hücre peletlerine eklenen reaktiflerin toplam hacmi şimdi 300 μL ve hedef hücre peletlerine 600 μL olmalıdır. Bu çözeltilerdeki gradyan orta konsantrasyonu %10, PI konsantrasyonu 1 μg/mL ve GzmB substrat konsantrasyonu 1:100 olmalıdır. - CD3, CD4 ve CD8 antikorlarını kullanarak alternatif etiketleme
NOT: Bazı durumlarda, hedef hücrelerle birlikte kapsüllemeden önce efektör hücreleri daha fazla etiketlemek ilgi çekici olabilir. Burada, CD3, CD4 ve CD8 antikorları ve PBMC kullanarak bu tür etiketleme için prensip kanıtını gösteriyoruz (bkz. Şekil 3).- 2.0 x 106 PBMC'yi 1.5 mL'lik bir tüpe aktarın ve hücreleri 300 x g'da 5 dakika döndürün. Süpernatanı çıkarın ve hücre peletini %0,5 BSA ile 200 μL dPBS'de yeniden süspanse edin. İçeriği 2 mL'lik iki tüpe bölün.
- Tüplerden birine 5 μL anti-CD3-APC ve 5 μL anti-CD4-StarBright Violet 760 ekleyin. Diğer tüpe 20 μL anti-CD3-FITC ve 5 μL anti-CD8-StarBright Violet 760 ekleyin.
- İyice karıştırın ve karanlıkta oda sıcaklığında 30 dakika inkübe edin. Hücrelere 1 mL yıkama tamponu ekleyin, 5 dakika boyunca 300 x g'da döndürün, süpernatanı çıkarın ve hücre peletlerini %0.5 BSA ile 1 mL dPBS'de yeniden süspanse edin.
- Hücreleri 5 dakika boyunca 300 x g'da döndürün, süpernatanı çıkarın ve hücre peletlerini fenol kırmızısı ve% 10 gradyan ortamı olmadan 150 μL RPM'de yeniden süspanse edin. Fenol kırmızısı içermeyen RPMI, hücreler için %33 stabilize edici çözelti ve dış ortam olarak %10 gradyan ortamı kullanarak adım 2.2'de açıklandığı gibi kapsülleyin.
- Hücrelerin kapsüllenmesi
- Kapsüllemeden önce bir kapsülleme kartuşunu ve stabilize edici çözeltiyi oda sıcaklığına önceden ısıtın. Tam RPMI-1640 ortamı, hücreler için %33 stabilize edici çözelti ve %10 gradyan ortamından oluşan bir dış ortam stoğu hazırlayın.
- Her kapsülleme numunesi için, karışık hedef efektör hücrelere sahip bir hücre numunesi çözeltisi hazırlayın. Bir pipet ile iyi hazırlanmış hücre çözeltilerini yeniden süspanse edin ve 65 μL hazırlanmış efektör hücre süspansiyonunu 65 μL hazırlanmış hedef hücre süspansiyonu ile 1.5 mL tüplerde karıştırın (her ikisi de adım 2.1'de hazırlanır).
- Uygun kapsüllemeyi sağlamak için kapsülleme kartuşunun belirtilen kuyucuklarını aşağıdaki sırayla reaktiflerle yüklemeye hemen devam edin. Hazırlanan her kapsülleme numunesi için bir set kuyucuk yükleyin.
İyi #A: 400 μL dış ortam.
İyi #D: Küçük rafta 40 μL dış ortam.
İyi #C: Hedef hücreler (JeKo-1) ve efektör hücreler ile 120 μL önceden karıştırılmış çözelti. Yüklemeden hemen önce hücreleri bir pipetle iyice yeniden askıya alın.
Kuyu #B: 250 μL yağ.
NOT: Paralel kapsülleme için her kartuşa 8 adede kadar numune yüklenebilir. - Yüklü kartuşu eğmekten, sallamaktan veya çarpmaktan kaçınırken hemen conta sızdırmazlığına ve kartuşu cihaza yüklemeye devam edin. Contayı dikkatlice kartuşun üzerine kapatın.
- Kartuşu dikkatlice mikroakışkan cihazına aktarın ve kullanım kılavuzunda açıklandığı gibi kapsüllemeyi başlatın.
- Üretilen damlacıklar, çevredeki dış ortamdan daha yüksek yoğunluklara sahiptir ve toplama kuyusunun dibinde hızla çökelir (Kuyu #D). Her damlacık üretimini (tüm damlacıklar ve çevresindeki dış ortam), çökeltilmiş damlacıkları üst üste binme ortamında Kuyu #D'den yeniden süspanse ederek ve bunları kapaklı 2 mL düşük bağlayıcı bir DNA tüpüne aktararak toplayın. Kalan damlacıkları toplamak için Well #D'yi Well #A'dan kalan dış ortamla yıkayın.
- Damlacıklar toplama tüplerinde çökeldiğinde (yaklaşık 1 dakika sürer), damlacık üretimini parlak alan mikroskobunda inceleyerek doğrulayın. Bunu yapmak için, 10 μL'lik bir pipet ucunu bir numune ile doldurun: yaklaşık 1/3'ü damlacık fazının yüzeyinden gelen damlacıklarla (beyaz faz) ve yaklaşık 2/3'ü ucu doldurmak için üst üste binen dış ortamla. Numuneyi hemen 8 odacıklı bir cam slayta yükleyin ve hücrelerle damlacık yüklemesini doğrulamak için damlacıkları 4x ve 20x büyütmede parlak alan mikroskobu ile inceleyin.
NOT: Bu şekilde damlacıkların çevredeki ortamın daha büyük bir hacminde aspire edilmesi önemlidir.
- Kuluçka
NOT: Damlacıklar artık standart bir nemlendirilmiş 37 ° C,% 5 CO2 inkübatörde 2 mL DNA düşük bağlayıcı tüplerde inkübe edilebilir. Damlacık kültürü için en uygun yüzey özelliklerine sahip oldukları için bu tüpleri kullanmanızı öneririz.- Bir şırınga iğnesi (23G) ile, gerekli sayıda 2 mL düşük bağlayıcı DNA tüpünün kapağını dikkatli ve güvenli bir şekilde delin. Bu, ortamın buharlaşmasını önlerken serbest CO2 / O2 difüzyonunu sağlayacaktır.
- Her inkübasyon tüpüne 1 mL dış ortam ekleyin. Uygun tamponlamayı sağlamak için damlacıklar en az 5x hacimde dış ortamla inkübe edilmelidir. Eklenen dış ortamın hacmi, uygulanan hücrelerin metabolizmasına bağlı olarak arttırılabilir.
- Üst üste binme ortamında oluşan damlacıkları yeniden süspanse edin ve her üretimi hazırlanan üç inkübasyon tüpüne bölün (her zaman noktası ölçümü için bir tane). Damlacıklar ağırdır ve tortu hızlıdır ve bu nedenle her transfer arasında stoğu yeniden askıya almak önemlidir.
NOT: Damlacık üretimlerinin bölündüğü inkübasyon tüplerinin sayısı değişebilir, ancak her numunenin analiz için yeterli olay içerdiğinden emin olmak için bir üretimi en fazla 4 inkübasyon tüpüne bölmenizi öneririz. - Damlacık oluşumundan sonra tüpleri 2 saat, 4 saat veya 6 saat inkübatöre dik olarak yerleştirin.
3. Damlacıkların aşağı akış analizi
- Mikroskopi
- İnkübasyondan sonra, az sayıda damlacığı adım 2.2.7'de açıklandığı gibi bir mikroskop lamına aktarın ve bunları uygun lazer ve filtre konfigürasyonuna sahip standart bir floresan mikroskobu kullanarak parlak alan ve floresan mikroskobu ile analiz edin.
NOT: Damlacıklar parlak alan mikroskobu ile tespit edilebilir. Menekşe lekeli T hücreleri bir DAPI filtresi ile, uzak kırmızı lekeli JeKo-1 hücreleri bir APC filtresi ile, GzmB-FAM sinyali bir FITC filtresi ile ve PI sinyali bir PE filtresi ile tespit edilebilir. Erken apoptotik hücreler, geç apoptotik hücrelerden daha düşük bir tepe emisyonuna sahip olduğundan, en çok ilgi çeken PI sinyalinin mikroskopi ile görüntülenmesi zor olabilir. Temsili veriler için Şekil 4'e bakın.
- İnkübasyondan sonra, az sayıda damlacığı adım 2.2.7'de açıklandığı gibi bir mikroskop lamına aktarın ve bunları uygun lazer ve filtre konfigürasyonuna sahip standart bir floresan mikroskobu kullanarak parlak alan ve floresan mikroskobu ile analiz edin.
- Akış sitometrisi
- İnkübasyondan sonra, her bir damlacık örneğini kaplama ortamında yeniden süspanse edin ve 5 mL FACS tüplerine aktarın. Aşağıda listelenen genel yönergeleri izleyerek standart bir akış sitometresi kullanarak damlacıkları analiz edin.
- Uygun lazer ve filtre konfigürasyonuna sahip bir akış sitometresi kullanın. Seçilen hücre boyaları ve tahlil paneli ile, burada kullanılan akış sitometresinde renk telafisi gerekli değildir. Başka renkler uygulanmışsa veya uygulanan akış sitometresinin konfigürasyonu farklıysa, kompanzasyon gerekli olabilir.
- Küçük yağ olaylarından arka plan gürültüsünü dışlamak için eşik tetikleyici olarak FSC-H'yi kullanın.
- Damlacıklar ağırdır ve FACS tüplerinin dibinde tortu oluşturur. SIP'nin damlacıklara ulaştığından emin olun. Damlacıklar, alımdan önce damlacıklara en az 5x dış tampon hacminde askıya alınmalıdır.
- Damlacık olayları yüksek hız kullanılarak elde edilir. Damlacıklar analiz edilirken yoğunluk yüksekliği ölçümleri kullanıldığından, FSC ve SSC ve incelenen floroforlar için yoğunluk yüksekliği (H) sinyallerini kaydedin. Olumlu ve olumsuz olayların uygun şekilde ayrılmasını sağlamak için kazançları ayarlayın.
NOT: GzmB sinyalini ölçmek için FITC kanalını, mor lekeli T hücrelerini tespit etmek için Pasifik Mavisi kanalını, uzak kırmızı lekeli JeKo-1 hücrelerini tespit etmek için APC kanalını ve PI sinyalini tespit etmek için PE kanalını kullandık. - Aşağı akış analizi için yeterli olayı kaydedin. Burada, zaman noktası başına 4,5 - 8,3 x 103 birlikte kapsüllenen damlacıkları kaydettik.
- Standart temizleme ve durulama solüsyonları kullanarak her damlacık alımından sonra akış sitometresini SIP'den yıkayın. Deneyin sonunda akış sitometresini iyice temizleyin. Temsili veriler için Şekil 4 ve Şekil 5'e bakın.
- İnkübasyondan sonra, her bir damlacık örneğini kaplama ortamında yeniden süspanse edin ve 5 mL FACS tüplerine aktarın. Aşağıda listelenen genel yönergeleri izleyerek standart bir akış sitometresi kullanarak damlacıkları analiz edin.
- Verilerin analizi
- GzmB salgılayan T hücrelerinin yüzdesini, söz konusu zaman noktasında yalnızca T hücresi damlacık popülasyonlarında belirlenen T hücresi canlılığına normalize edilmiş GzmB pozitif T hücresi ve JeKo-1 hücresi ko-kapsülasyonlarının yüzdesine dayalı olarak aşağıdaki gibi hesaplayın:
Damlacıklar T hücresi+, Jeko-1+, GzmB+ / (Damlacıklar T hücresi+, Jeko-1+ - Damlacıklar ölü T hücresi+, Jeko-1+)
burada Damlacıklar ölü T hücresi+, Jeko-1+, yalnızca T hücreli damlacıklarda ölümden tahmin edilir: Damlacıklarölü T hücresi+, Jeko-1+ = DamlacıklarT hücresi+, Jeko-1+x Damlacıklar ölü T hücresi+, Jeko-1- / DamlacıklarTcell+, Jeko-1-. - Hedef hücrelerini öldüren T hücrelerinin yüzdesini aşağıdaki gibi hesaplayın:
Yüzde sitotoksik T hücreleri = (Gözlenen ölüm - Arka plan ölümü)/(100 - Arka plan ölümü)
burada arka plan ölümü, (T hücresi +, Jeko-1 +) ya öldürmeye bağlı olmayan ölümden ya da kapsüllemeden önce meydana gelen ölümden kaynaklanan damlacıklar içinde bulunan ölümdür. - (T hücresi +, Jeko-1-) damlacıklarında ve (T hücresi-, Jeko-1 +) damlacıklarında hücre ölümünden kaynaklanan arka plan ölümünü tahmin edin:
Arka plan ölümü = (1- (1- DamlacıkThücresinde ölüm oranı-, Jeko-1+) x (1- DamlacıkT hücresinde ölüm oranı+, Jeko-1-)) x 100
burada ölüm oranı, sırasıyla yalnızca T hücresi damlacıklarında ve yalnızca JeKo-1 hücresi damlacıklarında % PI pozitif damlacık olarak doğrudan ölçülür. Tüm hesaplamalar, örnekleme zamanına özgü sayılarla gerçekleştirilir.
- GzmB salgılayan T hücrelerinin yüzdesini, söz konusu zaman noktasında yalnızca T hücresi damlacık popülasyonlarında belirlenen T hücresi canlılığına normalize edilmiş GzmB pozitif T hücresi ve JeKo-1 hücresi ko-kapsülasyonlarının yüzdesine dayalı olarak aşağıdaki gibi hesaplayın:
Sonuçlar
Transdüksiyonu takiben, T hücreleri, anti-CD3 ve anti-NGFR antikorları kullanılarak akış sitometrisi ile CAR ekspresyonu açısından analiz edildi. CAR T hücre popülasyonu daha sonra anti-NGFR manyetik boncuklar kullanılarak zenginleştirildi ve her iki donör için %98'in üzerinde bir saflık elde edildi (Şekil 1A-B). Kullanılan sıralanmış CAR hücrelerinin CD4 / CD8 oranı ve bellek fenotipi de CCR7 ve CD45RA antikorlarını kullanan standart bir kapı stratejisi kullanılarak ölçüldü. Bu veriler, kullanılan CAR T hücrelerinin CD4/CD8 oranının 0.73 olduğunu ve hücrelerin esas olarak naif benzeri bellek fenotipine sahip olduğunu göstermektedir (Şekil 1C-E).
CAR T hücreleri ve JeKo-1 hücreleri sırasıyla mor ve uzak kırmızı boyalarla boyandı ve tahlil reaktifleri GzmB substratı ve PI ile birlikte DE50 damlacıkları içinde kapsüllendi (Şekil 2). Alternatif olarak, CAR T hücreleri, anti-CD4 veya anti-CD8 gibi antikorlar kullanılarak da etiketlenebilir (Şekil 3), bu da T hücrelerinin daha ayrıntılı bir karakterizasyonunu sağlar. Her bir T hücresi süspansiyonu (CAR T veya NTD), bir efektörde kapsüllemeden hemen önce bir JeKo-1 hücre süspansiyonu ile karıştırıldı: hedef hücre oranı 1: 3 (0.5 x 106 T hücreleri ve 1.5 x 106 JeKo-1). Kapsüllemeyi takiben, her damlacık üretimi (CAR T hücreleri + JeKo-1 ve NTD + JeKo-1) sırasıyla 2 saat, 4 saat ve 6 saat inkübasyon için üç inkübasyon tüpüne bölündü. Hücreler, damlacıkların içinde 37 °C'de% 5 CO2 içinde inkübe edildi ve daha sonra belirtilen zaman noktalarında mikroskopi ve akış sitometrisi ile analiz edildi.
4 saatlik inkübasyondan sonra çift emülsiyon damlacıklarının floresan mikroskobu yapıldı (Şekil 4). Yeşil floresan sinyalinin (FITC) yoğunluğu, DE50 damlacıkları içindeki CAR T hücrelerinin veya NTD'lerin salgılanan GzmB aktivitesinin seviyesini gösterir. Şekil 4B , yakın temas halinde bir CAR T hücresi ve bir JeKo-1 hedef hücresi içeren tek bir GzmB pozitif damlacığın faz kontrastı ve floresan mikroskobu görüntülerini sunar.
Daha sonra, DE50 damlacıkları, erken GzmB sekresyonu ve sitotoksik hücre öldürme aktivitesine sahip CAR T hücrelerinin yüzdesini ölçmek için akış sitometrisi ile analiz edildi (Şekil 5). JeKo-1 hedef hücrelerinin uzak kırmızı bir boya ile ve efektör T hücrelerinin kapsüllemeden önce mor bir boya ile inkübasyon öncesi boyanması, hücreler Poisson dağılımına dayalı olarak damlacıklar halinde dağıtıldığından, hücre içeren üç farklı damlacık popülasyonunun tanımlanmasını kolaylaştırdı. Tanımlanan damlacık popülasyonları, tek başına T hücreleri, tek başına JeKo-1 hücreleri ve birlikte T hücreleri ve JeKo-1 hücreleri olan damlacıklardır (Şekil 5A). JeKo-1 hücreleri ile birlikte kapsüllenen T hücrelerini kaplayan damlacıklar, PI ile gösterildiği gibi GzmB aktivitesini (Şekil 5B) ve hücre ölümünü (Şekil 5C) gösteren sinyaller için kapılandı ve analiz edildi.
Hücrelerin damlacıklar halinde kapsüllenmesi Poisson dağılımını takip eder ve dört farklı damlacık popülasyonu elde edilir (Şekil 6A). Şekil 6B , spontan GzmB salgılayan T hücrelerinin yüzdesinin belirlenebildiği damlacıkların 6 saatlik inkübasyonundan sonra tüm damlacık popülasyonlarındaki GzmB pozitif damlacıkların seviyesini göstermektedir. Bu veriler, yalnızca CAR T hücreleri GzmB salgıladığı için yöntemin yüksek özgüllüğünü göstermektedir.
Son olarak, 2 saat, 4 saat ve 6 saatlik birlikte inkübasyonun ardından zaman noktalarında GzmB ve PI seviyelerini ölçtük. Referans olarak, sadece T hücreleri ve sadece JeKo-1 hücreleri içeren damlacıklar, her popülasyondaki arka plan hücre ölümünü incelemek için analiz edildi (Şekil 6C). Arka plan hücre ölümü, adım 3.3'te açıklandığı gibi, efektör hücrelerin popülasyonundaki canlı GzmB salgılayan ve hedef hücre öldürücü T hücrelerinin yüzdesini belirlemek için kullanıldı (Şekil 7). İki donörden alınan CAR T hücreleri, hem hedef hücre kaynaklı GzmB sekresyonunda hem de hücre öldürme aktivitesinde zamana bağlı bir artış sergiledi. Donör 1'den gelen canlı CAR T hücrelerinin yaklaşık% 36'sı ve Donör 2'den% 31'i, hedef hücre ile 6 saatlik ko-kapsüllemeden sonra GzmB salgılamıştır, bu NTD kontrol T hücrelerine kıyasla önemli bir artıştır (Şekil 7A). Buna bağlı olarak, canlı Donör 1'in yaklaşık% 21'i ve canlı Donör 2 CAR T hücrelerinin% 22'si, pozitif bir PI sinyali ile gösterildiği gibi hedef hücreleri öldürmüştür (Şekil 7B). GzmB salgılayan CAR T hücrelerinin yüzdesi, GzmB aracılı sitotoksisitede beklenen olay dizisi ile tutarlı olarak, her zaman noktasında öldürülen hedef hücrelerin yüzdesini aştı. Birlikte ele alındığında, bu veriler, burada sunulan yöntemin, bir hücre popülasyonu içindeki bireysel T hücresi sitotoksisitesindeki heterojenliğin karakterizasyonuna ve farklı popülasyonlar arasındaki karşılaştırmalara izin verdiğini göstermektedir.
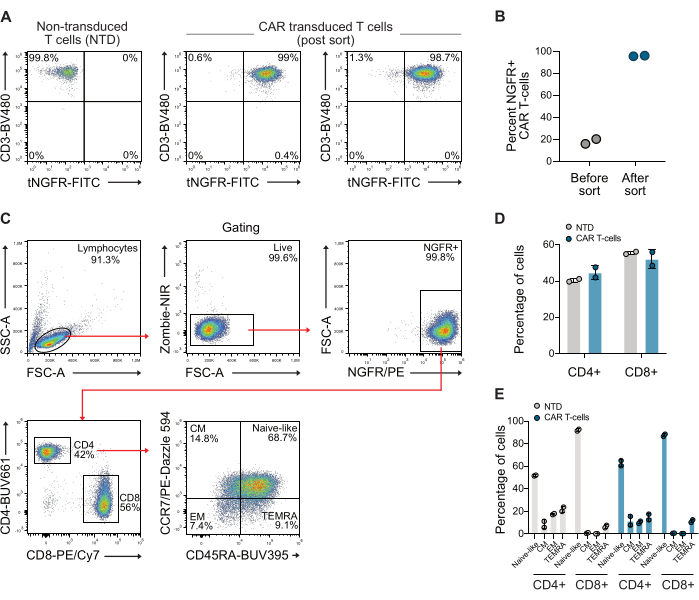
Şekil 1: NGFR sıralamasını takiben temsili akış sitometrisi grafikleri. (A) Yaklaşık 10 günlük genişlemenin ardından, CAR T hücreleri, NGFR'ye özgü mikro boncuklar ve manyetik sıralama kullanılarak sıralandı ve bu, %>98 CAR T hücresi olan bir CAR T hücresi popülasyonu ile sonuçlandı. (B) Bu çalışmada kullanılan iki donörden alınan CAR T hücrelerinin tasnif öncesi ve sonrası miktarının belirlenmesi. (C) T hücrelerinin CD4 / CD8 oranını ve hafıza fenotipini incelemek için kullanılan geçit stratejisi. (D) Kullanılan T hücrelerinin CD4 ve CD8'inin miktar tayini. (E) Kullanılan T hücrelerinin hafıza fenotipinin nicelleştirilmesi. Kısaltma: CM = merkezi bellek, EM = efektör bellek, NTD = transdüksiyonsuz, TEMRA = terminal olarak farklılaşmış efektör hücreler. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
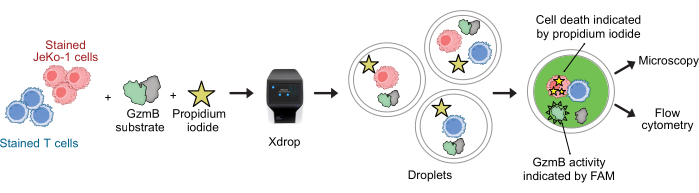
Şekil 2: Damlacıklarda tek hücre çözünürlüğü ile kombine GzmB sekresyonu ve sitotoksisite deneyi için iş akışı. DE damlacıklarında kapsüllemeden önce, hedef ve efektör hücreler mor ve uzak kırmızı hücre boyaları kullanılarak ayrı ayrı boyanır. Mikroakışkanlar cihazı ve kapsülleme kartuşu kullanılarak, efektör hücreler, hücre ortamı, PI ve FAM etiketli GzmB peptit substratı ile birlikte damlacıklar halinde hedef hücrelerle birlikte kapsüllenir. Tahlil ve inkübasyon damlacıklar içinde gerçekleşir. Salgılanan GzmB aktivitesi, GzmB substratı parçaladıktan sonra meydana gelen yeşil floresan emisyonu ile gösterilir. Hücre ölümü PI ile gösterilir. İnkübasyondan sonra, DE50 damlacıkları mikroskopi ve/veya akış sitometrisi ile analiz edilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
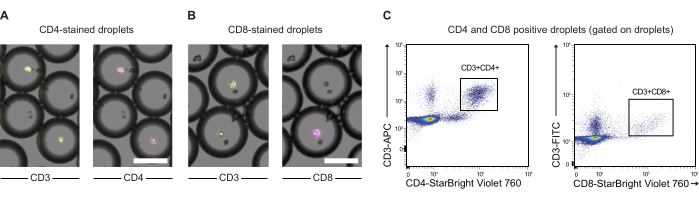
Şekil 3: Anti-CD3, anti-CD4 ve anti-CD8 antikorları ile önceden etiketlenmiş damlacık kapsüllü PBMC'lerin analizi. (A) Anti-CD3 (APC) ve anti-CD4 (NIR) antikorları ile önceden etiketlenmiş kapsüllenmiş PBMC'lere sahip damlacıkların mikroskopi görüntüleri. Ölçek çubuğu = 100 μm. (B) (A) olarak, ancak bunun yerine CD3 (FITC) ve anti-CD8 (NIR) etiketlemesi ile. Ölçek çubuğu = 100 μm. (C) Aynı damlacıkların akış sitometrisi analizi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
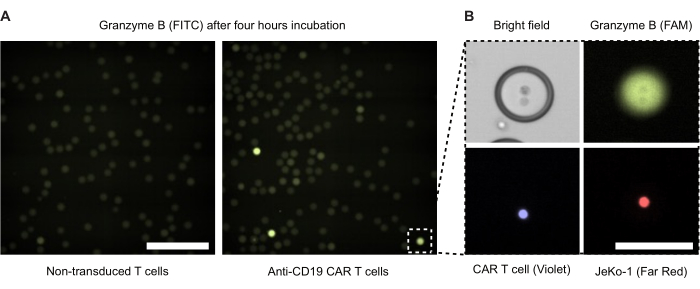
Şekil 4: Efektör ve hedef hücrelere sahip damlacıkların mikroskop görüntüleri. Görüntüler, standart 37 °C,% 5 CO2 nemlendirilmiş hücre inkübatöründe 4 saatlik inkübasyondan sonra çekildi. (A) GzmB pozitif (yeşil) damlacıkları tespit etmek için FITC kanalı kullanılarak floresan mikroskobu ile görüntülenen kapsüllenmiş NTD ve JeKo-1 hücreleri (solda) veya CAR T hücreleri ve JeKo-1 hücreleri (sağda) olan bir numuneden damlacıklar. Ölçek çubuğu = 500 μm. (B) Faz kontrastı, FITC (GzmB), APC (JeKo-1 hücresi) ve DAPI (CAR T hücresi) ile görüntülenen tek bir damlacık. Ölçek çubuğu = 100 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
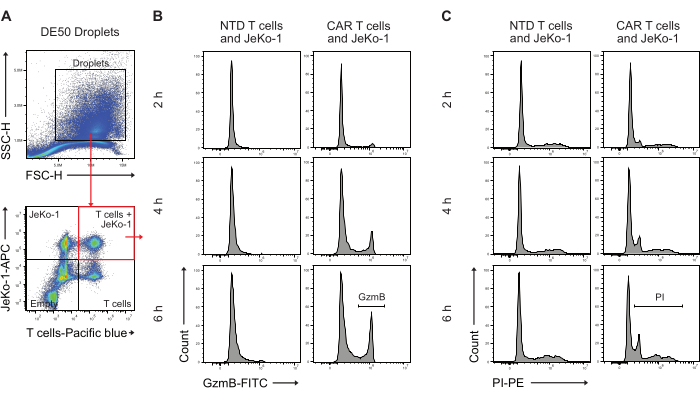
Şekil 5: İnkübasyonu takiben akış sitometrisi ile damlacıkları analiz etmek için geçit stratejisi. (A) Geçitleme, damlacıkları tanımlamak için ileri ve yan saçılma ile yapıldı, ardından damlacıkları içeren kapı seçildi. Kapının dışındaki olaylar, çift emülsiyonlu damlacık üretiminin bir yan ürünü olarak üretilen yağ damlacıklarını temsil eder. Uygulanan hücre lekelerine karşılık gelen kanallardaki damlacıkların müteakip floresan analizi, dört damlacık popülasyonunu tanımlar: hem T hücrelerini hem de JeKo-1 hücrelerini içeren damlacıklar (kırmızı kare); tek başına JeKo-1 hücreleri ile damlacıklar; tek başına T hücreli damlacıklar; ve boş damlacıklar. (B) Zaman noktaları boyunca ve NTD ve CAR T hücreleri arasında çift pozitif damlacıklarda GzmB sinyali için temsili histogramlar. (C) Zaman noktaları boyunca ve NTD ile CAR T hücreleri arasında çift pozitif damlacıklarda PI sinyali için temsili histogramlar. Tüm damlacık ölçümleri yoğunluk yüksekliği (H) ölçümleri olarak gerçekleştirilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
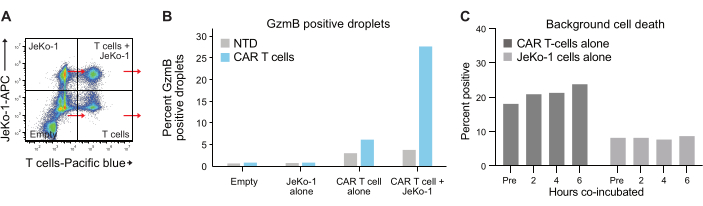
Şekil 6: İç kontrol ve referans popülasyonları. (A) Şekil 5A'daki dört kadranın her biri seçildi ve her birinde GzmB ve PI ölçüldü. Bu tür bir niceleme, T hücresi etkinliğinin nihai bir analizi yapılmadan önce arka plan sinyallerinin ölçülmesine ve çıkarılmasına izin verir. (B) Dört damlacık popülasyonunun her biri için 6 saatlik inkübasyondan sonra GzmB pozitif damlacıkların frekansını gösteren grafik, Donör 1 CAR T örneğinden elde edilen verilerle örneklenmiştir. (C) Arka plan hücre ölümü, donör 1'den alınan verilerle ölçülen her zaman noktasında yalnızca JeKo-1 ve yalnızca T hücresi kontrol damlacık popülasyonlarında belirlendi. Arka plan hücre ölümü, Şekil 7'de gösterilen ve adım 3.3'te açıklanan canlı GzmB salgılayan ve hücre öldürücü efektör hücrelerin frekansını hesaplamak için kullanılır. Kısaltmalar: Pre = kapsülleme. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
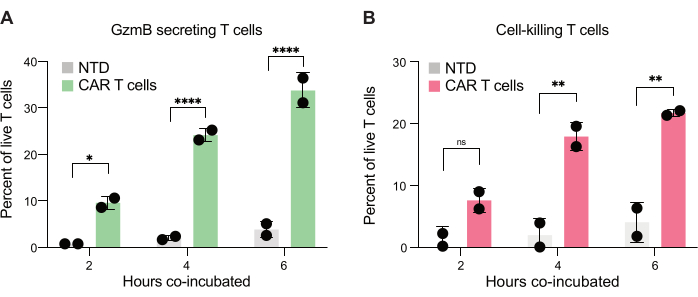
Şekil 7: Çift pozitif damlacıklarda GzmB salgılayabilen ve JeKo-1 hücrelerini öldürebilen T hücrelerinin miktar tayini. İki donörden alınan çift pozitif damlacıklar, damlacıklarda 2 saat, 4 saat ve 6 saat birlikte inkübasyonun ardından incelendi. (A) GzmB salgılayan hedef hücre ile karşılaşan T hücrelerinin sıklığı ve NTD T hücreleri ile CAR T hücreleri arasındaki karşılaştırma. (B) Birlikte kapsüllenmiş hedef hücreyi öldüren hedef hücreyle karşılaşan T hücrelerinin sıklığı. Kısaltmalar: GzmB = granzim B, NTD = dönüştürülmemiş, PI = propidyum iyodür. * = P değeri < 0.05, ** = P değeri < 0.005, **** = P değeri < iki yönlü ANOVA ile 0.0001. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Burada, CD19 pozitif manto hücreli lenfoma hücre hattı JeKo-1 ile ko-enkapsülasyon üzerine CD19-CD28-CD3z CAR T hücrelerinin sitotoksik potansiyelini değerlendirmek için kullanımı kolay, ticari olarak temin edilebilen bir mikroakışkan cihazı kullanarak T hücrelerinin sitotoksik potansiyelini tek hücre düzeyinde incelemek için bir yöntem sunuyoruz.
Bu protokolde birkaç kritik adım vardır. İlk olarak, yanlış pozitif sonuçlardan kaçınmak için herhangi bir test yapmadan en az 48 saat önce stimülasyon boncuklarının T hücrelerinden çıkarılmasını öneririz. İkinci olarak, CAR'lar veya T hücresi reseptörleri gibi yapılarla T hücresi transdüksiyon verimliliği önemli ölçüde değişebilir. Transdüksiyona uğrayan T hücrelerinin müteakip bir saflaştırma adımı olmadan, sonuçların yorumlanması zor olabilir. Burada, saf bir CAR T hücresi popülasyonu kullanıldı ve bu nedenle, CAR T hücrelerini her zaman noktasında öldürücü veya öldürücü olmayan olarak karakterize ederken yüksek derecede bir kesinlik beklenebilir. Alternatif olarak, CAR'ların floresan proteini veya genetik etiket ile etiketlenmesi, CAR pozitif olan hücreleri belirtmek için uygulanabilir ve daha sonra damlacıkları analiz ederken üzerine geçit yapılabilir. Etiketleme kullanılıyorsa, seçilen floresan molekülleri, diğer tahlil floroforlarının hiçbirinden kaynaklanan floresan emisyonlarına müdahale etmemelidir. Örneğin, GFP etiketlemesinin kullanılması, burada gerçekleştirilen deneylerde uygulanan FAM etiketli GzmB substratına müdahale eder ve bu nedenle önerilmez.
Burada özetlenen protokolün önemli bir avantajı, damlacık üretiminin kendisinin basitleştirilmiş ve otomatikleştirilmiş olmasıdır. Bununla birlikte, tek hücreli kapsüllemeyi sağlamak için, kartuş yüklemeden önce hücrelerin tamamen yeniden askıya alınması önemlidir. Bu nedenle, kartuşu yüklemeye hazırlanırken makul bir hızda çalışmanız önerilir. Benzer bir husus, GzmB substratı eklenirken de geçerlidir, çünkü bazı hücreler GzmB'nin yüksek salgılayıcılarıdır. Hücrelerin yeniden süspansiyonu, küçük kartuşlu mikroakışkan kanalların tıkanmasını da önleyecektir. Hücrelerin uygun şekilde kapsüllenmesi, yukarıda belirtildiği gibi mikroskopi ile kolayca kontrol edilir.
Damlacık hücre ortamını kapsadığından ve hücrelerden salgılanan hücresel ürünleri tuttuğundan, diğer sitokinler, antikorlar ve bileşikler analiz edilebilir. Gerçekten de, mevcut protokolün değiştirilmesini gerektiren IFN-γ ve TNF-α gibi diğer ilgili bağışıklık hücresi tarafından salgılanan molekülleri test ettik. Sitokin tespiti için, efektör hücre yüzeyi32 üzerinde bir ELISA sandviçinin oluşturulması gibi, burada GzmB için kullandığımızdan farklı bir test formatı uygulanabilir. Ek olarak, hücre lekeleri ve tahlil renkleri değiştirilebilir, örneğin karboksifloresein süksinimidil ester (CFSE), ancak standart akış sitometrisinde olduğu gibi farklı renk kombinasyonlarında minimum kanama sağlamak veya hiç kanama olmamasını sağlamak önemlidir.
Ayrıca, bu protokol CAR T hücrelerini analiz etmekle sınırlı değildir. Ayrıca diğer T hücresi / hedef etkileşimlerini veya CAR NK hücreleri gibi diğer bağışıklık hücrelerini incelemek için genişletilebilir. Daha ileri deneyler de öngörülebilir, örneğin daha geniş fonksiyonel immünofenotipleme gerçekleştirmek için CD4 ve CD8 T hücresi alt kümelerinin ek floroforlarla renklendirilmesi. Gerçekten de, burada damlacıklarda CD4 ve CD8'in tespit edilebileceğini ve böylece efektör T hücrelerinin ve sitotoksik kapasitelerinin daha fazla karakterizasyonunu mümkün kıldığını gösteriyoruz.
Bu protokolü optimize ederek, özellikle standart akış sitometrisi cihazlarında çalışmasını hedefledik. Damlacık akış sitometrisi karmaşık olmasa da, akış sitometresi belirli aralıklarla veya her zaman aralığında numunelerin analizinden sonra burada önerildiği gibi uygun şekilde durulanmazsa yağ birikmesinin meydana gelebileceğini fark ettik. En iyi durulama protokolü, her bir akış sitometresi için spesifik olabilir.
Bu yöntemin önemli avantajlarından biri, kapsamlı uzmanlığa veya son derece özel ekipmana ihtiyaç duymadan hedef hücrelere karşı tek hücreli efektör aracılı sitotoksisitenin izlenmesine izin veren yüksek verim kapasitesidir. Test, akış sitometrisi veya mikroskopi gibi mevcut araçlar kullanılarak kolayca yapılabilir. Çift emülsiyon damlacıkları, sitotoksik potansiyeli olan ve olmayan CAR T hücreleri gibi belirli işlevlere sahip hücrelerin izolasyonunu ve ardından tek hücreli transkriptom analizini sağlayabilen hücre sıralayıcıları30,31 kullanılarak sınıflandırmaya da uygundur.
Teknoloji sınırsız değildir. Bazı hücre hatları damlacıklardaki kültürü 24 saat ve daha uzun süre tolere ederken, birincil hücreler 24 saat sonra önemli ölçüde daha düşük canlılığa sahip olabilir. Bu, genel olarak tahliller üzerinde bir zaman kısıtlamasını temsil eder, ancak mevcut tahlil için, gözle görülür GzmB ve hücre öldürme aktivitesi 4-6 saat içinde gözlemlenebilir, çünkü küçük damlacık bölmesi, efektör ve hedef hücrelerin hızlı bir şekilde karşılaşmasını sağlar. Benzer şekilde, küçük damlacık hacmi, salgılanan GzmB parçalanmış substratın tespit edilebilir seviyelerine konsantrasyonda hızlı bir birikim sağlayacaktır. Teknolojinin bir başka sınırlaması, standart akış sitometreleri kullanılırken efektör hücreler tarafından seri öldürmenin tespit edilememesidir. Bununla birlikte, bu, araştırılması gereken görüntü akış sitometreleri veya görüntü sitometrisi teknolojileri ile mümkün olabilir.
CD19 CAR T hücrelerinin adoptif transferi, hematolojik maligniteleri olan hastaların tedavisinde dikkate değer bir başarı göstermiştir. Buna rağmen, hastalarda32 büyük bir yanıt varyasyonu ve öngörülemeyen toksisite vardır, bu kısmen CAR T infüzyon ürünü içindeki heterojenliğe bağlı olabilir. Sonuç olarak, bir popülasyon içindeki bireysel CAR T hücrelerinin fenotipik bileşimini ve sitotoksik yeteneğini analiz etmeye artan bir ilgi vardır. CAR tedavisi otoimmün koşullarda ve diğer kanser türlerinde giderek daha fazla test edildiğinden, bu özellikle önemli olacaktır. Burada açıklanan mikroakışkan cihaz ve protokol, CAR T hücrelerinin ve diğer hücre bazlı tedavilerin heterojenliğini incelemek için sağlam ve çok yönlü bir yaklaşım sunar.
Açıklamalar
Yazarlar aşağıdaki çatışan çıkarları beyan ederler: M.B.B., bu çalışmayla ilgisi olmayan Janssen, Roche ve Kite/Gilead'dan danışmanlık onurları almıştır. D.L.P. ve P.M. Samplix'in çalışanlarıdır.
Teşekkürler
Yazarlar, yararlı tartışmalar ve öneriler için CITCO ve Samplix üyelerine ve çalışanlarına teşekkür etmek isterler. MBB, Lundbeck Vakfı'ndan (R381-2021-1278) Erken Kariyer Klinisyen Bilim İnsanları bursu ile desteklenmektedir. Bu çalışma, Odense Üniversite Hastanesi'nden seçkin bir araştırma bursu ile desteklenmektedir. Ayrıca, bu araştırma Avrupa İnovasyon Konseyi Projesi'nden Samplix ApS'ye 190144395 bir hibe ile desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| Blocker BSA (BSA) | Thermo Scientific | 37525 | |
| CellTrace Far Red Cell Proliferation Kit (far red fluorescent dye) | Invitrogen | C34564 | |
| CellTrace Violet Cell Proliferation Kit (violet fluorescent dye) | Invitrogen | C34557 | |
| DE Stabilizing Solution (stabilizing solution) | Samplix | REDIVSTABSOL1500 | |
| DPBS (dPBS) | Gibco | 14190-094 | |
| Dulbecco’s PBS (dPBS) | Capricorn Scientific | PBS-1A | |
| Dynabeads Human T-Activator (CD3/CD28 activation beads) | Gibco | 11132D | |
| Fetal Bovine Serum (FBS) | Capricorn Scientific | FBS-HI-12A | |
| Lenti-X Concentrator (PEG-based reagent) | Takara Bio | 631232 | |
| MACSelect LNGFR Microbeads (anti-NGFR magnetic beads) | Miltenyi Biotec | 130-091-330 | |
| OptiPrep density gradient medium (gradient medium) | Stemcell | 7820 | |
| Penicillin-Streptomycin (P/S) | Capricorn Scientific | PS-B | |
| Propidium iodide (PI) | Invitrogen | BMS500PI | |
| Recombinant Human IL-2 (IL-2) | Peprotech | 200-02 | |
| RPMI-1640 with Stable Glutamine (RPMI-1640) | Capricorn Scientific | RPMI-STA | |
| RPMI-1640 without L-Glutamine and phenol red | Gibco | 32404-014 | |
| Xdrop DE oil I (oil) | Samplix | REOILDEC1900 | |
| Xdrop Granzyme B substrate (GzmB substrate) | Samplix | REGRB100 | |
| Zombie-NIR viability dye (viability dye) | BioLegend | 423106 | |
| Plasticware etc. | |||
| 8-chamber glass slide | Chemometec | 942-0003 | |
| Cell culture plate, 12 well | TH Geyer | 7696791 | |
| DNA LoBind tube, 2 mL (DNA tube) | Eppendorf | 30108078 | |
| Eppendorf tube, 1.5 mL (1.5 mL tube) | Eppendorf | 30108051 | |
| Falcon tube, 15 mL (15 mL tube) | TPP | 91015 | |
| Falcon tube, 5 mL (5 mL tube) | Falcon (VWR) | 734-0443 | |
| Green cell suspension flasks for cell incubations (T75 flask) | Sarstedt | 148.19.22 | |
| Green cell suspension plates for cell incubations (96 well plate) | Sarstedt | 148.32.20 | |
| LS Separation Columns (separation column) | Miltenyi Biotec | 130-042-401 | |
| Xdrop DE Gaskets (gaskets) | Samplix | #GADEA100 | |
| Xdrop DE50 Cartridge (encapsulation cartridge) | Samplix | #CADE50A100 | |
| Antibodies | |||
| anti-CCR7 PE-Dazzle 594 | BioLegend | 353236 | |
| anti-CD19 CAR FMC63 Idiotype Antibody, PE | Miltenyi Biotec | 130-127-342 | |
| anti-CD3 APC | Biolegend | 300439 | |
| anti-CD3 BV480 | BD Biosciences | 566105 | |
| anti-CD3 FITC | BD Biosciences | 345763 | |
| anti-CD4 BUV661 | BD Biosciences | 612962 | |
| anti-CD4 StarBright Violet 760 | Bio-Rad | MCA1267SBV760T | |
| anti-CD45RA BUV395 | BD Biosciences | 740298 | |
| anti-CD8 PE-Cy7 | BioLegend | 344712 | |
| anti-CD8 StarBright Violet | Bio-Rad | MCA1226SBV760 | |
| anti-NGFR FITC | BioLegend | 345106 | |
| anti-NGFR PE | BioLegend | 345106 | |
| Cells | |||
| JeKo-1 Mantle-cell lymphoma cell-line (JeKo-1) | ATCC | CRL-3006 | |
| Primary peripheral blood mononuclear cells (PBMCs) | |||
| Equipment | |||
| Countess 3 Automated Cell Counter | Thermo Fisher Scientific | A50298 | |
| DynaMag-2 Magnet | Invitrogen | 12321D | |
| NovoCyte Quanteon Flow Cytometer (flow cytometer) | Agilent | 2010011AA | |
| Xdrop (microfluidics device) | Samplix | IN00110-EU |
Referanslar
- Pasqui, D. M., Latorraca, C. D. O. C., Pacheco, R. L., Riera, R. CAR-T cell therapy for patients with hematological malignancies. A systematic review. Eur J Haematol. 109 (6), 601-618 (2022).
- Krejcik, J., et al. Harnessing the immune system to fight multiple myeloma. Cancers. 13 (18), 4546 (2021).
- Tokarew, N., Ogonek, J., Endres, S., von Bergwelt-Baildon, M., Kobold, S. Teaching an old dog new tricks: next-generation CAR T cells. British J Cancer. 120 (1), 26-37 (2019).
- Bogetofte Barnkob, M., Vitting-Seerup, K., Rønn Olsen, L. Target isoforms are an overlooked challenge and opportunity in chimeric antigen receptor cell therapy. Immunother Adv. 2 (1), ltac009 (2022).
- Daei Sorkhabi, A., et al. The current landscape of CAR T-cell therapy for solid tumors: Mechanisms, research progress, challenges, and counterstrategies. Front Immunol. 14, 1113882 (2023).
- . Considerations for the Development of Chimeric Antigen Receptor (CAR) T Cell Products Available from: https://www.fda.gov/regulatory-information/search-fda-guidance-documents/considerations-development-chimeric-antigen-receptor-car-t-cell-products (2024)
- Roddie, C., O'Reilly, M., Dias Alves Pinto, J., Vispute, K., Lowdell, M. Manufacturing chimeric antigen receptor T cells: issues and challenges. Cytotherapy. 21 (3), 327-340 (2019).
- Wang, L., et al. Improvement of in vitro potency assays by a resting step for clinical-grade chimeric antigen receptor engineered T cells. Cytotherapy. 21 (5), 566-578 (2019).
- Burrows, S. R., Fernan, A., Argaet, V., Suhrbier, A. Bystander apoptosis induced by CD8+ cytotoxic T cell (CTL) clones: implications for CTL lytic mechanisms. Int Immunol. 5 (9), 1049-1058 (1993).
- Gattinoni, L., et al. Acquisition of full effector function in vitro paradoxically impairs the in vivo antitumor efficacy of adoptively transferred CD8+ T cells. J Clin Invest. 115 (6), 1616-1626 (2005).
- Chen, G. M., et al. Integrative bulk and single-cell profiling of premanufacture T-cell populations reveals factors mediating long-term persistence of CAR T-cell therapy. Cancer Dis. 11 (9), 2186-2199 (2021).
- Frazer, G. L., Gawden-Bone, C. M., Dieckmann, N. M. G., Asano, Y., Griffiths, G. M. Signal strength controls the rate of polarization within CTLs during killing. J Cell Biol. 220 (10), e202104093 (2021).
- Hermans, I. F., et al. The VITAL assay: a versatile fluorometric technique for assessing CTL- and NKT-mediated cytotoxicity against multiple targets in vitro and in vivo. J Immunol Meth. 285 (1), 25-40 (2004).
- Zaritskaya, L., Shurin, M. R., Sayers, T. J., Malyguine, A. M. New flow cytometric assays for monitoring cell-mediated cytotoxicity. Expert Rev Vaccines. 9 (6), 601-616 (2010).
- Piccinini, C., et al. In vitro CAR-T cell killing: validation of the potency assay. Cancer Immunol Immunother CII. 73 (9), 168 (2024).
- Martinez, E. M., et al. High-throughput flow cytometric method for the simultaneous measurement of CAR-T cell characterization and cytotoxicity against solid tumor cell lines. SLAS Disc Adv Life Sci. 23 (7), 603-612 (2018).
- Jedema, I., van der Werff, N. M., Barge, R. M. Y., Willemze, R., Falkenburg, J. H. F. New CFSE-based assay to determine susceptibility to lysis by cytotoxic T cells of leukemic precursor cells within a heterogeneous target cell population. Blood. 103 (7), 2677-2682 (2004).
- Liu, L., et al. Cellular and molecular imaging of CAR-T cell-based immunotherapy. Adv Drug Delivery Rev. 203, 115135 (2023).
- Liadi, I., et al. Defining potency of CAR+ T cells: Fast and furious or slow and steady. Oncoimmunology. 8 (10), e1051298 (2019).
- Xhangolli, I., et al. Single-cell analysis of CAR-T cell activation reveals a mixed TH1/TH2 response independent of differentiation. Genom Proteom Bioinfo. 17 (2), 129-139 (2019).
- Zhou, Y., et al. Evaluation of single-cell cytokine secretion and cell-cell interactions with a hierarchical loading microwell chip. Cell Rep. 31 (4), 107574 (2020).
- LaBelle, C. A., Zhang, R. J., Hunsucker, S. A., Armistead, P. M., Allbritton, N. L. Microraft arrays for serial-killer CD19 chimeric antigen receptor T cells and single cell isolation. Cytometry J Int Soc Anal Cytol. 103 (3), 208-220 (2023).
- Hellmann, M. J., et al. Heterogeneously deacetylated chitosans possess an unexpected regular pattern favoring acetylation at every third position. Nat Comm. 15 (1), 6695 (2024).
- Wong, K. U., et al. Assessment of chimeric antigen receptor T cytotoxicity by droplet microfluidics in vitro. Antibody Therapeut. 5 (2), 85-99 (2022).
- Antona, S., Platzman, I., Spatz, J. P. Droplet-based cytotoxicity assay: Implementation of time-efficient screening of antitumor activity of natural killer cells. ACS omega. 5 (38), 24674-24683 (2020).
- Subedi, N., et al. An automated real-time microfluidic platform to probe single NK cell heterogeneity and cytotoxicity on-chip. Sci Rep. 11 (1), 17084 (2021).
- Zhang, Y., et al. Enhanced CRISPR/Cas12a-based quantitative detection of nucleic acids using double emulsion droplets. Biosens Bioelect. 257, 116339 (2024).
- Kochenderfer, J. N., et al. Construction and preclinical evaluation of an anti-CD19 chimeric antigen receptor. J Immunother. 32 (7), 689-702 (2009).
- Michaels, Y. S., et al. Precise tuning of gene expression levels in mammalian cells. Nat Comm. 10 (1), 818 (2019).
- Yuan, Y., et al. Droplet encapsulation improves accuracy of immune cell cytokine capture assays. Lab on a Chip. 20 (8), 1513-1520 (2020).
- Brower, K. K., et al. Double emulsion flow cytometry with high-throughput single droplet isolation and nucleic acid recovery. Lab on a Chip. 20 (12), 2062-2074 (2020).
- Kirouac, D. C., et al. Deconvolution of clinical variance in CAR-T cell pharmacology and response. Nat Biotechnol. 41 (11), 1606-1617 (2023).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır