Method Article
Tröpfchenbasierter Zytotoxizitätsassay zur Beurteilung von chimären Antigenrezeptor-T-Zellen auf Einzelzellebene
In diesem Artikel
Zusammenfassung
Hier beschreiben wir ein Verfahren zur Herstellung von Doppelemulsionströpfchen, die eine T-Zelle und eine Krebszielzelle verkapseln, um die Zellabtötung auf Einzelzellebene zu untersuchen. Diese Methode ermöglicht die duale Quantifizierung sowohl zytotoxischer Moleküle als auch der Apoptose der Zielzellen innerhalb einer großen Population von T-Zellen.
Zusammenfassung
Die Bewertung des zytotoxischen Potenzials von T-Zell-basierten Therapien, wie z. B. T-Zell-Behandlungen mit chimären Antigenrezeptoren (CAR), ist entscheidend für die Beurteilung ihrer Wirksamkeit und eine Voraussetzung für die klinische Anwendung. Traditionelle Zytotoxizitätsassays werden jedoch als Bulk-Assays durchgeführt und liefern keine detaillierten Informationen über die funktionelle Heterogenität der CAR-T-Zellpopulation. In dieser Arbeit beschreiben wir eine Doppelemulsions-Tröpfchen-basierte Methode, die eine großflächige Co-Verkapselung von Einzeleffektor-CAR-T-Zellen mit einzelnen Zielzellen ermöglicht und gleichzeitig die duale Quantifizierung sowohl zytotoxischer Effektormoleküle aus T-Zellen als auch des Zelltods der Zielzelle ermöglicht. Das Protokoll beschreibt eine Methode zur Erzeugung und Reinigung von CD19-spezifischen CAR-T-Zellen, gefolgt von ihrer Co-Verkapselung in Tröpfchen mit der CD19+ -Zelllinie JeKo-1, zusammen mit Reagenzien zur Visualisierung der zytotoxischen Effektormolekülsekretion (Granzym B) und des Zelltods (unter Verwendung von Propidiumiodid, PI). Wir zeigen, wie Tröpfchen mit einzelnen CAR-T- und Zielzellen unter Verwendung eines kommerziell erhältlichen Mikrofluidikgeräts zur Erzeugung von Doppelemulsionströpfchen erzeugt werden können. Darüber hinaus stellen wir Beispiele vor, wie die funktionelle Diversität von CAR-T-Zellen in Tröpfchen mit Standard-Durchflusszytometrie-Geräten getestet werden kann. Abschließend beschreiben wir kurz die zeitliche Kinetik und Heterogenität der CD19-spezifischen CAR-T-Zell-T-Abtötung. Während sich diese Methode auf den Zelltod nach einem CAR-T-Zell-Angriff konzentriert, ist sie auch für die Untersuchung anderer Arten von T-Zellen, zytotoxischen Immunzellen und Effektorzellfunktionen, wie z. B. der Zytokinsekretion, anpassbar.
Einleitung
Die T-Zelltherapie mit chimären Antigenrezeptoren (CAR) ist ein schnell wachsendes Gebiet der zellulären Krebsimmuntherapie, das sich bei verschiedenen Formen von Leukämie, Lymphom1 und Multiplem Myelom2 als wirksam erwiesen hat. CAR-T-Zellen werden erzeugt, indem T-Zellen mit einem synthetischen Antigenrezeptor modifiziert werden, der selektiv an Oberflächenproteine wie CD19 oder B-Zell-Reifungsantigen (BCMA) binden kann, die auf B-Zellen, Plasmazellen und ihren bösartigen Gegenstücken exprimiert werden. Jüngste Fortschritte im CAR-Design haben es ermöglicht, mehrere Antigene gleichzeitig ins Visier zu nehmen3, sich auf mehrere Eingangssignale zu stützen oder ausschließlich an tumorassoziierte Antigene, wie z. B. spezifische Proteinisoformen4, zu binden. Darüber hinaus werden derzeit mehrere CARs gegen Ziele von nicht-hämatologischen Krebsarten getestet5.
Zytotoxizitätstests sind sowohl für die CAR-Entwicklung als auch für die Qualitätskontrolle vor der Freigabe klinischer Produkte unerlässlich 6,7,8. Die meisten aktuellen Assays beruhen jedoch auf Massenpopulationen von Effektor-CAR-T-Zellen, die Krebszelllinien überschüssig zugesetzt werden, was aufgrund von Bystander-Effekten zu falsch-positiven Ergebnissen führen kann9 und zu einer schlechten Korrelation zwischen In-vitro- und In-vivo-Ergebnissen führt10. Da die T-Zellproliferation und die Langzeitpersistenz von den Signalen abhängen, die während der initialen Aktivierungsereignisse empfangen werden11,12, ist die genaue Untersuchung zytotoxischer Ereignisse auf Einzelzellebene von großem Interesse.
Um die Einschränkungen der Bulk-Methoden zu überwinden, können Zytotoxizitätsstudien auf Einzelzellebene mit Hilfe der Durchflusszytometrie 13,14,15,16,17 und bildgebenden Assays 18 durchgeführt werden. Obwohl die Standard-Durchflusszytometrie eine Einzelzellauflösung für die Quantifizierung und Charakterisierung von Effektor- und Zielzellen bietet, kann sie die spezifische zytotoxische Fähigkeit einzelner CAR-T-Zellen gegenüber Zielzellen nicht direkt bestimmen. Darüber hinaus ist die Abbildung einzelner CAR-T-Zellen, die mit ihren jeweiligen Zielen in großen Mengen interagieren, aufgrund der gleichbleibenden Beweglichkeit der Zellen eine Herausforderung und zeitaufwändig. Um diesen Herausforderungen zu begegnen, wurden neuartige Werkzeuge für die Einzelzellanalyse entwickelt, die auf der Paarung von Effektor- und Zielzellen in räumlich begrenzten Räumen unter Verwendung von Mikrotiter-Arrays19,20,21, Mikroraft-Arrays22, Mikrochips23 und Tröpfchen-Mikrofluidik 24,25,26 beruhen. Diese Werkzeuge bieten eine verbesserte Messempfindlichkeit und ermöglichen die Untersuchung von weniger Zellen mit reduziertem Reagenzienvolumen. Es bleiben jedoch einige Herausforderungen bestehen, darunter eine effiziente Zellpaarung, die begrenzte Anzahl von Proben, die analysiert werden können, die Abhängigkeit von ausschließlich bildgebenden Analysen und Schwierigkeiten bei der Gewinnung lebensfähiger Zellpopulationen für weitere Analysen.
Hier verwenden wir ein kommerziell erhältliches Mikrofluidik-Gerät, das einen massiv vereinfachten Ansatz für die tröpfchenbasierte Mikrofluidik ermöglicht. Dieses Gerät ermöglicht die Durchführung fortschrittlicher Einzelzellanalysen und Assays mit hochstabilen Doppelemulsionströpfchen (DE). Im Vergleich zu Mikrotiter- und herkömmlichen Tröpfchen-Mikrofluidik-Assays erfordert das hier beschriebene Protokoll keine umfangreiche mikrofluidische Expertise.
DE-Tröpfchen sind kleine kugelförmige Kompartimente, die aus einer Ölhülle mit einem wässrigen Kern bestehen, der in einer wässrigen Lösung suspendiert ist. Das wässrige Tröpfchen enthält und hält Zellen, Zellsekretom, Zellmedium und Assay-Reagenzien zurück, so dass komplexe Assays in jedem Kompartiment durchgeführt werden können. Mit dem Mikrofluidik-Gerät werden DE-Tröpfchen mit einem festgelegten Volumen (ca. 100 pL) erzeugt, das für Einzelzell- oder Zell-Zell-Interaktionsassays an Säugetieren geeignet ist, die in sehr hoher Anzahl (ca. 750.000 Tröpfchen pro Probe) und in einem kurzen Zeitrahmen (ca. 10 min für 8 Proben) von allgemeinen Laboranwendern ohne spezielle Kenntnisse in Mikrofluidik erzeugt werden können. Die erzeugten Tröpfchen können im Zellmedium suspendiert werden, wodurch eine Trans-Shell-Diffusion von O2 und CO2 und eine Pufferung des Inneren ermöglicht wird, während gleichzeitig hydrophile und größere Moleküle, wie z. B. zellsezernierte Effektormoleküle, zurückgehalten werden. Die untersuchten Zellen werden somit ausreichend gepuffert, so dass Zell-Zell-Interaktionen und zeitliche Dynamiken über die Zeit untersucht werden können. Im Gegensatz zu einzelnen Emulsionströpfchen (z. B. Wasser-in-Öl-Tröpfchen)27 handelt es sich bei den DE-Tröpfchen um robuste Strukturen, die in Standard-Zellinkubatoren nicht verschmelzen oder verschmelzen. Aufgrund ihrer Stabilität und einer wässrigen äußeren Phase sind sie auch mit nachgelagerten Analyseverfahren wie der traditionellen Durchflusszytometrie kompatibel. Diese Pikolitertröpfchen, die von dem Mikrofluidikgerät erzeugt werden, können daher für die Einzelzellanalyse der Zellfunktion mit hohem Durchsatz verwendet werden, um die funktionelle Heterogenität aufzuklären, die in herkömmlichen Bulk-Assays verborgen ist.
Hier skizzieren wir ein Protokoll, das DE-Tröpfchen verwendet, um das zytotoxische Potenzial von CD19-spezifischen CARs gegenüber Lymphomzellen zu untersuchen. Unser Protokoll ermöglicht die Einzelzellanalyse der Zielabtötung und der Granzyme B (GzmB)-Sekretion und zeigt, dass etwa 20% der hier untersuchten CAR-T-Zellen ein sofortiges Abtötungspotenzial haben.
Protokoll
Die in dieser Studie verwendeten CAR-T-Zellen wurden durch lentivirale Transduktion von primären T-Zellen mit einem CD19scFv-CD28-CD3ζ-tNGFR CAR-Konstrukt in einem zertifizierten Biosicherheitslabor der GVO-Klasse 2 erzeugt und nach 4 Tagen gemäß dem Institutsstandard deklassifiziert. Gereinigte T-Zellen stammten aus weggeworfenem überschüssigem Material aus anonymisierten Blutspenden und waren nach dänischem Recht von weiteren ethischen Genehmigungen ausgenommen.
1. Erzeugung von CAR-T-Zellen
HINWEIS: Die Namen der unten verwendeten Reagenzien verwenden generische und abgekürzte Namen. Der vollständige Handelsname ist in Klammern in der Materialtabelle zu finden.
- Aktivierung, Transduktion und Expansion von T-Zellen
HINWEIS: Die stabile Expression von CD19-CAR-T-Zellen wurde durch lentivirale Transduktion von primären humanen T-Zellen erreicht, die aus frischen mononukleären Zellen des peripheren Blutes (PBMCs) unter Verwendung eines T-Zell-Isolationskits mit negativer Selektion isoliert wurden. Das verwendete Anti-CD19-CAR ist ein Konstrukt der zweiten Generation, das aus einem FMC63-Einzelketten-Variablenfragment (scFv), einer CD28-Scharnier- und Transmembrandomäne, einer CD28-kostimulatorischen Domäne, einer CD3ζ-Aktivierungsdomäne28 und einer verkürzten Version des Nervenwachstumsfaktor-Rezeptors (tNGFR) zur Überwachung und Anreicherung von CAR-exprimierenden Zellenbesteht 29. Das Transfervektor-Plasmid wurde de novo synthetisiert, und es wurde ein Lentivirus der dritten Generation hergestellt, indem es mit pMDLg/pRRE (Addgene-Plasmid #12251), pRSV-Rev (Addgene-Plasmid #12253) und pMD2.G (Addgene-Plasmid #12259)30 kombiniert wurde. Die drei letztgenannten Plasmide waren ein Geschenk von Didier Trono. Das Rohvirus wurde unter Verwendung eines PEG-basierten Reagenzes konzentriert, und die Multiplizität der Infektion (MOI) wurde durch Transduktion von SUP-T1-Zellen und Messung von tNGFR durch Durchflusszytometrie gemäß dem Standardprotokoll31 bestimmt.- Übertragen Sie 2 x 106 primäre humane T-Zellen in eine 12-Well-Kulturschale und stimulieren Sie sie mit CD3/CD28-beschichteten Kügelchen in einem Bead-to-Zell-Verhältnis von 1:1 in 1 ml vollständigem RPMI-1640-Medium (10 % hitzeinaktiviertes fötales Rinderserum, 1 % Penicillin/Streptomycin), ergänzt mit 100 Einheiten/ml rekombinantem humanem Interleukin-2 (IL-2). Inkubieren Sie die Zellen bei 37°C in einem befeuchteten 5% CO2 -Inkubator für 24 h.
- Fügen Sie lentivirale Partikel zu den aktivierten T-Zellen bei einem MOI von 5-10 hinzu. Vorsichtig mischen und die Zellen 72 h inkubieren. Nicht transduzierte (NTD) T-Zellen sind als Negativkontrolle einzubeziehen.
- Entfernen Sie am Tag 3 nach der Transduktion die CD3/CD28-Aktivierungskügelchen, indem Sie die T-Zellen in ein 1,5-ml-Röhrchen ernten und das Röhrchen für 1-2 Minuten auf einen Magnetständer stellen. Den Überstand mit den Zellen in ein neues 1,5-ml-Röhrchen umfüllen.
- Führen Sie eine Zellzählung mit einem automatisierten Zellzähler durch und stellen Sie die Zelldichte auf 1 x 106 Zellen/ml in einem vollständigen RPMI-1640-Medium ein, das mit 100 U/ml IL-2 ergänzt wird. Setzen Sie die Expansion der T-Zellen fort, bis die Gesamtanzahl der CAR-T-Zellen in der Suspension mindestens 1,5 x 106 (normalerweise insgesamt etwa 6 x 106 T-Zellen) erreicht, bevor Sie mit der NGFR-Anreicherung fortfahren (siehe unten).
- Überwachen Sie die Zellzahl jeden zweiten Tag und passen Sie die Konzentration auf 1 x 106 Zellen/ml an, indem Sie frisches Medium hinzufügen, das mit 100 Einheiten/ml IL-2 ergänzt wird, um einen optimalen Zellzustand während der Expansion zu gewährleisten.
- Anreicherung von CAR-exprimierenden T-Zellen
- 6 x 10,6 oder mehr transduzierte T-Zellen in ein 15-ml-Röhrchen überführen und 5 Minuten lang bei 300 x g zentrifugieren. Resuspendieren Sie das Zellpellet in 320 μl PBS, ergänzt mit 0,5 % Rinderserumalbumin (BSA), um PBSA herzustellen, und fügen Sie 40 μl magnetische Anti-NGFR-Kügelchen hinzu. Gut mischen und 15 min auf Eis inkubieren.
HINWEIS: Dieses Protokoll geht von einer Transduktionseffizienz von ca. 25 % aus, was zu >1,5 x 106 CAR-T-Zellen nach der Anreicherung führt. Wir empfehlen, nicht mit weniger als 6 x 106 Zellen zu beginnen, da dies zu einer schlechten Rückgewinnung der CAR-T-Zellen führen kann. - Fügen Sie 1640 μl PBSA hinzu, um das endgültige Volumen auf 2 ml zu bringen, und fahren Sie dann mit der magnetischen Trennung mit Trennsäulen gemäß den Anweisungen des Herstellers fort.
- 6 x 10,6 oder mehr transduzierte T-Zellen in ein 15-ml-Röhrchen überführen und 5 Minuten lang bei 300 x g zentrifugieren. Resuspendieren Sie das Zellpellet in 320 μl PBS, ergänzt mit 0,5 % Rinderserumalbumin (BSA), um PBSA herzustellen, und fügen Sie 40 μl magnetische Anti-NGFR-Kügelchen hinzu. Gut mischen und 15 min auf Eis inkubieren.
- Nachweis der CAR-Expression mittels Durchflusszytometrie
HINWEIS: Wir empfehlen, den Prozentsatz der CAR-exprimierenden Zellen und ihre Lebensfähigkeit zu diesem Zeitpunkt zu bestimmen, um sicherzustellen, dass die Zellen richtig sind, bevor Sie den folgenden Assay durchführen. Auch das CD4- und CD8-Verhältnis und der Gedächtnisphänotyp können an dieser Stelle bestimmt werden. Siehe Abbildung 1 für repräsentative Diagramme.- Übertragen Sie 2,5 x 105 T-Zellen aus transduzierten und nicht transduzierten Kulturen in separate Durchflusszytometrie-Röhrchen. Waschen Sie die Zellen 2x mit 200 μL PBS und zentrifugieren Sie sie nach jedem Waschen 5 min lang bei 300 x g .
- Bereiten Sie eine Antikörpermischung vor, die Anti-CD19-, CAR-, FMC63-, Idiotyp-PE-, Anti-CD3-BV480- und Anti-NGFR-FITC-Antikörper enthält, jeweils 1:100 in PBS verdünnt. Die Zellen werden in 50 μl des Antikörpermixes resuspendiert und 20 Minuten lang bei 4 °C inkubiert.
- Waschen Sie die Zellen 2x mit 200 μL PBS und zentrifugieren Sie sie nach jedem Waschen 5 min lang bei 300 x g . Resuspendieren Sie die Zellen in 200 μl PBS und analysieren Sie sie mittels Durchflusszytometrie.
2. Erzeugung von Tröpfchen, die T-Zellen und Zielzellen verkapseln
HINWEIS: Vor der Verkapselung werden T-Zellen und JeKo-1-Zellen mit unterschiedlichen Zellfärbungen gefärbt, um den zellulären Tröpfchengehalt zu überwachen. Die Zellen werden mit Assay-Reagenzien verkapselt und 2-6 Stunden inkubiert, bevor die Tröpfchen auf dem Durchflusszytometer analysiert werden (siehe Abbildung 2).
- Färben von Zellen vor der Verkapselung
- Bereiten Sie Arbeitslösungen aus zwei Fluoreszenzfarbstoffen vor (wir haben einen violetten Farbstoff und einen dunkelroten Farbstoff verwendet), indem Sie die Stammlösungen (hergestellt nach Herstellerangaben) 1:5.000 in dPBS verdünnen.
- Für jeden Spender werden 2,5 x 106 CAR T, 2,5 x 106 NTD T und 15 x 106 JeKo-1 Zellen in separate Zentrifugenröhrchen (15 mL oder 50 mL Röhrchen) überführt und 5 Minuten lang bei 300 x g zentrifugiert. In diesem Experiment wurden 0,5 x 106 Effektorzellen mit 1,5 x 106 Zielzellen für jede vorbereitete Probe verkapselt.
HINWEIS: Die Anzahl der hier übertragenen Zellen ist für 4x Verkapselungsproben mit jedem Effektorzelltyp für jeden Spender vorgesehen. Skalieren Sie die Anzahl der Zellen und Reagenzien entsprechend der Anzahl der benötigten Proben herunter. Darüber hinaus kann die genaue Anzahl der Zellen pro Probe je nach experimentellem Bedarf skaliert werden. - Entfernen Sie den Überstand und resuspendieren Sie die Effektorzellenpellets in der 1:5.000-Arbeitslösung des violetten Fluoreszenzfarbstoffs und die Zielzellpellets (JeKo-1) in der 1:5.000-Arbeitslösung des dunkelroten Fluoreszenzfarbstoffs. Resuspendieren Sie die Zellen gut mit einer Pipette und auf eine Zellkonzentration von 1 x 106 Zellen/ml Färbelösung.
- Inkubieren Sie die Zellen für 20 min in einem 37 °C befeuchteten CO2 -Inkubator. Zentrifugieren Sie die Zellen 5 Minuten lang bei 300 x g , entfernen Sie den Überstand und resuspendieren Sie sie in 15 ml vollständigem RPMI-1640-Medium, um die Zellen zu waschen.
- Wiederholen Sie den Waschgang und zentrifugieren Sie ihn bei 300 x g für 5 min. Entfernen Sie den Überstand und resuspendieren Sie die Effektorzellenpellets in 225 μl vollständigem RPMI-1640 und die Zielzellpellets in 450 μl vollständigem RPMI-1640.
- Geben Sie 30 μl eines Gradientenmediums in die Effektorzellsuspensionen und 60 μl desselben Gradientenmediums in die Zielzellsuspensionen. Resuspendieren Sie die Gradientenmedium-Stammlösung gut vor dem Pipettieren.
- Geben Sie 15 μl eines 20 μg/ml-PI-Stamms in die Effektorzellsuspensionen und 30 μl des PI-Stamms in die Zielzellsuspensionen. Die endgültige PI-Konzentration beträgt schließlich 1 μg/ml, nachdem das Granzyme B (GzmB)-Substrat unten hinzugefügt wurde.
- Bereiten Sie eine 1:10-Verdünnung des GzmB-Substrats in vollständigem RPMI-1640 vor und geben Sie 30 μl dieser GzmB-Substratverdünnung in die Effektorzellsuspension und 60 μl davon in die Zielzellsuspensionen. Mit der Pipette gut vermischen.
HINWEIS: Das Gesamtvolumen der Reagenzien, die zu jedem Effektorzellpellet hinzugefügt werden, sollte nun 300 μl und zu den Zielzellpellets 600 μl betragen. Die Konzentration des Gradientenmediums in diesen Lösungen sollte 10 %, die PI-Konzentration 1 μg/ml und die GzmB-Substratkonzentration 1:100 betragen. - Alternative Markierung mit CD3-, CD4- und CD8-Antikörpern
HINWEIS: In einigen Fällen kann es von Interesse sein, Effektorzellen vor der Co-Verkapselung mit Zielzellen weiter zu markieren. Hier zeigen wir den Proof-of-Principle für diese Art der Markierung mit CD3-, CD4- und CD8-Antikörpern und PBMC (siehe Abbildung 3).- Übertragen Sie 2,0 x 106 PBMC in ein 1,5 mL Röhrchen und schleudern Sie die Zellen 5 Minuten lang bei 300 x g herunter. Entfernen Sie den Überstand und resuspendieren Sie das Zellpellet in 200 μl dPBS mit 0,5 % BSA. Teilen Sie den Inhalt auf zwei 2-ml-Röhrchen auf.
- Geben Sie 5 μl Anti-CD3-APC und 5 μl Anti-CD4-StarBright Violet 760 in eines der Röhrchen. Geben Sie 20 μl Anti-CD3-FITC und 5 μl Anti-CD8-StarBright Violet 760 in das andere Röhrchen.
- Gut mischen und 30 min bei Raumtemperatur im Dunkeln inkubieren. Geben Sie 1 mL Waschpuffer zu den Zellen, schleudern Sie 5 Minuten lang bei 300 x g , entfernen Sie den Überstand und resuspendieren Sie die Zellpellets in 1 mL dPBS mit 0,5 % BSA.
- Schleudern Sie die Zellen 5 min lang bei 300 x g herunter, entfernen Sie den Überstand und resuspendieren Sie die Zellpellets in 150 μl RPMI ohne Phenolrot und 10 % Gradientenmedium. Verkapseln Sie wie in Schritt 2.2 beschrieben mit RPMI ohne Phenolrot, 33 % Stabilisierungslösung für Zellen und 10 % Gradientenmedium als äußeres Medium.
- Verkapselung der Zellen
- Heizen Sie eine Verkapselungspatrone und eine Stabilisierungslösung vor der Verkapselung auf Raumtemperatur vor. Bereiten Sie einen Vorrat an äußerem Medium vor, der aus vollständigem RPMI-1640-Medium, 33 % Stabilisierungslösung für Zellen und 10 % Gradientenmedium besteht.
- Bereiten Sie für jede Verkapselungsprobe eine Zellprobenlösung mit Mixed-Target-Effektorzellen vor. Resuspendieren Sie die gut vorbereiteten Zelllösungen mit einer Pipette und mischen Sie 65 μl der vorbereiteten Effektorzellsuspension mit 65 μl der vorbereiteten Zielzellsuspension in 1,5 ml-Röhrchen (beide in Schritt 2.1 hergestellt).
- Fahren Sie sofort mit dem Beladen der angegebenen Vertiefungen der Verkapselungspatrone mit den Reagenzien in der folgenden Reihenfolge fort, um eine ordnungsgemäße Verkapselung zu gewährleisten. Laden Sie einen Satz Wells für jede vorbereitete Verkapselungsprobe.
Gut #A: 400 μl äußeres Medium.
Gut #D: 40 μL äußeres Medium auf dem kleinen Regal.
Gut #C: 120 μl vorgemischte Lösung mit Zielzellen (JeKo-1) und Effektorzellen. Resuspendieren Sie die Zellen direkt vor dem Laden gut mit einer Pipette.
Gut #B: 250 μl Öl.
HINWEIS: Jede Kartusche kann mit bis zu 8 Proben zur parallelen Verkapselung geladen werden. - Fahren Sie sofort mit dem Abdichten der Dichtung fort und legen Sie die Kartusche in das Instrument ein, während Sie ein Kippen, Schütteln oder Anstoßen der geladenen Kartusche vermeiden. Verschließen Sie die Dichtung vorsichtig auf der Patrone.
- Übertragen Sie die Kartusche vorsichtig in das Mikrofluidikgerät und starten Sie die Verkapselung, wie in der Bedienungsanleitung beschrieben.
- Die erzeugten Tröpfchen haben eine höhere Dichte als das umgebende äußere Medium und sedimentieren schnell am Boden der Sammelvertiefung (Well #D). Sammeln Sie jede Tröpfchenproduktion (alle Tröpfchen und das umgebende äußere Medium), indem Sie die sedimentierten Tröpfchen aus dem Well #D im überlagernden Medium resuspendieren und in ein 2-ml-DNA-Röhrchen mit geringer Bindung mit Deckel überführen. Waschen Sie Well #D mit dem restlichen äußeren Medium aus Well #A, um die restlichen Tröpfchen aufzufangen.
- Wenn sich die Tröpfchen in den Sammelröhrchen abgesetzt haben (es dauert ca. 1 Minute), überprüfen Sie die Tröpfchenproduktion, indem Sie sie mit einem Hellfeldmikroskop untersuchen. Füllen Sie dazu eine 10 μL Pipettenspitze mit einer Probe: ca. 1/3 mit Tröpfchen von der Oberfläche der Tröpfchenphase (weiße Phase) und ca. 2/3 mit dem darüber liegenden äußeren Medium, um die Spitze zu filizieren. Laden Sie die Probe sofort auf einen 8-Kammer-Objektträger und untersuchen Sie die Tröpfchen durch Hellfeldmikroskopie bei 4- und 20-facher Vergrößerung, um die Tröpfchenbeladung mit den Zellen zu bestätigen.
HINWEIS: Es ist wichtig, dass die Tröpfchen auf diese Weise in einem größeren Volumen des umgebenden Mediums abgesaugt werden.
- Inkubation
HINWEIS: Die Tröpfchen können nun in 2 ml DNA-Röhrchen mit geringer Bindung in einem standardmäßigen befeuchteten Inkubator mit 37 °C und 5 % CO2 inkubiert werden. Wir empfehlen die Verwendung dieser Röhrchen, da sie optimale Oberflächeneigenschaften für die Tröpfchenkultivierung aufweisen.- Durchstechen Sie mit einer Spritzennadel (23 G) vorsichtig und sicher den Deckel der erforderlichen Anzahl von 2 mL schwach bindenden DNA-Röhrchen. Dies gewährleistet eine freie CO2/O2 -Diffusion und verhindert gleichzeitig die Verdunstung des Mediums.
- Geben Sie 1 ml äußeres Medium in jedes Inkubationsröhrchen. Die Tröpfchen sollten mit mindestens dem 5-fachen Volumen des äußeren Mediums inkubiert werden, um eine ordnungsgemäße Pufferung zu gewährleisten. Das Volumen des zugegebenen äußeren Mediums kann je nach Stoffwechsel der angewendeten Zellen vergrößert werden.
- Resuspendieren Sie die in den überlagernden Medien erzeugten Tröpfchen und teilen Sie jede Produktion in drei der vorbereiteten Inkubationsröhrchen auf (eines für jede Zeitpunktmessung). Die Tröpfchen sind schwer und sedimentieren schnell, und es ist daher wichtig, den Stoff zwischen jedem Transfer wieder zu suspendieren.
HINWEIS: Die Anzahl der Inkubationsröhrchen, in die die Tröpfchenproduktion aufgeteilt wird, kann variiert werden, aber wir empfehlen, eine Produktion in nicht mehr als 4 Inkubationsröhrchen aufzuteilen, um sicherzustellen, dass jede Probe genügend Ereignisse für die Analyse enthält. - Legen Sie die Röhrchen nach der Tröpfchenerzeugung für 2 h, 4 h oder 6 h Inkubation aufrecht in den Inkubator.
3. Nachgelagerte Analyse von Tröpfchen
- Mikroskopie
- Nach der Inkubation wird eine kleine Anzahl von Tröpfchen auf einen Objektträger übertragen, wie in Schritt 2.2.7 beschrieben, und durch Hellfeld- und Fluoreszenzmikroskopie mit einem Standard-Fluoreszenzmikroskop mit geeigneter Laser- und Filterkonfiguration analysiert.
HINWEIS: Die Tröpfchen können durch Hellfeldmikroskopie nachgewiesen werden. Die violett gefärbten T-Zellen können mit einem DAPI-Filter detektiert werden, die fernrot gefärbten JeKo-1-Zellen mit einem APC-Filter, das GzmB-FAM-Signal mit einem FITC-Filter und das PI-Signal mit einem PE-Filter. Das PI-Signal von größtem Interesse kann mikroskopisch schwer sichtbar zu machen sein, da frühe apoptotische Zellen eine geringere Spitzenemission aufweisen als späte apoptotische Zellen. Siehe Abbildung 4 für repräsentative Daten.
- Nach der Inkubation wird eine kleine Anzahl von Tröpfchen auf einen Objektträger übertragen, wie in Schritt 2.2.7 beschrieben, und durch Hellfeld- und Fluoreszenzmikroskopie mit einem Standard-Fluoreszenzmikroskop mit geeigneter Laser- und Filterkonfiguration analysiert.
- Durchflusszytometrie
- Nach der Inkubation resuspendieren Sie jede Tröpfchenprobe im überlagernden Medium und überführen Sie sie in 5-ml-FACS-Röhrchen. Analysieren Sie die Tröpfchen mit einem Standard-Durchflusszytometer, indem Sie die unten aufgeführten allgemeinen Richtlinien befolgen.
- Verwenden Sie ein Durchflusszytometer mit geeigneter Laser- und Filterkonfiguration. Mit dem ausgewählten Panel von Zellfärbungen und Assay ist eine Farbkompensation auf dem hier verwendeten Durchflusszytometer nicht erforderlich. Wenn andere Farben verwendet werden oder die Konfiguration des verwendeten Durchflusszytometers anders ist, kann eine Kompensation erforderlich sein.
- Verwenden Sie FSC-H als Schwellenwertauslöser, um Hintergrundgeräusche von kleinen Ölereignissen auszuschließen.
- Tröpfchen sind schwer und sedimentieren auf dem Boden der FACS-Röhrchen. Stellen Sie sicher, dass das SIP die Tröpfchen erreicht. Die Tröpfchen sollten vor der Aufnahme in mindestens dem 5-fachen Volumen des äußeren Puffers zu den Tröpfchen suspendiert werden.
- Droplet-Ereignisse werden mit hoher Geschwindigkeit erfasst. Aufzeichnung von Intensitätshöhensignalen (H) für FSC und SSC und die untersuchten Fluorophore, da Intensitätshöhenmessungen bei der Analyse von Tröpfchen verwendet werden. Passen Sie die Gewinne an, um positive und negative Ereignisse richtig zu trennen.
HINWEIS: Wir haben den FITC-Kanal zur Messung des GzmB-Signals, den Pacific Blue-Kanal zur Detektion der violett gefärbten T-Zellen, den APC-Kanal zur Detektion der fernrot gefärbten JeKo-1-Zellen und den PE-Kanal zur Detektion des PI-Signals verwendet. - Zeichnen Sie genügend Ereignisse für die nachgelagerte Analyse auf. Hier haben wir 4,5 - 8,3 x 103 der co-verkapselnden Tröpfchen pro Zeitpunkt aufgezeichnet.
- Waschen Sie das Durchflusszytometer nach jedem Satz von Tröpfchenaufnahmen mit Standard-Reinigungs- und Spüllösungen durch das SIP. Reinigen Sie das Durchflusszytometer am Ende des Versuchs gründlich. Siehe Abbildung 4 und Abbildung 5 für repräsentative Daten.
- Nach der Inkubation resuspendieren Sie jede Tröpfchenprobe im überlagernden Medium und überführen Sie sie in 5-ml-FACS-Röhrchen. Analysieren Sie die Tröpfchen mit einem Standard-Durchflusszytometer, indem Sie die unten aufgeführten allgemeinen Richtlinien befolgen.
- Analyse der Daten
- Berechnen Sie den Prozentsatz der T-Zellen, die GzmB sezernieren, basierend auf dem Prozentsatz der GzmB-positiven T-Zell- und JeKo-1-Zell-Koverkapselungen, die auf die T-Zell-Lebensfähigkeit normiert sind, die in den reinen T-Zell-Tröpfchenpopulationen zum fraglichen Zeitpunkt zum fraglichen Zeitpunkt bestimmt wurde, wie folgt:
Tröpfchen T-Zelle+, Jeko-1+, GzmB+ / (Tröpfchen T-Zelle+, Jeko-1+ - Tröpfchen tote T-Zelle+, Jeko-1+)
wobei Tröpfchen tote T-Zelle+, Jeko-1+ wird ab dem Tod in Tröpfchen nur mit T-Zellen geschätzt: Tröpfchentote T-Zelle+, Jeko-1+ = TröpfchenT-Zelle+, Jeko-1+ x Tröpfchen tote T-Zelle+, Jeko-1- / TröpfchenTelle+, Jeko-1-. - Berechnen Sie den Prozentsatz der T-Zellen, die ihre Zielzellen abgetötet haben, wie folgt:
Prozentualer Anteil zytotoxischer T-Zellen = (Beobachteter Tod - Tod im Hintergrund)/(100 - Tod im Hintergrund)
wobei der Hintergrundtod der Tod ist, der in (T-Zelle+, Jeko-1+) Tröpfchen vorhanden ist, die entweder aus einem nicht tötungsbedingten Tod oder einem Tod resultieren, der vor der Verkapselung eingetreten ist. - Schätzen Sie den Hintergrundtod durch Zelltod in (T-Zelle+, Jeko-1-) Tröpfchen und (T-Zell-, Jeko-1+) Tröpfchen:
Hintergrund Tod = (1- (1- Todesrate in TröpfchenTzell-, Jeko-1+) x (1- Todesrate in TröpfchenT-Zelle+, Jeko-1-)) x 100
wobei das Sterbeverhältnis direkt als % PI-positives Tröpfchen in reinen Tröpfchen und JeKo-1-Zell-Tröpfchen gemessen wird. Alle Berechnungen werden mit abtastzeitspezifischen Zahlen durchgeführt.
- Berechnen Sie den Prozentsatz der T-Zellen, die GzmB sezernieren, basierend auf dem Prozentsatz der GzmB-positiven T-Zell- und JeKo-1-Zell-Koverkapselungen, die auf die T-Zell-Lebensfähigkeit normiert sind, die in den reinen T-Zell-Tröpfchenpopulationen zum fraglichen Zeitpunkt zum fraglichen Zeitpunkt bestimmt wurde, wie folgt:
Ergebnisse
Nach der Transduktion wurden die T-Zellen mittels Durchflusszytometrie mit anti-CD3- und anti-NGFR-Antikörpern auf ihre CAR-Expression untersucht. Die CAR-T-Zellpopulation wurde anschließend mit magnetischen Anti-NGFR-Kügelchen angereichert, was zu einer Reinheit von über 98 % für beide Spender führte (Abbildung 1A-B). Das CD4/CD8-Verhältnis und der Gedächtnisphänotyp der verwendeten sortierten CAR-Zellen wurden ebenfalls quantifiziert, wobei eine Standard-Gate-Strategie unter Verwendung von CCR7- und CD45RA-Antikörpern verwendet wurde. Diese Daten zeigen, dass das CD4/CD8-Verhältnis der verwendeten CAR-T-Zellen 0,73 betrug und die Zellen hauptsächlich einen naiven Gedächtnisphänotyp aufwiesen (Abbildung 1C-E).
CAR-T-Zellen und JeKo-1-Zellen wurden mit violetten bzw. dunkelroten Farbstoffen gefärbt und zusammen mit den Assay-Reagenzien GzmB-Substrat und PI in DE50-Tröpfchen verkapselt (Abbildung 2). Alternativ können CAR-T-Zellen auch mit Antikörpern wie anti-CD4 oder anti-CD8 markiert werden (Abbildung 3), was eine detailliertere Charakterisierung von T-Zellen ermöglicht. Jede T-Zell-Suspension (CAR, T oder NTD) wurde unmittelbar vor der Verkapselung mit einer JeKo-1-Zellsuspension bei einem Effektor-Zielzell-Verhältnis von 1:3 (0,5 x 106 T-Zellen und 1,5 x 106 JeKo-1) gemischt. Nach der Verkapselung wurde jede Tröpfchenproduktion (CAR-T-Zellen + JeKo-1 und NTD + JeKo-1) in drei Inkubationsröhrchen für eine Inkubation von 2 h, 4 h bzw. 6 h aufgeteilt. Die Zellen wurden in den Tröpfchen bei 37 °C in 5 % CO2 inkubiert und dann zu den angegebenen Zeitpunkten durch Mikroskopie und Durchflusszytometrie analysiert.
Wir führten eine Fluoreszenzmikroskopie von Doppelemulsionströpfchen nach 4 Stunden Inkubation durch (Abbildung 4). Die Intensität des grünen Fluoreszenzsignals (FITC) veranschaulicht das Ausmaß der sezernierten GzmB-Aktivität von CAR-T-Zellen oder NTDs in den DE50-Tröpfchen. Abbildung 4B zeigt Phasenkontrast- und Fluoreszenzmikroskopie-Bilder eines einzelnen GzmB-positiven Tröpfchens, das eine CAR-T-Zelle und eine JeKo-1-Zielzelle in engem Kontakt enthält.
Anschließend wurden DE50-Tröpfchen mittels Durchflusszytometrie analysiert, um den Prozentsatz der CAR-T-Zellen mit früher GzmB-Sekretion und zytotoxischer zellabtötender Aktivität zu quantifizieren (Abbildung 5). Die Färbung von JeKo-1-Zielzellen vor der Inkubation mit einem dunkelroten Farbstoff und Effektor-T-Zellen mit einem violetten Farbstoff vor der Verkapselung ermöglichte die Identifizierung von drei verschiedenen zellhaltigen Tröpfchenpopulationen, da die Zellen in Tröpfchen auf der Grundlage der Poisson-Verteilung verteilt sind. Bei den identifizierten Tröpfchenpopulationen handelt es sich um Tröpfchen mit T-Zellen allein, JeKo-1-Zellen allein sowie T-Zellen und JeKo-1-Zellen zusammen (Abbildung 5A). Tröpfchen, die T-Zellen mit JeKo-1-Zellen verkapseln, wurden gated und auf Signale analysiert, die auf GzmB-Aktivität (Abbildung 5B) und Zelltod hinweisen, wie durch PI (Abbildung 5C) angezeigt.
Die Verkapselung der Zellen in Tröpfchen folgt der Poisson-Verteilung, und es werden vier verschiedene Tröpfchenpopulationen erhalten (Abbildung 6A). Abbildung 6B zeigt den Gehalt an GzmB-positiven Tröpfchen in allen Tröpfchenpopulationen nach 6 h Inkubation von Tröpfchen, aus dem der Prozentsatz der spontanen GzmB-sezernierenden T-Zellen bestimmt werden kann. Diese Daten deuten auf die hohe Spezifität der Methode hin, da nur CAR-T-Zellen GzmB sezernieren.
Schließlich quantifizierten wir die GzmB- und PI-Spiegel über verschiedene Zeitpunkte nach 2 h, 4 h und 6 h Co-Inkubation. Als Referenz wurden die Tröpfchen, die nur T-Zellen und nur JeKo-1-Zellen enthielten, analysiert, um den Hintergrundzelltod in jeder Population zu untersuchen (Abbildung 6C). Der Hintergrundzelltod wurde verwendet, um den Prozentsatz lebender GzmB-sezernierender und zielzelltötender T-Zellen in der Population von Effektorzellen zu bestimmen (Abbildung 7), wie in Schritt 3.3 beschrieben. CAR-T-Zellen von zwei Spendern zeigten einen zeitabhängigen Anstieg sowohl der zielzellinduzierten GzmB-Sekretion als auch der zelltötenden Aktivität. Fast 36 % der lebenden CAR-T-Zellen von Spender 1 und 31 % von Spender 2 hatten GzmB nach 6-stündiger Co-Verkapselung mit der Zielzelle sezerniert, ein signifikanter Anstieg im Vergleich zu NTD-Kontroll-T-Zellen (Abbildung 7A). Dementsprechend hatten etwa 21 % der lebenden Spender-1- und 22 % der lebenden Spender-2-CAR-T-Zellen Zielzellen abgetötet, was durch ein positives PI-Signal angezeigt wird (Abbildung 7B). Der Prozentsatz der CAR-T-Zellen, die GzmB sezerniert hatten, überstieg den Prozentsatz der abgetöteten Zielzellen zu jedem Zeitpunkt, was mit der erwarteten Abfolge von Ereignissen bei GzmB-vermittelter Zytotoxizität übereinstimmt. Zusammengenommen zeigen diese Daten, dass die hier vorgestellte Methode die Charakterisierung der Heterogenität der einzelnen T-Zell-Zytotoxizität innerhalb einer Zellpopulation sowie Vergleiche zwischen verschiedenen Populationen ermöglicht.
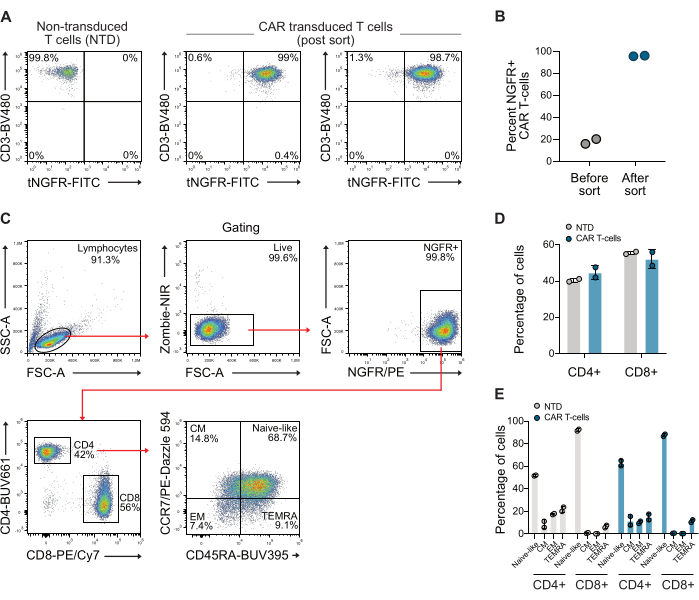
Abbildung 1: Repräsentative Durchflusszytometrie-Diagramme nach NGFR-Sortierung. (A) Nach etwa 10 Tagen der Expansion wurden die CAR-T-Zellen mit NGFR-spezifischen Mikrokügelchen und magnetischer Sortierung sortiert, was zu einer Population von CAR-T-Zellen führte, die zu >98 % aus CAR-T-Zellen bestand. (B) Quantifizierung von CAR-T-Zellen von zwei Spendern, die in dieser Studie verwendet wurden, vor und nach der Sortierung. (C) Gating-Strategie zur Untersuchung des CD4/CD8-Verhältnisses und des Gedächtnisphänotyps von T-Zellen. (D) Quantifizierung von CD4 und CD8 der verwendeten T-Zellen. (E) Quantifizierung des Gedächtnisphänotyps der verwendeten T-Zellen. Abkürzung: CM = zentraler Speicher, EM = Effektorspeicher, NTD = nicht transduziert, TEMRA = terminale differenzierte Effektorzellen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
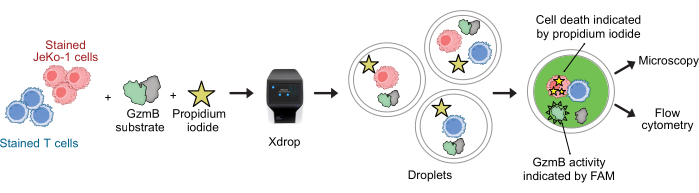
Abbildung 2: Arbeitsablauf für den kombinierten GzmB-Sekretions- und Zytotoxizitätsassay mit Einzelzellauflösung in Tröpfchen. Vor der Verkapselung in DE-Tröpfchen werden die Ziel- und Effektorzellen getrennt mit violetten und dunkelroten Zellfärbungen gefärbt. Unter Verwendung des Mikrofluidikgeräts und der Verkapselungskartusche werden Effektorzellen zusammen mit Zielzellen in Tröpfchen zusammen mit Zellmedium, PI und FAM-markiertem GzmB-Peptidsubstrat verkapselt. Der Assay und die Inkubation finden innerhalb der Tröpfchen statt. Die sezernierte GzmB-Aktivität wird durch die Emission von grüner Fluoreszenz angezeigt, die nach der Spaltung des Substrats durch GzmB erfolgt. Der Zelltod wird durch PI angezeigt. Nach der Inkubation werden die DE50-Tröpfchen mikroskopisch und/oder durchflusszytometrisch analysiert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
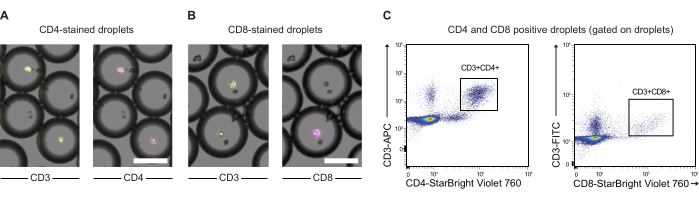
Abbildung 3: Analyse von tröpfchenverkapselten PBMCs, die mit Anti-CD3-, Anti-CD4- und Anti-CD8-Antikörpern vormarkiert sind. (A) Mikroskopische Bilder von Tröpfchen mit verkapselten PBMCs, die mit Anti-CD3 (APC) und Anti-CD4 (NIR) Antikörpern vormarkiert sind. Maßstabsleiste = 100 μm. (B) Wie (A), jedoch mit CD3 (FITC) und Anti-CD8 (NIR) Markierung. Maßstabsleiste = 100 μm. (C) Durchflusszytometrische Analyse der gleichen Tröpfchen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
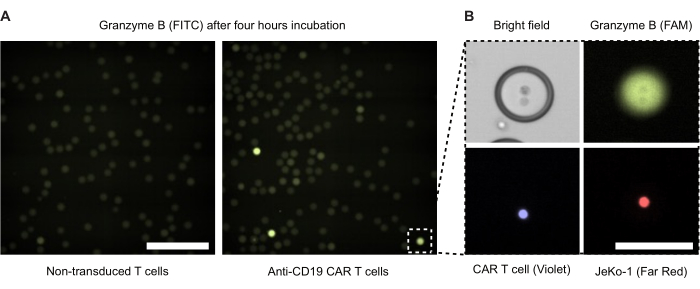
Abbildung 4: Mikroskopische Aufnahmen von Tröpfchen mit Effektor- und Zielzellen. Die Bilder wurden nach 4-stündiger Inkubation in einem standardmäßigen 37 °C, 5 % CO2 -befeuchteten Zellinkubator aufgenommen. (A) Tröpfchen aus einer Probe mit verkapselten NTD- und JeKo-1-Zellen (links) oder CAR-T-Zellen und JeKo-1-Zellen (rechts), die durch Fluoreszenzmikroskopie unter Verwendung des FITC-Kanals abgebildet wurden, um GzmB-positive (grüne) Tröpfchen zu detektieren. Maßstabsleiste = 500 μm. (B) Ein einzelnes Tröpfchen, das durch Phasenkontrast, FITC (GzmB), APC (JeKo-1-Zelle) und DAPI (CAR-T-Zelle) abgebildet wird. Maßstabsleiste = 100 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
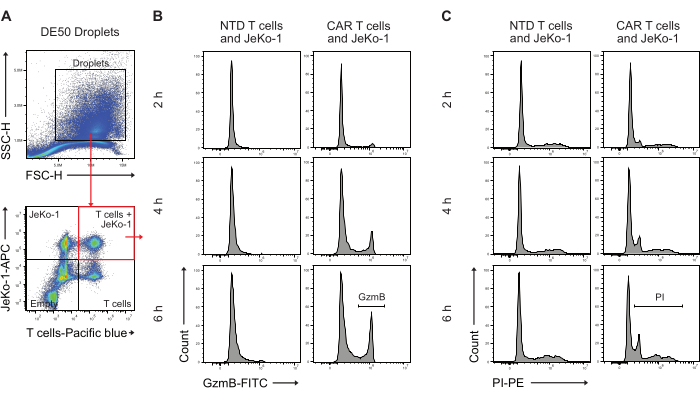
Abbildung 5: Gating-Strategie für die Analyse von Tröpfchen durch Durchflusszytometrie nach der Inkubation. (A) Das Gating erfolgte durch Vorwärts- und Seitenstreuung, um Tröpfchen zu identifizieren, gefolgt von der Auswahl des Gates, das die Tröpfchen enthält. Die Ereignisse außerhalb des Tores stellen Öltröpfchen dar, die als Nebenprodukt der Doppelemulsionströpfchenproduktion entstehen. Die anschließende Fluoreszenzanalyse von Tröpfchen in Kanälen, die den applizierten Zellfärbungen entsprechen, identifiziert vier Tröpfchenpopulationen: Tröpfchen, die sowohl T-Zellen als auch JeKo-1-Zellen enthalten (rotes Quadrat); Tröpfchen mit JeKo-1-Zellen allein; Tröpfchen mit T-Zellen allein; und leere Tröpfchen. (B) Repräsentative Histogramme für das GzmB-Signal in doppel-positiven Tröpfchen über Zeitpunkte hinweg und zwischen NTD- und CAR-T-Zellen. (C) Repräsentative Histogramme für das PI-Signal in doppel-positiven Tröpfchen über Zeitpunkte hinweg und zwischen NTD- und CAR-T-Zellen. Alle Tröpfchenmessungen werden als Intensitätshöhenmessungen (H) durchgeführt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
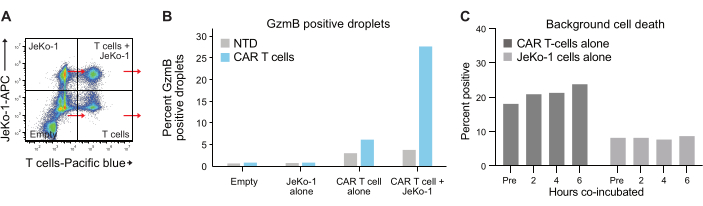
Abbildung 6: Interne Kontroll- und Referenzpopulationen. (A) Jeder der vier Quadranten aus Abbildung 5A wurde ausgewählt, und GzmB und PI wurden in jedem gemessen. Diese Art der Quantifizierung ermöglicht es, Hintergrundsignale zu messen und zu subtrahieren, bevor eine abschließende Analyse der Wirksamkeit der T-Zellen durchgeführt wird. (B) Diagramm mit der Häufigkeit von GzmB-positiven Tröpfchen nach 6-stündiger Inkubation für jede der vier Tröpfchenpopulationen, beispielhaft mit Daten aus der CAR-T-Probe von Donor 1. (C) Der Zelltod im Hintergrund wurde in reinen JeKo-1- und T-Zell-Kontrolltröpfchenpopulationen zu jedem gemessenen Zeitpunkt mit Daten von Spender 1 bestimmt. Der Hintergrundzelltod wird zur Berechnung der Häufigkeit von lebenden GzmB-sezernierenden und zelltötenden Effektorzellen verwendet, die in Abbildung 7 dargestellt und in Schritt 3.3 erläutert werden. Abkürzungen: Pre = Verkapselung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
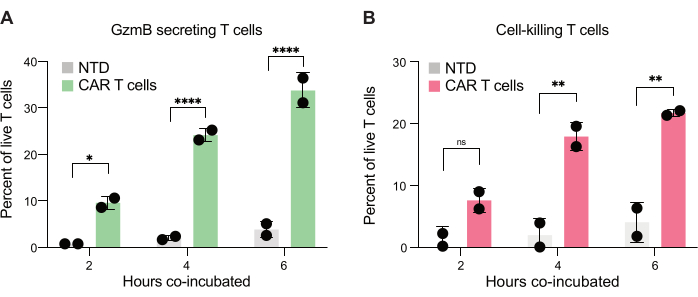
Abbildung 7: Quantifizierung von T-Zellen, die in der Lage sind, GzmB zu sezernieren und JeKo-1-Zellen in doppel-positiven Tröpfchen abzutöten. Doppelt positive Tröpfchen, die von zwei Spendern abgegrenzt wurden, wurden nach 2 h, 4 h und 6 h Co-Inkubation in Tröpfchen untersucht. (A) Häufigkeit von T-Zellen, die auf Zielzellen treffen, die GzmB sezernieren, und Vergleich zwischen NTD-T-Zellen und CAR-T-Zellen. (B) Häufigkeit, mit der Zielzellen auf T-Zellen treffen, die die co-verkapselte Zielzelle töten. Abkürzungen: GzmB = Granzym B, NTD = nicht transduziert, PI = Propidiumiodid. * = P-Wert < 0,05, ** = P-Wert < 0,005, **** = P-Wert < 0,0001 bei bidirektionaler ANOVA. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
In dieser Arbeit stellen wir eine Methode zur Untersuchung des zytotoxischen Potenzials von T-Zellen auf Einzelzellebene unter Verwendung eines einfach zu bedienenden, kommerziell erhältlichen Mikrofluids vor, um das zytotoxische Potenzial von CD19-CD28-CD3z CAR-T-Zellen nach Co-Verkapselung mit der CD19-positiven Mantelzell-Lymphom-Zelllinie JeKo-1 zu bewerten.
Dieses Protokoll umfasst mehrere kritische Schritte. Zunächst empfehlen wir, Stimulationsperlen mindestens 48 Stunden vor der Durchführung von Assays von den T-Zellen zu entfernen, um falsch positive Ergebnisse zu vermeiden. Zweitens kann die Effizienz der T-Zell-Transduktion mit Konstrukten wie CARs oder T-Zell-Rezeptoren erheblich variieren. Ohne einen anschließenden Aufreinigungsschritt der transduzierten T-Zellen können die Ergebnisse schwierig zu interpretieren sein. Hier wurde eine reine Population von CAR-T-Zellen verwendet, so dass ein hohes Maß an Sicherheit bei der Charakterisierung von CAR-T-Zellen als Killer oder Nicht-Killer zu jedem Zeitpunkt erwartet werden kann. Alternativ kann das Markieren von CARs mit fluoreszierendem Protein oder genetischem Tag angewendet werden, um Zellen anzuzeigen, die CAR-positiv sind, und dann bei der Analyse von Tröpfchen zu bestimmen. Wenn Markierung verwendet wird, sollten die ausgewählten fluoreszierenden Moleküle die Fluoreszenzemissionen von keinem der anderen Assay-Fluorophore beeinträchtigen. So würde z.B. die Verwendung von GFP-Tagging das in den hier durchgeführten Versuchen aufgetragene FAM-markierte GzmB-Substrat beeinträchtigen und wird daher nicht empfohlen.
Ein großer Vorteil des hier skizzierten Protokolls besteht darin, dass die Tröpfchenerzeugung selbst vereinfacht und automatisiert wird. Um jedoch eine Einzelzellverkapselung zu gewährleisten, ist es wichtig, dass die Zellen vor dem Laden der Kartusche gründlich resuspendiert werden. Aus diesem Grund wird empfohlen, bei der Vorbereitung des Ladens der Patrone in einem fairen Tempo zu arbeiten. Eine ähnliche Überlegung gilt für die Zugabe des GzmB-Substrats, da einige Zellen hohe Sekretoren von GzmB sind. Die Resuspension der Zellen verhindert auch das Verstopfen kleiner mikrofluidischer Kartuschenkanäle. Die richtige Verkapselung von Zellen lässt sich, wie oben beschrieben, leicht durch Mikroskopie überprüfen.
Da das Tröpfchen das Zellmedium einkapselt und zelluläre Produkte zurückhält, die von Zellen sezerniert werden, können andere Zytokine, Antikörper und Verbindungen analysiert werden. In der Tat haben wir andere relevante Immunzell-sezernierte Moleküle wie IFN-γ und TNF-α getestet, die Modifikationen des aktuellen Protokolls erfordern. Für die Zytokindetektion kann eine andere Art von Assay-Format als das, was wir hier für GzmB verwenden, angewendet werden, wie z. B. die Erzeugung eines ELISA-Sandwiches auf der Effektorzelloberfläche32. Darüber hinaus können Zellfärbungen und Assay-Farben geändert werden, z. B. Carboxyfluorescein-Succinimidylester (CFSE), aber es ist wichtig, ein minimales oder kein Durchscheinen über verschiedene Farbkombinationen hinweg zu gewährleisten, wie dies bei der Standard-Durchflusszytometrie der Fall wäre.
Darüber hinaus ist dieses Protokoll nicht auf die Analyse von CAR-T-Zellen beschränkt. Es kann auch erweitert werden, um andere T-Zell-Ziel-Interaktionen oder andere Immunzellen wie CAR-NK-Zellen zu untersuchen. Fortgeschrittenere Experimente sind ebenfalls denkbar, z. B. die Markierung von CD4- und CD8-T-Zell-Untergruppen mit zusätzlichen Fluorophoren, um eine breitere funktionelle Immunphänotypisierung durchzuführen. In der Tat zeigen wir hier, dass CD4 und CD8 in den Tröpfchen nachgewiesen werden können, was eine weitere Charakterisierung der Effektor-T-Zellen und ihrer zytotoxischen Kapazität ermöglicht.
Um dieses Protokoll zu optimieren, haben wir speziell darauf abgezielt, dass es auf Standard-Durchflusszytometrie-Instrumenten funktioniert. Obwohl die Tröpfchen-Durchflusszytometrie nicht kompliziert ist, haben wir festgestellt, dass es zu Ölablagerungen kommen kann, wenn das Durchflusszytometer in bestimmten Intervallen oder wie hier empfohlen nach der Analyse der Proben in jedem Zeitintervall nicht ordnungsgemäß gespült wird. Das beste Spülprotokoll kann für jedes einzelne Durchflusszytometer spezifisch sein.
Einer der wesentlichen Vorteile dieser Methode ist ihre Hochdurchsatzfähigkeit, die es ermöglicht, die Einzelzelleffektor-vermittelte Zytotoxizität gegen Zielzellen zu überwachen, ohne dass umfangreiches Fachwissen oder hochspezialisierte Geräte erforderlich sind. Der Assay kann problemlos mit vorhandenen Instrumenten wie Durchflusszytometrie oder Mikroskopie durchgeführt werden. Doppelemulsionströpfchen sind auch für die Sortierung unter Verwendung von Zellsortierern30, 31 zugänglich, was die Isolierung von Zellen mit spezifischen Funktionalitäten, z. B. CAR-T-Zellen mit und ohne zytotoxisches Potenzial, gefolgt von einer Einzelzell-Transkriptomanalyse, ermöglichen kann.
Die Technologie ist nicht ohne Einschränkungen. Während einige Zelllinien die Kultivierung in Tröpfchen für 24 Stunden und darüber hinaus tolerieren, können Primärzellen nach 24 Stunden eine deutlich geringere Lebensfähigkeit aufweisen. Dies stellt eine Zeitbeschränkung für die Assays im Allgemeinen dar, aber für den aktuellen Assay kann eine spürbare GzmB- und zelltötende Aktivität innerhalb von 4-6 Stunden beobachtet werden, wahrscheinlich weil das kleine Tröpfchenkompartiment ein schnelles Zusammentreffen von Effektor- und Zielzellen gewährleistet. Ebenso gewährleistet das kleine Tröpfchenvolumen einen schnellen Aufbau der Konzentration auf ein nachweisbares Niveau des sezernierten GzmB-gespaltenen Substrats. Eine weitere Einschränkung der Technologie ist die Unfähigkeit, bei Verwendung von Standard-Durchflusszytometern eine serielle Tötung durch Effektorzellen zu erkennen. Dies könnte jedoch möglicherweise mit bildgebenden Durchflusszytometern oder bildgebenden Zytometrietechnologien erreicht werden, was untersucht werden muss.
Der adoptive Transfer von CD19-CAR-T-Zellen hat bei der Behandlung von Patienten mit hämatologischen Malignomen bemerkenswerte Erfolge gezeigt. Trotzdem gibt es bei Patienten32 eine große Variation des Ansprechens und der unvorhersehbaren Toxizität, was teilweise auf die Heterogenität innerhalb des CAR-T-Infusionsprodukts zurückzuführen sein kann. Infolgedessen besteht ein wachsendes Interesse an der Analyse der phänotypischen Zusammensetzung und zytotoxischen Fähigkeit einzelner CAR-T-Zellen innerhalb einer Population. Dies wird besonders wichtig sein, da die CAR-Therapie zunehmend bei Autoimmunerkrankungen und anderen Krebsarten getestet wird. Das hier beschriebene Mikrofluidik-Gerät und -Protokoll bieten einen robusten und vielseitigen Ansatz zur Untersuchung der Heterogenität von CAR-T-Zellen und anderen zellbasierten Therapien.
Offenlegungen
Die Autoren erklären folgende Interessenkonflikte: M.B.B. hat Beratungshonorare von Janssen, Roche und Kite/Gilead erhalten, die in keinem Zusammenhang mit der vorliegenden Arbeit stehen. D.L.P. und P.M. sind Mitarbeiter von Samplix.
Danksagungen
Die Autoren danken den Mitgliedern und Mitarbeitenden von CITCO und Samplix für die hilfreichen Diskussionen und Anregungen. M.B.B. wird durch das Early-Career Clinician Scientists' Fellowship der Lundbeck Foundation (R381-2021-1278) unterstützt. Diese Arbeit wird durch ein Elite-Forschungsstipendium des Universitätskrankenhauses Odense unterstützt. Darüber hinaus wurde diese Forschung durch einen Zuschuss des European Innovation Council Project 190144395 an Samplix ApS unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| Blocker BSA (BSA) | Thermo Scientific | 37525 | |
| CellTrace Far Red Cell Proliferation Kit (far red fluorescent dye) | Invitrogen | C34564 | |
| CellTrace Violet Cell Proliferation Kit (violet fluorescent dye) | Invitrogen | C34557 | |
| DE Stabilizing Solution (stabilizing solution) | Samplix | REDIVSTABSOL1500 | |
| DPBS (dPBS) | Gibco | 14190-094 | |
| Dulbecco’s PBS (dPBS) | Capricorn Scientific | PBS-1A | |
| Dynabeads Human T-Activator (CD3/CD28 activation beads) | Gibco | 11132D | |
| Fetal Bovine Serum (FBS) | Capricorn Scientific | FBS-HI-12A | |
| Lenti-X Concentrator (PEG-based reagent) | Takara Bio | 631232 | |
| MACSelect LNGFR Microbeads (anti-NGFR magnetic beads) | Miltenyi Biotec | 130-091-330 | |
| OptiPrep density gradient medium (gradient medium) | Stemcell | 7820 | |
| Penicillin-Streptomycin (P/S) | Capricorn Scientific | PS-B | |
| Propidium iodide (PI) | Invitrogen | BMS500PI | |
| Recombinant Human IL-2 (IL-2) | Peprotech | 200-02 | |
| RPMI-1640 with Stable Glutamine (RPMI-1640) | Capricorn Scientific | RPMI-STA | |
| RPMI-1640 without L-Glutamine and phenol red | Gibco | 32404-014 | |
| Xdrop DE oil I (oil) | Samplix | REOILDEC1900 | |
| Xdrop Granzyme B substrate (GzmB substrate) | Samplix | REGRB100 | |
| Zombie-NIR viability dye (viability dye) | BioLegend | 423106 | |
| Plasticware etc. | |||
| 8-chamber glass slide | Chemometec | 942-0003 | |
| Cell culture plate, 12 well | TH Geyer | 7696791 | |
| DNA LoBind tube, 2 mL (DNA tube) | Eppendorf | 30108078 | |
| Eppendorf tube, 1.5 mL (1.5 mL tube) | Eppendorf | 30108051 | |
| Falcon tube, 15 mL (15 mL tube) | TPP | 91015 | |
| Falcon tube, 5 mL (5 mL tube) | Falcon (VWR) | 734-0443 | |
| Green cell suspension flasks for cell incubations (T75 flask) | Sarstedt | 148.19.22 | |
| Green cell suspension plates for cell incubations (96 well plate) | Sarstedt | 148.32.20 | |
| LS Separation Columns (separation column) | Miltenyi Biotec | 130-042-401 | |
| Xdrop DE Gaskets (gaskets) | Samplix | #GADEA100 | |
| Xdrop DE50 Cartridge (encapsulation cartridge) | Samplix | #CADE50A100 | |
| Antibodies | |||
| anti-CCR7 PE-Dazzle 594 | BioLegend | 353236 | |
| anti-CD19 CAR FMC63 Idiotype Antibody, PE | Miltenyi Biotec | 130-127-342 | |
| anti-CD3 APC | Biolegend | 300439 | |
| anti-CD3 BV480 | BD Biosciences | 566105 | |
| anti-CD3 FITC | BD Biosciences | 345763 | |
| anti-CD4 BUV661 | BD Biosciences | 612962 | |
| anti-CD4 StarBright Violet 760 | Bio-Rad | MCA1267SBV760T | |
| anti-CD45RA BUV395 | BD Biosciences | 740298 | |
| anti-CD8 PE-Cy7 | BioLegend | 344712 | |
| anti-CD8 StarBright Violet | Bio-Rad | MCA1226SBV760 | |
| anti-NGFR FITC | BioLegend | 345106 | |
| anti-NGFR PE | BioLegend | 345106 | |
| Cells | |||
| JeKo-1 Mantle-cell lymphoma cell-line (JeKo-1) | ATCC | CRL-3006 | |
| Primary peripheral blood mononuclear cells (PBMCs) | |||
| Equipment | |||
| Countess 3 Automated Cell Counter | Thermo Fisher Scientific | A50298 | |
| DynaMag-2 Magnet | Invitrogen | 12321D | |
| NovoCyte Quanteon Flow Cytometer (flow cytometer) | Agilent | 2010011AA | |
| Xdrop (microfluidics device) | Samplix | IN00110-EU |
Referenzen
- Pasqui, D. M., Latorraca, C. D. O. C., Pacheco, R. L., Riera, R. CAR-T cell therapy for patients with hematological malignancies. A systematic review. Eur J Haematol. 109 (6), 601-618 (2022).
- Krejcik, J., et al. Harnessing the immune system to fight multiple myeloma. Cancers. 13 (18), 4546 (2021).
- Tokarew, N., Ogonek, J., Endres, S., von Bergwelt-Baildon, M., Kobold, S. Teaching an old dog new tricks: next-generation CAR T cells. British J Cancer. 120 (1), 26-37 (2019).
- Bogetofte Barnkob, M., Vitting-Seerup, K., Rønn Olsen, L. Target isoforms are an overlooked challenge and opportunity in chimeric antigen receptor cell therapy. Immunother Adv. 2 (1), ltac009 (2022).
- Daei Sorkhabi, A., et al. The current landscape of CAR T-cell therapy for solid tumors: Mechanisms, research progress, challenges, and counterstrategies. Front Immunol. 14, 1113882 (2023).
- . Considerations for the Development of Chimeric Antigen Receptor (CAR) T Cell Products Available from: https://www.fda.gov/regulatory-information/search-fda-guidance-documents/considerations-development-chimeric-antigen-receptor-car-t-cell-products (2024)
- Roddie, C., O'Reilly, M., Dias Alves Pinto, J., Vispute, K., Lowdell, M. Manufacturing chimeric antigen receptor T cells: issues and challenges. Cytotherapy. 21 (3), 327-340 (2019).
- Wang, L., et al. Improvement of in vitro potency assays by a resting step for clinical-grade chimeric antigen receptor engineered T cells. Cytotherapy. 21 (5), 566-578 (2019).
- Burrows, S. R., Fernan, A., Argaet, V., Suhrbier, A. Bystander apoptosis induced by CD8+ cytotoxic T cell (CTL) clones: implications for CTL lytic mechanisms. Int Immunol. 5 (9), 1049-1058 (1993).
- Gattinoni, L., et al. Acquisition of full effector function in vitro paradoxically impairs the in vivo antitumor efficacy of adoptively transferred CD8+ T cells. J Clin Invest. 115 (6), 1616-1626 (2005).
- Chen, G. M., et al. Integrative bulk and single-cell profiling of premanufacture T-cell populations reveals factors mediating long-term persistence of CAR T-cell therapy. Cancer Dis. 11 (9), 2186-2199 (2021).
- Frazer, G. L., Gawden-Bone, C. M., Dieckmann, N. M. G., Asano, Y., Griffiths, G. M. Signal strength controls the rate of polarization within CTLs during killing. J Cell Biol. 220 (10), e202104093 (2021).
- Hermans, I. F., et al. The VITAL assay: a versatile fluorometric technique for assessing CTL- and NKT-mediated cytotoxicity against multiple targets in vitro and in vivo. J Immunol Meth. 285 (1), 25-40 (2004).
- Zaritskaya, L., Shurin, M. R., Sayers, T. J., Malyguine, A. M. New flow cytometric assays for monitoring cell-mediated cytotoxicity. Expert Rev Vaccines. 9 (6), 601-616 (2010).
- Piccinini, C., et al. In vitro CAR-T cell killing: validation of the potency assay. Cancer Immunol Immunother CII. 73 (9), 168 (2024).
- Martinez, E. M., et al. High-throughput flow cytometric method for the simultaneous measurement of CAR-T cell characterization and cytotoxicity against solid tumor cell lines. SLAS Disc Adv Life Sci. 23 (7), 603-612 (2018).
- Jedema, I., van der Werff, N. M., Barge, R. M. Y., Willemze, R., Falkenburg, J. H. F. New CFSE-based assay to determine susceptibility to lysis by cytotoxic T cells of leukemic precursor cells within a heterogeneous target cell population. Blood. 103 (7), 2677-2682 (2004).
- Liu, L., et al. Cellular and molecular imaging of CAR-T cell-based immunotherapy. Adv Drug Delivery Rev. 203, 115135 (2023).
- Liadi, I., et al. Defining potency of CAR+ T cells: Fast and furious or slow and steady. Oncoimmunology. 8 (10), e1051298 (2019).
- Xhangolli, I., et al. Single-cell analysis of CAR-T cell activation reveals a mixed TH1/TH2 response independent of differentiation. Genom Proteom Bioinfo. 17 (2), 129-139 (2019).
- Zhou, Y., et al. Evaluation of single-cell cytokine secretion and cell-cell interactions with a hierarchical loading microwell chip. Cell Rep. 31 (4), 107574 (2020).
- LaBelle, C. A., Zhang, R. J., Hunsucker, S. A., Armistead, P. M., Allbritton, N. L. Microraft arrays for serial-killer CD19 chimeric antigen receptor T cells and single cell isolation. Cytometry J Int Soc Anal Cytol. 103 (3), 208-220 (2023).
- Hellmann, M. J., et al. Heterogeneously deacetylated chitosans possess an unexpected regular pattern favoring acetylation at every third position. Nat Comm. 15 (1), 6695 (2024).
- Wong, K. U., et al. Assessment of chimeric antigen receptor T cytotoxicity by droplet microfluidics in vitro. Antibody Therapeut. 5 (2), 85-99 (2022).
- Antona, S., Platzman, I., Spatz, J. P. Droplet-based cytotoxicity assay: Implementation of time-efficient screening of antitumor activity of natural killer cells. ACS omega. 5 (38), 24674-24683 (2020).
- Subedi, N., et al. An automated real-time microfluidic platform to probe single NK cell heterogeneity and cytotoxicity on-chip. Sci Rep. 11 (1), 17084 (2021).
- Zhang, Y., et al. Enhanced CRISPR/Cas12a-based quantitative detection of nucleic acids using double emulsion droplets. Biosens Bioelect. 257, 116339 (2024).
- Kochenderfer, J. N., et al. Construction and preclinical evaluation of an anti-CD19 chimeric antigen receptor. J Immunother. 32 (7), 689-702 (2009).
- Michaels, Y. S., et al. Precise tuning of gene expression levels in mammalian cells. Nat Comm. 10 (1), 818 (2019).
- Yuan, Y., et al. Droplet encapsulation improves accuracy of immune cell cytokine capture assays. Lab on a Chip. 20 (8), 1513-1520 (2020).
- Brower, K. K., et al. Double emulsion flow cytometry with high-throughput single droplet isolation and nucleic acid recovery. Lab on a Chip. 20 (12), 2062-2074 (2020).
- Kirouac, D. C., et al. Deconvolution of clinical variance in CAR-T cell pharmacology and response. Nat Biotechnol. 41 (11), 1606-1617 (2023).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten