Method Article
בדיקת ציטוטוקסיות מבוססת טיפות להערכת תאי T קולטני אנטיגן כימריים ברמת התא הבודד
In This Article
Summary
כאן, אנו מתארים שיטה ליצירת טיפות תחליב כפולות המכילות תא T אחד ותא מטרה סרטני כדי לבחון הרג תאים ברמת התא הבודד. שיטה זו מאפשרת כימות כפול הן של מולקולות ציטוטוקסיות והן של אפופטוזיס של תאי מטרה בתוך אוכלוסייה גדולה של תאי T.
Abstract
הערכת הפוטנציאל הציטוטוקסי של טיפולים מבוססי תאי T, כגון טיפולי תאי T בקולטן אנטיגן כימרי (CAR), היא חיונית להערכת יעילותם ומהווה תנאי מוקדם ליישום קליני. עם זאת, מבחני ציטוטוקסיות מסורתיים נערכים כמבחנים בתפזורת ואינם מספקים מידע מפורט על ההטרוגניות התפקודית של אוכלוסיית תאי ה-CAR T. במחקר זה, אנו מתארים שיטה מבוססת טיפות אמולסיה כפולה המאפשרת אנקפסולציה משותפת בקנה מידה גדול של תאי CAR T אפקטור יחיד עם תאי מטרה בודדים תוך מתן אפשרות לכימות כפול הן של מולקולות אפקטור ציטוטוקסיות מתאי T והן של מוות תאי של תא המטרה. הפרוטוקול מתאר שיטה ליצירה וטיהור של תאי CAR T ספציפיים ל-CD19, ואחריו האנקפסולציה המשותפת שלהם בטיפות עם קו התאים CD19+ JeKo-1, יחד עם ריאגנטים להמחשת הפרשת מולקולות אפקטור ציטוטוקסיות (Granzyme B) ומוות תאים (באמצעות פרופידיום יודיד, PI). אנו מדגימים כיצד ליצור טיפות המכילות CAR T בודד ותאי מטרה באמצעות מכשיר מיקרופלואידיקה זמין מסחרית ליצירת טיפות תחליב כפולות. בנוסף, אנו מספקים דוגמאות כיצד לבחון את המגוון התפקודי של תאי CAR T בטיפות באמצעות ציוד ציטומטריית זרימה סטנדרטי. לבסוף, אנו מתארים בקצרה את הקינטיקה הזמנית וההטרוגניות של הריגת תאי T CAR ספציפיים ל-CD19. בעוד ששיטה זו מתמקדת במוות תאים לאחר מתקפת תאי T CAR, היא ניתנת להתאמה גם לבחינת סוגים אחרים של תאי T, תאי חיסון ציטוטוקסיים ותפקודי תאי אפקטור, כגון הפרשת ציטוקינים.
Introduction
טיפול בתאי T בקולטן אנטיגן כימרי (CAR) הוא תחום המתרחב במהירות של אימונותרפיה לסרטן התאים שהוכח כיעיל נגד צורות שונות של לוקמיה, לימפומה1 ומיאלומה נפוצה2. תאי CAR T נוצרים על ידי שינוי תאי T עם קולטן אנטיגן סינתטי שיכול להיקשר באופן סלקטיבי לחלבוני פני השטח כגון CD19 או אנטיגן התבגרות תאי B (BCMA), המתבטא בתאי B, תאי פלזמה ועמיתיהם הממאירים. ההתקדמות האחרונה בתכנון CAR אפשרה מיקוד של מספר אנטיגנים בו זמנית3, תוך הסתמכות על אותות קלט מרובים, או קשירה בלעדית לאנטיגנים הקשורים לגידול, כגון איזופורמים ספציפיים של חלבון4. בנוסף, מספר CARs נבדקים כעת נגד מטרות של סרטן לא המטולוגי5.
בדיקות ציטוטוקסיות חיוניות הן לפיתוח CAR והן לבקרת איכות לפני שחרור מוצרים קליניים 6,7,8. עם זאת, רוב הבדיקות הנוכחיות תלויות באוכלוסיות בתפזורת של תאי CAR T אפקטורים שנוספו בעודף לשורות התאים הסרטניים, מה שעלול להוביל לתוצאות חיוביות כוזבות עקב השפעות עוברי אורח9 ולגרום למתאם גרוע בין תוצאות in vitro ו-in vivo 10. מכיוון שהתפשטות תאי T והתמדה לטווח ארוך תלויים באותות המתקבלים במהלך אירועי ההפעלה הראשוניים11,12, בחינה מדוקדקת של אירועים ציטוטוקסיים ברמת התא הבודד היא מעניינת מאוד.
כדי להתמודד עם המגבלות של מתודולוגיות בתפזורת, ניתן לבצע מחקרי ציטוטוקסיות ברמת התא הבודד באמצעות ציטומטריית זרימה 13,14,15,16,17 ומבחנים מבוססי הדמיה18. עם זאת, למרות שציטומטריית זרימה סטנדרטית מציעה רזולוציה של תא בודד לכימות ואפיון של תאי אפקטור ותאי מטרה, היא אינה יכולה לקבוע ישירות את היכולת הציטוטוקסית הספציפית של תאי CAR T בודדים כלפי תאי מטרה. בנוסף, הדמיה של תאי CAR T בודדים המקיימים אינטראקציה עם המטרות שלהם בכמויות גדולות היא מאתגרת וגוזלת זמן בשל התנועתיות העקבית של התאים. כדי להתמודד עם אתגרים אלה, פותחו כלים חדשים לניתוח תאים בודדים המסתמכים על זיווג תאי אפקטור ותאי מטרה בחללים סגורים מרחבית באמצעות מערכי מיקרו-באר19,20,21, מערכי מיקרורפודה22, שבבים23 ומיקרופלואידיקה טיפתית 24,25,26. כלים אלה מספקים רגישות מדידה משופרת, ומאפשרים חקירה של פחות תאים באמצעות נפחי ריאגנטים מופחתים. עם זאת, נותרו מספר אתגרים, כולל זיווג תאים יעיל, המספר המוגבל של דגימות שניתן לנתח, הסתמכות על ניתוח מבוסס הדמיה בלבד וקשיים באחזור אוכלוסיות תאים ברות קיימא לניתוחים נוספים.
כאן, אנו משתמשים במכשיר מיקרופלואידיקה זמין מסחרית המאפשר גישה מפושטת מאוד למיקרופלואידיקה מבוססת טיפות. התקן זה מאפשר לבצע ניתוח ובדיקות מתקדמים של תא יחיד באמצעות טיפות תחליב כפול (DE) יציבות ביותר. בהשוואה למבחני מיקרו-וול ומיקרופלואידיקה טיפתית מסורתית, הפרוטוקול המתואר כאן אינו דורש מומחיות נרחבת במיקרופלודיקס.
טיפות DE הן תאים כדוריים קטנים המורכבים ממעטפת שמן עם ליבה מימית התלויה בתמיסה מימית. הטיפה המימית מכילה ושומרת על תאים, הפרשת תאים, מדיום תאים וריאגנטים לבדיקה, מה שמאפשר לבצע בדיקות מורכבות בתוך כל תא. באמצעות מכשיר המיקרופלואידיקה, טיפות DE נוצרות בנפח מוגדר (כ-100 pL) המתאים לבדיקות אינטראקציה של תא בודד או תא-תא של יונקים, שניתן ליצור במספרים גבוהים מאוד (כ-750,000 טיפות לדגימה) ובמסגרת זמן קצרה (כ-10 דקות ל-8 דגימות) על ידי משתמשי מעבדה כלליים ללא ידע מיוחד במיקרופלואידיקה. ניתן להשעות את הטיפות שנוצרו במדיום התא, ובכך לאפשר דיפוזיה חוצה מעטפת של O2 ו-CO2 וחציצה של החלק הפנימי תוך שמירה על מולקולות הידרופיליות וגדולות יותר כגון מולקולות אפקטור המופרשות בתא. התאים הנבדקים מאוחסנים בצורה מספקת, מה שמאפשר בחינה לאורך זמן של אינטראקציות תא-תא ודינמיקה זמנית. בניגוד לטיפות תחליב בודדות (למשל, טיפות מים בשמן)27, טיפות DE הן מבנים חזקים שאינם מתמזגים או מתמזגים בחממות תאים סטנדרטיות. בגלל יציבותם ושלב חיצוני מימי, הם תואמים גם להליכי ניתוח במורד הזרם כגון ציטומטריית זרימה מסורתית. טיפות הפיקוליטר הללו הנוצרות על ידי מכשיר המיקרופלואידיקה יכולות, אם כן, לשמש לניתוח תפוקה גבוהה של תא בודד של תפקוד התא כדי להבהיר הטרוגניות תפקודית החבויה במבחני תפזורת מסורתיים.
כאן, אנו מתארים פרוטוקול המשתמש בטיפות DE כדי לבחון את הפוטנציאל הציטוטוקסי של CARs ספציפיים ל-CD19 כלפי תאי לימפומה. הפרוטוקול שלנו מאפשר ניתוח של תא בודד של הרג מטרה והפרשת גרנזים B (GzmB) ומגלה כי לכ-20% מתאי ה-CAR T שנבדקו כאן יש פוטנציאל הרג מיידי.
Protocol
תאי ה-CAR T ששימשו במחקר זה נוצרו על ידי התמרת לנטי-ויראלית של תאי T ראשוניים עם מבנה CD19scFv-CD28-CD3ζ-tNGFR CAR במעבדה מוסמכת לבטיחות ביולוגית GMO Class 2 ונחשפו לאחר 4 ימים על פי תקן המכון. תאי T מטוהרים היו מעודפי חומר שהושלכו מתרומות דם אנונימיות והיו פטורים מאישורים אתיים נוספים על פי החוק הדני.
1. יצירת תאי CAR T
הערה: שם הריאגנטים המשמשים להלן משתמש בשמות גנריים ומקוצרים. את השם המסחרי המלא ניתן למצוא בסוגריים בטבלת החומרים.
- הפעלה, התמרה והתרחבות של תאי T
הערה: ביטוי יציב של תאי CD19 CAR T הושג באמצעות התמרה לנטי-ויראלית של תאי T אנושיים ראשוניים שבודדו מתאים חד-גרעיניים טריים בדם היקפי (PBMCs) באמצעות ערכת בידוד תאי T לבחירה שלילית. ה-CAR האנטי-CD19 המשמש הוא מבנה מהדור השני המורכב משבר משתנה חד-שרשרת FMC63 (scFv), ציר CD28 ותחום טרנסממברני, תחום קוסטימולטורי CD28, תחום הפעלה CD3ζ28 וגרסה קטומה של קולטן גורם הגדילה העצבי (tNGFR) לניטור והעשרה של תאים המבטאים CAR29. הפלסמיד וקטור ההעברה סונתז דה נובו, ו-lentivirus מהדור השלישי נוצר על ידי שילוב זה עם pMDLg/pRRE (Addgene plasmid #12251), pRSV-Rev (Addgene plasmid #12253) ו-pMD2.G (Addgene plasmid #12259)30. שלושת הפלסמידים המאוחרים יותר היו מתנה מדידייה טרונו. הנגיף הגולמי רוכז באמצעות ריאגנט מבוסס PEG, וריבוי הזיהום (MOI) נקבע על ידי התמרת תאי SUP-T1 ומדידת tNGFR על ידי זרימה ציטומטרית לפי פרוטוקולסטנדרטי 31.- העבירו 2 x 106 תאי T אנושיים ראשוניים לצלחת תרבית של 12 בארות ועוררו אותם עם חרוזים מצופים CD3/CD28 ביחס של 1:1 חרוז לתא ב-1 מ"ל של מדיום RPMI-1640 שלם (10% סרום בקר עוברי מומת בחום, 1% פניצילין/סטרפטומיצין) בתוספת 100 יחידות/מ"ל אינטרלוקין-2 אנושי רקומביננטי (IL-2). דגרו את התאים בטמפרטורה של 37 מעלות צלזיוס באינקובטור לחות של 5% CO2 למשך 24 שעות.
- הוסף חלקיקים לנטי-ויראלים לתאי ה-T המופעלים ב-MOI של 5-10. מערבבים בעדינות ודוגרים על התאים למשך 72 שעות. כלול תאי T שאינם מתמרים (NTD) כבקרה שלילית.
- ביום השלישי לאחר ההעברה, הסר את חרוזי ההפעלה CD3/CD28 על ידי קצירת תאי ה-T לתוך צינור של 1.5 מ"ל והנחת הצינור על מעמד מגנטי למשך 1-2 דקות. העבירו את הסופרנטנט המכיל את התאים לצינור חדש של 1.5 מ"ל.
- בצע ספירת תאים באמצעות מונה תאים אוטומטי והתאם את צפיפות התאים ל-1 x 106 תאים/מ"ל במדיום RPMI-1640 שלם בתוספת 100 U/mL IL-2. המשך להרחיב את תאי ה-T עד שספירת תאי ה-CAR T הכוללת תגיע לפחות ל-1.5 x 106 (בדרך כלל בסביבות 6 x 106 תאי T בסך הכל) בתרחיף לפני שתמשיך בהעשרת NGFR (ראה להלן).
- עקוב אחר ספירת התאים אחת ליומיים והתאם את הריכוז ל-1 x 106 תאים/מ"ל על ידי הוספת מדיום טרי בתוספת 100 יחידות/מ"ל IL-2 כדי להבטיח מצב תא אופטימלי במהלך ההתרחבות.
- העשרה של תאי T המבטאים CAR
- העבירו 6 x 106 או יותר תאי T מותמרים לתוך צינור של 15 מ"ל וצנטריפוגה ב-300 x גרם למשך 5 דקות. השעו מחדש את גלולת התא ב-320 מיקרוליטר של PBS בתוספת 0.5% אלבומין בסרום בקר (BSA) כדי ליצור PBSA ולהוסיף 40 מיקרוליטר של חרוזים מגנטיים נגד NGFR. מערבבים היטב ודוגרים על קרח למשך 15 דקות.
הערה: פרוטוקול זה מניח יעילות התמרה של כ-25%, וכתוצאה מכך >1.5 x 106 תאי CAR T לאחר העשרה. אנו לא ממליצים להתחיל עם פחות מ-6 x 106 תאים, מכיוון שהדבר עלול לגרום להתאוששות לקויה של תאי CAR T. - הוסף 1640 מיקרוליטר של PBSA כדי להביא את הנפח הסופי ל-2 מ"ל, ולאחר מכן המשך בהפרדה מגנטית באמצעות עמודות הפרדה בהתאם להוראות היצרן.
- העבירו 6 x 106 או יותר תאי T מותמרים לתוך צינור של 15 מ"ל וצנטריפוגה ב-300 x גרם למשך 5 דקות. השעו מחדש את גלולת התא ב-320 מיקרוליטר של PBS בתוספת 0.5% אלבומין בסרום בקר (BSA) כדי ליצור PBSA ולהוסיף 40 מיקרוליטר של חרוזים מגנטיים נגד NGFR. מערבבים היטב ודוגרים על קרח למשך 15 דקות.
- זיהוי ביטוי CAR על ידי זרימה ציטומטרית
הערה: אנו ממליצים לקבוע את אחוז התאים המבטאים CAR ואת כדאיותם בשלב זה, כדי להבטיח תאים תקינים לפני ביצוע הבדיקה שלהלן. ניתן לקבוע גם יחס CD4 ו- CD8 ופנוטיפ זיכרון בשלב זה. ראה איור 1 לעלילות מייצגות.- העבר 2.5 x 105 תאי T מתרבויות מתמרות ולא מתמרות לצינורות ציטומטריה נפרדים. שוטפים את התאים פי 2 עם 200 מיקרוליטר PBS, צנטריפוגה ב -300 x גרם למשך 5 דקות לאחר כל שטיפה.
- הכן תערובת נוגדנים המכילה נוגדנים נגד CD19 CAR FMC63 Idiotype PE, נוגדנים נגד CD3 BV480 ואנטי NGFR FITC, כל אחד מדולל 1:100 ב-PBS. השעו מחדש את התאים ב-50 מיקרוליטר מתערובת הנוגדנים ודגרו בטמפרטורה של 4 מעלות צלזיוס למשך 20 דקות.
- שוטפים את התאים פי 2 עם 200 מיקרוליטר PBS, צנטריפוגה ב -300 x גרם למשך 5 דקות לאחר כל שטיפה. השעו מחדש את התאים ב -200 מיקרוליטר של PBS ונתחו באמצעות ציטומטריית זרימה.
2. יצירת טיפות העוטפות תאי T ותאי מטרה
הערה: לפני האנקפסולציה, תאי T ותאי JeKo-1 מוכתמים בכתמי תאים שונים כדי לנטר את תכולת התאים הטיפתיים. התאים עטופים בריאגנטים לבדיקה ומודגרים במשך 2-6 שעות לפני ניתוח הטיפות על ציטומטר הזרימה (ראה איור 2).
- צביעת תאים לפני אנקפסולציה
- הכנת פתרונות עבודה של שני צבעים פלואורסצנטיים (השתמשנו בצבע סגול וצבע אדום רחוק) על ידי דילול תמיסות הסטוק (שהוכנו לפי הוראות היצרן) 1:5,000 ב-dPBS.
- עבור כל תורם, העבירו 2.5 x 106 CAR T, 2.5 x 106 NTD T ו-15 x 106 תאי JeKo-1 לצינורות צנטריפוגה נפרדים (צינורות של 15 מ"ל או 50 מ"ל) וצנטריפוגה ב-300 x גרם למשך 5 דקות. בניסוי זה, 0.5 x 106 תאי אפקטור היו עטופים ב-1.5 x 106 תאי מטרה עבור כל דגימה שהוכנה.
הערה: מספר התאים המועברים כאן מיועד ל-4x דגימות אנקפסולציה עם כל סוג תא אפקטור עבור כל תורם. הקטינו את מספר התאים והריאגנטים בהתאם למספר הדגימות הדרושות. בנוסף, ניתן לשנות את המספר המדויק של תאים לדגימה בהתאם לצרכי הניסוי. - הסר את כדורי תאי האפקטור בתמיסת העבודה של 1:5,000 של כדורי הצבע הפלואורסצנטי הסגול ותא המטרה (JeKo-1) בתמיסת העבודה של 1:5,000 של הצבע הפלואורסצנטי האדום הרחוק. השעו את התאים היטב בעזרת פיפטה ולריכוז תאים של 1 x 106 תאים/תמיסת צביעה.
- דגרו את התאים למשך 20 דקות בחממת CO2 לחה של 37 מעלות צלזיוס. צנטריפוגה של התאים ב-300 x גרם למשך 5 דקות, הסר סופרנטנט והשהה מחדש ב-15 מ"ל של מדיום RPMI-1640 שלם כדי לשטוף את התאים.
- חזור על הכביסה והצנטריפוגה בחום של 300 x גרם למשך 5 דקות. הסר את הסופרנטנט והשהה מחדש את כדורי תאי האפקטור ב-225 מיקרוליטר של RPMI-1640 מלא ואת כדורי תאי המטרה ב-450 מיקרוליטר של RPMI-1640 מלא.
- הוסף 30 מיקרוליטר של מדיום שיפוע למתלי תאי האפקטור ו-60 מיקרוליטר של אותו מדיום שיפוע למתלי תאי המטרה. השעו מחדש את תמיסת המלאי הבינוני של השיפוע היטב לפני הפיפטה.
- הוסף 15 μL של מלאי PI של 20 μg/mL למתלי תאי האפקטור ו-30 μL של מלאי PI למתלי תאי המטרה. ריכוז ה-PI הסופי יהיה בסופו של דבר 1 מיקרוגרם/מ"ל לאחר הוספת מצע Granzyme B (GzmB) למטה.
- הכן דילול של 1:10 של מצע GzmB ב-RPMI-1640 שלם והוסף 30 מיקרוליטר של דילול מצע GzmB זה לתרחיף תאי האפקטור ו-60 מיקרוליטר ממנו למתלי תאי המטרה. מערבבים היטב עם הפיפט.
הערה: הנפח הכולל של הריאגנטים שנוספו לכל כדורי תא אפקטור צריך להיות כעת 300 מיקרוליטר ולכדורי תא המטרה 600 מיקרוליטר. ריכוז מדיום השיפוע בתמיסות אלו צריך להיות 10%, ריכוז PI 1 מיקרוגרם/מ"ל וריכוז הסובסטרט GzmB 1:100. - תיוג חלופי באמצעות נוגדנים CD3, CD4 ו-CD8
הערה: במקרים מסוימים, זה עשוי להיות מעניין לתייג תאי אפקטור נוספים לפני אנקפסולציה משותפת עם תאי מטרה. כאן אנו מציגים הוכחה עקרונית לסוג זה של תיוג באמצעות נוגדנים CD3, CD4 ו-CD8 ו-PBMC (ראה איור 3).- העבירו 2.0 x 106 PBMC לצינור של 1.5 מ"ל וסובבו את התאים כלפי מטה למשך 5 דקות ב-300 x גרם. הסר את הסופרנטנט והשהה מחדש את גלולת התא ב-200 מיקרוליטר של dPBS עם 0.5% BSA. מחלקים את התוכן לשני צינורות של 2 מ"ל.
- הוסף 5 מיקרוליטר של אנטי-CD3-APC ו-5 מיקרוליטר של אנטי-CD4-StarBright Violet 760 לאחד הצינורות. הוסף 20 מיקרוליטר של אנטי-CD3-FITC ו-5 מיקרוליטר של אנטי-CD8-StarBright Violet 760 לצינור השני.
- מערבבים היטב ודוגרים במשך 30 דקות בטמפרטורת החדר בחושך. הוסף 1 מ"ל של מאגר כביסה לתאים, סובב ב-300 x גרם למשך 5 דקות, הסר את הסופרנטנט והשהה מחדש את כדורי התא ב-1 מ"ל של dPBS עם 0.5% BSA.
- סובבו את התאים ב-300 x גרם למשך 5 דקות, הסירו את הסופרנטנט והשעו מחדש את כדוריות התא ב-150 מיקרוליטר של RPMI ללא פנול אדום ו-10% מדיום שיפוע. עטוף כמתואר בשלב 2.2 באמצעות RPMI ללא פנול אדום, תמיסה מייצבת 33% לתאים ומדיום שיפוע 10% כמדיום החיצוני.
- עטיפת התאים
- מחממים מראש מחסנית אנקפסולציה ותמיסה מייצבת לטמפרטורת החדר לפני האנקפסולציה. הכן מלאי של מדיום חיצוני המורכב ממדיום RPMI-1640 שלם, תמיסת ייצוב 33% לתאים ומדיום שיפוע 10%.
- עבור כל דגימת אנקפסולציה, הכינו תמיסת דגימת תאים עם תאי אפקטור מטרה מעורבים. השעו מחדש את תמיסות התאים שהוכנו היטב עם פיפט וערבבו 65 מיקרוליטר של תרחיף תאי אפקטור מוכן עם 65 מיקרוליטר של תרחיף תאי מטרה מוכן בצינורות של 1.5 מ"ל (שניהם הוכנו בשלב 2.1).
- המשך מיד בטעינת הבארות המצוינות של מחסנית האנקפסולציה עם ריאגנטים בסדר הבא כדי להבטיח עטיפה תקינה. טען סט אחד של בארות עבור כל דגימת אנקפסולציה שהוכנה.
ובכן #A: 400 מיקרוליטר של מדיה חיצונית.
ובכן #D: 40 מיקרוליטר של מדיה חיצונית על המדף הקטן.
ובכן #C: 120 מיקרוליטר של תמיסה מעורבת מראש עם תאי מטרה (JeKo-1) ותאי אפקטור. השעו תאים היטב עם פיפטה ממש לפני הטעינה.
ובכן #B: 250 מיקרוליטר שמן.
הערה: ניתן לטעון כל מחסנית עם עד 8 דוגמאות לאנקפסולציה במקביל. - המשך מיד באיטום אטם וטעינת המחסנית במכשיר תוך הימנעות מהטיה, טלטול או חבטה במחסנית הטעונה. אטום בזהירות את האטם על המחסנית.
- העבר בזהירות את המחסנית למכשיר המיקרופלואידיקה והתחל את האנקפסולציה כמתואר במדריך למשתמש.
- לטיפות שנוצרו יש צפיפות גבוהה יותר מהמדיום החיצוני שמסביב והן ישקעו במהירות בתחתית באר האיסוף (באר #D). אסוף כל ייצור טיפות (כל הטיפות והמדיום החיצוני הסובב אותן) על ידי השעיית הטיפות המשקעות מבאר #D בתווך הכיסוי והעברתן לצינור DNA בעל קושרה נמוכה של 2 מ"ל עם מכסה. שטפו היטב #D עם המדיה החיצונית שנותרה מבאר #A כדי לאסוף את הטיפות הנותרות.
- כאשר הטיפות שקעו בצינורות האיסוף (זה לוקח בערך דקה), ודא את ייצור הטיפות על ידי בחינתן במיקרוסקופ שדה בהיר. לשם כך, מלאו קצה פיפטה של 10 מיקרוליטר בדגימה: כ. 1/3 עם טיפות מפני השטח של שלב הטיפה (שלב לבן) וכ. 2/3 עם המדיום החיצוני המכסה כדי להגיש את הקצה. טען מיד את הדגימה על שקופית זכוכית בת 8 תאים ובדוק את הטיפות על ידי מיקרוסקופ שדה בהיר בהגדלה של פי 4 ו-20x כדי לאשר טעינת טיפות בתאים.
הערה: חשוב שהטיפות בדרך זו יישאבו בנפח גדול יותר של המדיום שמסביב.
- דגירה
הערה: כעת ניתן לדגור את הטיפות ב-2 מ"ל של צינורות קשירה נמוכה של DNA בחממה סטנדרטית של 37 מעלות צלזיוס, 5% CO2. אנו ממליצים להשתמש בצינורות אלה, מכיוון שיש להם תכונות פני שטח אופטימליות לתרבית טיפות.- בעזרת מחט מזרק (23G), נקב בזהירות ובבטחה את המכסה של המספר הנדרש של 2 מ"ל צינורות DNA בעלי קשירה נמוכה. זה יבטיח דיפוזיה חופשית של CO2/O2 תוך מניעת אידוי מדיה.
- הוסף 1 מ"ל של מדיום חיצוני לכל צינור דגירה. יש לדגור את הטיפות בנפח של לפחות פי 5 של מדיה חיצונית כדי להבטיח חציצה נכונה. ניתן להגדיל את נפח המדיום החיצוני שנוסף בהתאם לחילוף החומרים של התאים המיושמים.
- השעו מחדש את הטיפות שנוצרו במדיית הכיסוי ופצלו כל ייצור לשלושה מצינורות הדגירה המוכנים (אחד לכל מדידת נקודת זמן). הטיפות כבדות ומשקעים במהירות, ולכן חשוב להשהות את המלאי בין כל העברה.
הערה: ניתן לשנות את מספר צינורות הדגירה שאליהם מפוצלים הפקות הטיפות, אך אנו ממליצים לפצל ייצור אחד ללא יותר מ-4 צינורות דגירה כדי להבטיח שכל דגימה מכילה מספיק אירועים לניתוח. - הנח את הצינורות זקופים בחממה למשך שעתיים, 4 שעות או 6 שעות דגירה לאחר יצירת טיפות.
3. ניתוח במורד הזרם של טיפות
- מיקרוסקופ
- לאחר הדגירה, העבירו מספר קטן של טיפות לשקופית מיקרוסקופ כמתואר בשלב 2.2.7 ונתחו אותן על ידי שדה בהיר ומיקרוסקופ פלואורסצנטי באמצעות מיקרוסקופ פלואורסצנטי סטנדרטי עם תצורת לייזר ומסנן מתאימה.
הערה: ניתן לזהות את הטיפות על ידי מיקרוסקופ שדה בהיר. ניתן לזהות את תאי ה-T המוכתמים בסגול באמצעות מסנן DAPI, תאי JeKo-1 המוכתמים באדום רחוק עם מסנן APC, אות GzmB-FAM עם מסנן FITC ואות PI עם מסנן PE. אות ה-PI בעל העניין הגבוה ביותר יכול להיות קשה להמחשה במיקרוסקופיה מכיוון שלתאים אפופטוטיים מוקדמים יש פליטת שיא נמוכה יותר מאשר לתאים אפופטוטיים מאוחרים. ראה איור 4 לנתונים מייצגים.
- לאחר הדגירה, העבירו מספר קטן של טיפות לשקופית מיקרוסקופ כמתואר בשלב 2.2.7 ונתחו אותן על ידי שדה בהיר ומיקרוסקופ פלואורסצנטי באמצעות מיקרוסקופ פלואורסצנטי סטנדרטי עם תצורת לייזר ומסנן מתאימה.
- ציטומטריית זרימה
- לאחר הדגירה, השעו מחדש כל דגימת טיפה במדיום הכיסוי והעבירו אותה לצינורות FACS של 5 מ"ל. נתח את הטיפות באמצעות ציטומטר זרימה סטנדרטי על ידי ביצוע ההנחיות הכלליות המפורטות להלן.
- השתמש בציטומטר זרימה עם תצורת לייזר ומסנן מתאימה. עם הפאנל שנבחר של כתמי תאים ובדיקה, אין צורך בפיצוי צבע על ציטומטר הזרימה המשמש כאן. אם מוחלים צבעים אחרים או שהתצורה של ציטומטר הזרימה המיושם שונה, ייתכן שיהיה צורך בפיצוי.
- השתמש ב-FSC-H כטריגר הסף כדי לא לכלול רעשי רקע מאירועי נפט קטנים.
- טיפות כבדות וישקעו בתחתית צינורות ה-FAKS. ודא שה-SIP מגיע לטיפות. יש להשעות את הטיפות בנפח של לפחות פי 5 מהמאגר החיצוני לטיפות לפני הרכישה.
- אירועי טיפות נרכשים במהירות גבוהה. רשום אותות גובה עוצמה (H) עבור FSC ו-SSC והפלואורופורים שנבדקו מכיוון שמדידות גובה עוצמה משמשות בעת ניתוח טיפות. התאם את הרווחים כדי שתהיה הפרדה נכונה בין אירועים חיוביים ושליליים.
הערה: השתמשנו בערוץ ה-FITC כדי למדוד את אות ה-GzmB, בערוץ הכחול של האוקיינוס השקט כדי לזהות את תאי ה-T המוכתמים בסגול, בערוץ ה-APC כדי לזהות את תאי JeKo-1 המוכתמים באדום ובערוץ PE כדי לזהות את אות ה-PI. - רשום מספיק אירועים לניתוח במורד הזרם. כאן, רשמנו 4.5 - 8.3 x 103 מהטיפות המקבילות לנקודת זמן.
- שטפו את ציטומטר הזרימה דרך ה-SIP לאחר כל סט של רכישת טיפות, באמצעות תמיסות ניקוי ושטיפה סטנדרטיות. נקה היטב את ציטומטר הזרימה בסוף הניסוי. ראה איור 4 ואיור 5 לנתונים מייצגים.
- לאחר הדגירה, השעו מחדש כל דגימת טיפה במדיום הכיסוי והעבירו אותה לצינורות FACS של 5 מ"ל. נתח את הטיפות באמצעות ציטומטר זרימה סטנדרטי על ידי ביצוע ההנחיות הכלליות המפורטות להלן.
- ניתוח נתונים
- חשב את אחוז תאי ה-T המפרישים GzmB בהתבסס על אחוז תאי T חיוביים ל-GzmB ואנקפסולציות של תאי JeKo-1 מנורמלים לכדאיות תאי T שנקבעה באוכלוסיות הטיפות של תאי T בלבד בנקודת הזמן המדוברת, כדלקמן:
טיפות T cell+ , Jeko-1+ , GzmB+ / (טיפות T cell+, Jeko-1+ - טיפות T cell+ , Jeko-1+)
כאשר טיפות מתות T cell+, Jeko-1+ מוערך ממוות בטיפות עם תאי T בלבד: טיפותמתות T cell+, Jeko-1+ = טיפותT cell+, Jeko-1+ x טיפות מתות T cell+, Jeko-1- / טיפותTcell+, Jeko-1-. - חשב את אחוז תאי ה-T שהרגו את תאי המטרה שלהם באופן הבא:
אחוז תאי T ציטוטוקסיים = (מוות נצפה - מוות רקע)/(100 - מוות רקע)
כאשר מוות רקע הוא המוות הקיים בתוך (תא T+, Jeko-1+) הנובע ממוות שאינו קשור להרג או מוות שהתרחש לפני האנקפסולציה. - העריכו את מוות הרקע ממוות תאים בטיפות (T cell+, Jeko-1-) וטיפות (T cell-, Jeko-1+):
תמותה ברקע = (1- (1- יחס תמותה בטיפותTcell-, Jeko-1+) x (1- יחס תמותה בטיפותT cell+, Jeko-1-)) x 100
כאשר יחס התמותה נמדד ישירות כ-% טיפות PI חיוביות בטיפות תאי T בלבד וטיפות JeKo-1-cell בלבד, בהתאמה. כל החישובים מבוצעים עם מספרים ספציפיים לזמן הדגימה.
- חשב את אחוז תאי ה-T המפרישים GzmB בהתבסס על אחוז תאי T חיוביים ל-GzmB ואנקפסולציות של תאי JeKo-1 מנורמלים לכדאיות תאי T שנקבעה באוכלוסיות הטיפות של תאי T בלבד בנקודת הזמן המדוברת, כדלקמן:
תוצאות
לאחר הטרנסדוקציה, תאי ה-T נותחו לביטוי CAR על ידי זרימה ציטומטרית באמצעות נוגדנים נגד CD3 ואנטי-NGFR. אוכלוסיית תאי ה-CAR T הועשרה לאחר מכן באמצעות חרוזים מגנטיים נגד NGFR, וכתוצאה מכך טוהר של יותר מ-98% עבור שני התורמים (איור 1A-B). יחס CD4/CD8 ופנוטיפ הזיכרון של תאי CAR ממוינים ששימשו כומתו גם הם, תוך שימוש באסטרטגיית שער סטנדרטית המשתמשת בנוגדנים CCR7 ו-CD45RA. הנתונים האלה מראים שיחס CD4/CD8 של תאי CAR T בשימוש היה 0.73, והתאים היו בעיקר של פנוטיפ זיכרון דמוי נאיבי (איור 1C-E).
תאי CAR T ותאי JeKo-1 נצבעו בצבעים סגולים ואדומים רחוקים, בהתאמה, ונכללו בטיפות DE50 יחד עם ריאגנטים לבדיקה מצע GzmB ו-PI (איור 2). לחלופין, ניתן לתייג תאי T CAR גם באמצעות נוגדנים כגון anti-CD4 או anti-CD8 (איור 3), מה שמאפשר אפיון מפורט יותר של תאי T. כל תרחיף תאי T (CAR T או NTD) עורבב עם תרחיף תאי JeKo-1 מיד לפני האנקפסולציה באפקטור: יחס תאי מטרה של 1:3 (0.5 x 106 תאי T ו-1.5 x 106 JeKo-1). לאחר האנקפסולציה, כל ייצור טיפות (תאי CAR T + JeKo-1 ו-NTD + JeKo-1) חולק לשלושה צינורות דגירה למשך 2 שעות, 4 שעות ו-6 שעות, בהתאמה. התאים הודגרו בתוך הטיפות בטמפרטורה של 37 מעלות צלזיוס ב-5% CO2 ולאחר מכן נותחו על ידי מיקרוסקופיה וזרימה ציטומטרית בנקודות הזמן שצוינו.
ביצענו מיקרוסקופיה פלואורסצנטית של טיפות אמולסיה כפולה אחרי 4 שעות של דגירה (איור 4). עוצמת האות הקרינה הירוק (FITC) ממחישה את רמת פעילות ה-GzmB המופרש של תאי CAR T או NTDs בתוך טיפות DE50. איור 4B מציג תמונות ניגודיות פאזה ומיקרוסקופיה פלואורסצנטית של טיפה אחת חיובית ל-GzmB המכילה תא CAR T ותא מטרה JeKo-1 במגע קרוב.
לאחר מכן, טיפות DE50 נותחו על ידי זרימה ציטומטרית כדי לכמת את אחוז תאי ה-CAR T עם הפרשת GzmB מוקדמת ופעילות הרג תאים ציטוטוקסית (איור 5). צביעה לפני הדגירה של תאי מטרה JeKo-1 עם צבע אדום רחוק ותאי T אפקטור עם צבע סגול לפני האנקפסולציה אפשרה זיהוי של שלוש אוכלוסיות טיפות נפרדות המכילות תאים כאשר התאים מופצים בטיפות על סמך התפלגות פואסון. אוכלוסיות הטיפות שזוהו הן טיפות עם תאי T בלבד, תאי JeKo-1 בלבד, ותאי T ותאי JeKo-1 יחד (איור 5A). טיפות שעוטפות תאי T עם תאי JeKo-1 היו מגודרות ונותחו לאיתור אותות המצביעים על פעילות GzmB (איור 5B) ומוות של תאים, כפי שמצוין על ידי PI (איור 5C).
האנקפסולציה של תאים בטיפות עוקבת אחר התפלגות פואסון, ומתקבלות ארבע אוכלוסיות טיפות שונות (איור 6A). איור 6B מראה את רמת הטיפות החיוביות ל-GzmB בכל אוכלוסיות הטיפות לאחר 6 שעות דגירה של טיפות שמהן ניתן לקבוע את אחוז תאי ה-T המפרישים GzmB באופן ספונטני. נתונים אלה מצביעים על הספציפיות הגבוהה של השיטה, שכן רק תאי T של CAR מפרישים GzmB.
לבסוף, כימתנו את רמות GzmB ו-PI על פני נקודות זמן, לאחר 2 שעות, 4 שעות ו-6 שעות של דגירה משותפת. לשם השוואה, הטיפות המכילות רק תאי T ורק תאי JeKo-1 נותחו כדי לבחון את מוות תאי הרקע בכל אוכלוסייה (איור 6C). מוות תאי הרקע שימש לקביעת אחוז תאי T חיים המפרישים GzmB והורגים תאי מטרה באוכלוסיית תאי האפקטור (איור 7), כמתואר בשלב 3.3. תאי CAR T משני תורמים הראו עלייה תלוית זמן הן בהפרשת GzmB המושרה על ידי תאי מטרה והן בפעילות הריגת התאים. כמעט 36% מתאי ה-CAR T החיים מתורם 1 ו-31% מתורם 2 הפרישו GzmB לאחר 6 שעות של אנקפסולציה משותפת עם תא המטרה, עלייה משמעותית בהשוואה לתאי T בקרה של NTD (איור 7A). בהתאמה, כ-21% מתאי ה-CAR T החיים של תורם 1 ו-22% מתאי ה-CAR החיים של תורם 2 הרגו תאי מטרה, כפי שמצוין על ידי אות PI חיובי (איור 7B). אחוז תאי ה-CAR T שהפרישו GzmB עלה על אחוז תאי המטרה שנהרגו בכל נקודת זמן, בהתאם לרצף האירועים הצפוי בציטוטוקסיות בתיווך GzmB. יחד, נתונים אלה מראים כי השיטה המוצגת כאן מאפשרת לאפיין את ההטרוגניות בציטוטוקסיות של תאי T בודדים בתוך אוכלוסיית תאים וכן השוואות בין אוכלוסיות שונות.
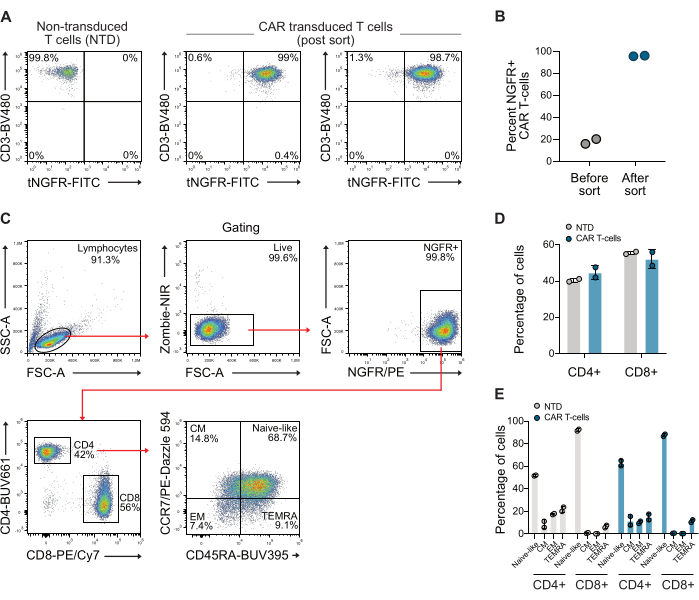
איור 1: תרשימי ציטומטריית זרימה מייצגת לאחר מיון NGFR. (A) אחרי כ-10 ימים של התרחבות, תאי CAR T מוינו באמצעות מיקרו-חרוזים ספציפיים ל-NGFR ומיון מגנטי, וכתוצאה מכך אוכלוסייה של תאי CAR T שהייתה >98% תאי CAR T. (B) כימות של תאי CAR T משני תורמים ששימשו במחקר הזה לפני ואחרי המיון. (C) אסטרטגיית שער המשמשת לבחינת יחס CD4/CD8 ופנוטיפ זיכרון של תאי T. (D) כימות CD4 ו-CD8 של תאי T בשימוש. (E) כימות פנוטיפ הזיכרון של תאי T בשימוש. קיצור: CM = זיכרון מרכזי, EM = זיכרון אפקטור, NTD = לא מתמר, TEMRA = תאי אפקטור מובחנים סופית. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
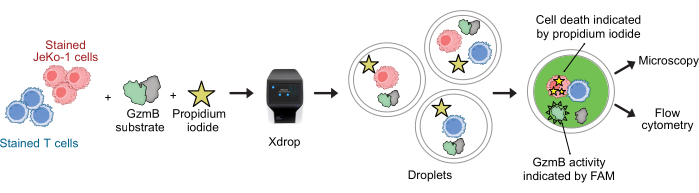
איור 2: זרימת עבודה עבור מבחן הפרשת GzmB וציטוטוקסיות משולבת עם רזולוציית תא בודד בטיפות. לפני האנקפסולציה בטיפות DE, תאי המטרה והאפקטור נצבעים בנפרד באמצעות כתמי תאים סגולים ואדומים רחוקים. באמצעות מכשיר המיקרופלואידיקה ומחסנית האנקפסולציה, תאי אפקטור עטופים יחד עם תאי מטרה בטיפות יחד עם מדיום התא, PI ומצע פפטיד GzmB המסומן על ידי FAM. הבדיקה והדגירה מתרחשות בתוך הטיפות. פעילות GzmB מופרשת מסומנת על ידי פליטת פלואורסצנציה ירוקה המתרחשת לאחר ש-GzmB מבקע את המצע. מוות תאים מסומן על ידי PI. לאחר הדגירה, טיפות DE50 מנותחות על ידי מיקרוסקופיה ו/או ציטומטריית זרימה. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
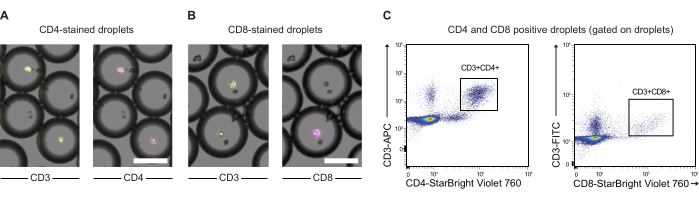
איור 3: ניתוח של PBMCs עטופים טיפות המסומנים מראש בנוגדנים anti-CD3, anti-CD4 ו-anti-CD8. (A) תמונות מיקרוסקופיה של טיפות עם PBMCs עטופים שסומנו מראש עם נוגדנים נגד CD3 (APC) ואנטי-CD4 (NIR). Scalebar = 100 מיקרומטר. (B) כ-(A), אך עם תיוג CD3 (FITC) ו-anti-CD8 (NIR) במקום. Scalebar = 100 מיקרומטר. (C) ניתוח ציטומטריית זרימה של אותן טיפות. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
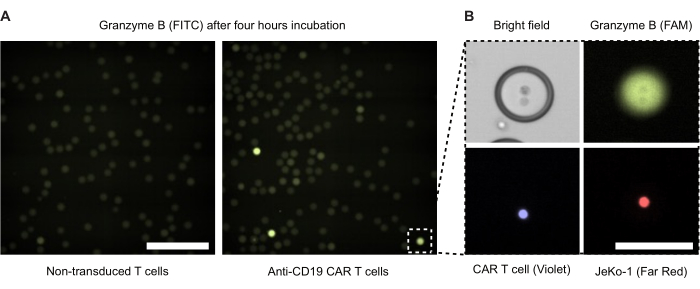
איור 4: תמונות מיקרוסקופ של טיפות עם תאי אפקטור ותאי מטרה. התמונות צולמו לאחר 4 שעות דגירה בחממת תאים לחה סטנדרטית של 37 מעלות צלזיוס, 5% CO2 . (A) טיפות מדגימה עם תאי NTD ו-JeKo-1 עטופים (משמאל) או תאי CAR T ותאי JeKo-1 (מימין) שצולמו על ידי מיקרוסקופיה פלואורסצנטית באמצעות ערוץ FITC כדי לזהות טיפות חיוביות (ירוקות) של GzmB. Scalebar = 500 מיקרומטר. (B) טיפה בודדת המצולמת על ידי ניגודיות פאזה, FITC (GzmB), APC (תא JeKo-1) ו-DAPI (תא CAR T). Scalebar = 100 מיקרומטר. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
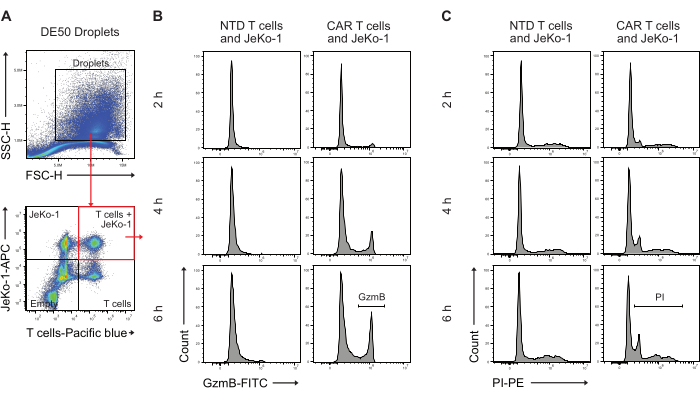
איור 5: אסטרטגיית שער לניתוח טיפות על ידי זרימה ציטומטרית לאחר הדגירה. (A) שער נעשה על ידי פיזור קדימה וצדדי כדי לזהות טיפות, ואחריו בחירת השער המכיל את הטיפות. האירועים מחוץ לשער מייצגים טיפות שמן המיוצרות כתוצר לוואי של ייצור טיפות אמולסיה כפולה. ניתוח פלואורסצנטי עוקב של טיפות בתעלות המתאימות לכתמי התאים המיושמים מזהה ארבע אוכלוסיות טיפות: טיפות המכילות גם תאי T וגם תאי JeKo-1 (ריבוע אדום); טיפות עם תאי JeKo-1 בלבד; טיפות עם תאי T בלבד; וטיפות ריקות. (B) היסטוגרמות מייצגות עבור אות GzmB בטיפות חיוביות כפולות על פני נקודות זמן ובין תאי NTD ו-CAR T. (C) היסטוגרמות מייצגות עבור אות PI בטיפות חיוביות כפולות על פני נקודות זמן ובין תאי T NTD ו-CAR. כל מדידות הטיפות מבוצעות כמדידות גובה עוצמה (H). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
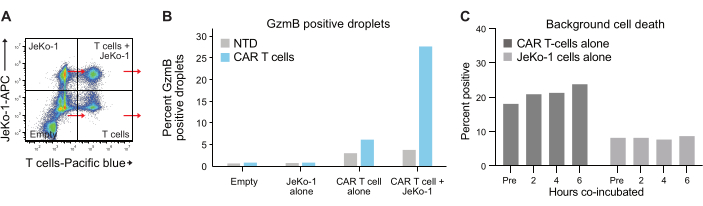
איור 6: אוכלוסיות בקרה פנימית ואוכלוסיות ייחוס. (A) כל אחד מארבעת הרבעים מאיור 5A נבחר, ו-GzmB ו-PI נמדדו בכל אחד מהם. סוג זה של כימות מאפשר למדוד ולהחסיר אותות רקע לפני ביצוע ניתוח סופי של יעילות תאי T. (B) גרף שמראה את תדירות הטיפות החיוביות של GzmB אחרי 6 שעות דגירה עבור כל אחת מארבע אוכלוסיות הטיפות, שמודגם על ידי נתונים מדגימת תורם 1 CAR T. (C) מוות תאי רקע נקבע באוכלוסיות טיפות ביקורת של JeKo-1 בלבד ותאי T בלבד בכל נקודת זמן שנמדדה, עם נתונים מתורם 1. מוות תאי הרקע משמש לחישוב התדירות של תאי אפקטור חיים המפרישים GzmB והורגים תאים המוצגים באיור 7 ומוסברים בשלב 3.3. קיצורים: Pre = אנקפסולציה. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
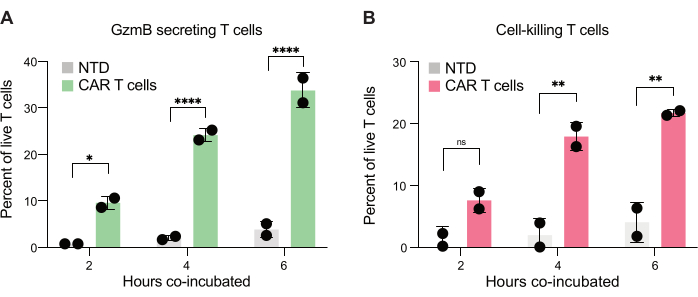
איור 7: כימות של תאי T המסוגלים להפריש GzmB ולהרוג תאי JeKo-1 בטיפות חיוביות כפולות. טיפות חיוביות כפולות מגודרות משני תורמים נבדקו לאחר דגירה משותפת של 2 שעות, 4 שעות ו-6 שעות בטיפות. (A) תדירות תאי T המפרישים GzmB בתאי מטרה והשוואה בין תאי NTD T לתאי T CAR. (B) תדירות תאי T שנתקלים בתאי מטרה שהורגים את תא המטרה המשותף. קיצורים: GzmB = גרנזים B, NTD = לא מתמר, PI = פרופידיום יודיד. * = ערך P < 0.05, ** = ערך P < 0.005, **** = ערך P < 0.0001 על ידי ANOVA דו-כיווני. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
Discussion
כאן אנו מציגים שיטה לבחינת הפוטנציאל הציטוטוקסי של תאי T ברמת התא הבודד באמצעות מכשיר מיקרו-נוזלים זמין מסחרי קל לשימוש כדי להעריך את הפוטנציאל הציטוטוקסי של תאי CD19-CD28-CD3z CAR T בעת אנקפסולציה משותפת עם קו תאי הלימפומה של תאי המעטפת החיוביים ל-CD19 JeKo-1.
ישנם מספר שלבים קריטיים בפרוטוקול זה. ראשית, אנו ממליצים להסיר חרוזי גירוי מתאי T לפחות 48 שעות לפני ביצוע בדיקות כלשהן, כדי למנוע תוצאות חיוביות כוזבות. שנית, יעילות התמרה של תאי T עם מבנים כגון CARs או קולטני תאי T יכולה להשתנות במידה ניכרת. ללא שלב טיהור עוקב של תאי ה-T המומרים, התוצאות עשויות להיות מאתגרות לפירוש. כאן נעשה שימוש באוכלוסייה טהורה של תאי CAR T ולכן ניתן לצפות לרמה גבוהה של ודאות כאשר מאפיינים תאי CAR T כרוצחים או לא רוצחים בכל נקודת זמן. לחלופין, ניתן ליישם תיוג CARs עם חלבון פלואורסצנטי או תג גנטי כדי לציין תאים חיוביים ל-CAR ולאחר מכן מגודרים עליהם בעת ניתוח טיפות. אם נעשה שימוש בתיוג, המולקולות הפלואורסצנטיות שנבחרו לא אמורות להפריע לפליטות הפלואורסצנטיות מכל אחד מהפלואורופורים האחרים של הבדיקה. לדוגמה, שימוש בתיוג GFP יפריע למצע GzmB המסומן ב-FAM המיושם בניסויים שבוצעו כאן ולכן אינו מומלץ.
יתרון מרכזי של הפרוטוקול המתואר כאן הוא שיצירת הטיפות עצמה היא פשוטה ואוטומטית. עם זאת, על מנת להבטיח אנקפסולציה של תא בודד, חשוב שהתאים ישעו מחדש ביסודיות לפני טעינת המחסנית. מסיבה זו, מומלץ לעבוד בקצב הוגן כאשר מתכוננים להעמסת המחסנית. שיקול דומה חל בעת הוספת מצע GzmB, מכיוון שחלק מהתאים מפרישים גבוה של GzmB. השעיה מחדש של תאים תמנע גם סתימה של תעלות מיקרופלואידיות קטנות של מחסניות. אנקפסולציה נכונה של תאים נבדקת בקלות על ידי מיקרוסקופיה, כמתואר לעיל.
מכיוון שהטיפה עוטפת את מדיום התא ושומרת על תוצרים תאיים המופרשים מהתאים, ניתן לנתח ציטוקינים, נוגדנים ותרכובות אחרות. ואכן, בדקנו מולקולות רלוונטיות אחרות המופרשות על ידי תאים חיסוניים, כגון IFN-γ ו-TNF-α, הדורשות שינויים בפרוטוקול הנוכחי. לזיהוי ציטוקינים, ניתן ליישם סוג שונה של פורמט בדיקה מזה שאנו משתמשים בו כאן עבור GzmB, כגון יצירת כריך ELISA על פני תא האפקטור32. בנוסף, ניתן לשנות כתמי תאים וצבעי בדיקה, למשל, קרבוקסיפלואורסצאין סוקסינימידיל אסטר (CFSE), אך חשוב להבטיח דימום מינימלי או ללא דימום על פני שילובי צבעים שונים, כפי שנעשה בציטומטריית זרימה סטנדרטית.
יתר על כן, פרוטוקול זה אינו מוגבל לניתוח תאי CAR T. ניתן גם להרחיב אותו לחקר אינטראקציות אחרות בין תאי T למטרה או תאים חיסוניים אחרים כגון תאי CAR NK. ניתן גם לדמיין ניסויים מתקדמים יותר, למשל תיוג תת-קבוצות של תאי T CD4 ו-CD8 עם פלואורופורים נוספים כדי לבצע אימונופנוטיפ תפקודי רחב יותר. ואכן, כאן אנו מראים כי ניתן לזהות CD4 ו- CD8 בטיפות, ובכך לאפשר אפיון נוסף של תאי ה- T האפקטורים ויכולתם הציטוטוקסית.
אופטימיזציה של פרוטוקול זה, כיוונו במיוחד שהוא יעבוד על מכשירי זרימה ציטומטריים סטנדרטיים. בעוד שציטומטריית זרימת טיפות אינה מסובכת, שמנו לב שהצטברות שמן עלולה להתרחש אם ציטומטר הזרימה אינו נשטף כראוי במרווחי זמן מסוימים או כפי שהומלץ כאן לאחר ניתוח הדגימות בכל מרווח זמן. פרוטוקול השטיפה הטוב ביותר עשוי להיות ספציפי לכל ציטומטר זרימה בודד.
אחד היתרונות המשמעותיים של שיטה זו הוא יכולת התפוקה הגבוהה שלה, המאפשרת ניטור של ציטוטוקסיות בתיווך אפקטור של תא בודד כנגד תאי מטרה ללא צורך במומחיות נרחבת או בציוד מיוחד ביותר. ניתן לבצע את הבדיקה בקלות באמצעות כלים קיימים, כגון ציטומטריית זרימה או מיקרוסקופיה. טיפות תחליב כפולות ניתנות גם למיון באמצעות ממייני תאים30,31, שעשויים לאפשר בידוד של תאים בעלי פונקציות ספציפיות, למשל, תאי CAR T עם ובלי פוטנציאל ציטוטוקסי, ואחריו ניתוח טרנסקריפטום של תא בודד.
הטכנולוגיה אינה חפה ממגבלות. בעוד שקווי תאים מסוימים יסבלו תרבית בטיפות במשך 24 שעות ויותר, לתאים ראשוניים עשויה להיות כדאיות נמוכה משמעותית לאחר 24 שעות. זה מייצג אילוץ זמן על הבדיקות באופן כללי, אך עבור הבדיקה הנוכחית, ניתן לראות GzmB ניכר ופעילות הרג תאים תוך 4-6 שעות, ככל הנראה מכיוון שתא הטיפות הקטן מבטיח מפגש מהיר של האפקטור ותאי המטרה. כמו כן, נפח הטיפות הקטן יבטיח הצטברות מהירה בריכוז לרמות הניתנות לזיהוי של המצע המופרש GzmB. מגבלה נוספת של הטכנולוגיה היא חוסר היכולת לזהות הרג סדרתי על ידי תאי אפקטור בעת שימוש בציטומטרים זרימה סטנדרטיים. עם זאת, זה יכול להיות בר השגה עם ציטומטרים של זרימת תמונה או טכנולוגיות ציטומטריית תמונה, שיהיה צורך לחקור.
ההעברה המאמצת של תאי CD19 CAR T הראתה הצלחה יוצאת דופן בטיפול בחולים עם ממאירויות המטולוגיות. למרות זאת, קיימת שונות גדולה של תגובה ורעילות בלתי צפויה בחולים32, שעשויה לנבוע בחלקה מההטרוגניות בתוך מוצר העירוי CAR T. כתוצאה מכך, יש עניין גובר בניתוח ההרכב הפנוטיפי והיכולת הציטוטוקסית של תאי CAR T בודדים בתוך אוכלוסייה. זה יהיה חשוב במיוחד מכיוון שטיפול ב-CAR נבדק יותר ויותר במצבים אוטואימוניים ובצורות אחרות של סרטן. מכשיר המיקרופלואידיקה והפרוטוקול המתוארים כאן מציעים גישה חזקה ורב-תכליתית לבחינת ההטרוגניות של תאי CAR T וטיפולים אחרים מבוססי תאים.
Disclosures
המחברים מצהירים על ניגודי האינטרסים הבאים: MBB קיבלה תעודות ייעוץ מ-Janssen, Roche ו-Kite/Gilead, שאינן קשורות לעבודה הנוכחית. D.L.P. ו-P.M. הם עובדי Samplix.
Acknowledgements
המחברים מבקשים להודות לחברים ולעובדים של CITCO ו-Samplix על דיונים והצעות מועילות. MBB נתמך על ידי מלגת מדענים קליניים בתחילת הקריירה מקרן לונדבק (R381-2021-1278). עבודה זו נתמכת באמצעות מענק מחקר עילית מבית החולים האוניברסיטאי אודנסה. יתר על כן, מחקר זה נתמך על ידי מענק מפרויקט מועצת החדשנות האירופית 190144395 ל-Samplix ApS.
Materials
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| Blocker BSA (BSA) | Thermo Scientific | 37525 | |
| CellTrace Far Red Cell Proliferation Kit (far red fluorescent dye) | Invitrogen | C34564 | |
| CellTrace Violet Cell Proliferation Kit (violet fluorescent dye) | Invitrogen | C34557 | |
| DE Stabilizing Solution (stabilizing solution) | Samplix | REDIVSTABSOL1500 | |
| DPBS (dPBS) | Gibco | 14190-094 | |
| Dulbecco’s PBS (dPBS) | Capricorn Scientific | PBS-1A | |
| Dynabeads Human T-Activator (CD3/CD28 activation beads) | Gibco | 11132D | |
| Fetal Bovine Serum (FBS) | Capricorn Scientific | FBS-HI-12A | |
| Lenti-X Concentrator (PEG-based reagent) | Takara Bio | 631232 | |
| MACSelect LNGFR Microbeads (anti-NGFR magnetic beads) | Miltenyi Biotec | 130-091-330 | |
| OptiPrep density gradient medium (gradient medium) | Stemcell | 7820 | |
| Penicillin-Streptomycin (P/S) | Capricorn Scientific | PS-B | |
| Propidium iodide (PI) | Invitrogen | BMS500PI | |
| Recombinant Human IL-2 (IL-2) | Peprotech | 200-02 | |
| RPMI-1640 with Stable Glutamine (RPMI-1640) | Capricorn Scientific | RPMI-STA | |
| RPMI-1640 without L-Glutamine and phenol red | Gibco | 32404-014 | |
| Xdrop DE oil I (oil) | Samplix | REOILDEC1900 | |
| Xdrop Granzyme B substrate (GzmB substrate) | Samplix | REGRB100 | |
| Zombie-NIR viability dye (viability dye) | BioLegend | 423106 | |
| Plasticware etc. | |||
| 8-chamber glass slide | Chemometec | 942-0003 | |
| Cell culture plate, 12 well | TH Geyer | 7696791 | |
| DNA LoBind tube, 2 mL (DNA tube) | Eppendorf | 30108078 | |
| Eppendorf tube, 1.5 mL (1.5 mL tube) | Eppendorf | 30108051 | |
| Falcon tube, 15 mL (15 mL tube) | TPP | 91015 | |
| Falcon tube, 5 mL (5 mL tube) | Falcon (VWR) | 734-0443 | |
| Green cell suspension flasks for cell incubations (T75 flask) | Sarstedt | 148.19.22 | |
| Green cell suspension plates for cell incubations (96 well plate) | Sarstedt | 148.32.20 | |
| LS Separation Columns (separation column) | Miltenyi Biotec | 130-042-401 | |
| Xdrop DE Gaskets (gaskets) | Samplix | #GADEA100 | |
| Xdrop DE50 Cartridge (encapsulation cartridge) | Samplix | #CADE50A100 | |
| Antibodies | |||
| anti-CCR7 PE-Dazzle 594 | BioLegend | 353236 | |
| anti-CD19 CAR FMC63 Idiotype Antibody, PE | Miltenyi Biotec | 130-127-342 | |
| anti-CD3 APC | Biolegend | 300439 | |
| anti-CD3 BV480 | BD Biosciences | 566105 | |
| anti-CD3 FITC | BD Biosciences | 345763 | |
| anti-CD4 BUV661 | BD Biosciences | 612962 | |
| anti-CD4 StarBright Violet 760 | Bio-Rad | MCA1267SBV760T | |
| anti-CD45RA BUV395 | BD Biosciences | 740298 | |
| anti-CD8 PE-Cy7 | BioLegend | 344712 | |
| anti-CD8 StarBright Violet | Bio-Rad | MCA1226SBV760 | |
| anti-NGFR FITC | BioLegend | 345106 | |
| anti-NGFR PE | BioLegend | 345106 | |
| Cells | |||
| JeKo-1 Mantle-cell lymphoma cell-line (JeKo-1) | ATCC | CRL-3006 | |
| Primary peripheral blood mononuclear cells (PBMCs) | |||
| Equipment | |||
| Countess 3 Automated Cell Counter | Thermo Fisher Scientific | A50298 | |
| DynaMag-2 Magnet | Invitrogen | 12321D | |
| NovoCyte Quanteon Flow Cytometer (flow cytometer) | Agilent | 2010011AA | |
| Xdrop (microfluidics device) | Samplix | IN00110-EU |
References
- Pasqui, D. M., Latorraca, C. D. O. C., Pacheco, R. L., Riera, R. CAR-T cell therapy for patients with hematological malignancies. A systematic review. Eur J Haematol. 109 (6), 601-618 (2022).
- Krejcik, J., et al. Harnessing the immune system to fight multiple myeloma. Cancers. 13 (18), 4546 (2021).
- Tokarew, N., Ogonek, J., Endres, S., von Bergwelt-Baildon, M., Kobold, S. Teaching an old dog new tricks: next-generation CAR T cells. British J Cancer. 120 (1), 26-37 (2019).
- Bogetofte Barnkob, M., Vitting-Seerup, K., Rønn Olsen, L. Target isoforms are an overlooked challenge and opportunity in chimeric antigen receptor cell therapy. Immunother Adv. 2 (1), ltac009 (2022).
- Daei Sorkhabi, A., et al. The current landscape of CAR T-cell therapy for solid tumors: Mechanisms, research progress, challenges, and counterstrategies. Front Immunol. 14, 1113882 (2023).
- . Considerations for the Development of Chimeric Antigen Receptor (CAR) T Cell Products Available from: https://www.fda.gov/regulatory-information/search-fda-guidance-documents/considerations-development-chimeric-antigen-receptor-car-t-cell-products (2024)
- Roddie, C., O'Reilly, M., Dias Alves Pinto, J., Vispute, K., Lowdell, M. Manufacturing chimeric antigen receptor T cells: issues and challenges. Cytotherapy. 21 (3), 327-340 (2019).
- Wang, L., et al. Improvement of in vitro potency assays by a resting step for clinical-grade chimeric antigen receptor engineered T cells. Cytotherapy. 21 (5), 566-578 (2019).
- Burrows, S. R., Fernan, A., Argaet, V., Suhrbier, A. Bystander apoptosis induced by CD8+ cytotoxic T cell (CTL) clones: implications for CTL lytic mechanisms. Int Immunol. 5 (9), 1049-1058 (1993).
- Gattinoni, L., et al. Acquisition of full effector function in vitro paradoxically impairs the in vivo antitumor efficacy of adoptively transferred CD8+ T cells. J Clin Invest. 115 (6), 1616-1626 (2005).
- Chen, G. M., et al. Integrative bulk and single-cell profiling of premanufacture T-cell populations reveals factors mediating long-term persistence of CAR T-cell therapy. Cancer Dis. 11 (9), 2186-2199 (2021).
- Frazer, G. L., Gawden-Bone, C. M., Dieckmann, N. M. G., Asano, Y., Griffiths, G. M. Signal strength controls the rate of polarization within CTLs during killing. J Cell Biol. 220 (10), e202104093 (2021).
- Hermans, I. F., et al. The VITAL assay: a versatile fluorometric technique for assessing CTL- and NKT-mediated cytotoxicity against multiple targets in vitro and in vivo. J Immunol Meth. 285 (1), 25-40 (2004).
- Zaritskaya, L., Shurin, M. R., Sayers, T. J., Malyguine, A. M. New flow cytometric assays for monitoring cell-mediated cytotoxicity. Expert Rev Vaccines. 9 (6), 601-616 (2010).
- Piccinini, C., et al. In vitro CAR-T cell killing: validation of the potency assay. Cancer Immunol Immunother CII. 73 (9), 168 (2024).
- Martinez, E. M., et al. High-throughput flow cytometric method for the simultaneous measurement of CAR-T cell characterization and cytotoxicity against solid tumor cell lines. SLAS Disc Adv Life Sci. 23 (7), 603-612 (2018).
- Jedema, I., van der Werff, N. M., Barge, R. M. Y., Willemze, R., Falkenburg, J. H. F. New CFSE-based assay to determine susceptibility to lysis by cytotoxic T cells of leukemic precursor cells within a heterogeneous target cell population. Blood. 103 (7), 2677-2682 (2004).
- Liu, L., et al. Cellular and molecular imaging of CAR-T cell-based immunotherapy. Adv Drug Delivery Rev. 203, 115135 (2023).
- Liadi, I., et al. Defining potency of CAR+ T cells: Fast and furious or slow and steady. Oncoimmunology. 8 (10), e1051298 (2019).
- Xhangolli, I., et al. Single-cell analysis of CAR-T cell activation reveals a mixed TH1/TH2 response independent of differentiation. Genom Proteom Bioinfo. 17 (2), 129-139 (2019).
- Zhou, Y., et al. Evaluation of single-cell cytokine secretion and cell-cell interactions with a hierarchical loading microwell chip. Cell Rep. 31 (4), 107574 (2020).
- LaBelle, C. A., Zhang, R. J., Hunsucker, S. A., Armistead, P. M., Allbritton, N. L. Microraft arrays for serial-killer CD19 chimeric antigen receptor T cells and single cell isolation. Cytometry J Int Soc Anal Cytol. 103 (3), 208-220 (2023).
- Hellmann, M. J., et al. Heterogeneously deacetylated chitosans possess an unexpected regular pattern favoring acetylation at every third position. Nat Comm. 15 (1), 6695 (2024).
- Wong, K. U., et al. Assessment of chimeric antigen receptor T cytotoxicity by droplet microfluidics in vitro. Antibody Therapeut. 5 (2), 85-99 (2022).
- Antona, S., Platzman, I., Spatz, J. P. Droplet-based cytotoxicity assay: Implementation of time-efficient screening of antitumor activity of natural killer cells. ACS omega. 5 (38), 24674-24683 (2020).
- Subedi, N., et al. An automated real-time microfluidic platform to probe single NK cell heterogeneity and cytotoxicity on-chip. Sci Rep. 11 (1), 17084 (2021).
- Zhang, Y., et al. Enhanced CRISPR/Cas12a-based quantitative detection of nucleic acids using double emulsion droplets. Biosens Bioelect. 257, 116339 (2024).
- Kochenderfer, J. N., et al. Construction and preclinical evaluation of an anti-CD19 chimeric antigen receptor. J Immunother. 32 (7), 689-702 (2009).
- Michaels, Y. S., et al. Precise tuning of gene expression levels in mammalian cells. Nat Comm. 10 (1), 818 (2019).
- Yuan, Y., et al. Droplet encapsulation improves accuracy of immune cell cytokine capture assays. Lab on a Chip. 20 (8), 1513-1520 (2020).
- Brower, K. K., et al. Double emulsion flow cytometry with high-throughput single droplet isolation and nucleic acid recovery. Lab on a Chip. 20 (12), 2062-2074 (2020).
- Kirouac, D. C., et al. Deconvolution of clinical variance in CAR-T cell pharmacology and response. Nat Biotechnol. 41 (11), 1606-1617 (2023).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved