Method Article
단일 세포 수준에서 키메라 항원 수용체 T 세포를 평가하기 위한 액적 기반 세포 독성 분석
요약
여기에서는 단일 세포 수준에서 세포 사멸을 조사하기 위해 하나의 T 세포와 암 표적 세포를 캡슐화하는 이중 에멀젼 방울을 만드는 방법을 설명합니다. 이 방법은 많은 T 세포 집단 내에서 세포독성 분자와 표적 세포 사멸을 모두 이중 정량화할 수 있습니다.
초록
키메라 항원 수용체(CAR) T 세포 치료제와 같은 T 세포 기반 치료법의 세포독성 잠재력 평가는 효능을 평가하는 데 중요한 역할을 하며 임상 적용의 전제 조건입니다. 그러나 기존의 세포독성 분석은 벌크 분석으로 수행되며 CAR T 세포 집단의 기능적 이질성에 대한 자세한 정보를 제공하지 않습니다. 이 연구에서는 단일 이펙터 CAR T 세포와 단일 표적 세포의 대규모 공동 캡슐화를 허용하는 동시에 T 세포의 세포독성 이펙터 분자와 표적 세포의 세포 사멸을 모두 이중 정량화할 수 있는 이중 에멀젼 액적 기반 방법에 대해 설명합니다. 이 프로토콜은 CD19 특이적 CAR T 세포의 생성 및 정제 방법을 개략적으로 설명하고, CD19+ 세포주 JeKo-1과 함께 액적에서 공동 캡슐화하는 방법과 함께 세포독성 효과기 분자 분비(Granzyme B) 및 세포 사멸(프로피듐 요오드화물, PI 사용)을 시각화하는 시약을 제공합니다. 이중 에멀젼 액적을 생성하기 위해 상업적으로 이용 가능한 미세유체 장치를 사용하여 단일 CAR T 및 표적 세포를 포함하는 액적을 생성하는 방법을 시연합니다. 또한 표준 유세포 분석 장비를 사용하여 액적에서 CAR T 세포의 기능적 다양성을 분석하는 방법에 대한 예를 제공합니다. 마지막으로, CD19 특이적 CAR T세포 사멸의 시간적 동역학과 이질성을 간략하게 설명합니다. 이 방법은 CAR T 세포 공격 후 세포 사멸에 초점을 맞추고 있지만 다른 유형의 T 세포, 세포 독성 면역 세포 및 사이토카인 분비와 같은 효과기 세포 기능을 검사하는 데에도 적용할 수 있습니다.
서문
키메라 항원 수용체(CAR) T 세포 치료제는 다양한 형태의 백혈병, 림프종1 및 다발성 골수종2에 대해 효과적인 것으로 입증된 세포 암 면역 요법의 빠르게 확장되고 있는 분야입니다. CAR T 세포는 B 세포, 형질 세포 및 그 악성 세포에서 발현되는 CD19 또는 B 세포 성숙 항원(BCMA)과 같은 표면 단백질에 선택적으로 결합할 수 있는 합성 항원 수용체로 T 세포를 변형하여 생성됩니다. 최근 CAR 설계의 발전으로 여러 항원을 동시에 표적화할 수 있게 되었습니다3, 여러 입력 신호에 의존하거나 특정 단백질 동형과 같은 종양 관련 항원에만 독점적으로 결합할 수 있습니다4. 또한, 현재 여러 CAR이 비혈액암(non-hematological cancers)의 표적에 대해 시험되고 있다5.
세포독성 분석법은 임상 제품이 출시되기 전에 CAR 개발과 품질 관리 모두에 필수적입니다 6,7,8. 그러나 대부분의 최신 분석은 암 세포주에 과도하게 첨가된 effector CAR T 세포의 벌크 집단에 의존하고 있으며, 이는 방관자 효과(bystander effect)9로 인해 위양성 결과를 초래할 수 있으며, in vitro 결과와 in vivo 결과10 간의 상관관계가 좋지 않을 수 있습니다. T 세포 증식과 장기 지속성은 초기 활성화 이벤트11,12 동안 수신된 신호에 의존하기 때문에 단일 세포 수준에서 세포독성 이벤트를 면밀히 조사하는 것이 매우 중요합니다.
벌크 방법론의 한계를 해결하기 위해 유세포 분석 13,14,15,16,17 및 이미징 기반 분석18을 사용하여 단일 세포 수준에서 세포 독성 연구를 수행할 수 있습니다. 그러나 표준 유세포 분석법은 효과기와 표적 세포 모두를 정량화하고 특성화하기 위한 단일 세포 분해능을 제공하지만, 표적 세포에 대한 개별 CAR T 세포의 특정 세포독성 능력을 직접 결정할 수는 없습니다. 또한 각각의 표적과 대량으로 상호 작용하는 개별 CAR T 세포를 이미징하는 것은 세포의 일관된 운동성으로 인해 까다롭고 시간이 많이 걸립니다. 이러한 문제를 해결하기 위해 마이크로웰 어레이 19,20,21, 마이크로래프트 어레이22, 마이크로칩23 및 액적 미세유체역학 24,25,26을 사용하여 공간적으로 제한된 공간에서 이펙터와 표적 세포를 페어링하는 단일 세포 분석을 위한 새로운 도구가 개발되었습니다. 이러한 도구는 향상된 측정 감도를 제공하여 감소된 시약 부피로 더 적은 수의 세포를 조사할 수 있습니다. 그러나 효율적인 세포 쌍, 분석할 수 있는 샘플의 제한된 수, 이미징 기반 분석에만 대한 의존, 추가 분석을 위해 생존 가능한 세포 집단을 검색하는 어려움 등 몇 가지 과제가 남아 있습니다.
여기에서 우리는 액적 기반 미세유체역학에 대한 대대적으로 단순화된 접근 방식을 허용하는 상업적으로 이용 가능한 미세유체역학 장치를 사용합니다. 이 장치를 사용하면 매우 안정적인 이중 에멀젼(DE) 액적을 사용하여 고급 단일 세포 분석 및 분석을 수행할 수 있습니다. 마이크로웰 및 기존 액적 미세유체 분석법과 비교했을 때, 여기에 요약된 프로토콜은 광범위한 미세유체 전문 지식을 필요로 하지 않습니다.
DE 액적은 수용액에 매달려 있는 수성 코어가 있는 오일 쉘로 구성된 작은 구형 구획입니다. 수성 액적에는 세포, 세포 분비체, 세포 배지 및 분석 시약이 포함되어 있고 유지되므로 각 구획 내에서 복잡한 분석을 수행할 수 있습니다. microfluidics 장치를 사용하여, DE 작은 물방울은 포유류 단 하나 세포 또는 세포 상호 작용 분석실험을 위해 적당한 세트 양 (대략 100 pL)로 microfluidics에 있는 전문 지식 없이 일반적인 실험실 사용자에 의해 아주 높은 수 (표본 당 대략 750,000의 작은 물방울) 그리고 짧은 시간 프레임 (8개의 표본을 위한 대략 10 분)에서 생성될 수 있습니다. 생성된 액적은 세포 배지에 부유할 수 있으며, 따라서 O2 및 CO2 의 트랜스 쉘 확산과 내부의 완충을 허용하는 동시에 친수성 및 세포 분비 효과기 분자와 같은 더 큰 분자를 유지할 수 있습니다. 따라서 검사된 세포는 적절하게 완충되어 시간이 지남에 따라 세포-세포 상호 작용 및 시간 역학을 검사할 수 있습니다. 단일 에멀젼 액적(예: 유류 내 물 액적)27과 대조적으로, DE 액적은 표준 cell incubator에서 융합하거나 병합되지 않는 견고한 구조입니다. 안정성과 수성 외부 상으로 인해 기존 유세포 분석과 같은 다운스트림 분석 절차와도 호환됩니다. 따라서 미세유체 장치에서 생성된 이러한 피코리터 방울은 기존 벌크 분석에 숨겨진 기능적 이질성을 규명하기 위해 세포 기능에 대한 고처리량 단일 세포 분석에 사용할 수 있습니다.
여기에서는 DE 방울을 활용하여 림프종 세포에 대한 CD19 특이적 CAR의 세포독성 가능성을 조사하는 프로토콜에 대해 간략하게 설명합니다. 당사의 프로토콜은 표적 사멸 및 그란자임 B(GzmB) 분비에 대한 단일 세포 분석을 가능하게 하며, 여기에서 조사된 CAR T 세포의 약 20%가 즉각적인 사멸 잠재력을 가지고 있음을 밝혔습니다.
프로토콜
본 연구에 사용된 CAR T세포는 인증된 생물안전성 GMO 클래스 2 실험실에서 CD19scFv-CD28-CD3ζ-tNGFR CAR 구조체로 일차 T세포의 렌티바이러스 형질도입에 의해 생성되었으며 연구소 표준에 따라 4일 후 기밀 해제되었습니다. 정제된 T 세포는 익명의 헌혈에서 버려진 잉여 물질에서 추출한 것으로, 덴마크 법에 따라 추가적인 윤리적 승인이 면제되었습니다.
1. CAR T 세포의 생성
참고: 아래에 사용된 시약의 이름은 일반 및 약어 이름을 사용합니다. 전체 상업명은 Table of Materials의 괄호 안에 있습니다.
- T세포 활성화, 형질도입 및 증식
참고: CD19 CAR T 세포의 안정적인 발현은 음성 선택 T 세포 분리 키트를 사용하여 신선한 말초 혈액 단핵 세포(PBMC)에서 분리된 1차 인간 T 세포의 렌티바이러스 형질도입을 통해 달성되었습니다. 사용된 항-CD19 CAR은 FMC63 단쇄 가변 단편(scFv), CD28 힌지 및 막관통 도메인, CD28 공동 자극 도메인, CD3ζ 활성화 도메인28 및 CAR 발현 세포의 모니터링 및 농축을 위한 신경 성장 인자 수용체(tNGFR)의 잘린 버전으로 구성된 2세대 구축물입니다29. 전달 벡터 플라스미드는 de novo를 합성하고, 이를 pMDLg/pRRE (Addgene plasmid #12251), pRSV-Rev (Addgene plasmid #12253) 및 pMD2.G (Addgene plasmid #12259)와 결합하여 3세대 렌티바이러스를 만들었습니다30. 나중에 3개의 플라스미드는 디디에 트로노(Didier Trono)의 선물이었습니다. 미처리 바이러스는 PEG 기반 시약을 사용하여 농축되었으며, 감염 다중성(MOI)은 SUP-T1 세포를 형질도입하고 표준 프로토콜31에 따라 유세포 분석으로 tNGFR을 측정하여 측정했습니다.- 2 x 106 primary human T cell을 12-well 배양 접시에 옮기고 100 units/mL 재조합 human interleukin-2(IL-2)가 보충된 완전한 RPMI-1640 배지(10% 열 비활성화 소 태아 혈청, 1% 페니실린/스트렙토마이신)에서 1:1 bead 대 cell 비율로 CD3/CD28 코팅 비드로 자극합니다. 37°C의 가습된 5% CO2 인큐베이터에서 24시간 동안 세포를 배양합니다.
- 활성화된 T 세포에 5-10의 MOI로 렌티바이러스 입자를 추가합니다. 부드럽게 섞고 72시간 동안 세포를 배양합니다. 비형질도입(NTD) T 세포를 음성 대조군으로 포함합니다.
- transduction 후 3일차에 T cell을 1.5mL tube로 채취하고 튜브를 자기 스탠드에 1-2분 동안 올려 놓아 CD3/CD28 활성화 beads를 제거합니다. 세포가 들어 있는 상등액을 새 1.5mL 튜브로 옮깁니다.
- 자동화된 세포 계수기를 사용하여 세포 계수를 수행하고 100 U/mL IL-2가 보충된 완전한 RPMI-1640 배지에서 세포 밀도를 1 x 106 cells/mL로 조정합니다. NGFR 농축을 진행하기 전에 총 CAR T 세포 수가 현탁액에서 최소 1.5 x 106 (보통 총 약 6 x 106 T 세포)에 도달할 때까지 T 세포를 계속 확장하십시오(아래 참조).
- 격일로 세포 수를 모니터링하고 100 units/mL IL-2가 보충된 새로운 배지를 추가하여 농도를 1 x 106 cells/mL로 조정하여 증식 중 최적의 세포 상태를 보장합니다.
- CAR 발현 T 세포의 농축
- 6 x 106 이상의 형질도입된 T 세포를 15mL 튜브로 옮기고 300 x g 에서 5분 동안 원심분리합니다. 0.5% 소 혈청 알부민(BSA)이 보충된 320μL의 PBS에 세포 펠릿을 재현탁시켜 PBSA를 만들고 40μL의 항-NGFR 마그네틱 비드를 추가합니다. 잘 섞어 얼음 위에서 15분 동안 배양합니다.
참고: 이 프로토콜은 약 25%의 transduction efficiency를 가정하여 농축 후 >1.5 x 106 CAR T cell을 생성합니다. 6 x 106 세포 미만으로 시작하면 CAR T 세포 회복이 저하될 수 있으므로 권장하지 않습니다. - 1640μL의 PBSA를 추가하여 최종 부피를 2mL로 만든 다음 제조업체의 지침에 따라 분리 컬럼을 사용하여 자기 분리를 진행합니다.
- 6 x 106 이상의 형질도입된 T 세포를 15mL 튜브로 옮기고 300 x g 에서 5분 동안 원심분리합니다. 0.5% 소 혈청 알부민(BSA)이 보충된 320μL의 PBS에 세포 펠릿을 재현탁시켜 PBSA를 만들고 40μL의 항-NGFR 마그네틱 비드를 추가합니다. 잘 섞어 얼음 위에서 15분 동안 배양합니다.
- 유세포 분석에 의한 CAR 발현 검출
참고: 아래 분석을 수행하기 전에 적절한 세포를 확인하기 위해 이 시점에서 CAR 발현 세포의 비율과 생존력을 결정하는 것이 좋습니다. CD4 및 CD8 비율과 메모리 표현형도 이 시점에서 결정할 수 있습니다. 대표적인 플롯은 그림 1 을 참조하십시오.- transducted 및 non-transduced 배양에서 2.5 x 105 T cell을 별도의 유세포 분석 튜브로 전달합니다. 200μL의 PBS로 셀을 2회 세척하고 세척할 때마다 300 x g 에서 5분 동안 원심분리합니다.
- 항-CD19 CAR FMC63 특이형 PE, 항-CD3 BV480 및 항-NGFR FITC 항체를 각각 PBS에 1:100으로 희석하여 포함하는 항체 혼합물을 준비합니다. 항체 혼합물 50μL에 세포를 재현탁시키고 4°C에서 20분 동안 배양합니다.
- 200μL의 PBS로 셀을 2회 세척하고 세척할 때마다 300 x g 에서 5분 동안 원심분리합니다. 200μL의 PBS에 세포를 재현탁하고 유세포 분석을 사용하여 분석합니다.
2. T세포와 표적세포를 캡슐화하는 액적의 생성
참고: 캡슐화 전에 T 세포와 JeKo-1 세포는 액적 세포 함량을 모니터링하기 위해 서로 다른 세포 염색으로 염색됩니다. 세포는 분석 시약으로 캡슐화되고 유세포 분석기에서 액적을 분석하기 전에 2-6시간 동안 배양됩니다( 그림 2 참조).
- 캡슐화 전 세포 염색
- 원액(제조업체의 지침에 따라 준비됨)을 dPBS로 1:5,000으로 희석하여 두 가지 형광 염료(보라색 염료와 원적색 염료 사용)의 작업 용액을 준비합니다.
- 각 공여자에 대해 2.5 x 106 CAR T, 2.5 x 106 NTD T 및 15 x 106 JeKo-1 세포를 별도의 원심분리 튜브(15 mL 또는 50 mL 튜브)로 옮기고 300 x g 에서 5분 동안 원심분리합니다. 이 실험에서는 0.5 x 106 effector cell을 준비된 각 샘플에 대해 1.5 x 106 target cell로 캡슐화했습니다.
참고: 여기에서 전송된 세포의 수는 각 donor에 대한 각 effector 세포 유형을 가진 4x 캡슐화 샘플을 위한 것입니다. 필요한 시료 수에 따라 세포와 시약의 수를 축소합니다. 또한 샘플당 정확한 세포 수는 실험 요구 사항에 따라 확장할 수 있습니다. - 보라색 형광 염료의 1:5,000 작업 용액 및 원적외선 형광 염료의 1:5,000 작업 용액에서 표적 세포(JeKo-1) 펠릿의 상등액을 제거하고 효과기 세포 펠릿을 재현탁합니다. 피펫을 사용하여 세포를 1 x 106 cells/mL 염색 용액의 세포 농도로 잘 재현탁시킵니다.
- 37°C 가습된 CO2 인큐베이터에서 20분 동안 세포를 배양합니다. 300 x g 에서 5분 동안 세포를 원심분리하고, 상층액을 제거하고, 15mL의 완전한 RPMI-1640 배지에 재현탁하여 세포를 세척합니다.
- 세척과 원심분리를 300 x g 에서 5분 동안 반복합니다. 상등액을 제거하고 effector cell pellets를 225 μL의 완전한 RPMI-1640에 재현탁시키고 target cell pellets를 450 μL의 완전한 RPMI-1640에 재현탁시킵니다.
- 30 μL의 그래디언트 배지를 effector cell suspension에 추가하고 60 μL의 동일한 gradient medium을 target cell suspension에 추가합니다. 파이펫팅하기 전에 그래디언트 배지 스톡 용액을 재현탁합니다.
- 15 μL의 20 μg/mL PI 스톡을 effector cell 현탁액에 추가하고 30 μL의 PI stock을 타겟 세포 현탁액에 추가합니다. 최종 PI 농도는 Granzyme B(GzmB) 기질이 아래에 추가된 후 결국 1μg/mL가 됩니다.
- 완전한 RPMI-1640에서 GzmB 기질의 1:10 희석을 준비하고 이 GzmB 기질 희석액 30μL를 effector cell 현탁액에 추가하고 60μL를 타겟 세포 현탁액에 추가합니다. 피펫과 잘 섞습니다.
참고: 각 effector cell pellet에 추가된 시약의 총 부피는 이제 300μL이고 target cell pellet에 대한 부피는 600μL가 되어야 합니다. 이러한 용액의 그래디언트 매체 농도는 10%, PI 농도는 1μg/mL, GzmB 기질 농도는 1:100이어야 합니다. - CD3, CD4 및 CD8 항체를 사용한 대체 라벨링
참고: 어떤 경우에는 타겟 세포와 함께 캡슐화하기 전에 effector 세포를 추가로 라벨링하는 것이 흥미로울 수 있습니다. 여기에서는 CD3, CD4 및 CD8 항체와 PBMC를 사용한 이러한 유형의 라벨링에 대한 원리 증명을 보여줍니다( 그림 3 참조).- 2.0 x 106 PBMC를 1.5 mL 튜브에 옮기고 300 x g에서 5분 동안 세포를 스핀다운합니다. 상층액을 제거하고 세포 펠릿을 0.5% BSA로 200μL의 dPBS에 재현탁합니다. 내용물을 2mL 튜브 2개로 나눕니다.
- 튜브 중 하나에 5μL의 anti-CD3-APC와 5μL의 anti-CD4-StarBright Violet 760을 추가합니다. 다른 튜브에 20μL의 anti-CD3-FITC 및 5μL의 anti-CD8-StarBright Violet 760을 추가합니다.
- 잘 섞어 어두운 곳에서 실온에서 30분 동안 배양합니다. 세척 완충액 1mL를 세포에 추가하고, 300 x g 에서 5분 동안 스핀다운하고, 상층액을 제거하고, 0.5% BSA가 포함된 1mL의 dPBS에 세포 펠릿을 재현탁합니다.
- 300 x g 에서 5분 동안 세포를 스핀다운하고 상층액을 제거한 다음 페놀 레드 및 10% 그래디언트 배지가 없는 150μL의 RPMI에 세포 펠릿을 재현탁합니다. 페놀 레드가 없는 RPMI, 세포용 33% 안정화 용액 및 외부 배지로 10% 구배 배지를 사용하여 2.2단계에서 설명한 대로 캡슐화합니다.
- 셀 캡슐화
- 캡슐화 전에 캡슐화 카트리지와 안정화 용액을 실온으로 예열합니다. 완전한 RPMI-1640 배지, 세포용 안정화 용액 33% 및 구배 배지 10%로 구성된 외부 배지 스톡을 준비합니다.
- 각 캡슐화 샘플에 대해 mixed-target-effector cell이 있는 세포 샘플 용액을 준비합니다. 피펫으로 잘 준비된 세포 용액을 재현탁하고 1.5mL 튜브에서 65μL의 준비된 이펙터 세포 현탁액과 65μL의 준비된 표적 세포 현탁액을 혼합합니다(둘 다 단계 2.1에서 준비).
- 적절한 캡슐화를 보장하기 위해 다음 순서로 캡슐화 카트리지의 표시된 웰에 시약을 즉시 로드하십시오. 준비된 각 캡슐화 샘플에 대해 한 세트의 웰을 로드합니다.
웰 #A: 400μL의 외부 매체.
웰 #D: 작은 선반에 40μL의 외부 매체가 있습니다.
웰 #C: 표적 세포(JeKo-1) 및 효과기 세포가 있는 120μL의 사전 혼합 용액. 로딩 직전에 피펫으로 세포를 잘 재현탁합니다.
웰 #B: 오일 250μL.
참고: 각 카트리지에는 최대 8개의 샘플을 로드할 수 있습니다.amp병렬로 캡슐화하기 위해. - 즉시 개스킷 밀봉을 진행하고 기기에 카트리지를 로드하면서 로드된 카트리지가 기울어지거나 흔들리거나 부딪히지 않도록 합니다. 개스킷을 카트리지에 조심스럽게 밀봉합니다.
- 카트리지를 미세유체 장치로 조심스럽게 옮기고 사용 설명서에 설명된 대로 캡슐화를 시작합니다.
- 생성된 액적은 주변 외부 매체보다 밀도가 높으며 수집 우물(Well #D)의 바닥에 빠르게 침전됩니다. Well #D의 침전된 액적을 오버레이 배지에 재현탁시키고 뚜껑이 있는 2mL 저결합 DNA 튜브로 옮겨 각 액적 생성(모든 액적 및 주변 외부 배지)을 수집합니다. Well #A의 나머지 외부 매체와 함께 Well #D 세척하여 나머지 물방울을 수집합니다.
- 비말이 수집 튜브에 침전되면(약 1분 소요) 명시야 현미경으로 액적을 검사하여 비말 생성을 확인합니다. 이를 위해 10 μL 피펫 팁에 시료를 채웁니다: 약 1/3은 액적 상(백색 상) 표면의 액적으로, 약 2/3는 오버레이 외부 매체로 팁을 필링합니다. 즉시 8-챔버 유리 슬라이드에 샘플을 로드하고 4x 및 20x 배율에서 명시야 현미경으로 액적을 검사하여 세포의 액적 포집을 확인합니다.
참고: 이러한 방식으로 액적이 주변 매체의 더 큰 부피에서 흡인되는 것이 중요합니다.
- 잠복
참고: 방울은 이제 표준 가습된 37°C, 5% CO2 인큐베이터에서 2mL의 DNA 저결합 튜브에서 배양할 수 있습니다. 이 튜브는 액적 배양을 위한 최적의 표면 특성을 가지고 있으므로 사용하는 것이 좋습니다.- 주사기 바늘(23G)을 사용하여 필요한 수의 2mL 저결합 DNA 튜브의 뚜껑에 신중하고 안전하게 구멍을 뚫습니다. 이렇게 하면 자유 CO2/O2 확산이 보장되는 동시에 매체 증발을 방지할 수 있습니다.
- 각 배양 튜브에 외부 배지 1mL를 추가합니다. 액적은 적절한 완충을 보장하기 위해 최소 5배 부피의 외부 매체와 함께 배양해야 합니다. 첨가된 외부 배지의 부피는 적용된 세포의 신진대사에 따라 증가할 수 있습니다.
- 오버레이 배지에서 생성된 액적을 재현탁하고 각 생산을 준비된 배양 튜브 중 3개로 분할합니다(각 시점 측정에 대해 하나씩). 액적은 무겁고 침전물이 빠르기 때문에 각 이송 사이에 스톡을 다시 부유시키는 것이 중요합니다.
참고: 액적 생산이 분할되는 배양 튜브의 수는 다양할 수 있지만, 각 샘플에 분석을 위한 충분한 이벤트가 포함되도록 하기 위해 하나의 생산을 4개 이하의 배양 튜브로 분할하는 것이 좋습니다. - 액적 생성 후 2시간, 4시간 또는 6시간 배양을 위해 튜브를 인큐베이터에 똑바로 세웁니다.
3. 액적의 다운스트림 분석
- 현미경 검사 법
- 배양 후 2.2.7단계에서 설명한 대로 소수의 액적을 현미경 슬라이드로 옮기고 적절한 레이저 및 필터 구성의 표준 형광 현미경을 사용하여 명시야 및 형광 현미경으로 분석합니다.
참고: 방울은 명시야 현미경으로 감지할 수 있습니다. 보라색으로 염색된 T 세포는 DAPI 필터로, 원붉은색으로 염색된 JeKo-1 세포는 APC 필터로, GzmB-FAM 신호는 FITC 필터로, PI 신호는 PE 필터로 검출할 수 있습니다. 가장 관심 있는 PI 신호는 초기 세포사멸 세포가 후기 세포사멸 세포보다 피크 방출이 낮기 때문에 현미경으로 시각화하기 어려울 수 있습니다. 대표적인 데이터는 그림 4 를 참조하십시오.
- 배양 후 2.2.7단계에서 설명한 대로 소수의 액적을 현미경 슬라이드로 옮기고 적절한 레이저 및 필터 구성의 표준 형광 현미경을 사용하여 명시야 및 형광 현미경으로 분석합니다.
- 유세포 분석
- 배양 후 각 액적 시료를 오버레이 배지에 재현탁하고 5mL FACS 튜브로 옮깁니다. 아래 나열된 일반 지침에 따라 표준 유세포 분석기를 사용하여 액적을 분석합니다.
- 적절한 레이저 및 필터 구성의 유세포 분석기를 사용하십시오. 선택된 세포 염색 및 분석 패널을 사용하면 여기에 사용된 유세포 분석기에서 색상 보정이 필요하지 않습니다. 다른 색상이 적용되거나 적용된 유세포 분석기의 구성이 다른 경우 보상이 필요할 수 있습니다.
- FSC-H를 임계값 트리거로 사용하여 작은 오일 이벤트에서 배경 소음을 제외합니다.
- 물방울은 무겁고 FACS 튜브 바닥에 침전됩니다. SIP가 방울에 도달하는지 확인합니다. 액적은 획득하기 전에 액적에 대한 외부 버퍼의 최소 5배 부피에 부유해야 합니다.
- Droplet 이벤트는 고속을 사용하여 획득됩니다. 액적을 분석할 때 강도 높이 측정이 사용되므로 FSC 및 SSC와 검사된 형광단에 대한 강도 높이(H) 신호를 기록합니다. 긍정적 인 이벤트와 부정적인 이벤트를 적절하게 구분하기 위해 이득을 조정합니다.
참고: FITC 채널을 사용하여 GzmB 신호를 측정하고, 퍼시픽 블루 채널을 사용하여 보라색으로 염색된 T 세포를 감지하고, APC 채널을 사용하여 원붉게 염색된 JeKo-1 세포를 감지하고, PE 채널을 사용하여 PI 신호를 감지했습니다. - 다운스트림 분석을 위해 충분한 이벤트를 기록합니다. 여기에서 우리는 시점당 4.5 - 8.3 x 103 의 동시 캡슐화 액적을 기록했습니다.
- 각 액적 획득 세트 후에 표준 세척 및 헹굼 용액을 사용하여 SIP를 통해 유세포 분석기를 세척합니다. 실험이 끝나면 유세포 분석기를 철저히 세척하십시오. 대표적인 데이터는 그림 4 및 그림 5 를 참조하십시오.
- 배양 후 각 액적 시료를 오버레이 배지에 재현탁하고 5mL FACS 튜브로 옮깁니다. 아래 나열된 일반 지침에 따라 표준 유세포 분석기를 사용하여 액적을 분석합니다.
- 데이터 분석
- 해당 시점의 T 세포 전용 액적 집단에서 결정된 T 세포 생존율로 정규화된 GzmB 양성 T 세포 및 JeKo-1 세포 공동 캡슐화의 백분율을 기반으로 GzmB를 분비하는 T 세포의 백분율을 다음과 같이 계산합니다.
비말 T cell+, Jeko-1+, GzmB+ / (비말 T cell+, Jeko-1+ - 비말 사체 T cell+, Jeko-1+)
여기서 비말은 T 세포를 죽여, Jeko-1+는 T 세포만을 가진 비말의 사멸로부터 추정됩니다 : 비말사멸 T 세포 +, Jeko-1 + = 비말T 세포 +, Jeko-1 + x 비말 사멸 T 세포 +, Jeko-1- / 비말Tcell+, Jeko-1-. - 다음과 같이 표적 세포를 사멸시킨 T 세포의 비율을 계산합니다.
세포독성 T 세포 비율 = (관찰된 죽음 - 배경 죽음)/(100 - 배경 죽음)
여기서 배경 사망은 (T cell+, Jeko-1+) 비사멸 관련 사망 또는 캡슐화 전에 발생한 사망으로 인한 (T cell+, Jeko-1+) 방울 내에 존재하는 사망입니다. - (T cell+, Jeko-1-) 방울 및 (T cell-, Jeko-1+) 방울에서 세포 사멸로 인한 배경 사멸을 추정합니다.
배경 사망 = (1- (1- DropletsTcell-, Jeko-1+의 사망률) x (1- DropletsT cell+, Jeko-1-)의 사망률) x 100
여기서 사멸 비율은 각각 T-세포 단독 액적 및 JeKo-1 세포 단독 액적에서 % PI 양성 액적으로 직접 측정됩니다. 모든 계산은 샘플링 시간별 숫자로 수행됩니다.
- 해당 시점의 T 세포 전용 액적 집단에서 결정된 T 세포 생존율로 정규화된 GzmB 양성 T 세포 및 JeKo-1 세포 공동 캡슐화의 백분율을 기반으로 GzmB를 분비하는 T 세포의 백분율을 다음과 같이 계산합니다.
결과
형질도입 후, 항-CD3 및 항-NGFR 항체를 사용하여 유세포 분석으로 T 세포의 CAR 발현을 분석했습니다. 이후 CAR T 세포 집단은 anti-NGFR 마그네틱 비드를 사용하여 농축되어 두 공여자에 대해 98% 이상의 순도를 달성했습니다(그림 1A-B). 사용된 분류된 CAR 세포의 CD4/CD8 비율 및 메모리 표현형도 CCR7 및 CD45RA 항체를 활용하는 표준 게이트 전략을 사용하여 정량화했습니다. 이 데이터는 사용된 CAR T 세포의 CD4/CD8 비율이 0.73이었고 세포는 주로 나이브와 유사한 메모리 표현형임을 보여줍니다(그림 1C-E).
CAR T 세포와 JeKo-1 세포를 각각 보라색 및 원적외선 염료로 염색하고 분석 시약 GzmB 기질 및 PI와 함께 DE50 방울에 캡슐화했습니다(그림 2). 또는 anti-CD4 또는 anti-CD8과 같은 항체를 사용하여 CAR T 세포를 표지할 수도 있으므로(그림 3) T 세포의 특성을 보다 자세히 분석할 수 있습니다. 각 T 세포 현탁액(CAR T 또는 NTD)을 효과기에서 캡슐화 직전에 JeKo-1 세포 현탁액과 혼합하였다: 1:3의 표적 세포 비율(0.5 x 106 T 세포 및 1.5 x 106 JeKo-1). 캡슐화 후, 각 액적 생산(CAR T 세포 + JeKo-1 및 NTD + JeKo-1)을 각각 2시간, 4시간 및 6시간 배양을 위해 3개의 배양 튜브로 분할했습니다. 세포를 37°C에서 5%CO2 로 액적 내부에서 배양한 다음 표시된 시점에서 현미경 및 유세포 분석으로 분석했습니다.
우리는 배양 4시간 후 이중 에멀젼 방울에 대한 형광 현미경을 수행했습니다(그림 4). 녹색 형광 신호(FITC)의 강도는 DE50 방울 내에서 CAR T 세포 또는 NTD의 분비된 GzmB 활성 수준을 보여줍니다. 그림 4B 는 CAR T 세포와 JeKo-1 표적 세포가 밀접하게 접촉하는 단일 GzmB 양성 액적의 위상차 및 형광 현미경 이미지를 보여줍니다.
다음으로, DE50 방울을 유세포 분석법으로 분석하여 초기 GzmB 분비 및 세포독성 세포 사멸 활성을 보이는 CAR T 세포의 비율을 정량화했습니다(그림 5). 캡슐화 전에 JeKo-1 표적 세포를 원적외선 염료로 염색하고 effector T 세포를 보라색 염료로 사전 배양 염색하면 세포가 푸아송 분포에 따라 액적으로 분포함에 따라 3개의 별개의 세포 함유 액적 집단을 쉽게 식별할 수 있었습니다. 확인된 액적 집단은 T 세포만 있는 액적, JeKo-1 세포만 있는 액적, T 세포와 JeKo-1 세포가 함께 있는 액적입니다(그림 5A). T 세포와 JeKo-1 세포를 함께 캡슐화하는 액적을 게이트하고 PI(그림 5C)에서 알 수 있듯이 GzmB 활성(그림 5B) 및 세포 사멸을 나타내는 신호에 대해 분석했습니다.
액적에서 세포의 캡슐화는 푸아송 분포를 따르며 4개의 서로 다른 액적 집단을 얻습니다(그림 6A). 그림 6B 는 자발적인 GzmB 분비 T 세포의 비율을 결정할 수 있는 방울을 6시간 배양 한 후 모든 방울 집단 내에서 GzmB 양성 방울의 수준을 보여줍니다. 이러한 데이터는 CAR T 세포만 GzmB를 분비하기 때문에 이 방법의 높은 특이성을 나타냅니다.
마지막으로, 2시간, 4시간 및 6시간의 공동 배양 후 시점에 걸쳐 GzmB 및 PI 수준을 정량화했습니다. 참고로, T 세포와 JeKo-1 세포만 포함하는 방울을 분석하여 각 집단의 배경 세포 사멸을 조사했습니다(그림 6C). 배경 세포 사멸은 3.3단계에서 설명한 바와 같이 효과기 세포 집단에서 살아있는 GzmB 분비 및 표적 세포 사멸 T 세포의 비율을 결정하는 데 사용되었습니다(그림 7). 두 명의 공여자로부터 얻은 CAR T 세포는 표적 세포 유도 GzmB 분비와 세포 사멸 활성 모두에서 시간 의존적 증가를 보였다. 공여자 1의 살아있는 CAR T 세포의 거의 36%와 공여자 2의 살아있는 CAR T 세포의 약 31%가 표적 세포와 6시간 동시 캡슐화 후 GzmB를 분비했으며, 이는 NTD 대조 T 세포에 비해 현저히 증가한 수치입니다(그림 7A). 이에 상응하여, 살아있는 공여자 1의 약 21%와 살아있는 공여자 2 CAR T 세포의 약 22%가 표적 세포를 사멸시켰으며, 이는 양성 PI 신호로 나타났습니다(그림 7B). GzmB를 분비한 CAR T 세포의 비율은 각 시점에서 사멸된 표적 세포의 비율을 초과했으며, 이는 GzmB 매개 세포독성에서 예상되는 사건 순서와 일치했습니다. 종합하면, 이러한 데이터는 여기에 제시된 방법이 세포 집단 내에서 개별 T 세포 독성의 이질성을 특성화하고 서로 다른 집단 간의 비교를 가능하게 한다는 것을 보여줍니다.
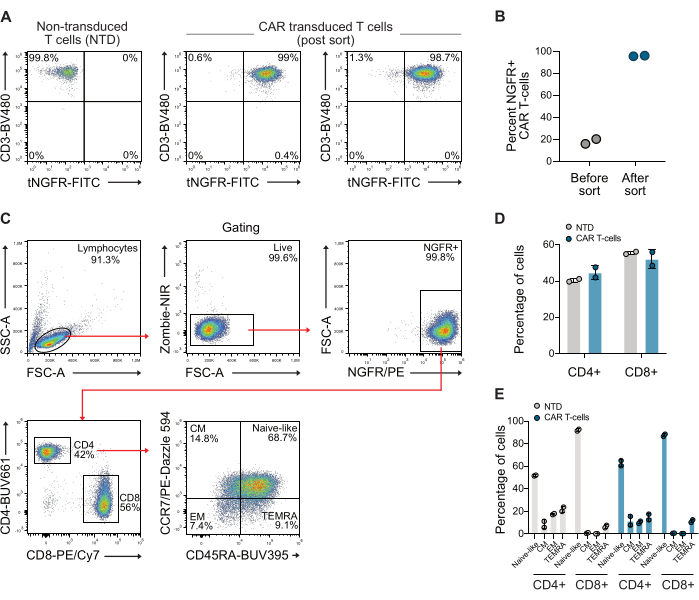
그림 1: NGFR 분류에 따른 대표적인 유세포 분석 플롯. (A) 약 10일간의 확장 후, NGFR 특이적 마이크로비드 및 자기 분류를 사용하여 CAR T 세포를 분류하여 >98% CAR T 세포인 CAR T 세포 집단을 생성했습니다. (B) 분류 전과 후 본 연구에 사용된 2명의 기증자로부터 얻은 CAR T 세포의 정량화. (C) T 세포의 CD4/CD8 비율 및 기억 표현형을 조사하는 데 사용되는 게이팅 전략. (D) 사용된 T 세포의 CD4 및 CD8 정량화. (E) 사용된 T 세포의 기억 표현형의 정량화. 약칭 : CM = 중앙 메모리, EM = 이펙터 메모리, NTD = 비 형질 전환, TEMRA = 말단 분화 이펙터 세포. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
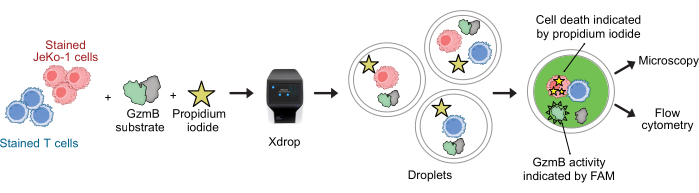
그림 2: 액적에서 단일 세포 분해능을 가진 결합된 GzmB 분비 및 세포 독성 분석을 위한 워크플로우. DE 액적에 캡슐화하기 전에 표적 세포와 효과기 세포는 보라색 및 원적외선 세포 염색을 사용하여 별도로 염색됩니다. 미세유체역학(microfluidics) 장치와 캡슐화 카트리지를 사용하여 이펙터 세포는 세포 배지, PI 및 FAM 표지된 GzmB 펩타이드 기질과 함께 액적의 표적 세포와 함께 공동 캡슐화됩니다. 분석 및 배양은 액적 내에서 발생합니다. 분비된 GzmB 활성은 GzmB가 기판을 절단한 후 발생하는 녹색 형광의 방출로 표시됩니다. 세포 사멸은 PI로 표시됩니다. 배양 후 DE50 액적은 현미경 및/또는 유세포 분석으로 분석됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
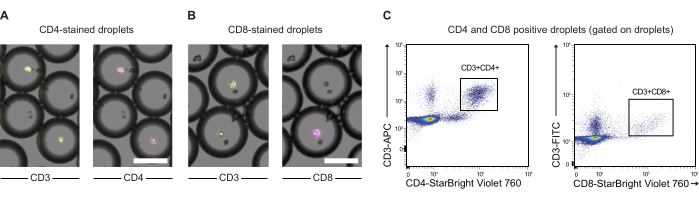
그림 3: anti-CD3, anti-CD4 및 anti-CD8 항체로 사전 라벨링된 액적 캡슐화 PBMC의 분석. (A) 항-CD3(APC) 및 항-CD4(NIR) 항체로 사전 라벨링된 캡슐화된 PBMC가 있는 비말의 현미경 이미지. 스케일바 = 100 μm. (B) As (A), 그러나 대신 CD3 (FITC) 및 anti-CD8 (NIR) 라벨링이 있습니다. 스케일바 = 100 μm. (C) 동일한 액적의 유세포 분석 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
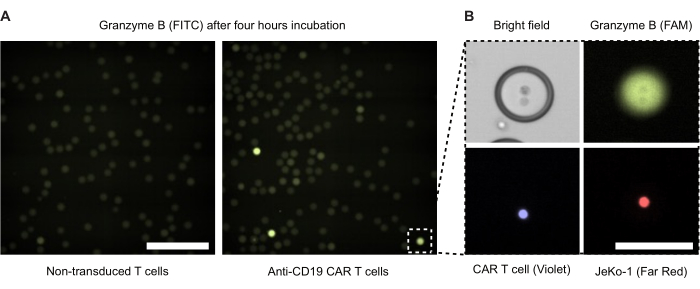
그림 4: effector 및 target cell이 있는 비말의 현미경 이미지. 이미지는 표준 37°C, 5% CO2 가습 세포 인큐베이터에서 4시간 배양 후 촬영되었습니다. (A) 캡슐화된 NTD 및 JeKo-1 세포(왼쪽) 또는 CAR T 세포와 JeKo-1 세포(오른쪽)가 있는 샘플의 방울을 GzmB 양성(녹색) 방울을 검출하기 위해 FITC 채널을 사용하여 형광 현미경으로 이미지화했습니다. 스케일바 = 500μm. (B) 위상차, FITC(GzmB), APC(JeKo-1 셀) 및 DAPI(CAR T 셀)로 이미지화된 단일 액적. 스케일바 = 100μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
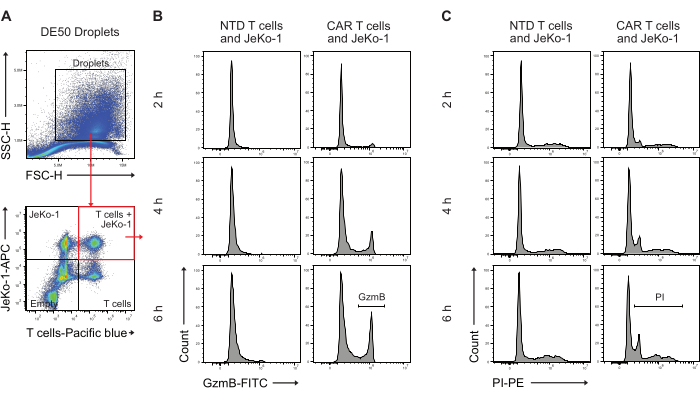
그림 5: 배양 후 유세포 분석으로 액적을 분석하기 위한 게이팅 전략. (A) 게이팅은 액적을 식별하기 위해 전방 및 측면 산란에 의해 수행되었으며, 그 후 액적을 포함하는 게이트를 선택했습니다. 게이트 외부의 이벤트는 이중 에멀젼 액적 생산의 부산물로 생성되는 기름 방울을 나타냅니다. 적용된 세포 염색에 해당하는 채널의 방울에 대한 후속 형광 분석은 4개의 방울 집단을 식별합니다: T 세포와 JeKo-1 세포를 모두 포함하는 방울(빨간색 사각형); JeKo-1 세포만 있는 비말; T 세포만 있는 비말; 그리고 빈 물방울. (B) 시점 및 NTD와 CAR T 세포 사이의 이중 양성 방울에서 GzmB 신호에 대한 대표 히스토그램. (C) 시간 지점 및 NTD와 CAR T 세포 사이의 이중 양성 방울에서 PI 신호에 대한 대표 히스토그램. 모든 액적 측정은 강도 높이(H) 측정으로 수행됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
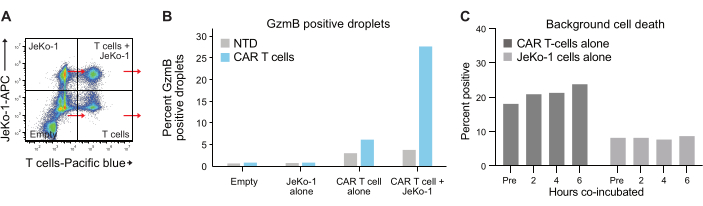
그림 6: 내부 대조군 및 참조 모집단. (A) 그림 5A 의 4개 사분면 각각을 선택하고 GzmB 및 PI를 각각 측정했습니다. 이러한 유형의 정량화를 통해 T 세포 효능에 대한 최종 분석을 수행하기 전에 배경 신호를 측정하고 뺄 수 있습니다. (B) 4개의 액적 집단 각각에 대해 6시간 배양 후 빈도 GzmB 양성 액적을 보여주는 그래프로, Donor 1 CAR T 샘플의 데이터로 예시됩니다. (C) 배경 세포 사멸은 측정된 각 시점에서 측정된 각 시점에서 JeKo-1 단독 및 T 세포 단독 대조군 액적 집단에서 공여자 1의 데이터를 사용하여 결정되었습니다. 배경 세포 사멸은 그림 7에 나와 있고 3.3단계에서 설명한 살아있는 GzmB 분비 및 세포 사멸 효과기 세포의 빈도를 계산하는 데 사용됩니다. 약어: Pre = encapsulation. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
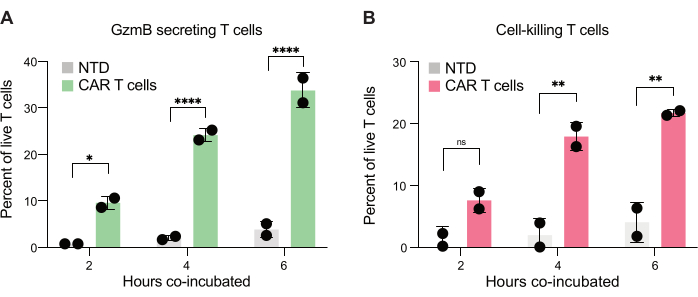
그림 7: 이중 양성 액적에서 GzmB를 분비하고 JeKo-1 세포를 사멸시킬 수 있는 T 세포의 정량화. 2명의 기증자로부터 게이트된 이중 양성 액적을 액적에서 2시간, 4시간 및 6시간 동시 배양 후 검사했습니다. (A) GzmB를 분비하는 표적 세포와 조우하는 T 세포의 빈도 및 NTD T 세포와 CAR T 세포의 비교. (B) 함께 캡슐화된 표적 세포를 죽이는 표적 세포와 조우하는 T 세포의 빈도. 약어: GzmB = 그랜자임 B, NTD = 비형질도입, PI = 요오드화 프로피듐. * = P-값 < 0.05, ** = P-값 < 0.005, **** = 이원 분산분석에 의한 P-값 < 0.0001. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
여기에서는 CD19 양성 맨틀 세포 림프종 세포주 JeKo-1과 동시 캡슐화 시 CD19-CD28-CD3z CAR T 세포의 세포독성 전위를 평가하기 위해 사용하기 쉬운 상용 미세유체 장치를 사용하여 단일 세포 수준에서 T 세포의 세포독성 전위를 검사하는 방법을 제시합니다.
이 프로토콜에는 몇 가지 중요한 단계가 있습니다. 먼저, 위양성 결과를 피하기 위해 분석을 수행하기 최소 48시간 전에 T 세포에서 자극 비드를 제거하는 것이 좋습니다. 둘째, CAR 또는 T-세포 수용체와 같은 구조체를 통한 T 세포 형질 전환 효율은 상당히 다를 수 있습니다. 형질도입된 T 세포의 후속 정제 단계가 없으면 결과를 해석하기 어려울 수 있습니다. 여기에서는 순수한 CAR T 세포 집단이 사용되었으므로 각 시점에서 CAR T 세포를 킬러 또는 비킬러로 특성화할 때 높은 수준의 확실성을 기대할 수 있습니다. 또는 형광 단백질 또는 유전자 태그로 CAR을 태그하여 CAR 양성인 세포를 표시한 다음 액적을 분석할 때 게이트를 적용할 수 있습니다. 태깅(tagging)을 사용하는 경우, 선택된 형광 분자는 다른 분석 형광단의 형광 방출을 방해하지 않아야 합니다. 예를 들어, GFP-태깅을 사용하면 여기에서 수행된 실험에 적용된 FAM-표지된 GzmB 기질을 방해할 수 있으므로 권장되지 않습니다.
여기에 설명된 프로토콜의 주요 장점은 액적 생성 자체가 단순화되고 자동화된다는 것입니다. 그러나 단일 셀 캡슐화를 보장하기 위해서는 카트리지가 로딩되기 전에 셀이 완전히 재현탁되는 것이 중요합니다. 이러한 이유로 카트리지 로드를 준비할 때 적절한 속도로 작업하는 것이 좋습니다. 일부 세포는 GzmB의 높은 분비자이므로 GzmB 기질을 추가할 때도 유사한 고려 사항이 적용됩니다. 세포의 재부유는 또한 작은 카트리지 미세유체 채널의 막힘을 방지합니다. 세포의 적절한 캡슐화는 위에서 설명한 바와 같이 현미경으로 쉽게 확인할 수 있습니다.
액적은 세포 배지를 캡슐화하고 세포에서 분비되는 세포 산물을 유지하기 때문에 다른 사이토카인, 항체 및 화합물을 분석할 수 있습니다. 실제로, 우리는 현재 프로토콜의 수정이 필요한 IFN-γ 및 TNF-α와 같은 다른 관련 면역 세포 분비 분자를 테스트했습니다. 사이토카인 검출의 경우, GzmB에 대해 여기에서 사용하는 것과는 다른 유형의 분석 형식이 적용될 수 있으며, 이를테면 이펙터 세포 표면(32)에 ELISA 샌드위치를 생성하는 것이 적용될 수 있습니다. 또한 세포 염색 및 분석 색상(예: 카르복시플루오레세인 숙시니미딜 에스테르(CFSE))을 변경할 수 있지만, 표준 유세포 분석에서 수행되는 것처럼 다양한 색상 조합에서 블리드스루를 최소화하거나 전혀 없애는 것이 중요합니다.
또한, 이 프로토콜은 CAR T 세포 분석에만 국한되지 않습니다. 또한 다른 T 세포/표적 상호 작용 또는 CAR NK 세포와 같은 다른 면역 세포를 연구하도록 확장할 수도 있습니다. 예를 들어, CD4 및 CD8 T 세포 subset을 추가 형광단으로 라벨링하여 더 광범위한 기능적 면역 표현형 분석을 수행하는 것과 같은 고급 실험도 구상할 수 있습니다. 실제로, 여기에서 우리는 CD4 및 CD8이 액적에서 검출될 수 있음을 보여주며, 따라서 effector T 세포와 그 세포독성 능력의 추가 특성화를 가능하게 합니다.
이 프로토콜을 최적화하여 표준 유세포 분석 기기에서 작동하도록 특별히 목표로 삼았습니다. 액적 유세포 분석은 복잡하지 않지만, 유세포 분석기가 특정 간격으로 적절하게 헹궈지지 않거나 각 시간 간격에서 샘플을 분석한 후 여기에서 권장하는 대로 헹궈지지 않으면 오일 축적이 발생할 수 있음을 발견했습니다. 최상의 헹굼 프로토콜은 각 개별 유세포 분석기에 따라 다를 수 있습니다.
이 방법의 중요한 장점 중 하나는 고처리량 기능으로, 광범위한 전문 지식이나 고도로 전문화된 장비 없이도 표적 세포에 대한 단일 세포 효과기 매개 세포 독성을 모니터링할 수 있습니다. 분석은 유세포 분석 또는 현미경과 같은 기존 도구를 사용하여 쉽게 수행할 수 있습니다. 이중 에멀젼 액적은 또한 세포 분류기(cell sorter)30,31를 사용하여 분류할 수 있으며, 이는 특정 기능을 가진 세포, 예를 들어 세포독성 전위가 있거나 없는 CAR T 세포를 분리한 후 단일 세포 전사체 분석을 가능하게 할 수 있습니다.
기술에 제한이 없는 것은 아닙니다. 일부 세포주는 24시간 이상 액적에서 배양을 허용하지만, 일차 세포는 24시간 이후에는 생존율이 현저히 낮아질 수 있습니다. 이는 일반적으로 분석에 대한 시간 제약을 나타내지만, 현재 분석의 경우 4-6시간 이내에 눈에 띄는 GzmB 및 세포 사멸 활성을 관찰할 수 있는데, 이는 작은 액적 구획이 효과기와 표적 세포의 빠른 만남을 보장하기 때문일 수 있습니다. 마찬가지로, 작은 액적 부피는 분비된 GzmB-절단된 기질의 검출 가능한 수준까지 농도의 빠른 축적을 보장합니다. 이 기술의 또 다른 한계는 표준 유세포 분석기를 사용할 때 effector 세포에 의한 연속 사멸을 감지할 수 없다는 것입니다. 그러나 이는 이미지 유세포 분석기 또는 이미지 세포 분석 기술을 통해 달성할 수 있으며, 이는 조사가 필요합니다.
CD19 CAR T 세포의 채택 이식은 혈액 악성 종양 환자 치료에 놀라운 성공을 보여주었습니다. 그럼에도 불구하고, 환자32에서 반응의 큰 변화와 예측할 수 없는 독성이 있는데, 이는 부분적으로 CAR T 주입 제품 내의 이질성 때문일 수 있습니다. 그 결과, 집단 내 개별 CAR T 세포의 표현형 조성 및 세포 독성 능력을 분석하는 데 대한 관심이 높아지고 있습니다. 이것은 CAR 요법이 자가면역 질환 및 다른 형태의 암에서 점점 더 많이 테스트되고 있기 때문에 특히 중요할 것입니다. 여기에 설명된 미세유체역학 장치 및 프로토콜은 CAR T 세포 및 기타 세포 기반 치료법의 이질성을 검사하기 위한 강력하고 다양한 접근 방식을 제공합니다.
공개
저자는 다음과 같은 경쟁 이익을 선언합니다 : MBB는 현재 연구와 관련이 없는 Janssen, Roche 및 Kite/Gilead로부터 컨설팅 사례금을 받았습니다. D.L.P. 및 P.M.은 Samplix의 직원입니다.
감사의 말
저자는 유용한 토론과 제안에 대해 CITCO와 Samplix의 회원과 직원들에게 감사의 뜻을 전합니다. MBB는 Lundbeck Foundation(R381-2021-1278)의 Early-Career Clinician Scientists' Fellowship의 지원을 받습니다. 이 연구는 오덴세 대학병원의 엘리트 연구 보조금을 통해 지원됩니다. 또한 이 연구는 Samplix ApS에 대한 유럽 혁신 위원회 프로젝트 190144395의 보조금으로 지원되었습니다.
자료
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| Blocker BSA (BSA) | Thermo Scientific | 37525 | |
| CellTrace Far Red Cell Proliferation Kit (far red fluorescent dye) | Invitrogen | C34564 | |
| CellTrace Violet Cell Proliferation Kit (violet fluorescent dye) | Invitrogen | C34557 | |
| DE Stabilizing Solution (stabilizing solution) | Samplix | REDIVSTABSOL1500 | |
| DPBS (dPBS) | Gibco | 14190-094 | |
| Dulbecco’s PBS (dPBS) | Capricorn Scientific | PBS-1A | |
| Dynabeads Human T-Activator (CD3/CD28 activation beads) | Gibco | 11132D | |
| Fetal Bovine Serum (FBS) | Capricorn Scientific | FBS-HI-12A | |
| Lenti-X Concentrator (PEG-based reagent) | Takara Bio | 631232 | |
| MACSelect LNGFR Microbeads (anti-NGFR magnetic beads) | Miltenyi Biotec | 130-091-330 | |
| OptiPrep density gradient medium (gradient medium) | Stemcell | 7820 | |
| Penicillin-Streptomycin (P/S) | Capricorn Scientific | PS-B | |
| Propidium iodide (PI) | Invitrogen | BMS500PI | |
| Recombinant Human IL-2 (IL-2) | Peprotech | 200-02 | |
| RPMI-1640 with Stable Glutamine (RPMI-1640) | Capricorn Scientific | RPMI-STA | |
| RPMI-1640 without L-Glutamine and phenol red | Gibco | 32404-014 | |
| Xdrop DE oil I (oil) | Samplix | REOILDEC1900 | |
| Xdrop Granzyme B substrate (GzmB substrate) | Samplix | REGRB100 | |
| Zombie-NIR viability dye (viability dye) | BioLegend | 423106 | |
| Plasticware etc. | |||
| 8-chamber glass slide | Chemometec | 942-0003 | |
| Cell culture plate, 12 well | TH Geyer | 7696791 | |
| DNA LoBind tube, 2 mL (DNA tube) | Eppendorf | 30108078 | |
| Eppendorf tube, 1.5 mL (1.5 mL tube) | Eppendorf | 30108051 | |
| Falcon tube, 15 mL (15 mL tube) | TPP | 91015 | |
| Falcon tube, 5 mL (5 mL tube) | Falcon (VWR) | 734-0443 | |
| Green cell suspension flasks for cell incubations (T75 flask) | Sarstedt | 148.19.22 | |
| Green cell suspension plates for cell incubations (96 well plate) | Sarstedt | 148.32.20 | |
| LS Separation Columns (separation column) | Miltenyi Biotec | 130-042-401 | |
| Xdrop DE Gaskets (gaskets) | Samplix | #GADEA100 | |
| Xdrop DE50 Cartridge (encapsulation cartridge) | Samplix | #CADE50A100 | |
| Antibodies | |||
| anti-CCR7 PE-Dazzle 594 | BioLegend | 353236 | |
| anti-CD19 CAR FMC63 Idiotype Antibody, PE | Miltenyi Biotec | 130-127-342 | |
| anti-CD3 APC | Biolegend | 300439 | |
| anti-CD3 BV480 | BD Biosciences | 566105 | |
| anti-CD3 FITC | BD Biosciences | 345763 | |
| anti-CD4 BUV661 | BD Biosciences | 612962 | |
| anti-CD4 StarBright Violet 760 | Bio-Rad | MCA1267SBV760T | |
| anti-CD45RA BUV395 | BD Biosciences | 740298 | |
| anti-CD8 PE-Cy7 | BioLegend | 344712 | |
| anti-CD8 StarBright Violet | Bio-Rad | MCA1226SBV760 | |
| anti-NGFR FITC | BioLegend | 345106 | |
| anti-NGFR PE | BioLegend | 345106 | |
| Cells | |||
| JeKo-1 Mantle-cell lymphoma cell-line (JeKo-1) | ATCC | CRL-3006 | |
| Primary peripheral blood mononuclear cells (PBMCs) | |||
| Equipment | |||
| Countess 3 Automated Cell Counter | Thermo Fisher Scientific | A50298 | |
| DynaMag-2 Magnet | Invitrogen | 12321D | |
| NovoCyte Quanteon Flow Cytometer (flow cytometer) | Agilent | 2010011AA | |
| Xdrop (microfluidics device) | Samplix | IN00110-EU |
참고문헌
- Pasqui, D. M., Latorraca, C. D. O. C., Pacheco, R. L., Riera, R. CAR-T cell therapy for patients with hematological malignancies. A systematic review. Eur J Haematol. 109 (6), 601-618 (2022).
- Krejcik, J., et al. Harnessing the immune system to fight multiple myeloma. Cancers. 13 (18), 4546 (2021).
- Tokarew, N., Ogonek, J., Endres, S., von Bergwelt-Baildon, M., Kobold, S. Teaching an old dog new tricks: next-generation CAR T cells. British J Cancer. 120 (1), 26-37 (2019).
- Bogetofte Barnkob, M., Vitting-Seerup, K., Rønn Olsen, L. Target isoforms are an overlooked challenge and opportunity in chimeric antigen receptor cell therapy. Immunother Adv. 2 (1), ltac009 (2022).
- Daei Sorkhabi, A., et al. The current landscape of CAR T-cell therapy for solid tumors: Mechanisms, research progress, challenges, and counterstrategies. Front Immunol. 14, 1113882 (2023).
- . Considerations for the Development of Chimeric Antigen Receptor (CAR) T Cell Products Available from: https://www.fda.gov/regulatory-information/search-fda-guidance-documents/considerations-development-chimeric-antigen-receptor-car-t-cell-products (2024)
- Roddie, C., O'Reilly, M., Dias Alves Pinto, J., Vispute, K., Lowdell, M. Manufacturing chimeric antigen receptor T cells: issues and challenges. Cytotherapy. 21 (3), 327-340 (2019).
- Wang, L., et al. Improvement of in vitro potency assays by a resting step for clinical-grade chimeric antigen receptor engineered T cells. Cytotherapy. 21 (5), 566-578 (2019).
- Burrows, S. R., Fernan, A., Argaet, V., Suhrbier, A. Bystander apoptosis induced by CD8+ cytotoxic T cell (CTL) clones: implications for CTL lytic mechanisms. Int Immunol. 5 (9), 1049-1058 (1993).
- Gattinoni, L., et al. Acquisition of full effector function in vitro paradoxically impairs the in vivo antitumor efficacy of adoptively transferred CD8+ T cells. J Clin Invest. 115 (6), 1616-1626 (2005).
- Chen, G. M., et al. Integrative bulk and single-cell profiling of premanufacture T-cell populations reveals factors mediating long-term persistence of CAR T-cell therapy. Cancer Dis. 11 (9), 2186-2199 (2021).
- Frazer, G. L., Gawden-Bone, C. M., Dieckmann, N. M. G., Asano, Y., Griffiths, G. M. Signal strength controls the rate of polarization within CTLs during killing. J Cell Biol. 220 (10), e202104093 (2021).
- Hermans, I. F., et al. The VITAL assay: a versatile fluorometric technique for assessing CTL- and NKT-mediated cytotoxicity against multiple targets in vitro and in vivo. J Immunol Meth. 285 (1), 25-40 (2004).
- Zaritskaya, L., Shurin, M. R., Sayers, T. J., Malyguine, A. M. New flow cytometric assays for monitoring cell-mediated cytotoxicity. Expert Rev Vaccines. 9 (6), 601-616 (2010).
- Piccinini, C., et al. In vitro CAR-T cell killing: validation of the potency assay. Cancer Immunol Immunother CII. 73 (9), 168 (2024).
- Martinez, E. M., et al. High-throughput flow cytometric method for the simultaneous measurement of CAR-T cell characterization and cytotoxicity against solid tumor cell lines. SLAS Disc Adv Life Sci. 23 (7), 603-612 (2018).
- Jedema, I., van der Werff, N. M., Barge, R. M. Y., Willemze, R., Falkenburg, J. H. F. New CFSE-based assay to determine susceptibility to lysis by cytotoxic T cells of leukemic precursor cells within a heterogeneous target cell population. Blood. 103 (7), 2677-2682 (2004).
- Liu, L., et al. Cellular and molecular imaging of CAR-T cell-based immunotherapy. Adv Drug Delivery Rev. 203, 115135 (2023).
- Liadi, I., et al. Defining potency of CAR+ T cells: Fast and furious or slow and steady. Oncoimmunology. 8 (10), e1051298 (2019).
- Xhangolli, I., et al. Single-cell analysis of CAR-T cell activation reveals a mixed TH1/TH2 response independent of differentiation. Genom Proteom Bioinfo. 17 (2), 129-139 (2019).
- Zhou, Y., et al. Evaluation of single-cell cytokine secretion and cell-cell interactions with a hierarchical loading microwell chip. Cell Rep. 31 (4), 107574 (2020).
- LaBelle, C. A., Zhang, R. J., Hunsucker, S. A., Armistead, P. M., Allbritton, N. L. Microraft arrays for serial-killer CD19 chimeric antigen receptor T cells and single cell isolation. Cytometry J Int Soc Anal Cytol. 103 (3), 208-220 (2023).
- Hellmann, M. J., et al. Heterogeneously deacetylated chitosans possess an unexpected regular pattern favoring acetylation at every third position. Nat Comm. 15 (1), 6695 (2024).
- Wong, K. U., et al. Assessment of chimeric antigen receptor T cytotoxicity by droplet microfluidics in vitro. Antibody Therapeut. 5 (2), 85-99 (2022).
- Antona, S., Platzman, I., Spatz, J. P. Droplet-based cytotoxicity assay: Implementation of time-efficient screening of antitumor activity of natural killer cells. ACS omega. 5 (38), 24674-24683 (2020).
- Subedi, N., et al. An automated real-time microfluidic platform to probe single NK cell heterogeneity and cytotoxicity on-chip. Sci Rep. 11 (1), 17084 (2021).
- Zhang, Y., et al. Enhanced CRISPR/Cas12a-based quantitative detection of nucleic acids using double emulsion droplets. Biosens Bioelect. 257, 116339 (2024).
- Kochenderfer, J. N., et al. Construction and preclinical evaluation of an anti-CD19 chimeric antigen receptor. J Immunother. 32 (7), 689-702 (2009).
- Michaels, Y. S., et al. Precise tuning of gene expression levels in mammalian cells. Nat Comm. 10 (1), 818 (2019).
- Yuan, Y., et al. Droplet encapsulation improves accuracy of immune cell cytokine capture assays. Lab on a Chip. 20 (8), 1513-1520 (2020).
- Brower, K. K., et al. Double emulsion flow cytometry with high-throughput single droplet isolation and nucleic acid recovery. Lab on a Chip. 20 (12), 2062-2074 (2020).
- Kirouac, D. C., et al. Deconvolution of clinical variance in CAR-T cell pharmacology and response. Nat Biotechnol. 41 (11), 1606-1617 (2023).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유