Method Article
Saggio di citotossicità basato su goccioline per valutare le cellule T del recettore dell'antigene chimerico a livello di singola cellula
In questo articolo
Riepilogo
Qui, descriviamo un metodo per creare goccioline a doppia emulsione che incapsulano una cellula T e una cellula bersaglio del cancro per esaminare l'uccisione cellulare a livello di singola cellula. Questo metodo consente la doppia quantificazione sia delle molecole citotossiche che dell'apoptosi delle cellule bersaglio all'interno di un'ampia popolazione di cellule T.
Abstract
La valutazione del potenziale citotossico delle terapie basate sulle cellule T, come i trattamenti con cellule T del recettore chimerico dell'antigene (CAR), è fondamentale per valutarne l'efficacia ed è un prerequisito per l'applicazione clinica. Tuttavia, i saggi di citotossicità tradizionali sono condotti come saggi di massa e non forniscono informazioni dettagliate sull'eterogeneità funzionale della popolazione di cellule T CAR. In questo studio, descriviamo un metodo basato su goccioline a doppia emulsione che consente la co-incapsulazione su larga scala di singole cellule CAR T effettrici con singole cellule bersaglio, consentendo al contempo la doppia quantificazione di entrambe le molecole effettrici citotossiche dalle cellule T e la morte cellulare della cellula bersaglio. Il protocollo delinea un metodo per la generazione e la purificazione di cellule CAR T CD19-specifiche, seguite dalla loro co-incapsulazione in goccioline con la linea cellulare CD19+ JeKo-1, insieme a reagenti per visualizzare la secrezione di molecole effettrici citotossiche (Granzima B) e la morte cellulare (utilizzando ioduro di propidio, PI). Dimostriamo come generare goccioline contenenti singole cellule CAR T e cellule bersaglio utilizzando un dispositivo microfluidico disponibile in commercio per la generazione di goccioline a doppia emulsione. Inoltre, forniamo esempi di come analizzare la diversità funzionale delle cellule CAR T nelle goccioline utilizzando apparecchiature standard per citometria a flusso. Infine, descriviamo brevemente la cinetica temporale e l'eterogeneità dell'uccisione delle cellule T CAR CD19-specifiche. Sebbene questo metodo si concentri sulla morte cellulare a seguito di un attacco di cellule T CAR, è anche adattabile per esaminare altri tipi di cellule T, cellule immunitarie citotossiche e funzioni delle cellule effettrici, come la secrezione di citochine.
Introduzione
La terapia con cellule T del recettore dell'antigene chimerico (CAR) è un campo in rapida espansione dell'immunoterapia del cancro cellulare che si è dimostrata efficace contro varie forme di leucemia, linfoma1 e mieloma multiplo2. Le cellule T CAR sono generate modificando le cellule T con un recettore sintetico dell'antigene in grado di legarsi selettivamente a proteine di superficie come il CD19 o l'antigene di maturazione delle cellule B (BCMA), espresso sulle cellule B, sulle plasmacellule e sulle loro controparti maligne. I recenti progressi nella progettazione delle CAR hanno permesso di colpire più antigeni contemporaneamente3, basandosi su più segnali di input o legandosi esclusivamente ad antigeni associati al tumore, come le isoforme proteiche specifiche4. Inoltre, diversi CAR sono attualmente in fase di sperimentazione contro bersagli di tumori non ematologici5.
I test di citotossicità sono essenziali sia per lo sviluppo di CAR che per il controllo di qualità prima del rilascio dei prodotti clinici 6,7,8. Tuttavia, la maggior parte dei test attuali dipende da popolazioni di massa di cellule CAR T effettrici aggiunte in eccesso alle linee cellulari tumorali, il che può portare a risultati falsi positivi a causa degli effetti degli astanti9 e risultare in una scarsa correlazione tra gli esiti in vitro e in vivo 10. Poiché la proliferazione delle cellule T e la persistenza a lungo termine dipendono dai segnali ricevuti durante gli eventi di attivazione iniziali11,12, è di grande interesse esaminare attentamente gli eventi citotossici a livello di singola cellula.
Per affrontare i limiti delle metodologie di massa, gli studi di citotossicità a livello di singola cellula possono essere eseguiti utilizzando la citometria a flusso 13,14,15,16,17 e saggi basati sull'imaging 18. Tuttavia, anche se la citometria a flusso standard offre una risoluzione a singola cellula per quantificare e caratterizzare sia le cellule effettrici che quelle bersaglio, non può determinare direttamente la capacità citotossica specifica delle singole cellule CAR T nei confronti delle cellule bersaglio. Inoltre, l'imaging delle singole cellule CAR T che interagiscono con i rispettivi bersagli in blocco è impegnativo e richiede molto tempo a causa della motilità costante delle cellule. Per affrontare queste sfide, sono stati sviluppati nuovi strumenti per l'analisi di singole cellule che si basano sull'accoppiamento di cellule effettrici e bersaglio in spazi spazialmente ristretti utilizzando array di micropozzetti 19,20,21, array di microraft22, microchip23 e microfluidica a goccia 24,25,26. Questi strumenti offrono una maggiore sensibilità di misura, consentendo l'indagine di un minor numero di cellule utilizzando volumi di reagenti ridotti. Tuttavia, permangono diverse sfide, tra cui l'efficiente accoppiamento delle cellule, il numero limitato di campioni che possono essere analizzati, la dipendenza solo dall'analisi basata sull'imaging e le difficoltà di recuperare popolazioni cellulari vitali per ulteriori analisi.
In questo caso, utilizziamo un dispositivo microfluidico disponibile in commercio che consente un approccio notevolmente semplificato alla microfluidica basata su goccioline. Questo dispositivo consente di eseguire analisi e saggi avanzati su singole cellule utilizzando goccioline a doppia emulsione (DE) altamente stabili. Rispetto ai saggi microfluidici a micropozzetti e a goccioline, il protocollo qui descritto non richiede una vasta esperienza in microfludics.
Le goccioline DE sono piccoli compartimenti sferici composti da un guscio d'olio con un nucleo acquoso sospeso in una soluzione acquosa. La gocciolina acquosa contiene e trattiene le cellule, il secretoma cellulare, il mezzo cellulare e i reagenti del saggio, consentendo l'esecuzione di saggi complessi all'interno di ciascun compartimento. Utilizzando il dispositivo microfluidico, le goccioline di DE vengono generate con un volume impostato (circa 100 pL) adatto per saggi di singola cellula o di interazione cellula-cellula nei mammiferi, che possono essere generati in numero molto elevato (circa 750.000 goccioline per campione) e in un breve lasso di tempo (circa 10 minuti per 8 campioni) da utenti generici di laboratorio senza conoscenze specialistiche in microfluidica. Le goccioline generate possono essere sospese nel mezzo cellulare, consentendo così la diffusione trans-shell di O2 e CO2 e il tamponamento dell'interno, trattenendo allo stesso tempo molecole idrofile e più grandi come le molecole effettrici secrete dalla cellula. Le cellule esaminate sono quindi adeguatamente tamponate, consentendo l'esame nel tempo delle interazioni cellula-cellula e delle dinamiche temporali. A differenza delle goccioline di emulsione singola (ad esempio, goccioline di acqua nell'olio)27, le goccioline DE sono strutture robuste che non si fondono o si fondono negli incubatori cellulari standard. Grazie alla loro stabilità e alla fase esterna acquosa, sono compatibili anche con le procedure di analisi a valle come la citometria a flusso tradizionale. Queste goccioline di picolitri generate dal dispositivo microfluidico possono, quindi, essere utilizzate per l'analisi di singole cellule ad alto rendimento della funzione cellulare per chiarire l'eterogeneità funzionale nascosta nei tradizionali saggi di massa.
Qui, descriviamo un protocollo che utilizza goccioline di DE per esaminare il potenziale citotossico dei CAR CD19-specifici nei confronti delle cellule di linfoma. Il nostro protocollo consente l'analisi di singole cellule dell'uccisione del bersaglio e della secrezione di Granzima B (GzmB) e rivela che circa il 20% delle cellule CAR T esaminate qui ha un potenziale di uccisione immediato.
Protocollo
Le cellule T CAR utilizzate in questo studio sono state generate dalla trasduzione lentivirale di cellule T primarie con un costrutto CAR CD19scFv-CD28-CD3ζ-tNGFR in un laboratorio OGM certificato di biosicurezza di classe 2 e declassificate dopo 4 giorni secondo lo standard dell'istituto. Le cellule T purificate provenivano da materiale in eccesso scartato da donazioni di sangue rese anonime ed erano esenti da ulteriori approvazioni etiche secondo la legge danese.
1. Generazione di cellule T CAR
NOTA: Il nome dei reagenti utilizzati di seguito utilizza nomi generici e abbreviati. Il nome commerciale completo si trova tra parentesi nella Tabella dei materiali.
- Attivazione, trasduzione ed espansione delle cellule T
NOTA: L'espressione stabile delle cellule T CAR CD19 è stata ottenuta attraverso la trasduzione lentivirale di cellule T umane primarie isolate da cellule mononucleate di sangue periferico fresco (PBMC) utilizzando un kit di isolamento delle cellule T a selezione negativa. L'anti-CD19 CAR utilizzato è un costrutto di seconda generazione composto da un frammento variabile a catena singola FMC63 (scFv), una cerniera CD28 e un dominio transmembrana, un dominio costimolatorio CD28, un dominio di attivazione CD3ζ28 e una versione troncata del recettore del fattore di crescita nervoso (tNGFR) per il monitoraggio e l'arricchimento delle cellule che esprimono CAR29. Il plasmide vettore di trasferimento è stato sintetizzato de novo e il lentivirus di terza generazione è stato prodotto combinandolo con pMDLg/pRRE (Addgene plasmid #12251), pRSV-Rev (Addgene plasmid #12253) e pMD2.G (Addgene plasmid #12259)30. Gli ultimi tre plasmidi furono un dono di Didier Trono. Il virus grezzo è stato concentrato utilizzando un reagente a base di PEG e la molteplicità dell'infezione (MOI) è stata determinata trasducendo le cellule SUP-T1 e misurando il tNGFR mediante citometria a flusso secondo il protocollostandard 31.- Trasferire 2 x 106 cellule T umane primarie in un piatto di coltura a 12 pozzetti e stimolarle con perle rivestite di CD3/CD28 a un rapporto perlina-cellula 1:1 in 1 mL di terreno RPMI-1640 completo (10% di siero fetale bovino inattivato termicamente, 1% di penicillina/streptomicina) integrato con 100 unità/mL di interleuchina-2 umana ricombinante (IL-2). Incubare le cellule a 37°C in un incubatore umidificato al 5% di CO2 per 24 ore.
- Aggiungere particelle lentivirali alle cellule T attivate con un MOI di 5-10. Mescolare delicatamente e incubare le cellule per 72 ore. Includere le cellule T non trasdotte (NTD) come controllo negativo.
- Il 3° giorno dopo la trasduzione, rimuovere le perle di attivazione CD3/CD28 raccogliendo le cellule T in una provetta da 1,5 ml e posizionando la provetta su un supporto magnetico per 1-2 minuti. Trasferire il surnatante contenente le cellule in una nuova provetta da 1,5 mL.
- Eseguire un conteggio delle cellule utilizzando un contatore di cellule automatizzato e regolare la densità cellulare a 1 x 106 cellule/mL in un terreno RPMI-1640 completo integrato con 100 U/mL di IL-2. Continuare ad espandere le cellule T fino a quando la conta totale delle cellule T CAR raggiunge almeno 1,5 x 106 (di solito circa 6 x 106 cellule T in totale) nella sospensione prima di procedere con l'arricchimento di NGFR (vedi sotto).
- Monitorare la conta delle cellule a giorni alterni e regolare la concentrazione a 1 x 106 cellule/mL aggiungendo terreno fresco integrato con 100 unità/mL di IL-2 per garantire uno stato ottimale delle cellule durante l'espansione.
- Arricchimento di cellule T che esprimono CAR
- Trasferire 6 x 10,6 o più cellule T trasdotte in una provetta da 15 mL e centrifugare a 300 x g per 5 minuti. Risospendere il pellet cellulare in 320 μL di PBS integrato con albumina sierica bovina (BSA) allo 0,5% per produrre PBSA e aggiungere 40 μL di biglie magnetiche anti-NGFR. Mescolare bene e incubare con ghiaccio per 15 minuti.
NOTA: Questo protocollo presuppone un'efficienza di trasduzione di circa il 25%, con conseguente >1,5 x 106 cellule T CAR dopo l'arricchimento. Si sconsiglia di iniziare con meno di 6 x 106 cellule, poiché ciò potrebbe comportare uno scarso recupero delle cellule T CAR. - Aggiungere 1640 μL di PBSA per portare il volume finale a 2 mL, quindi procedere con la separazione magnetica utilizzando colonne di separazione secondo le istruzioni del produttore.
- Trasferire 6 x 10,6 o più cellule T trasdotte in una provetta da 15 mL e centrifugare a 300 x g per 5 minuti. Risospendere il pellet cellulare in 320 μL di PBS integrato con albumina sierica bovina (BSA) allo 0,5% per produrre PBSA e aggiungere 40 μL di biglie magnetiche anti-NGFR. Mescolare bene e incubare con ghiaccio per 15 minuti.
- Rilevamento dell'espressione di CAR mediante citometria a flusso
NOTA: Si consiglia di determinare la percentuale di cellule che esprimono CAR e la loro vitalità a questo punto, per garantire che le cellule siano corrette prima di eseguire il test seguente. A questo punto è possibile determinare anche il rapporto CD4 e CD8 e il fenotipo della memoria. Vedere la Figura 1 per i grafici rappresentativi.- Trasferire 2,5 x 105 cellule T da colture trasdotte e non trasdotte in provette separate per citometria a flusso. Lavare le cellule 2 volte con 200 μL di PBS, centrifugando a 300 x g per 5 minuti dopo ogni lavaggio.
- Preparare una miscela di anticorpi contenente anticorpi anti-CD19 CAR FMC63 Idiotype PE, anti-CD3 BV480 e anti-NGFR FITC, ciascuno diluito 1:100 in PBS. Risospendere le cellule in 50 μl della miscela di anticorpi e incubare a 4 °C per 20 minuti.
- Lavare le cellule 2 volte con 200 μL di PBS, centrifugando a 300 x g per 5 minuti dopo ogni lavaggio. Risospendere le cellule in 200 μL di PBS e analizzarle utilizzando la citometria a flusso.
2. Generazione di goccioline che incapsulano le cellule T e le cellule bersaglio
NOTA: Prima dell'incapsulamento, le cellule T e le cellule JeKo-1 vengono colorate con diverse colorazioni cellulari per monitorare il contenuto cellulare delle goccioline. Le cellule vengono incapsulate con reagenti per il saggio e incubate per 2-6 ore prima che le goccioline vengano analizzate sul citometro a flusso (vedere Figura 2).
- Colorazione delle cellule prima dell'incapsulamento
- Preparare le soluzioni di lavoro di due coloranti fluorescenti (abbiamo utilizzato un colorante viola e un colorante rosso lontano) diluendo le soluzioni madre (preparate secondo le istruzioni del produttore) 1:5.000 in dPBS.
- Per ogni donatore, trasferire 2,5 x 106 CAR T, 2,5 x 106 NTD T e 15 x 106 cellule JeKo-1 in provette da centrifuga separate (provette da 15 mL o 50 mL) e centrifugare a 300 x g per 5 minuti. In questo esperimento, 0,5 x 106 cellule effettrici sono state incapsulate con 1,5 x 106 cellule bersaglio per ogni campione preparato.
NOTA: Il numero di cellule trasferite qui è inteso per campioni di incapsulamento 4x con ogni tipo di cellula effettrice per ogni donatore. Ridurre il numero di cellule e reagenti in base al numero di campioni necessari. Inoltre, il numero esatto di cellule per campione può essere scalato in base alle esigenze sperimentali. - Rimuovere il surnatante e risospendere i pellet delle celle effettrici nella soluzione di lavoro 1:5.000 del colorante fluorescente viola e i pellet della cella bersaglio (JeKo-1) nella soluzione di lavoro 1:5.000 del colorante fluorescente rosso lontano. Risospendere bene le cellule con una pipetta e ad una concentrazione di 1 x 106 cellule/mL di soluzione colorante.
- Incubare le cellule per 20 minuti in un incubatore a CO2 umidificato a 37 °C. Centrifugare le cellule a 300 x g per 5 minuti, rimuovere il surnatante e risospendere in 15 mL di terreno RPMI-1640 completo per lavare le cellule.
- Ripetere il lavaggio e centrifugare a 300 x g per 5 min. Rimuovere il surnatante e risospendere i pellet di celle effettrici in 225 μl di RPMI-1640 completo e i pellet di cellule target in 450 μl di RPMI-1640 completo.
- Aggiungere 30 μl di un mezzo gradiente alle sospensioni delle celle effettrici e 60 μl dello stesso mezzo gradiente alle sospensioni delle cellule target. Risospendere bene la soluzione madre del terreno gradiente prima del pipettaggio.
- Aggiungere 15 μL di 20 μg/mL di PI stock alle sospensioni di cellule effettrici e 30 μL di PI stock alle sospensioni di cellule target. La concentrazione finale di PI sarà infine di 1 μg/mL dopo che il substrato del Granzima B (GzmB) è stato aggiunto di seguito.
- Preparare una diluizione 1:10 del substrato GzmB in RPMI-1640 completo e aggiungere 30 μl di questa diluizione del substrato GzmB alla sospensione della cellula effettrice e 60 μl di essa alle sospensioni della cellula target. Mescolare bene con la pipetta.
NOTA: Il volume totale dei reagenti aggiunti a ciascun pellet di cella effettrice dovrebbe ora essere di 300 μl e di 600 μl per i pellet di celle target. La concentrazione del mezzo a gradiente in queste soluzioni dovrebbe essere del 10%, la concentrazione PI di 1 μg/mL e la concentrazione del substrato GzmB di 1:100. - Marcatura alternativa con anticorpi CD3, CD4 e CD8
NOTA: In alcuni casi, potrebbe essere interessante marcare ulteriormente le cellule effettrici prima del co-incapsulamento con le cellule bersaglio. Qui mostriamo la prova di principio per questo tipo di marcatura utilizzando anticorpi CD3, CD4 e CD8 e PBMC (vedi Figura 3).- Trasferire 2,0 x 106 PBMC in una provetta da 1,5 mL e centrifugare le cellule verso il basso per 5 minuti a 300 x g. Rimuovere il surnatante e risospendere il pellet cellulare in 200 μL di dPBS con lo 0,5% di BSA. Dividere il contenuto in due provette da 2 mL.
- Aggiungere 5 μL di anti-CD3-APC e 5 μL di anti-CD4-StarBright Violet 760 in una delle provette. Aggiungere 20 μL di anti-CD3-FITC e 5 μL di anti-CD8-StarBright Violet 760 all'altra provetta.
- Mescolare bene e incubare per 30 minuti a temperatura ambiente al buio. Aggiungere 1 mL di tampone di lavaggio alle cellule, centrifugare a 300 x g per 5 minuti, rimuovere il surnatante e risospendere i pellet cellulari in 1 mL di dPBS con BSA allo 0,5%.
- Centrifugare le celle a 300 x g per 5 minuti, rimuovere il surnatante e risospendere i pellet cellulari in 150 μl di RPMI senza rosso fenolo e con gradiente del 10%. Incapsulare come descritto nel passaggio 2.2 utilizzando RPMI senza rosso fenolo, soluzione stabilizzante al 33% per le cellule e terreno a gradiente al 10% come mezzo esterno.
- Incapsulamento delle cellule
- Preriscaldare una cartuccia di incapsulamento e una soluzione stabilizzante a temperatura ambiente prima dell'incapsulamento. Preparare una scorta di terreno esterno costituito da un terreno RPMI-1640 completo, una soluzione stabilizzante al 33% per le cellule e un mezzo di gradiente al 10%.
- Per ogni campione di incapsulamento, preparare una soluzione di campione cellulare con cellule effettrici target miste. Risospendere le soluzioni cellulari ben preparate con una pipetta e miscelare 65 μl di sospensione di cellule effettrici preparate con 65 μl di sospensione di cellule target preparate in provette da 1,5 mL (entrambe preparate nella fase 2.1).
- Procedere immediatamente con il caricamento dei pozzetti indicati della cartuccia di incapsulamento con i reagenti nell'ordine seguente per garantire un corretto incapsulamento. Caricare un set di pozzetti per ogni campione di incapsulamento preparato.
Bene #A: 400 μL di terreno esterno.
Ben #D: 40 μL di terreno esterno sul piccolo ripiano.
Ben #C: 120 μL di soluzione premiscelata con cellule bersaglio (JeKo-1) e cellule effettrici. Risospendere bene le cellule con una pipetta prima del caricamento.
Pozzo #B: 250 μL di olio.
NOTA: Ogni cartuccia può essere caricata con un massimo di 8 campioni per l'incapsulamento in parallelo. - Procedere immediatamente con la sigillatura della guarnizione e il caricamento della cartuccia nello strumento evitando di inclinare, scuotere o urtare la cartuccia caricata. Sigillare accuratamente la guarnizione sulla cartuccia.
- Trasferire con cautela la cartuccia nel dispositivo microfluidico e avviare l'incapsulamento come descritto nel manuale dell'utente.
- Le goccioline generate hanno densità più elevate rispetto al mezzo esterno circostante e sedimenteranno rapidamente sul fondo del pozzetto di raccolta (Well #D). Raccogliere ogni produzione di goccioline (tutte le goccioline e il terreno esterno circostante) risospendendo le goccioline sedimentate dal pozzetto #D nel terreno di sovrapposizione e trasferendole in una provetta di DNA a basso legame da 2 ml con coperchio. Lavare bene #D con il mezzo esterno rimanente dal pozzetto #A per raccogliere le goccioline rimanenti.
- Quando le goccioline si sono sedimentate nelle provette di raccolta (ci vuole circa 1 minuto), verificare la produzione di goccioline esaminandole in un microscopio a campo chiaro. A tale scopo, riempire un puntale per pipetta da 10 μl con un campione: circa 1/3 con goccioline dalla superficie della fase gocciolina (fase bianca) e circa 2/3 con il mezzo esterno sovrapposto per filtrare il puntale. Caricare immediatamente il campione su un vetrino a 8 camere ed esaminare le goccioline mediante microscopia a campo chiaro con ingrandimento 4x e 20x per confermare il caricamento delle goccioline con le cellule.
NOTA: È importante che le goccioline in questo modo vengano aspirate in un volume maggiore del mezzo circostante.
- Incubazione
NOTA: Le goccioline possono ora essere incubate in 2 mL di provette a basso legame di DNA in un incubatore standard umidificato a 37 °C, 5% di CO2. Si consiglia di utilizzare questi tubi, in quanto hanno proprietà superficiali ottimali per la coltura di goccioline.- Con un ago per siringa (23G), perforare con cura e sicurezza il coperchio del numero richiesto di provette di DNA a basso legame da 2 mL. Ciò garantirà la libera diffusione di CO2/O2 prevenendo l'evaporazione del fluido.
- Aggiungere 1 mL di terreno esterno a ciascuna provetta di incubazione. Le goccioline devono essere incubate con almeno 5 volte il volume del terreno esterno per garantire un corretto buffering. Il volume del mezzo esterno aggiunto può essere aumentato a seconda del metabolismo delle cellule applicate.
- Risospendere le goccioline generate nel terreno di sovrapposizione e dividere ciascuna produzione in tre delle provette di incubazione preparate (una per ogni punto di misurazione temporale). Le goccioline sono pesanti e sedimentano velocemente, ed è quindi importante risospendere lo stock tra un trasferimento e l'altro.
NOTA: Il numero di provette di incubazione in cui vengono suddivise le goccioline prodotte può essere variato, ma si consiglia di suddividere una produzione in non più di 4 provette di incubazione per garantire che ogni campione contenga un numero sufficiente di eventi per l'analisi. - Posizionare le provette in posizione verticale nell'incubatore per 2 ore, 4 ore o 6 ore di incubazione dopo la generazione di goccioline.
3. Analisi a valle delle goccioline
- Microscopia
- Dopo l'incubazione, trasferire un piccolo numero di goccioline su un vetrino da microscopio come descritto al punto 2.2.7 e analizzarle mediante microscopia a campo chiaro e a fluorescenza utilizzando un microscopio a fluorescenza standard con configurazione laser e filtro appropriata.
NOTA: Le goccioline possono essere rilevate mediante microscopia a campo chiaro. Le cellule T colorate in viola possono essere rilevate con un filtro DAPI, le cellule JeKo-1 colorate in rosso lontano con un filtro APC, il segnale GzmB-FAM con un filtro FITC e il segnale PI con un filtro PE. Il segnale PI di maggiore interesse può essere difficile da visualizzare al microscopio poiché le cellule apoptotiche precoci hanno un'emissione di picco inferiore rispetto alle cellule apoptotiche tardive. Vedere la Figura 4 per i dati rappresentativi.
- Dopo l'incubazione, trasferire un piccolo numero di goccioline su un vetrino da microscopio come descritto al punto 2.2.7 e analizzarle mediante microscopia a campo chiaro e a fluorescenza utilizzando un microscopio a fluorescenza standard con configurazione laser e filtro appropriata.
- Citometria a flusso
- Dopo l'incubazione, risospendere ogni campione di gocciolina nel terreno di sovrapposizione e trasferirlo in provette FACS da 5 mL. Analizzare le goccioline utilizzando un citometro a flusso standard seguendo le linee guida generali elencate di seguito.
- Utilizzare un citometro a flusso con una configurazione laser e filtro appropriata. Con il pannello selezionato di colorazioni cellulari e saggi, la compensazione del colore non è richiesta sul citometro a flusso utilizzato qui. Se vengono applicati altri colori o la configurazione del citometro a flusso applicato è diversa, potrebbe essere necessaria una compensazione.
- Utilizzare FSC-H come trigger di soglia per escludere il rumore di fondo da piccoli eventi petroliferi.
- Le goccioline sono pesanti e si depositano sul fondo dei tubi FACS. Assicurarsi che il SIP raggiunga le goccioline. Le goccioline devono essere sospese in almeno 5 volte il volume del tampone esterno alle goccioline prima dell'acquisizione.
- Gli eventi droplet vengono acquisiti utilizzando l'alta velocità. Registrare i segnali di altezza di intensità (H) per FSC e SSC e i fluorofori esaminati poiché le misurazioni dell'altezza di intensità vengono utilizzate durante l'analisi delle goccioline. Regola i guadagni per avere una corretta separazione degli eventi positivi e negativi.
NOTA: Abbiamo utilizzato il canale FITC per misurare il segnale GzmB, il canale Pacific Blue per rilevare le cellule T colorate in viola, il canale APC per rilevare le cellule JeKo-1 colorate in rosso e il canale PE per rilevare il segnale PI. - Registra un numero sufficiente di eventi per l'analisi a valle. Qui, abbiamo registrato 4,5 - 8,3 x 103 delle goccioline di co-incapsulamento per punto temporale.
- Lavare il citometro a flusso attraverso il SIP dopo ogni serie di acquisizioni di goccioline, utilizzando soluzioni standard di pulizia e risciacquo. Pulire accuratamente il citometro a flusso al termine dell'esperimento. Vedere la Figura 4 e la Figura 5 per i dati rappresentativi.
- Dopo l'incubazione, risospendere ogni campione di gocciolina nel terreno di sovrapposizione e trasferirlo in provette FACS da 5 mL. Analizzare le goccioline utilizzando un citometro a flusso standard seguendo le linee guida generali elencate di seguito.
- Analisi dei dati
- Calcolare la percentuale di cellule T che secernono GzmB in base alla percentuale di cellule T positive per GzmB e di co-incapsulazioni di cellule JeKo-1 normalizzate alla vitalità delle cellule T determinata nelle popolazioni di goccioline di sole cellule T al momento in questione, come segue:
Goccioline Cellula T+, Jeko-1+, GzmB+ / (Goccioline cellula T+, Jeko-1+ - Goccioline cellula T morta+, Jeko-1+)
dove Droplets dead T cell+, Jeko-1+ è stimato dalla morte in goccioline con solo cellule T: Dropletsdead T cell+, Jeko-1+ = DropletsT cell+, Jeko-1+ x Droplets dead T cell+, Jeko-1- / DropletsTcell+, Jeko-1-. - Calcola la percentuale di cellule T che hanno ucciso le loro cellule bersaglio come segue:
Percentuale di cellule T citotossiche = (Morte osservata - Morte di fondo)/(100 - Morte di fondo)
dove la morte di fondo è la morte presente all'interno di goccioline (cellula T+, Jeko-1+) derivante da morte non correlata all'uccisione o morte avvenuta prima dell'incapsulamento. - Stimare la morte di fondo da morte cellulare in goccioline (T cell-, Jeko-1-) e goccioline (T cell-, Jeko-1+):
Morte di fondo = (1- (1- rapporto di mortalità in DropletsTcell-, Jeko-1+) x (1- rapporto di morte inDroplets T cell+, Jeko-1-)) x 100
dove il tasso di morte è misurato direttamente come la % di gocciolina PI positiva nelle goccioline di sole cellule T e nelle goccioline di sola cellule JeKo-1, rispettivamente. Tutti i calcoli vengono eseguiti con numeri di campionamento specifici per il tempo.
- Calcolare la percentuale di cellule T che secernono GzmB in base alla percentuale di cellule T positive per GzmB e di co-incapsulazioni di cellule JeKo-1 normalizzate alla vitalità delle cellule T determinata nelle popolazioni di goccioline di sole cellule T al momento in questione, come segue:
Risultati
Dopo la trasduzione, le cellule T sono state analizzate per l'espressione di CAR mediante citometria a flusso utilizzando anticorpi anti-CD3 e anti-NGFR. La popolazione di cellule T CAR è stata successivamente arricchita utilizzando biglie magnetiche anti-NGFR, ottenendo una purezza di oltre il 98% per entrambi i donatori (Figura 1A-B). Sono stati inoltre quantificati il rapporto CD4/CD8 e il fenotipo di memoria delle cellule CAR selezionate utilizzate, utilizzando una strategia di gate standard che utilizza gli anticorpi CCR7 e CD45RA. Questi dati mostrano che il rapporto CD4/CD8 delle cellule CAR T utilizzate era di 0,73 e che le cellule erano principalmente di fenotipo di memoria naive (Figura 1C-E).
Le cellule CAR T e le cellule JeKo-1 sono state colorate rispettivamente con coloranti viola e rosso lontano e incapsulate in goccioline DE50 insieme ai reagenti del saggio Substrato GzmB e PI (Figura 2). In alternativa, le cellule T CAR possono anche essere marcate utilizzando anticorpi come anti-CD4 o anti-CD8 (Figura 3), consentendo una caratterizzazione più dettagliata delle cellule T. Ogni sospensione di cellule T (CAR, T o NTD) è stata miscelata con una sospensione di cellule JeKo-1 immediatamente prima dell'incapsulamento in un rapporto effettore: cellule bersaglio di 1:3 (0,5 x 106 cellule T e 1,5 x 106 JeKo-1). Dopo l'incapsulamento, ogni produzione di goccioline (cellule T CAR + JeKo-1 e NTD + JeKo-1) è stata divisa in tre provette di incubazione per 2 ore, 4 ore e 6 ore di incubazione, rispettivamente. Le cellule sono state incubate all'interno delle goccioline a 37 °C in CO2 al 5% e poi analizzate al microscopio e citometria a flusso nei punti temporali indicati.
Abbiamo eseguito la microscopia a fluorescenza di goccioline a doppia emulsione dopo 4 ore di incubazione (Figura 4). L'intensità del segnale di fluorescenza verde (FITC) illustra il livello di attività GzmB secreta delle cellule CAR T o NTD all'interno delle goccioline DE50. La Figura 4B presenta le immagini al microscopio a contrasto di fase e a fluorescenza di una singola gocciolina GzmB-positiva contenente una cellula T CAR e una cellula bersaglio JeKo-1 a stretto contatto.
Successivamente, le goccioline di DE50 sono state analizzate mediante citometria a flusso per quantificare la percentuale di cellule CAR T con secrezione precoce di GzmB e attività citotossica di uccisione delle cellule (Figura 5). La colorazione pre-incubazione delle cellule bersaglio di JeKo-1 con un colorante rosso lontano e delle cellule T effettrici con un colorante viola prima dell'incapsulamento ha facilitato l'identificazione di tre distinte popolazioni di goccioline contenenti cellule, poiché le cellule sono distribuite in goccioline in base alla distribuzione di Poisson. Le popolazioni di goccioline identificate sono goccioline con solo cellule T, solo cellule JeKo-1 e cellule T e cellule JeKo-1 insieme (Figura 5A). Le goccioline che co-incapsulano le cellule T con le cellule JeKo-1 sono state gated e analizzate per i segnali che indicano l'attività di GzmB (Figura 5B) e la morte cellulare, come indicato da PI (Figura 5C).
L'incapsulamento delle cellule in goccioline segue la distribuzione di Poisson e si ottengono quattro diverse popolazioni di goccioline (Figura 6A). La Figura 6B mostra il livello di goccioline positive al GzmB all'interno di tutte le popolazioni di goccioline dopo 6 ore di incubazione delle goccioline, da cui è possibile determinare la percentuale di cellule T spontanee secernenti GzmB. Questi dati indicano l'elevata specificità del metodo, poiché solo le cellule T CAR secernono GzmB.
Infine, abbiamo quantificato i livelli di GzmB e PI in punti temporali, dopo 2 ore, 4 ore e 6 ore di co-incubazione. Per riferimento, le goccioline contenenti solo cellule T e solo cellule JeKo-1 sono state analizzate per esaminare la morte cellulare di fondo in ciascuna popolazione (Figura 6C). La morte cellulare di fondo è stata utilizzata per determinare la percentuale di cellule T vive che secernono GzmB e che uccidono le cellule bersaglio nella popolazione di cellule effettrici (Figura 7), come descritto nel passaggio 3.3. Le cellule T CAR di due donatori hanno mostrato un aumento dipendente dal tempo sia della secrezione di GzmB indotta dalle cellule bersaglio che dell'attività di uccisione cellulare. Quasi il 36% delle cellule CAR T vive del donatore 1 e il 31% del donatore 2 avevano secreto GzmB dopo 6 ore di co-incapsulamento con la cellula bersaglio, un aumento significativo rispetto alle cellule T di controllo NTD (Figura 7A). Di conseguenza, circa il 21% delle cellule CAR T del donatore 1 e il 22% delle cellule CAR T del donatore 2 avevano ucciso le cellule bersaglio, come indicato da un segnale PI positivo (Figura 7B). La percentuale di cellule CAR T che avevano secreto GzmB superava la percentuale di cellule bersaglio uccise in ogni momento, coerentemente con la sequenza attesa di eventi nella citotossicità mediata da GzmB. Nel loro insieme, questi dati mostrano che il metodo qui presentato consente la caratterizzazione dell'eterogeneità della citotossicità delle singole cellule T all'interno di una popolazione di cellule, nonché il confronto tra diverse popolazioni.
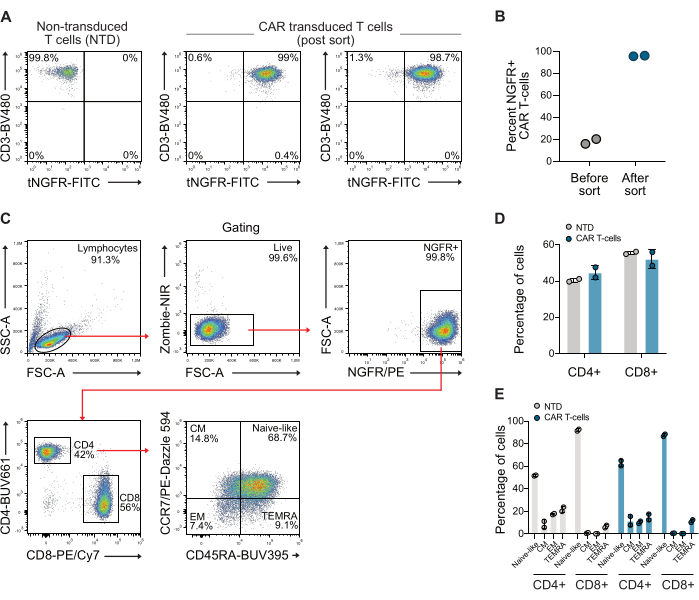
Figura 1: Grafici rappresentativi della citometria a flusso dopo lo smistamento dell'NGFR. (A) Dopo circa 10 giorni di espansione, le cellule T CAR sono state selezionate utilizzando microsfere specifiche per NGFR e smistamento magnetico, ottenendo una popolazione di cellule T CAR composta per il >98% da cellule T CAR. (B) Quantificazione delle cellule T CAR da due donatori utilizzate in questo studio prima e dopo lo smistamento. (C) Strategia di gating utilizzata per esaminare il rapporto CD4/CD8 e il fenotipo di memoria delle cellule T. (D) Quantificazione dei cellule CD4 e CD8 delle cellule T utilizzate. (E) Quantificazione del fenotipo di memoria delle cellule T utilizzate. Abbreviazione: CM = memoria centrale, EM = memoria effettrice, NTD = non trasdotta, TEMRA = cellule effettrici terminalmente differenziate. Clicca qui per visualizzare una versione più grande di questa figura.
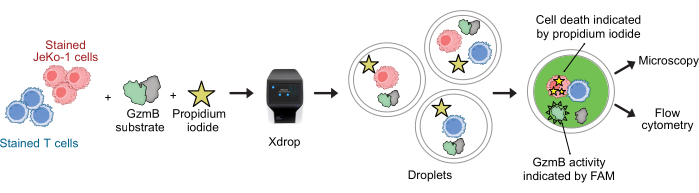
Figura 2: Flusso di lavoro per il saggio combinato di secrezione e citotossicità di GzmB con risoluzione di singole cellule in goccioline. Prima dell'incapsulamento nelle goccioline di DE, le cellule bersaglio e quelle effettrici vengono colorate separatamente utilizzando colorazioni di cellule viola e rosso lontano. Utilizzando il dispositivo microfluidico e la cartuccia di incapsulamento, le cellule effettrici vengono co-incapsulate con le cellule bersaglio in goccioline insieme al terreno cellulare, al PI e al substrato peptidico GzmB marcato con FAM. Il saggio e l'incubazione avvengono all'interno delle goccioline. L'attività secreta di GzmB è indicata dall'emissione di fluorescenza verde che si verifica dopo che GzmB ha scisso il substrato. La morte cellulare è indicata dal PI. Dopo l'incubazione, le goccioline di DE50 vengono analizzate mediante microscopia e/o citometria a flusso. Clicca qui per visualizzare una versione più grande di questa figura.
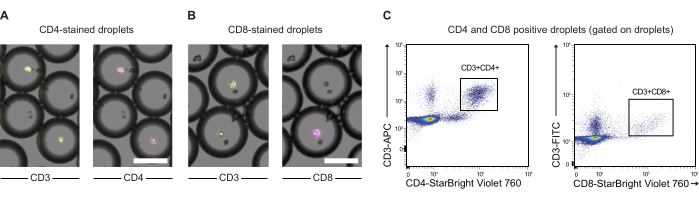
Figura 3: Analisi di PBMC incapsulate in goccioline pre-marcate con anticorpi anti-CD3, anti-CD4 e anti-CD8. (A) Immagini al microscopio di goccioline con PBMC incapsulate pre-marcate con anticorpi anti-CD3 (APC) e anti-CD4 (NIR). Barra di scala = 100 μm. (B) Come (A), ma con marcatura CD3 (FITC) e anti-CD8 (NIR). Barra di scala = 100 μm. (C) Analisi in citometria a flusso delle stesse goccioline. Clicca qui per visualizzare una versione più grande di questa figura.
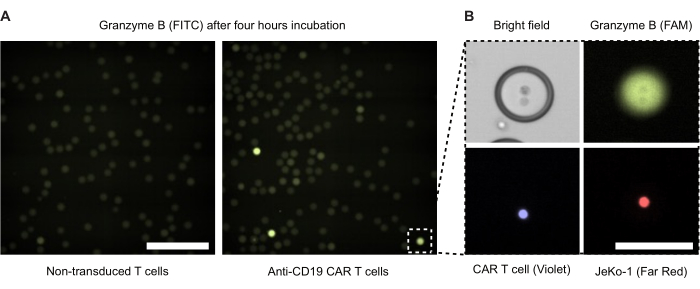
Figura 4: Immagini al microscopio di goccioline con cellule effettrici e cellule bersaglio. Le immagini sono state scattate dopo 4 ore di incubazione in un incubatore cellulare umidificato standard a 37 °C, 5% di CO2 2 . (A) Goccioline da un campione con cellule NTD e JeKo-1 incapsulate (a sinistra) o cellule T CAR e cellule JeKo-1 (a destra) visualizzate mediante microscopia a fluorescenza utilizzando il canale FITC per rilevare goccioline positive al GzmB (verdi). Barra di scala = 500 μm. (B) Una singola goccia ripresa mediante contrasto di fase, FITC (GzmB), APC (cella JeKo-1) e DAPI (cellula CAR T). Barra di scala = 100 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
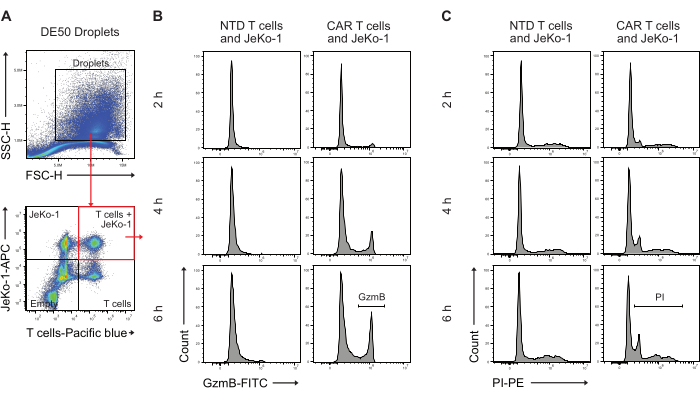
Figura 5: Strategia di gating per l'analisi delle goccioline mediante citometria a flusso dopo l'incubazione. (A) Il gating è stato effettuato mediante dispersione diretta e laterale per identificare le goccioline, seguito dalla selezione del gate contenente le goccioline. Gli eventi al di fuori del cancello rappresentano goccioline di olio prodotte come sottoprodotto della produzione di goccioline a doppia emulsione. La successiva analisi della fluorescenza delle goccioline nei canali corrispondenti alle colorazioni cellulari applicate identifica quattro popolazioni di goccioline: goccioline contenenti sia cellule T che cellule JeKo-1 (quadrato rosso); goccioline con le sole cellule JeKo-1; goccioline con le sole cellule T; e goccioline vuote. (B) Istogrammi rappresentativi per il segnale GzmB in goccioline doppie positive attraverso punti temporali e tra cellule NTD e CAR T. (C) Istogrammi rappresentativi per il segnale PI in goccioline doppie positive attraverso punti temporali e tra NTD e cellule T CAR. Tutte le misurazioni delle goccioline vengono eseguite come misure di intensità e altezza (H). Clicca qui per visualizzare una versione più grande di questa figura.
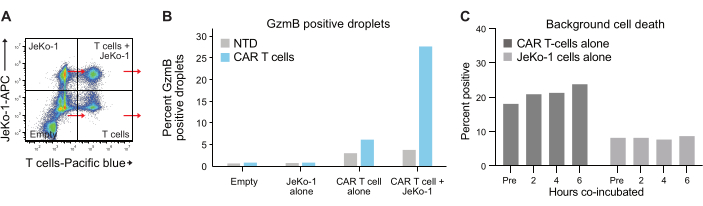
Figura 6: Controllo interno e popolazioni di riferimento. (A) È stato selezionato ciascuno dei quattro quadranti della Figura 5A e in ciascuno di essi sono stati misurati GzmB e PI. Questo tipo di quantificazione consente di misurare e sottrarre i segnali di fondo prima di eseguire un'analisi finale dell'efficacia delle cellule T. (B) Grafico che mostra la frequenza delle goccioline positive al GzmB dopo 6 ore di incubazione per ciascuna delle quattro popolazioni di goccioline, esemplificato con i dati del campione CAR T del donatore 1. (C) La morte cellulare di fondo è stata determinata nelle popolazioni di goccioline di controllo solo JeKo-1 e solo cellule T in ogni punto temporale misurato, con i dati del donatore 1. La morte cellulare di fondo viene utilizzata per calcolare la frequenza delle cellule effettrici che secernono GzmB e uccidono le cellule vive mostrate nella Figura 7 e spiegate nel passaggio 3.3. Abbreviazioni: Pre = incapsulamento. Clicca qui per visualizzare una versione più grande di questa figura.
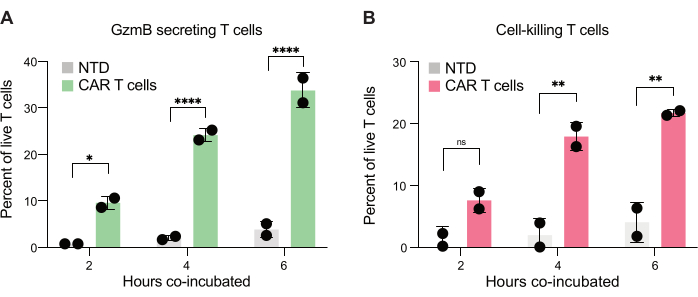
Figura 7: Quantificazione di cellule T in grado di secernere GzmB e uccidere le cellule JeKo-1 in goccioline doppiamente positive. Le goccioline doppie positive gated da due donatori sono state esaminate dopo 2 ore, 4 ore e 6 ore di co-incubazione in goccioline. (A) Frequenza delle cellule T bersaglio che secernono GzmB e confronto tra cellule T NTD e cellule T CAR. (B) Frequenza dell'incontro con le cellule T della cellula bersaglio che uccidono la cellula bersaglio co-incapsulata. Abbreviazioni: GzmB = granzima B, NTD = non trasdotdotto, PI = ioduro di propidio. * = valore P < 0,05, ** = valore P < 0,005, **** = valore P < 0,0001 con ANOVA bidirezionale. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Qui presentiamo un metodo per esaminare il potenziale citotossico delle cellule T a livello di singola cellula utilizzando un dispositivo di microfluidi facile da usare disponibile in commercio per valutare il potenziale citotossico delle cellule T CAR CD19-CD28-CD3z dopo co-incapsulazione con la linea cellulare di linfoma mantellare CD19-positivo JeKo-1.
Ci sono diversi passaggi critici in questo protocollo. Innanzitutto, si consiglia di rimuovere le perle di stimolazione dalle cellule T almeno 48 ore prima di eseguire qualsiasi test, per evitare risultati falsi positivi. In secondo luogo, l'efficienza di trasduzione delle cellule T con costrutti come i CAR o i recettori delle cellule T può variare considerevolmente. Senza una successiva fase di purificazione delle cellule T trasdotte, i risultati possono essere difficili da interpretare. In questo caso, è stata utilizzata una popolazione pura di cellule T CAR e quindi ci si può aspettare un alto grado di certezza quando si caratterizzano le cellule T CAR come killer o non killer in ogni momento. In alternativa, è possibile applicare l'etichettatura dei CAR con una proteina fluorescente o un tag genetico per indicare le cellule che sono CAR-positive e quindi controllate durante l'analisi delle goccioline. Se si utilizza l'etichettatura, le molecole fluorescenti selezionate non devono interferire con le emissioni fluorescenti di nessuno degli altri fluorofori del saggio. Ad esempio, l'uso del GFP-tagging interferirebbe con il substrato GzmB marcato con FAM applicato negli esperimenti eseguiti qui e quindi non è raccomandato.
Uno dei principali vantaggi del protocollo qui descritto è che la generazione di goccioline è semplificata e automatizzata. Tuttavia, per garantire l'incapsulamento di una singola cella, è importante che le celle si risospendano completamente prima del caricamento della cartuccia. Per questo motivo, si consiglia di lavorare a un ritmo discreto quando ci si prepara a caricare la cartuccia. Una considerazione simile vale quando si aggiunge il substrato di GzmB, poiché alcune cellule sono altamente secernenti di GzmB. La risospensione delle cellule previene anche l'intasamento dei canali microfluidici di piccole cartucce. Il corretto incapsulamento delle cellule è facilmente verificabile al microscopio, come descritto sopra.
Poiché la gocciolina incapsula il mezzo cellulare e trattiene i prodotti cellulari secreti dalle cellule, possono essere analizzate altre citochine, anticorpi e composti. Infatti, abbiamo testato altre molecole secernenti da cellule immunitarie, come l'IFN-γ e il TNF-α, che richiedono modifiche dell'attuale protocollo. Per la rilevazione delle citochine, può essere applicato un tipo di formato di saggio diverso da quello che utilizziamo qui per il GzmB, come la generazione di un sandwich ELISA sulla superficie della cellula effettrice32. Inoltre, le colorazioni cellulari e i colori dei saggi possono essere modificati, ad esempio l'estere succinimidil carbossifluoresceina (CFSE), ma è importante garantire un sanguinamento minimo o nullo tra diverse combinazioni di colori, come si farebbe nella citometria a flusso standard.
Inoltre, questo protocollo non si limita all'analisi delle cellule T CAR. Può anche essere esteso per studiare altre interazioni tra cellule T e bersaglio o altre cellule immunitarie come le cellule CAR NK. Si possono anche prevedere esperimenti più avanzati, ad esempio la marcatura di sottogruppi di cellule T CD4 e CD8 con fluorofori aggiuntivi per eseguire un'immunofenotipizzazione funzionale più ampia. Infatti, qui mostriamo che CD4 e CD8 possono essere rilevati nelle goccioline, consentendo così un'ulteriore caratterizzazione delle cellule T effettrici e della loro capacità citotossica.
Ottimizzando questo protocollo, abbiamo mirato in modo specifico a farlo funzionare su strumenti standard di citometria a flusso. Sebbene la citometria a flusso di goccioline non sia complicata, abbiamo notato che può verificarsi un accumulo di olio se il citometro a flusso non viene risciacquato correttamente a determinati intervalli o come raccomandato qui dopo l'analisi dei campioni ad ogni intervallo di tempo. Il miglior protocollo di risciacquo potrebbe essere specifico per ogni singolo citometro a flusso.
Uno dei vantaggi significativi di questo metodo è la sua elevata capacità di rendimento, che consente il monitoraggio della citotossicità mediata da effettori a singola cellula contro le cellule bersaglio senza la necessità di competenze approfondite o apparecchiature altamente specializzate. Il test può essere facilmente eseguito utilizzando gli strumenti esistenti, come la citometria a flusso o la microscopia. Le goccioline a doppia emulsione sono anche suscettibili di smistamento utilizzando selezionatori cellulari30,31, che possono consentire l'isolamento di cellule con funzionalità specifiche, ad esempio cellule CAR T con e senza potenziale citotossico, seguite dall'analisi del trascrittoma a singola cellula.
La tecnologia non è priva di limitazioni. Mentre alcune linee cellulari tollerano la coltura in goccioline per 24 ore e oltre, le cellule primarie possono avere una vitalità significativamente inferiore dopo 24 ore. Ciò rappresenta un limite di tempo per i saggi in generale, ma per il test attuale, il GzmB evidente e l'attività di uccisione cellulare possono essere osservati entro 4-6 ore, probabilmente perché il piccolo compartimento delle goccioline garantisce un rapido incontro tra l'effettore e le cellule bersaglio. Allo stesso modo, il piccolo volume di goccioline garantirà un rapido accumulo di concentrazione a livelli rilevabili del substrato secernente GzmB-clived. Un'altra limitazione della tecnologia è l'incapacità di rilevare l'uccisione seriale da parte delle cellule effettrici quando si utilizzano citometri a flusso standard. Tuttavia, questo potrebbe essere possibile con citometri a flusso per immagini o tecnologie di citometria per immagini, che dovranno essere studiate.
Il trasferimento adottivo di cellule T CAR CD19 ha mostrato un notevole successo nel trattamento di pazienti con neoplasie ematologiche. Nonostante ciò, c'è un'ampia variazione di risposta e tossicità imprevedibile nei pazienti32, che può essere in parte dovuta all'eterogeneità all'interno del prodotto per infusione CAR T. Di conseguenza, c'è un crescente interesse nell'analisi della composizione fenotipica e della capacità citotossica delle singole cellule CAR T all'interno di una popolazione. Ciò sarà particolarmente importante in quanto la terapia CAR è sempre più testata in condizioni autoimmuni e in altre forme di cancro. Il dispositivo e il protocollo microfluidico qui descritti offrono un approccio robusto e versatile all'esame dell'eterogeneità delle cellule CAR T e di altre terapie cellulari.
Divulgazioni
Gli autori dichiarano i seguenti interessi concorrenti: M.B.B. ha ricevuto onorari di consulenza da Janssen, Roche e Kite/Gilead, non correlati al presente lavoro. D.L.P. e P.M. sono dipendenti di Samplix.
Riconoscimenti
Gli autori desiderano ringraziare i membri e i dipendenti di CITCO e Samplix per le utili discussioni e suggerimenti. M.B.B. è supportato dalla borsa di studio Early-Career Clinician Scientists' fellowship della Lundbeck Foundation (R381-2021-1278). Questo lavoro è sostenuto da una sovvenzione per la ricerca d'élite dell'Ospedale Universitario di Odense. Inoltre, questa ricerca è stata supportata da una sovvenzione del Progetto del Consiglio Europeo per l'Innovazione 190144395 a Samplix ApS.
Materiali
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| Blocker BSA (BSA) | Thermo Scientific | 37525 | |
| CellTrace Far Red Cell Proliferation Kit (far red fluorescent dye) | Invitrogen | C34564 | |
| CellTrace Violet Cell Proliferation Kit (violet fluorescent dye) | Invitrogen | C34557 | |
| DE Stabilizing Solution (stabilizing solution) | Samplix | REDIVSTABSOL1500 | |
| DPBS (dPBS) | Gibco | 14190-094 | |
| Dulbecco’s PBS (dPBS) | Capricorn Scientific | PBS-1A | |
| Dynabeads Human T-Activator (CD3/CD28 activation beads) | Gibco | 11132D | |
| Fetal Bovine Serum (FBS) | Capricorn Scientific | FBS-HI-12A | |
| Lenti-X Concentrator (PEG-based reagent) | Takara Bio | 631232 | |
| MACSelect LNGFR Microbeads (anti-NGFR magnetic beads) | Miltenyi Biotec | 130-091-330 | |
| OptiPrep density gradient medium (gradient medium) | Stemcell | 7820 | |
| Penicillin-Streptomycin (P/S) | Capricorn Scientific | PS-B | |
| Propidium iodide (PI) | Invitrogen | BMS500PI | |
| Recombinant Human IL-2 (IL-2) | Peprotech | 200-02 | |
| RPMI-1640 with Stable Glutamine (RPMI-1640) | Capricorn Scientific | RPMI-STA | |
| RPMI-1640 without L-Glutamine and phenol red | Gibco | 32404-014 | |
| Xdrop DE oil I (oil) | Samplix | REOILDEC1900 | |
| Xdrop Granzyme B substrate (GzmB substrate) | Samplix | REGRB100 | |
| Zombie-NIR viability dye (viability dye) | BioLegend | 423106 | |
| Plasticware etc. | |||
| 8-chamber glass slide | Chemometec | 942-0003 | |
| Cell culture plate, 12 well | TH Geyer | 7696791 | |
| DNA LoBind tube, 2 mL (DNA tube) | Eppendorf | 30108078 | |
| Eppendorf tube, 1.5 mL (1.5 mL tube) | Eppendorf | 30108051 | |
| Falcon tube, 15 mL (15 mL tube) | TPP | 91015 | |
| Falcon tube, 5 mL (5 mL tube) | Falcon (VWR) | 734-0443 | |
| Green cell suspension flasks for cell incubations (T75 flask) | Sarstedt | 148.19.22 | |
| Green cell suspension plates for cell incubations (96 well plate) | Sarstedt | 148.32.20 | |
| LS Separation Columns (separation column) | Miltenyi Biotec | 130-042-401 | |
| Xdrop DE Gaskets (gaskets) | Samplix | #GADEA100 | |
| Xdrop DE50 Cartridge (encapsulation cartridge) | Samplix | #CADE50A100 | |
| Antibodies | |||
| anti-CCR7 PE-Dazzle 594 | BioLegend | 353236 | |
| anti-CD19 CAR FMC63 Idiotype Antibody, PE | Miltenyi Biotec | 130-127-342 | |
| anti-CD3 APC | Biolegend | 300439 | |
| anti-CD3 BV480 | BD Biosciences | 566105 | |
| anti-CD3 FITC | BD Biosciences | 345763 | |
| anti-CD4 BUV661 | BD Biosciences | 612962 | |
| anti-CD4 StarBright Violet 760 | Bio-Rad | MCA1267SBV760T | |
| anti-CD45RA BUV395 | BD Biosciences | 740298 | |
| anti-CD8 PE-Cy7 | BioLegend | 344712 | |
| anti-CD8 StarBright Violet | Bio-Rad | MCA1226SBV760 | |
| anti-NGFR FITC | BioLegend | 345106 | |
| anti-NGFR PE | BioLegend | 345106 | |
| Cells | |||
| JeKo-1 Mantle-cell lymphoma cell-line (JeKo-1) | ATCC | CRL-3006 | |
| Primary peripheral blood mononuclear cells (PBMCs) | |||
| Equipment | |||
| Countess 3 Automated Cell Counter | Thermo Fisher Scientific | A50298 | |
| DynaMag-2 Magnet | Invitrogen | 12321D | |
| NovoCyte Quanteon Flow Cytometer (flow cytometer) | Agilent | 2010011AA | |
| Xdrop (microfluidics device) | Samplix | IN00110-EU |
Riferimenti
- Pasqui, D. M., Latorraca, C. D. O. C., Pacheco, R. L., Riera, R. CAR-T cell therapy for patients with hematological malignancies. A systematic review. Eur J Haematol. 109 (6), 601-618 (2022).
- Krejcik, J., et al. Harnessing the immune system to fight multiple myeloma. Cancers. 13 (18), 4546 (2021).
- Tokarew, N., Ogonek, J., Endres, S., von Bergwelt-Baildon, M., Kobold, S. Teaching an old dog new tricks: next-generation CAR T cells. British J Cancer. 120 (1), 26-37 (2019).
- Bogetofte Barnkob, M., Vitting-Seerup, K., Rønn Olsen, L. Target isoforms are an overlooked challenge and opportunity in chimeric antigen receptor cell therapy. Immunother Adv. 2 (1), ltac009 (2022).
- Daei Sorkhabi, A., et al. The current landscape of CAR T-cell therapy for solid tumors: Mechanisms, research progress, challenges, and counterstrategies. Front Immunol. 14, 1113882 (2023).
- . Considerations for the Development of Chimeric Antigen Receptor (CAR) T Cell Products Available from: https://www.fda.gov/regulatory-information/search-fda-guidance-documents/considerations-development-chimeric-antigen-receptor-car-t-cell-products (2024)
- Roddie, C., O'Reilly, M., Dias Alves Pinto, J., Vispute, K., Lowdell, M. Manufacturing chimeric antigen receptor T cells: issues and challenges. Cytotherapy. 21 (3), 327-340 (2019).
- Wang, L., et al. Improvement of in vitro potency assays by a resting step for clinical-grade chimeric antigen receptor engineered T cells. Cytotherapy. 21 (5), 566-578 (2019).
- Burrows, S. R., Fernan, A., Argaet, V., Suhrbier, A. Bystander apoptosis induced by CD8+ cytotoxic T cell (CTL) clones: implications for CTL lytic mechanisms. Int Immunol. 5 (9), 1049-1058 (1993).
- Gattinoni, L., et al. Acquisition of full effector function in vitro paradoxically impairs the in vivo antitumor efficacy of adoptively transferred CD8+ T cells. J Clin Invest. 115 (6), 1616-1626 (2005).
- Chen, G. M., et al. Integrative bulk and single-cell profiling of premanufacture T-cell populations reveals factors mediating long-term persistence of CAR T-cell therapy. Cancer Dis. 11 (9), 2186-2199 (2021).
- Frazer, G. L., Gawden-Bone, C. M., Dieckmann, N. M. G., Asano, Y., Griffiths, G. M. Signal strength controls the rate of polarization within CTLs during killing. J Cell Biol. 220 (10), e202104093 (2021).
- Hermans, I. F., et al. The VITAL assay: a versatile fluorometric technique for assessing CTL- and NKT-mediated cytotoxicity against multiple targets in vitro and in vivo. J Immunol Meth. 285 (1), 25-40 (2004).
- Zaritskaya, L., Shurin, M. R., Sayers, T. J., Malyguine, A. M. New flow cytometric assays for monitoring cell-mediated cytotoxicity. Expert Rev Vaccines. 9 (6), 601-616 (2010).
- Piccinini, C., et al. In vitro CAR-T cell killing: validation of the potency assay. Cancer Immunol Immunother CII. 73 (9), 168 (2024).
- Martinez, E. M., et al. High-throughput flow cytometric method for the simultaneous measurement of CAR-T cell characterization and cytotoxicity against solid tumor cell lines. SLAS Disc Adv Life Sci. 23 (7), 603-612 (2018).
- Jedema, I., van der Werff, N. M., Barge, R. M. Y., Willemze, R., Falkenburg, J. H. F. New CFSE-based assay to determine susceptibility to lysis by cytotoxic T cells of leukemic precursor cells within a heterogeneous target cell population. Blood. 103 (7), 2677-2682 (2004).
- Liu, L., et al. Cellular and molecular imaging of CAR-T cell-based immunotherapy. Adv Drug Delivery Rev. 203, 115135 (2023).
- Liadi, I., et al. Defining potency of CAR+ T cells: Fast and furious or slow and steady. Oncoimmunology. 8 (10), e1051298 (2019).
- Xhangolli, I., et al. Single-cell analysis of CAR-T cell activation reveals a mixed TH1/TH2 response independent of differentiation. Genom Proteom Bioinfo. 17 (2), 129-139 (2019).
- Zhou, Y., et al. Evaluation of single-cell cytokine secretion and cell-cell interactions with a hierarchical loading microwell chip. Cell Rep. 31 (4), 107574 (2020).
- LaBelle, C. A., Zhang, R. J., Hunsucker, S. A., Armistead, P. M., Allbritton, N. L. Microraft arrays for serial-killer CD19 chimeric antigen receptor T cells and single cell isolation. Cytometry J Int Soc Anal Cytol. 103 (3), 208-220 (2023).
- Hellmann, M. J., et al. Heterogeneously deacetylated chitosans possess an unexpected regular pattern favoring acetylation at every third position. Nat Comm. 15 (1), 6695 (2024).
- Wong, K. U., et al. Assessment of chimeric antigen receptor T cytotoxicity by droplet microfluidics in vitro. Antibody Therapeut. 5 (2), 85-99 (2022).
- Antona, S., Platzman, I., Spatz, J. P. Droplet-based cytotoxicity assay: Implementation of time-efficient screening of antitumor activity of natural killer cells. ACS omega. 5 (38), 24674-24683 (2020).
- Subedi, N., et al. An automated real-time microfluidic platform to probe single NK cell heterogeneity and cytotoxicity on-chip. Sci Rep. 11 (1), 17084 (2021).
- Zhang, Y., et al. Enhanced CRISPR/Cas12a-based quantitative detection of nucleic acids using double emulsion droplets. Biosens Bioelect. 257, 116339 (2024).
- Kochenderfer, J. N., et al. Construction and preclinical evaluation of an anti-CD19 chimeric antigen receptor. J Immunother. 32 (7), 689-702 (2009).
- Michaels, Y. S., et al. Precise tuning of gene expression levels in mammalian cells. Nat Comm. 10 (1), 818 (2019).
- Yuan, Y., et al. Droplet encapsulation improves accuracy of immune cell cytokine capture assays. Lab on a Chip. 20 (8), 1513-1520 (2020).
- Brower, K. K., et al. Double emulsion flow cytometry with high-throughput single droplet isolation and nucleic acid recovery. Lab on a Chip. 20 (12), 2062-2074 (2020).
- Kirouac, D. C., et al. Deconvolution of clinical variance in CAR-T cell pharmacology and response. Nat Biotechnol. 41 (11), 1606-1617 (2023).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon