Method Article
تصوير إشارات Ca2+ في الأوردة الرئوية الصغيرة عند الضغوط الفسيولوجية داخل اللمعة
In This Article
Summary
في هذا البروتوكول ، نقدم تقنية جديدة لتسجيل وتحليل إشارات Ca2+ في الأوردة الرئوية (الأوردة الرئوية الصغيرة أو PVs) عند الضغوط الفسيولوجية داخل اللمعة. تتضمن هذه التقنية عزل الكهروضوئية الصغيرة ، واحتضانها بمؤشر Ca2+ ، وتحريكها وضغطها ، والتصوير متحد البؤر لإشارات Ca2 + ، وتحليل البيانات.
Abstract
تحمل الأوردة الرئوية (PVs) الدم الغني بالأكسجين من الرئتين إلى القلب الأيسر ، وبالتالي تؤدي وظيفة مهمة في توصيل الدم الغني بالأكسجين إلى الأعضاء الحيوية. ومع ذلك ، ركزت معظم الدراسات حول الأوعية الدموية الرئوية على الشرايين الرئوية والشعيرات الدموية في ظل الظروف الطبيعية والمرضية. إشارات Ca2+ هي منظمات مهمة لوظيفة الأوعية الدموية. على الرغم من الأدوار الفسيولوجية الحاسمة للمركبات الكهروضوئية ، لم يتم تسجيل إشارات Ca2+ في الكهروضوئيات الصغيرة داخل الرئة في ظل الظروف الفسيولوجية. هنا ، نصف تقنية لتسجيل نشاط إشارة Ca2+ في PVs الماوس المعزولة والمعلومة والضغط عند 5 مم زئبق. من خلال دمج مؤشر Ca2 + ، يمكننا دراسة إشارات Ca2+ في طبقة الخلايا العضلية للPVs الصغيرة باستخدام التصوير متحد البؤر للقرص الدوار عالي السرعة في ظل الظروف الفسيولوجية. تشير بياناتنا التمثيلية إلى أن إشارات Ca2 + في الخلايا العضلية الكهروضوئية الصغيرة يتم التوسط فيها عن طريق فتحات القنوات الأيونية لمستقبلات الريانودين. ستكون هذه الطريقة ذات أهمية كبيرة للباحثين في مجال فسيولوجيا واضطرابات الأوعية الدموية الرئوية.
Introduction
تلعب الأوعية الدموية الرئوية دورا مهما في تبادل الغازات وإضافة الأكسجين وإزالة ثاني أكسيد الكربون من الدم1،2. تتلقى الشرايين الرئوية (PAs) دما يفتقر إلى الأكسجين من القلب الأيمن. يحدث تبادل الغازات على مستوى الشعيرات الدموية (الشعيرات الدموية السنخية) ، ويتم توصيل الدم الغني بالأكسجين إلى القلب الأيسر عن طريق الأوردة الرئوية (PVs). على عكس الأوردة الأخرى التي تحمل الدم الذي يفتقر إلى الأكسجين ، فإن PVs تؤدي وظيفة مهمة في توصيل الدم الغني بالأكسجين إلى القلب الأيسر ، وبالتالي إلى الأعضاء الحيوية في الجسم. ومع ذلك ، فإن آليات الإشارات التي تنظم الوظيفة الكهروضوئية في ظل الظروف العادية والمرضية غير مفهومة جيدا.
ركزت الدراسات التي أجريت على الأوعية الدموية الرئوية بشكل أساسي على PAs والشعيرات الدموية الرئوية. تظهر الدراسات الحديثة أن إشارات Ca2+ في طبقات خلايا البطانية والعضلات الملساء ضرورية في تنظيم وظيفة PAs3،4،5. علاوة على ذلك ، فإن آليات إشارات Ca2+ غير الطبيعية هي المسؤولة عن ضعف وظيفة PAs والشعيرات الدموية الرئوية في الظروف المرضية6،7،8،9،10. ومع ذلك ، لا تزال الدراسات التي أجريت على الأوردة الرئوية (PVs الصغيرة) نادرة. تم اقتراح النشاط خارج الرحم في الكهروضوئيات الكبيرة المجاورة للقلب الأيسر (PVs القلبية) كمصدر للرجفان الأذيني لدى البشر11،12 ، كما تم عرض إشارات النبضالتلقائي 13 و Ca2+ 12،14،15 في PVs الكبيرة. ومع ذلك ، لم تتم دراسة آليات إشارات Ca2+ في الكهروضوئية الصغيرة تحت الضغوط الفسيولوجية داخل اللمعة.
في هذه المخطوطة ، نقدم طريقة جديدة لعزل الكهروضوئيات الصغيرة وتحريكها وضغطها وتصوير إشارات Ca2+ في الخلايا العضلية الكهروضوئية باستخدام الفحص المجهري متحد البؤر للقرص الدوار عالي السرعة. الهدف العام من هذه الطريقة هو تسجيل إشارات Ca2+ التلقائية والمستحثة في الخلايا العضلية الكهروضوئية الصغيرة تحت الضغوط الفسيولوجية داخل اللمعة. يلعب الضغط داخل اللمعة دورا مهما في تنظيم إشارات Ca2+ في الخلايا العضلية16. عادة ما تتعرض الكهروضوئية لضغوط فسيولوجية داخل اللمعة تتراوح من 4 إلى 10 مم زئبق17,18. يمكن أن تؤثر التغيرات في الضغط داخل اللمعة طوال الدورة القلبية على إشارات Ca2+ في الخلايا العضلية الكهروضوئية. لذلك ، من الضروري استخدام تقنية تسمح لنا بدراسة هذه الإشارات في ظل الظروف الفسيولوجية وفحص كيفية تأثير الضغوط المتغيرة داخل اللمعة عليها. بالإضافة إلى ذلك ، ركزت معظم الأبحاث السابقة حول PVs على الخلايا الكهروضوئية القلبية الأكبر. تركز التقنية الحالية على الكهروضوئيات الصغيرة الموجودة في أعماق الرئتين ، والتي قد تكون أكثر صلة بفهم تنظيم وظائف الرئة في كل من الصحة والمرض.
Protocol
تمت الموافقة على جميع بروتوكولات من قبل لجنة رعاية واستخدامه بجامعة فيرجينيا (البروتوكولان 4100 و 4120). C57BL6 / J الفئران ، التي تتراوح أعمارها بين 10 و 12 أسبوعا ، يتم القتل الرحيم بالبنتوباربيتال (90 مجم / كجم ؛ داخل الصفاق) ، يليها خلع عنق الرحم لحصاد أنسجة الرئة3،4،19،20.
1. عزل الكهروضوئية الصغيرة
- نظف أدوات التشريح والأطباق بالإيثانول بنسبة 100٪ ، متبوعا بغسلها بالماء منزوع الأيونات.
- استخدم المقص لفتح التجويف الصدري. استخدم الملقط لإزالة القلب والرئتين بعناية من التجويف الصدري بأقل قدر من لمس الرئتين.
- ضع الأنسجة على صفيحة مطلية ب Sylgard تحتوي على محلول ملح فسيولوجي بارد (4-10 درجات مئوية) مخزن ب HEPES (HEPES-PSS ، بالمللي مولار ، 10 HEPES ، 134 كلوريد الصوديوم ، 6 كيلو كلوريد ،1 ملليجرام كلوريد 2 سداسي هيدرات ، 2 كلوريد الكالسيوم2 ثنائي الهيدرات ، و 7 سكر العنب ، الرقم الهيدروجيني المعدل إلى 7.4 باستخدام 1 M هيدروكسيد الصوديوم) 3،4،19. استخدم دبابيس التشريح لتثبيت القلب والرئتين بحيث تكون الألواح الكهروضوئية الكبيرة و PAs مرئية بوضوح ويكون الفص الأيسر للرئة ممتدا قليلا ، كما هو موضح في الشكل 1.
- باستخدام الأوردة الرئوية الكبيرة (PVs) كنقاط مرجعية ، قم بإزالة الأنسجة المحيطة بالأوردة الرئوية الصغيرة بعناية (PVs الصغيرة ، قطرها حوالي 50-100 ميكرومتر ، المشار إليها بالمستطيل المتقطع في الشكل 1) بمقص ناعم. تأكد من تجنب الاتصال المباشر بالخلايا الكهروضوئية الصغيرة. اعزل الكهروضوئية الصغيرة برفق عن الأنسجة المحيطة.
- اعزل الأجزاء الطويلة حوالي 1-2 مم من الكهروضوئية الصغيرة. ضع الكهروضوئيات الصغيرة في 4-10 درجة مئوية HEPES-PSS.
2. تحميل PVs الصغيرة بمؤشر Ca2+
ملاحظة: يجب التعامل مع الكهروضوئيات الصغيرة بعناية ، مما يضمن أن الملقط يلمس أطراف الكهروضوئيات فقط. هذه الطريقة هي تعديل للتقنية الموضحة سابقا3،7،20،21.
- قم بإعداد تركيز مخزون 2.5 ملي مولار Fluo-4 AM مع DMSO3،4. باستخدام محلول المخزون أعلاه ، قم بإعداد 10 ميكرومتر فلو -4 صباحا و 0.04٪ حمض البلورونيك مع HEPES-PSS.
- ضع الكهروضوئيات الصغيرة في أنبوب سعة 1.5 مل مع محلول التحميل (10 ميكرومتر فلو -4 صباحا و 0.04٪ حمض البلورونيك في HEPES-PSS) 3،4. قم بتغطية الأنبوب بورق الألمنيوم وضعه في حمام مائي للحضانة عند 37 درجة مئوية لمدة 1 ساعة.
- بعد الحضانة ، استبدل محلول التحميل بعناية ب 4-10 درجة مئوية HEPES-PSS واستمر في وضع الثلج لمدة 30 دقيقة كخطوة غسيل.
3. قنة الكهروضوئية الصغيرة
ملاحظة: هذه الطريقة هي تعديل للتقنية الموصوفة سابقا3،20،21.
- قم بإعداد غرفة التصوير العضلي للضغط بقنية زجاجية ، واحدة على كل جانب. املأ القنيات ب PSS (119 ملي كلوريد الصوديوم ، 4.7 ملي كلوريد كلوريد ، 1.2 ملي كيلو هيدرات2PO4 ، 1.2 ملي ملي كلوريد المغنيد2 160 سداسي هيدرات ، 2.5 ملي كلوريد الكالسيوم2 ثنائي هيدرات3،4،21،22 ، 7 ملي مولار سكر العنب ، و 24 ملي مولار هيدروكسيد الصوديوم3 ، يتم الحفاظ عليه عند درجة الحموضة 7.4 عن طريق فقاعات المحلول بنسبة 21٪ O2 و 5٪ CO2) باستخدام حقنة سعة 10 مل.
- قم بإزالة PV صغير من محلول الغسيل وضعه في غرفة تصوير العضل بالضغط. باستخدام ملقط رفيع الرؤوس ، قم بتحريك أحد طرفي الكهروضوئية الصغيرة بعناية على إحدى القنيات. بعد ذلك ، باستخدام خيوط دقيقة مصنوعة من خيط النايلون ، اربط عقدة حول الطرف المقنن للكهروضوئية الصغيرة وطرف القنية لتثبيتها.
- ادفع PSS برفق عبر القنية لإزالة الدم داخل PV. استخدم خيط النايلون لربط الطرف الآخر بقنية زجاجية باستخدام خيوط دقيقة ، كما هو موضح في الشكل 1.
4. الضغط والتصوير Ca2 + للكهروضوئية الصغيرة
ملاحظة: هذه الطريقة هي تعديل للتقنية الموضحة سابقا3،21.
- باستخدام وحدة التحكم في الضغط المؤازرة المتصلة بأنبوب يحتوي على PSS ، قم بالضغط على الكهروضوئية الصغيرة من أحد طرفيها عند 5 مم زئبق. استخدم مضخة تمعجية متصلة بكل من المدخل والمخرج ، لتفوق صهر PSS. حافظ على درجة حرارة الصحف الفائق عند 37 درجة مئوية.
- بعد فترة التوازن ، احصل على صور Ca2+ ل 1000 إطار (معدل الإطارات: 30 إطارا في الثانية) باستخدام هدف غمس الماء 40x (NA 0.8) ونظام التصوير متحد البؤر للقرص الدوار. قم بإثارة Fluo-4 باستخدام ليزر الحالة الصلبة 488 نانومتر والتقاط التألق المنبعث باستخدام مرشح تمرير النطاق 525/36 نانومتر.
- ضع مضاد مستقبلات الريانودين (RyR) الريانودين (5 ميكرومتر) 21،23 على الصحف الفائق. انتظر لمدة 5 دقائق. أعد التقاط صور Ca2+ كما هو موضح أعلاه ، والتقط 1000 إطار آخر بمعدل 30 إطارا / ثانية.
5. تحليل الصورCa 2+
ملاحظة: هذه الطريقة هي تعديل للتقنية الموضحة سابقا21،22،24. يمكن أن توفر التغييرات في نشاط إشارات Ca2 + في الخلايا العضلية الكهروضوئية رؤى مهمة حول تثبيط أو تعزيز اقتران الإثارة والانكماش في الخلايا الكهروضوئية.
- استخدم برنامجا مصمما خصيصا (طوره الدكتور أدريان بونيف ، https://github.com/vesselman/SparkAn) لتحليل صور Ca2+ .
- يمكنك تجسيد الصور باستخدام مرشح صندوق 5 × 5 ومرشح متوسط 5 × 5. استخدم إطارا يحدد منطقة مسطحة من PV مع خلايا متعددة للكشف التلقائي عن الأحداث.
- انقر فوق عرض والكشف التلقائي عن الأحداث. استخدم الإعدادات التالية: عتبة الحدث بسعة 1.3 F/F0، وتفاوت 20٪، ومربع مسح ضوئي بحجم 7 × 7 بكسل، ومتوسط تشغيل 7 صور. قم بإنشاء صور متوسطة تلقائيا كل 10 صور ، بدءا من الصورة الأولى.
- انقر فوق بدء البحث (أيقونة العين). ابحث عن جدول الأحداث المحفوظ كملف تمييز ضمن القائمة ملف. لحساب الأحداث لكل ميكرومتر²، اقسم عدد إشارات Ca2+ المكتشفة على مساحة الإطار المحدد.
النتائج
يوضح الشكل 2 أ مجال رؤية من كهروضوئية صغيرة عند ضغط داخل اللمعة 5 مم زئبق. تشير الرموز + إلى إشارات Ca2+ المكتشفة تلقائيا داخل إطار محدد (فيديو 1) ، يشار إليه بالمخطط الأخضر. تم تسجيل مجال رؤية واحد من كل PV ، وتم استخدام PV واحد من كل ماوس. تم اعتبار PV صغير على أنه n = 1. تمت مقارنة عدد إشارات Ca2+ لكل ميكرومتر2 في الدقيقة قبل وبعد 5 دقائق من إضافة ريانودين مثبط RyR (5 ميكرومتر) 23 في التجارب المزدوجة. تم استخدام اختبار t المزدوج للمقارنات الإحصائية للكشف عن الاختلافات الدلالية. كان عدد إشارات Ca2+ التي تحدث تلقائيا 0.73 ± 0.2 حدث في الدقيقة لكل ميكرومتر2 (الشكل 2B ، C) في ظل الظروف الموضحة أعلاه. أدى علاج الريانودين إلى تثبيط إشارات Ca2+ بالكامل تقريبا في PVs الصغيرة (الشكل 2C ، الفيديو 2) ، كما يتضح من انخفاض كبير في الأحداث في الدقيقة لكل ميكرومتر2. تظهر هذه البيانات أن النشاط التلقائي لإشارات Ca2+ في طبقة الخلايا العضلية من PVs الصغيرة المضغوطة يمثل فتحات RyRs. تقدم هذه النتائج دليلا على أن نشاط إشارات Ca2+ يمكن دراستها في PVs الصغيرة تحت الضغوط الفسيولوجية داخل اللمعة. ستسهل هذه الطريقة الدراسات المستقبلية حول تأثيرات الضغط داخل اللمعة والوسطاء العصبيين على إشارات Ca2 + في الخلايا العضلية الكهروضوئية الصغيرة ، مما قد يقدم رؤى قيمة حول تنظيم الوظيفة الكهروضوئية. بينما تركز الدراسة الحالية على عدد إشارات RyR Ca2+ ، فمن الممكن أيضا تحليل الخصائص الحركية لهذه الإشارات ، بما في ذلك المدة والسعة والانتشار المكاني ووقت الارتفاع. قد يوفر فهم كيفية تأثير المحفزات الفسيولوجية والمرضية على الخصائص الحركية لإشارات RyR Ca2 + معلومات مهمة فيما يتعلق بتنظيم الوظيفة الكهروضوئية في كل من الحالات الصحية والمريضة.
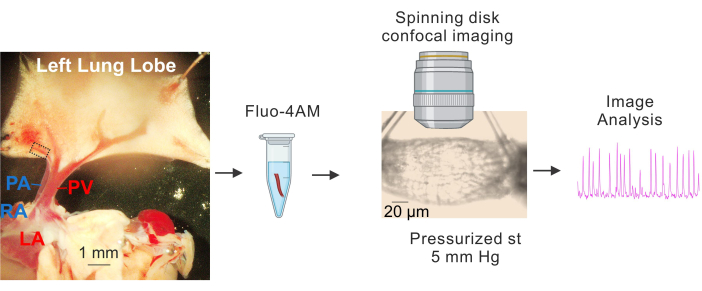
الشكل 1: التحضير والتصوير Ca2 + للكهروضوئية. صور متسلسلة توضح تحديد وعزل PVs الصغيرة ، وحضانة fluo4-AM ، والقنية والضغط (5 مم زئبق) ، والتصوير متحد البؤر عالي السرعة للقرص الدوار ، وتحليل الصور. يمثل المستطيل المتقطع في الصورة على اليسار PV المستخدم في الدراسة. الاختصارات: PA = الشريان الرئوي. RA = الأذين الأيمن. PV = الوريد الرئوي. LA = الأذين الأيسر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
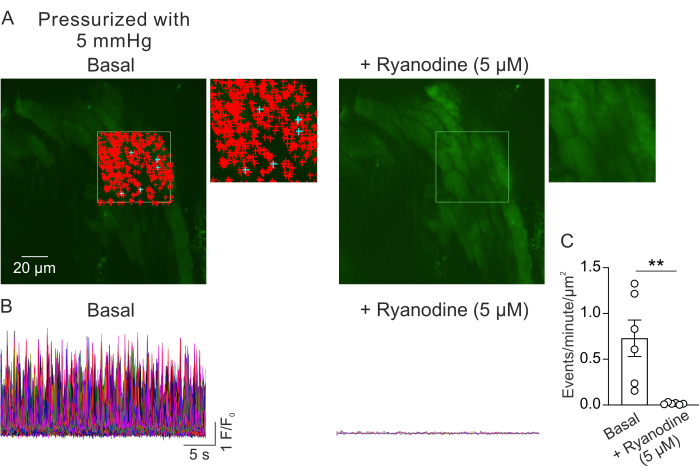
الشكل 2: تحليل تصوير Ca2+ . (أ) صور لمجال رؤية من كهروضوئية صغيرة مضغوطة (5 مم زئبق) ، محملة بفلو-4 في غياب (يسار) أو وجود ريانودين (5 ميكرومتر؛ مثبط RyR ، على اليمين). يشير المستطيل الأخضر إلى المنطقة التي تم تحديدها للكشف التلقائي عن إشارات Ca2+ . تمثل علامات + الأحداث المكتشفة تلقائيا داخل الإطار. تشير العلامات الحمراء إلى إشارات تقل مساحتها عن 3000 ميكرومترمربع ، بينما تشير العلامات الزرقاء إلى إشارات تشغل مساحة تزيد عن 3000 ميكرومتر2. تشير كل علامة + إلى حدث أو إشارة Ca2+ واحدة. (ب) آثار F / F0 للأحداث المكتشفة من المنطقة المحددة المشار إليها في A ، والتي تظهر نشاط إشارات Ca2+ في طبقة الخلايا العضلية من PVs الصغيرة المضغوطة في ظل الظروف القاعدية (على اليسار) وفي وجود الريانودين (يمين). (ج) القياس الكمي للأحداث في الدقيقة لكل ميكرومتر2 من إشارات Ca2+ في الكهروضوئية الصغيرة قبل وبعد إضافة الريانودين (1 PV لكل فأر؛ n = 6 فئران؛ ** p < 0.01 مقابل Basal؛ اختبار t مقترن). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
فيديو 1: إشارات Ca2+ في PV صغير مضغوط عند 5 مم زئبق قبل المعالجة بالريانودين. يمثل مجال الرؤية الإطار المحدد، الموضح باللون الأخضر في الشكل 2. الرجاء النقر هنا لتنزيل هذا الفيديو.
فيديو 2: إشارات Ca2+ في PV صغير مضغوطة عند 5 مم زئبق بعد المعالجة بالريانودين (5 ميكرومتر). يمثل مجال الرؤية الإطار المحدد، الموضح باللون الأخضر في الشكل 2. الرجاء النقر هنا لتنزيل هذا الفيديو.
Discussion
تلعب إشارات Ca2+ في خلايا العضلات الملساء دورا مهما في تنظيم وظيفة الأوعيةالدموية 25. PVs هي سرير وعائي مهم ولكنه غير مدروس نسبيا مسؤول عن توصيل الدم الغني بالأكسجين إلى القلب الأيسر26. ومع ذلك ، فإن آليات إشارات Ca2+ في PVs الصغيرة وتأثيرها على الوظيفة الفسيولوجية غير معروفة. الهدف من هذه المخطوطة هو وصف طريقة جديدة لعزل الكهروضوئية الصغيرة وتعليمها وضغطها لتسجيل إشارات Ca2+ في طبقة الخلايا العضلية وتحليل إشارات Ca2 + هذه. يمكن أن تساعد القدرة على تصور إشارات Ca2 + في PVs الصغيرة في تعزيز فهمنا لكيفية عمل هذه الإشارات في ظل الظروف العادية والمريضة. في حين أن دراسة إشارات Ca2 + في PVs داخل الرئة السليمة ستوفر بيانات أكثر صلة من الناحية الفسيولوجية ، فإن PVs الصغيرة غير مرئية بوضوح في الرئة السليمة ، مما قد يؤدي إلى تحديات تقنية في تحميل أصباغ Ca2+ والتصوير متحد البؤر. يوفر عزل الكهروضوئيات الصغيرة والضغط عليها طريقة بديلة لمراقبة إشارات Ca2+ تحت الضغوط الفسيولوجية داخل اللمعة ودرجة الحرارة والمحاليل الأيونية.
يعتمد تصوير Ca2 + للPVs الموصوفة في هذه المخطوطة على إجراءاتنا الراسخة لتصوير Ca2 + في الشرايين الجهازية21،22،27. تشير البيانات إلى أن غالبية إشارات Ca2+ في الخلايا العضلية الكهروضوئية الصغيرة ترجع إلى فتحات قنوات RyR الأيونية. لذلك ، فإن البروتوكول الموضح في هذه المخطوطة سيمكن من إجراء دراسات مستقبلية لتنظيم RyR وتأثيره على الوظيفة الكهروضوئية في ظل الظروف العادية وفي الأمراض. يعد نشاط RyR2 ضروريا للتقلصات في الخلايا العضليةالقلبية 28 ، بينما في خلايا العضلات الملساء الشريانية ، ارتبط بالاسترخاء29. لا يزال التأثير الدقيق لنشاط RyR على الانكماش الكهروضوئي الصغير غير معروف. تصوير عضل الضغط هو تقنية شائعة الاستخدام لمراقبة التغيرات في تقلص الأوعية الدموية الصغيرة. لذلك ، من المحتمل أيضا استخدام المستحضر الكهروضوئي المضغوط لمراقبة الانقباضات الكهروضوئية الصغيرة.
يظهر الريانودين تأثيرات تعتمد على التركيز على نشاط RyR ، حيث يزيده عند التركيزات تحت الميكرومولار ويقلله عند تركيزات الميكرومولار23. قد يكون للريانودين أيضا تأثير مثبط غير مباشر على إشارات Ca2+ الأخرى في PVs الصغيرة ، وهو احتمال لم يتم اختباره. عند التركيز المستخدم ، لم نلاحظ زيادة تعويضية في إشارات Ca2+ في PVs. قد يختلف تنظيم إشارات Ca2 + في الكهروضوئيات المعزولة والمضغوطة عن تلك الموجودة في PVs داخل الرئة السليمة ، وهو احتمال لم يتم استكشافه بعد. ومع ذلك ، فإن تسجيل إشارات Ca2 + في PVs صغيرة في الرئة السليمة من فأر مخدر يمثل تحديات كبيرة ، تنشأ عن موقع الرئة في التجويف الصدري وصعوبة تحميل مؤشر Ca2+ بشكل انتقائي في PVs في فأر مخدر.
من المعروف أن إجهاد القص في تدفق الدم يغير وظيفة الأوعية الدموية. على الرغم من أن الطريقة الحالية تسمح بعزل تأثير الضغط داخل اللمعة على إشارات Ca2+ في PVs الصغيرة ، إلا أن نقص التدفق أو إجهاد القص يمثل قيدا محتملا. ومع ذلك ، يمكن دمج إجهاد التدفق أو القص بسهولة وإجراؤه مع تصوير Ca2+ باستخدام الإعدادات الموضحة سابقا21. من الممكن أن يعدل إجهاد التدفق / القص نشاط إشارات Ca2+ في الكهروضوئيات الصغيرة ، والتي ستكون موضوعا مثيرا للاهتمام للتحقيق المستقبلي.
استخدمنا fluo-4-AM كمؤشر Ca2+ لتسجيل إشارات Ca2+ في PVs الصغيرة. اعتمادا على الاحتياجات التجريبية ، يجب أن يكون من الممكن استخدام مؤشرات Ca2+ الأخرى التي يمكن إثارتها عند 488 نانومتر (Calbryte 520 AM) 7 أو 560 نانومتر (Calbryte 590 AM) 30. يسمح استخدام نظام التصوير متحد البؤر للقرص الدوار بتصوير إشارات Ca2+ ، وتحديدا في الخلايا العضلية الكهروضوئية. على الرغم من عدم دراسته في الدراسة الحالية ، إلا أن التركيز على طبقة الخلية البطانية سيسمح بتسجيل إشارات Ca2+ البطانية في PVs الصغيرة. لذلك ، قد توفر مقارنة إشارات الخلايا العضلية وإشارات Ca2+ البطانية بين PAs الصغيرة والكهروضوئية الصغيرة رؤى مهمة حول اختلافاتها الوظيفية.
من المعقول أن إشارات Ca2+ في PVs الصغيرة تنظم تدفق الدم الغني بالأكسجين عبر PVs. يتغير الضغط داخل الأذين الأيسر من 4 مم زئبق إلى 12 مم زئبق خلال كل دورةقلبية 17،18. نظرا لأن الأذين الكهروضوئي يزود الأذين الأيسر بالدم ، فمن المحتمل أن يتغير الضغط داخل الكهروضوئية أيضا أثناء الدورة القلبية. أظهرت الدراسات السابقة أنه يمكن تنشيط RyRs عن طريق الضغط داخل اللمعة في الشرايين الصغيرة16. لذلك ، قد يوفر قياس تأثير الضغط داخل اللمعة على إشارات PV Ca2 + رؤى جديدة حول توصيل الدم الغني بالأكسجين من PVs إلى القلب الأيسر. يمكن لتحفيز الأعصاب والوسطاء الخلطيين في مجرى الدم أيضا تنشيط إشارات Ca2 + للعضلات الملساء. ستسهل الطريقة الحالية الدراسات المستقبلية حول تأثير الوسطاء العصبيين على إشارات PV Ca2+ والوظيفة الكهروضوئية.
هناك بعض الخطوات الحاسمة في البروتوكول التي يجب الاهتمام بها. يعد التشريح الدقيق للأوردة الرئوية (PVs) أمرا في غاية الأهمية. من الأهمية بمكان تجنب لمس منطقة التصوير للكهروضوئية باستخدام أدوات التشريح ، لأن ذلك يمكن أن يؤثر سلبا على صحتهم. يجب لمس نهايات PVs فقط. يمكن أن يؤدي تقليل وقت التشريح إلى تعزيز معدل النجاح. يمكن أن يؤدي تحميل الصبغة غير الكافي إلى انخفاض نسبة الإشارة إلى الضوضاء وزيادة احتمالية حدوث إيجابيات خاطئة أثناء الكشف التلقائي عن الحدث. يجب أن يضمن اتباع البروتوكول الموضح هنا تحميل الصبغة الكافي في الخلايا العضلية الكهروضوئية.
باختصار ، قدمنا طريقة لتسجيل إشارات Ca2+ في PVs الصغيرة ، والتي تسمح بالتحقيق في آليات إشارات Ca2+ في هذا السرير الوعائي المهم ولكن غالبا ما يتم تجاهله. الأهم من ذلك ، أن القدرة على تسجيل إشارات Ca2+ في PVs الصغيرة في ظل الظروف العادية يمكن أن توفر فهما قيما للآليات المرضية لأمراض الرئة ، بما في ذلك ارتفاع ضغط الدم الرئوي وإصابة الرئة ووذمة الرئة الناجمة عن قصور القلب.
Disclosures
المؤلفون ليس لديهم ما يكشفون عنه.
Acknowledgements
تم تمويل هذا البحث من خلال جوائز من NHLBI (HL167208 و HL157407 و HL146914) إلى SKS و NIDDK (DK138271) إلى YLC.
Materials
| Name | Company | Catalog Number | Comments |
| Custom-Designed SparkAn Software | University of Vermont | https://github.com/vesselman/SparkAn | |
| Fluo-4, AM | Thermo Fisher Scientific | F14201 | |
| FN1 Upright Microscope | Nikon | ||
| Heater/Temperature Controller | Warner Instruments | ||
| Imaging System | Andor | ||
| iQ 3.x acquisition Software | Andor | ||
| iXon EMCCD Cameras | Andor | ||
| Nylon Thread for Tying Blood Vessels | Living Systems Instrumentation | THR-G | |
| Pressure Myography Chamber | Instrumentation and Model Facility, University of Vermont, Burlington, VT, USA | ||
| Revolution WD (with Borealis) High Speed Spinning Disk Confocal Imaging System | Andor | ||
| Ryanodine | Bio-Techne | 1329 | |
| Servo Pressure Controller | Living Systems Instrumentation | ||
| SS Dissection Pins, 0.2mm dia | Living Systems Instrumentation | PIN-0.2mm | |
| Tubing Pump REGLO | ISMATEC | ISM4212 |
References
- Suresh, K., Shimoda, L. A. Lung circulation. Compr Physiol. 6 (2), 897-943 (2016).
- Sundjaja, J. H., Bordoni, B. . Thorax, heart pulmonic valve. , (2024).
- Daneva, Z., et al. Caveolar peroxynitrite formation impairs endothelial TRPV4 channels and elevates pulmonary arterial pressure in pulmonary hypertension. Proc Natl Acad Sci U S A. 118 (17), e2023130118 (2021).
- Daneva, Z., et al. Endothelial pannexin 1-TRPV4 channel signaling lowers pulmonary arterial pressure in mice. Elife. 10, e67777 (2021).
- Kuhr, F. K., Smith, K. A., Song, M. Y., Levitan, I., Yuan, J. X. New mechanisms of pulmonary arterial hypertension: role of Ca2+ signaling. Am J Physiol Heart Circ Physiol. 302 (8), H1546-H1562 (2012).
- Sonkusare, S. K., Laubach, V. E. Endothelial TRPV4 channels in lung edema and injury. Curr Top Membr. 89, 43-62 (2022).
- Kuppusamy, M., et al. Purinergic P2Y2 receptor-induced activation of endothelial TRPV4 channels mediates lung ischemia-reperfusion injury. Sci Signal. 16 (808), eadg1553 (2023).
- Alvarez, D. F., et al. Transient receptor potential vanilloid 4-mediated disruption of the alveolar septal barrier: a novel mechanism of acute lung injury. Circ Res. 99 (9), 988-995 (2006).
- Balakrishna, S., et al. TRPV4 inhibition counteracts edema and inflammation and improves pulmonary function and oxygen saturation in chemically induced acute lung injury. Am J Physiol Lung Cell Mol Physiol. 307 (2), L158-L172 (2014).
- Suresh, K., et al. Reactive oxygen species induced Ca2+ influx via TRPV4 and microvascular endothelial dysfunction in the SU5416/hypoxia model of pulmonary arterial hypertension. Am J Physiol Lung Cell Mol Physiol. 314 (5), L893-L907 (2018).
- Haissaguerre, M., et al. Spontaneous initiation of atrial fibrillation by ectopic beats originating in the pulmonary veins. N Engl J Med. 339 (10), 659-666 (1998).
- Heijman, J., Voigt, N., Nattel, S., Dobrev, D. Cellular and molecular electrophysiology of atrial fibrillation initiation, maintenance, and progression. Circ Res. 114 (9), 1483-1499 (2014).
- Brunton, T. L., Fayrer, J. Note on independent pulsation of the pulmonary veins and vena cava. Proc R Soc Lond. 25, 174-176 (1877).
- Namekata, I., et al. Involvement of the Na(+)/Ca(2+) exchanger in the automaticity of guinea-pig pulmonary vein myocardium as revealed by SEA0400. J Pharmacol Sci. 110 (1), 111-116 (2009).
- Cros, C., et al. Regional differences in Ca2+ signaling and transverse-tubules across left atrium from adult sheep. Int J Mol Sci. 24 (3), 2347 (2023).
- Dabertrand, F., Nelson, M. T., Brayden, J. E. Ryanodine receptors, calcium signaling, and regulation of vascular tone in the cerebral parenchymal microcirculation. Microcirculation. 20 (4), 307-316 (2013).
- Nair, R., Lamaa, N. . Pulmonary capillary wedge pressure. , (2024).
- Fukuta, H., Little, W. C. The cardiac cycle and the physiologic basis of left ventricular contraction, ejection, relaxation, and filling. Heart Fail Clin. 4 (1), 1-11 (2008).
- Daneva, Z., et al. Endothelial IK and SK channel activation decreases pulmonary arterial pressure and vascular remodeling in pulmonary hypertension. Pulm Circ. 13 (1), e12186 (2023).
- Marziano, C., et al. Nitric oxide-dependent feedback loop regulates transient receptor potential vanilloid 4 (TRPV4) channel cooperativity and endothelial function in small pulmonary arteries. J Am Heart Assoc. 6 (12), e007157 (2017).
- Chen, Y. L., et al. Novel smooth muscle Ca2+-signaling nanodomains in blood pressure regulation. Circulation. 146 (7), 548-564 (2022).
- Sonkusare, S. K., et al. Elementary Ca2+ signals through endothelial TRPV4 channels regulate vascular function. Science. 336, 597-601 (2012).
- Arias-Cavieres, A., et al. Ryanodine receptor-mediated calcium release has a key role in hippocampal LTD induction. Front Cell Neurosci. 12, 403 (2018).
- Chen, Y. L., et al. Calcium signal profiles in vascular endothelium from Cdh5-GCaMP8 and Cx40-GCaMP2 mice. J Vasc Res. 58 (3), 159-171 (2021).
- Ottolini, M., Sonkusare, S. K. The calcium signaling mechanisms in arterial smooth muscle and endothelial cells. Compr Physiol. 11 (2), 1831-1869 (2021).
- Boyette, L. C., Burns, B. . Physiology, pulmonary circulation. , (2024).
- Ottolini, M., et al. Local peroxynitrite impairs endothelial transient receptor potential vanilloid 4 channels and elevates blood pressure in obesity. Circulation. 141 (16), 1318-1333 (2020).
- Shan, J., et al. Phosphorylation of the ryanodine receptor mediates the cardiac fight or flight response in mice. J Clin Invest. 120 (12), 4388-4398 (2010).
- Knot, H. J., Standen, N. B., Nelson, M. T. Ryanodine receptors regulate arterial diameter and wall [Ca2+] in cerebral arteries of rat via Ca2+-dependent K+ channels. J Physiol. 1 (Pt 1), 211-221 (1998).
- Tischbirek, C., Birkner, A., Jia, H., Sakmann, B., Konnerth, A. Deep two-photon brain imaging with a red-shifted fluorometric Ca2+ indicator. Proc Natl Acad Sci U S A. 112 (36), 11377-11382 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved