Method Article
생리학적 내강내 압력에서 작은 폐정맥의 Ca2+ 신호 이미징
요약
이 프로토콜에서는 생리학적 내강내 압력에서 폐내 정맥(작은 폐정맥 또는 PV)에서 Ca2+ 신호를 기록하고 분석하기 위한 새로운 기술을 제시합니다. 이 기술에는 작은 PV를 분리하고, Ca2+ 지표로 배양하고, 캐뉼러 및 가압하고, Ca2+ 신호의 컨포칼 이미징 및 데이터 분석이 포함됩니다.
초록
폐정맥(PV)은 산소가 풍부한 혈액을 폐에서 왼쪽 심장으로 다시 운반하여 산소가 풍부한 혈액을 주요 장기에 전달하는 데 중요한 기능을 합니다. 그러나 폐혈관 구조에 대한 대부분의 연구는 정상 및 질병 상태에서의 폐동맥과 모세혈관에 초점을 맞추고 있습니다. Ca2+ 신호는 혈관 기능의 중요한 조절자입니다. PV의 중요한 생리학적 역할에도 불구하고, 소폐내 PV의 Ca2+ 신호는 생리학적 조건에서 기록되지 않았습니다. 여기에서는 5mmHg에서 분리, 캐뉼레이션 및 가압된 마우스 PV에서 Ca2+ 신호 활성을 기록하는 기술에 대해 설명합니다. Ca2+ 지표를 통합함으로써 생리학적 조건에서 고속 회전 디스크 컨포칼 이미징을 사용하여 작은 PV의 근세포층에서 Ca2+ 신호를 연구할 수 있습니다. 우리의 대표적인 데이터는 작은 PV 근세포의 Ca2+ 신호가 리아노딘 수용체 이온 채널의 개구부에 의해 매개된다는 것을 나타냅니다. 이 방법은 폐 혈관 생리학 및 질환 분야의 연구자들에게 상당한 관심을 끌 것입니다.
서문
폐혈관 조직은 가스를 교환하고, 산소를 공급하고, 혈액에서 이산화탄소를 제거하는 데 중요한 역할을 합니다 1,2. 폐동맥(PA)은 우측 심장에서 산소가 부족한 혈액을 공급받습니다. 가스 교환은 모세혈관(폐포 모세혈관) 수준에서 발생하며, 산소가 풍부한 혈액은 폐정맥(PV)을 통해 왼쪽 심장으로 전달됩니다. 산소가 부족한 혈액을 운반하는 다른 정맥과 달리 PV는 산소가 풍부한 혈액을 왼쪽 심장으로 전달하고 결과적으로 신체의 중요한 기관에 전달하는 중요한 기능을 수행합니다. 그러나 정상 및 질병 조건에서 PV 기능을 조절하는 신호 전달 메커니즘은 잘 이해되지 않았습니다.
폐혈관 구조에 대한 연구는 주로 PA와 폐 모세혈관에 초점을 맞추고 있습니다. 최근 연구에 따르면 내피 및 평활근 세포층의 Ca2+ 신호는 PA 3,4,5의 기능을 조절하는 데 중요합니다. 또한, 비정상적인 Ca2+ 신호 전달 메커니즘은 질병 상태에서 PA와 폐 모세혈관의 기능 장애를 담당합니다 6,7,8,9,10. 그러나 폐내 정맥(small PV)에 대한 연구는 여전히 부족합니다. 좌측 심장에 인접한 대형 PV(심장 PV)에서의 이소성 활성은 인간에서 심방세동의 원인으로 제안되었으며11,12, 자발적 맥동13 및 Ca2+ 신호 12,14,15도 대형 PV에서 나타났습니다.소형 PV는 산소가 풍부한 혈액을 대형 PV에 전달합니다. 그러나 작은 PV의 Ca2+ 신호 전달 메커니즘은 생리학적 내강내 압력에서 연구되지 않았습니다.
이 원고에서는 고속 회전 디스크 컨포칼 현미경을 사용하여 PV 근세포에서 작은 PV를 분리, 캐뉼레이션 및 가압하고 Ca2+ 신호를 이미징하는 새로운 방법을 소개합니다. 이 방법의 전반적인 목표는 생리학적 내강내 압력 하에서 작은 PV 근세포에서 자발적이고 유도된 Ca2+ 신호를 기록하는 것입니다. 루미나믹 압력(intraluminal pressure)은 근세포(myocytes16)에서 Ca2+ 신호를 조절하는 데 중요한 역할을 합니다. 일반적으로 PV는 4에서 10 mm Hg17,18 범위의 생리적 광내 압력을받습니다. 심장 주기 전반에 걸친 내강내압의 변화는 PV 근세포의 Ca2+ 신호에 영향을 미칠 수 있습니다. 따라서 생리학적 조건에서 이러한 신호를 연구하고 다양한 광내 압력이 신호에 어떤 영향을 미치는지 조사할 수 있는 기술을 사용하는 것이 필수적입니다. 또한, PV에 대한 대부분의 선행 연구는 더 큰 심장 PV에 집중되어 있습니다. 현재 기술은 폐 깊숙한 곳에 위치한 작은 PV에 초점을 맞추고 있으며, 이는 건강과 질병 모두에서 폐 기능의 조절을 이해하는 데 더 관련이 있을 수 있습니다.
프로토콜
모든 동물 프로토콜은 버지니아 대학교 동물 관리 및 사용 위원회(프로토콜 4100 및 4120)의 승인을 받았습니다. 생후 10-12주 된 C57BL6/J 마우스는 펜토바르비탈(90mg/kg, 복강내)로 안락사시킨 후 폐 조직을 채취하기 위해 자궁경부 탈구를 합니다 3,4,19,20.
1. 소형 PV의 격리
- 해부 도구와 접시를 100% 에탄올로 세척한 다음 탈이온수로 세척합니다.
- 가위를 사용하여 흉강을 엽니다. 집게를 사용하여 폐를 최소한으로 건드리지 않고 흉강에서 심장과 폐를 조심스럽게 제거합니다.
- 차갑게 (4-10 ° C) HEPES 완충 생리 학적 염 용액 (HEPES-PSS, mM, 10 hepes, 134 NaCl, 6 KCl, 1 MgCl2 육수화물, 2 CaCl2 이수화물 및 7 포도당, 1 M NaOH를 사용하여 7.4로 pH 조정) 3,4,19. 그림 1과 같이 박리 핀을 사용하여 심장과 폐를 고정하여 큰 PV와 PA가 명확하게 보이고 폐의 왼쪽 엽이 약간 늘어나도록 합니다.
- 큰 폐정맥(PV)을 기준점으로 사용하여 작은 폐 내 정맥(작은 PV, 직경 약 50-100μm, 그림 1에서 점선 직사각형으로 표시)을 둘러싼 조직을 가는 가위로 조심스럽게 제거합니다. 작은 PV와의 직접적인 접촉을 피하십시오. 작은 PV를 주변 조직과 부드럽게 분리하십시오.
- 약 1-2mm 길이의 작은 PV 세그먼트를 분리합니다. 작은 PV를 4-10 °C hepes-PSS에 놓습니다.
2. Ca2+ 표시기로 작은 PV로드
알림: 작은 PV는 집게가 PV의 끝에만 닿도록 조심스럽게 다루어야 합니다. 이 방법은 앞서설명한 기술 3,7,20,21을 변형한 것입니다.
- DMSO 3,4를 사용하여 2.5mM Fluo-4 AM의 스톡 농도를 준비합니다. 위의 원액을 사용하여 HEPES-PSS로 10μM 플루오-4 AM 및 0.04% 플루론산을 제조합니다.
- 로딩 용액 (10 μM fluo-4 AM 및 HEPES-PSS의 0.04 % pluronic acid)과 함께 1.5 mL 튜브에 작은 PV를 놓습니다 3,4. 튜브를 알루미늄 호일로 덮고 37°C에서 1시간 동안 배양하기 위해 수조에 넣습니다.
- 배양 후, 적재 용액을 4-10 °C HEPES-PSS로 조심스럽게 교체하고 세척 단계로 30 분 동안 얼음에 보관하십시오.
3. 소형 PV의 캐뉼레이션
참고: 이 방법은 앞에서 설명한 기술 3,20,21을 수정한 것입니다.
- 양쪽에 하나씩 두 개의 유리 캐뉼라가 있는 압력 근조영 챔버를 준비합니다. 10mL 주사기를 사용하여 용액을 21%O2 및 5% CO2로 버블링하여 pH 7.4로 유지한 PSS(119mM NaCl, 4.7mM KCl, 1.2mM KH2PO4, 1.2m MgCl2 160 hexahydrate, 2.5 mM CaCl2 dihydrate 3,4,21,22, 7 mM dextrose 및 24 mM NaHCO3)로 캐뉼라를 채웁니다.
- 세척 용액에서 작은 PV를 제거하고 압력 근조영실에 넣습니다. 끝이 가는 집게를 사용하여 작은 PV의 한쪽 끝을 캐뉼러 중 하나에 조심스럽게 캐뉼러를 끼웁니다. 그런 다음 나일론 실로 만든 마이크로 필라멘트를 사용하여 작은 PV의 캐뉼러 끝과 캐뉼라 끝 부분에 매듭을 묶어 고정합니다.
- PSS를 캐뉼라를 통해 부드럽게 밀어 PV 내부의 혈액을 제거합니다. 그림 1과 같이 나일론 실을 사용하여 마이크로 필라멘트를 사용하여 유리 캐뉼러로 다른 쪽 끝을 묶습니다.
4. 작은 PV의 가압 그리고 캘리포니아2+ 화상 진찰
참고: 이 방법은 앞에서설명한 기술 3,21을 수정한 것입니다.
- PSS가 들어있는 튜브에 부착 된 서보 압력 컨트롤러를 사용하여 한쪽 끝에서 5mm Hg로 작은 PV를 가압합니다. 입구와 출구에 연결된 연동 펌프를 사용하여 PSS를 수퍼 퓨즈합니다. 과용화물의 온도를 37°C로 유지하십시오.
- 평형 기간이 끝나면 40x water-dipping objective(NA 0.8)와 회전 디스크 컨포칼 이미징 시스템을 사용하여 1000프레임(프레임 속도: 초당 30프레임)의 Ca2+ 이미지를 획득합니다. 488nm 고체 레이저를 사용하여 Fluo-4를 여기하고 525/36nm 대역 통과 필터를 사용하여 방출된 형광을 캡처합니다.
- 랴노딘 수용체(RyR) 길항제인 랴노딘(5μM)21,23을 과분산물에 적용합니다. 5분 동안 기다립니다. 위에서 설명한 대로 Ca2+ 이미지를 다시 촬영하여 30프레임/초의 속도로 1000프레임을 더 캡처합니다.
5. 캘리포니아2+ 이미지 분석
참고: 이 방법은 이전에 설명한 기술 21,22,24를 수정한 것입니다. PV 근세포에서 Ca2+ 신호의 활성 변화는 PV에서 여기-수축 결합의 억제 또는 향상에 대한 중요한 통찰력을 제공할 수 있습니다.
- 맞춤 설계된 소프트웨어(https://github.com/vesselman/SparkAn 년 Adrian Bonev 박사가 개발)를 사용하여 Ca2+ 이미지를 분석합니다.
- 5 x 5 박스카 필터와 5 x 5 중앙값 필터를 사용하여 이미지를 매끄럽게 만듭니다. 이벤트 자동 감지를 위해 여러 셀이 있는 PV의 평평한 영역을 설명하는 프레임을 사용합니다.
- View and Event Autodetection(보기 및 이벤트 자동 감지)을 클릭합니다. 진폭에서 이벤트 임계값 1.3 F/F0, 허용 오차 20%, 스캔 상자 7 x 7 픽셀, 실행 평균 7개 이미지 설정을 사용합니다. 첫 번째 이미지부터 시작하여 10개의 이미지마다 평균 이미지를 자동으로 생성합니다.
- 검색 시작(눈 아이콘)을 클릭합니다. File(파일) 메뉴에서 Mark File(마크 파일)로 저장된 이벤트 테이블을 찾습니다. μm²당 이벤트를 계산하려면 감지된 Ca2+ 신호의 수를 선택한 프레임의 영역으로 나눕니다.
결과
그림 2A는 5mm Hg 내강 압력에서 작은 PV의 시야를 보여줍니다. + 기호는 녹색 윤곽선으로 표시된 선택한 프레임(비디오 1) 내에서 자동으로 감지된 Ca2+ 신호를 나타냅니다. 각 PV에서 하나의 시야가 기록되었고 각 마우스에서 하나의 PV가 사용되었습니다. 하나의 작은 PV는 n = 1로 간주되었습니다. 쌍을 이루는 실험에서 RyR 억제제 리야노딘(5μM)23을 첨가하기 전과 5분 후에 Ca2+ 신호의 수를 비교했습니다. 유의미한 차이를 탐지하기 위해 통계적 비교를 위해 쌍체 t-검정을 사용했습니다. 자발적으로 발생하는 Ca2+ 신호의 수는 위에서 설명한 조건에서 μm2 당 분당 0.73 ± 0.2 이벤트였습니다 (그림 2B, C). 라이아노딘 처리는 작은 PV에서 Ca2+ 신호를 거의 완전히 억제했으며(그림 2C, 비디오 2), μm2당 분당 이벤트의 급격한 감소로 나타났습니다. 이 데이터는 가압된 작은 PV에서 근세포층에서 Ca2+ 신호의 자발적인 활동이 RyR의 개방을 나타낸다는 것을 보여줍니다. 이러한 결과는 Ca2+ 신호의 활성이 생리학적 내강압 하에서 작은 PV에서 연구될 수 있다는 증거를 제공합니다. 이 방법은 작은 PV 근세포에서 Ca2+ 신호 전달에 대한 내강 압력 및 신경 체액 매개체의 영향에 대한 향후 연구를 촉진하여 PV 기능 조절에 대한 귀중한 통찰력을 제공할 수 있습니다. 현재 연구는 RyR Ca2+ 신호의 수에 초점을 맞추고 있지만, 지속 시간, 진폭, 공간 확산 및 상승 시간을 포함하여 이러한 신호의 운동 속성을 분석할 수도 있습니다. 생리학적 및 병리학적 자극이 RyR Ca2+ 신호의 운동 특성에 어떻게 영향을 미치는지 이해하면 건강한 상태와 질병 상태 모두에서 PV 기능의 조절에 관한 중요한 정보를 제공할 수 있습니다.
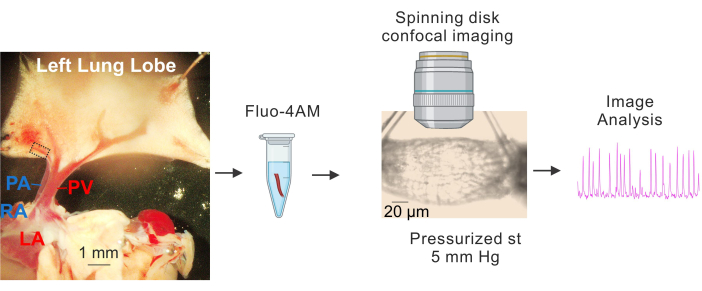
그림 1: PV의 준비 및 Ca2+ 이미징. 소형 PV의 식별 및 분리, fluo4-AM의 배양, 캐뉼레이션 및 가압(5mm Hg), 회전 디스크 고속 컨포칼 이미징 및 이미지 분석을 보여주는 순차적 이미지. 왼쪽 이미지에서 파선 사각형은 스터디에 사용된 PV를 나타냅니다. 약어: PA = 폐동맥; RA = 우심방; PV = 폐정맥; LA = 좌심방. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
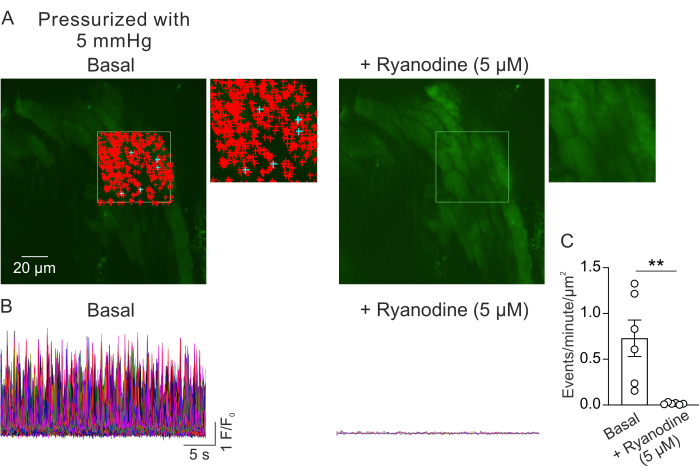
그림 2: Ca2+ 이미징 분석. (A) 가압(5mm Hg), fluo-4 로드, 부재 시 작은 PV(왼쪽) 또는 리아노딘(5μM; RyR 억제제, 오른쪽). 녹색 사각형은 자동 감지 Ca2+ 신호를 위해 선택된 영역을 나타냅니다. + 기호는 프레임 내에서 자동 감지된 이벤트를 나타냅니다. 빨간색 기호는 3000μm2 미만의 영역을 가진 신호를 나타내고 파란색 기호는 3000μm2 이상의 영역을 차지하는 신호를 나타냅니다. 각 + 기호는 하나의 Ca2+ 이벤트 또는 신호를 나타냅니다. (B) A에 표시된 선택된 영역에서 감지된 이벤트의 F/F0 흔적으로, 기저 조건(왼쪽) 및 리아노딘(오른쪽)의 존재 하에서 가압된 작은 PV로부터 근세포층에서 Ca2+ 신호의 활성을 보여줍니다. (C) 리아노딘 첨가 전후의 작은 PV에서 Ca2+ 신호의 μm2당 분당 이벤트 정량화(마우스당 1PV, n=6 마우스, **p < 0.01 대 Basal, 쌍체 t-검정). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
동영상 1: 리아노딘으로 치료하기 전에 5mmHg로 가압된 작은 PV의 Ca2+ 신호. field of view는 그림 2에서 녹색으로 표시된 선택된 프레임을 나타냅니다. 이 비디오를 다운로드하려면 여기를 클릭하십시오.
동영상 2: 리아노딘(5μM)으로 처리한 후 5mmHg로 가압된 작은 PV의 Ca2+ 신호. field of view는 그림 2에서 녹색으로 표시된 선택된 프레임을 나타냅니다. 이 비디오를 다운로드하려면 여기를 클릭하십시오.
토론
평활근 세포의 Ca2+ 신호는 혈관 기능을 조절하는 데 중요한 역할을 한다25. PV는 중요하지만 상대적으로 연구가 부족한 혈관층으로, 산소가 풍부한 혈액을 좌측 심장에 전달하는 역할을 한다26. 그러나 작은 PV의 Ca2+ 신호 전달 메커니즘과 생리적 기능에 미치는 영향은 알려져 있지 않습니다. 이 원고의 목표는 근세포층에 Ca2+ 신호를 기록하고 이러한 Ca2+ 신호를 분석하기 위해 작은 PV를 분리, 캐뉼레이션 및 가압하는 새로운 방법을 설명하는 것입니다. 작은 PV에서 Ca2+ 신호를 시각화하는 기능은 이러한 신호가 정상 및 질병 조건에서 어떻게 작동하는지에 대한 이해를 높이는 데 도움이 될 수 있습니다. 온전한 폐 내의 PV에서 Ca2+ 신호를 연구하면 생리학적으로 더 관련성 있는 데이터를 얻을 수 있지만, 작은 PV는 온전한 폐에서 명확하게 볼 수 없기 때문에 Ca2+ 염료 로딩 및 컨포칼 이미징에 기술적인 문제가 발생할 수 있습니다. 작은 PV를 분리 및 가압하면 생리학적 광강 내 압력, 온도 및 이온 용액에서 Ca2+ 신호를 관찰할 수 있는 대체 방법을 제공합니다.
이 원고에 기술된 PV의 Ca2+ 이미징은 전신 동맥에서 Ca2+ 이미징에 대한 잘 확립된 절차를 기반으로 합니다 21,22,27. 이 데이터는 작은 PV 근세포에서 Ca2+ 신호의 대다수가 RyR 이온 채널의 개방으로 인한 것임을 나타냅니다. 따라서 이 원고에 요약된 프로토콜은 RyR 조절과 정상적인 조건 및 질병에서 PV 기능에 미치는 영향에 대한 향후 연구를 가능하게 할 것입니다. RyR2 활성은 심장 근세포의 수축에 필수적이며,28 동맥 평활근 세포에서는 이완과 관련이 있습니다29. RyR 활동이 소규모 PV 수축에 미치는 정확한 영향은 아직 알려지지 않았습니다. 압력 근조영술은 작은 혈관 수축의 변화를 모니터링하기 위해 일반적으로 사용되는 기술입니다. 따라서 가압 PV 준비를 사용하여 작은 PV 수축을 모니터링 할 수도 있습니다.
Ryanodine은 RyR 활성에 대한 농도 의존적 효과를 나타내며, 서브 마이크로 몰 농도에서 증가시키고 마이크로 몰 농도에서 감소시킵니다23. 라이아노딘은 또한 작은 PV에서 다른 Ca2+ 신호에 대한 간접적인 억제 효과를 가질 수 있으며, 이는 테스트되지 않은 가능성입니다. 사용된 농도에서 PV에서 Ca2+ 신호의 보상적 증가를 관찰하지 못했습니다. 격리 및 가압 PV에서 Ca2+ 신호의 조절은 손상되지 않은 폐 내 PV의 조절과 다를 수 있으며, 이는 아직 연구되지 않은 가능성입니다. 그러나 마취된 마우스의 온전한 폐에 있는 작은 PV에서 Ca2+ 신호를 기록하는 것은 흉강 내 폐의 위치와 마취된 마우스에서 PV에 Ca2+ 지시약을 선택적으로 로드하는 어려움으로 인해 발생하는 중요한 문제를 제시합니다.
혈류 전단 응력은 혈관의 기능을 변화시키는 것으로 알려져 있습니다. 현재 방법을 사용하면 작은 PV에서 Ca2+ 신호에 대한 내강 압력의 영향을 분리할 수 있지만 흐름 또는 전단 응력이 부족하다는 것은 잠재적인 제한 사항입니다. 그러나 유동 또는 전단 응력은 앞서 설명한 설정을 사용하여 Ca2+ 이미징과 함께 쉽게 통합되고 수행될 수 있습니다21. 흐름/전단 응력이 작은 PV에서 Ca2+ 신호의 활성을 수정할 수 있으며, 이는 향후 조사에 흥미로운 주제가 될 것입니다.
우리는 fluo-4-AM을 Ca2+ 지표로 사용하여 작은 PV에서 Ca2+ 신호를 기록했습니다. 실험 요구 사항에 따라 488nm(Calbryte 520 AM)7 또는 560nm(Calbryte 590 AM)30에서 여기될 수 있는 다른 Ca2+ 지표를 사용할 수 있어야 합니다. 스피닝 디스크 컨포칼 이미징 시스템을 사용하면 특히 PV 근세포에서 Ca2+ 신호를 이미징할 수 있습니다. 현재 연구에서는 연구되지 않았지만 내피 세포층에 초점을 맞추면 작은 PV에서 내피 Ca2+ 신호를 기록할 수 있습니다. PA와 PV는 기능적으로 다르며 뚜렷한 미세환경에 노출됩니다. 따라서 작은 PA와 작은 PV 간의 근세포와 내피 Ca2+ 신호를 비교하면 기능적 차이에 대한 중요한 통찰력을 얻을 수 있습니다.
작은 PV의 Ca2+ 신호가 PV를 통한 산소가 풍부한 혈액의 흐름을 조절한다는 것은 그럴듯합니다. 좌심방 내부의 압력은 각 심장 주기 동안 4mmHg에서 12mmHg로 변합니다17,18. PV는 좌심방에 혈액을 공급하기 때문에 PVs 내부의 압력도 심장 주기 동안 변할 가능성이 있습니다. 이전 연구에서는 RyRs가 소동맥에서 내강내 압력에 의해 활성화될 수 있음을 보여주었다16. 따라서 PV Ca2+ 신호에 대한 광내압의 영향을 측정하면 PV에서 산소가 풍부한 혈액이 왼쪽 심장으로 전달되는 것에 대한 새로운 통찰력을 제공할 수 있습니다. 혈류의 신경 자극 및 체액성 매개체도 평활근 Ca2+ 신호를 활성화할 수 있습니다. 현재 방법은 PV Ca2+ 신호 및 PV 기능에 대한 신경체액 매개체의 영향에 대한 향후 연구를 촉진할 것입니다.
프로토콜 내에서 처리해야 할 몇 가지 중요한 단계가 있습니다. 폐정맥(PV)을 주의 깊게 절제하는 것은 매우 중요합니다. 해부 도구로 PV의 이미징 영역을 만지면 건강에 부정적인 영향을 미칠 수 있으므로 피하는 것이 중요합니다. PV의 끝만 건드려야 합니다. 해부 시간을 줄이면 성공률을 높일 수 있습니다. 염료 로딩이 충분하지 않으면 신호 대 잡음비가 낮아지고 이벤트 자동 감지 중에 거짓 긍정이 발생할 가능성이 높아질 수 있습니다. 여기에 설명된 프로토콜을 따르면 PV 근세포에서 적절한 염료 로딩을 보장할 수 있습니다.
요약하면, 우리는 작은 PV에서 Ca2+ 신호를 기록하는 방법을 제시했으며, 이를 통해 중요하지만 종종 간과되는 혈관층에서 Ca2+ 신호 전달 메커니즘을 조사할 수 있습니다. 중요한 것은, 정상적인 조건에서 작은 PV에서 Ca2+ 신호를 기록하는 능력은 폐고혈압, 폐 손상 및 심부전으로 인한 폐부종을 포함한 폐 질환에 대한 병리학적 메커니즘에 대한 귀중한 이해를 제공할 수 있다는 것입니다.
공개
저자는 공개할 내용이 없습니다.
감사의 말
이 연구는 NHLBI(HL167208, HL157407 및 HL146914)에서 SKS, NIDDK(DK138271)에서 YLC에 이르기까지 상금으로 자금을 지원받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| Custom-Designed SparkAn Software | University of Vermont | https://github.com/vesselman/SparkAn | |
| Fluo-4, AM | Thermo Fisher Scientific | F14201 | |
| FN1 Upright Microscope | Nikon | ||
| Heater/Temperature Controller | Warner Instruments | ||
| Imaging System | Andor | ||
| iQ 3.x acquisition Software | Andor | ||
| iXon EMCCD Cameras | Andor | ||
| Nylon Thread for Tying Blood Vessels | Living Systems Instrumentation | THR-G | |
| Pressure Myography Chamber | Instrumentation and Model Facility, University of Vermont, Burlington, VT, USA | ||
| Revolution WD (with Borealis) High Speed Spinning Disk Confocal Imaging System | Andor | ||
| Ryanodine | Bio-Techne | 1329 | |
| Servo Pressure Controller | Living Systems Instrumentation | ||
| SS Dissection Pins, 0.2mm dia | Living Systems Instrumentation | PIN-0.2mm | |
| Tubing Pump REGLO | ISMATEC | ISM4212 |
참고문헌
- Suresh, K., Shimoda, L. A. Lung circulation. Compr Physiol. 6 (2), 897-943 (2016).
- Sundjaja, J. H., Bordoni, B. Thorax, heart pulmonic valve. , StatPearls Publishing. Treasure Island, FL, USA. (2024).
- Daneva, Z., et al. Caveolar peroxynitrite formation impairs endothelial TRPV4 channels and elevates pulmonary arterial pressure in pulmonary hypertension. Proc Natl Acad Sci U S A. 118 (17), e2023130118(2021).
- Daneva, Z., et al. Endothelial pannexin 1-TRPV4 channel signaling lowers pulmonary arterial pressure in mice. Elife. 10, e67777(2021).
- Kuhr, F. K., Smith, K. A., Song, M. Y., Levitan, I., Yuan, J. X. New mechanisms of pulmonary arterial hypertension: role of Ca2+ signaling. Am J Physiol Heart Circ Physiol. 302 (8), H1546-H1562 (2012).
- Sonkusare, S. K., Laubach, V. E. Endothelial TRPV4 channels in lung edema and injury. Curr Top Membr. 89, 43-62 (2022).
- Kuppusamy, M., et al. Purinergic P2Y2 receptor-induced activation of endothelial TRPV4 channels mediates lung ischemia-reperfusion injury. Sci Signal. 16 (808), eadg1553(2023).
- Alvarez, D. F., et al. Transient receptor potential vanilloid 4-mediated disruption of the alveolar septal barrier: a novel mechanism of acute lung injury. Circ Res. 99 (9), 988-995 (2006).
- Balakrishna, S., et al. TRPV4 inhibition counteracts edema and inflammation and improves pulmonary function and oxygen saturation in chemically induced acute lung injury. Am J Physiol Lung Cell Mol Physiol. 307 (2), L158-L172 (2014).
- Suresh, K., et al. Reactive oxygen species induced Ca2+ influx via TRPV4 and microvascular endothelial dysfunction in the SU5416/hypoxia model of pulmonary arterial hypertension. Am J Physiol Lung Cell Mol Physiol. 314 (5), L893-L907 (2018).
- Haissaguerre, M., et al. Spontaneous initiation of atrial fibrillation by ectopic beats originating in the pulmonary veins. N Engl J Med. 339 (10), 659-666 (1998).
- Heijman, J., Voigt, N., Nattel, S., Dobrev, D. Cellular and molecular electrophysiology of atrial fibrillation initiation, maintenance, and progression. Circ Res. 114 (9), 1483-1499 (2014).
- Brunton, T. L., Fayrer, J. XXII Note on independent pulsation of the pulmonary veins and vena cava. Proc R Soc Lond. 25, 174-176 (1877).
- Namekata, I., et al. Involvement of the Na(+)/Ca(2+) exchanger in the automaticity of guinea-pig pulmonary vein myocardium as revealed by SEA0400. J Pharmacol Sci. 110 (1), 111-116 (2009).
- Cros, C., et al. Regional differences in Ca2+ signaling and transverse-tubules across left atrium from adult sheep. Int J Mol Sci. 24 (3), 2347(2023).
- Dabertrand, F., Nelson, M. T., Brayden, J. E. Ryanodine receptors, calcium signaling, and regulation of vascular tone in the cerebral parenchymal microcirculation. Microcirculation. 20 (4), 307-316 (2013).
- Nair, R., Lamaa, N. Pulmonary capillary wedge pressure. , StatPearls Publishing. Treasure Island, FL, USA. (2024).
- Fukuta, H., Little, W. C. The cardiac cycle and the physiologic basis of left ventricular contraction, ejection, relaxation, and filling. Heart Fail Clin. 4 (1), 1-11 (2008).
- Daneva, Z., et al. Endothelial IK and SK channel activation decreases pulmonary arterial pressure and vascular remodeling in pulmonary hypertension. Pulm Circ. 13 (1), e12186(2023).
- Marziano, C., et al. Nitric oxide-dependent feedback loop regulates transient receptor potential vanilloid 4 (TRPV4) channel cooperativity and endothelial function in small pulmonary arteries. J Am Heart Assoc. 6 (12), e007157(2017).
- Chen, Y. L., et al. Novel smooth muscle Ca2+-signaling nanodomains in blood pressure regulation. Circulation. 146 (7), 548-564 (2022).
- Sonkusare, S. K., et al. Elementary Ca2+ signals through endothelial TRPV4 channels regulate vascular function. Science. 336, 597-601 (2012).
- Arias-Cavieres, A., et al. Ryanodine receptor-mediated calcium release has a key role in hippocampal LTD induction. Front Cell Neurosci. 12, 403(2018).
- Chen, Y. L., et al. Calcium signal profiles in vascular endothelium from Cdh5-GCaMP8 and Cx40-GCaMP2 mice. J Vasc Res. 58 (3), 159-171 (2021).
- Ottolini, M., Sonkusare, S. K. The calcium signaling mechanisms in arterial smooth muscle and endothelial cells. Compr Physiol. 11 (2), 1831-1869 (2021).
- Boyette, L. C., Burns, B. Physiology, pulmonary circulation. , StatPearls Publishing. Treasure Island, FL, USA. (2024).
- Ottolini, M., et al. Local peroxynitrite impairs endothelial transient receptor potential vanilloid 4 channels and elevates blood pressure in obesity. Circulation. 141 (16), 1318-1333 (2020).
- Shan, J., et al. Phosphorylation of the ryanodine receptor mediates the cardiac fight or flight response in mice. J Clin Invest. 120 (12), 4388-4398 (2010).
- Knot, H. J., Standen, N. B., Nelson, M. T. Ryanodine receptors regulate arterial diameter and wall [Ca2+] in cerebral arteries of rat via Ca2+-dependent K+ channels. J Physiol. 1 (Pt 1), 211-221 (1998).
- Tischbirek, C., Birkner, A., Jia, H., Sakmann, B., Konnerth, A. Deep two-photon brain imaging with a red-shifted fluorometric Ca2+ indicator. Proc Natl Acad Sci U S A. 112 (36), 11377-11382 (2015).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유