Method Article
Obtención de imágenes de señales de Ca2+ en pequeñas venas pulmonares a presiones intraluminales fisiológicas
En este artículo
Resumen
En este protocolo, presentamos una técnica novedosa para registrar y analizar las señales de Ca2+ en las venas intrapulmonares (pequeñas venas pulmonares o PVs) a presiones intraluminales fisiológicas. La técnica consiste en aislar pequeños PV, incubarlos con un indicador de Ca2+ , canularlos y presurizarlos, imágenes confocales de señales de Ca2+ y análisis de datos.
Resumen
Las venas pulmonares transportan sangre rica en oxígeno desde los pulmones hasta el corazón izquierdo, por lo que cumplen una función importante en el suministro de sangre rica en oxígeno a los órganos vitales. Sin embargo, la mayoría de los estudios de la vasculatura pulmonar se han centrado en las arterias y capilares pulmonares en condiciones normales y patológicas. Las señales de Ca2+ son reguladores críticos de la función vascular. A pesar de las funciones fisiológicas críticas de las VP, las señales de Ca2+ en las VP intrapulmonares pequeñas no se han registrado en condiciones fisiológicas. En este trabajo, describimos una técnica para registrar la actividad de la señal de Ca2+ en PVs de ratón aislados, canulados y presurizados a 5 mmHg. Al incorporar un indicador de Ca2+ , podemos estudiar las señales de Ca2+ en la capa de miocitos de pequeños PV utilizando imágenes confocales de disco giratorio de alta velocidad en condiciones fisiológicas. Nuestros datos representativos indican que las señales de Ca2+ en miocitos PV pequeños están mediadas por aperturas de canales iónicos receptores de rianodina. Este método será de considerable interés para los investigadores en el campo de la fisiología y los trastornos vasculares pulmonares.
Introducción
La vasculatura pulmonar desempeña un papel importante en el intercambio de gases, la adición de oxígeno y la eliminación de dióxido de carbono de la sangre 1,2. Las arterias pulmonares (AP) reciben sangre pobre en oxígeno del corazón derecho. El intercambio gaseoso se produce a nivel de los capilares (capilares alveolares) y la sangre rica en oxígeno llega al corazón izquierdo a través de las venas pulmonares (VP). A diferencia de otras venas que transportan sangre pobre en oxígeno, las PV cumplen una función importante de llevar sangre rica en oxígeno al corazón izquierdo y, en consecuencia, a los órganos vitales del cuerpo. Sin embargo, los mecanismos de señalización que regulan la función de la PV en condiciones normales y de enfermedad son poco conocidos.
Los estudios sobre la vasculatura pulmonar se han centrado principalmente en las AP y los capilares pulmonares. Estudios recientes muestran que las señales de Ca2+ en las capas de células endoteliales y musculares lisas son cruciales en la regulación de la función de las PA 3,4,5. Además, los mecanismos anormales de señalización de Ca2+ son responsables del deterioro de la función de los PA y los capilares pulmonares en condiciones de enfermedad 6,7,8,9,10. Sin embargo, los estudios sobre las venas intrapulmonares (VP pequeñas) siguen siendo escasos. Se ha propuesto la actividad ectópica en los VP grandes adyacentes al corazón izquierdo (VP cardíacos) como fuente de fibrilación auricular en humanos11,12, y también se han demostrado señales de pulsación espontánea13 y Ca2+ 12,14,15 en VP grandes. Los VP pequeños suministran sangre rica en oxígeno a los VP grandes. Sin embargo, los mecanismos de señalización de Ca2+ en pequeñas PV no se han estudiado bajo presiones intraluminales fisiológicas.
En este manuscrito, presentamos un nuevo método para aislar, canular y presurizar pequeñas PVs e imágenes de señales de Ca2+ en miocitos PV utilizando microscopía confocal de disco giratorio de alta velocidad. El objetivo general de este método es registrar las señales espontáneas e inducidas de Ca2+ en pequeños miocitos PV bajo presiones intraluminales fisiológicas. La presión intraluminal desempeña un papel fundamental en la regulación de las señales de Ca2+ en los miocitos16. Típicamente, los PV están sometidos a presiones intraluminales fisiológicas que oscilan entre 4 y 10 mm Hg17,18. Los cambios en la presión intraluminal a lo largo del ciclo cardíaco pueden influir en las señales de Ca2+ en los miocitos PV. Por lo tanto, es esencial emplear una técnica que nos permita estudiar estas señales en condiciones fisiológicas y examinar cómo las presiones intraluminales variables las afectan. Además, la mayoría de las investigaciones anteriores sobre las VP se han concentrado en las VP cardíacas más grandes. La técnica actual se centra en pequeños PV localizados en lo profundo de los pulmones, que pueden ser más relevantes para comprender la regulación de la función pulmonar tanto en la salud como en la enfermedad.
Protocolo
Todos los protocolos para animales fueron aprobados por el Comité de Cuidado y Uso de Animales de la Universidad de Virginia (protocolos 4100 y 4120). Los ratones C57BL6/J, de 10-12 semanas de edad, son sacrificados con pentobarbital (90 mg/kg; intraperitoneal), seguido de luxación cervical para la extracción de tejido pulmonar 3,4,19,20.
1. Aislamiento de pequeños PV
- Limpie las herramientas de disección y los platos con etanol al 100%, seguido de un lavado con agua desionizada.
- Use tijeras para abrir la cavidad torácica. Use fórceps para extraer cuidadosamente el corazón y los pulmones de la cavidad torácica con un contacto mínimo de los pulmones.
- Colocar el tejido en una placa recubierta de Sylgard que contenga una solución salina fisiológica fría (4-10 °C) tamponada con HEPES (HEPES-PSS, en mM, 10 HEPES, 134 NaCl, 6 KCl, 1 MgCl,2 hexahidratados, 2 CaCl,2 dihidratados y 7 dextrosa, pH ajustado a 7,4 utilizando 1 M de NaOH)3,4,19. Use clavijas de disección para fijar el corazón y los pulmones de manera que los PV y PA grandes sean claramente visibles y el lóbulo izquierdo del pulmón esté ligeramente estirado, como se muestra en la Figura 1.
- Utilizando venas pulmonares grandes (VP) como puntos de referencia, extraiga cuidadosamente el tejido que rodea las venas intrapulmonares pequeñas (VP pequeñas, de aproximadamente 50-100 μm de diámetro, indicado por el rectángulo discontinuo en la Figura 1) con unas tijeras finas. Asegúrese de evitar el contacto directo con los VP pequeños. Aísle suavemente los VP pequeños del tejido circundante.
- Aísle segmentos de aproximadamente 1-2 mm de largo de PV pequeños. Coloque PV pequeños en HEPES-PSS de 4-10 °C.
2. Carga de PV pequeños con un indicador Ca2+
NOTA: Los VP pequeños deben manipularse con cuidado, asegurándose de que las pinzas toquen solo las puntas de los VP. Este método es una modificación de la técnica descrita anteriormente 3,7,20,21.
- Prepare una concentración de stock de 2,5 mM Fluo-4 AM con DMSO 3,4. Con la solución madre anterior, prepare 10 μM de fluo-4 AM y ácido plurónico al 0,04% con HEPES-PSS.
- Colocar pequeños PV en un tubo de 1,5 mL con la solución de carga (10 μM de fluo-4 AM y 0,04% de ácido plurónico en HEPES-PSS)3,4. Cubra el tubo con papel de aluminio y colóquelo en un baño de agua para la incubación a 37 °C durante 1 h.
- Después de la incubación, sustituya con cuidado la solución de carga por HEPES-PSS a 4-10 °C y manténgala en hielo durante 30 minutos como paso de lavado.
3. Canulación de pequeños PV
NOTA: Este método es una modificación de la técnica descrita anteriormente 3,20,21.
- Prepare la cámara de miografía a presión con dos cánulas de vidrio, una a cada lado. Llene las cánulas con PSS (119 mM de NaCl, 4,7 mM de KCl, 1,2 mM de KH2PO4, 1,2 mM de MgCl2 160 hexahidratado, 2,5 mM de CaCl2 dihidratado, 3,4,21,22, 7 mM de dextrosa y 24 mM de NaHCO 3, mantenidas a pH 7,4 burbujeando la solución con 21% deO2 y 5% de CO 2) utilizando una jeringa de 10 mL.
- Extraiga un pequeño PV de la solución de lavado y colóquelo en la cámara de miografía a presión. Con pinzas de punta fina, cánula cuidadosamente un extremo del pequeño PV en una de las cánulas. Luego, usando un microfilamento hecho de hilo de nylon, haga un nudo alrededor del extremo canulado del pequeño PV y la punta de la cánula para asegurarlo.
- Empuje el PSS suavemente a través de la cánula para eliminar la sangre dentro del PV. Use hilo de nailon para atar el otro extremo con una cánula de vidrio usando microfilamentos, como se muestra en la Figura 1.
4. Presurización e imágenes de Ca2+ de PV pequeño
NOTA: Este método es una modificación de la técnica descrita anteriormente 3,21.
- Usando un servocontrolador de presión conectado a un tubo que contiene PSS, presurice el pequeño PV desde un extremo a 5 mm Hg. Use una bomba peristáltica conectada a una entrada y una salida, para superfusionar el PSS. Mantenga la temperatura del superfusado a 37 °C.
- Después del período de equilibrio, adquiera imágenes Ca2+ durante 1000 fotogramas (velocidad de fotogramas: 30 fotogramas por segundo) utilizando el objetivo de inmersión en agua de 40x (NA 0,8) y un sistema de imágenes confocal de disco giratorio. Excite Fluo-4 con un láser de estado sólido de 488 nm y capture la fluorescencia emitida con un filtro de paso de banda de 525/36 nm.
- Aplicar el antagonista del receptor de rianodina (RyR) rianodina (5 μM)21,23 al superfusado. Espere 5 min. Vuelva a tomar las imágenes de Ca2+ como se describe anteriormente, capturando otros 1000 fotogramas a una velocidad de 30 fotogramas/s.
5. Análisis de imágenes Ca2+
NOTA: Este método es una modificación de la técnica descrita anteriormente 21,22,24. Los cambios en la actividad de las señales de Ca2+ en los miocitos PV pueden proporcionar información importante sobre la inhibición o mejora del acoplamiento excitación-contracción en los PV.
- Utilice un software diseñado a medida (desarrollado por el Dr. Adrian Bonev, https://github.com/vesselman/SparkAn) para analizar imágenes de Ca2+ .
- Suaviza las imágenes con el filtro de vagón de 5 x 5 y el filtro mediano de 5 x 5. Utilice un marco que delinee una región plana de PV con varias celdas para la detección automática de eventos.
- Haga clic en Vista y autodetección de eventos. Utilice los siguientes ajustes: umbral de evento con una amplitud de 1,3 F/F0, tolerancia del 20%, cuadro de escaneo de 7 x 7 píxeles y media móvil de 7 imágenes. Genere un promedio de imágenes automáticamente cada 10 imágenes, comenzando desde la primera imagen.
- Haga clic en Iniciar búsqueda (el icono del ojo). Busque la tabla de eventos guardada como un archivo de marca en el menú Archivo. Para calcular eventos por μm², divida el número de señales de Ca2+ detectadas por el área de la trama seleccionada.
Resultados
La figura 2A muestra un campo de visión de un pequeño PV a una presión intraluminal de 5 mm Hg. Los símbolos + indican las señales Ca2+ detectadas automáticamente dentro de un fotograma seleccionado (Vídeo 1), indicadas por el contorno verde. Se registró un campo de visión de cada PV y se utilizó un PV de cada ratón. Un VP pequeño se consideró como n=1. Se comparó el número de señales de Ca2+ por μm2 por minuto antes y 5 min después de la adición de rianodina inhibidor de RyR (5 μM)23 en experimentos pareados. Se utilizó una prueba t pareada para las comparaciones estadísticas con el fin de detectar diferencias significativas. El número de señales de Ca2+ que ocurrieron espontáneamente fue de 0,73 ± 0,2 eventos por minuto por μm2 (Figura 2B,C) en las condiciones descritas anteriormente. El tratamiento con rianodina inhibió casi por completo las señales de Ca2+ en PV pequeñas (Figura 2C, Video 2), como lo indica una reducción drástica de los eventos por minuto por μm2. Estos datos muestran que la actividad espontánea de las señales de Ca2+ en la capa de miocitos de pequeños PV presurizados representa aperturas de RyR. Estos resultados proporcionan evidencia de que la actividad de las señales de Ca2+ puede estudiarse en pequeñas PVs bajo presiones intraluminales fisiológicas. Este método facilitará futuros estudios sobre los efectos de la presión intraluminal y los mediadores neurohumorales en la señalización de Ca2+ en miocitos PV pequeños, lo que podría ofrecer información valiosa sobre la regulación de la función PV. Si bien el estudio actual se centra en el número de señales RyR Ca2+, también es posible analizar las propiedades cinéticas de estas señales, incluida la duración, la amplitud, la dispersión espacial y el tiempo de elevación. Comprender cómo los estímulos fisiológicos y patológicos afectan las propiedades cinéticas de las señales de RyR Ca2+ puede proporcionar información importante sobre la regulación de la función de PV tanto en estados sanos como enfermos.
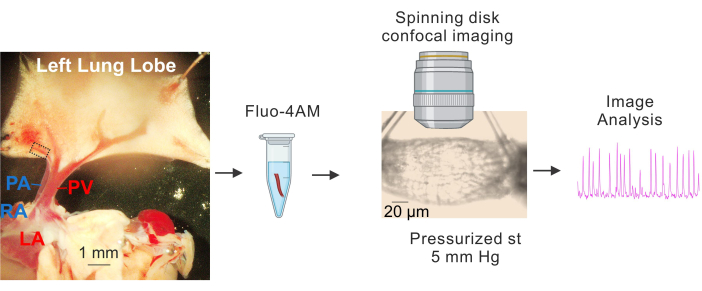
Figura 1: Preparación e imagen de Ca2+ de PVs. Imágenes secuenciales que muestran la identificación y el aislamiento de pequeños PV, la incubación de fluo4-AM, la canulación y presurización (5 mm Hg), la obtención de imágenes confocales de alta velocidad en disco giratorio y el análisis de imágenes. El rectángulo discontinuo de la imagen de la izquierda representa el PV utilizado para el estudio. Abreviaturas: PA = arteria pulmonar; RA = aurícula derecha; PV = vena pulmonar; LA = aurícula izquierda. Haga clic aquí para ver una versión más grande de esta figura.
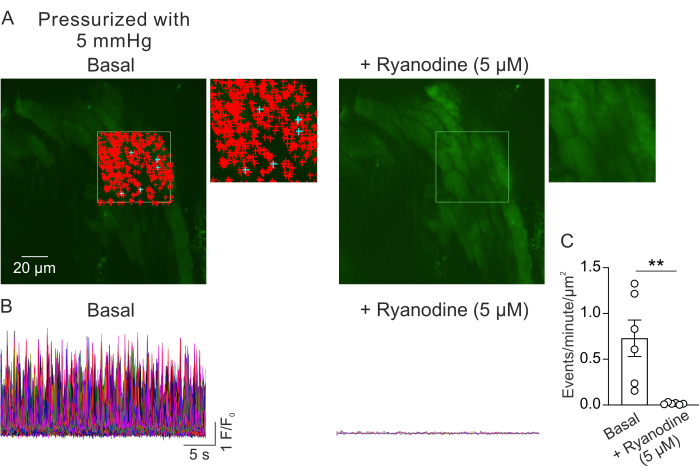
Figura 2: Análisis de imágenes de Ca2+ . (A) Imágenes de un campo de visión desde un PV presurizado (5 mm Hg), cargado con fluo-4, pequeño en ausencia (izquierda) o presencia de rianodina (5 μM; Inhibidor de RyR, derecha). El rectángulo verde denota el área que se seleccionó para las señales de detección automática Ca2+ . Los signos + representan eventos autodetectados dentro del fotograma. Los signos rojos indican señales con un área inferior a 3000 μm2, mientras que los signos azules indican señales que ocupan un área de más de 3000 μm2. Cada signo + indica un evento o señal Ca2+ . (B) Trazas F/F0 de eventos detectados desde el área seleccionada indicada en A, que muestran la actividad de las señales de Ca2+ en la capa de miocitos de pequeños PV presurizados en condiciones basales (izquierda) y en presencia de rianodina (derecha). (C) Cuantificación de eventos por minuto por μm2 de señales de Ca2+ en pequeños PVs antes y después de la adición de rianodina (1 PV por ratón; n=6 ratones; **p < 0,01 vs Basal; prueba t pareada). Haga clic aquí para ver una versión más grande de esta figura.
Vídeo 1: Señales de Ca2+ en un pequeño PV presurizado a 5 mm Hg antes del tratamiento con ryanodine. El campo de visión representa el fotograma seleccionado, que se muestra en color verde en la Figura 2. Haga clic aquí para descargar este video.
Vídeo 2: Señales de Ca2+ en un pequeño PV presurizado a 5 mm Hg después del tratamiento con rianodina (5 μM). El campo de visión representa el fotograma seleccionado, que se muestra en color verde en la Figura 2. Haga clic aquí para descargar este video.
Discusión
Las señales de Ca2+ en las células musculares lisas juegan un papel crucial en la regulación de la función vascular25. Los PV son un lecho vascular importante, pero relativamente poco estudiado, responsable de suministrar sangre rica en oxígeno al corazón izquierdo26. Sin embargo, se desconocen los mecanismos de señalización de Ca2+ en pequeñas PV y su impacto en la función fisiológica. El objetivo de este manuscrito es describir un nuevo método para aislar, canular y presurizar pequeños PVs para registrar señales de Ca2+ en la capa de miocitos y analizar estas señales de Ca2+ . La capacidad de visualizar señales de Ca2+ en pequeños PV podría ayudar a avanzar en nuestra comprensión de cómo funcionan estas señales en condiciones normales y enfermas. Si bien el estudio de las señales de Ca2+ en las PV dentro del pulmón intacto proporcionaría datos fisiológicamente más relevantes, las VP pequeñas no son claramente visibles en el pulmón intacto, lo que puede presentar desafíos técnicos con los colorantes de carga de Ca2+ y las imágenes confocales. El aislamiento y la presurización de pequeños PV ofrece una forma alternativa de observar las señales de Ca2+ bajo presiones intraluminales fisiológicas, temperatura y soluciones iónicas.
Las imágenes de Ca2+ de las VP descritas en este manuscrito se basan en nuestro procedimiento bien establecido para la obtención de imágenes de Ca2+ en arterias sistémicas 21,22,27. Los datos indican que la mayoría de las señales de Ca2+ en los miocitos PV pequeños se deben a las aperturas de los canales iónicos RyR. Por lo tanto, el protocolo descrito en este manuscrito permitirá futuros estudios sobre la regulación de RyR y su impacto en la función de PV en condiciones normales y en enfermedades. La actividad de RyR2 es esencial para las contracciones en los miocitos cardíacos28, mientras que en las células del músculo liso arterial, se ha asociado con la relajación29. El efecto preciso de la actividad de RyR en la pequeña contracción de PV sigue siendo desconocido. La micografía a presión es una técnica comúnmente utilizada para monitorear los cambios en la contracción de los vasos sanguíneos pequeños. Por lo tanto, es probable que la preparación presurizada de PV también se pueda utilizar para controlar pequeñas contracciones de PV.
La rionodina exhibe efectos dependientes de la concentración sobre la actividad de RyR, aumentándola a concentraciones submicromolares y disminuyéndola a concentraciones micromolares23. La rianodina también puede tener un efecto inhibidor indirecto sobre otras señales de Ca2+ en pequeñas PV, una posibilidad que no se ha probado. A la concentración utilizada, no observamos un aumento compensatorio de las señales de Ca2+ en los PV. La regulación de las señales de Ca2+ en las VP aisladas y presurizadas puede diferir de las de las VP dentro de un pulmón intacto, una posibilidad que aún no se ha explorado. Sin embargo, el registro de señales de Ca2+ en pequeños PV en el pulmón intacto de un ratón anestesiado presenta desafíos significativos, derivados de la ubicación del pulmón en la cavidad torácica y la dificultad de cargar un indicador de Ca2+ de forma selectiva en PV en un ratón anestesiado.
Se sabe que el estrés por cizallamiento del flujo sanguíneo altera la función de los vasos sanguíneos. Aunque el método actual permite aislar el efecto de la presión intraluminal sobre las señales de Ca2+ en PV pequeñas, la falta de flujo o esfuerzo cortante es una limitación potencial. Sin embargo, el esfuerzo de flujo o cizallamiento puede incorporarse fácilmente y realizarse en combinación con la obtención de imágenes de Ca2+ utilizando las configuraciones descritas anteriormente21. Es posible que el esfuerzo de flujo/cizallamiento modifique la actividad de las señales de Ca2+ en pequeños PV, lo que sería un tema interesante para futuras investigaciones.
Utilizamos fluo-4-AM como indicador de Ca2+ para registrar señales de Ca2+ en PVs pequeñas. Dependiendo de las necesidades experimentales, debería ser posible utilizar otros indicadores de Ca2+ que puedan ser excitados a 488 nm (Calbryte 520 AM)7 o 560 nm (Calbryte 590 AM)30. El uso de un sistema de imagen confocal de disco giratorio permite obtener imágenes de señales de Ca2+ , específicamente en miocitos PV. Aunque no se ha estudiado en el estudio actual, centrarse en la capa de células endoteliales permitirá el registro de señales endoteliales de Ca2+ en pequeñas PV. Las PA y las PV son funcionalmente diferentes y están expuestas a microambientes distintos. Por lo tanto, una comparación de las señales de Ca2+ de los miocitos y los endoteliales entre los PA pequeños y los PV pequeños puede proporcionar información crucial sobre sus diferencias funcionales.
Es plausible que las señales de Ca2+ en pequeñas PV regulen el flujo de sangre rica en oxígeno a través de las PV. La presión dentro de la aurícula izquierda cambia de 4 mmHg a 12 mmHg durante cada ciclo cardíaco17,18. Dado que los VP suministran sangre a la aurícula izquierda, es probable que la presión dentro de los VP también cambie durante el ciclo cardíaco. Estudios previos han demostrado que los RyRs pueden ser activados por presión intraluminal en pequeñas arterias16. Por lo tanto, la medición del efecto de la presión intraluminal en las señales de PV Ca2+ puede proporcionar nuevos conocimientos sobre el suministro de sangre rica en oxígeno desde las PV al corazón izquierdo. La estimulación nerviosa y los mediadores humorales en el torrente sanguíneo también pueden activar las señales de Ca2+ del músculo liso. El método actual facilitará futuros estudios sobre el impacto de los mediadores neurohumorales en las señales de PV Ca2+ y la función de PV.
Hay algunos pasos críticos dentro del protocolo que deben cuidarse. Una disección cuidadosa de las venas pulmonares (VP) es extremadamente importante. Es crucial evitar tocar el área de imagen de los VP con herramientas de disección, ya que esto puede afectar negativamente su salud. Solo se deben tocar los extremos de los PV. Reducir el tiempo de disección puede mejorar la tasa de éxito. Una carga insuficiente de colorante puede dar lugar a una menor relación señal-ruido y aumentar la probabilidad de falsos positivos durante la autodetección de eventos. Seguir el protocolo descrito aquí debería garantizar una carga adecuada de colorante en los miocitos PV.
En resumen, hemos presentado un método para registrar las señales de Ca2+ en pequeñas PVs, que permite investigar los mecanismos de señalización de Ca2+ en este lecho vascular importante pero a menudo pasado por alto. Es importante destacar que la capacidad de registrar señales de Ca2+ en pequeñas VP en condiciones normales podría proporcionar una valiosa comprensión de los mecanismos patológicos de las enfermedades pulmonares, incluida la hipertensión pulmonar, la lesión pulmonar y el edema pulmonar inducido por insuficiencia cardíaca.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Esta investigación fue financiada por premios del NHLBI (HL167208, HL157407 y HL146914) a SKS y NIDDK (DK138271) a YLC.
Materiales
| Name | Company | Catalog Number | Comments |
| Custom-Designed SparkAn Software | University of Vermont | https://github.com/vesselman/SparkAn | |
| Fluo-4, AM | Thermo Fisher Scientific | F14201 | |
| FN1 Upright Microscope | Nikon | ||
| Heater/Temperature Controller | Warner Instruments | ||
| Imaging System | Andor | ||
| iQ 3.x acquisition Software | Andor | ||
| iXon EMCCD Cameras | Andor | ||
| Nylon Thread for Tying Blood Vessels | Living Systems Instrumentation | THR-G | |
| Pressure Myography Chamber | Instrumentation and Model Facility, University of Vermont, Burlington, VT, USA | ||
| Revolution WD (with Borealis) High Speed Spinning Disk Confocal Imaging System | Andor | ||
| Ryanodine | Bio-Techne | 1329 | |
| Servo Pressure Controller | Living Systems Instrumentation | ||
| SS Dissection Pins, 0.2mm dia | Living Systems Instrumentation | PIN-0.2mm | |
| Tubing Pump REGLO | ISMATEC | ISM4212 |
Referencias
- Suresh, K., Shimoda, L. A. Lung circulation. Compr Physiol. 6 (2), 897-943 (2016).
- Sundjaja, J. H., Bordoni, B. . Thorax, heart pulmonic valve. , (2024).
- Daneva, Z., et al. Caveolar peroxynitrite formation impairs endothelial TRPV4 channels and elevates pulmonary arterial pressure in pulmonary hypertension. Proc Natl Acad Sci U S A. 118 (17), e2023130118 (2021).
- Daneva, Z., et al. Endothelial pannexin 1-TRPV4 channel signaling lowers pulmonary arterial pressure in mice. Elife. 10, e67777 (2021).
- Kuhr, F. K., Smith, K. A., Song, M. Y., Levitan, I., Yuan, J. X. New mechanisms of pulmonary arterial hypertension: role of Ca2+ signaling. Am J Physiol Heart Circ Physiol. 302 (8), H1546-H1562 (2012).
- Sonkusare, S. K., Laubach, V. E. Endothelial TRPV4 channels in lung edema and injury. Curr Top Membr. 89, 43-62 (2022).
- Kuppusamy, M., et al. Purinergic P2Y2 receptor-induced activation of endothelial TRPV4 channels mediates lung ischemia-reperfusion injury. Sci Signal. 16 (808), eadg1553 (2023).
- Alvarez, D. F., et al. Transient receptor potential vanilloid 4-mediated disruption of the alveolar septal barrier: a novel mechanism of acute lung injury. Circ Res. 99 (9), 988-995 (2006).
- Balakrishna, S., et al. TRPV4 inhibition counteracts edema and inflammation and improves pulmonary function and oxygen saturation in chemically induced acute lung injury. Am J Physiol Lung Cell Mol Physiol. 307 (2), L158-L172 (2014).
- Suresh, K., et al. Reactive oxygen species induced Ca2+ influx via TRPV4 and microvascular endothelial dysfunction in the SU5416/hypoxia model of pulmonary arterial hypertension. Am J Physiol Lung Cell Mol Physiol. 314 (5), L893-L907 (2018).
- Haissaguerre, M., et al. Spontaneous initiation of atrial fibrillation by ectopic beats originating in the pulmonary veins. N Engl J Med. 339 (10), 659-666 (1998).
- Heijman, J., Voigt, N., Nattel, S., Dobrev, D. Cellular and molecular electrophysiology of atrial fibrillation initiation, maintenance, and progression. Circ Res. 114 (9), 1483-1499 (2014).
- Brunton, T. L., Fayrer, J. Note on independent pulsation of the pulmonary veins and vena cava. Proc R Soc Lond. 25, 174-176 (1877).
- Namekata, I., et al. Involvement of the Na(+)/Ca(2+) exchanger in the automaticity of guinea-pig pulmonary vein myocardium as revealed by SEA0400. J Pharmacol Sci. 110 (1), 111-116 (2009).
- Cros, C., et al. Regional differences in Ca2+ signaling and transverse-tubules across left atrium from adult sheep. Int J Mol Sci. 24 (3), 2347 (2023).
- Dabertrand, F., Nelson, M. T., Brayden, J. E. Ryanodine receptors, calcium signaling, and regulation of vascular tone in the cerebral parenchymal microcirculation. Microcirculation. 20 (4), 307-316 (2013).
- Nair, R., Lamaa, N. . Pulmonary capillary wedge pressure. , (2024).
- Fukuta, H., Little, W. C. The cardiac cycle and the physiologic basis of left ventricular contraction, ejection, relaxation, and filling. Heart Fail Clin. 4 (1), 1-11 (2008).
- Daneva, Z., et al. Endothelial IK and SK channel activation decreases pulmonary arterial pressure and vascular remodeling in pulmonary hypertension. Pulm Circ. 13 (1), e12186 (2023).
- Marziano, C., et al. Nitric oxide-dependent feedback loop regulates transient receptor potential vanilloid 4 (TRPV4) channel cooperativity and endothelial function in small pulmonary arteries. J Am Heart Assoc. 6 (12), e007157 (2017).
- Chen, Y. L., et al. Novel smooth muscle Ca2+-signaling nanodomains in blood pressure regulation. Circulation. 146 (7), 548-564 (2022).
- Sonkusare, S. K., et al. Elementary Ca2+ signals through endothelial TRPV4 channels regulate vascular function. Science. 336, 597-601 (2012).
- Arias-Cavieres, A., et al. Ryanodine receptor-mediated calcium release has a key role in hippocampal LTD induction. Front Cell Neurosci. 12, 403 (2018).
- Chen, Y. L., et al. Calcium signal profiles in vascular endothelium from Cdh5-GCaMP8 and Cx40-GCaMP2 mice. J Vasc Res. 58 (3), 159-171 (2021).
- Ottolini, M., Sonkusare, S. K. The calcium signaling mechanisms in arterial smooth muscle and endothelial cells. Compr Physiol. 11 (2), 1831-1869 (2021).
- Boyette, L. C., Burns, B. . Physiology, pulmonary circulation. , (2024).
- Ottolini, M., et al. Local peroxynitrite impairs endothelial transient receptor potential vanilloid 4 channels and elevates blood pressure in obesity. Circulation. 141 (16), 1318-1333 (2020).
- Shan, J., et al. Phosphorylation of the ryanodine receptor mediates the cardiac fight or flight response in mice. J Clin Invest. 120 (12), 4388-4398 (2010).
- Knot, H. J., Standen, N. B., Nelson, M. T. Ryanodine receptors regulate arterial diameter and wall [Ca2+] in cerebral arteries of rat via Ca2+-dependent K+ channels. J Physiol. 1 (Pt 1), 211-221 (1998).
- Tischbirek, C., Birkner, A., Jia, H., Sakmann, B., Konnerth, A. Deep two-photon brain imaging with a red-shifted fluorometric Ca2+ indicator. Proc Natl Acad Sci U S A. 112 (36), 11377-11382 (2015).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados