Method Article
הדמיית אותות Ca2+ בוורידי ריאה קטנים בלחצים תוך-לומינליים פיזיולוגיים
In This Article
Summary
בפרוטוקול זה, אנו מציגים טכניקה חדשה לרישום וניתוח אותות Ca2+ בוורידים תוך-ריאתיים (ורידים ריאתיים קטנים או PVs) בלחצים תוך-לומינליים פיזיולוגיים. הטכניקה כוללת בידוד PVs קטנים, דגירה שלהם עם מחוון Ca2+ , קנולציה ולחץ עליהם, הדמיה קונפוקלית של אותות Ca2+ וניתוח נתונים.
Abstract
ורידי ריאה (PVs) נושאים דם עשיר בחמצן מהריאות בחזרה ללב השמאלי, ובכך ממלאים תפקיד חשוב באספקת דם עשיר בחמצן לאיברים חיוניים. עם זאת, רוב המחקרים על כלי דם ריאתיים התמקדו בעורקי ריאה ונימים בתנאים רגילים ומחלה. אותות Ca2+ הם מווסתים קריטיים של תפקוד כלי הדם. למרות התפקידים הפיזיולוגיים הקריטיים של PVs, אותות Ca2+ ב-PVs תוך-ריאתיים קטנים לא תועדו בתנאים פיזיולוגיים. כאן, אנו מתארים טכניקה לרישום פעילות אות Ca2+ ב-PVs של עכברים מבודדים, קנולטים ומופעלים בלחץ ב-5 מ"מ כספית. על ידי שילוב מחוון Ca2+ , אנו יכולים לחקור אותות Ca2+ בשכבת המיוציט של PVs קטנים באמצעות הדמיה קונפוקלית של דיסק מסתובב במהירות גבוהה בתנאים פיזיולוגיים. הנתונים המייצגים שלנו מצביעים על כך שאותות Ca2+ במיוציטים PV קטנים מתווכים על ידי פתחים של תעלות יונים של קולטני ריאנודין. שיטה זו תעורר עניין רב לחוקרים בתחום הפיזיולוגיה וההפרעות של כלי הדם הריאתיים.
Introduction
כלי הדם הריאתיים ממלאים תפקיד חשוב בהחלפת גזים, הוספת חמצן והוצאת פחמן דו חמצני מהדם 1,2. עורקי הריאה (PAs) מקבלים דם דל בחמצן מהלב הימני. חילופי הגזים מתרחשים ברמת הנימים (נימים מכתשית), ודם עשיר בחמצן מועבר ללב השמאלי על ידי ורידים ריאתיים (PVs). בניגוד לוורידים אחרים הנושאים דם דל בחמצן, PVs ממלאים תפקיד חשוב של העברת דם עשיר בחמצן ללב השמאלי וכתוצאה מכך לאיברים חיוניים בגוף. עם זאת, מנגנוני האיתות המווסתים את תפקוד ה-PV בתנאים רגילים ומחלה אינם מובנים היטב.
מחקרים על כלי דם ריאתיים התמקדו בעיקר ב-PAs ובנימי ריאה. מחקרים אחרונים מראים כי אותות Ca2+ בשכבות תאי האנדותל והשריר החלק הם חיוניים בוויסות התפקוד של PAs 3,4,5. יתר על כן, מנגנוני איתות חריגים של Ca2+ אחראים לתפקוד לקוי של PAs ונימי ריאה במצבי מחלה 6,7,8,9,10. עם זאת, מחקרים על ורידים תוך-ריאתיים (PVs קטנים) נותרו נדירים. פעילות חוץ רחמית ב-PVs גדולים הסמוכים ללב השמאלי (PVs לבביים) הוצעה כמקור לפרפור פרוזדורים בבני אדם11,12, ופעימה ספונטנית13 ואותות Ca2+ 12,14,15 הוצגו גם ב-PVs גדולים. PVs קטנים מספקים דם עשיר בחמצן ל-PVs גדולים. עם זאת, מנגנוני איתות Ca2+ ב-PVs קטנים לא נחקרו תחת לחצים תוך-לומינליים פיזיולוגיים.
בכתב יד זה, אנו מציגים שיטה חדשה לבידוד, קנולציה ולחץ של PVs קטנים והדמיית אותות Ca2+ במיוציטים PV באמצעות מיקרוסקופיה קונפוקלית של דיסק מסתובב במהירות גבוהה. המטרה הכוללת של שיטה זו היא להקליט אותות Ca2+ ספונטניים ומושרים במיוציטים PV קטנים תחת לחצים תוך-לומינליים פיזיולוגיים. לחץ תוך-לומינלי ממלא תפקיד קריטי בוויסות אותות Ca2+ במיוציטים16. בדרך כלל, PVs נתונים ללחצים תוך-לומינליים פיזיולוגיים הנעים בין 4 ל-10 מ"מ כספית17,18. שינויים בלחץ התוך-לומינלי לאורך מחזור הלב יכולים להשפיע על אותות Ca2+ במיוציטים PV. לכן, חיוני להשתמש בטכניקה המאפשרת לנו לחקור את האותות הללו בתנאים פיזיולוגיים ולבחון כיצד לחצים תוך-לומינליים משתנים משפיעים עליהם. בנוסף, רוב המחקרים הקודמים על PVs התמקדו ב-PVs לבביים גדולים יותר. הטכניקה הנוכחית מתמקדת ב-PVs קטנים הממוקמים עמוק בתוך הריאות, מה שעשוי להיות רלוונטי יותר להבנת ויסות תפקוד הריאות הן בבריאות והן בחולי.
Protocol
כל הפרוטוקולים לבעלי חיים אושרו על ידי הוועדה לטיפול ושימוש בבעלי חיים של אוניברסיטת וירג'יניה (פרוטוקולים 4100 ו-4120). עכברי C57BL6/J, בגילאי 10-12 שבועות, מורדמים עם פנטוברביטל (90 מ"ג/ק"ג; תוך צפק), ואחריו נקע צוואר הרחם לקצירת רקמת ריאה 3,4,19,20.
1. בידוד של PVs קטנים
- נקו את כלי החיתוך והכלים עם 100% אתנול, ולאחר מכן שטפו במים נטולי יונים.
- השתמש במספריים כדי לפתוח את חלל בית החזה. השתמש במלקחיים כדי להסיר בזהירות את הלב והריאות מחלל בית החזה עם נגיעה מינימלית בריאות.
- הנח את הרקמה על צלחת מצופה סילגארד המכילה תמיסת מלח פיזיולוגית קרה (4-10 מעלות צלזיוס) עם חוצץ HEPES (HEPES-PSS, במ"מ, 10 HEPES, 134 NaCl, 6 KCl, 1 MgCl2 הקסהידרט, 2 CaCl2 דיהידרט ו-7 דקסטרוז, pH מותאם ל-7.4 באמצעות 1 M NaOH)3,4,19. השתמש בפיני דיסקציה כדי להצמיד את הלב והריאות כך שה-PVs וה-PAs הגדולים נראים בבירור והאונה השמאלית של הריאה נמתחת מעט, כפי שמוצג באיור 1.
- באמצעות ורידי ריאה גדולים (PVs) כנקודות ייחוס, הסר בזהירות את הרקמה המקיפה את הוורידים התוך-ריאתיים הקטנים (PVs קטנים, בקוטר של כ-50-100 מיקרומטר, המסומן על ידי המלבן המקווקו באיור 1) בעזרת מספריים עדינים. הקפד להימנע ממגע ישיר עם ה-PVs הקטנים. בודד בעדינות את ה-PVs הקטנים מהרקמה שמסביב.
- בודד מקטעים באורך של כ-1-2 מ"מ של PVs קטנים. הנח PVs קטנים ב-4-10 מעלות צלזיוס.
2. טעינת PVs קטנים עם מחוון Ca2+
הערה: יש לטפל בזהירות ב-PVs קטנים, ולוודא שהמלקחיים נוגעים רק בקצות ה-PV. שיטה זו היא שינוי של הטכניקה שתוארה קודם לכן 3,7,20,21.
- הכן ריכוז מלאי של 2.5 מ"מ Fluo-4 AM עם DMSO 3,4. בעזרת תמיסת המלאי לעיל, הכינו 10 מיקרומטר fluo-4 AM וחומצה פלורונית 0.04% עם HEPES-PSS.
- הנח PVs קטנים בצינור של 1.5 מ"ל עם תמיסת הטעינה (10 מיקרומטר fluo-4 AM ו-0.04% חומצה פלורונית ב-HEPES-PSS)3,4. מכסים את הצינור בנייר אלומיניום ומניחים באמבט מים לדגירה בטמפרטורה של 37 מעלות צלזיוס למשך שעה.
- לאחר הדגירה, החלף בזהירות את תמיסת ההעמסה ב-4-10 מעלות צלזיוס HEPES-PSS ושמור על קרח למשך 30 דקות כשלב כביסה.
3. קנולציה של PVs קטנים
הערה: שיטה זו היא שינוי של הטכניקה שתוארה קודם לכן 3,20,21.
- הכן את תא מיוגרפיית הלחץ עם שתי צינוריות זכוכית, אחת מכל צד. מלאו את הצינוריות ב-PSS (119 מ"מ NaCl, 4.7 מ"מ KCl, 1.2 מ"מ KH2PO4, 1.2 מ"מ MgCl2 160 הקסהידרט, 2.5 מ"מ CaCl2 דיהידראט 3,4,21,22, 7 מ"מ דקסטרוז ו-24 מ"מ NaHCO3, נשמר ב-pH 7.4 על ידי בעבוע התמיסה עם 21% O2 ו-5% CO2) באמצעות מזרק של 10 מ"ל.
- הסר PV קטן מתמיסת הכביסה והנח אותו בתא מיוגרפיית הלחץ. בעזרת מלקחיים בעלי קצה עדין, קנו בזהירות קצה אחד של ה-PV הקטן על אחת הצינוריות. לאחר מכן, בעזרת מיקרופילמנט העשוי מחוט ניילון, קשרו קשר סביב הקצה הקנולטי של ה-PV הקטן וקצה הצינורית כדי לאבטח אותו.
- דחוף את ה-PSS בעדינות דרך הצינורית כדי להסיר את הדם בתוך ה-PV. השתמש בחוט ניילון כדי לקשור את הקצה השני עם צינורית זכוכית באמצעות מיקרו-פילמנטים, כפי שמוצג באיור 1.
4. לחץוהדמיית Ca2+ של PV קטן
הערה: שיטה זו היא שינוי של הטכניקה שתוארה קודם לכן 3,21.
- באמצעות בקר לחץ סרוו המחובר לצינור המכיל PSS, לחץ על ה-PV הקטן מקצה אחד ב-5 מ"מ כספית. השתמש במשאבה פריסטלטית המחוברת הן לכניסה והן ליציאה, כדי להתיך את ה-PSS. שמור על טמפרטורת הסופרפוסאט על 37 מעלות צלזיוס.
- לאחר תקופת שיווי המשקל, רכוש תמונות Ca2+ עבור 1000 פריימים (קצב פריימים: 30 פריימים לשנייה) באמצעות מטרת טבילת מים פי 40 (NA 0.8) ומערכת הדמיה קונפוקלית של דיסק מסתובב. Excite Fluo-4 באמצעות לייזר מצב מוצק של 488 ננומטר ולכידת פלואורסצנטיות הנפלטת באמצעות מסנן מעביר פס של 525/36 ננומטר.
- מרחו את אנטגוניסט קולטן הריאנודין (RyR) ריאנודין (5 מיקרומטר)21,23 על הסופרפוסאט. המתן 5 דקות. צלם מחדש את תמונות Ca2+ כמתואר לעיל, וצלם עוד 1000 פריימים בקצב של 30 פריימים לשנייה.
5. ניתוח תמונות Ca2+
הערה: שיטה זו היא שינוי של הטכניקה שתוארה קודם לכן 21,22,24. שינויים בפעילות של אותות Ca2+ במיוציטים PV יכולים לספק תובנות חשובות לגבי עיכוב או שיפור של צימוד עירור-התכווצות ב-PVs.
- השתמש בתוכנה מותאמת אישית (שפותחה על ידי ד"ר אדריאן בונב, https://github.com/vesselman/SparkAn) כדי לנתח תמונות Ca2+ .
- החלקת תמונות באמצעות מסנן 5 x 5 ומסנן חציוני של 5 x 5. השתמש במסגרת המתארת אזור שטוח של PV עם תאים מרובים לזיהוי אוטומטי של אירועים.
- לחץ על תצוגה וזיהוי אוטומטי של אירועים. השתמש בהגדרות הבאות: סף אירועים במשרעת של 1.3 F/F0, רגישות של 20%, תיבת סריקה של 7 x 7 פיקסלים וממוצע ריצה של 7 תמונות. צור תמונות ממוצעות באופן אוטומטי כל 10 תמונות, החל מהתמונה הראשונה.
- לחץ על התחל חיפוש (סמל העין). מצא את טבלת האירועים שנשמרה כקובץ סימון בתפריט קובץ. כדי לחשב אירועים למיקרומטר רבוע, חלקו את מספר אותות Ca2+ שזוהו בשטח המסגרת שנבחרה.
תוצאות
איור 2A מציג שדה ראייה מ-PV קטן בלחץ תוך-לומינלי של 5 מ"מ כספית. הסמלים + מציינים את אותות Ca2+ שזוהו אוטומטית בתוך מסגרת שנבחרה (וידאו 1), המסומנים על ידי המתאר הירוק. שדה ראייה אחד נרשם מכל PV, ו-PV אחד שימש מכל עכבר. PV קטן אחד נחשב כ-n=1. מספר אותות Ca2+ למיקרומטר2 לדקה הושווה לפני ו-5 דקות לאחר הוספת מעכב RyR ריאנודין (5 מיקרומטר)23 בניסויים זוגיים. מבחן t זוגי שימש להשוואות סטטיסטיות כדי לזהות הבדלים משמעותיים. מספר אותות Ca2+ המתרחשים באופן ספונטני היה 0.73 ± 0.2 אירועים לדקה למיקרומטר2 (איור 2B,C) בתנאים שתוארו לעיל. הטיפול בריאנודין עיכב כמעט לחלוטין את אותות Ca2+ ב-PVs קטנים (איור 2C, וידאו 2), כפי שמצוין על ידי ירידה דרסטית באירועים לדקה למיקרומטר2. נתונים אלה מראים שפעילות ספונטנית של אותות Ca2+ בשכבת המיוציטים מ-PVs קטנים בלחץ מייצגת פתחים של RyRs. תוצאות אלו מספקות ראיות לכך שניתן לחקור את הפעילות של אותות Ca2+ ב-PVs קטנים תחת לחצים תוך-לומינליים פיזיולוגיים. שיטה זו תקל על מחקרים עתידיים על ההשפעות של לחץ תוך-לומינלי ומתווכים נוירו-הומורליים על איתות Ca2+ במיוציטים PV קטנים, מה שעשוי להציע תובנות חשובות לגבי ויסות תפקוד ה-PV. בעוד שהמחקר הנוכחי מתמקד במספר אותות RyR Ca2+, ניתן גם לנתח את המאפיינים הקינטיים של אותות אלה, כולל משך זמן, משרעת, התפשטות מרחבית וזמן עלייה. הבנת האופן שבו גירויים פיזיולוגיים ופתולוגיים משפיעים על התכונות הקינטיות של אותות RyR Ca2+ עשויה לספק מידע חשוב לגבי ויסות תפקוד ה-PV במצבים בריאים וחולים כאחד.
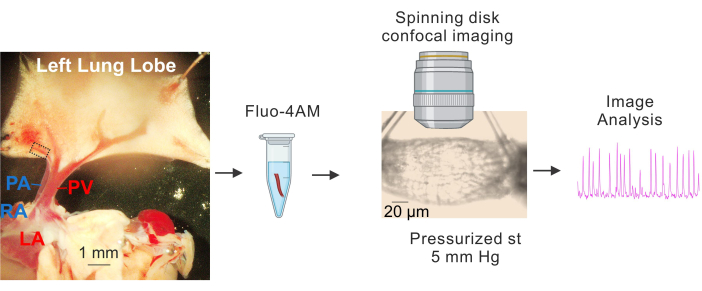
איור 1: הכנה והדמיית Ca2+ של PVs. תמונות עוקבות המציגות זיהוי ובידוד של PVs קטנים, דגירה של fluo4-AM, קנולציה ולחץ (5 מ"מ כספית), הדמיה קונפוקלית במהירות גבוהה של דיסק מסתובב וניתוח תמונה. המלבן המקווקו בתמונה משמאל מייצג את ה-PV ששימש למחקר. קיצורים: PA = עורק ריאתי; RA = פרוזדור ימני; PV = וריד ריאתי; LA = אטריום שמאלי. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
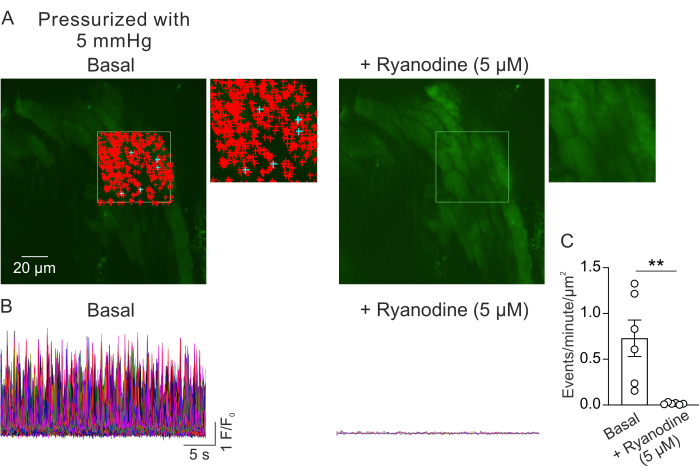
איור 2: ניתוח של הדמיית Ca2+ . (A) תמונות של שדה ראייה מ-PV קטן בלחץ (5 מ"מ כספית), טעון פלואו-4, בהיעדר (משמאל) או נוכחות של ריאנודין (5 מיקרומטר; מעכב RyR, מימין). המלבן הירוק מציין את האזור שנבחר לזיהוי אוטומטי של אותות Ca2+ . סימני + מייצגים אירועים שזוהו אוטומטית בתוך המסגרת. סימנים אדומים מציינים אותות בשטח של פחות מ-3000 מיקרומטר2, בעוד שסימנים כחולים מציינים אותות שתפסו שטח של יותר מ-3000 מיקרומטר2. כל סימן + מציין אירוע או אות Ca2+ אחד. (B) עקבות F/F0 של אירועים שזוהו מהאזור שנבחר שמצוין ב-A, שמראים את הפעילות של אותות Ca2+ בשכבת המיוציט מ-PVs קטנים בלחץ בתנאים בסיסיים (משמאל) ובנוכחות ריאנודין (מימין). (C) כימות אירועים לדקה למיקרומטר2 של אותות Ca2+ ב-PVs קטנים לפני ואחרי הוספת ריאנודין (1 PV לעכבר; n=6 עכברים; **p < 0.01 לעומת בסיסי; מבחן t מזווג). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
סרטון 1: Ca2+ אותות ב-PV קטן בלחץ של 5 מ"מ כספית לפני הטיפול בריאנודין. שדה הראייה מייצג את המסגרת שנבחרה, המוצגת בצבע ירוק באיור 2. אנא לחץ כאן להורדת סרטון זה.
סרטון 2: Ca2+ אותות ב-PV קטן בלחץ של 5 מ"מ כספית לאחר טיפול בריאנודין (5 מיקרומטר). שדה הראייה מייצג את המסגרת שנבחרה, המוצגת בצבע ירוק באיור 2. אנא לחץ כאן להורדת סרטון זה.
Discussion
אותות Ca2+ בתאי שריר חלק ממלאים תפקיד מכריע בוויסות תפקוד כלי הדם25. PVs הם מצע כלי דם חשוב אך לא נחקר יחסית האחראי על אספקת דם עשיר בחמצן ללב השמאלי26. עם זאת, מנגנוני איתות Ca2+ ב-PVs קטנים והשפעתם על התפקוד הפיזיולוגי אינם ידועים. מטרת כתב היד הזה היא לתאר שיטה חדשה לבידוד, קנולציה ולחץ של PVs קטנים כדי להקליט אותות Ca2+ בשכבת המיוציטים ולנתח את אותות Ca2+ הללו. היכולת לדמיין אותות Ca2+ ב-PVs קטנים יכולה לעזור לקדם את ההבנה שלנו כיצד אותות אלה פועלים בתנאים רגילים וחולים. בעוד שחקר אותות Ca2+ ב-PVs בתוך הריאה השלמה יספק נתונים רלוונטיים יותר מבחינה פיזיולוגית, PVs קטנים אינם נראים בבירור בריאה השלמה, מה שעלול להציג אתגרים טכניים בהעמסת צבעי Ca2+ והדמיה קונפוקלית. בידוד ולחץ PVs קטנים מציע דרך חלופית להתבונן באותות Ca2+ תחת לחצים תוך-לומינליים פיזיולוגיים, טמפרטורה ותמיסות יוניות.
הדמיית Ca2+ של PVs המתוארת בכתב יד זה מבוססת על הנוהל המבוסס שלנו להדמיית Ca2+ בעורקים מערכתיים 21,22,27. הנתונים מצביעים על כך שרוב אותות Ca2+ במיוציטים PV קטנים נובעים מפתחים של תעלות יונים RyR. לכן, הפרוטוקול המתואר בכתב יד זה יאפשר מחקרים עתידיים על ויסות RyR והשפעתו על תפקוד PV בתנאים רגילים ובמחלות. פעילות RyR2 חיונית להתכווצויות במיוציטים לבביים28, בעוד שבתאי שריר חלק עורקי, היא נקשרה להרפיה29. ההשפעה המדויקת של פעילות RyR על התכווצות PV קטנה נותרה לא ידועה. מיוגרפיית לחץ היא טכניקה נפוצה לניטור שינויים בהתכווצות כלי דם קטנים. לכן, סביר להניח שניתן להשתמש בהכנת PV בלחץ גם לניטור התכווצויות PV קטנות.
ריאנודין מציג השפעות תלויות ריכוז על פעילות RyR, מגדיל אותו בריכוזים תת-מיקרומולריים ומפחית אותו בריכוזים מיקרו-מולאריים23. לריאנודין עשויה להיות גם השפעה מעכבת עקיפה על אותות Ca2+ אחרים ב-PVs קטנים, אפשרות שלא נבדקה. בריכוז בו נעשה שימוש, לא ראינו עלייה מפצה באותות Ca2+ ב-PVs. הוויסות של אותות Ca2+ ב-PVs מבודדים ובלחץ עשוי להיות שונה מאלה ב-PVs בתוך ריאה שלמה, אפשרות שטרם נחקרה. עם זאת, רישום אותות Ca2+ ב-PVs קטנים בריאה השלמה מעכבר מורדם מציב אתגרים משמעותיים, הנובעים ממיקום הריאה בחלל בית החזה והקושי לטעון מחוון Ca2+ באופן סלקטיבי ב-PVs בעכבר מורדם.
ידוע כי מתח גזירה של זרימת הדם משנה את תפקוד כלי הדם. למרות שהשיטה הנוכחית מאפשרת לבודד את השפעת הלחץ התוך-לומינלי על אותות Ca2+ ב-PVs קטנים, היעדר מתח זרימה או גזירה הוא מגבלה פוטנציאלית. עם זאת, ניתן לשלב בקלות מתח זרימה או גזירה ולבצע אותו בשילוב עם הדמיית Ca2+ באמצעות הגדרות שתוארו קודם לכן21. ייתכן שמתח זרימה/גזירה משנה את הפעילות של אותות Ca2+ ב-PVs קטנים, מה שיהיה נושא מעניין למחקר עתידי.
השתמשנו ב-fluo-4-AM כמחוון Ca2+ כדי להקליט אותות Ca2+ ב-PVs קטנים. בהתאם לצרכי הניסוי, אמור להיות אפשרי להשתמש באינדיקטורים אחרים של Ca2+ שניתן לרגש ב-488 ננומטר (Calbryte 520 AM)7 או 560 ננומטר (Calbryte 590 AM)30. השימוש במערכת הדמיה קונפוקלית של דיסק מסתובב מאפשר הדמיה של אותות Ca2+ , במיוחד במיוציטים PV. למרות שלא נחקר במחקר הנוכחי, התמקדות בשכבת תאי האנדותל תאפשר הקלטה של אותות Ca2+ אנדותל ב-PVs קטנים. PAs ו-PVs שונים מבחינה תפקודית וחשופים למיקרו-סביבות שונות. לכן, השוואה של אותות Ca2+ מיוציטים ואנדותל בין PAs קטנים ל-PVs קטנים עשויה לספק תובנות מכריעות לגבי ההבדלים התפקודיים שלהם.
סביר להניח שאותות Ca2+ ב-PVs קטנים מווסתים את זרימת הדם העשיר בחמצן דרך PVs. הלחץ בתוך הפרוזדור השמאלי משתנה מ-4 מ"מ כספית ל-12 מ"מ כספית במהלך כל מחזור לב17,18. מכיוון ש-PVs מספקים דם לאטריום השמאלי, סביר להניח שהלחץ בתוך ה-PVs משתנה גם במהלך מחזור הלב. מחקרים קודמים הראו כי ניתן להפעיל RyRs על ידי לחץ תוך-לומינלי בעורקים קטנים16. לכן, מדידת ההשפעה של לחץ תוך-לומינלי על אותות PV Ca2+ עשויה לספק תובנות חדשות לגבי העברת דם עשיר בחמצן מ-PVs ללב השמאלי. גירוי עצבי ומתווכים הומורליים בזרם הדם יכולים גם להפעיל אותות Ca2+ של שריר חלק. השיטה הנוכחית תקל על מחקרים עתידיים על ההשפעה של מתווכים נוירו-הומורליים על אותות PV Ca2+ ותפקוד PV.
ישנם כמה שלבים קריטיים בתוך הפרוטוקול שצריך לטפל בהם. דיסקציה זהירה של ורידי הריאה (PVs) חשובה ביותר. חשוב להימנע מלגעת באזור ההדמיה של ה-PVs עם כלי דיסקציה, מכיוון שהדבר עלול להשפיע לרעה על בריאותם. יש לגעת רק בקצוות ה- PVs. הפחתת זמן הנתיחה יכולה לשפר את אחוזי ההצלחה. טעינת צבע לא מספקת עלולה לגרום ליחס אות לרעש נמוך יותר ולהגדיל את הסבירות לתוצאות חיוביות שגויות במהלך זיהוי אוטומטי של אירועים. ביצוע הפרוטוקול המתואר כאן אמור להבטיח העמסת צבע נאותה במיוציטים PV.
לסיכום, הצגנו שיטה להקלטת אותות Ca2+ ב-PVs קטנים, המאפשרת לחקור מנגנוני איתות Ca2+ במיטת כלי דם חשובה זו אך לעתים קרובות מתעלמים ממנה. חשוב לציין, היכולת להקליט אותות Ca2+ ב-PVs קטנים בתנאים רגילים יכולה לספק הבנה רבת ערך של מנגנונים פתולוגיים למחלות ריאה, כולל יתר לחץ דם ריאתי, פגיעה ריאתית ובצקת ריאות הנגרמת על ידי אי ספיקת לב.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
מחקר זה מומן על ידי פרסים מ-NHLBI (HL167208, HL157407 ו-HL146914) ל-SKS ו-NIDDK (DK138271) ל-YLC.
Materials
| Name | Company | Catalog Number | Comments |
| Custom-Designed SparkAn Software | University of Vermont | https://github.com/vesselman/SparkAn | |
| Fluo-4, AM | Thermo Fisher Scientific | F14201 | |
| FN1 Upright Microscope | Nikon | ||
| Heater/Temperature Controller | Warner Instruments | ||
| Imaging System | Andor | ||
| iQ 3.x acquisition Software | Andor | ||
| iXon EMCCD Cameras | Andor | ||
| Nylon Thread for Tying Blood Vessels | Living Systems Instrumentation | THR-G | |
| Pressure Myography Chamber | Instrumentation and Model Facility, University of Vermont, Burlington, VT, USA | ||
| Revolution WD (with Borealis) High Speed Spinning Disk Confocal Imaging System | Andor | ||
| Ryanodine | Bio-Techne | 1329 | |
| Servo Pressure Controller | Living Systems Instrumentation | ||
| SS Dissection Pins, 0.2mm dia | Living Systems Instrumentation | PIN-0.2mm | |
| Tubing Pump REGLO | ISMATEC | ISM4212 |
References
- Suresh, K., Shimoda, L. A. Lung circulation. Compr Physiol. 6 (2), 897-943 (2016).
- Sundjaja, J. H., Bordoni, B. . Thorax, heart pulmonic valve. , (2024).
- Daneva, Z., et al. Caveolar peroxynitrite formation impairs endothelial TRPV4 channels and elevates pulmonary arterial pressure in pulmonary hypertension. Proc Natl Acad Sci U S A. 118 (17), e2023130118 (2021).
- Daneva, Z., et al. Endothelial pannexin 1-TRPV4 channel signaling lowers pulmonary arterial pressure in mice. Elife. 10, e67777 (2021).
- Kuhr, F. K., Smith, K. A., Song, M. Y., Levitan, I., Yuan, J. X. New mechanisms of pulmonary arterial hypertension: role of Ca2+ signaling. Am J Physiol Heart Circ Physiol. 302 (8), H1546-H1562 (2012).
- Sonkusare, S. K., Laubach, V. E. Endothelial TRPV4 channels in lung edema and injury. Curr Top Membr. 89, 43-62 (2022).
- Kuppusamy, M., et al. Purinergic P2Y2 receptor-induced activation of endothelial TRPV4 channels mediates lung ischemia-reperfusion injury. Sci Signal. 16 (808), eadg1553 (2023).
- Alvarez, D. F., et al. Transient receptor potential vanilloid 4-mediated disruption of the alveolar septal barrier: a novel mechanism of acute lung injury. Circ Res. 99 (9), 988-995 (2006).
- Balakrishna, S., et al. TRPV4 inhibition counteracts edema and inflammation and improves pulmonary function and oxygen saturation in chemically induced acute lung injury. Am J Physiol Lung Cell Mol Physiol. 307 (2), L158-L172 (2014).
- Suresh, K., et al. Reactive oxygen species induced Ca2+ influx via TRPV4 and microvascular endothelial dysfunction in the SU5416/hypoxia model of pulmonary arterial hypertension. Am J Physiol Lung Cell Mol Physiol. 314 (5), L893-L907 (2018).
- Haissaguerre, M., et al. Spontaneous initiation of atrial fibrillation by ectopic beats originating in the pulmonary veins. N Engl J Med. 339 (10), 659-666 (1998).
- Heijman, J., Voigt, N., Nattel, S., Dobrev, D. Cellular and molecular electrophysiology of atrial fibrillation initiation, maintenance, and progression. Circ Res. 114 (9), 1483-1499 (2014).
- Brunton, T. L., Fayrer, J. Note on independent pulsation of the pulmonary veins and vena cava. Proc R Soc Lond. 25, 174-176 (1877).
- Namekata, I., et al. Involvement of the Na(+)/Ca(2+) exchanger in the automaticity of guinea-pig pulmonary vein myocardium as revealed by SEA0400. J Pharmacol Sci. 110 (1), 111-116 (2009).
- Cros, C., et al. Regional differences in Ca2+ signaling and transverse-tubules across left atrium from adult sheep. Int J Mol Sci. 24 (3), 2347 (2023).
- Dabertrand, F., Nelson, M. T., Brayden, J. E. Ryanodine receptors, calcium signaling, and regulation of vascular tone in the cerebral parenchymal microcirculation. Microcirculation. 20 (4), 307-316 (2013).
- Nair, R., Lamaa, N. . Pulmonary capillary wedge pressure. , (2024).
- Fukuta, H., Little, W. C. The cardiac cycle and the physiologic basis of left ventricular contraction, ejection, relaxation, and filling. Heart Fail Clin. 4 (1), 1-11 (2008).
- Daneva, Z., et al. Endothelial IK and SK channel activation decreases pulmonary arterial pressure and vascular remodeling in pulmonary hypertension. Pulm Circ. 13 (1), e12186 (2023).
- Marziano, C., et al. Nitric oxide-dependent feedback loop regulates transient receptor potential vanilloid 4 (TRPV4) channel cooperativity and endothelial function in small pulmonary arteries. J Am Heart Assoc. 6 (12), e007157 (2017).
- Chen, Y. L., et al. Novel smooth muscle Ca2+-signaling nanodomains in blood pressure regulation. Circulation. 146 (7), 548-564 (2022).
- Sonkusare, S. K., et al. Elementary Ca2+ signals through endothelial TRPV4 channels regulate vascular function. Science. 336, 597-601 (2012).
- Arias-Cavieres, A., et al. Ryanodine receptor-mediated calcium release has a key role in hippocampal LTD induction. Front Cell Neurosci. 12, 403 (2018).
- Chen, Y. L., et al. Calcium signal profiles in vascular endothelium from Cdh5-GCaMP8 and Cx40-GCaMP2 mice. J Vasc Res. 58 (3), 159-171 (2021).
- Ottolini, M., Sonkusare, S. K. The calcium signaling mechanisms in arterial smooth muscle and endothelial cells. Compr Physiol. 11 (2), 1831-1869 (2021).
- Boyette, L. C., Burns, B. . Physiology, pulmonary circulation. , (2024).
- Ottolini, M., et al. Local peroxynitrite impairs endothelial transient receptor potential vanilloid 4 channels and elevates blood pressure in obesity. Circulation. 141 (16), 1318-1333 (2020).
- Shan, J., et al. Phosphorylation of the ryanodine receptor mediates the cardiac fight or flight response in mice. J Clin Invest. 120 (12), 4388-4398 (2010).
- Knot, H. J., Standen, N. B., Nelson, M. T. Ryanodine receptors regulate arterial diameter and wall [Ca2+] in cerebral arteries of rat via Ca2+-dependent K+ channels. J Physiol. 1 (Pt 1), 211-221 (1998).
- Tischbirek, C., Birkner, A., Jia, H., Sakmann, B., Konnerth, A. Deep two-photon brain imaging with a red-shifted fluorometric Ca2+ indicator. Proc Natl Acad Sci U S A. 112 (36), 11377-11382 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved