Method Article
Sinais de imagem de Ca2+ em pequenas veias pulmonares a pressões intraluminais fisiológicas
Neste Artigo
Resumo
Neste protocolo, apresentamos uma nova técnica para registrar e analisar sinais de Ca2+ em veias intrapulmonares (pequenas veias pulmonares ou VPs) em pressões intraluminais fisiológicas. A técnica envolve isolar pequenas PVs, incubá-las com um indicador de Ca2+ , canulá-las e pressurizá-las, imagens confocais de sinais de Ca2+ e análise de dados.
Resumo
As veias pulmonares (VPs) transportam sangue rico em oxigênio dos pulmões de volta para o coração esquerdo, desempenhando assim uma função importante no fornecimento de sangue rico em oxigênio aos órgãos vitais. No entanto, a maioria dos estudos sobre a vasculatura pulmonar tem se concentrado nas artérias e capilares pulmonares em condições normais e de doença. Os sinais de Ca2+ são reguladores críticos da função vascular. Apesar dos papéis fisiológicos críticos das VPs, os sinais de Ca2+ em pequenas PVs intrapulmonares não foram registrados em condições fisiológicas. Aqui, descrevemos uma técnica para registrar a atividade do sinal de Ca2+ em PVs de camundongos isolados, canulados e pressurizados a 5 mmHg. Ao incorporar um indicador de Ca2+ , podemos estudar os sinais de Ca2+ na camada de miócitos de pequenos PVs usando imagens confocais de disco giratório de alta velocidade sob condições fisiológicas. Nossos dados representativos indicam que os sinais de Ca2+ em pequenos miócitos PV são mediados por aberturas de canais iônicos do receptor de rianodina. Este método será de considerável interesse para pesquisadores no campo da fisiologia e distúrbios vasculares pulmonares.
Introdução
A vasculatura pulmonar desempenha um papel importante na troca de gases, adição de oxigênio e remoção de dióxido de carbono do sangue 1,2. As artérias pulmonares (APs) recebem sangue pobre em oxigênio do coração direito. A troca gasosa ocorre no nível dos capilares (capilares alveolares), e o sangue rico em oxigênio é fornecido ao coração esquerdo pelas veias pulmonares (VPs). Ao contrário de outras veias que transportam sangue pobre em oxigênio, os PVs desempenham uma função importante de fornecer sangue rico em oxigênio ao coração esquerdo e, consequentemente, aos órgãos vitais do corpo. No entanto, os mecanismos de sinalização que regulam a função da VP em condições normais e de doença são pouco compreendidos.
Os estudos sobre a vasculatura pulmonar têm se concentrado principalmente em APs e capilares pulmonares. Estudos recentes mostram que os sinais de Ca2+ nas camadas de células endoteliais e musculares lisas são cruciais na regulação da função dos PAs 3,4,5. Além disso, mecanismos de sinalização anormais de Ca2+ são responsáveis pelo comprometimento da função dos APs e capilares pulmonares em condições de doença 6,7,8,9,10. No entanto, estudos sobre veias intrapulmonares (pequenas VPs) permanecem escassos. A atividade ectópica em grandes VPs adjacentes ao coração esquerdo (VPs cardíacas) foi proposta como uma fonte de fibrilação atrial em humanos11,12, e sinais de pulsação espontânea13 e Ca2+ 12,14,15 também foram mostrados em grandes VPs. Pequenas VPs fornecem sangue rico em oxigênio para grandes VPs. No entanto, os mecanismos de sinalização de Ca2+ em pequenas VPs não foram estudados sob pressões intraluminais fisiológicas.
Neste manuscrito, apresentamos um novo método para isolar, canular e pressurizar pequenas VPs e imagens de sinais de Ca2+ em miócitos PV usando microscopia confocal de disco giratório de alta velocidade. O objetivo geral deste método é registrar sinais espontâneos e induzidos de Ca2+ em pequenos miócitos PV sob pressões intraluminais fisiológicas. A pressão intraluminal desempenha um papel crítico na regulação dos sinais de Ca2+ nos miócitos16. Tipicamente, as VPs são submetidas a pressões intraluminais fisiológicas que variam de 4 a 10 mm Hg17,18. Alterações na pressão intraluminal ao longo do ciclo cardíaco podem influenciar os sinais de Ca2+ nos miócitos da VP. Portanto, é essencial empregar uma técnica que nos permita estudar esses sinais em condições fisiológicas e examinar como as variações das pressões intraluminais os afetam. Além disso, a maioria das pesquisas anteriores sobre PVs concentrou-se em VPs cardíacos maiores. A técnica atual se concentra em pequenas VPs localizadas profundamente nos pulmões, o que pode ser mais relevante para entender a regulação da função pulmonar tanto na saúde quanto na doença.
Protocolo
Todos os protocolos de animais foram aprovados pelo Comitê de Cuidados e Uso de Animais da Universidade da Virgínia (protocolos 4100 e 4120). Camundongos C57BL6/J, 10-12 semanas de idade, são eutanasiados com pentobarbital (90 mg/kg; intraperitoneal), seguido de luxação cervical para coleta de tecido pulmonar 3,4,19,20.
1. Isolamento de pequenos PVs
- Limpe as ferramentas de dissecação e pratos com etanol 100%, seguido de lavagem com água deionizada.
- Use uma tesoura para abrir a cavidade torácica. Use uma pinça para remover cuidadosamente o coração e os pulmões da cavidade torácica com o mínimo de toque nos pulmões.
- Coloque o tecido em uma placa revestida com Sylgard contendo solução salina fisiológica tamponada com HEPES fria (4-10 ° C) (HEPES-PSS, em mM, 10 HEPES, 134 NaCl, 6 KCl, 1 MgCl2 hexahidratado, 2 CaCl2 di-hidratado e 7 dextrose, pH ajustado para 7,4 usando 1 M NaOH) 3 , 4 , 19 . Use pinos de dissecção para fixar o coração e os pulmões de forma que os grandes PVs e PAs sejam claramente visíveis e o lobo esquerdo do pulmão esteja ligeiramente esticado, conforme mostrado na Figura 1.
- Usando grandes veias pulmonares (VPs) como pontos de referência, remova cuidadosamente o tecido ao redor das pequenas veias intrapulmonares (pequenas VPs, aproximadamente 50-100 μm de diâmetro, indicadas pelo retângulo tracejado na Figura 1) com uma tesoura fina. Certifique-se de evitar o contato direto com os pequenos PVs. Isole suavemente os pequenos PVs do tecido circundante.
- Isole segmentos de aproximadamente 1-2 mm de comprimento de pequenas PVs. Coloque pequenas PVs em 4-10 ° C HEPES-PSS.
2. Carregando pequenos PVs com um indicador de Ca2+
NOTA: Pequenas PVs devem ser manuseadas com cuidado, garantindo que a pinça toque apenas nas pontas das PVs. Este método é uma modificação da técnica descrita anteriormente 3,7,20,21.
- Prepare uma concentração de estoque de 2,5 mM Fluo-4 AM com DMSO 3,4. Usando a solução estoque acima, prepare 10 μM de fluo-4 AM e ácido plurônico a 0,04% com HEPES-PSS.
- Coloque pequenas VPs em um tubo de 1,5 mL com a solução de carga (10 μM fluo-4 AM e ácido plurônico a 0,04% em HEPES-PSS)3,4. Cobrir o tubo com papel alumínio e colocar em banho-maria para incubação a 37 °C durante 1 h.
- Após a incubação, substitua cuidadosamente a solução de carregamento por HEPES-PSS 4-10 °C e mantenha no gelo por 30 min como etapa de lavagem.
3. Canulação de pequenas VP
NOTA: Este método é uma modificação da técnica descrita anteriormente 3,20,21.
- Preparar a câmara de moção de pressão com duas cânulas de vidro, uma de cada lado. Encha as cânulas com PSS (119 mM NaCl, 4,7 mM KCl, 1,2 mM KH2PO4, 1,2 mM MgCl2 160 hexahidratado, 2,5 mM CaCl2 di-hidratado 3,4,21,22, 7 mM dextrose e 24 mM NaHCO 3, mantido em pH 7,4 borbulhando a solução com 21% O 2 e 5% CO 2) usando uma seringa de 10 mL.
- Remova um pequeno PV da solução de lavagem e coloque-o na câmara de miografia de pressão. Usando uma pinça de ponta fina, canule cuidadosamente uma extremidade do pequeno PV em uma das cânulas. Em seguida, usando um microfilamento feito de fio de náilon, dê um nó ao redor da extremidade canulada do pequeno PV e da ponta da cânula para prendê-lo.
- Empurre o PSS suavemente através da cânula para remover o sangue dentro do PV. Use fio de náilon para amarrar a outra extremidade com uma cânula de vidro usando microfilamentos, conforme mostrado na Figura 1.
4. Pressurização e imagem de Ca2+ de pequenos PV
NOTA: Este método é uma modificação da técnica descrita anteriormente 3,21.
- Usando um controlador de pressão servo conectado a uma tubulação contendo PSS, pressurize o pequeno PV de uma extremidade a 5 mm Hg. Use uma bomba peristáltica conectada a uma entrada e uma saída para superfundir o PSS. Manter a temperatura do superfusato a 37 °C.
- Após o período de equilíbrio, adquira imagens de Ca2+ para 1000 quadros (taxa de quadros: 30 quadros por segundo) usando a objetiva de imersão em água de 40x (NA 0,8) e um sistema de imagem confocal de disco giratório. Excite o Fluo-4 usando um laser de estado sólido de 488 nm e capture a fluorescência emitida usando um filtro passa-banda de 525/36 nm.
- Aplique o antagonista do receptor de rianodina (RyR) rianodina (5 μM)21,23 ao superfusato. Aguarde 5 min. Refaça as imagens de Ca2+ conforme descrito acima, capturando mais 1000 quadros a uma taxa de 30 quadros/s.
5. Análise de imagem de Ca2+
NOTA: Este método é uma modificação da técnica descrita anteriormente 21,22,24. Mudanças na atividade dos sinais de Ca2+ em miócitos PV podem fornecer informações importantes sobre a inibição ou aumento do acoplamento excitação-contração em PVs.
- Use um software personalizado (desenvolvido pelo Dr. Adrian Bonev, https://github.com/vesselman/SparkAn) para analisar imagens de Ca2+ .
- Imagens suaves usando filtro de vagão 5 x 5 e filtro mediano 5 x 5. Use um quadro delineando uma região plana de PV com várias células para detecção automática de eventos.
- Clique em Exibir e detecção automática de eventos. Use as seguintes configurações: limite de evento em uma amplitude de 1,3 F/F0, Tolerância de 20%, caixa de digitalização de 7 x 7 pixels e média de execução de 7 imagens. Gere imagens médias automaticamente a cada 10 imagens, a partir da primeira imagem.
- Clique em Iniciar pesquisa (o ícone de olho). Encontre a tabela de eventos salva como um arquivo de marca no menu Arquivo. Para calcular eventos por μm², divida o número de sinais de Ca2+ detectados pela área do quadro selecionado.
Resultados
A Figura 2A mostra um campo de visão de um pequeno PV a 5 mm Hg de pressão intraluminal. Os símbolos + indicam os sinais de Ca2+ detectados automaticamente dentro de um quadro selecionado (Vídeo 1), indicados pelo contorno verde. Um campo de visão foi registrado de cada VP e um PV foi usado de cada camundongo. Uma VP pequena foi considerada como n=1. O número de sinais de Ca2+ por μm2 por minuto foi comparado antes e 5 min após a adição do inibidor de RyR rianodina (5 μM)23 em experimentos pareados. Um teste t pareado foi usado para comparações estatísticas para detectar diferenças significativas. O número de sinais de Ca2+ que ocorrem espontaneamente foi de 0,73 ± 0,2 eventos por minuto por μm2 ( Figura 2B , C ) nas condições descritas acima. O tratamento com rianodina inibiu quase completamente os sinais de Ca2+ em pequenas VPs ( Figura 2C, Vídeo 2 ), conforme indicado por uma redução drástica nos eventos por minuto por μm2. Esses dados mostram que a atividade espontânea dos sinais de Ca2+ na camada de miócitos de pequenos PVs pressurizados representa aberturas de RyRs. Esses resultados fornecem evidências de que a atividade dos sinais de Ca2+ pode ser estudada em pequenas VPs sob pressões intraluminais fisiológicas. Este método facilitará estudos futuros sobre os efeitos da pressão intraluminal e mediadores neuro-humorais na sinalização de Ca2+ em pequenos miócitos PV, potencialmente oferecendo informações valiosas sobre a regulação da função PV. Embora o estudo atual se concentre no número de sinais RyR Ca2+, também é possível analisar as propriedades cinéticas desses sinais, incluindo duração, amplitude, dispersão espacial e tempo de subida. Compreender como os estímulos fisiológicos e patológicos afetam as propriedades cinéticas dos sinais RyR Ca2+ pode fornecer informações importantes sobre a regulação da função PV em estados saudáveis e doentes.
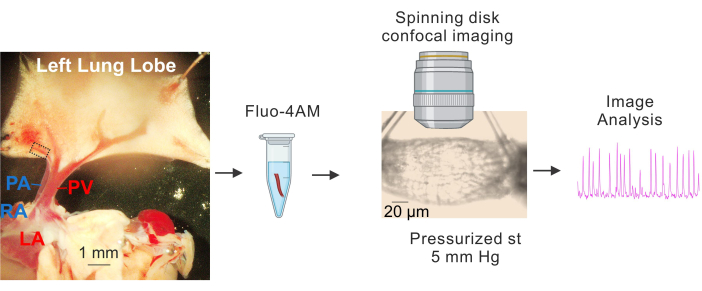
Figura 1: Preparação e imagem de Ca2+ de PVs. Imagens sequenciais mostrando a identificação e isolamento de pequenas VPs, incubação de fluo4-AM, canulação e pressurização (5 mm Hg), imagens confocais de alta velocidade de disco giratório e análise de imagens. O retângulo tracejado na imagem à esquerda representa o PV usado para o estudo. Abreviaturas: PA = artéria pulmonar; AD = átrio direito; VP = veia pulmonar; AE = átrio esquerdo. Clique aqui para ver uma versão maior desta figura.
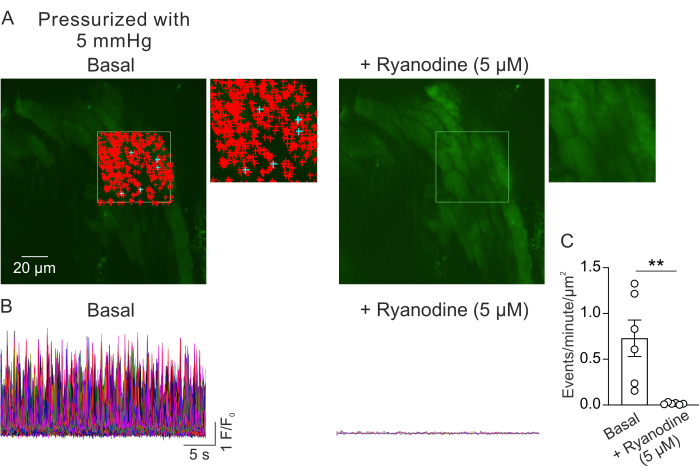
Figura 2: Análise de imagens de Ca2+ . (A) Imagens de um campo de visão de um PV pequeno pressurizado (5 mm Hg), carregado com fluo-4 na ausência (esquerda) ou presença de rianodina (5 μM; Inibidor de RyR, à direita). O retângulo verde denota a área que foi selecionada para a detecção automática de sinais de Ca2+ . Os sinais + representam eventos detectados automaticamente dentro do quadro. Os sinais vermelhos indicam sinais com área inferior a 3000 μm2, enquanto os sinais azuis indicam sinais que ocuparam uma área superior a 3000 μm2. Cada sinal + indica um evento ou sinal de Ca2+ . (B) Traços F/F0 de eventos detectados da área selecionada indicada em A, mostrando a atividade dos sinais de Ca2+ na camada de miócitos de pequenos PVs pressurizados sob condições basais (esquerda) e na presença de rianodina (direita). (C) Quantificação de eventos por minuto por μm2 de sinais de Ca2+ em pequenas PVs antes e depois da adição de rianodina (1 PV por camundongo; n = 6 camundongos; ** p < 0,01 vs Basal; teste t pareado). Clique aqui para ver uma versão maior desta figura.
Vídeo 1: Sinais de Ca2+ em um pequeno PV pressurizado a 5 mm Hg antes do tratamento com riadina. O campo de visão representa o quadro selecionado, mostrado na cor verde na Figura 2. Clique aqui para baixar este vídeo.
Vídeo 2: Sinais de Ca2+ em um pequeno PV pressurizado a 5 mm Hg após tratamento com rianodina (5 μM). O campo de visão representa o quadro selecionado, mostrado na cor verde na Figura 2. Clique aqui para baixar este vídeo.
Discussão
Os sinais de Ca2+ nas células musculares lisas desempenham um papel crucial na regulação da função vascular25. As VPs são um leito vascular importante, mas relativamente pouco estudado, responsável por fornecer sangue rico em oxigênio ao coração esquerdo26. No entanto, os mecanismos de sinalização de Ca2+ em pequenas VPs e seu impacto na função fisiológica são desconhecidos. O objetivo deste manuscrito é descrever um novo método para isolar, canular e pressurizar pequenas VPs para registrar sinais de Ca2+ na camada de miócitos e analisar esses sinais de Ca2+ . A capacidade de visualizar sinais de Ca2+ em pequenas PVs pode ajudar a avançar nossa compreensão de como esses sinais funcionam em condições normais e doentes. Embora o estudo dos sinais de Ca2+ em PVs dentro do pulmão intacto forneça dados fisiologicamente mais relevantes, os pequenos PVs não são claramente visíveis no pulmão intacto, o que pode apresentar desafios técnicos com o carregamento de corantes de Ca2+ e imagens confocais. Isolar e pressurizar pequenas PVs oferece uma maneira alternativa de observar sinais de Ca2+ sob pressões intraluminais fisiológicas, temperatura e soluções iônicas.
A imagem de Ca2+ de VPs descrita neste manuscrito é baseada em nosso procedimento bem estabelecido para imagem de Ca2+ em artérias sistêmicas 21,22,27. Os dados indicam que a maioria dos sinais de Ca2+ em pequenos miócitos PV são devidos a aberturas de canais iônicos RyR. Portanto, o protocolo descrito neste manuscrito permitirá estudos futuros da regulação do RyR e seu impacto na função PV em condições normais e em doenças. A atividade do RyR2 é essencial para as contrações nos miócitos cardíacos28, enquanto nas células musculares lisas arteriais tem sido associada ao relaxamento29. O efeito preciso da atividade de RyR na contração de pequenas PV permanece desconhecido. A miografia de pressão é uma técnica comumente usada para monitorar alterações na contração de pequenos vasos sanguíneos. Portanto, é provável que a preparação de PV pressurizada também possa ser usada para monitorar pequenas contrações de PV.
A rianodina exibe efeitos dependentes da concentração na atividade do RyR, aumentando-a em concentrações submicromolares e diminuindo-a em concentrações micromolares23. A rianodina também pode ter um efeito inibitório indireto em outros sinais de Ca2+ em pequenas PVs, uma possibilidade que não foi testada. Na concentração utilizada, não observamos um aumento compensatório nos sinais de Ca2+ em PVs. A regulação dos sinais de Ca2+ em PVs isolados e pressurizados pode diferir daquelas em PVs dentro de um pulmão intacto, uma possibilidade que ainda não foi explorada. No entanto, o registro de sinais de Ca2+ em pequenas VPs no pulmão intacto de um camundongo anestesiado apresenta desafios significativos, decorrentes da localização do pulmão na cavidade torácica e da dificuldade de carregar um indicador de Ca2+ seletivamente em PVs em um camundongo anestesiado.
Sabe-se que o estresse de cisalhamento do fluxo sanguíneo altera a função dos vasos sanguíneos. Embora o método atual permita isolar o efeito da pressão intraluminal nos sinais de Ca2+ em pequenas PVs, a falta de fluxo ou tensão de cisalhamento é uma limitação potencial. No entanto, a tensão de fluxo ou cisalhamento pode ser facilmente incorporada e realizada em combinação com imagens de Ca2+ usando as configurações descritas anteriormente21. É possível que a tensão de fluxo/cisalhamento modifique a atividade dos sinais de Ca2+ em pequenas PVs, o que seria um tópico interessante para futuras investigações.
Usamos o fluo-4-AM como um indicador de Ca2+ para registrar sinais de Ca2+ em pequenas PVs. Dependendo das necessidades experimentais, deve ser possível usar outros indicadores de Ca2+ que podem ser excitados a 488 nm (Calbryte 520 AM)7 ou 560 nm (Calbryte 590 AM)30. O uso de um sistema de imagem confocal de disco giratório permite a aquisição de imagens de sinais de Ca2+ , especificamente em miócitos PV. Embora não tenha sido estudado no presente estudo, o foco na camada de células endoteliais permitirá o registro de sinais endoteliais de Ca2+ em pequenas VPs. PAs e PVs são funcionalmente diferentes e estão expostos a microambientes distintos. Portanto, uma comparação dos sinais de Ca2+ de miócitos e endoteliais entre pequenos PAs e pequenos PVs pode fornecer informações cruciais sobre suas diferenças funcionais.
É plausível que os sinais de Ca2+ em pequenas VPs regulem o fluxo de sangue rico em oxigênio através das VPs. A pressão no interior do átrio esquerdo muda de 4 mmHg para 12 mmHg durante cada ciclo cardíaco17,18. Como as VPs fornecem sangue para o átrio esquerdo, é provável que a pressão dentro das VPs também mude durante o ciclo cardíaco. Estudos anteriores mostraram que os RyRs podem ser ativados por pressão intraluminal em pequenas artérias16. Portanto, medir o efeito da pressão intraluminal nos sinais de PV Ca2+ pode fornecer novos insights sobre a entrega de sangue rico em oxigênio das PVs para o coração esquerdo. A estimulação nervosa e os mediadores humorais na corrente sanguínea também podem ativar os sinais de Ca2+ do músculo liso. O método atual facilitará estudos futuros sobre o impacto dos mediadores neuro-humorais nos sinais de PV Ca2+ e na função PV.
Existem algumas etapas críticas dentro do protocolo que devem ser atendidas. Uma dissecção cuidadosa das veias pulmonares (VPs) é extremamente importante. É crucial evitar tocar na área de imagem das VPs com ferramentas de dissecção, pois isso pode afetar negativamente sua saúde. Apenas as extremidades dos PVs devem ser tocadas. Reduzir o tempo de dissecção pode aumentar a taxa de sucesso. O carregamento insuficiente de corante pode resultar em uma relação sinal-ruído mais baixa e aumentar a probabilidade de falsos positivos durante a autodetecção de eventos. Seguir o protocolo descrito aqui deve garantir a carga adequada de corante nos miócitos PV.
Em resumo, apresentamos um método para registrar sinais de Ca2+ em pequenas VPs, que permite investigar os mecanismos de sinalização de Ca2+ neste leito vascular importante, mas muitas vezes esquecido. É importante ressaltar que a capacidade de registrar sinais de Ca2+ em pequenas VPs em condições normais pode fornecer uma compreensão valiosa dos mecanismos patológicos para doenças do pulmão, incluindo hipertensão pulmonar, lesão pulmonar e edema pulmonar induzido por insuficiência cardíaca.
Divulgações
Os autores não têm nada a divulgar.
Agradecimentos
Esta pesquisa foi financiada por prêmios do NHLBI (HL167208, HL157407 e HL146914) para SKS e NIDDK (DK138271) para YLC.
Materiais
| Name | Company | Catalog Number | Comments |
| Custom-Designed SparkAn Software | University of Vermont | https://github.com/vesselman/SparkAn | |
| Fluo-4, AM | Thermo Fisher Scientific | F14201 | |
| FN1 Upright Microscope | Nikon | ||
| Heater/Temperature Controller | Warner Instruments | ||
| Imaging System | Andor | ||
| iQ 3.x acquisition Software | Andor | ||
| iXon EMCCD Cameras | Andor | ||
| Nylon Thread for Tying Blood Vessels | Living Systems Instrumentation | THR-G | |
| Pressure Myography Chamber | Instrumentation and Model Facility, University of Vermont, Burlington, VT, USA | ||
| Revolution WD (with Borealis) High Speed Spinning Disk Confocal Imaging System | Andor | ||
| Ryanodine | Bio-Techne | 1329 | |
| Servo Pressure Controller | Living Systems Instrumentation | ||
| SS Dissection Pins, 0.2mm dia | Living Systems Instrumentation | PIN-0.2mm | |
| Tubing Pump REGLO | ISMATEC | ISM4212 |
Referências
- Suresh, K., Shimoda, L. A. Lung circulation. Compr Physiol. 6 (2), 897-943 (2016).
- Sundjaja, J. H., Bordoni, B. . Thorax, heart pulmonic valve. , (2024).
- Daneva, Z., et al. Caveolar peroxynitrite formation impairs endothelial TRPV4 channels and elevates pulmonary arterial pressure in pulmonary hypertension. Proc Natl Acad Sci U S A. 118 (17), e2023130118 (2021).
- Daneva, Z., et al. Endothelial pannexin 1-TRPV4 channel signaling lowers pulmonary arterial pressure in mice. Elife. 10, e67777 (2021).
- Kuhr, F. K., Smith, K. A., Song, M. Y., Levitan, I., Yuan, J. X. New mechanisms of pulmonary arterial hypertension: role of Ca2+ signaling. Am J Physiol Heart Circ Physiol. 302 (8), H1546-H1562 (2012).
- Sonkusare, S. K., Laubach, V. E. Endothelial TRPV4 channels in lung edema and injury. Curr Top Membr. 89, 43-62 (2022).
- Kuppusamy, M., et al. Purinergic P2Y2 receptor-induced activation of endothelial TRPV4 channels mediates lung ischemia-reperfusion injury. Sci Signal. 16 (808), eadg1553 (2023).
- Alvarez, D. F., et al. Transient receptor potential vanilloid 4-mediated disruption of the alveolar septal barrier: a novel mechanism of acute lung injury. Circ Res. 99 (9), 988-995 (2006).
- Balakrishna, S., et al. TRPV4 inhibition counteracts edema and inflammation and improves pulmonary function and oxygen saturation in chemically induced acute lung injury. Am J Physiol Lung Cell Mol Physiol. 307 (2), L158-L172 (2014).
- Suresh, K., et al. Reactive oxygen species induced Ca2+ influx via TRPV4 and microvascular endothelial dysfunction in the SU5416/hypoxia model of pulmonary arterial hypertension. Am J Physiol Lung Cell Mol Physiol. 314 (5), L893-L907 (2018).
- Haissaguerre, M., et al. Spontaneous initiation of atrial fibrillation by ectopic beats originating in the pulmonary veins. N Engl J Med. 339 (10), 659-666 (1998).
- Heijman, J., Voigt, N., Nattel, S., Dobrev, D. Cellular and molecular electrophysiology of atrial fibrillation initiation, maintenance, and progression. Circ Res. 114 (9), 1483-1499 (2014).
- Brunton, T. L., Fayrer, J. Note on independent pulsation of the pulmonary veins and vena cava. Proc R Soc Lond. 25, 174-176 (1877).
- Namekata, I., et al. Involvement of the Na(+)/Ca(2+) exchanger in the automaticity of guinea-pig pulmonary vein myocardium as revealed by SEA0400. J Pharmacol Sci. 110 (1), 111-116 (2009).
- Cros, C., et al. Regional differences in Ca2+ signaling and transverse-tubules across left atrium from adult sheep. Int J Mol Sci. 24 (3), 2347 (2023).
- Dabertrand, F., Nelson, M. T., Brayden, J. E. Ryanodine receptors, calcium signaling, and regulation of vascular tone in the cerebral parenchymal microcirculation. Microcirculation. 20 (4), 307-316 (2013).
- Nair, R., Lamaa, N. . Pulmonary capillary wedge pressure. , (2024).
- Fukuta, H., Little, W. C. The cardiac cycle and the physiologic basis of left ventricular contraction, ejection, relaxation, and filling. Heart Fail Clin. 4 (1), 1-11 (2008).
- Daneva, Z., et al. Endothelial IK and SK channel activation decreases pulmonary arterial pressure and vascular remodeling in pulmonary hypertension. Pulm Circ. 13 (1), e12186 (2023).
- Marziano, C., et al. Nitric oxide-dependent feedback loop regulates transient receptor potential vanilloid 4 (TRPV4) channel cooperativity and endothelial function in small pulmonary arteries. J Am Heart Assoc. 6 (12), e007157 (2017).
- Chen, Y. L., et al. Novel smooth muscle Ca2+-signaling nanodomains in blood pressure regulation. Circulation. 146 (7), 548-564 (2022).
- Sonkusare, S. K., et al. Elementary Ca2+ signals through endothelial TRPV4 channels regulate vascular function. Science. 336, 597-601 (2012).
- Arias-Cavieres, A., et al. Ryanodine receptor-mediated calcium release has a key role in hippocampal LTD induction. Front Cell Neurosci. 12, 403 (2018).
- Chen, Y. L., et al. Calcium signal profiles in vascular endothelium from Cdh5-GCaMP8 and Cx40-GCaMP2 mice. J Vasc Res. 58 (3), 159-171 (2021).
- Ottolini, M., Sonkusare, S. K. The calcium signaling mechanisms in arterial smooth muscle and endothelial cells. Compr Physiol. 11 (2), 1831-1869 (2021).
- Boyette, L. C., Burns, B. . Physiology, pulmonary circulation. , (2024).
- Ottolini, M., et al. Local peroxynitrite impairs endothelial transient receptor potential vanilloid 4 channels and elevates blood pressure in obesity. Circulation. 141 (16), 1318-1333 (2020).
- Shan, J., et al. Phosphorylation of the ryanodine receptor mediates the cardiac fight or flight response in mice. J Clin Invest. 120 (12), 4388-4398 (2010).
- Knot, H. J., Standen, N. B., Nelson, M. T. Ryanodine receptors regulate arterial diameter and wall [Ca2+] in cerebral arteries of rat via Ca2+-dependent K+ channels. J Physiol. 1 (Pt 1), 211-221 (1998).
- Tischbirek, C., Birkner, A., Jia, H., Sakmann, B., Konnerth, A. Deep two-photon brain imaging with a red-shifted fluorometric Ca2+ indicator. Proc Natl Acad Sci U S A. 112 (36), 11377-11382 (2015).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados